Einführung in die Katalyse
Überblick
Quelle: Labor von Dr. Ryan Richards – Colorado School of Mines
Katalyse gehört zu den wichtigsten Bereichen von moderner Technologie und derzeit entfallen rund 35 % des Bruttoinlandsprodukts (BIP) und Unterhalt von rund 33 % der Weltbevölkerung durch Düngemittel über das Haber-Verfahren hergestellt. 1 Katalysatoren sind Systeme, die chemische Reaktionen durch Absenkung der Aktivierungsenergie und beeinflussen die Selektivität zu erleichtern. Katalyse wird eine zentrale Technik im Hinblick auf die Energie- und umweltpolitischen Herausforderungen der Neuzeit sein.
Grundsätze
Heterogene Katalysatoren bestehen typischerweise aus einer nanoskaligen katalytische Einheit (in der Regel ein Metall) verstreut auf einem Trägermaterial (in der Regel Carbon oder Metall Oxid), das vergrößert die Oberfläche und oft vermittelt gewisse Stabilität gegen Aggregation der Nanopartikel. Katalysator-Nanopartikel hat aktive Zentren auf seiner Oberfläche, wo die Reaktion stattfindet. Abhängig von der Reaktion könnte diese aktiven Zentren planaren Flächen oder Kanten Kristall auf der Oberfläche des Partikels. In der Regel haben kleinere Nanopartikel höhere katalytischen Aktivität, aufgrund der höheren Anzahl der Oberflächenatome pro Mol des Katalysators. 2
Die Reaktion auf der Katalysatoroberfläche beginnt mit Adsorption von Reagenzien zur aktiven Seite, gefolgt von der Reaktion auf der Oberfläche. Die Oberflächenreaktion kann zwischen einer adsorbierten Spezies und in loser Schüttung, genannt den Eley-Rideal-Mechanismus, oder zwischen zwei adsorbierten Spezies, genannt den Langmuir-Hinshelwood-Mechanismus auftreten. Die reagierten Arten desorbs dann von der Oberfläche in die Masse. 2
Unterstützten nanoskaligen Palladium Partikel Aktivität in vielen wichtigen katalytischen Reaktionen gezeigt haben und ein Modellsystem zur Demonstration eines heterogenen Katalysators zu vertreten. Palladium Basis Katalysator Forschung Bemühungen sind breit und reichten von Ausbau der Biomasse auf die Zersetzung von chemischen Farbstoffen in Abwasserströme. Der Einsatz von Palladium-Katalysatoren als Vertreter für heterogene Katalysatoren ist wünschenswert, weil sie einfache Abtrennung des Katalysators die Produkte ermöglicht. 2
Hier besteht der heterogenen Katalysator von nanoskaligen Palladium Teilchen verteilt auf eine große Oberfläche Kohlenstoff-Unterstützung. Derzeit sind mehrere unterstützte Palladium-Katalysatoren im Handel erhältlich. In diesem pädagogischen Artikel unterstützt zwei handelsübliche Palladium verwendeten Materialien, 1 % Palladium auf Aktivkohle unterstützt und 0,5 % Palladium auf Granulat Kohlenstoff unterstützt. Ein anderes Material, Aktivkohle, dient als ein Kontrollexperiment. Die Reduktion von 4-Nitrophenol ist für die katalytische Reaktion gewählt, weil es leicht ist zu bearbeiten und die Ergebnisse durch eine Farbänderung sichtbar sind. Dieses experimentelle Protokoll bietet eine sehr klare visuelle Demonstration einer typischen katalytische Reaktion.
Verfahren
1. Vorbereitung von 4-Nitrophenol Lösung gemischt mit Natriumborohydrid
- 14 mg 4-Nitrophenol wiegen und in 10 mL VE-Wasser in ein Glas-Durchstechflasche auflösen.
- 57 mg von Natriumborohydrid wiegen und in 15 mL VE-Wasser auflösen.
- Mischen Sie die zwei Lösungen und magnetische rühren für 30 min bei Raumtemperatur zu einer einheitlichen Lösung. Laborkittel, Sicherheit Brille und Handschuhe sind als Standardprotokoll Schutz erforderlich.
2. Vorbereitung des Katalysator-Lösung
- Wiegen Sie 10 mg Palladium auf Aktivkohle und Palladium auf Granulat Kohlenstoff bzw.. Wiegen Sie 10 mg Aktivkohle als Kontrollgruppe.
- Transfer wog Katalysatoren zu einem Fläschchen und jedes Fläschchen 100 mL VE-Wasser hinzufügen.
- Beschallen Sie die Fläschchen mit einer Ausgangsleistung von 135 W für 10 min bis Katalysatoren im Wasser gut verteilt sind.
3. katalytische Reduktion von 4-Nitrophenol
- Messen Sie 1,15 mL fertige Lösung für 4-Nitrophenol und Natrium Natriumborhydrid, übertragen auf eine 5-mL-Glasflasche.
- Notieren Sie die Farbe der Lösung in das Fläschchen, warten Sie 10 min und Rekord, wenn es irgendeine Änderung in der Farbe der Lösung.
- Die Ampulle fügen Sie 1 mL der vorbereiteten Palladium auf Aktivkohle-Katalysator-Lösung hinzu, schütteln Sie das Fläschchen mit der hand 20 S. beobachten Reaktion für 20 min, zeichnen Sie auf, wenn Lösung Farbe beginnt sich zu verändern und wenn Lösung Farbe verblasst völlig transparent.
- Wiederholen Sie den Vorgang mit dem Palladium auf Granulat Kohlenstoff-Katalysator-Lösung.
- Wiederholen Sie den Vorgang mit der Aktivkohle-Katalysator-Lösung.
- Der Farbwechsel zwischen drei Katalysatoren nach 0, 5, 10, 15 und 20 min. Reaktionszeit zu vergleichen. Um diese Änderung zu quantifizieren, Messen Sie UV-Vis-Spektren der Probe während der 20 min-Reaktion-Intervall.
Ergebnisse
Die Reduktion von 4-Nitrophenol mit einem Katalysator ist eine Benchmark-Reaktion in der Literatur für die Katalysatorleistung Bewertung und Messung der Kinetik. Vor der Zugabe des Katalysators, die Farbe der Lösung ist hell gelb, das entspricht 4-Nitrophenol Ion in alkalischen Bedingungen. Ohne den Zusatz eines Katalysators die gelbe Farbe nicht verblassen, dies bedeutet, dass die Mischung von 4-Nitrophenol und Natrium Natriumborhydrid stabil ist.
Nach der Zugabe von Palladium auf Aktivkohle und Palladium auf Granulat Kohlenstoff-Katalysator-Lösungen verblasst die gelbe Farbe des 4-Nitrophenol Lösung allmählich. Auf einer Zeitskala von ca. 20 min wird die Lösung farblos, was auf eine vollständige Reduktion von 4-Nitrophenol durch den Katalysator.
Nach der Zugabe von Aktivkohle-Lösung, mit keinen Katalysator bleibt die gelbe Farbe des 4-Nitrophenol innerhalb von 20 min Reaktionsfenster unverändert. Carbon fungiert lediglich als Trägermaterial für Palladium, also Kohlenstoff durch selbst keine katalytische Wirkung auf die Reaktion zeigen. Die Kontrollgruppe hier zeigt, dass nanoskaligen Palladium Partikel unterstützt auf Kohlenstoff ist ein aktiver Katalysator der Kohlenstoff selbst ist zwar kein Katalysator. Dieses Control Experiment zeigt auch, dass die 4-Nitrophenol ist nicht einfach von der Kohlenstoff aufgenommen und aus der Lösung entfernt.
Beobachtung der UV-Vis-Absorptionsspektren zeigt eine allmähliche Abnahme bei rund 400 nm erhöhend bei rund 300 nm. Diese Änderung ist bezeichnend für die Reduktion von 4-Nitrophenol während des Prozesses. Die relative Konzentration von 4-Nitrophenol ist vertreten durch die relative Intensität der Absorption bei 400 nm. Eine Plot-ln (t/a0) vs. Zeit zeigt Reaktion Verfahrens in einer quantitativen Weise. Ein repräsentatives Grundstück ist in Abbildung 1dargestellt.
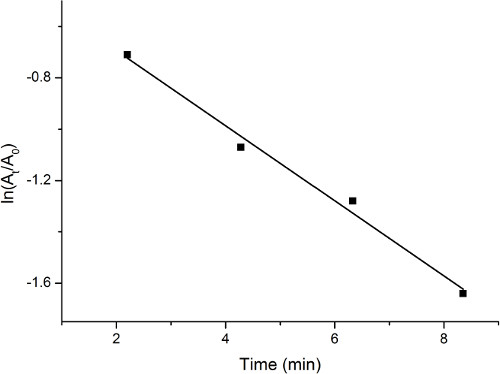
Abbildung 1. Grundstück von Absorption vs. Zeit bei der Reduktion von 4-Nitrophenol durch Palladium-Katalysators auf Aktivkohle.
Für beide Palladium-Katalysatoren verwendet gibt es keinen Unterschied zwischen ihre Farbe ändern Verhalten und ihre Spektren. Dieses Ergebnis zeigt an, dass Palladium ist aktiv im katalytischen Reduktion von 4-Nitrophenol unabhängig davon, ob es auf Aktivkohle oder granulare Carbon unterstützt wird.
Anwendung und Zusammenfassung
Als Benchmark Reaktion kann die katalytische Anwendung von nanoskaligen Palladium Teilchen auf andere Bereiche erweitert werden. Ähnlich wie bei der Reduktion von 4-Nitrophenol, was eine Colorometric (die Reaktion wird als eine Farbänderung beobachtet), die Hydrierung von chemischen Farbstoffen kann mit dem gleichen Protokoll durchgeführt werden. Chemischen Hydrierung Prozesse sind sehr wichtig in vielen industriellen Reaktionen sowie Abfallentsorgung. Forscher fanden Anwendungen von Katalysatoren in Hydrierung Reaktionen in den Bereichen Petrochemie. In den Vereinigten Staaten erreichte Benzol Produktion 415144 Millionen Gallonen im vierten Quartal im Jahr 2010, wo Hydrierung Prozess eine wichtige Rolle.
In Anwesenheit eines Palladium-Katalysators und eine einfache Umgebung auftreten C-C-Kupplungsreaktionen zwischen Aryl/Vinyl Halogenide und Alkenen. 3,4 , dies als die Heck-Reaktion bezeichnet. C-C-Kupplungsreaktionen sind von entscheidender Bedeutung für die jetzt gesellschaftlichen Energieherausforderungen zu lösen. Die Implikation ist so wichtig, dass für die Arbeit am Kreuz Kupplung Reaktion katalysiert Palladium 2010 den Nobelpreis für Chemie ausgezeichnet wurde. Katalysatoren werden auch bei der Synthese von Nanopartikeln Polymer verwendet. In dieser Anwendung sind Polymer-Filialen mit einem Katalysator vermischt, um induzieren die Bildung von Sterne Partikeln. 5 schließlich sind Katalysatoren in Natur und biologische Reaktionen Laufwerk verbreitet. Hier gibt es sie natürlich als Form bestimmter Enzyme. 6
pringen zu...
Videos aus dieser Sammlung:

Now Playing
Einführung in die Katalyse
Organic Chemistry
34.6K Ansichten

Montage eines Reflux-Systems für beheizte chemische Reaktionen
Organic Chemistry
168.4K Ansichten

Durchführung von Reaktionen unterhalb der Raumtemperatur
Organic Chemistry
70.7K Ansichten

Übertragen von Lösungmitteln mit der Schlenk-Technik
Organic Chemistry
41.7K Ansichten

Entgasung von Flüssigkeiten mittels Freeze-Pump-Thaw Cycling
Organic Chemistry
56.4K Ansichten

Vorbereiten von wasserfreien Reagenzien und Geräten
Organic Chemistry
79.4K Ansichten

Reinigen von Verbindungen durch Umkristallisation
Organic Chemistry
710.2K Ansichten

Trennen von Gemischen durch Ausfällung
Organic Chemistry
158.0K Ansichten

Fest-Flüssig-Extraktion
Organic Chemistry
238.2K Ansichten

Entfernung von Lösungsmitteln mit dem Rotationsverdampfer
Organic Chemistry
213.0K Ansichten

Fraktionierte Destillation
Organic Chemistry
334.8K Ansichten

Züchten von Kristallen für die Röntgenbeugungsanalyse
Organic Chemistry
32.9K Ansichten

Performing 1D Thin Layer Chromatography
Organic Chemistry
290.1K Ansichten

Säulenchromatographie
Organic Chemistry
361.1K Ansichten

Kernspinresonanzspektroskopie (NMR-Spektroskopie)
Organic Chemistry
249.0K Ansichten
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten