Imágenes de fluorescencia infrarroja de aneurismas aórticos abdominales
Visión general
Fuente: Arvin H. Soepriatna1, Kelsey A. Bullens2, y Craig J. Goergen1
1 Weldon School of Biomedical Engineering, Universidad Purdue, West Lafayette, Indiana
2 Departamento de Bioquímica, Universidad Purdue, West Lafayette, Indiana
La fluorescencia infrarroja cercana (NIRF) es una técnica óptica emocionante que utiliza sondas fluorescentes para visualizar conjuntos biomoleculares complejos en tejidos. Las imágenes NIRF tienen muchas ventajas sobre los métodos de diagnóstico por imágenes convencionales para la toma de imágenes no invasivas de enfermedades. A diferencia de la tomografía computarizada por emisión de fotones (SPECT) y la tomografía por emisión de positrones (PET), las imágenes NIRF son rápidas y de alto rendimiento y no implican radiación ionizante. Además, los recientes avances en la ingeniería de sondas fluorescentes específicas y activables proporcionan a NIRF una alta especificidad y sensibilidad, lo que la convierte en una modalidad atractiva en el estudio del cáncer y las enfermedades cardiovasculares. El procedimiento presentado está diseñado para demostrar los principios detrás de las imágenes NIRF y cómo llevar a cabo experimentos in vivo y ex vivo en animales pequeños para estudiar una variedad de enfermedades. El ejemplo específico que se muestra aquí emplea una sonda fluorescente activa para matriz metaloproteinasa-2 (MMP2) para estudiar su absorción en dos modelos diferentes de roedores de aneurismas de la aorta abdominal (AAA).
Principios
Como su nombre indica, las imágenes NIRF utilizan luz dentro de la primera ventana de infrarrojo cercano, que va de 650 nm a 900 nm, para entregar fotones en el tejido. La energía, E, de un fotón se caracteriza por la Ecuación 1, donde h es la constante del Planck, c es la velocidad de la luz en un vacío, y es la longitud de onda de la luz.
 •
•  (Ecuación 1)
(Ecuación 1)
Las moléculas fluorescentes específicas de destino llamadas fluoróforos se introducen típicamente en el animal a través de la ingeniería genética o a través de la inyección de venas de cola antes de la toma de imágenes. Estos fluoróforos absorben la energía del fotón, que eleva la energía de las moléculas desde el estado del suelo, S0, al estado inestable y excitado S1'. Debido a la inestabilidad del estado S1', las moléculas se relajan al nivel de energía vibratoria más bajo dentro de ese estado y liberan energía en forma de calor. Los fluoróforos, ahora en el estado relajado y excitado S1, luego regresan al estado de tierra S0, emitiendo luz en una longitud de onda específica. La luz emitida, que tiene una longitud de onda más larga debido a la disipación de energía en forma de calor, se captura y se registra mediante un sistema de imágenes de fluorescencia. El cambio fundamental entre los espectros de absorción y emisión se llama el cambio Stokes y es importante, ya que permite diferenciar entre la excitación y la luz de emisión.
Procedimiento
El siguiente procedimiento proporciona los pasos detallados necesarios para recopilar imágenes in vivo y ex vivo DE NIRF de animales pequeños:
1. Configuración experimental
- Conecte una fuente de luz de fibra óptica al sistema de imágenes de fluorescencia mediante una guía de luz de fibra óptica.
- Seleccione el filtro de excitación adecuado para el experimento. El filtro de excitación determina la longitud de onda de la luz que se entregará a la muestra y debe elegirse para que coincida con el espectro de excitación del fluoróforo introducido en la muestra.
- Seleccione el filtro de emisión adecuado. El filtro de emisión bloquea los componentes espectrales no deseados, que pueden atribuirse a la autofluorescencia, y deben elegirse para que coincidan con el espectro de emisión del fluoróforo.
2. Preparación de muestras
-
In Vivo
- Anestetizar al animal en una cámara de inducción utilizando isoflurano a una concentración de 3-4% en la esfera del caudalímetro.
- Transfiera el animal a un cono nasal que esté fijado en la etapa de toma de imágenes y mantenga el isoflurano en una concentración de 1-2%. Una fuente de calor no es necesaria porque los animales normalmente sólo se imaginan durante un corto período de tiempo (> 5 min), y su temperatura corporal no disminuye sustancialmente.
- Asegure las patas del animal para minimizar los artefactos de movimiento. Retire el vello de la región de interés aplicando una crema depilatoria.
- Aplicar crema depilatoria en la zona más pequeña necesaria. Después de 30 s, límpielo con una gasa. Limpie la zona por segunda vez con una gasa humedecida con alcohol etílico para eliminar por completo la crema depilatoria.
- Aplique pomada oftálmica en los ojos para evitar el secado de las córneas.
- Inyecte la sonda molecular fluorescente activa en el animal. Para esta aplicación específica, las sondas activables MMP2 se inyectaron por vía intravenosa en la vena de la cola. En este punto, se puede crear una imagen del ratón. Proceda a la "Adquisición de imagen" de este protocolo para continuar. Supervise al animal para la respiración regular durante todo el breve procedimiento.
-
Ex Vivo
- Después de la inyección de la sonda fluorescente, eutanasia al animal de una manera humana de acuerdo con las Directrices AVMA 2013 para la eutanasia de los animales. La sobredosis de dióxido de carbono (CO2)es una práctica estándar para la eutanasia de animales pequeños.
- Extraiga quirúrgicamente el tejido u órgano de interés y retire cuidadosamente el exceso de tejido adiposo con fórceps.
- Enjuague el tejido con solución salina tamponada de fosfato para eliminar la sangre residual y colocar la muestra directamente en la etapa de toma de imágenes.
3. Adquisición de imágenes
- Abra el software de imágenes moleculares y encienda tanto la fuente de luz de fibra óptica como el sistema de imágenes de fluorescencia.
- Abra la ventana de adquisición y especifique el tipo de exposición adecuado para el estudio. Las exposiciones disponibles incluyen: Exposición estándar para capturar una sola imagen, Exposición de lapso de tiempo para capturar una serie de imágenes en un intervalo de tiempo fijo y Exposición progresiva para capturar una secuencia continua de exposiciones en diferentes momentos de exposición.
- Seleccione UV-Transillumination como fuente de iluminación.
- Utilizando la imagen previsualizada como referencia, ajuste el enfoque de la lente, el campo de visión y la f-stop/aperture en la cámara del sistema de captura para optimizar la calidad de imagen muestreada. Ajuste el tiempo de exposición y la posición de la muestra.
- Cierre la ventana de vista previa y asegúrese de que todos los parámetros de la ventana de adquisición coincidan con la configuración de la cámara y el filtro.
- Haga clic en 'Exponer' para adquirir y guardar la imagen.
- El software de imágenes moleculares estándar normalmente proporciona una variedad de herramientas analíticas, de medición y de corrección de imágenes para cuantificar las señales de fluorescencia para el análisis de imágenes.
- Al final de la sesión de imágenes, retire la muestra/animal, apague el sistema y limpie la etapa de diagnóstico para minimizar los daños en el sistema.
Resultados
En las figuras 1-2 se muestran imágenes representativas de NIRF in vivo y ex vivo tomadas de roedores con aneurismas de la aorta abdominal (AAA). Una sonda fluorescente activa fue inyectada sistémicamente a través de la vena de cola para visualizar la actividad de la matriz metaloproteinasa-2 (MMP2). MMP2 es una enzima elastolítica implicada en la degradación de la matriz extracelular que desempeña un papel importante en la iniciación y progresión de La AAA. Todas las imágenes se adquirieron utilizando un filtro de excitación de 625 nm, un filtro de emisión de 700 nm y un tiempo de exposición de 60 segundos.
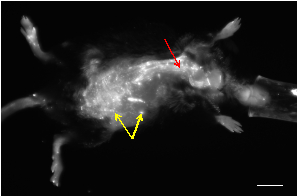
Figura 1: Una imagen representativa in vivo NIRF de un ratón apopoprotein E-deficienciat que desarrolló un AAA después de la infusión de angiotensina-II. La mayoría de las pequeñas manchas que muestran una señal alta provienen de la autofluorescencia de la piel (flechas amarillas). La vasculatura se puede visualizar como estructuras tubulares con señales de alta fluorescencia (flecha roja). Barra de escala: 1 cm.
La Figura 2 muestra un aumento en la actividad de MMP2 en la región aneurisma de la aorta abdominal, como se ve por el aumento observado en la intensidad de la señal en relación con las regiones sanas de la aorta abdominal. Este resultado es consistente con los resultados en la literatura que muestran niveles elevados de MMP2 dentro de AAA. El exceso de sondas fluorescentes se filtró y acumuló en los riñones, lo que llevó a señales fluorescentes brillantes.

Figura 2: Imágenes NIRF de AAA de dos modelos animales diferentes: (A) un AAA suprarrenal en angiotensina II-infusado apolipoprotein-E ratón deficiente y (B) un AAA infrarrenal en rata infundida con porcina pancreática elastasa. Las flechas amarillas apuntan a los AAA. Barras de escala: 3 mm.
Aplicación y resumen
Las imágenes NIRF se basan en sondas fluorescentes para cuantificar y visualizar conjuntos biomoleculares en tejidos. La energía de fotones absorbida de la luz infrarroja cercana excita las moléculas fluorescentes a un estado de energía más alto, y la luz emitida con una longitud de onda característica más larga es capturada por un sistema de imágenes de fluorescencia. Aquí, la aplicación de imágenes NIRF para estudiar la actividad De MMP2 en aneurismas de la aorta abdominal se demostró in vivo y ex vivo. A diferencia de SPECT o PET, que se consideran los estándares de oro en el estudio de los procesos metabólicos en el cuerpo de forma no invasiva, la imagen NIRF es una técnica de imagen rápida y de alto rendimiento que no implica radiación ionizante. Una de las limitaciones de esta modalidad es su profundidad de penetración relativamente pequeña. Aunque esta limitación hace que las imágenes clínicas de los tejidos profundos sean un reto, las imágenes NIRF desempeñan un papel importante en el estudio de tumores y enfermedades cardiovasculares en animales pequeños.
Dada la sonda fluorescente adecuada, muchas estructuras moleculares se pueden visualizar utilizando los procedimientos de diagnóstico por imágenes NIRF presentados para estudiar tanto el inicio de la enfermedad como la progresión en modelos animales pequeños. Las aplicaciones específicas ex vivo e in vivo incluyen 1) evaluación de la actividad de MMP en vasculatura de roedores, 2) detección temprana de tumores en diferentes tipos de cáncer, y 3) evaluación de la farmacocinética de nanopartículas y biodistribución para aplicaciones terapéuticas. Además del aumento de la actividad de MMP2 dentro de aAA, se han utilizado otras sondas fluorescentes MMP para estudiar la progresión de la aterosclerosis y para caracterizar la composición de la matriz extracelular cardíaca después de un infarto de miocardio. Además, el verde fluoróforo indocyanina se ha utilizado para estudiar la perfusión de tejido en modelos murinos de isquemia de las extremidades posteriores. Para profundizar más en la aplicación de imágenes NIRF en la detección temprana del cáncer, se pueden utilizar colorantes NIRF dirigidos a tumores para evaluar los márgenes tumorales y ayudar en los procedimientos de resección. La integración de fluoróforos infrarrojos cercanos en nanopartículas desarrolladas para la administración de fármacos permite a los científicos desarrollar terapias más eficaces basadas en nanopartículas para una variedad de enfermedades. Por último, la capacidad de localizar espacialmente la señal fluorescente en animales enteros o tejido intacto es una clara ventaja sobre otros ensayos enzimáticos convencionales (zymografía de gel) y análisis de proteínas (western blot) que requieren que los animales sean sacrificados y los tejidos sean homogeneizados.
Saltar a...
Vídeos de esta colección:

Now Playing
Imágenes de fluorescencia infrarroja de aneurismas aórticos abdominales
Biomedical Engineering
8.2K Vistas

Obtención de imágenes de muestras biológicas con microscopía óptica y confocal
Biomedical Engineering
35.7K Vistas

Imágenes con MEB de muestras biológicas
Biomedical Engineering
23.5K Vistas

Biodistribución de nanotransportadores de fármacos: Aplicaciones del MEB
Biomedical Engineering
9.3K Vistas

Imágenes por ultrasonido de alta frecuencia de la aorta abdominal
Biomedical Engineering
14.4K Vistas

Mapeo cuantitativo de la deformación de un aneurisma de la aorta abdominal
Biomedical Engineering
4.6K Vistas

Tomografía fotoacústica para obtener imágenes de sangre y lípidos de la Aorta Infrarrenal
Biomedical Engineering
5.7K Vistas

Resonancia Magnética Cardíaca
Biomedical Engineering
14.7K Vistas

Simulaciones de dinámica de fluidos computacionales del flujo sanguíneo en un aneurisma cerebral
Biomedical Engineering
11.7K Vistas

Técnicas no invasivas para medir la presión arterial
Biomedical Engineering
11.9K Vistas

Adquisición y análisis de una señal de ECG (electrocardiografía)
Biomedical Engineering
104.8K Vistas

Resistencia a la tracción de biomateriales reabsorbibles
Biomedical Engineering
7.5K Vistas

Imágenes por micro-CT de la médula espinal de un ratón
Biomedical Engineering
8.0K Vistas

Visualización de la degeneración articular de rodilla posterior a una lesión no invasiva del LCA en ratas
Biomedical Engineering
8.2K Vistas

Imágenes combinadas de SPECT y TC para visualizar la funcionalidad cardíaca
Biomedical Engineering
11.0K Vistas
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados