Method Article
Optimización de la tecnología de procesamiento de aceite de cordero Epimedii folium y prueba de su efecto en el desarrollo embrionario del pez cebra
En este artículo
Resumen
En este protocolo, la tecnología de procesamiento de aceite de cordero de Epimedii folium (EF) se optimizó aplicando una metodología experimental de superficie de diseño-respuesta de Box-Behnken, y se investigó preliminarmente el efecto de la EF cruda y optimizada extraída en agua en el desarrollo embrionario del pez cebra.
Resumen
Como medicina tradicional china (MTC), Epimedii folium (EF) tiene una historia en medicina y alimentos que tiene > 2.000 años de antigüedad. Clínicamente, la EF procesada con aceite de cordero se usa a menudo como medicamento. En los últimos años, los informes de riesgos de seguridad y reacciones adversas de productos que utilizan FE como materia prima han aumentado gradualmente. El procesamiento puede mejorar efectivamente la seguridad de la MTC. Según la teoría de la MTC, el procesamiento del aceite de cordero puede reducir la toxicidad de la FE y mejorar su efecto tonificante en los riñones. Sin embargo, hay una falta de investigación sistemática y evaluación de la tecnología de procesamiento de aceite de cordero EF. En este estudio, utilizamos la metodología experimental de superficie de diseño-respuesta de Box-Behnken para optimizar los parámetros clave de la tecnología de procesamiento mediante la evaluación del contenido de múltiples componentes. Los resultados mostraron que la tecnología óptima de procesamiento de aceite de cordero de EF era la siguiente: calentar el aceite de cordero a 120 °C ± 10 °C, agregar el EF crudo, freírlo suavemente a 189 °C ± 10 °C hasta que esté uniformemente brillante, y luego retirarlo y enfriarlo. Por cada 100 kg de EF, se deben usar 15 kg de aceite de cordero. Las toxicidades y teratogenicidades de un extracto acuoso de EF cruda y procesada con aceite de cordero se compararon en un modelo de desarrollo de embriones de pez cebra. Los resultados mostraron que el grupo de hierbas crudas tenía más probabilidades de causar deformidades de pez cebra, y su concentración de EF letal media máxima era menor. En conclusión, la tecnología optimizada de procesamiento de aceite de cordero fue estable y confiable, con buena repetibilidad. A una cierta dosis, el extracto acuoso de EF fue tóxico para el desarrollo de embriones de pez cebra, y la toxicidad fue más fuerte para el medicamento crudo que para el medicamento procesado. Los resultados mostraron que el procesamiento del aceite de cordero redujo la toxicidad de la FE cruda. Estos hallazgos se pueden utilizar para mejorar la calidad, la uniformidad y la seguridad clínica de la FE procesada con aceite de cordero.
Introducción
Epimedii folium (EF) son las hojas secas de Epimedium brevicornu Maxim., Epimedium sagittatum (Sieb. et Zucc.) Maxim., Epimedium pubescens Maxim., o Epimedium koreanum Nakai. La FE se puede utilizar para tratar la osteoporosis, el síndrome menopáusico, los bultos en los senos, la hipertensión, la enfermedad coronaria y otras enfermedades1. Como medicina tradicional china (MTC), EF tiene una historia en medicina y alimentos de más de 2.000 años. Debido a su bajo precio y notable efecto de tonificación de los riñones, es ampliamente utilizado en medicamentos y alimentos saludables. EF se procesa salteándolo con aceite de cordero, un proceso descrito por primera vez en la Teoría de procesamiento de Lei Gong escrita por Lei Xiao en el períodoLiu Song 2. Las eficacias del EF crudo y el EF salteado son bastante diferentes. La EF cruda disipa principalmente el reumatismo, mientras que la EF salteada calienta los riñones para reforzar el yang3. En la actualidad, la FE es ampliamente utilizada como materia prima en medicamentos y alimentos saludables; hay 399 medicamentos chinos patentados listados, nueve alimentos saludables importados y 455 alimentos saludables domésticos con FE como materia prima4. Este material medicinal tiene grandes perspectivas de aplicación. Sin embargo, en los últimos años, ha habido cada vez más informes de reacciones adversas y lesiones hepáticas humanas causadas por alimentos saludables y medicamentos chinos patentados que utilizan FE como materia prima, y los estudios de toxicidad relacionados 5,6,7 han informado que la HA como materia prima tiene riesgos potenciales para la seguridad.
El procesamiento medicinal chino se refiere a las técnicas farmacéuticas que pueden reducir o eliminar eficazmente la toxicidad y mejorar la seguridad de las MTC. El método de procesamiento tradicional de EF es freír con aceite de cordero, lo que reduce la toxicidad de EF y mejora su efecto de calentamiento de los riñones y promoción de yang8. Este método de procesamiento está incluido en la Farmacopea China y en varias especificaciones de procesamiento1. El proceso de EF solo se especifica de la siguiente manera: por cada 100 kg de EF, se agregan 20 kg de aceite amniótico (refinado), y se cuece suavemente hasta que sea uniforme y brillante1. No hay parámetros estrictos del método de procesamiento EF en los estándares anteriores, por lo que las especificaciones de procesamiento local no se han unificado para proporcionar coherencia. Por lo tanto, sería útil realizar un estudio sistemático del proceso de FE. En este artículo, se utilizó el método experimental de superficie de diseño-respuesta de Box-Behnken para optimizar la tecnología de procesamiento de EF.
El diseño experimental de Box-Behnken es un método típicamente utilizado para optimizar los factores en un proceso. Los parámetros de extracción se pueden optimizar estableciendo la relación funcional entre los factores de ajuste de la ecuación de regresión múltiple y los valores del efecto. Recientemente, este método ha sido ampliamente utilizado para estudiar la extracción de MTC 5,6,7 y el procesamiento 9,10,11. Varios estudios han reportado métodos de preparación de la MTC que involucran el procesamiento de sal, el procesamiento del vino y la fritura siguiendo un diseño de Box-Behnken, como para Psoraleae fructus12 procesado con sal, Cnidii fructus13 procesado con vino y Cinnamomi ramulus14 tostado. Este método ha reducido el tiempo de prueba, alta precisión de prueba y es adecuado para pruebas multifactor y multinivel. El método es más simple que el método de prueba de diseño ortogonal y más completo que el método de diseño uniforme15. Las relaciones obtenidas pueden determinar el valor predicho de cualquier punto de prueba dentro del rango de prueba, lo cual es una gran ventaja. Se puede usar un modelo de pez cebra para probar si la EF es menos tóxica después del procesamiento.
En los estudios de toxicidad de la MTC, el modelo del pez cebra tiene la doble ventaja del alto rendimiento de los experimentos celulares y las similitudes con los experimentos con roedores16. Este modelo se caracteriza por su pequeño tamaño, alta tasa de desove, ciclo de reproducción corto y facilidad de reproducción. El modelo se puede utilizar en experimentos sincrónicos a gran escala en placas de cultivo celular, y la dosis del fármaco experimental es pequeña, el ciclo experimental es corto, el costo es bajo y todo el proceso experimental es fácil de observar y operar17. Los embriones de pez cebra son transparentes y se desarrollan rápidamente. Por lo tanto, la toxicidad y los efectos teratogénicos de los fármacos sobre los tejidos viscerales en diferentes etapas del desarrollo pueden ser observados directamente bajo un microscopio18. La homología genética entre el pez cebra y los humanos es tan alta como 85%18. La vía de transducción de señales del pez cebra es similar a la de los humanos18. La estructura biológica y la función fisiológica del pez cebra son muy similares a las de los mamíferos18. Por lo tanto, un modelo de pez cebra para pruebas de drogas puede proporcionar animales experimentales que son confiables y totalmente aplicables a los humanos19.
En este estudio, utilizamos la metodología de superficie de diseño-respuesta de Box-Behnken para optimizar la cantidad y temperatura del aceite de cordero y la temperatura de fritura utilizada en la tecnología de procesamiento EF, con los contenidos de icariina, epimedina A, epimedina B, epimedina C y baohuósido I como índices de evaluación. El modelo de pez cebra se utilizó para explorar preliminarmente el efecto de un extracto de agua EF en el desarrollo embrionario del pez cebra antes y después del procesamiento para evaluar el efecto de atenuación del procesamiento en la FE.
Protocolo
Todos los experimentos relacionados con animales se llevaron a cabo con la aprobación del Comité de Ética de Experimentos del Instituto de MTC de Chongqing (número de certificado de revisión ética de animales de laboratorio: ZJS2022-03).
1. Determinación de los componentes bioactivos
NOTA: La especie utilizada en esta investigación fue Epimedium sagittatum, y las muestras se recolectaron en el condado de Fengdu, Chongqing. La muestra fue identificada como una parte seca sobre el suelo de E. sagittatum (Sieb. et Zucc.) Máxima. por investigadores del Instituto de Medicina Biológica del Instituto de Medicina Tradicional China de Chongqing.
- Preparar la solución del producto de control pesando con precisión la cantidad adecuada de cada sustancia de referencia, a saber, icariina, epimedina A (EA), epimedina B (EB), epimedina C (EC) y baohuósido I (BI), utilizando una balanza analítica electrónica, y disolver en metanol. Usando estos, prepare una solución madre de referencia mixta que contenga 381.61 μg/mL de icariina, 124.14 μg/mL EA, 110.24 μg/mL EB, 1091.75 μg/mL EC y 184.98 μg/mL BI.
- Prepare la solución del producto de prueba triturando EF a través de un tamiz No. 3. Introducir aproximadamente 0,2 g (utilizando una balanza analítica electrónica) de EF triturado en un erlenmeyer tapado, añadir 20 ml de etanol diluido y, a continuación, ultrasonicar a 400 W de potencia y frecuencia de 50 kHz durante 1 h. Agitar bien y pasar a través de un filtro de membrana de 0,22 μm para obtener la solución de prueba.
- Realice la cromatografía de la siguiente manera. Utilice cromatografía líquida de alta resolución (HPLC) con una columna C18 con dimensiones de 4,6 mm x 250 mm y un diámetro interior de 5 μm. Utilice acetonitrilo como fase móvil A y agua ultrapura como fase móvil B. Utilice los siguientes parámetros de elución de gradiente: 0-30 min, 24% A a 26% A; 30-31 min, 26% A a 45% A; 31-45 min, 45% A a 47% A. Utilice una longitud de onda de detección de 220 nm (para el detector utilizado, consulte la Tabla de materiales). Mantener la temperatura de la columna a 30 °C y la velocidad actual a 1,0 ml/min, y utilizar un tamaño de muestra de 10 μL.
- Para investigar la relación lineal, use la solución de referencia mixta como en el paso 1.1 diluida 2 veces, 4 veces, 8 veces, 16 veces y 32 veces, para icariina, EA, EB, EC y BI, respectivamente. Utilice acetonitrilo como fase móvil A y agua ultrapura como fase móvil B.
- Utilice los siguientes parámetros de elución de gradiente: 0-30 min, 24% A a 26% A; 30-31 min, 26% A a 45% A; 31-45 min, 45% A a 47% A. Utilice una longitud de onda de detección de 220 nm (para el detector utilizado, consulte la Tabla de materiales). Mantener la temperatura de la columna a 30 °C y la velocidad actual a 1,0 ml/min y utilizar un tamaño de muestra de 10 μL. Finalmente, registre las áreas pico. Trazar la regresión lineal con la concentración de referencia (eje x, μg/mL) como abscisa y el área del pico (eje y) como ordenada utilizando un software profesional (ver Tabla de materiales).
- Realizar el ensayo de precisión midiendo la solución de control mixto seis veces consecutivas por HPLC utilizando las condiciones cromatográficas mostradas en el paso 1.3. Registre el tiempo de detección y las áreas pico de cada composición química, y calcule las desviaciones estándar relativas (RSD) de las áreas pico para evaluar la precisión (reproducibilidad) utilizando la siguiente fórmula:
RSD% = desviación típica (DE)/media aritmética de los resultados calculados (X) x 100 % - Para realizar la prueba de reproducibilidad, pesar con precisión el polvo EF y preparar seis partes de la solución del producto de ensayo en paralelo de acuerdo con el método del paso 1.2. Someter las soluciones preparadas a HPLC bajo las condiciones cromatográficas presentadas en el paso 1.3. Registre los tiempos de retención y las áreas pico de cada composición química y calcule las cantidades de cada compuesto a partir de una curva estándar (áreas pico versus concentraciones). Calcule el RSD% como se indica arriba.
- Para realizar la prueba de estabilidad, almacenar las soluciones de ensayo a temperatura ambiente y medir su contenido mediante el método de HPLC descrito en el paso 1.3 a las 0 h, 2 h, 4 h, 8 h, 12 h y 24 h después de la preparación para evaluar la estabilidad. Registre los tiempos de retención y las áreas pico de cada composición química y calcule el porcentaje RSD de las áreas pico como se indica anteriormente.
- Para realizar el ensayo de recuperación de muestras, pesar 0,2 g de polvo EF en un erlenmeyer tapado durante seis réplicas. Añadir una cantidad adecuada de la solución de referencia (la cantidad de sustancia de referencia añadida a la muestra es equivalente al 100 % del contenido conocido de la muestra) y preparar la solución problema con arreglo al método presentado en la etapa 1.2.
- Inyectar las muestras en el cromatógrafo y analizar de acuerdo con las condiciones cromatográficas del paso 1.3. Registre las áreas pico y calcule los valores promedio de recuperación y RSD % de la siguiente manera:
Tasa de recuperación de muestras con picos = (contenido de muestra con picos - contenido de muestra)/cantidad de muestra x 100%
2. Optimización de la tecnología de procesamiento de aceite de cordero EF utilizando la metodología de superficie de diseño-respuesta de Box-Behnken
- Seleccione los parámetros clave en el procesamiento de EF, como la cantidad de aceite de cordero (A; 15% -35%), la temperatura del aceite de cordero (B; 50-120 ° C) y la temperatura de fritura (C; 80-300 ° C), como factores influyentes. Utilice los puntajes completos de contenido de icariin, EA, EB, EC y BI como índices de evaluación. El porcentaje de aceite de cordero aquí es el porcentaje de masa.
- Utilice el software de análisis de superficie de respuesta (consulte la Tabla de materiales) para diseñar los experimentos de superficie de respuesta de Box-Behnken, explore la superficie de respuesta cuadrática y construya un modelo polinómico de segundo orden. Seleccione el nuevo diseño Box-Behnken y establezca la opción Factores numéricos en 3; establezca los factores A, B y C. Haga clic en Continuar. Establezca la opción Respuestas en 1 (que fue la puntuación completa). Haga clic en Continuar para completar el diseño. Se planificaron un total de 17 experimentos (ver Tabla 1).
NOTA: Para las variables independientes y dependientes, junto con sus niveles bajo, medio y alto, ver Tabla 2. - Procesar la FE de acuerdo con los parámetros específicos de la Tabla 1; por ejemplo, para el número de orden 1, pese el aceite de cordero refinado como 15% v / v, y luego caliente a 50 ° C para derretirlo. Añadir el EF crudo al cordero derretido, saltear a fuego suave (190 °C) hasta que esté uniformemente brillante, y luego retirar y enfriar. Realizó 17 operaciones experimentales. En este trabajo se obtuvieron un total de 17 grupos de productos procesados con EF.
NOTA: El aceite de cordero es sólido a temperatura ambiente (25 °C) y se funde en líquido cuando se calienta. El aceite de cordero en estado líquido se puede utilizar como excipiente. - Preparar las soluciones de ensayo de los productos transformados según el método descrito en el paso 1.2. A continuación, analícelos mediante HPLC de acuerdo con las condiciones cromatográficas descritas en el paso 1.3. Registre los tiempos de retención y las áreas pico de cada composición química, y calcule el contenido de icariina, EA, EB, EC y BI en cada solución de prueba contra una curva estándar externa. Utilice la fórmula de cálculo de puntuación completa a continuación para calcular las puntuaciones completas de los 17 grupos experimentales:
Puntuación completa = Z/Z máx. × 0,5 + BI/BImáx. × 0,5
donde Z es la suma de los contenidos de icariina, EA, EB y CE; Zmax es el valor máximo de la suma de los contenidos de icariina, EA, EB y EC en los 17 grupos experimentales; BI es el contenido de BI; y BImax es el valor máximo del contenido de BI en los 17 grupos experimentales. - Importe los resultados de puntuación completos de los 17 grupos de experimentos en el software de análisis de datos (consulte la Tabla de materiales) para analizar los datos experimentales. En los elementos de evaluación, seleccione la opción de orden de proceso cuadrático y la opción de tipo de modelo polinómico.
3. Prueba del efecto del procesamiento en el desarrollo embrionario del pez cebra
- Preparación de muestras
- Triture el crudo y el EF procesado a través de un tamiz No. 3 (consulte la Tabla de materiales). A 100 g de cada muestra de EF, agregue 1,000 ml de agua ultrapura. Remoje el EF durante 0,5 h, hierva el agua dos veces durante 30 minutos cada una y luego filtre con papel de filtro.
- Combinar los filtrados y concentrar la muestra calentando. Añadir agua ultrapura a un volumen final de 100 ml para obtener las soluciones madre de EF procesada (PEF, 1 g/ml) y EF bruta (CEF,1 g/ml). Mida la cantidad de medicamento crudo en cada solución madre.
- Colocar alícuotas de 1 ml, 1,5 ml, 2,5 ml, 5 ml y 7,5 ml de soluciones madre en matraces aforados de 10 ml y, a continuación, añadir agua ultrapura al volumen para preparar las soluciones de ensayo con concentraciones de 100 mg/ml, 150 mg/ml, 200 mg/ml, 250 mg/ml, 500 mg/ml y 750 mg/ml para el estudio de embriotoxicidad del pez cebra.
NOTA: Las concentraciones de las soluciones de ensayo se prepararon remitiéndose a la bibliografía pertinente 20,21 y realizando experimentos preliminares para dar el gradiente de concentración de10 veces utilizado en toxicología normal. La MCE fue una muestra sin procesar, y la HAP fue una muestra preparada con la mejor tecnología de procesamiento descrita en la sección 2.
- Cría de pez cebra y tratamiento embrionario21
- Adapte el pez cebra de tipo salvaje (consulte la Tabla de materiales) a una temperatura controlada durante 2 días, manténgalos en un acuario de flujo continuo a pH 7.0-7.4 y aliméntelos dos veces al día.
NOTA: La inhibición de la formación de melanina en el pez cebra se logró mediante la adición de 1-fenil-2-tiourea en una concentración de 0,003% (masa/volumen) al medio de cultivo, que mantuvo sus cuerpos transparentes para la observación morfológica. - Seleccione peces cebra de tipo salvaje fértiles adultos por la noche y sepárelos usando deflectores en cajas de apareamiento. Retire los deflectores a la mañana siguiente y deje que los peces desoven durante 30 minutos. Recogió los huevos fertilizados con un gotero cada 15 min. En total, se recolectaron 520 embriones sanos de tipo salvaje. Mantener los embriones de pez cebra en una incubadora a 28,5 °C durante 24 h.
- Asigne aleatoriamente los embriones sanos a las 24 h después de la fertilización (hpf) a 13 grupos, y junto con un grupo control, remoje por separado en 10 ml de cada una de las siguientes soluciones en una placa de cultivo: PEF: 100 μg/mL, 150 μg/mL, 200 μg/mL, 250 μg/mL, 500 μg/mL, 750 μg/mL; CEF: 100 μg/mL, 150 μg/mL, 200 μg/mL, 250 μg/mL, 500 μg/mL, 750 μg/mL. Trate el grupo de control en blanco con el medio como una solución. Cada grupo contenía 40 embriones en este estudio.
NOTA: La composición media es 0.15 M NaCl, 5 mM KCl, 0.25 mM Na 2 HPO 4, 0.45 mM KH 2 PO 4, 1.3 mM CaCl2, 1.0 mM MgSO 4 y 4 mM NaHCO3. - Cultive el pez cebra en una incubadora de temperatura constante hasta 120 hpf. Contar el número de larvas muertas cada día, observar la morfología de los órganos principales de las larvas en cada grupo experimental bajo un microscopio estereoscópico (barra de escala = 500 μm, ver Tabla de materiales), y calcular la concentración de media muerte (CL50) del pez cebra a 72 hpf utilizando software de análisis de datos (ver Tabla de materiales).
- Adapte el pez cebra de tipo salvaje (consulte la Tabla de materiales) a una temperatura controlada durante 2 días, manténgalos en un acuario de flujo continuo a pH 7.0-7.4 y aliméntelos dos veces al día.
Resultados
Resultados de la investigación metodológica
Se observó una relación lineal entre la concentración de icariina, EA, EB, EC, BI y áreas pico cromatográficas (ver Tabla 3). Los valores de RSD% (n = 6) de las áreas pico cromatográficas de icariin, EA, EB, EC y BI fueron 0,28%, 1,22%, 0,65%, 1,67% y 1,06%, respectivamente, lo que indica que la precisión de las mediciones de HPLC fue buena. Los valores de RSD% (n = 6) de los contenidos de icariin, EA, EB, EC y BI fueron 1,59%, 1,46%, 1,86%, 2,29% y 0,98%, respectivamente, lo que indica que el método tenía buena repetibilidad. Los valores de RSD% (n = 6) de las áreas pico de icariina, EA, EB, EC y BI en las muestras fueron 1,49%, 1,96%, 1,42%, 0,96% y 0,81%, respectivamente, lo que indica que la solución de la muestra fue estable dentro de las 24 h. Las tasas medias de recuperación de icariina, EA, EB, EC y BI fueron de 99,98%, 100,14%, 100,09%, 100,75% y 100,94%, respectivamente, y los valores de RSD% fueron 0,56%, 0,78%, 0,84%, 1,10% y 1,47%, respectivamente (ver Tabla 4). Estos resultados muestran que la precisión del método cumplió con los requisitos.
Los resultados experimentales anteriores mostraron que el método analítico proporcionó resultados que tenían una excelente precisión, reproducibilidad y exactitud y eran aceptables para el análisis de calidad de los productos procesados con EF.
Optimización de la tecnología de procesamiento de aceite de cordero de EF mediante la aplicación de la metodología de superficie de diseño-respuesta de Box-Behnken
Se realizó el ajuste de regresión polinómica cuadrática de los datos anteriores para obtener el siguiente modelo: Y = 0,86 − 0,11 x A + 0,025 x B − 0,078 x C − 0,023 x A x B − 0,037 x A x C + 0,037 x B x C − 0,045 x A 2 + 2,5 x 10-3 x B 2 − 0,14 x C 2. El análisis de varianza dio un valor de P < 0,01, indicando que el modelo fue significativo. El valor de p de la falta de ajuste fue de P > 0,05, lo que indica que la falta de ajuste no fue significativa. El valor de R2 fue 0.9300, lo que indica que el ajuste del modelo fue bueno y el error fue pequeño. Fue factible utilizar este modelo para analizar y predecir el efecto del contenido de composición química del EF salteado con aceite de cordero. Además, A 2 y D2 tuvieron un efecto sobre el contenido de los productos procesados, y la diferencia fue estadísticamente significativa (P < 0,01). Los efectos de A y C del término de un grado y C2 del término de segundo orden en la puntuación integral fueron significativos. El término de un grado B, el segundo orden A 2, B2 y todos los elementos de interacción no tuvieron un efecto significativo en la puntuación integral. El análisis de los valores de P mostró que, de los parámetros experimentales, la cantidad de aceite de cordero (A) tuvo el mayor efecto en la puntuación global, seguida de la temperatura de fritura (C) y luego la temperatura del aceite de cordero (B). Los resultados anteriores se muestran en la Tabla 5.
El software se utilizó para establecer la cantidad de aceite de cordero, la temperatura del aceite de cordero y la temperatura de fritura a las medianas y para usar la puntuación completa como índice para dibujar un diagrama de influencia de un solo factor de un factor (Figura 1). El aumento de la temperatura de fritura primero aumentó la puntuación completa y luego la disminuyó (Figura 1). La temperatura del aceite de cordero tuvo un efecto insignificante en la puntuación completa. La cantidad de aceite de cordero fue el principal factor significativo que afectó el cambio en la puntuación integral, y a medida que la cantidad aumentó, el contenido tendió a la baja.
Para ayudar a comprender mejor los resultados, los modelos predichos se presentan en la Figura 2 como gráficos de superficie de respuesta 3D. En términos de la pendiente de la superficie de respuesta, cuanto mayor sea la importancia del efecto de interacción entre los factores, más suave será la pendiente y menos significativo será el efecto. Una elipse en forma de curva de nivel indica una fuerte interacción entre factores, mientras que un círculo indica lo contrario. La superficie de respuesta de la cantidad de aceite de cordero y la temperatura de fritura fue más pronunciada en comparación con los otros factores probados, y las curvas de nivel tendían a ser más elípticas (ver Figura 2C, D), lo que indica que la interacción entre estos dos factores fue más significativa; en contraste, las interacciones entre otros factores no fueron significativas (ver Figura 2A,B,E,F).
La tecnología óptima de procesamiento de aceite de cordero de EF se seleccionó de la siguiente manera: una cantidad de aceite de cordero del 15%; una temperatura del aceite de cordero de 120 °C; y una temperatura de fritura de 189 °C. Teniendo en cuenta que la temperatura no se puede controlar con mucha precisión en el funcionamiento real, el valor de temperatura se especifica como una variable ±10 °C. Por lo tanto, los parámetros finales fueron los siguientes: una cantidad de aceite de cordero del 15%; una temperatura del aceite de cordero de 120 °C ± 10 °C; y una temperatura de fritura de 189 °C ± 10 °C. El proceso óptimo fue el siguiente: calentar el aceite de cordero a 120 °C ± 10 °C, añadir el crudo EF, freírlo con fuego suave (189 °C ± 10 °C) hasta que esté uniformemente brillante, y retirar y enfriar. Por cada 100 kg de FE, se deben usar 15 kg de aceite de cordero (aceite refinado). Utilizando estas condiciones, se realizaron tres experimentos paralelos, y las puntuaciones obtenidas fueron 0,96, 0,97 y 0,94 (RSD% = 1,60%), lo que indica condiciones estables y factibles. Los cromatogramas típicos de HPLC de las sustancias de referencia crudas, procesadas y mixtas de EF se muestran en la Figura 3.
Prueba del efecto del procesamiento en el desarrollo embrionario del pez cebra
El pez cebra eclosionó en juveniles a 72 hpf. El desarrollo de cada órgano fue básicamente completo. Los cuerpos de los peces permanecieron transparentes, y fue fácil colocarlos de lado en el tobogán de vidrio. Las formas de los órganos eran fáciles de observar e identificar cuando se veían bajo un microscopio. El grupo control en blanco no experimentó ninguna muerte o toxicidad orgánica durante el período de administración. En comparación con el grupo control, a una concentración del fármaco de 100 μg/ml, no se encontraron anomalías obvias en el grupo de FE bruta (S) y el grupo procesado (P) a 72 hpf. A 96 hpf y más tarde, la incompletitud de la vejiga natatoria y la pérdida de la vejiga natatoria fueron más comunes en los peces juveniles en el grupo crudo, pero fueron raros en los peces juveniles en el grupo procesado. A una concentración del fármaco de 150 μg/ml, se observaron deformidades espinales obvias, deformidades de curvatura corporal, edema pericárdico y deformación hepática en los peces juveniles del grupo crudo a 72 hpf, pero esos cambios fueron raros en los peces juveniles del grupo procesado, y el grado de teratogenicidad fue más débil que el del grupo crudo. A una concentración de fármaco de 200 μg/ml, todos los peces juveniles en el grupo crudo murieron, y apareció teratogenicidad obvia en los peces juveniles en el grupo procesado. A una concentración de fármaco de 250 μg/ml, un pequeño número de pez cebra sobrevivió en el grupo procesado. Los resultados del examen microscópico del pez cebra se muestran en la Figura 4.
Las tasas de mortalidad del pez cebra en los grupos de hierbas Epimedium crudas y procesadas dependieron de la concentración y el tiempo de administración. La relación tiempo-dosis-mortalidad se muestra en la Figura 5. Los resultados de mortalidad del pez cebra mostraron que 24 h después de la administración (48 hpf), a una concentración de fármaco de 200 μg / ml, todos los peces cebra en el grupo de drogas crudas murieron, mientras que la mortalidad en el grupo procesado fue solo del 6,67%. A las 48 h después de la administración de FE (72 hpf), la concentración que causó la muerte de todos los peces cebra en el grupo de drogas crudas fue de 200 μg / ml, y la concentración que causó la muerte de todos los peces cebra en el grupo procesado fue de 500 μg / ml. Se calculó la concentración letal mediana de los dos grupos experimentales a 72 hpf. Los resultados mostraron que la CL50 (ver Figura 6) fue de 151,3 μg/mL en el grupo crudo (S) y de 219,8 μg/mL en el grupo procesado (P).

Figura 1: Análisis univariante. La figura muestra el diagrama de influencia de un solo factor. A es el resultado de un solo factor de la cantidad de aceite de cordero (sebo); B es el resultado de un solo factor de la temperatura del aceite de cordero (sebo); y C es el resultado de un solo factor de la temperatura de fritura. Con una temperatura de fritura en aumento, la puntuación completa primero aumenta y luego disminuye. La temperatura del aceite de cordero tiene poco efecto en la puntuación. La cantidad de aceite de cordero fue el principal factor significativo que afectó el cambio en la puntuación integral, y el contenido mostró una tendencia a la baja con una cantidad creciente de aceite de cordero. Haga clic aquí para ver una versión más grande de esta figura.
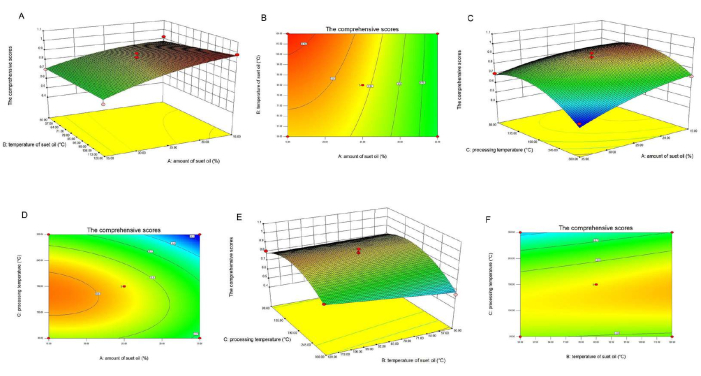
Figura 2: Superficie de respuesta y gráfico de contorno de la influencia de diferentes interacciones factoriales en la puntuación global. (A) Esta figura muestra un gráfico de superficie de respuesta 3D de la interacción entre la cantidad de aceite de cordero y la temperatura. (B) Esta figura muestra un diagrama de contorno de la interacción entre la cantidad de aceite de cordero y la temperatura. (C) Esta figura muestra un gráfico de superficie de respuesta 3D de la interacción entre la cantidad de aceite de cordero y la temperatura de procesamiento. (D) Esta figura muestra un diagrama de contorno de la interacción entre la dosis de aceite de cordero y la temperatura de procesamiento. (E) Esta figura muestra un gráfico de superficie de respuesta 3D de la interacción entre la cantidad de aceite de cordero y la temperatura de procesamiento. (F) Esta figura muestra un diagrama de contorno de la interacción entre la cantidad de aceite de cordero y la temperatura de procesamiento. El resultado muestra que la superficie de respuesta de la cantidad de aceite de cordero y la temperatura de fritura fue pronunciada, que los otros parámetros probados y las líneas de contorno tendían a ser elípticas (ver C, D), lo que indica que la interacción entre estos dos factores fue significativa, mientras que las interacciones entre otros factores no fueron significativas (ver A, B, E, F). El término aceite de sebo utilizado en la figura se refiere al aceite de cordero. Haga clic aquí para ver una versión más grande de esta figura.
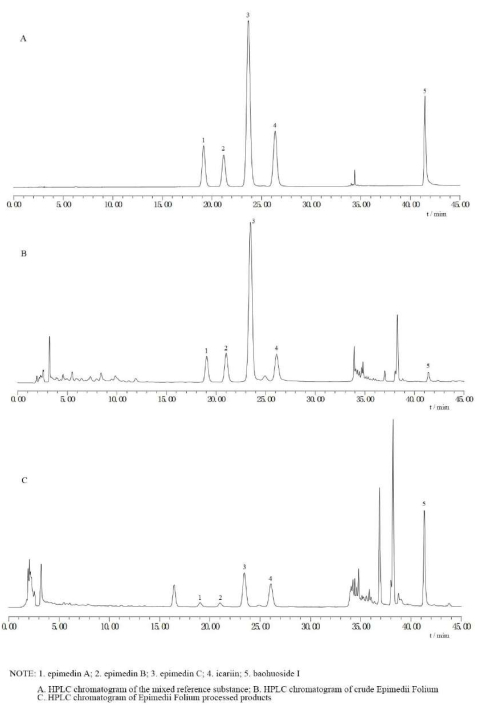
Figura 3: Cromatogramas por HPLC de las sustancias de referencia crudas, procesadas y mixtas de la FE. (A) Esta figura muestra el cromatograma HPLC de la sustancia de referencia mixta. (B) Esta figura muestra el cromatograma HPLC de Epimedii folium crudo. (C) Esta figura muestra el cromatograma HPLC de los productos procesados Epimedii folium. Estas tres imágenes demuestran que el contenido de BI en EF sin procesar es bajo, mientras que aumenta después del procesamiento. Haga clic aquí para ver una versión más grande de esta figura.
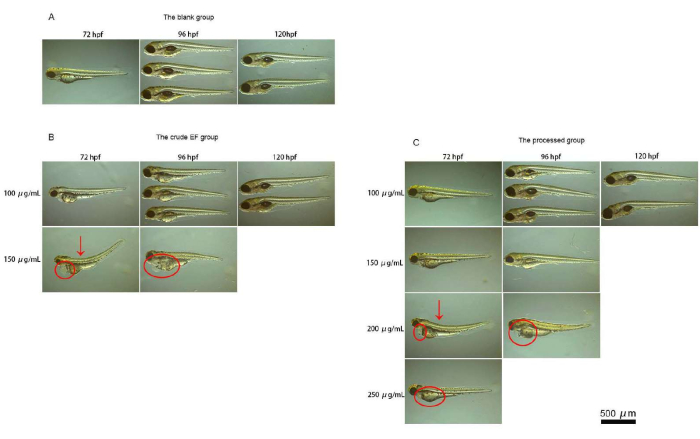
Figura 4: Micrografías de pez cebra. Esta figura muestra micrografías del pez cebra. (A) Esta figura muestra los resultados para la observación del pez cebra bajo un microscopio en el grupo en blanco. (B) Esta figura muestra los resultados para la observación del pez cebra bajo un microscopio en el grupo crudo. (C) Esta figura muestra los resultados para la observación del pez cebra bajo un microscopio en el grupo procesado. El grupo control en blanco no experimentó ninguna muerte o toxicidad orgánica durante el período de administración. A una concentración de fármaco EF de 150 μg/ml, se observaron deformidades espinales obvias, curvatura corporal, edema pericárdico y deformación hepática en los peces juveniles del grupo crudo a 72 hpf, mientras que esos cambios fueron raros en los peces juveniles del grupo procesado, y el grado de teratogenicidad fue más débil que en el grupo crudo. A una concentración de fármaco de 200 μg/ml, todos los peces juveniles en el grupo crudo murieron, y apareció teratogenicidad obvia en el grupo procesado. A una concentración de fármaco de 250 μg/ml, sólo un pequeño número de pez cebra sobrevivió en el grupo procesado. Haga clic aquí para ver una versión más grande de esta figura.

Figura 5: La relación dosis-dosis-mortalidad. Esta figura muestra la relación dosis-tiempo-dosis-mortalidad. (A) Esta figura muestra la relación dosis-tiempo-dosis-mortalidad del grupo bruto. (B) Esta figura muestra la relación dosis-tiempo-dosis-mortalidad del grupo procesado. n = 40. Haga clic aquí para ver una versión más grande de esta figura.
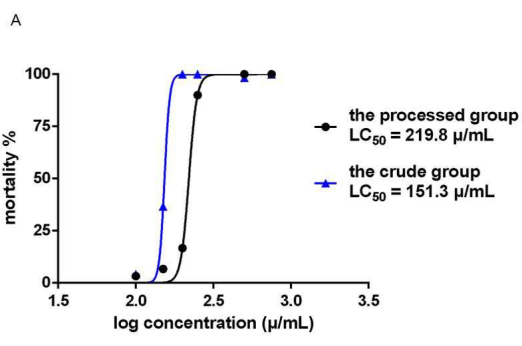
Figura 6: Diagrama LC50 de crudo y EF procesado. Se muestra el diagrama LC50 del EF crudo y procesado. Se calcularon las concentraciones letales medianas de los dos grupos experimentales a 72 hpf. La CL50 fue de 151,3 μg/mL en el grupo crudo (S) y de 219,8 μg/mL en el grupo de procesamiento (P). n = 40. Haga clic aquí para ver una versión más grande de esta figura.
Tabla 1: Diseño experimental y resultados del método de superficie de respuesta de Box-Behnken de los 17 grupos de experimentos. La Tabla 1 muestra los 17 grupos de experimentos diseñados por el método de superficie de diseño-respuesta de Box-Behnken y sus resultados de puntuación integral. Haga clic aquí para descargar esta tabla.
Tabla 2: Variables utilizadas en el diseño de Box-Behnken. Las variables independientes y dependientes se enumeran aquí junto con sus niveles bajo, medio y alto. El diseño de Box-Behnken permitió la identificación de los factores más influyentes en el procesamiento de EF, con la cantidad de aceite de cordero (A) (15% -35%), la temperatura del aceite de cordero (B) (50 °C-120 °C) y la temperatura de fritura (C) (80 °C-300 °C) como factores influyentes. Haga clic aquí para descargar esta tabla.
Tabla 3: Ecuaciones de regresión y rangos lineales de los constituyentes químicos de la FE. Los resultados de la ecuación de regresión y el rango lineal de la composición química de la FE muestran que hubo buena linealidad entre cada una de las concentraciones de icariina, EA, EB, EC y BI y sus áreas pico cromatográficas. Haga clic aquí para descargar esta tabla.
Tabla 4: Tasas de prueba de recuperación de muestras. Las tasas medias de recuperación de icariina, EA, EB, EC y BI fueron 99,98%, 100,14%, 100,09%, 100,75% y 100,94%, respectivamente, y los valores de RSD% fueron 0,56%, 0,78%, 0,84%, 1,10% y 1,47%, respectivamente. Los resultados muestran que la precisión del método fue adecuada. Haga clic aquí para descargar esta tabla.
Tabla 5: Coeficientes de regresión del modelo cuadrático predicho. El valor de p del modelo fue de p < 0,01, lo que indica que el modelo fue significativo. El valor de p de la falta de ajuste fue de P > 0,05, lo que indica que la falta de ajuste no fue significativa. El valor de R2 fue 0.9300, lo que indica que el ajuste del modelo fue bueno y el error fue pequeño, por lo que el modelo fue adecuado para analizar y predecir el efecto del contenido de composición química del EF salteado con aceite de cordero. Además, A 2 y D2 tuvieron efectos significativos en el contenido de productos procesados (P < 0,01). Las influencias de A y C del término de un grado y C2 del término de segundo orden en la puntuación integral fueron significativas. El término de un grado B, el segundo orden A 2, B2 y todos los ítems de interacción no tuvieron efectos significativos en la puntuación integral. El análisis del valor de P mostró que, de los parámetros experimentales, la cantidad de aceite de cordero (A) tuvo la mayor influencia en la puntuación global, seguida de la temperatura de fritura (C) y luego la temperatura del aceite de cordero (B). Haga clic aquí para descargar esta tabla.
Discusión
Variables independientes y determinación de sus niveles
La tecnología de procesamiento EF solo se describe en la edición 2020 de la Farmacopea China y las especificaciones locales de procesamiento de medicamentos chinos publicadas por 26 provincias, municipios y regiones autónomas de todo el país1. La descripción implica los siguientes pasos: tomar aceite de cordero y calentarlo para que se derrita, agregar trozos EF, freír a fuego lento hasta que esté uniforme y brillante, sacarlo y dejar que se enfríe. Además, se utilizan 20 kg (abreviado como 20%) de aceite de cordero (refinado) por cada 100 kg de Epimedium. Sin embargo, no se especifican los parámetros del proceso de procesamiento de EF. Entre las variables independientes en este experimento, se pudieron cuantificar tres factores clave en el proceso de producción: la dosis de aceite de cordero, la temperatura del aceite de cordero y la temperatura de fritura. El rango de valores debe establecerse de acuerdo con la descripción anterior. A partir de los resultados de la prueba preliminar, se puede ver que cuando la cantidad de aceite de cordero es del 15%, las hojas EF se pueden cubrir uniformemente con aceite de cordero. Cuando la dosis supera el 35%, hay demasiado aceite de cordero. Finalmente, el rango de la cantidad de aceite de cordero debe ser 15% -35%. Cuando la temperatura alcanza los 50 °C, el aceite de cordero se derrite. Cuando la temperatura alcanza > 120 ° C, el aceite de cordero comienza a humear y la temperatura es demasiado alta. Por lo tanto, el rango de temperatura del aceite de cordero debe ser de 50 ° C a 120 ° C. La edición 2020 de la Farmacopea China estipula que la EF debe saltearse con fuego lento. El fuego lento no debe exceder los 200 °C, y la temperatura de fritura debe oscilar entre 80 °C y 300 °C.
Puntuación completa
Durante el procesamiento de Epimedium, los enlaces glucosídicos se rompen y los componentes glucosídicos se transforman en componentes glucosídicos inferiores. La determinación del contenido de productos procesados con HA en la edición 2020 de la Farmacopea China se basa en la determinación del contenido total de icariina, EA, EB y EC en los materiales medicinales originales, y un componente monoglucósido, BI, se enumera por separado como indicador. En este experimento, el peso total de la icariina, EA, EB y EC en la FE procesada fue del 50%, el peso de la BI fue del 50% y la puntuación integral se estableció en función de estos valores.
La metodología de superficie de respuesta (RSM) es una técnica estadística para identificar parámetros óptimos del proceso y resolver problemas multivariantes. En esta técnica, se utiliza un diseño experimental razonable para obtener ciertos datos a través de experimentos, y se utiliza una ecuación de regresión cuadrática multivariante para derivar una relación funcional entre los factores y las respuestas22. El diseño uniforme y la optimización del proceso de diseño ortogonal se usan comúnmente, pero su precisión de prueba no es alta y el modelo matemático no es muy predecible. El modelo matemático subyacente a RSM es altamente predecible. RSM requiere menos experimentos y ciclos más cortos, lo que no sólo puede eliminar los problemas asociados con la estadística matemática tradicional, sino que también puede aclarar las relaciones entre los factores y las respuestas23. RSM conceptualiza la respuesta del sistema en función de uno o más factores y utiliza técnicas gráficas para mostrar esta relación funcional para ayudar al usuario a seleccionar las condiciones óptimas en el diseño experimental mediante la observación visual intuitiva. Estas ventajas han llevado al amplio uso de este método en la industria química24, la ingeniería biológica, la industria alimentaria25, la industria farmacéutica y las preparaciones de MTC.
Aunque RSM puede identificar la relación funcional entre las respuestas (índices a investigar) y los factores (variables independientes), no todos los experimentos son adecuados para la optimización de la superficie de respuesta porque no siempre existe una fuerte relación funcional entre la respuesta y los factores. RSM a menudo obtiene relaciones de función continuas, que requieren que todos los factores sean variables continuas. Sin embargo, no todos los factores a investigar son variables continuas o tienen efectos significativos sobre los valores de respuesta al inicio del diseño experimental. Para reducir el número de experimentos y mejorar la precisión del modelado de superficie de respuesta, es necesario seleccionar los factores significativos y determinar sus niveles a través del diseño factorial, el diseño uniforme o el diseño ortogonal antes de realizar la metodología de diseño de superficie de respuesta. La mayor ventaja de la metodología de superficie de respuesta es que una vez que el modelo se establece correctamente, se puede predecir el valor de respuesta bajo cualquier combinación de condiciones, y la relación funcional se puede ver de manera más intuitiva y visual a través de la superficie de respuesta 3D. Esta visualización es de gran ayuda para los investigadores en la búsqueda de las condiciones óptimas de procesamiento26.
Este estudio utilizó el principio de diseño de Box-Behnken de RSM para diseñar 17 experimentos combinados utilizando la puntuación de contenido químico integral de EF como valor de respuesta. Finalmente, los mejores resultados de optimización de procesos se obtuvieron mediante análisis de regresión. La tecnología de procesamiento se optimizó de la siguiente manera: calentar el aceite de cordero a 120 °C ± 10 °C, agregar el crudo EF, freírlo con un fuego suave (189 °C ± 10 °C) hasta que esté uniformemente brillante, y luego retirarlo y enfriarlo. Por cada 100 kg de FE, se deben usar 15 kg de aceite de cordero (aceite refinado). Nuestros resultados mostraron que el proceso de EF fue estable, confiable y repetible. Además, se analizaron las interacciones de los factores, y la interacción entre la cantidad de aceite de cordero y la temperatura de fritura, pero no las interacciones entre otros factores, fue significativa. Este estudio demostró que el diseño de la superficie de respuesta, como método para analizar las interacciones entre los factores y las relaciones entre los factores y sus valores de superficie de respuesta, permitió la optimización de las condiciones de procesamiento en un período corto con un número mínimo de experimentos. Los factores seleccionados en este estudio fueron los factores clave identificados en el experimento de detección de un solo factor, y sus niveles se determinaron en un experimento preliminar. Las muestras de prueba se ajustaron a las características del método de superficie de respuesta, por lo que el estudio pudo utilizar la metodología de superficie de respuesta para establecer un modelo predictivo. Los resultados experimentales pueden proporcionar una referencia para mejorar la calidad y la uniformidad de la FE procesada.
Los embriones de pez cebra se utilizan como organismos modelo en el campo de la genética del desarrollo porque son transparentes, se desarrollan in vitro y son fáciles de observar27. Los indicadores de toxicidad del pez cebra comúnmente utilizados en los estudios de toxicidad para el desarrollo incluyen mortalidad embrionaria, tasa de malformación embrionaria, edema del saco vitelino, formación de pigmento, condensación de huevos, extensión de la cola, morfología de la cabeza y formación del segmento corporal, entre otros28. En comparación con las técnicas de evaluación de la toxicidad en mamíferos, la especificidad de los embriones de pez cebra para la detección de toxicidad compuesta es del 70%-80%, y la sensibilidad supera el 80%18. Ton et al.29 encontraron que la precisión de evaluar la toxicidad para el desarrollo de compuestos no teratogénicos con embriones de pez cebra fue del 75%. Los compuestos teratogénicos se evaluaron con una precisión del 100% aquí. Aunque la MTC tiene las características de componentes complejos y órganos diana poco claros de toxicidad, los embriones de pez cebra todavía se pueden utilizar como un modelo animal experimental para la evaluación precisa y rápida de la toxicidad para el desarrollo. He et al.30 encontraron que la emodina afectaba las tasas de supervivencia y eclosión de los embriones de pez cebra, causando flexión del tronco y edema del saco vitelino. Chen et al.31 encontraron que la muscona causaba edema pericárdico embrionario de pez cebra, curvatura espinal y edema del saco vitelino. He et al.32 encontraron que Arnebiae Radix tenía efectos letales sobre el pez cebra en todas las etapas de desarrollo, y 1,0 mg/L Arnebiae Radix inhibió el desarrollo embrionario, resultando en un número reducido de somitas, deformidades de la cola, flexión corporal y melanina reducida en embriones de pez cebra.
Para investigar los efectos de la FE cruda y procesada en el desarrollo del embrión de pez cebra, se realizó un experimento de toxicidad para el desarrollo del embrión de pez cebra en este estudio. Los datos mostraron que los valores de CL50 fueron 151,3 μg/mL para el grupo crudo (S) y 219,8 μg/mL para el grupo procesado (P). La observación de los cuerpos del pez cebra en cada grupo experimental a través de un microscopio mostró un grado obvio de teratogenicidad del pez cebra en el grupo crudo. La mayoría de los peces mostraron diversos grados de teratogenicidad, incluyendo deformidad espinal, deformidad de la curvatura corporal, edema pericárdico, vejiga natatoria incompleta o deformación hepática, y estas observaciones fueron raras en el grupo procesado. Estos experimentos mostraron que la toxicidad de la FE se redujo significativamente después del procesamiento, lo que sugiere que el procesamiento podría reducir la toxicidad del fármaco en humanos. Los resultados experimentales proporcionan una referencia para mejorar la seguridad clínica de la medicación de la FE procesada con aceite de cordero.
La medicina tradicional china sugiere que la función del riñón está estrechamente relacionada con el crecimiento, desarrollo y reproducción del cuerpo humano33. Los antiguos libros de medicina tradicional china registran que el riñón es la médula ósea del cuerpo. El riñón almacena la esencia y la médula reside en la cavidad ósea para nutrir el hueso. Cuando la esencia del riñón es deficiente, la médula ósea se reduce34. La medicina tradicional china de tonificar el yang del riñón puede tratar la debilidad lumbar, la osteoporosis, la impotencia, la eyaculación precoz y la infertilidad por frío uterino35. EF es uno de los materiales medicinales representativos para tonificar el yang renal. Estudios farmacológicos modernos han demostrado que la FE tiene efectos evidentes sobre el sistema esquelético, el sistema inmunológico, el sistema reproductivo, el sistema cardiovascular y el sistema nervioso, además de tener efectos antitumorales36. En términos de actividad sobre el sistema esquelético, icariin37 puede mejorar el nivel de E2 sérico en ratas ovariectomizadas y regular al alza la expresión del ARNm de ERβ en el tejido óseo de ratas ovariectomizadas. La síntesis de ERβ aumenta, mejorando así el efecto biológico de ER, debilitando la actividad de resorción ósea de los osteoclastos y mejorando la formación ósea de osteoblastos. Los cambios en la resorción ósea son mayores que el balance negativo del metabolismo óseo. Epimedin A puede mejorar la microestructura ósea y los marcadores de recambio óseo sérico en ratones modelo de osteoporosis al inhibir la formación, diferenciación y resorción ósea de osteoclastos y desempeñar un papel en la protección ósea38. Epimedin C tiene una actividad antiosteoporosis evidente, principalmente en términos de aumentar la masa ósea y mejorar la microestructura trabecular para finalmente aumentar la resistencia ósea39. Otros estudios han demostrado que la epimedina B40 y el baohuósido I41 tienen actividad antiosteoporosis.
Divulgaciones
Los autores declaran no tener conflictos de intereses.
Agradecimientos
Este trabajo cuenta con el apoyo del Proyecto Empresarial de Investigación Científica Básica de la Academia de Medicina Tradicional China de Chongqing (Número de proyecto: jbky20200013), el Proyecto de Orientación de Incentivos al Desempeño de las Instituciones de Investigación Científica de Chongqing (Número de proyecto: cstc2021jxjl 130025), y el Proyecto de Construcción de Disciplina Clave de la Comisión Municipal de Salud de Chongqing de Procesamiento de Materia Médica China.
Materiales
| Name | Company | Catalog Number | Comments |
| Acetonitrile | Fisher | 197164 | |
Baohuoside 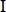 (B (B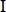 ) ) | Chengdu Manst Biotechnology Co., Ltd. | MUST-20042402 | |
| Chromatographic column | Waters Corporation | Symmetry C18 | |
| Design Expert software | Stat- Ease Inc., Minneapolis, MN | Trial Version8.0.6.1 | |
| Detector | Waters Corporation | 2998 | |
| Disintegrator | Hefei Rongshida Small Household Appliance Co., Ltd. | S-FS553 | |
| Electronic analytical balance | Mettler-Toledo International Inc. | MS205DU | |
| Epimedin A (EA) | Chengdu Manst Biotechnology Co., Ltd. | MUST-21112118 | |
| Epimedin B (EB) | Chengdu Manst Biotechnology Co., Ltd. | MUST-20080403 | |
| Epimedin C (EC) | Chengdu Manst Biotechnology Co., Ltd. | MUST-20080310 | |
| Ethanol | Chongqing Chuandong Chemical ( Group ) Co., Ltd. | 20180801 | |
| Graphpad software | GraphPad Software Inc., San Diego, CA, USA | 6.02 | |
| High Performance Liquid Chromatography (HPLC) | Waters Corporation | 2695 | |
| Icariin | Chengdu Glip Biotechnology Co., Ltd. | 21091401 | |
| Methanol | Chongqing Chuandong Chemical (Group) Co., Ltd. | 20171101 | |
| Microporous membrane | Tianjin Jinteng Experimental Equipment Co., Ltd. | 0.22μm | |
| Mutton oil | Kuoshan Zhiniu Fresh Food Store | 20211106 | |
| Office Excel office software | Microsoft | Office Excel 2021 | |
| Pharmacopoeia sieve | Shaoxing Shangyu Huafeng Hardware Instrument Co., Ltd. | R40/3 | |
| Pure water machine | Chongqing Andersen Environmental Protection Equipment Co., Ltd. | AT Sro 10A | |
| Qualitative filter paper | Shanghai Leigu Instrument Co., Ltd. | 18cm | |
| Stereomicroscope | Carl Zeiss, Oberkochen, Germany | Stemi 2000 | |
| Ultrasonic cleaner | Branson Ultrasonics (Shanghai) Co.,Ltd. | BUG25-12 | |
| Zebrafish | China Zebrafish Resource Center (CZRC) | The AB strain |
Referencias
- Chinese Pharmacopoeia Commission. . Chinese Pharmacopoeia. Volume I. , (2020).
- Wang, X. T. . Collection of Traditional Chinese Medicine Processing Methods. , (1998).
- Chen, L. L., Jia, X. B., Jia, D. S. Advances in studies on processing mechanism of Epimedii Folium. Chinese Traditional and Herbal Drugs. 12 (12), 2108-2111 (2010).
- Zhao, W., et al. Optimized extraction of polysaccharides from corn silk by pulsed electric field and response surface quadratic design. Journal of The Science of Food and Agriculture. 91 (12), 2201-2209 (2011).
- Zhao, L. C., et al. The use of response surface methodology to optimize the ultrasound-assisted extraction of five anthraquinones from Rheum palmatum L. Molecules. 16 (7), 5928-5937 (2011).
- Mao, W. H., Han, L. J., Shi, B. Optimization of microwave assisted extraction of flavonoid from Radix Astragali using response surface methodology. Separation Science and Technology. 43 (12), 671-681 (2008).
- Liu, W., et al. Optimization of total flavonoid compound extraction from Gynura medica leaf using response surface methodology and chemical composition analysis. International Journal of Molecular Sciences. 11 (11), 4750-4763 (2010).
- Guo, G. L., et al. Research progress on processing mechanism of Epimedium fried with sheep fat oil based on warming kidney and promoting yang. Journal of Liaoning University of TCM. 22 (07), 1-5 (2020).
- Shen, X. J., Zhou, Q., Sun, L. -. L., Dai, Y. -. P., Yan, X. -. S. Optimization for cutting procedure of astragali radix with Box-Behnken design and response surface method. China Journal of Chinese Materia Medica. 39 (13), 2498-2503 (2014).
- Wang, L. H., et al. Optimization of processing technology of honey wheat bran based on Box-Behnken response surface methodology. Chinese Traditional and Herbal Drugs. 52 (12), 3538-3543 (2021).
- Zhang, J. B., et al. Study on integrated process of producing area and processing production for Paeoniae Radix Alba based on Box-Behnken response surface methodology. Chinese Traditional and Herbal Drugs. 53 (18), 5657-5662 (2022).
- Li, N., Zhang, X. M., Yao, Y. Y., Chen, Y. L., Fan, Q. Optimization of processing technology for Psoraleae Fructus by D-optimal response surface methodology with UHPLC. Chinese Traditional and Herbal Drugs. 39 (05), 42-44 (2022).
- Jia, Y. Q., et al. Optimization of processing technology with wine of Cnidii Fructus by AHP-entropy weight method combined with response surface method. Journal of Chinese Medicinal Materials. 10, 2338-2343 (2022).
- Chen, F. G., et al. Optimization of the baked drying technology of Cinnamomi Ramulus based on CRITIC combined with Box-Behnken response surface method. Journal of Chinese Medicinal Materials. 2022 (08), 1838-1842 (2022).
- Wang, W. D., et al. Optimization extraction of effective constituents from Epimedii Herba based on central composite design-response surface methodology and orthogonal experimental design. Lishizhen Medicine and Materia Medica. 21 (11), 2766-2768 (2010).
- Yang, L., et al. Zebrafish embryos as models for embryotoxic and teratological effects of chemicals. Reproductive Toxicology. 28 (2), 245-253 (2009).
- Kanungo, J., Cuevas, E., Ali, S. F., Paule, M. G. Zebrafish model in drug safety assessment. Current Pharmaceutical Design. 20 (34), 5416-5429 (2014).
- Jayasinghe, C. D., Jayawardena, U. A. Toxicity assessment of herbal medicine using zebrafish embryos: A systematic review. Evidence-Based Complementary and Alternative Medicine. 2019, 7272808 (2019).
- Scholz, S. Zebrafish embryos as an alternative model for screening of drug induced organ toxicity. Archives of Toxicology. 87 (5), 767-769 (2013).
- Ling, J., et al. Analysis of Folium Epimedium toxicity in combination with Radix Morindae Officinalis based on zebrafish toxicity/metabolism synchronization. Acta Pharmaceutica Sinica. 53 (1), 74 (2018).
- Wang, Y., et al. Tri-n-butyl phosphate delays tissue repair by dysregulating neutrophil function in zebrafish. Toxicology and Applied Pharmacology. 449, 116114 (2022).
- Sheng, Z. L., Li, J. C., Li, Y. H. Optimization of forsythoside extraction from Forsythia suspensa by Box-Behnken design. African Journal of Biotechnology. 10 (55), 11728-11737 (2011).
- Pang, X., et al. Prenylated flavonoids and dihydrophenanthrenes from the leaves of Epimedium brevicornu and their cytotoxicity against HepG2 cells. Natural Product Research. 32 (19), 2253-2259 (2018).
- Zhong, R., et al. The toxicity and metabolism properties of Herba Epimedii flavonoids on laval and adult zebrafish. Evidence-Based Complementary and Alternative Medicine. 2019, 3745051 (2019).
- Zhang, L., et al. Effect of 2" -O-rhamnosyl icariside II, baohuoside I and baohuoside II in Herba Epimedii on cytotoxicity indices in HL-7702 and HepG2 cells. Molecules. 24 (7), 1263 (2019).
- Chen, Y., Yang, R. J., Yu, M., Ding, S. L., Chen, R. Q. Application of response surface methodology in modern production process optimization. Science & Technology Vision. 2016 (19), 36-39 (2016).
- Zhang, Y., et al. Progress in using zebrafish as a toxicological model for traditional Chinese medicine. Journal of Ethnopharmacology. 282, 114638 (2022).
- Oliveira, R., Domingues, I., Grisolia, C. K., Soares, A. M. V. M. Effects of triclosan on zebrafish early-life stages and adults. Environmental Science and Pollution Research. 16 (6), 679-688 (2009).
- Ton, C., Lin, Y., Willett, C. Zebrafish as a model for developmental neurotoxicity testing. Birth Defects Research. Part A, Clinical and Molecular Teratology. 76 (7), 553-567 (2006).
- He, Q., et al. Toxicity induced by emodin on zebrafish embryos. Drug and Chemical Toxicology. 35 (2), 149-154 (2012).
- Chen, Y., et al. Developmental toxicity of muscone on zebrafish embryos. Chinese Journal of Pharmacology and Toxicology. (6), 267-273 (2014).
- He, Y. L., et al. Effects of shikonin on zebrafish's embryo and angiogenesis. Chinese Traditional Patent Medicine. 38 (2), 241-245 (2016).
- Zhou, Y. . The transformation research on the chemical compositions in the processing of Epimedium. , (2016).
- Xiao, Y. P., Zeng, J., Jiao, L. -. N., Xu, X. -. Y. Review for treatment effect and signaling pathway regulation of kidney-tonifying traditional Chinese medicine on osteoporosis. China Journal of Chinese Materia Medica. 43 (1), 21-30 (2018).
- Wang, R. H. Study on modern pharmacological effects of traditional Chinese medicine for tonifying kidney yang. Journal of Hubei University of Chinese Medicine. 13 (04), 63-66 (2011).
- Luo, L., et al. Advances in the chemical constituents and pharmacological studies of Epimedium. Asia-Pacific Traditional Medicine. 15 (6), 190-194 (2019).
- Liu, S., et al. Effects of icariin on ERβ gene expression and serum estradiol level in ovariectomized rats. Hunan Journal of Traditional Chinese Medicine. 32 (1), 150-152 (2016).
- Liu, Y., et al. Effects of epimedin A on osteoclasts and osteoporotic male mice. Chinese Journal of Veterinary Science. 41 (07), 1359-1364 (2021).
- Liu, Y. L., et al. Effects of icariin and epimedium C on microstructure of bone tissue in glucocorticoid osteoporosis model mice based on Micro-CT technique. Drug Evaluation Research. 43 (09), 1733-1739 (2020).
- Zhan, Y. Evaluation of antiosteoporotic activity for micro amount icariin and epimedin B based on the osteoporosis model using zebrafish. Chinese Pharmaceutical Journal. (24), 30-35 (2014).
- Zhan, Y., Wei, Y. -. J., Sun, E., Xu, F. -. J., Jia, X. -. B. Two-dimensional zebrafish model combined with hyphenated chromatographic techniques for evaluation anti-osteoporosis activity of epimendin A and its metabolite baohuoside I. Acta Pharmaceutica Sinica. 49 (06), 932-937 (2014).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados