Method Article
Análisis de microscopía de video de alta velocidad para el diagnóstico de primera línea de discinesia ciliar primaria
En este artículo
Resumen
El análisis de microscopía de video de alta velocidad es una herramienta relativamente fácil de realizar, rápida, rentable y, en manos experimentadas, una herramienta considerablemente confiable para el diagnóstico de primera línea de la discinesia ciliar primaria, que debe estar disponible en todos los centros involucrados en el diagnóstico y el tratamiento de enfermedades pulmonares graves.
Resumen
La discinesia ciliar primaria (PCD) es un trastorno congénito predominantemente hereditario en un rasgo autosómico recesivo. El trastorno causa alteración en el movimiento de los cilios, lo que lleva a un deterioro grave del aclaramiento mucociliar (CCM). Si no se diagnostica o se diagnostica demasiado tarde, la afección conduce al desarrollo de bronquiectasias y daños graves a los pulmones en la vida posterior. La mayoría de los métodos para diagnosticar la PCD consumen mucho tiempo y exigen amplios recursos económicos para establecerlos. El análisis de videomicscopía de alta velocidad (HSVMA) es la única herramienta de diagnóstico para visualizar y analizar células respiratorias vivas con cilios golpeadores in vitro. Es rápido, rentable y, en manos experimentadas, muy confiable como herramienta de diagnóstico para PCD. Además, las medidas diagnósticas clásicas, como la microscopía electrónica de transmisión (TEM), no son aplicables a algunas mutaciones, ya que los cambios morfológicos están ausentes.
Este artículo describe el proceso de recolección de células epiteliales respiratorias, la preparación posterior de la muestra y el proceso de HSVMA. También describimos cómo las células cepilladas pueden mantenerse con éxito ilesas y latiendo manteniéndolas en un medio nutritivo para su almacenamiento y transporte al sitio de investigación en los casos en que una clínica no posee el equipo para realizar HSVMA. También se muestran videos con patrones de latidos patológicos de pacientes con una mutación en el gen de cadena pesada 11 del brazo de dineína (DNAH11), que no puede ser diagnosticado con TEM; el resultado de una HSVMA no concluyente debido a una infección de las vías respiratorias superiores, así como un cepillado fallido con superposición de glóbulos rojos. Con este artículo, nos gustaría alentar a cada unidad que se ocupa de pacientes de neumología y enfermedades pulmonares raras a realizar HSVMA como parte de sus diagnósticos de rutina diaria para PCD o enviar las muestras a un centro especializado en la realización de HSVMA.
Introducción
La discinesia ciliar primaria (PCD) es un trastorno genético hereditario poco frecuente, que causa alteraciones en el movimiento de los cilios golpeados. Si no se diagnostica, conduce a un daño pulmonar grave en la vida posterior debido a un deterioro grave del CCM. En el pasado, su prevalencia se ha estimado en el rango de 1:4.000 a 50.000. Debido a la mejora constante de los diagnósticos y una creciente conciencia de la afección, las actualizaciones sobre la prevalencia de pcD sugieren que podría ser mucho más común y probablemente en el rango de 1: 4,000 a 20,000 en lugarde 1,2. Sin embargo, los pacientes con PCD todavía están infradiagnosticados o diagnosticados demasiado tarde 1,3. Por lo tanto, los lactantes con situs inversus congénito y/o heterotaxia o rinorrea perinatal, dificultad respiratoria neonatal, nariz tapada y dificultades de alimentación deben ser sospechosos de PCD. En la vida posterior, la otitis crónica, la neumonía recurrente, la rinosinusitis y una tos húmeda crónica y típica debido a un CCM deteriorado son los síntomas distintivos de la PCD, que en combinación con la bronquiectasia y la función pulmonar deteriorada, continúan en la edad adulta2.
Los pacientes sospechosos de tener PCD pueden ser diagnosticados mediante el uso de diferentes herramientas de diagnóstico. TEM ha sido considerado el estándar de oro para el diagnóstico de primera línea en el pasado. Sin embargo, hasta el 30% de los casos de PCD no muestran una ultraestructura anormal 1,3,4,5,6, lo que exige un enfoque diagnóstico diferente. Por lo tanto, un número creciente de centros y las directrices de la Sociedad Respiratoria Europea (ERS) sugieren una combinación de óxido nítrico nasal (nNO) y HSVMA como diagnósticos de primera línea 1,7,9,10. HSVMA y nNO también son las opciones más rentables para identificar a un paciente con PCD11. Sin embargo, incluso si las pruebas genéticas se incluyeran en los diagnósticos, debe tenerse en cuenta que actualmente no existe una prueba independiente o una combinación de pruebas que pueda excluir la PCD con una certeza del 100% 8,9,10.
De las opciones de diagnóstico disponibles, HSVMA es la única prueba que se centra en las células respiratorias vivas recubiertas de cilios y evalúa el patrón de latido ciliar (CBP) y la frecuencia de latido ciliar (CBF). A diferencia de TEM, los resultados de HSVMA están disponibles rápidamente, generalmente el día de la prueba, mientras que los resultados de TEM pueden llegar meses después de que se haya tomado la muestra. HSVMA se puede aplicar a todos los grupos de edad, mientras que nNO exige un alto grado de cumplimiento; los intentos de usarlo menores de 5 años suelen ser infructuosos10. En manos experimentadas, HSVMA tiene una excelente sensibilidad y especificidad para diagnosticar PCD al 100% y 96%, respectivamente12.
Este documento describe el procedimiento paso a paso para realizar HSVMA, incluida la recolección de células respiratorias recubiertas de cilios del cornete inferior de la nariz, la preservación de las células cosechadas en un medio que nutre las células para su transporte al sitio de investigación y el proceso de análisis de video microscópico para determinar CBF y CBP. Además, se muestran algunos videoclips de pacientes, comparando CBP y CPF normales con la función anormal de los cilios (Video 3, Video 4, Video 5, Video 6, Video 7 y Video 8).
Protocolo
Declaración de ética:
Este estudio fue aprobado por el comité de ética local (69/2017) y se realizó en cumplimiento de la declaración de Helsinki.
1. Recolección y transporte de células epiteliales respiratorias
- Cepillado
- Antes del cepillado, administre un ciclo de dos semanas de amoxicilina-ácido clavulánico oral al paciente para erradicar las biopelículas que interfieren con la función de los cilios. Asegúrese de que el antibiótico se termine 2 días antes del procedimiento.
- Para disminuir una superposición de material mucoso en las tiras de células epiteliales cepilladas, pídale al paciente que se suene bien la nariz. Pida a los padres que ayuden a sus hijos pequeños a sonarse la nariz.
- Para el cepillado, utilice un cepillo interdental de 0,6 mm de tamaño (consulte la Tabla de materiales). Mantenga la cabeza del paciente fija con una mano y, con la otra, cepille el cornete inferior de ambas fosas nasales para recolectar suficientes tiras de células epiteliales.
NOTA: Por lo general, se experimenta una ligera resistencia al insertar el cepillo interdental profundamente debajo del cornete inferior. El cepillado nasal se lleva a cabo mediante un giro rápido y la recolección durante aproximadamente 2 s. De lo contrario, un cepillado más largo e intenso podría causar una lesión epitelial grave y epistaxis consecutiva. - Si la broncoscopia se planifica por razones distintas de la sospecha de PCD, recolectar muestras durante la broncoscopia cepillando la carina o el epitelio bronquial o mediante biopsia13.
- Deje caer las tiras de células cosechadas en un tubo de microcentrífuga de 1,5 ml que contiene el Medio Águila Modificada (DMEM) de Dulbecco que nutre las células.
NOTA: Las tiras de células epiteliales generalmente caen del cepillo más fácilmente al lanzar y girar el cepillo contra la pared del tubo. - Cierre la tapa del tubo de la microcentrífuga y sostenga el tubo contra una fuente de luz. Agite el tubo para descubrir tiras y conglomerados celulares cosechados.
- Transporte del espécimen
- Coloque los tubos de la microcentrífuga en una caja de poliestireno bien cerrada y asegúrese de que la tapa de los tubos esté bien cerrada y que los tubos estén fijados dentro de la caja.
- Agregue una compresa fría; sin embargo, evite congelar la muestra.
NOTA: La temperatura óptima para preservar la muestra antes de la investigación es de aproximadamente 4-8 ° C (39.2-46.4 ° F). - Asegúrese de que las muestras conservadas se analicen durante las próximas 24 h.
NOTA: En estos experimentos, el tiempo medio entre los cepillados y HSVMA fue de 3 h.
2. Análisis de microscopía de video de alta velocidad (HSVMA)
- Video microscopía de las muestras
- Después de recibir los tubos de microcentrífuga que contienen las muestras, caliéntelas hasta 37 ° C (98.6 ° F) para imitar un ambiente óptimo , similar al vivo.
- Si el microscopio está equipado con una unidad de calefacción, coloque los tubos debajo del capó y caliéntelos allí. Alternativamente, use una incubadora para calentar las muestras.
- Inicie la cámara y el software de la unidad de video en la PC.
- Usando una pipeta, tome una pequeña cantidad de la muestra y coloque dos gotas en una cubeta o plato con fondo de vidrio (consulte la Tabla de materiales). Cubra la cubeta o el plato con una tapa y colóquelo bajo el microscopio.
- Para la evaluación de las muestras, utilice un microscopio de interferencia diferencial equipado con una fuente de luz fría y una cámara de vídeo capaz de grabar a alta velocidad (al menos 200 fotogramas/s). Use una lente de inmersión en aceite con un aumento de 100x y coloque una gota de aceite de inmersión en la superficie de la óptica.
NOTA: Se recomiendan microscopios con una lente que se acerque desde abajo. - Acérquese a la parte inferior del plato con la lente del microscopio y busque grupos de células sin glóbulos rojos y con bajo contenido de moco. Después de encontrar una región representativa de interés (ROI), concéntrese en un grupo específico de cilios golpeadores con los movimientos de cilios más grandes y grabe una secuencia de video. Graba células con cilios golpeados lateralmente y desde arriba. Después de eso, busque otro grupo representativo de células y repita la grabación.
NOTA: Las células recubiertas de cilios deben investigarse bajo un aumento de 1,000x, y los cilios golpeados deben grabarse con una cámara de video digital de alta velocidad (DHSV) configurada a una velocidad de fotogramas de 200 / s o más (256 / s en este protocolo). Debido a que los datos obtenidos de los videoclips grabados requieren mucho espacio en el disco duro, se recomienda un disco duro SSD externo.
- Análisis de secuencias de vídeo
- Para determinar CBF y CBP, reproduzca los clips de vídeo fotograma a fotograma.
- Para determinar CBF, establezca la velocidad de fotogramas en cámara lenta con 15 fotogramas/s y cuente 10 latidos consecutivos.
- Registre el número de fotogramas que pasan durante un solo ciclo de 10 latidos e inserte el resultado en Eq (1). Determinar la frecuencia calculando la media de todos los ciclos de latido de cilios registrados y comparar el resultado con los valores de referencia para la edad (ver Tabla 1)14.
 (1)
(1)
Donde X es el número de fotogramas que pasan durante un ciclo de 10 latidos. - Para evaluar la CBP, observe si el movimiento de los cilios golpeadores está en el rango completo (ver Figura 1) y sincronizado. Haga que dos operadores independientes evalúen el CBP para evitar el sesgo de selección.
- Informe que los resultados del análisis HSVMA son compatibles, poco probables o no concluyentes con PCD.
Resultados
El video 1 y el video 2 muestran un control normal donde CBF y CBP están en el rango normal (ver Figura 1). Los videos 3, 4, 5 y 6 representan dos casos de pacientes con PCD con una mutación homocigota en el gen DNAH11 (c.2341G > A; p. Glu781Lys)3. Estos vídeos representativos fueron elegidos porque los fenotipos de mutaciones en el gen DNAH11 son notables porque no pueden ser diagnosticados por TEM debido a la ausencia de cambios morfológicos 3,4,5.
El video 3 muestra el clásico patrón rígido y mínimamente móvil de ritmo ciliar compatible con PCD. El patrón normal de rango completo que se muestra en el Video 1 y el Video 2 está ausente (consulte la Figura 1). El video 4 muestra una secuencia del mismo paciente (Video 3) pero grabada desde arriba. Los vídeos 5 y 6 muestran un fenotipo hipercinético e ineficaz de cilios golpeadores también compatible con PCD en pacientes portadores de una mutación en el gen DNAH11 . El CBF era tan alto que no se pudo determinar. El video 6 es del mismo paciente (Video 5) pero grabado desde arriba. El CBP es anormal y no muestra el movimiento de rango completo de los cilios sanos (ver Figura 1, Video 1 y Video 2).
El Video 7 y el Video 8 muestran un CBF patológico y CBP lateralmente (Video 7) y desde arriba (Video 8) de un paciente que ha estado sufriendo infecciones recurrentes de las vías respiratorias superiores; sin embargo, no se pudo establecer la CPD. A 10 Hz, el CBF permanece ligeramente por debajo del rango normal para la edad (ver Tabla 1), y el CBP es anormal en comparación con el CBP normal de la secuencia de video de control (Video 1, Video 2 y Figura 1), mostrando un movimiento ciliar rotatorio. El caso no es concluyente, y se deben considerar medidas diagnósticas adicionales, incluyendo nNO, TEM y pruebas genéticas, aunque el cuadro clínico del paciente es sugestivo de PCD.
Si el procedimiento de cepillado se lleva a cabo rigurosamente, el epitelio de la nariz podría lesionarse y podría ocurrir epistaxis. Si hay demasiadas células sanguíneas en la muestra, no se puede realizar el análisis de HSVMA porque las células epiteliales ciliadas están cubiertas con una capa de glóbulos rojos, como se puede ver en el Video 9.
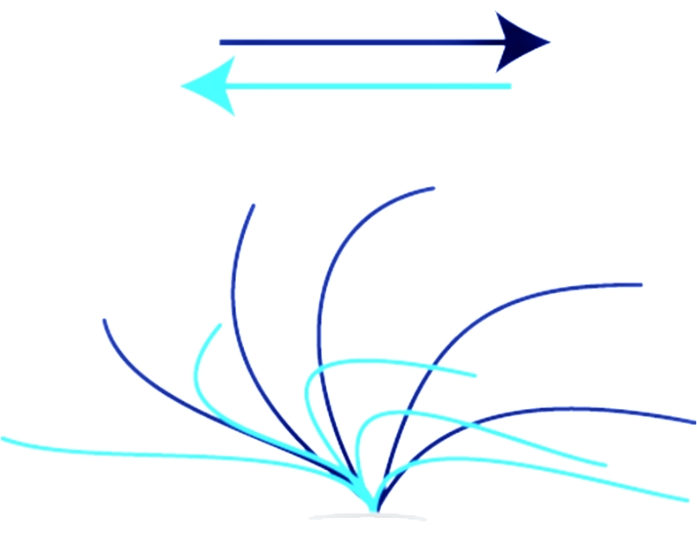
Figura 1: Accidente cerebrovascular ciliar normal. Accidente cerebrovascular ciliar de un individuo sano que muestra todo el rango de un accidente cerebrovascular normal hacia adelante y de recuperación. El trazo efectivo (azul oscuro) se mueve de izquierda a derecha en forma de latigazo cervical. El golpe de recuperación (azul claro) mueve los cilios hacia atrás de derecha a izquierda en la posición inicial. Haga clic aquí para ver una versión más grande de esta figura.
Video 1: Movimiento normal de los cilios de un paciente sin PCD, visto lateralmente. Abreviatura: PCD = Discinesia ciliar primaria. Haga clic aquí para descargar este video.
Video 2: Movimiento normal de los cilios de un paciente sin PCD, desde arriba. Abreviatura: PCD = Discinesia ciliar primaria. Haga clic aquí para descargar este video.
Video 3: Secuencia de video lateral de un paciente con PCD con una mutación en el gen DNAH11 (c.2341G > A p. Glu781Lys)3, mostrando cilios rígidos, casi inmóviles. Abreviaturas: PCD = Discinesia ciliar primaria; DNAH11 = gen de cadena pesada 11 del brazo de dineína. Haga clic aquí para descargar este video.
Video 4: Secuencia de video del mismo paciente con PCD (Video 3) grabada desde arriba. Abreviatura: PCD = Discinesia ciliar primaria. Haga clic aquí para descargar este video.
Video 5: Secuencia de video lateral de un paciente con PCD que muestra un patrón totalmente diferente, hipercinético pero ineficiente de cilios golpeados. El paciente era miembro de la misma familia y con la misma mutación que el paciente en video 3 y video 4. Abreviatura: PCD = Discinesia ciliar primaria. Haga clic aquí para descargar este video.
Video 6: Secuencia de video del mismo paciente con PCD (Video 5), grabado desde arriba. Abreviatura: PCD = Discinesia ciliar primaria. Haga clic aquí para descargar este video.
Video 7: Secuencia de video de movimiento anormal, descoordinado y lento de los cilios en un paciente con PCD que sufre de infección recurrente de las vías respiratorias superiores. Abreviatura: PCD = Discinesia ciliar primaria. Haga clic aquí para descargar este video.
Video 8: Secuencia de video del mismo paciente con PCD (Video 7) desde arriba. Abreviatura: PCD = Discinesia ciliar primaria. Haga clic aquí para descargar este video.
Video 9: Secuencia de video de una muestra, que no pudo ser analizada debido a un cepillado descuidado, lo que lleva a la epistaxis y la superposición de glóbulos rojos. Haga clic aquí para descargar este video.
| Frecuencia de latido ciliar (Hz)* | ||||
| Edad (años) | Significar | SD | 5º,95º centiles | Bordes que golpean discinéticamente (%) † |
| 0-6 | 12.9 | 2.3 | 10.0, 18.1 | 10.4 (0.0, 36.8) |
| 7-12 | 12.9 | 1.4 | 10.9, 15.0 | 9.1 (0.0, 40.3) |
| 13-18 | 12.6 | 1.7 | 10.9, 15.3 | 24.8 (0.0, 56.9) |
| ≥19 | 11.5 | 2.8 | 7.7, 15.5 | 5.8 (0.0, 24.3) |
| *Frecuencia media de latidos ciliares, desviación estándar (DE)y percentiles 5 y 95 | ||||
| †Contaciente medio (percentiles 5, 95) de bordes que exhiben áreas de discinesia ciliar | ||||
Tabla 1: Frecuencias de latido normales. Frecuencia de latido ciliar normal, relacionada con la edad. Esta tabla fue modificada a partir de Chilvers et al.14. * Frecuencia media de latido ciliar, SDy percentiles5 y 95. †Mean (percentiles 5,95) porcentaje de bordes que exhiben áreas de discinesia ciliar. Abreviatura: SD = desviación estándar.
Discusión
Aquí, el proceso de diagnóstico para PCD utilizando HSVMA se describe y discute a la luz de los diagnósticos de primera línea. A pesar de ser relativamente fácil de establecer, rentable11 y un método confiable en manos experimentadas12, HSVMA no es una medida diagnóstica sin trampas. La CBF y la CBP anormales pueden deberse a una infección secundaria, lo que lleva a la inflamación de los epitelios bronco-respiratorios15, y por la misma razón, los individuos fumadores pueden tener frecuencias de latido anormales 16,17. Además, se debe excluir la fibrosis quística antes de establecer el diagnóstico de PCD. Antes de que se considere que el análisis de una muestra de paciente es compatible con PCD, se deben confirmar los resultados anormales con dos muestras recolectadas de forma independiente, que requieren nuevos cepillados y un nuevo análisis de CBF y CBP. Esto puede ser un desafío, especialmente con los niños. Por ello, algunos investigadores recomiendan cultivar las células epiteliales obtenidas desde la primera sesión de cepillado para evitar repetir los cepillados 9,15.
Aunque la broncoscopia no es la opción preferida para diagnosticar la PCD, si se lleva a cabo por razones distintas a la PCD, las muestras se pueden obtener alternativamente bajo anestesia cepillando el epitelio bronquial o tomando una biopsia13. La infección secundaria puede alterar el movimiento ciliar y la frecuencia de los latidos. Para disminuir estos efectos no deseados, se recomienda administrar un ciclo de dos semanas con un antibiótico oral de amplio espectro como amoxicilina más ácido clavulánico o una cefalosporina para atacar patógenos respiratorios comunes. A pesar de tener beneficios sustanciales en el tratamiento de la PCD18, los macrólidos probablemente deben evitarse para este propósito porque podrían alterar la CBF debido a un efecto procinético sobre la paliza de los cilios19. Además, independientemente de la falta de evidencia en la literatura, los antibióticos deben suspenderse al menos 48 h antes del cepillado y el análisis para evitar cualquier impacto en la CBF. No se pudo observar un impacto sustancial de los antibióticos en CBF o CBP en experimentos en los que las muestras obtenidas por cepillado o biopsia se cultivaron en líquidos que contenían antibióticos 20,21,22.
Aunque HSVMA se considera la técnica más precisa y reproducible en Europa, conlleva el riesgo de error del operador debido al sesgo de selección y los problemas mencionados anteriormente15. Por lo tanto, varios grupos han desarrollado recientemente soluciones de software para automatizar el análisis a partir de imágenes digitales para superar este problema 23,24,25. Debido a que esta automatización aún está en desarrollo, los autores utilizan dos operadores independientes y expertos para analizar CBF y CBP manualmente, logrando resultados excelentes y confiables.
Los resultados representativos de este trabajo muestran videoclips de pacientes con una mutación en el gen DNAH11. Las mutaciones en este gen muestran una ultraestructura normal, por lo que los pacientes con esta mutación no pueden ser diagnosticados por TEM. La ultraestructura normal de los cilios demostrada por TEM se puede ver en hasta el 30% de todos los casos de PCD6. Además, el nNO podría ser normal con el fenotipo hipercinético de esta mutación (Video 5 y Video 6), lo que convierte a HSVMA, junto con las pruebas genéticas, en la única herramienta de diagnóstico confiable 3,8. Además, los pacientes pediátricos constituyen el objetivo principal para el diagnóstico de PCD. En muchos casos, los síntomas sugestivos de PCD se pueden observar en el período neonatal26, lo que hace que la HSVMA sea una medida diagnóstica rápida y de primera línea preferible a otras alternativas.
En un estudio norteamericano, el nNO ha sido examinado y propuesto como una prueba de detección diagnóstica de primera línea para PCD27. Aunque se informó que la especificidad y la sensibilidad eran cercanas a las de la HSVMA (0,98/0,79), debe tenerse en cuenta que el paciente más joven tenía 5,1 años y la edad media fue aún mucho mayor. También debe mencionarse que varios investigadores han reportado valores normales de nNO asociados con PCD15. Por lo tanto, si bien aún se está avanzando en el equipo técnico para realizar nNO en sujetos en edad preescolar, HSVMA sigue siendo el único diagnóstico confiable de primera línea para PCD, y los resultados normales descartan PCD con casi 100% de certeza en todos los grupos de edad.
Sin embargo, para convertirse en un experto en el diagnóstico de PCD utilizando HSVMA, se necesita un alto rendimiento de muestras normales y patológicas, lo que exige una capacitación adecuada y equipo especializado. Esto debería ser obligatorio y será gratificante para una clínica que se ocupa del diagnóstico y tratamiento de enfermedades pulmonares raras. Por cualquier motivo, si el procesamiento de las muestras constituye un obstáculo, se puede utilizar en su lugar un centro con personal especializado en diagnóstico de PCD utilizando HSVMA. En tales casos, el médico tratante puede realizar el cepillado y la muestra se puede enviar al centro de diagnóstico. En general, las muestras deben analizarse lo antes posible después del cepillado. Sin embargo, en nuestra experiencia, si las muestras se procesan correctamente (ver paso 1.2 del protocolo), las células epiteliales permanecen vitales y listas para el análisis durante al menos 24 h después del cepillado20,22. La mayoría de los centros que realizan HSVMA suelen realizar el análisis dentro de las 4 h posteriores al muestreo15. En cualquier caso, y antes del análisis final, las muestras deben calentarse a la temperatura corporal para imitar las condiciones óptimas in vivo.
Como se describió anteriormente en este trabajo, existen escollos en el proceso diagnóstico de pcD utilizando HSVMA, especialmente con casos no concluyentes como los que se han descrito en la sección de resultados representativos (Video 7 y Video 8). Para el diagnóstico final de pcd, se dispone de pautas que muestran que a veces es necesaria una batería de diferentes medidas diagnósticas 9,10,15, y lo más importante, que no existe una sola prueba o combinación de pruebas que diagnostiquen PCD con 100% de certeza. Sin embargo, se debe alentar a todas las unidades involucradas en el diagnóstico y tratamiento de la PCD a utilizar la HSVMA como una herramienta en el diagnóstico de primera línea.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Deseamos expresar un agradecimiento especial a la enfermera pediátrica Sra. Johanna Juvankoski por su excelente ayuda con los cepillados. También nos gustaría expresar un agradecimiento especial al profesor Heymut Omran (University Clinic Münster, UKM) por otorgar permiso para usar la figura esquemática del movimiento ciliar normal de su sitio web. Por último, quisiéramos dar las gracias al Sr. Alan Brown BA (Hons), PGCE, por la revisión del manuscrito.
Materiales
| Name | Company | Catalog Number | Comments |
| Amoxiciline-clavulanic acid | Orion Oyj | 40 mg/kg divided in 2 doses/day, for adults 875/125 mg 1 tablet x2/day | |
| Camera Software | Hamamatsu | HCI Image | |
| Cold pack | any | for preservation and transport | |
| Differential interference microscope | Carl Zeiss | Inverted, cell observer microscope | |
| Digitial High Speed Video Camera | Hamamatsu | Orca Flash 4.0, digital camera type C11440 | |
| Dulbecco´s Modified Eagle Medium | Thermo Fisher | 10565018 | basal cell culture medium |
| Eppendorf tube | Eppendorf | 30120086 | 1.5 mL tube |
| Glass-bottom microwell dish | MatTek | P35G-1.5-14-C | cuvette for microscopy |
| Heating Unit | Carl Zeiss/PeCon | 810-450001 | Carl Zeiss incubation elements with PeCon TempModule S1 temperature control |
| Interdental brush 0.6 mm | Doft | 872267 | Interdental brush on a long wire with a reusable handle and cap in zipbag |
| Objective | Carl Zeiss | 100x/1.46, α Plan-Apochromat DIC objective | |
| Small polystyrene box with lid | any | for transport |
Referencias
- Werner, C., Onnebrink, J. G., Omran, H. Diagnosis and management of primary ciliary dyskinesia. Cilia. 4 (1), 2 (2015).
- Mirra, V., Werner, C., Santamaria, F. Primary ciliary dyskinesia: An update on clinical aspects, genetics, diagnosis and future treatment strategies. Frontiers in Pediatrics. 5, 135 (2017).
- Schultz, R., Elenius, V., Lukkarinen, H., Saarela, T. Two novel mutations in the DNAH11 gene in primary ciliary dyskinesia (CILD7) with considerable variety in the clinical and beating cilia phenotype. BMC Medical Genetics. 21 (1), 237 (2020).
- Knowles, M. R., et al. Mutations of DNAH11 in patients with primary ciliary dyskinesia with normal ciliary ultrastructure. Thorax. 67 (5), 433-441 (2012).
- Boon, M., et al. Primary ciliary dyskinesia: critical evaluation of clinical symptoms and diagnosis in patients with normal and abnormal ultrastructure. Orphanet Journal of Rare Diseases. 9, 11 (2014).
- Kouis, P., et al. Prevalence of primary ciliary dyskinesia in consecutive referrals of suspected cases and the transmission electron microscopy detection rate: a systematic review and meta-analysis. Pediatric Research. 81 (3), 398-405 (2017).
- Marthin, J. K., Nielsen, K. G. Choice of nasal nitric oxide technique as first-line test for primary ciliary dyskinesia. European Respiratory Journal. 37 (3), 559-565 (2011).
- Jackson, C. L., Behan, L., Collins, S. A. Accuracy of diagnostic testing in primary ciliary dyskinesia. European Respiratory Journal. 47 (3), 837-848 (2016).
- Lucas, J. S., et al. European Respiratory Society guidelines for the diagnosis of primary ciliary dyskinesia. European Respiratory Journal. 49 (1), 1601090 (2017).
- Shoemark, A., Dell, S., Shapiro, A., Lucas, J. S. ERS and ATS diagnostic guidelines for primary ciliary dyskinesia: similarities and differences in approach to diagnosis. European Respiratory Journal. 54 (3), 1901066 (2019).
- Kouis, P. Cost-effectiveness analysis of three algorithms for diagnosing primary ciliary dyskinesia: a simulation study. Orphanet Journal of Rare Diseases. 14 (1), 142 (2019).
- Rubbo, B., et al. Accuracy of high-speed video analysis to diagnose primary ciliary dyskinesia. Chest. 155 (5), 1008-1017 (2019).
- Friedman, N. R., Pachigolla, R., Deskin, R. W., Hawkins, H. K. Optimal technique to diagnose primary ciliary dyskinesia. The Laryngoscope. 110 (9), 1548-1551 (2000).
- Chilvers, M. A., Rutman, A., O´Callaghan, C. Functional analysis of cilia and ciliated epithelial ultrastructure in healthy children and young adults. Thorax. 58 (4), 333-338 (2003).
- Lucas, J. S., Paff, T., Goggin, P., Haarman, E. Diagnostic methods in primary ciliary dyskinesia. Paediatric Respiratory Reviews. 18, 8-17 (2016).
- Ballenger, J. J. Experimental effect of cigarette smoke on human respiratory cilia. New England Journal of Medicine. 263, 832-835 (1960).
- Stanley, P. J., Wilson, R., Greenstone, M. A., Mac William, L., Cole, P. J. Effect of cigarette smoking on nasal mucociliary clearance and ciliary beat frequency. Thorax. 41 (7), 519-523 (1986).
- Kobbernagel, H. E., et al. Efficacy and safety of azithromycin maintenance therapy in primary cilia dyskinesia (BESTCILIA): a multicentre, double-blind, randomised, placebo-controlled phase 3 trial. Lancet Respiratory Medicine. 8 (5), 493-505 (2020).
- Takeyama, K., Tamaoki, J., Chiyotani, A., Tagaya, E., Konno, K. Effect of macrolide antibiotics on ciliary motility in rabbit airway epithelium in-vitro. Journal of Pharmacy and Pharmacology. 45 (8), 756-758 (1993).
- Toskala, E., Haataja, J., Shirasaki, H., Rautliainen, M. Culture of cells harvested with nasal brushing: a method for evaluating ciliary function. Rhinology. 43 (2), 121-124 (2005).
- Pifferi, M., et al. Simplified cell culture method for the diagnosis of atypical primary ciliary dyskinesia. Thorax. 64 (12), 1077-1081 (2009).
- Hirst, R. A., et al. Culture of primary ciliary dyskinesia epithelial cells at air liquid interface can alter ciliary phenotype but remains a robust and informative, diagnostic aid. PLoS One. 9 (2), 89675 (2014).
- Papon, J. F., et al. Quantitative analysis of ciliary beating in primary ciliary dyskinesia: a pilot study. Orphanet Journal of Rare Diseases. 7 (10), 78 (2012).
- Smith, C. M., et al. Cilia FA: a research tool for automated, high-throughput measurement of ciliary beat frequency using freely available software. Cilia. 1 (8), 14 (2012).
- Sampaio, P., et al. Ciliar Move: new software for evaluating ciliary beat frequency helps find novel mutations by a Portuguese multidisciplinary team on primary ciliary dyskinesia. European Respiratory Journal Open Research. 7 (1), 00792 (2021).
- Mullowney, T., et al. Primary ciliary dyskinesia and neonatal respiratory distress. Pediatrics. 134 (6), 1160-1166 (2014).
- Leigh, M. W., et al. Standardizing nasal nitric oxide measurement as a test for primary ciliary dyskinesia. Annals of the American Thoracic Society. 10 (6), 574-581 (2013).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados