Method Article
Hochgeschwindigkeits-Videomikroskopie-Analyse für die Erstliniendiagnose der primären ziliären Dyskinesie
In diesem Artikel
Zusammenfassung
Die Hochgeschwindigkeits-Videomikroskopie-Analyse ist ein relativ einfach durchzuführendes, schnelles, kostengünstiges und in erfahrenen Händen ein äußerst zuverlässiges Werkzeug für die Erstliniendiagnostik der primären ziliären Dyskinesie, das in jedem an der Diagnostik und Behandlung schwerer Lungenerkrankungen beteiligten Zentrum zur Verfügung stehen sollte.
Zusammenfassung
Die primäre ziliäre Dyskinesie (PKD) ist eine angeborene Erkrankung, die überwiegend autosomal-rezessiv vererbt wird. Die Störung verursacht eine Störung der Bewegung von Zilien, was zu einer schweren Beeinträchtigung der mukoziliären Clearance (MCC) führt. Wenn der Zustand nicht diagnostiziert oder zu spät diagnostiziert wird, führt er zur Entwicklung von Bronchiektasen und schweren Schäden an der Lunge im späteren Leben. Die meisten Methoden zur Diagnose von PCD sind zeitaufwendig und erfordern umfangreiche wirtschaftliche Ressourcen, um sie zu etablieren. Die Hochgeschwindigkeits-Videomikroskopie-Analyse (HSVMA) ist das einzige diagnostische Werkzeug zur Visualisierung und Analyse lebender Atemwegszellen mit schlagenden Zilien in vitro. Es ist schnell, kostengünstig und in erfahrenen Händen als Diagnosewerkzeug für PKD sehr zuverlässig. Darüber hinaus sind klassische diagnostische Maßnahmen wie die Transmissionselektronenmikroskopie (TEM) für einige Mutationen nicht anwendbar, da morphologische Veränderungen fehlen.
Diese Arbeit beschreibt den Prozess der Sammlung von Atemwegsepithelzellen, die weitere Vorbereitung der Probe und den Prozess von HSVMA. Wir beschreiben auch, wie gebürstete Zellen erfolgreich unversehrt und geschlagen gehalten werden können, indem sie in einem Nährmedium zur Lagerung und zum Transport zum Untersuchungsort aufbewahrt werden, wenn eine Klinik nicht über die Ausrüstung zur Durchführung von HSVMA verfügt. Gezeigt werden auch Videos mit pathologischen Schlagmustern von Patienten mit einer Mutation im Dynein-Arm-Schwerketten-11-Gen (DNAH11), die nicht mit TEM diagnostiziert werden können; das Ergebnis eines nicht schlüssigen HSVMA aufgrund einer Infektion der oberen Atemwege sowie eines erfolglosen Bürstens mit Überlagerung von roten Blutkörperchen. Mit diesem Artikel möchten wir jede Einheit, die sich mit Pneumologiepatienten und seltenen Lungenerkrankungen befasst, ermutigen, HSVMA als Teil ihrer täglichen Routinediagnostik für PCD durchzuführen oder die Proben an ein Zentrum zu senden, das auf die Durchführung von HSVMA spezialisiert ist.
Einleitung
Die primäre ziliäre Dyskinesie (PCD) ist eine seltene, erbliche genetische Störung, die Störungen in der Bewegung der schlagenden Zilien verursacht. Wenn es nicht diagnostiziert wird, führt es zu schweren Lungenschäden im späteren Leben aufgrund einer schweren Beeinträchtigung der MCC. In der Vergangenheit wurde seine Prävalenz auf den Bereich von 1:4.000 bis 50.000 geschätzt. Aufgrund der sich ständig verbessernden Diagnostik und eines wachsenden Bewusstseins für die Erkrankung deuten Aktualisierungen der Prävalenz der PCD darauf hin, dass sie viel häufiger auftreten könnte und wahrscheinlich im Bereich von 1:4.000 bis 20.000 statt 1,2 liegen könnte. Patienten mit PCD werden jedoch immer noch unterdiagnostiziert oder zu spät diagnostiziert 1,3. Daher sollten Säuglinge mit entweder angeborenem Situs inversus und / oder Heterotaxie oder perinataler Rhinorrhoe, neonataler Atemnot, einer blockierten Nase und Fütterungsschwierigkeiten verdächtig für PCD sein. Im späteren Leben sind chronische Otitis, wiederkehrende Lungenentzündung, Rhinosinusitis und ein chronischer, typischer nasser Husten aufgrund einer gestörten MCC die charakteristischen Symptome der PCD, die in Kombination mit Bronchiektasen und eingeschränkter Lungenfunktion bis ins Erwachsenenalter andauern2.
Patienten mit Verdacht auf PCD können mit verschiedenen diagnostischen Instrumenten diagnostiziert werden. TEM galt in der Vergangenheit als Goldstandard für die Erstliniendiagnostik. Bis zu 30% der PCD-Fälle zeigen jedoch keine abnormale Ultrastruktur 1,3,4,5,6, was einen anderen diagnostischen Ansatz erfordert. Daher empfehlen eine wachsende Zahl von Zentren und die Richtlinien der European Respiratory Society (ERS) eine Kombination von nasales Stickstoffmonoxid (nNO) und HSVMA als Erstliniendiagnostik 1,7,9,10. HSVMA und nNO sind auch die kostengünstigsten Optionen zur Identifizierung eines Patienten mit PCD11. Aber auch wenn Gentests in die Diagnostik einbezogen wurden, muss bedacht werden, dass es derzeit keinen eigenständigen Test oder eine Kombination von Tests gibt, die eine PCD mit 100%iger Sicherheitausschließen können 8,9,10.
Von den verfügbaren diagnostischen Optionen ist HSVMA der einzige Test, der sich auf lebende, mit Zilien beschichtete Atemzellen konzentriert und das Ziliarschlagmuster (CBP) und die Ziliarschlagfrequenz (CBF) bewertet. Im Gegensatz zu TEM sind die Ergebnisse von HSVMA schnell verfügbar, in der Regel am Tag der Prüfung, während die Ergebnisse von TEM Monate nach der Entnahme der Probe eintreffen können. HSVMA kann für alle Altersgruppen angewendet werden, während nNO ein hohes Maß an Compliance verlangt; Versuche, es unter dem Alter von 5 Jahren zu verwenden, sind in der Regel erfolglos10. In erfahrenen Händen hat HSVMA eine ausgezeichnete Sensitivität und Spezifität, um PCD bei 100% bzw. 96% bzw.12% zu diagnostizieren.
Dieses Papier beschreibt das Schritt-für-Schritt-Verfahren zur Durchführung von HSVMA, einschließlich der Ernte von mit Zilien überzogenen Atemwegszellen aus dem unteren Nasenrechen, der Konservierung von geernteten Zellen in einem zellnährenden Medium für den Transport zum Untersuchungsort und dem Prozess der mikroskopischen Videoanalyse zur Bestimmung von CBF und CBP. Zusätzlich werden einige Videoclips von Patienten gezeigt, in denen normale CBPs und CBFs mit abnormaler Zilienfunktion verglichen werden (Video 3, Video 4, Video 5, Video 6, Video 7 und Video 8).
Protokoll
Ethikerklärung:
Diese Studie wurde von der lokalen Ethikkommission (69/2017) genehmigt und in Übereinstimmung mit der Erklärung von Helsinki durchgeführt.
1. Entnahme und Transport von Atemwegsepithelzellen
- Bürstend
- Verabreichen Sie dem Patienten vor dem Bürsten einen zweiwöchigen Kurs oraler Amoxicillin-Clavulansäure, um Biofilme zu beseitigen, die die Zilienfunktion beeinträchtigen. Stellen Sie sicher, dass das Antibiotikum 2 Tage vor dem Eingriff beendet wird.
- Um eine Überlagerung von Schleimmaterial auf den gebürsteten Epithelzellstreifen zu verringern, bitten Sie den Patienten, sich gründlich die Nase zu putzen. Bitten Sie die Eltern, ihren kleinen Kindern zu helfen, sich die Nase zu putzen.
- Verwenden Sie zum Zähneputzen eine Interdentalbürste mit einer Größe von 0,6 mm (siehe Materialtabelle). Halten Sie den Kopf des Patienten mit einer Hand fixiert und bürsten Sie mit der anderen Hand das untere Nasenloch beider Nasenlöcher, um genügend Epithelzellstreifen zu sammeln.
HINWEIS: Ein leichter Widerstand tritt normalerweise auf, wenn die Interdentalbürste tief unter den unteren Nasenmuschel eingeführt wird. Das Nasenbürsten erfolgt durch schnelles Drehen und Picken für ca. 2 s. Längeres und intensives Bürsten kann sonst zu schweren Epithelverletzungen und aufeinanderfolgenden Epistaxis führen. - Wenn die Bronchoskopie aus anderen Gründen als dem Verdacht auf PCD geplant ist, entnehmen Sie Proben während der Bronchoskopie durch Bürsten der Carina oder des Bronchialepithels oder durch Biopsie13.
- Lassen Sie die geernteten Zellstreifen in ein 1,5-ml-Mikrozentrifugenröhrchen fallen, das das zellnährende Dulbecco's Modified Eagle Medium (DMEM) enthält.
HINWEIS: Epithelzellstreifen lassen normalerweise leichter von der Bürste fallen, indem sie die Bürste gegen die Rohrwand werfen und drehen. - Schließen Sie den Deckel des Mikrozentrifugenröhrchens und halten Sie das Röhrchen gegen eine Lichtquelle. Schütteln Sie die Röhre, um geerntete Zellstreifen und Konglomerate zu entdecken.
- Transport der Probe
- Legen Sie die Mikrozentrifugenröhrchen in eine fest verschlossene Styroporbox und stellen Sie sicher, dass der Deckel der Röhrchen ordnungsgemäß geschlossen ist und die Röhrchen in der Box befestigt sind.
- Fügen Sie eine Kühlpackung hinzu; Vermeiden Sie es jedoch, die Probe einzufrieren.
HINWEIS: Die optimale Temperatur für die Konservierung der Probe vor der Untersuchung beträgt ungefähr 4-8 ° C (39,2-46,4 ° F). - Stellen Sie sicher, dass die konservierten Proben während der nächsten 24 Stunden analysiert werden.
HINWEIS: In diesen Experimenten betrug die mittlere Zeit zwischen Bürsten und HSVMA 3 h.
2. Hochgeschwindigkeits-Videomikroskopie-Analyse (HSVMA)
- Videomikroskopie der Proben
- Nachdem Sie die Mikrozentrifugenröhrchen mit den Proben erhalten haben, erwärmen Sie sie auf 37 ° C (98,6 ° F), um eine optimale, in vivo-ähnliche Umgebung nachzuahmen.
- Wenn das Mikroskop mit einer Heizeinheit ausgestattet ist, legen Sie die Schläuche unter die Haube und erwärmen Sie sie dort. Alternativ können Sie einen Inkubator verwenden, um die Proben aufzuwärmen.
- Starten Sie die Kamera und die Software der Videoeinheit auf dem PC.
- Nehmen Sie mit einer Pipette eine kleine Menge der Probe und geben Sie zwei Tropfen in eine Küvette oder Glasbodenschale (siehe Materialtabelle). Decken Sie die Küvette oder Schale mit einem Deckel ab und legen Sie sie unter das Mikroskop.
- Verwenden Sie für die Auswertung der Proben ein Differential-Interferenz-Mikroskop, das mit einer Kaltlichtquelle und einer Videokamera ausgestattet ist, die mit hoher Geschwindigkeit (mindestens 200 Bilder/s) aufnehmen kann. Verwenden Sie eine Öltauchlinse mit einer 100-fachen Vergrößerung und geben Sie einen Tropfen Tauchöl auf die Oberfläche der Optik.
HINWEIS: Mikroskope mit einer Linse, die sich von unten nähert, werden empfohlen. - Nähern Sie sich dem Boden der Schale mit der Mikroskoplinse und suchen Sie nach Zellclustern ohne rote Blutkörperchen und mit niedrigem Schleimgehalt. Nachdem Sie eine repräsentative Region of Interest (ROI) gefunden haben, konzentrieren Sie sich auf eine bestimmte Gruppe von schlagenden Zilien mit den größten Chilibewegungen und nehmen Sie eine Videosequenz auf. Zeichnen Sie Zellen mit schlagenden Kielen seitlich und von oben auf. Suchen Sie anschließend nach einem anderen repräsentativen Zellcluster und wiederholen Sie die Aufnahme.
HINWEIS: Die mit Zilien beschichteten Zellen müssen unter einer 1.000-fachen Vergrößerung untersucht werden, und schlagende Zilien sollten mit einer digitalen Hochgeschwindigkeits-Videokamera (DHSV) aufgezeichnet werden, die auf eine Bildrate von 200 / s oder mehr eingestellt ist (256 / s in diesem Protokoll). Da die aus den aufgenommenen Videoclips gewonnenen Daten viel Platz auf der Festplatte benötigen, empfiehlt sich eine externe SSD-Festplatte.
- Analyse von Videosequenzen
- Um CBF und CBP zu bestimmen, spielen Sie die Videoclips Bild für Bild ab.
- Um CBF zu bestimmen, stellen Sie die Bildrate in Zeitlupe mit 15 Bildern / s ein und zählen Sie 10 aufeinanderfolgende Beats.
- Notieren Sie die Anzahl der Frames, die während eines einzelnen Zyklus von 10 Schlägen vergehen, und fügen Sie das Ergebnis in Eq (1) ein. Bestimmen Sie die Häufigkeit durch Berechnung des Mittelwerts aller aufgezeichneten Zilienschlagzyklen und vergleichen Sie das Ergebnis mit den Referenzwerten für das Alter (siehe Tabelle 1)14.
 (1)
(1)
Dabei ist X die Anzahl der Frames, die während eines Zyklus von 10 Schlägen vorbeiziehen. - Um CBP zu bewerten, achten Sie darauf, ob die Bewegung der schlagenden Zilien im vollen Bereich (siehe Abbildung 1) und synchronisiert ist. Lassen Sie zwei unabhängige Betreiber das CBP bewerten, um Auswahlverzerrungen zu vermeiden.
- Geben Sie an, dass die Ergebnisse der HSVMA-Analyse entweder kompatibel, unwahrscheinlich oder nicht schlüssig mit PCD sind.
Ergebnisse
Video 1 und Video 2 zeigen eine normale Steuerung, bei der CBF und CBP im Normalbereich liegen (siehe Abbildung 1). Video 3, Video 4, Video 5 und Video 6 stellen zwei Fälle von PCD-Patienten mit einer homozygoten Mutation im DNAH11-Gen dar (c.2341G > A; p. Glu781Lys)3. Diese repräsentativen Videos wurden ausgewählt, weil Phänotypen von Mutationen im DNAH11-Gen bemerkenswert sind, da sie aufgrund des Fehlens morphologischer Veränderungen nicht von TEM diagnostiziert werdenkönnen 3,4,5.
Video 3 zeigt das klassische, steife, sich minimal bewegende Muster des Ziliarschlags, der mit PCD kompatibel ist. Das normale Fullrange-Muster, das in Video 1 und Video 2 gezeigt wird, fehlt (siehe Abbildung 1). Video 4 zeigt eine Sequenz desselben Patienten (Video 3), die jedoch von oben aufgenommen wurde. Video 5 und Video 6 zeigen einen hyperkinetischen, ineffektiven Phänotyp von schlagenden Zilien, der auch mit PCD bei Patienten kompatibel ist, die eine Mutation im DNAH11-Gen tragen. Der CBF war so hoch, dass er nicht bestimmt werden konnte. Video 6 stammt vom selben Patienten (Video 5), wurde aber von oben aufgezeichnet. Das CBP ist abnormal und zeigt nicht die volle Bewegung gesunder Zilien (siehe Abbildung 1, Video 1 und Video 2).
Video 7 und Video 8 zeigen eine pathologische CBF und CBP seitlich (Video 7) und von oben (Video 8) von einem Patienten, der an wiederkehrenden Infektionen der oberen Atemwege leidet; PCD konnte jedoch nicht festgestellt werden. Bei 10 Hz bleibt der CBF leicht unter dem normalen Altersbereich (siehe Tabelle 1), und der CBP ist im Vergleich zum normalen CBP der Kontrollvideosequenz abnormal (Video 1, Video 2 und Abbildung 1), was eine rotatorische Ziliarbewegung zeigt. Der Fall ist nicht schlüssig, und weitere diagnostische Maßnahmen, einschließlich nNO, TEM und Gentests, müssen in Betracht gezogen werden, obwohl das klinische Bild des Patienten auf eine PCD hindeutet.
Wenn das Bürstenverfahren rigoros durchgeführt wird, kann das Epithel der Nase verletzt werden und Epistaxis kann auftreten. Wenn sich zu viele Blutzellen in der Probe befinden, kann die HSVMA-Analyse nicht durchgeführt werden, da verflixte Epithelzellen mit einer Beschichtung aus roten Blutkörperchen bedeckt sind, wie in Video 9 zu sehen ist.
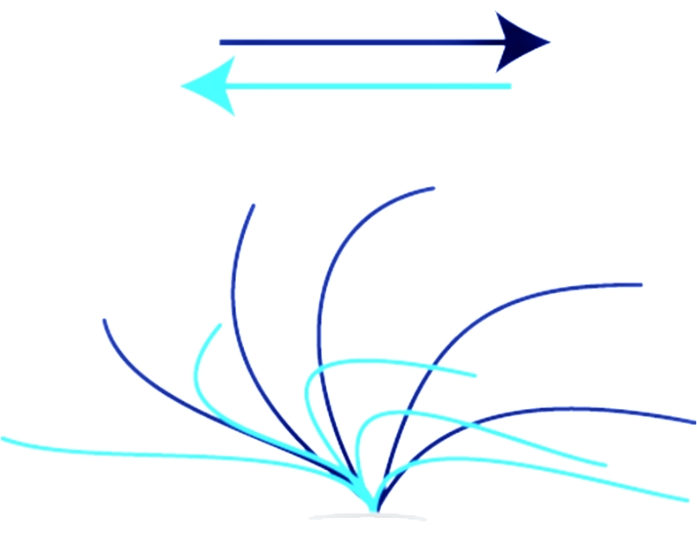
Abbildung 1: Normaler Ziliarschlag. Ziliarschlag einer gesunden Person, die das gesamte Spektrum eines normalen Vorwärts- und Erholungsschlags zeigt. Der effektive Strich (dunkelblau) bewegt sich schleudertraumatartig von links nach rechts. Der Erholungsschlag (hellblau) bewegt die Zilien von rechts nach links zurück in die Ausgangsposition. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Video 1: Normale Zilienbewegung eines Patienten ohne PCD, seitlich gesehen. Abkürzung: PCD = Primary Ciliary Dyskinesia. Bitte klicken Sie hier, um dieses Video herunterzuladen.
Video 2: Normale Zilienbewegung eines Patienten ohne PCD, von oben. Abkürzung: PCD = Primary Ciliary Dyskinesia. Bitte klicken Sie hier, um dieses Video herunterzuladen.
Video 3: Videosequenz seitlich eines PCD-Patienten mit einer Mutation im DNAH11-Gen (c.2341G > A p. Glu781Lys)3, die steife, fast unbewegliche Zilien zeigt. Abkürzungen: PCD = Primary Ciliary Dyskinesia; DNAH11 = Dynein Arm Heavy Chain 11 Gen. Bitte klicken Sie hier, um dieses Video herunterzuladen.
Video 4: Videosequenz desselben PCD-Patienten (Video 3) von oben aufgenommen. Abkürzung: PCD = Primary Ciliary Dyskinesia. Bitte klicken Sie hier, um dieses Video herunterzuladen.
Video 5: Videosequenz seitlich eines PCD-Patienten, die ein völlig anderes, hyperkinetisches, aber ineffizientes Muster des Schlagens von Zilien zeigt. Der Patient war ein Mitglied derselben Familie und mit der gleichen Mutation wie der Patient in Video 3 und Video 4. Abkürzung: PCD = Primary Ciliary Dyskinesia. Bitte klicken Sie hier, um dieses Video herunterzuladen.
Video 6: Videosequenz desselben PCD-Patienten (Video 5), aufgenommen von oben. Abkürzung: PCD = Primary Ciliary Dyskinesia. Bitte klicken Sie hier, um dieses Video herunterzuladen.
Video 7: Videosequenz einer abnormalen, unkoordinierten und langsamen Zilienbewegung bei einem PCD-Patienten, der an einer wiederkehrenden Infektion der oberen Atemwege leidet. Abkürzung: PCD = Primary Ciliary Dyskinesia. Bitte klicken Sie hier, um dieses Video herunterzuladen.
Video 8: Videosequenz desselben PCD-Patienten (Video 7) von oben. Abkürzung: PCD = Primary Ciliary Dyskinesia. Bitte klicken Sie hier, um dieses Video herunterzuladen.
Video 9: Videosequenz einer Probe, die aufgrund unvorsichtigen Bürstens nicht analysiert werden konnte, was zu Epistaxis und Überlagerung von roten Blutkörperchen führte. Bitte klicken Sie hier, um dieses Video herunterzuladen.
| Ziliare Schlagfrequenz (Hz)* | ||||
| Alter (Jahre) | Bedeuten | SD | 5. und 95. Jahrhundert | Dyskinetisch schlagende Kanten (%) † |
| 0-6 | 12.9 | 2.3 | 10.0, 18.1 | 10.4 (0.0, 36.8) |
| 7-12 | 12.9 | 1.4 | 10.9, 15.0 | 9.1 (0.0, 40.3) |
| 13-18 | 12.6 | 1.7 | 10.9, 15.3 | 24.8 (0.0, 56.9) |
| ≥19 | 11.5 | 2.8 | 7.7, 15.5 | 5.8 (0.0, 24.3) |
| *Mittlere Ziliarschlagfrequenz, Standardabweichung (SD) und5. und 95. Perzentil | ||||
| †Mittlerer Prozentsatz (5., 95. Perzentil ) der Kanten, die Bereiche der Ziliardyskinesie aufweisen | ||||
Tabelle 1: Normale Schlagfrequenzen. Normale, altersbedingte, ziliäre Schlagfrequenz. Diese Tabelle wurde von Chilvers et al.14 modifiziert. *Mittlere Ziliarschlagfrequenz, SD und 5. und 95. Perzentil. †Mittlerer Prozentsatz (5., 95. Perzentil) der Kanten, die Bereiche der ziliären Dyskinesieaufweisen. Abkürzung: SD = Standardabweichung.
Diskussion
Hier wird der diagnostische Prozess für PCD mittels HSVMA im Lichte der Erstliniendiagnostik beschrieben und diskutiert. Obwohl HSVMA relativ einfach zu etablieren, kostengünstig11 und eine zuverlässige Methode in erfahrenen Händen12 ist, ist es keine diagnostische Maßnahme ohne Fallstricke. Abnorme CBF und CBP können auf eine Sekundärinfektion zurückzuführen sein, die zu einer Entzündung des broncho-respiratorischen Epithels15 führt, und aus dem gleichen Grund können rauchende Personen abnormale Schlagfrequenzenvon 16,17 haben. Darüber hinaus sollte Mukoviszidose ausgeschlossen werden, bevor die Diagnose einer PCD gestellt wird. Bevor die Analyse einer Patientenprobe als mit PCD kompatibel beurteilt wird, sollten abnormale Ergebnisse mit zwei unabhängig voneinander entnommenen Proben bestätigt werden, die neue Bürsten und eine erneute Analyse von CBF und CBP erfordern. Dies kann eine Herausforderung sein, besonders bei Kindern. Daher empfehlen einige Forscher, Epithelzellen, die aus der ersten Bürstsitzung gewonnen wurden, zu kultivieren, um wiederholte Bürsten zu vermeiden 9,15.
Obwohl die Bronchoskopie nicht die bevorzugte Wahl für die Diagnose von PCD ist, können Proben, wenn sie aus anderen Gründen als der PCD durchgeführt wird, alternativ unter Narkose gewonnen werden, indem das Bronchialepithel gebürstet oder eine Biopsie13 entnommen wird. Eine Sekundärinfektion kann die Ziliarbewegung und die Schlagfrequenz verändern. Um diese unerwünschten Wirkungen zu verringern, wird empfohlen, einen zweiwöchigen Kurs mit einem oralen Breitbandantibiotikum wie Amoxicillin plus Clavulansäure oder einem Cephalosporin zu verabreichen, um auf häufige respiratorische Krankheitserreger abzuzielen. Obwohl sie erhebliche Vorteile bei der Behandlung von PCD18 haben, sollten Makrolide zu diesem Zweck wahrscheinlich vermieden werden, da sie CBF aufgrund einer prokinetischen Wirkung auf die Bekämpfung von Zilien19 verändern könnten. Darüber hinaus sollten Antibiotika ungeachtet des Mangels an Evidenz in der Literatur mindestens 48 h vor dem Bürsten und der Analyse gestoppt werden, um Auswirkungen auf CBF zu vermeiden. In Experimenten, bei denen durch Bürsten oder Biopsie gewonnene Proben in Flüssigkeiten, die Antibiotika enthielten, kultiviert wurden, konnten keine wesentlichen Auswirkungen von Antibiotika auf CBF oder CBP beobachtet werden20,21,22.
Obwohl HSVMA als die genaueste und reproduzierbarste Technik in Europa gilt, birgt es das Risiko von Bedienerfehlern aufgrund von Auswahlverzerrungen und den oben genannten Problemen15. Daher haben mehrere Gruppen kürzlich Softwarelösungen entwickelt, um die Analyse von digitalen Bildern zu automatisieren, um dieses Problemzu überwinden 23,24,25. Da sich diese Automatisierung noch in der Entwicklung befindet, verwenden die Autoren zwei unabhängige, erfahrene Bediener, um CBF und CBP manuell zu analysieren und hervorragende und zuverlässige Ergebnisse zu erzielen.
Die repräsentativen Ergebnisse dieses Papiers zeigen Videoclips von Patienten mit einer Mutation im DNAH11-Gen. Mutationen in diesem Gen zeigen eine normale Ultrastruktur, und Patienten mit dieser Mutation können daher nicht durch TEM diagnostiziert werden. Die normale Ultrastruktur von Zilien, die durch TEM nachgewiesen wurde, kann in bis zu 30% aller PCD-Fällebeobachtet werden 6. Darüber hinaus könnte nNO mit dem hyperkinetischen Phänotyp dieser Mutation normal sein (Video 5 und Video 6), was HSVMA zusammen mit Gentests zum einzigen zuverlässigen Diagnoseinstrumentmacht 3,8. Darüber hinaus stellen pädiatrische Patienten das primäre Ziel für die PCD-Diagnostik dar. In vielen Fällen können Symptome, die auf eine PCD hindeuten, in der Neugeborenenperiode26 beobachtet werden, was HSVMA zu einer schnellen, diagnostischen Erstlinienmaßnahme macht, die anderen Alternativen vorzuziehen ist.
In einer nordamerikanischen Studie wurde nNO untersucht und als Erstlinien-Diagnose-Screening-Test für PCD27 vorgeschlagen. Obwohl Spezifität und Sensitivität in der Nähe der HSVMA (0,98/0,79) liegen, muss beachtet werden, dass der jüngste Patient 5,1 Jahre alt war und das Durchschnittsalter sogar viel höher war. Es muss auch erwähnt werden, dass mehrere Forscher normale nNO-Werte im Zusammenhang mit PCD15 gemeldet haben. Während also eine Verbesserung der technischen Ausrüstung zur Durchführung von nNO in Fächern im Vorschulalter noch im Gange ist, bleibt HSVMA die einzige zuverlässige Erstliniendiagnostik für PCD, und normale Ergebnisse schließen PCD mit fast 100% iger Sicherheit in allen Altersgruppen aus.
Um jedoch ein Experte für die Diagnose von PCD mit HSVMA zu werden, ist ein hoher Durchsatz von normalen und pathologischen Proben erforderlich, was eine angemessene Ausbildung und spezielle Ausrüstung erfordert. Dies sollte obligatorisch sein und wird sich für eine Klinik lohnen, die sich mit der Diagnostik und Behandlung seltener Lungenerkrankungen befasst. Aus irgendeinem Grund, wenn die Verarbeitung der Proben ein Hindernis darstellt, kann stattdessen ein Zentrum mit spezialisiertem Personal in der PCD-Diagnostik mit HSVMA verwendet werden. In solchen Fällen kann der behandelnde Arzt das Bürsten durchführen und die Probe kann an das Diagnosezentrum geschickt werden. Im Allgemeinen sollten die Proben so schnell wie möglich nach dem Bürsten analysiert werden. Nach unserer Erfahrung bleiben die Epithelzellen jedoch bei ordnungsgemäßer Verarbeitung der Proben (siehe Protokollschritt 1.2) nach dem Bürsten20,22 Stunden lang vital und bereit für die Analyse. Die meisten Zentren, die HSVMA selbst durchführen, führen die Analyse in der Regel innerhalb von 4 Stunden nach der Probenahme15 durch. In jedem Fall und vor der endgültigen Analyse sollten die Proben auf Körpertemperatur erwärmt werden, um optimale In-vivo-Bedingungen nachzuahmen.
Wie bereits in diesem Beitrag beschrieben, gibt es Fallstricke im diagnostischen Prozess der PCD unter Verwendung von HSVMA, insbesondere bei nicht schlüssigen Fällen, wie sie im Abschnitt über die repräsentativen Ergebnisse (Video 7 und Video 8) beschrieben wurden. Für die endgültige Diagnose von PCD stehen Richtlinien zur Verfügung, die zeigen, dass manchmal eine Batterie verschiedener diagnostischer Maßnahmenerforderlich ist 9,10,15, und vor allem, dass es keinen einzigen Test oder eine Kombination von Tests gibt, die PCD mit 100% iger Sicherheit diagnostizieren. Dennoch sollte jede Einheit, die an der Diagnose und Behandlung von PCD beteiligt ist, ermutigt werden, HSVMA als Instrument in der Erstliniendiagnostik zu verwenden.
Offenlegungen
Die Autoren haben nichts offenzulegen.
Danksagungen
Besonderen Dank gilt der Kinderkrankenschwester Frau Johanna Juvankoski für ihre hervorragende Hilfe bei den Bürsten. Einen besonderen Dank gilt auch Professor Heymut Omran (Universitätsklinikum Münster, UKM) für die Erlaubnis, die schematische Abbildung der normalen Ziliarbewegung von ihrer Website aus verwenden zu dürfen. Abschließend möchten wir Herrn Alan Brown BA (Hons), PGCE, für das Korrekturlesen des Manuskripts danken.
Materialien
| Name | Company | Catalog Number | Comments |
| Amoxiciline-clavulanic acid | Orion Oyj | 40 mg/kg divided in 2 doses/day, for adults 875/125 mg 1 tablet x2/day | |
| Camera Software | Hamamatsu | HCI Image | |
| Cold pack | any | for preservation and transport | |
| Differential interference microscope | Carl Zeiss | Inverted, cell observer microscope | |
| Digitial High Speed Video Camera | Hamamatsu | Orca Flash 4.0, digital camera type C11440 | |
| Dulbecco´s Modified Eagle Medium | Thermo Fisher | 10565018 | basal cell culture medium |
| Eppendorf tube | Eppendorf | 30120086 | 1.5 mL tube |
| Glass-bottom microwell dish | MatTek | P35G-1.5-14-C | cuvette for microscopy |
| Heating Unit | Carl Zeiss/PeCon | 810-450001 | Carl Zeiss incubation elements with PeCon TempModule S1 temperature control |
| Interdental brush 0.6 mm | Doft | 872267 | Interdental brush on a long wire with a reusable handle and cap in zipbag |
| Objective | Carl Zeiss | 100x/1.46, α Plan-Apochromat DIC objective | |
| Small polystyrene box with lid | any | for transport |
Referenzen
- Werner, C., Onnebrink, J. G., Omran, H. Diagnosis and management of primary ciliary dyskinesia. Cilia. 4 (1), 2 (2015).
- Mirra, V., Werner, C., Santamaria, F. Primary ciliary dyskinesia: An update on clinical aspects, genetics, diagnosis and future treatment strategies. Frontiers in Pediatrics. 5, 135 (2017).
- Schultz, R., Elenius, V., Lukkarinen, H., Saarela, T. Two novel mutations in the DNAH11 gene in primary ciliary dyskinesia (CILD7) with considerable variety in the clinical and beating cilia phenotype. BMC Medical Genetics. 21 (1), 237 (2020).
- Knowles, M. R., et al. Mutations of DNAH11 in patients with primary ciliary dyskinesia with normal ciliary ultrastructure. Thorax. 67 (5), 433-441 (2012).
- Boon, M., et al. Primary ciliary dyskinesia: critical evaluation of clinical symptoms and diagnosis in patients with normal and abnormal ultrastructure. Orphanet Journal of Rare Diseases. 9, 11 (2014).
- Kouis, P., et al. Prevalence of primary ciliary dyskinesia in consecutive referrals of suspected cases and the transmission electron microscopy detection rate: a systematic review and meta-analysis. Pediatric Research. 81 (3), 398-405 (2017).
- Marthin, J. K., Nielsen, K. G. Choice of nasal nitric oxide technique as first-line test for primary ciliary dyskinesia. European Respiratory Journal. 37 (3), 559-565 (2011).
- Jackson, C. L., Behan, L., Collins, S. A. Accuracy of diagnostic testing in primary ciliary dyskinesia. European Respiratory Journal. 47 (3), 837-848 (2016).
- Lucas, J. S., et al. European Respiratory Society guidelines for the diagnosis of primary ciliary dyskinesia. European Respiratory Journal. 49 (1), 1601090 (2017).
- Shoemark, A., Dell, S., Shapiro, A., Lucas, J. S. ERS and ATS diagnostic guidelines for primary ciliary dyskinesia: similarities and differences in approach to diagnosis. European Respiratory Journal. 54 (3), 1901066 (2019).
- Kouis, P. Cost-effectiveness analysis of three algorithms for diagnosing primary ciliary dyskinesia: a simulation study. Orphanet Journal of Rare Diseases. 14 (1), 142 (2019).
- Rubbo, B., et al. Accuracy of high-speed video analysis to diagnose primary ciliary dyskinesia. Chest. 155 (5), 1008-1017 (2019).
- Friedman, N. R., Pachigolla, R., Deskin, R. W., Hawkins, H. K. Optimal technique to diagnose primary ciliary dyskinesia. The Laryngoscope. 110 (9), 1548-1551 (2000).
- Chilvers, M. A., Rutman, A., O´Callaghan, C. Functional analysis of cilia and ciliated epithelial ultrastructure in healthy children and young adults. Thorax. 58 (4), 333-338 (2003).
- Lucas, J. S., Paff, T., Goggin, P., Haarman, E. Diagnostic methods in primary ciliary dyskinesia. Paediatric Respiratory Reviews. 18, 8-17 (2016).
- Ballenger, J. J. Experimental effect of cigarette smoke on human respiratory cilia. New England Journal of Medicine. 263, 832-835 (1960).
- Stanley, P. J., Wilson, R., Greenstone, M. A., Mac William, L., Cole, P. J. Effect of cigarette smoking on nasal mucociliary clearance and ciliary beat frequency. Thorax. 41 (7), 519-523 (1986).
- Kobbernagel, H. E., et al. Efficacy and safety of azithromycin maintenance therapy in primary cilia dyskinesia (BESTCILIA): a multicentre, double-blind, randomised, placebo-controlled phase 3 trial. Lancet Respiratory Medicine. 8 (5), 493-505 (2020).
- Takeyama, K., Tamaoki, J., Chiyotani, A., Tagaya, E., Konno, K. Effect of macrolide antibiotics on ciliary motility in rabbit airway epithelium in-vitro. Journal of Pharmacy and Pharmacology. 45 (8), 756-758 (1993).
- Toskala, E., Haataja, J., Shirasaki, H., Rautliainen, M. Culture of cells harvested with nasal brushing: a method for evaluating ciliary function. Rhinology. 43 (2), 121-124 (2005).
- Pifferi, M., et al. Simplified cell culture method for the diagnosis of atypical primary ciliary dyskinesia. Thorax. 64 (12), 1077-1081 (2009).
- Hirst, R. A., et al. Culture of primary ciliary dyskinesia epithelial cells at air liquid interface can alter ciliary phenotype but remains a robust and informative, diagnostic aid. PLoS One. 9 (2), 89675 (2014).
- Papon, J. F., et al. Quantitative analysis of ciliary beating in primary ciliary dyskinesia: a pilot study. Orphanet Journal of Rare Diseases. 7 (10), 78 (2012).
- Smith, C. M., et al. Cilia FA: a research tool for automated, high-throughput measurement of ciliary beat frequency using freely available software. Cilia. 1 (8), 14 (2012).
- Sampaio, P., et al. Ciliar Move: new software for evaluating ciliary beat frequency helps find novel mutations by a Portuguese multidisciplinary team on primary ciliary dyskinesia. European Respiratory Journal Open Research. 7 (1), 00792 (2021).
- Mullowney, T., et al. Primary ciliary dyskinesia and neonatal respiratory distress. Pediatrics. 134 (6), 1160-1166 (2014).
- Leigh, M. W., et al. Standardizing nasal nitric oxide measurement as a test for primary ciliary dyskinesia. Annals of the American Thoracic Society. 10 (6), 574-581 (2013).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten