Spektrophotometrische Bestimmung der Gleichgewichtskonstante
Überblick
Quelle: Labor von Dr. Michael Evans, Georgia Institute of Technology
Die Gleichgewichts-Konstante K, chemisches System ist das Verhältnis der Produktkonzentrationen Edukt-Konzentrationen im Gleichgewicht, jeweils potenziert mit ihren jeweiligen stöchiometrischen Koeffizienten. Messung der K beinhaltet Entschlossenheit diese Konzentrationen für Systeme im chemischen Gleichgewicht.
Reaktionssysteme, enthält eine einzelne farbige Komponente können spektralphotometrisch untersucht werden. Das Verhältnis zwischen Extinktion und Konzentration für die farbigen Komponente gemessen und zur Ermittlung die Konzentration im Reaktionssystem von Interesse. Konzentrationen der farblosen Komponenten können indirekt über die ausgeglichene Reaktionsgleichung und die gemessene Konzentration der farbigen Komponente berechnet werden.
In diesem Video ist das Bier recht Kurve für Fe(SCN)2 + empirisch ermittelt und auf die Messung der K für die folgende Reaktion:

Vier Reaktionssysteme mit verschiedenen anfängliche Konzentrationen der Edukte werden untersucht, um veranschaulichen, die K unabhängig von der anfänglichen Konzentration konstant bleibt.
Grundsätze
Jede chemische Reaktion ist eine Gleichgewichts-Konstante K, widerspiegelt das Verhältnis der Produktkonzentrationen Edukt-Konzentrationen im chemischen Gleichgewicht zugeordnet. Für die allgemeine Reaktion ein A + b B  c C + d D die Gleichgewichts-Konstante ist definiert als
c C + d D die Gleichgewichts-Konstante ist definiert als

wo sind die Konzentrationen auf der rechten Seite der Gleichung Molarities im Gleichgewicht. Diese Gleichung ist als Ausdruck für die Reaktion Gleichgewicht bekannt. In chemischen Systemen, die nicht im Gleichgewicht befinden, die vorwärts und rückwärts Reaktionen auftreten mit unterschiedlichen Geschwindigkeiten bis die Konzentrationen der Edukte und Produkte erfüllen die Gleichgewicht-Ausdruck.
Um den Wert von K für ein System im chemischen Gleichgewicht zu messen, ist es notwendig, die Konzentrationen der Edukte und Produkte direkt oder indirekt bestimmen. Photometrische Methoden zur Bestimmung von K beinhalten direkte Messung der Konzentration von einer farbigen Komponente und indirekte Messung der anderen. Sichtbare Spektroskopie der farbigen Komponente bei bekannten Konzentrationen zeigt den Zusammenhang zwischen Extinktion und Konzentration für diese Komponente. Nach dem Gesetz des Bieres hat diese Beziehung die form
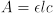
wo e Molares Absorptionsvermögen des Bauteils in Mol/L-cm, l ist die Weglänge des Lichtes durch die Probe in cm, c ist das Molarity der Komponente in Mol/L, und A ist die Extinktion.
Das Bier recht Kurve für die farbigen Komponente kann auf eine Reaktionssystem im Gleichgewicht zur Bestimmung der Konzentration dieser Komponente von Extinktion Messungen (Abbildung 1) angewendet werden. Konzentrationen der Edukte und Produkte können dann berechnet werden, indem Sie anfängliche Konzentration anhand der gemessenen Molarity der farbigen Arten anpassen.
Die hier untersuchten System ist die Reaktion von Eisen (III) kation mit Thiocyanat Anion, ein Eisen (III)-Thiocyanat-Komplex bilden.

Der Gleichgewicht-Ausdruck für dieses Reaktionssystem ist

wo der Eq -Index Gleichgewichtskonzentrationen bezeichnet. Das Eisen (III)-Thiocyanat-Produkt ist Orange, aber beide Edukte sind in wässriger Lösung farblos. [Fe(SCN)2 +]Eq kann daher direkt von Extinktion Messungen ermittelt werden.

Gleichgewichtskonzentrationen der Edukte können berechnet werden durch Subtraktion der Gleichgewicht-Konzentration des Produkts von der ursprünglichen Konzentrationen der Edukte. Eine Initial-Änderung-Gleichgewicht (ICE) Tabelle veranschaulicht, wie aus- und Gleichgewicht Konzentrationen zusammenhängen (Tabelle 1).

Wiederholte Versuche dieses Experiment mit verschiedenen anfängliche Konzentrationen der Reaktanden sollte den gleichen Wert von K, Ausbeute, da der Wert von K unabhängig von der Konzentration.
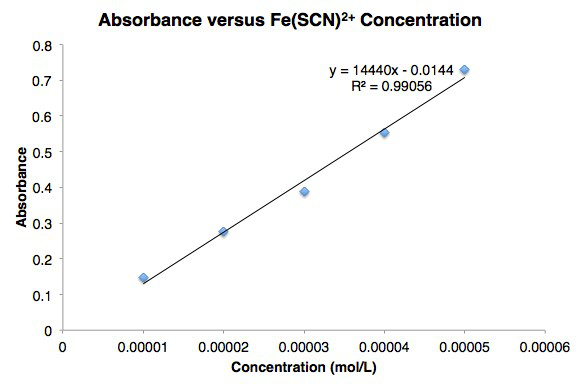
Abbildung 1. Bier Gesetz für Eisen (III) Thiocyanat Kurve.
| Fe3 + | SCN– | Fe(SCN)2 + | |
| Anfängliche | [Fe3 +] Ich | [SCN–] Ich | 0 |
| Änderung | –[Fe(SCN)2 +]eq | –[Fe(SCN)2 +]eq | +[Fe(SCN)2 +]eq |
| Gleichgewicht | [Fe3 +] ich – [Fe(SCN)2 +]eq | [SCN–] ich – [Fe(SCN)2 +]eq | [Fe(SCN)2 +] EQ |
Tabelle 1. Eine Initial-Änderung-Gleichgewicht (ICE) Tabelle, die zeigt, wie aus- und Gleichgewicht Konzentrationen zusammenhängen.
Verfahren
1. bestimmen das Bier recht Kurve für Fe(SCN)2 +
- Eine sichtbare Spektralphotometer mit destilliertem Wasser als eine leere zu kalibrieren.
- 1,0 mL 1,0 × 10-4 M Fe(NO3)3 Lösung in einem Teströhrchen zugeben.
- Zugeben Sie in der gleichen Teströhrchen 5,0 mL 0,50 M KSCN-Lösung.
- Hinzugeben Sie in der gleichen Teströhrchen 4,0 mL 0,10 M Druckaufschluss3 Lösung. Das Rohr mit einem behandschuhten Finger abdecken und schütteln um zu mischen.
- Verwenden Sie eine Pasteurpipette eine kleine Menge der Lösung in einer Küvette übertragen. Sicherstellen Sie, dass der Flüssigkeitsstand über dem Weg des Lichtstrahls im Spektralphotometer.
- Legen Sie die Küvette im Spektralphotometer, so dass das Licht durch die transparenten Seiten geht.
- Erwerben Sie ein Spektrum zu und zeichnen Sie der λ-max -Wert und die Extinktion bei λmax auf.
- Um ein Bier recht Kurve konstruieren, müssen zusätzliche Lösungen mit bekannten Konzentrationen von Fe(SCN)2 + vorbereitet und gemessen werden. Wiederholen Sie die Schritte 2 – 7 mit den Bänden der Fe (Nr.3)3, KSCN, und Druckaufschluss3 Lösungen in Tabelle 2.
- Die gemessene Extinktion gegen die Konzentrationen von Fe(SCN)2 + in jedes Reagenzglas des Grundstückes und die Linie der besten Passform für die Daten zu bestimmen. Die Steigung dieser Linie ist die molare Aufnahmefähigkeit und die Weglänge beträgt 1 cm.
2. Messung K für das Eisen (III)-Thiocyanat-System
- Bereiten Sie 4 mittlere Reagenzgläser mit den angegebenen Bänden von 0,0025 M Fe (Nr.3)3, 0.0025 M KSCN und 0,10 M Druckaufschluss3 Lösungen in Tabelle 3 vor.
- Jedes Rohr mit einem Finger zu decken und schütteln um zu mischen. Für mindestens 10 Minuten stehen lassen. Diese Ruhe sorgt für Periode die Lösungen im chemischen Gleichgewicht.
- Verwenden Sie eine Pasteurpipette, um eine kleine Menge der Lösung 6 auf eine Küvette zu übertragen. Sicherstellen Sie, dass der Flüssigkeitsstand über dem Weg des Lichtstrahls im Spektralphotometer.
- Erwerben Sie ein Spektrum zu und zeichnen Sie der λ-max -Wert und die Extinktion bei λmax auf.
- Mehrere Reaktionen mit verschiedenen anfängliche Konzentrationen der Edukte können untersucht werden, um zu veranschaulichen, die K nicht von der Konzentration abhängt. Um K für unterschiedliche Anfangsbedingungen bestimmen, wiederholen Sie die Schritte 3 und 4 für Lösungen 7 – 9.
| Röhre Nummer | Volumen 1.0 x 10– 4 M Fe (Nr.3)3 (mL) |
Volumen 0,50 M KSCN (mL) |
Volumen 0,10 M Druckaufschluss3 (mL) |
| 1 | 1.0 | 5.0 | 4.0 |
| 2 | 2.0 | 5.0 | 3.0 |
| 3 | 3.0 | 5.0 | 2.0 |
| 4 | 4.0 | 5.0 | 1.0 |
| 5 | 5.0 | 5.0 | 0.0 |
Tabelle 2. Entsprechende Mengen an Fe (Nr.3)3, KSCN und Druckaufschluss3 Lösungen in Röhren 2-5 platziert werden.
| Röhre Nummer | Volumen 0,0025 M Fe (Nr.3)3 (mL) |
Volumen 0,0025 M KSCN (mL) |
Volumen 0,10 M Druckaufschluss3 (mL) |
| 6 | 1.0 | 1.0 | 5.0 |
| 7 | 1.0 | 2.0 | 4.0 |
| 8 | 2.0 | 2.0 | 3.0 |
| 9 | 2.0 | 3.0 | 2.0 |
Tabelle 3. Entsprechende Mengen von 0,0025 M Fe (Nr.3)3, 0.0025 M KSCN und 0,10 M Druckaufschluss3 Lösungen.
Ergebnisse
Tabelle 4 enthält die Extinktion und Konzentration Daten für Lösungen 1 – 5. Konzentrationen von Fe(SCN)2 + wurden vom ursprünglichen Konzentrationen von Fe3 + unter der Annahme, dass alle von der Fe3 + konvertiert ist Fe(SCN)2 +bestimmt. Ein großer Überschuss an SCN– wurde in Röhren 1 – 5 verwendet, um sicherzustellen, dass diese Annahme zutrifft.
Das Molarity [Fe(SCN)2 +] und Absorption sind in Abbildung 2dargestellt. Die gemessenen Extinktionen stimmen gut mit den Beerschen Gesetz.
Tabelle 5 zeigt gemessenen Extinktionen und berechneten K Werte für Rohre 6 – 9. K -Werte wurden mit der ICE-Tabelle-Methode ermittelt. Anfänglichen Reaktionspartner Konzentrationen beruhten auf der bekannten Molarities von Fe3 + und SCN– in den Reaktanten Lösungen und das Gesamtvolumen der Reaktion (10 mL). Die Gleichgewicht-Konzentration von Fe(SCN)2 + war durch trennende gemessene Extinktion durch Molares Absorptionsvermögen von Fe(SCN)2 +bestimmt. Weil alle das Produkt entstand aus der 1:1 Reaktion von Fe3 + und SCN–, entspricht die Gleichgewicht-Konzentration von Fe(SCN)2 + der verringern , der Konzentration der Edukte. Tabelle 6 zeigt den Prozess für Reagenzglas 6.
Die Gleichgewichts-konstante errechnet sich aus den Konzentrationen in der Gleichgewichts-Reihe. Für Reagenzglas 6,

Die mittlere K -Wert betrug 147 ± 11, illustrieren, dass K über den Bereich der Konzentrationen untersucht etwa konstant ist.

Abbildung 2: Liniendiagramm der Extinktion und Konzentration für Fe(SCN)2 +.
| Rohr | [Fe(SCN)2 +] (Mol/L) | Extinktion |
| 1 | 1,00 x 10– 5 | 0.10 |
| 2 | 2,00 x 10– 5 | 0,20 |
| 3 | 3.00 x 10– 5 | 0,25 |
| 4 | 4.00 x 10– 5 | 0,32 |
| 5 | 5,00 x 10– 5 | 0,42 |
Tabelle 4. Extinktion gegen Konzentrationsdaten für Fe(SCN)2 +.
| Rohr | Extinktion | K |
| 6 | 0,120 | 136 |
| 7 | 0.268 | 161 |
| 8 | 0.461 | 142 |
| 9 | 0.695 | 150 |
Tabelle 5. Extinktion Werte und berechneten K für die Reaktion von Eisen (III) mit Thiocyanat gemessen.
| [Fe3 +] (Mol/L) | [SCN–] (Mol/L) | [Fe(SCN)2 +] (Mol/L) | |
| Anfängliche | 3.57 x 10– 4 | 3.57 x 10– 4 | 0 |
| Änderung | –1.58 x 10-5 | –1.58 x 10-5 | +1.58 x 10-5 |
| Gleichgewicht | 3,41 x 10– 4 | 3,41 x 10– 4 | 1,58 x 10– 5 |
Tabelle 6. Der ICE-Tabelle, die den Prozess für Reagenzglas 6 veranschaulicht.
Anwendung und Zusammenfassung
Die Gleichgewichts-konstante liefert nützliche Informationen über das Ausmaß, das eine Reaktion auf Formular Produkte im Laufe der Zeit weitergeht. Reaktionen mit einem großen Wert von K, viel größer als 1, bilden Produkte nahezu vollständige genügend Zeit (Abbildung 3). Reaktionen mit einem Wert von K kleiner als 1 werden zu einem bedeutenden Grad nicht nach vorne gehen. Die Gleichgewichts-Konstante dient somit als Maß für die Machbarkeit einer chemischen Reaktion.

Abbildung 3. Die konstante Gleichgewicht dieser Reaktion ist größer als 1. Eine erhebliche Menge an farbigen Produkt bildet in jedem Fall, auch wenn die anfängliche Konzentrationen der Reaktanden unterscheiden.
Die Gleichgewichts-konstante bietet auch thermodynamische Wissenswertes rund um die Änderungen in freie Energie, Enthalpie und Entropie im Verlauf einer chemischen Reaktion. Die Gleichgewichts-konstante bezieht sich auf die freie Energie-Änderung der Reaktion:
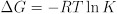
Die freie Energie-Änderung der Reaktion bezieht sich wiederum auf die Enthalpie und Entropie Veränderungen der Reaktion:
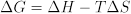
Messungen der Temperaturabhängigkeit von K können zeigen, die Enthalpie Änderung ΔH und die EntropieS Δ für eine Reaktion ändern. Neben der Bereitstellung von Chemikern mit Einblick in die Muster in molekulare Verhalten, können Tabellen der thermodynamischen Daten zur Reaktionen mit günstigen thermodynamischen Eigenschaften zu identifizieren. Redox-Reaktionen, die große Mengen an Energie (verbunden mit negativen ΔG -Werte) zu veröffentlichen sind beispielsweise attraktive Kandidaten für Batterien.
Werte von K für Säure Dissoziation Reaktionen(KWerte) eignen sich für die Vorhersage der Ergebnisse der Säure-Base-Reaktionen, die thermodynamisch gesteuert werden. Starke Säuren sind große Keinen Werten und schwache Säuren mit kleinen Keinen Werten zugeordnet. pH-Indikatoren sind schwache Säuren mit unterschiedlich gefärbten saure und basische Formen und die pKeine (negative Basis 10 Logarithmus der Kein) der Indikator stellt des pH-Wertes, bei dem eine Farbveränderung tritt als eine Säure oder Base wird hinzugefügt, um eine Lösung des Indikators.
Ebenso sind KWerte bei der Herstellung von Pufferlösungen verwendet, um ein Ziel-pH-Wert zu erreichen. Die pKeine schwache Säure ist den pH-Wert, bei dem die Säure und seine Basis konjugiert in die Lösung in gleicher Konzentration vorhanden sind. Wenn gleiche Mengen von einer schwachen Säure und ihre konjugierte Base sind in einer Lösung aufgelöst, der pH-Wert der Lösung entspricht der pKeine schwache Säure.
pringen zu...
Videos aus dieser Sammlung:

Now Playing
Spektrophotometrische Bestimmung der Gleichgewichtskonstante
General Chemistry
159.0K Ansichten

Labor-Glaswaren und deren Verwendung
General Chemistry
659.9K Ansichten

Lösungen und Konzentrationen
General Chemistry
275.9K Ansichten

Bestimmung der Dichte von Fest- und Flüssigstoffen
General Chemistry
557.4K Ansichten

Bestimmung der prozentualen Massenanteile in einer wässrigen Lösung
General Chemistry
384.4K Ansichten

Ermittlung der Summenformel
General Chemistry
183.9K Ansichten

Bestimmung der Löslichkeit von ionischen Verbindungen
General Chemistry
141.7K Ansichten

Verwendung eines pH-Meters
General Chemistry
347.2K Ansichten

Einführung in die Titration
General Chemistry
425.9K Ansichten

Ideale Gasgleichung
General Chemistry
79.5K Ansichten

Das Prinzip von Le Chatelier
General Chemistry
266.1K Ansichten

Gefrierpunktserniedrigung zur Bestimmung einer unbekannten Substanz
General Chemistry
161.1K Ansichten

Bestimmung der Ratengleichung und der Reaktionsreihenfolge
General Chemistry
196.6K Ansichten

Verwendung der dynamischen Differenzkalorimetrie zur Messung von Enthalpieänderungen
General Chemistry
44.8K Ansichten

Komplexchemie
General Chemistry
91.8K Ansichten
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten