Determinação espectrofotométrica de uma constante de equilíbrio
Visão Geral
Fonte: Laboratório do Dr. Michael Evans — Instituto de Tecnologia da Geórgia
A constante de equilíbrio, K,para um sistema químico é a razão das concentrações do produto para concentrações reagentes em equilíbrio, cada uma elevada ao poder de seus respectivos coeficientes estequiométricos. A medição de K envolve a determinação dessas concentrações para sistemas em equilíbrio químico.
Sistemas de reação contendo um único componente colorido podem ser estudados espectrofotometricamente. A relação entre absorvância e concentração para o componente colorido é medida e utilizada para determinar sua concentração no sistema de reação de interesse. As concentrações dos componentes incolores podem ser calculadas indiretamente utilizando a equação química equilibrada e a concentração medida do componente colorido.
Neste vídeo, a curva de lei da Cerveja para Fe(SCN)2+ é determinada empiricamente e aplicada à medição de K para a seguinte reação:

Quatro sistemas de reação com diferentes concentrações iniciais de reagentes são investigados para ilustrar que K permanece constante independentemente das concentrações iniciais.
Princípios
Toda reação química está associada a uma constante de equilíbrio K,que reflete a razão das concentrações do produto para concentrações reagentes no equilíbrio químico. Para a reação genérica a A + b B  c C + d D, a constante de equilíbrio é definida como
c C + d D, a constante de equilíbrio é definida como

onde as concentrações no lado direito da equação são molaridades em equilíbrio. Esta equação é conhecida como a expressão de equilíbrio para a reação. Em sistemas químicos que não estão em equilíbrio, as reações para frente e reversa ocorrem em diferentes taxas até que as concentrações de reagentes e produtos satisfaçam a expressão de equilíbrio.
Para medir o valor de K para um sistema em equilíbrio químico, é necessário determinar as concentrações de reagentes e produtos direta ou indiretamente. Os métodos espectrofotométricos para a determinação de K envolvem a medição direta da concentração de um componente colorido e a medição indireta dos demais. A espectroscopia visível do componente colorido em concentrações conhecidas revela a relação entre absorção e concentração para este componente. De acordo com a lei de Beer, essa relação tem a forma
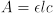
onde e é a absortividade molar do componente em L/mol-cm, l é o comprimento do caminho da luz através da amostra em cm, c é a molaridade do componente em mol/L, e A é a absorvância.
A curva de lei da Cerveja para o componente colorido pode ser aplicada a um sistema de reação em equilíbrio para determinar a concentração deste componente a partir de medidas de absorção(Figura 1). As concentrações dos remanescentes reagentes e produtos podem então ser calculadas ajustando as concentrações iniciais com base na molaridade medida das espécies coloridas.
O sistema estudado aqui é a reação do cáção de ferro (III) com o ânion de tiocianato para formar um complexo de tiocianato de ferro (III).

A expressão de equilíbrio para este sistema de reação é

onde o subscrito eq denota concentrações de equilíbrio. O produto de tiocianato de ferro (III) é laranja, mas ambos os reagentes são incolores em solução aquosa. Assim, [Fe(SCN)2+]eq pode ser determinado diretamente a partir de medidas de absorção.

As concentrações de equilíbrio dos reagentes podem ser calculadas subtraindo a concentração de equilíbrio do produto a partir das concentrações iniciais dos reagentes. Uma tabela de equilíbrio inicial de mudança (ICE) ilustra como concentrações iniciais e de equilíbrio estão relacionadas(Tabela 1).

Ensaios repetidos deste experimento envolvendo diferentes concentrações iniciais de reagentes devem produzir o mesmo valor de K, já que o valor de K é independente da concentração.
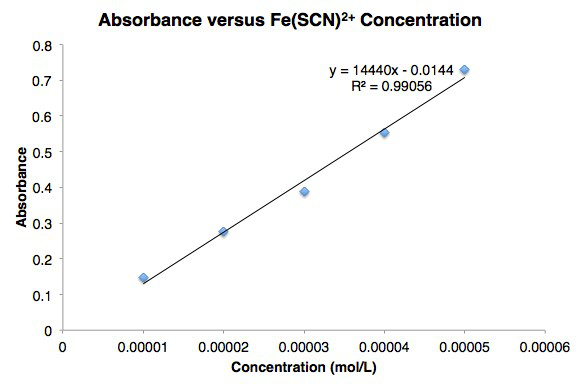
Figura 1. Curva da lei da cerveja para o tiocianato de ferro (III).
| Fe3+ | SCN- | Fe(SCN)2+ | |
| Inicial | [Fe3+] i | [SCN–] i | 0 |
| Mudar | –[Fe(SCN)2+]eq | –[Fe(SCN)2+]eq | +[Fe(SCN)2+]eq |
| Equilíbrio | [Fe3+] i – [Fe(SCN)2+]eq | [SCN–] i – [Fe(SCN)2+]eq | [Fe(SCN)2+] eq |
Mesa 1. Uma tabela de equilíbrio inicial de mudança (ICE) que ilustra como as concentrações iniciais e de equilíbrio estão relacionadas.
Procedimento
1. Determinando a Curva da Lei da Cerveja para Fe(SCN)2+
- Calibrar um espectrofotômetro visível usando água destilada como um branco.
- Adicione 1,0 mL de 1,0 × solução 10-4 M Fe(NO3)3 a um tubo de ensaio.
- Ao mesmo tubo de ensaio, adicione 5,0 mL de solução KSCN de 0,50 M.
- Ao mesmo tubo de ensaio, adicione 4,0 mL de solução HNO 3 de0,10 M. Cubra o tubo com um dedo enluvado e agite delicadamente para misturar.
- Use uma pipeta Pasteur para transferir uma pequena quantidade da solução para um cuvette. Certifique-se de que o nível líquido está acima do caminho do feixe de luz no espectrômetro.
- Coloque a cuvette no espectrômetro, para que a luz passe pelos lados transparentes.
- Adquira um espectro e regise o valormáximo λ e a absorvância noλ max.
- Para construir uma curva de lei da Cerveja, devem ser preparadas e medidas soluções adicionais com concentrações conhecidas da Fe(SCN)2+. Repetir passos 2 – 7 utilizando os volumes das soluções Fe(NO3)3, KSCN e HNO3 na Tabela 2. Certifique-se de usar o mesmo cuvette para todas as medidas, enxaguando 3 vezes com água destilada entre cada amostra.
- Plote a absorvância medida versus as concentrações de Fe(SCN)2+ em cada tubo de ensaio e determine a linha de melhor ajuste para os dados. A inclinação desta linha é a absortividade molar e o comprimento do caminho é de 1 cm.
2. Medindo K para o sistema de tiocianato de ferro (III)
- Prepare 4 tubos de ensaio médio contendo os volumes indicados de 0,0025 M Fe(NO3)3, 0,0025 M KSCN e 0,10 M HNO3 soluções na Tabela 3.
- Cubra cada tubo com um dedo e agite delicadamente para misturar. Deixe-os ficar por pelo menos 10 minutos. Este período de descanso garante que as soluções estejam em equilíbrio químico.
- Use uma pipeta Pasteur para transferir uma pequena quantidade de solução 6 para um cuvette. Certifique-se de que o nível líquido está acima do caminho do feixe de luz no espectrômetro.
- Adquira um espectro e regisse a absorvância noλ max.
- Múltiplas reações com diferentes concentrações iniciais de reagentes podem ser estudadas para ilustrar que K não depende da concentração. Para determinar K para diferentes condições iniciais, repita as etapas 3 e 4 para soluções 7 – 9.
| Número do tubo | Volume 1.0 x 10-4 M Fe(NO3)3 (mL) |
Volume 0,50 M KSCN (mL) |
Volume 0,10 M HNO3 (mL) |
| 1 | 1.0 | 5.0 | 4.0 |
| 2 | 2.0 | 5.0 | 3.0 |
| 3 | 3.0 | 5.0 | 2.0 |
| 4 | 4.0 | 5.0 | 1.0 |
| 5 | 5.0 | 5.0 | 0.0 |
Mesa 2. Volumes apropriados das soluções Fe(NO3)3,KSCN e HNO3 a serem colocadas nos tubos 2 - 5.
| Número do tubo | Volume 0.0025 M Fe(NO3)3 (mL) |
Volume 0,0025 M KSCN (mL) |
Volume 0,10 M HNO3 (mL) |
| 6 | 1.0 | 1.0 | 5.0 |
| 7 | 1.0 | 2.0 | 4.0 |
| 8 | 2.0 | 2.0 | 3.0 |
| 9 | 2.0 | 3.0 | 2.0 |
Mesa 3. Volumes apropriados de soluções 0,0025 M Fe(NO3), 0,0025 M KSCN e 0,10 M HNO3.
Resultados
A Tabela 4 lista os dados de absorção e concentração das soluções 1 – 5. As concentrações de Fe(SCN)2+ foram determinadas a partir de concentrações iniciais de Fe3+ sob a suposição de que todos os Fe3+ são convertidos para Fe(SCN)2+. Um grande excesso de SCN- foi usado nos tubos 1 – 5 para garantir que essa suposição se mantenha verdadeira.
A molaridade [Fe(SCN)2+] e a absorvência são traçadas na Figura 2. As absorventes medidas concordam bem com a lei de Beer.
Tabela 5 lista absorvâncias medidas e valores K calculados para tubos 6 – 9. Os valores K foram determinados usando o método de tabela ICE. As concentrações iniciais de reagente baseavam-se nas molaridades conhecidas de Fe3+ e SCN- nas soluções reagentes e no volume total da reação (10 mL). A concentração de equilíbrio de Fe(SCN)2+ foi determinada dividindo a absorvência medida pela absortividade molar de Fe(SCN)2+. Como todo o produto foi formado a partir da reação 1:1 de Fe3+ e SCN-, a concentração de equilíbrio do Fe(SCN)2+ corresponde à diminuição da concentração dos reagentes. A Tabela 6 mostra o processo para tubo de ensaio 6.
A constante de equilíbrio é calculada a partir das concentrações na linha de equilíbrio. Para tubo de ensaio 6,

O valor médio de K foi de 147 ± 11, ilustrando que K é aproximadamente constante sobre a gama de concentrações estudadas.

Figura 2. Gráfico de linha de Absorvência versus Concentração para Fe(SCN)2+.
| Tubo | [Fe(SCN)2+] (mol/L) | Absorvância |
| 1 | 1,00 x 10-5 | 0.10 |
| 2 | 2.00 x 10-5 | 0.20 |
| 3 | 3.00 x 10-5 | 0.25 |
| 4 | 4.00 x 10-5 | 0.32 |
| 5 | 5,00 x 10-5 | 0.42 |
Mesa 4. Absorver versus Dados de Concentração para Fe(SCN)2+.
| Tubo | Absorvância | K |
| 6 | 0.120 | 136 |
| 7 | 0.268 | 161 |
| 8 | 0.461 | 142 |
| 9 | 0.695 | 150 |
Mesa 5. Valores de absorção medidos e K calculados para a reação de ferro (III) com tiocianato.
| [Fe3+] (mol/L) | [SCN–] (mol/L) | [Fe(SCN)2+] (mol/L) | |
| Inicial | 3,57 x 10-4 | 3,57 x 10-4 | 0 |
| Mudar | –1,58 x 10-5 | –1,58 x 10-5 | +1,58 x 10-5 |
| Equilíbrio | 3.41 x 10-4 | 3.41 x 10-4 | 1,58 x 10-5 |
Mesa 6. A tabela ICE que ilustra o processo utilizado para o tubo de ensaio 6.
Aplicação e Resumo
A constante de equilíbrio fornece informações úteis sobre até que ponto uma reação procederá à formação de produtos ao longo do tempo. Reações com grande valor de K, muito maior que 1, formarão produtos quase completos dado tempo suficiente(Figura 3). Reações com um valor de K menos de 1 não avançarão a um grau significativo. A constante de equilíbrio serve, assim, como medida da viabilidade de uma reação química.

Figura 3. A constante de equilíbrio dessa reação é maior que 1. Uma quantidade significativa de formas de produtos coloridos em cada caso, embora as concentrações iniciais de reagentes diferem.
A constante de equilíbrio também fornece informações termodinâmicas úteis sobre as mudanças na energia livre, entalpia e entropia no curso de uma reação química. A constante de equilíbrio está relacionada à livre mudança de energia da reação:
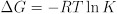
A mudança de energia livre de reação está, por sua vez, relacionada com as mudanças de reação entalias e entropias:
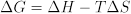
Medições da dependência de temperatura de K podem revelar a mudança entalpia ΔH e a alteração de entropia ΔS para uma reação. Além de fornecer aos químicos uma visão sobre padrões no comportamento molecular, tabelas de dados termodinâmicos podem ser usadas para identificar reações com propriedades termodinâmicas favoráveis. Por exemplo, reações redox que liberam grandes quantidades de energia (associadas a valores ΔG negativos) são candidatos atraentes para baterias.
Os valores de K para reações de dissociação ácida (Ka values) são úteis para prever os resultados das reações ácido-base, que são controladas termodinamicamente. Ácidos fortes estão associados com grandes valores Ka e ácidos fracos com pequenos valores Ka. os indicadores de pH são ácidos fracos com formas ácidas e básicas de cor diferente, e o pKa (o logaritmo negativo base-10 de Ka) de um indicador representa o pH no qual uma mudança de cor ocorre à medida que um ácido ou base é adicionado a uma solução do indicador.
Da mesma forma, ka valores são usados na preparação de soluções tampão para alcançar um valor de pH-alvo. O pKa de um ácido fraco representa o pH em que o ácido e sua base conjugada estão presentes na solução em concentrações iguais. Quando quantidades iguais de ácido fraco e sua base conjugada são dissolvidas em uma solução, o pH da solução é igual ao pKado ácido fraco.
Pular para...
Vídeos desta coleção:

Now Playing
Determinação espectrofotométrica de uma constante de equilíbrio
General Chemistry
158.3K Visualizações

Vidraria de laboratório comuns e seus usos
General Chemistry
654.0K Visualizações

Soluções e Concentrações
General Chemistry
273.2K Visualizações

Determinando a densidade de um sólido e um líquido
General Chemistry
554.9K Visualizações

Determinação de composição percentual em massa em uma solução aquosa
General Chemistry
383.1K Visualizações

Determinação da Fórmula Empírica
General Chemistry
180.1K Visualizações

Determinação das Regras de Solubilidade de Compostos Iônicos
General Chemistry
141.1K Visualizações

Usando um medidor de pH
General Chemistry
344.4K Visualizações

Introdução à Titulação
General Chemistry
423.5K Visualizações

Lei dos gases ideais
General Chemistry
78.2K Visualizações

Princípio de Le Châtelier
General Chemistry
264.1K Visualizações

Depressão do ponto de congelamento para determinar um composto desconhecido
General Chemistry
160.5K Visualizações

Determinação das Leis de Velocidade e da Ordem de Reação
General Chemistry
195.7K Visualizações

Uso de Calorimetria de Varredura Diferencial para Medir Mudanças na Entalpia
General Chemistry
44.4K Visualizações

Complexos de Química de Coordenação
General Chemistry
91.2K Visualizações
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados