Method Article
Highly-Multiplexed Tissue Imaging mit Raman-Farbstoffen
In diesem Artikel
Zusammenfassung
Die elektronische präresonanzstimulierte Raman-Streuung (epr-SRS) Bildgebung von regenbogenartigen Raman-Farbstoffen ist eine neue Plattform für die hochgradig gemultiplexte Epitop-basierte Proteinbildgebung. Hier stellen wir einen praktischen Leitfaden vor, der die Antikörpervorbereitung, die Gewebeprobenfärbung, die SRS-Mikroskopmontage und die EPR-SRS-Gewebebildgebung umfasst.
Zusammenfassung
Die Visualisierung einer Vielzahl spezifischer Biomarker in Geweben spielt eine wichtige Rolle bei der Erforschung der komplizierten Organisationen komplexer biologischer Systeme. Daher werden stark gemultiplexte Bildgebungstechnologien zunehmend geschätzt. Hier beschreiben wir eine aufstrebende Plattform der hochgemultiplexten Schwingungsbildgebung spezifischer Proteine mit vergleichbarer Empfindlichkeit gegenüber Standard-Immunfluoreszenz über elektronische präresonanzregenerierte Raman-Streuung (epr-SRS) Bildgebung von regenbogenartigen Raman-Farbstoffen. Diese Methode umgeht die Grenze der spektral auflösbaren Kanäle in der konventionellen Immunfluoreszenz und bietet einen optischen One-Shot-Ansatz, um mehrere Marker in Geweben mit subzellulärer Auflösung abzufragen. Es ist im Allgemeinen kompatibel mit Standard-Gewebepräparaten, einschließlich paraformaldehydfixiertem Gewebe, gefrorenem Gewebe und formalinfixiertem paraffineingebettetem (FFPE) menschlichem Gewebe. Wir gehen davon aus, dass diese Plattform ein umfassenderes Bild der Proteininteraktionen biologischer Proben liefern wird, insbesondere für dickes intaktes Gewebe. Dieses Protokoll bietet den Workflow von der Antikörpervorbereitung über die Gewebeprobenfärbung, die SRS-Mikroskopmontage bis hin zur EPR-SRS-Gewebebildgebung.
Einleitung
Komplexe Gewebesysteme bestehen aus unterschiedlichen zellulären Subpopulationen, deren räumliche Standorte und Interaktionsnetzwerke mit ihren Funktionen und Funktionsstörungen tief verflochten sind 1,2. Um die Gewebearchitektur aufzudecken und ihre Komplexität zu hinterfragen, ist die Kenntnis der räumlichen Positionen von Proteinen bei Einzelzellauflösung unerlässlich. Daher wurden stark gemultiplexte Protein-Bildgebungstechnologien zunehmend geschätzt und könnten zu einem Eckpfeiler für die Untersuchung der Gewebebiologie werden 3,4,5. Aktuelle gängige gemultiplexte Proteinbildgebungsverfahren können in zwei Hauptkategorien eingeteilt werden. Eine ist die serielle Immunfluoreszenzbildgebung, die auf mehreren Runden der Gewebefärbung und Bildgebung beruht, und die andere ist die Bildgebung der Massenzytometrie in Verbindung mit Schwermetall-markierten Antikörpern 6,7,8,9,10,11,12.
Hier wird eine alternative Strategie für die Multiplex-Antikörper-basierte Proteinbildgebung vorgestellt. Im Gegensatz zur vorherrschenden Fluoreszenzbildgebungsmodalität, die aufgrund der breiten Anregungs- und Emissionsspektren nur 4-5 Kanäle gleichzeitig visualisieren kann (volle Breite bei halbem Maximum (FWHM) ~ 500 cm-1), weist die Raman-Mikroskopie eine viel engere spektrale Linienbreite (FWHM ~ 10 cm-1) auf und bietet daher eine skalierbare Multiplexie. Vor kurzem wurde durch die Nutzung des engen Spektrums ein neuartiges Schema der Raman-Mikroskopie namens elektronische Präresonanz-stimulierte Raman-Streuung (epr-SRS) -Mikroskopie entwickelt, das eine leistungsstarke Strategie für die Multiplex-Bildgebung13 bietet. Durch die Untersuchung der elektronisch gekoppelten Schwingungsmoden von Raman-Farbstoffen erreicht epr-SRS einen drastischen Verstärkungseffekt von 10 13-fach auf Raman-Querschnitte und überwindet den Empfindlichkeitsengpass der konventionellen Raman-Mikroskopie (Abbildung 1A)13,14,15. Infolgedessen wurde die Nachweisgrenze von epr-SRS auf sub-μM angehoben, was den Raman-Nachweis interessanter molekularer Marker wie spezifischer Proteine und Organellen in Zellenermöglicht 13,16. Insbesondere unter Verwendung von Raman-Farbstoff-konjugierten Antikörpern wurde die epr-SRS-Bildgebung spezifischer Proteine in Zellen und Geweben (Immuno-EprSRS genannt) mit einer vergleichbaren Empfindlichkeit gegenüber der Standard-Immunfluoreszenz gezeigt (Abbildung 1B)13,17. Durch die Abstimmung der Pumpenwellenlänge um nur 2 nm wird das epr-SRS-Signal vollständig ausgeschaltet (Abbildung 1B), was einen hohen Schwingungskontrast zeigt.
Auf der Sondenseite wurde eine Reihe von regenbogenartigen Raman-Sonden namens Manhattan Raman scattering (MARS) -Farbstoffe für die Antikörperkonjugation13,18,19,20 entwickelt. Diese einzigartige Raman-Palette besteht aus neuartigen Farbstoffen mit π-konjugierten Dreifachbindungen (Supplementary Material), die jeweils einen einzelnen und schmalen epr-SRS-Peak im bioorthogonalen Raman-Spektralbereich aufweisen (Abbildung 1C). Durch Modifikation der Struktur des Kernchromophors und isotopische Bearbeitung beider Atome der Dreifachbindung (Ergänzungsmaterial) wurden spektral getrennte Raman-Sonden entwickelt. Durch die Nutzung der skalierbaren Multiplexität bietet die epr-SRS-Mikroskopie in Verbindung mit der MARS-Farbstoffpalette eine optische Strategie für die One-Shot-Multiplexprotein-Bildgebung in Zellen und Geweben.
Immuno-eprSRS bietet eine alternative Strategie zu aktuellen Multiplex-Protein-Bildgebungsverfahren mit einzigartigen Stärken. Im Vergleich zu Fluoreszenzansätzen mit zyklischer Färbung, Bildgebung und Signalentfernung gewährleistet diese Raman-basierte Plattform eine Einzelrundenfärbung und Bildgebung. Daher umgeht es die praktische Komplexität zyklischer Verfahren und vereinfacht das Protokoll weitgehend, wodurch neue Gebiete der multiplexten Proteinbildgebung erschlossen werden. Zum Beispiel wurde Immuno-eprSRS unter Verwendung eines auf Raman-Farbstoffe zugeschnittenen Gewebereinigungsprotokolls auf drei Dimensionen erweitert, um hochgradig gemultiplexte Proteinkartierungen in dicken intakten Gewebenzu ermöglichen 17. Über 10 Proteinziele wurden entlang des millimeterdicken Gehirngewebesder Maus sichtbar gemacht 17. In jüngerer Zeit wurde auch die Kopplung von Immun-eprSRS mit einem optimierten Biomolekül-Retentionsexpansionsmikroskopie-Protokoll (ExM)21, einer nanoskaligen One-Shot-Bildgebung mehrerer Ziele,gezeigt 22. Im Vergleich zur abbildenden Massenspektroskopie 4,9 ist epr-SRS zerstörungsfrei und verfügt über eine intrinsisch optische Schnittfähigkeit. Darüber hinaus ist epr-SRS beim Gewebescannen zeiteffizienter. Typischerweise benötigt eine Geweberegion von 0,25 mm2 mit einer Pixelgröße von 0,5 μm nur wenige Minuten, um einen einzelnen epr-SRS-Kanal abzubilden. Beispielsweise beträgt die Gesamtabbildungszeit von vier SRS-Kanälen plus vier Fluoreszenzkanälen in Abbildung 4 etwa 10 min.
Protokoll
Das Protokoll wurde in Übereinstimmung mit dem Tierversuchsprotokoll (AC-AABD1552) durchgeführt, das vom Institutional Animal Care and Use Committee der Columbia University genehmigt wurde.
1. Herstellung von Raman-Farbstoff-konjugierten Antikörpern
- Bereiten Sie den Konjugationspuffer als ~0,1 MNaHCO 3 im PBS-Puffer, pH = 8,3, bei 4 °C lagern.
- N-Hydroxysuccinimidy (NHS) Ester-funktionäre MARS-Sondenlösung (Supplementary Material) als 3 mM in wasserfreiem DMSO herstellen. Die Synthese von MARS-Sonden kann auf frühere Berichte13,17,18 verwiesen werden.
HINWEIS: Für Lagerungszwecke muss die Farbstoff-NHS-Esterlösung vor Licht geschützt und bei -20 °C gehalten werden. - Antikörperfeststoffe im Konjugationspuffer bis zu einer Konzentration von 2 mg/ml auflösen. Für Antikörper, die in anderen Puffern gelöst sind, tauschen Sie sie in den Konjugationspuffer bis zu einer Konzentration von 1-2 mg/ml mit Zentrifugalfiltern aus.
HINWEIS: Hochgradig kreuzadsorbierte sekundäre Antikörper werden für die Multiplexfärbung bevorzugt, um die artübergreifende Reaktivität zu minimieren. Die verwendeten sekundären Antikörper sind in Tabelle 1 und Materialtabelle aufgeführt. - Führen Sie die Konjugationsreaktion durch.
- Für sekundäre Antikörper fügen Sie der Antikörperlösung in einer Glasdurchstechflasche langsam unter Rühren einen 15-fachen molaren Überschuss an Farbstofflösung hinzu. Fügen Sie beispielsweise in 0,5 ml 2 mg/ml Antikörperlösung 35 μL 3 mM Farbstofflösung hinzu.
- Das Reaktionsgemisch bei Raumtemperatur (RT) unter Rühren für 1 h inkubieren. Schützen Sie die Reaktion vor Licht.
- Reinigung.
- Bereiten Sie die Aufschlämmung von Gelfiltrationsharz (Materialverzeichnis) im PBS-Puffer vor, indem Sie die Schritte 1.5.2-1.5.4 ausführen.
- Fügen Sie 10 ml Gelfiltrationsharzpulver in 40 ml PBS-Puffer in einem 50-ml-Rohr hinzu.
- Bewahren Sie die Lösung 1 Stunde lang in einem 90 °C warmen Wasserbad auf.
- Dekantieren Sie den Überstand und fügen Sie PBS wieder auf 40 ml hinzu. Lagern Sie die Gülle bei 4 °C.
- Packen Sie die Größenausschlusssäule (1 cm Durchmesser, Schwerkraft-Durchfluss-Säulen) mit der Güllelösung auf die Höhe von 10-15 cm.
- Spülen und waschen Sie die Säule mit ~ 10 ml PBS-Puffer, um das Harz weiter zu verpacken.
- Das Konjugationsreaktionsgemisch (~0,5 ml) wird auf die Säule pipettiert. Fügen Sie sofort 1 ml PBS-Puffer als Elutionspuffer hinzu, wenn das gesamte Reaktionsgemisch geladen ist. Füllen Sie den Elutionspuffer (PBS) ständig auf die Säule auf.
- Sammeln Sie das Eluat der Konjugatlösung, indem Sie die Farbe auf der Säule betrachten (MARS-Farbstoffe haben hellgrüne bis blaue Farben) oder die Absorption bei 280 nm (A280) messen.
- Konzentrieren Sie die gesammelte Lösung auf 1-2 mg/ml mit einem Zentrifugalfilter.
- Bestimmen Sie die Konzentration und den durchschnittlichen Markierungsgrad (DOL, Farbstoff-Protein-Verhältnis), indem Sie das UV-sichtbare (UV-Vis) Spektrum der konjugierten Lösung mit einem Nano-Plattenleser messen.
HINWEIS: Ergänzungsmaterial liefert Eigenschaften von MARS-Farbstoff NHS-Ester für die Berechnung. Der normale DOL für den sekundären Antikörper liegt bei etwa 3.
2. Gewebeprobenvorbereitung
- Paraformaldehyd fixierte das Hirngewebe der Maus.
- Betäuben Sie die Mäuse (C57BL/6J, weiblich, 25 d postnatal) mit Isofluran. Beurteilen Sie die richtige Anästhesie mit einem Zehenquetschtest.
- Töte die Mäuse durch zervikale Verdrängung. Perfusionieren Sie die Mäuse sofort mit 4% Paraformaldehyd (PFA) in PBS transkardial.
- Sammeln Sie das Mäusegehirn und befolgen Sie die Schritte 2.1.4-2.1.5
- Schneiden Sie entlang der sagittalen Naht vom Hirnstamm nach oben. Schälen Sie die beiden Schädelhälften zur Seite und schöpfen Sie das Gehirn mit einer Pinzette aus.
- Fixieren Sie das gesammelte Gehirn in 4% PFA in PBS bei 4 ° C für 24 h. Waschen Sie dann das Gehirn 24 Stunden lang im PBS-Puffer bei 4 ° C, um überschüssiges PFA zu entfernen.
- Feste Agarose bis zu einer Endkonzentration von 7% (w/v) in ein Becherglas mit lockerem Deckel in Wasser geben. Rühren Sie die Lösung mit einem Glasrührstab um. Erhitzen Sie die Aufschlämmung in der Mikrowelle, bis die Lösung klar ist.
- Die Agarose auf 45-55 °C abkühlen lassen.
- Gießen Sie die flüssige Agarose in eine kleine Kammer, übertragen Sie dann das Gehirn von PBS auf flüssige Agarose und orientieren Sie es mit einem Spatel, um das Gehirn einzubetten. Warten Sie, bis der Gewebe-Agarose-Block aushärtet.
- Schneiden Sie die Gewebeagrose mit einem Vibratom in 40 μm dicke koronale Scheiben.
- Übertragen Sie das Gewebe auf eine 4-Well-Platte für die folgende Färbung. Entfernen Sie die Agarose mit einer Pinzette. Waschen Sie das Tuch dreimal mit 1 ml PBS.
- Fixiertes gefrorenes Mäuse-Bauchspeicheldrüsengewebe.
- Fixieren Sie die Pankreate der Maus in 4% PFA in PBS bei 4 °C mit Schaukeln für 16-20 h.
- Waschen Sie die Probe dreimal in 1 ml PBS (4 °C), um PFA zu entfernen.
- Betten Sie die Probe (~ 0,3-0,5 cm groß) in Verbundblöcke mit optimaler Schnitttemperatur (OCT) ein. Geben Sie 2 Tropfen OCT in eine Kunststoffkryoform. Legen Sie das Gewebe in die richtige Ausrichtung und gießen Sie OCT auf das Gewebe, bis keines der Gewebe freiliegt.
- Die Bauchspeicheldrüse in 8 μm dicke Scheiben schneiden und auf einen gewebebindenden Glasobjektträger immobilisieren, bei -80 °C lagern.
- Vor dem Färben die Probe zu RT ausgleichen. Waschen Sie das Gewebe mit PBS, um OCT-Blöcke zu entfernen.
- FFPE-Proben.
- Den FFPE-Tissue-Objektträger bei 60 °C für 10 min backen.
- Deparaffinisierung und Rehydratation: Legen Sie die Proben nacheinander in die folgenden Lösungen in ein 50-ml-Röhrchen bei RT für jeweils 3 min mit leichtem Schütteln:
Xylol zweimal,
Ethanol zweimal,
95% (vol/vol) Ethanol in deionisiertem Wasser zweimal,
70% (vol/vol) Ethanol in deionisiertem Wasser zweimal,
50% (vol/vol) Ethanol in entionisiertem Wasser einmal,
Einmal deionisiertes Wasser. - Die Probe wird in 20 mM Natriumcitrat (pH 8,0) bei 100 °C in einem Glas überführt. Stellen Sie sicher, dass das Gewebe in die Lösung eingetaucht ist.
- Das Glas für 45 min in ein 60 °C warmes Wasserbad geben.
- Waschen Sie die Probe mit deionisiertem Wasser bei RT für 5 min.
3. Gewebe-Immuno-eprSRS-Färbung
- Verwenden Sie einen hydrophoben Pen, um eine Grenze um die Gewebeabschnitte auf dem Objektträger zu ziehen.
HINWEIS: Ein Objektträger-Färbeglas wird verwendet, um Inkubationsschritte von Gewebe auf dem Objektträger zu verfolgen. Schwimmende Gewebe (40 μm dicke Hirnschnitte der Maus) sind in Brunnenplatten gefärbt. - Inkubieren Sie das Gewebe mit 0,3-0,5% PBST (Triton X-100 in PBS) für 10 min.
- Inkubieren Sie das Gewebe mit Blockpuffer (5% Eselserum, 0,5% Triton X-100 in PBS) für 30 min.
- Bereiten Sie die primäre Färbelösung vor: Geben Sie alle primären Antikörper in 200-500 μL Färbepuffer (2% Eselserum, 0,5% Triton X-100 in PBS) in den gewünschten Konzentrationen. Zentrifen Sie die primäre Färbelösung bei 13.000 x g für 5 min. Verwenden Sie den Überstand nur, wenn sich Ausfällungen bilden.
- Inkubieren Sie das Gewebe in der primären Antikörperlösung bei 4 °C für 1-2 Tage.
HINWEIS: Um Gewebeabschnitte auf dem Objektträger zu färben, legen Sie die Probe in eine Färbebox mit einem Feuchttuch, um die Feuchtigkeit aufrechtzuerhalten. - Waschen Sie die Dias dreimal mit 0,3-0,5% PBST bei RT für jeweils 5 Minuten. Verwenden Sie 1 ml PBST für schwimmende Gewebe. Für Taschentücher auf dem Objektträger waschen Sie die Objektträger in einem Objektträger-Färbeglas und stellen Sie sicher, dass alle Gewebe in die Lösung eingetaucht sind.
- Inkubieren Sie das Gewebe in 200-500 μL Sperrpuffer für 30 min.
- Bereiten Sie die sekundäre Färbelösung vor: Fügen Sie alle sekundären Antikörper (und ggf. Lektine) zu 200-500 μL Färbepuffer mit den gewünschten Konzentrationen (normalerweise 10 μg/ml) hinzu. Zentrifugieren Sie die sekundäre Färbelösung bei 13.000 x g für 5 min. Verwenden Sie den Überstand nur, wenn sich Ausfällungen bilden.
- Inkubieren Sie das Gewebe in 200-500 μL sekundärer Antikörperlösung bei 4 °C für 1-2 Tage.
- Waschen Sie die Dias zweimal mit 0,3-0,5% PBST bei RT für jeweils 5 Minuten.
- Inkubieren Sie mit 200-500 μL DAPI-Lösung für 30 min.
- Waschen Sie die Dias dreimal mit PBS bei RT für jeweils 5 Minuten.
- Für schwimmende Gewebeabschnitte übertragen Sie sie auf Glasobjektträger mit einer Glaspipette. Verteilen Sie das Gewebe mit einer Taschentuchbürste und reinigen Sie die Umgebung bei Bedarf mit Tüchern.
- Montieren Sie das Gewebe in einem Tropfen Antifade-Reagenzien mit einem Glasdeckglas und befestigen Sie es mit Nagellack.
4. SRS-Mikroskop-Montage
HINWEIS: Ein kommerzielles konfokales Fluoreszenzsystem wird in der Tandem-SRS-Fluoreszenzbildgebung verwendet. Weitere Beschreibungen finden Sie in einem früheren Bericht17. Dieses Protokoll konzentriert sich auf die SRS-Bildgebungsseite unter Verwendung einer schmalbandigen Anregung.
- Bereiten Sie einen vibrationsisolierten optischen Tisch in einem Raum mit Temperaturregelung vor.
- Platzieren Sie ein synchronisiertes Dual-Laser-System (Pumpe und Stokes) auf dem optischen Tisch (Abbildung 2A) mit angeschlossenem Kaltwassersatz.
HINWEIS: Der grundlegende Laser im Dual-Laser-System bietet einen Ausgangspulszug bei 1064 nm mit 6 ps Pulsbreite und 80 MHz Wiederholrate. Der Stokes-Strahl stammt vom fundamentalen Laser. Die Intensität des Stokes-Strahls wurde sinusförmig durch einen eingebauten elektrooptischen Amplitudenmodulator (EOM) bei 8 MHz mit einer Modulationstiefe von mehr als 90% moduliert. Der andere Teil des fundamentalen Lasers ist frequenzverdoppelt auf 532 nm, was weiter verwendet wird, um synchron einen optischen parametrischen Pikoszillator (OPO) zu säen, um einen mode-locked Pulszug mit 5-6 ps Pulsbreite zu erzeugen (der Leerlaufstrahl des OPO wird mit einem interferometrischen Filter blockiert). Die Ausgangswellenlänge des OPO ist von 720-950 nm abstimmbar, was als Pumpstrahl dient. - Montieren Sie die Spiegel (Wellenlängenbereich: 750-1100 nm), dichroitische Strahlteiler (DBS, 980 nm Langpassfilter, rechteckig) und Objektive (achromatisch, AR-Beschichtung für 650-1050 nm) an ihren jeweiligen Halterungen. Verwenden Sie sehr stabilkinematische Spiegelhalterungen für die Spiegel und dichroitische Strahlteiler.
- Messen Sie die Höhe der Laserleistung und die Strahlgrößen der Pumpe und der Stokes-Strahlen. Passen Sie die Höhe von Spiegeln und Linsen an, um sicherzustellen, dass das Licht in die Mitte aller optischen Elemente trifft.
- Legen Sie den Spiegel M1 auf den optischen Tisch und machen Sie ihn ~ 45 ° zum Laserausgang (Abbildung 2B). Verwenden Sie die Knöpfe an der kinematischen Halterung, um Spitzen- und Neigeeinstellungen vorzunehmen. Stellen Sie sicher, dass sich das Licht auf der gleichen Höhe entlang der Länge des Tisches und einer geraden Linie in Bezug auf den Tisch bewegt.
- Platzieren und richten Sie die dichroitischen Strahlteiler (980-nm-Langpassfilter) und Spiegel aus, um die Pumpe und die Stokes-Strahlen zu teilen (Abbildung 2A-B).
- Platzieren und richten Sie Linsenpaare (L1, L2 und L3, L4) auf jedem der Strahlpfade aus, um die Strahlen zu kollimieren und die Strahldurchmesser entsprechend der hinteren Pupille des Objektivs zu erweitern (Abbildung 2A-B).
- Verwenden Sie M7- und M8-Spiegel, um kombinierte Laserstrahlen im Mikroskop auszurichten (Abbildung 2C). Richten Sie zuerst einen Strahl in das Mikroskop aus und verwenden Sie die Spiegelpaare auf dem anderen Strahl, um die räumliche Überlappung der beiden Strahlen sicherzustellen.
- Richten Sie den Erkennungsteil ein.
- Setzen Sie einen Infrarot-beschichteten Ölkondensator (1.4-NA) auf, um die vorwärts gerichtete Pumpe und die Stokes-Strahlen nach dem Durchlaufen der Proben zu sammeln (Abbildung 2C).
- Montieren Sie eine großflächige Si-Fotodiode auf einer geschirmten Box mit BNC-Anschlüssen (Abbildung 2E). Fügen Sie der montierten Fotodiode ein 64-V-DC-Netzteil hinzu, um ihre Sättigungsschwelle und Antwortbandbreite zu erhöhen.
- Reflektieren Sie das nach vorne gerichtete Licht mit einem 2-Zoll-Spiegel. Fokussieren Sie das Licht nach einem optischen Filter neu auf die Fotodiode, um den modulierenden Stokes-Strahl zu blockieren (Abbildung 2D).
- Senden Sie den Ausgangsstrom der Fotodiode an einen schnellen Lock-in-Verstärker, der mit 50 für die Signaldemodulation abgeschlossen ist. Senden Sie einen 8-MHz-Trigger als Referenzsignal an den Lock-in-Verstärker.
- Senden Sie die phasengenaue X-Komponente des Lock-in-Verstärkers in die analoge Schnittstellenbox des Mikroskops.
- Optimieren Sie die zeitliche Überlappung mit der eingebauten motorisierten Verzögerungsstufe, indem Sie das SRS-Signal der reinenD2O-Flüssigkeitam Mikroskop messen.
5. Bilderfassung und -analyse
- Führen Sie Mehrkanal-EPR-SRS-Bildgebung mit sequentieller Pumpenwellenlängenabstimmung durch.
- Stellen Sie die Laserleistung auf P-Pumpe = 10-40 mW und PStokes = 40-80 mW auf dem Laserbedienfeld ein.
- Stellen Sie die Pixelverweilzeit auf 2-4 μs ein und verwenden Sie mehrere Frames mit durchschnittlich 10-20 Frames in der Mikroskopie-Software.
HINWEIS: Vermeiden Sie eine kombinatorische Verwendung von hoher Laserleistung (P-Pumpe> 40 mW, P-Stokes> 80 mW) und kleiner Pixelgröße (<0,2 μm), die aufgrund der Multiphotonenanregung wahrscheinlich einen "Bleicheffekt" von Raman-Farbstoffen verursachen. - Stellen Sie die Zeitkonstanten des Lock-in-Verstärkers auf die Hälfte der Pixelverweilzeit ein.
- Lineare spektrale Entmischung.
HINWEIS: epr-SRS folgt einer strikten linearen Signal-zu-Konzentrations-Abhängigkeit über den gesamten Konzentrationsbereich; Daher ist die lineare spektrale Entmischung effektiv, um mögliche Übersprechen zwischen Kanälen zu entfernen. Für die N-Kanal-epr-SRS-Messung mit N MARS-Sonden können gemessene Signale (S) als S = MC ausgedrückt werden, wobei C die MARS-Sondenkonzentrationen und M eine N x N-Matrix ist, die durch Raman-Querschnitte von MARS-Sonden bestimmt wird.- Messen Sie Matrix M auf einfarbigen Immuno-eprSRS-Proben, die mit verschiedenen MARS-Sonden markiert sind.
- Gleichung C = M−1· verwenden S zur Bestimmung der Konzentrationsmatrix der MARS-Sonde mit Multiplex-Probensignalmessung S.
Ergebnisse
Abbildung 3 zeigt Beispielbilder von epr-SRS in verschiedenen Proben, einschließlich fixierter Zellen (Abbildung 3A), paraformaldehyd (PFA)-fixiertem Mausgewebe (Abbildung 3B) und formalinfixierten paraffineingebetteten (FFPE) menschlichen Proben (Abbildung 3C). Die räumliche Auflösung der SRS-Mikroskopie ist beugungsbegrenzt, die typische laterale Auflösung beträgt ~ 300 nm und die axiale Auflösung beträgt 1-2 μm mit Nahinfrarotlicht zur Anregung. Infolgedessen wurden feine subzelluläre Strukturen wie Mikrotubuli in HeLa-Zellen mit Immun-eprSRS-Bildgebung von α-Tubulin originalgetreu gezeigt (Abbildung 3A). Darüber hinaus ist epr-SRS im Allgemeinen mit FFPE-Geweben kompatibel (Abbildung 3C), einer häufigen Form von Biopsieproben für die klinische Diagnose und pathologische Forschung. Ähnlich wie die Zwei-Photonen-Fluoreszenzmikroskopie verfügt epr-SRS als nichtlineares Verfahren über eine optische Schnittfähigkeit zur Visualisierung dreidimensionaler Muster mit subzellulärer Auflösung (Abbildung 3D-E).
Wir haben zuerst den Multiplex-Protein-Imaging-Nutzen von epr-SRS an festsitzenden gefrorenen Gewebeproben von Mausinseln von Langerhans in der Bauchspeicheldrüse vorgestellt. Mehrere interessierte Ziele werden ausgewählt, darunter die Hormonexpression (z. B. Insulin, Glukosiagonist (Glucagon), Pankreas-Polypeptid (PP) und Somatostatin) für die Zelltypklassifizierung (β-Zellen und Nicht-β-Zellen (α-, δ-Zellen)) und Transkriptionsfaktoren, von denen bekannt ist, dass sie mit der β-Zell-Heterogenität zusammenhängen23. Da die Fluoreszenzdetektion orthogonal zur SRS-Detektion ist, ist epr-SRS vollständig kompatibel mit konfokaler Fluoreszenz und Zwei-Photonen-Fluoreszenz. Als Proof-of-Concept wurde eine 7-farbige SRS-Fluoreszenz-Tandemabbildung auf einer einzelnen Insel leicht erreicht (Abbildung 4) mit gutem Kontrast und korrekten Mustern. Low-Expression-Targets wie der Transkriptionsfaktor Pdx1 wurden mit ausreichendem Kontrast abgebildet.
Wir zeigten auch eine achtfarbige SRS-Fluoreszenz-Tandembildgebung in PFA-fixierten Kleinhirngeweben der Maus (Abbildung 5). Durch etablierte Biomarker können verschiedene Zelltypen wie Kleinhirngranula-Neuronen (NeuN), Purkinje-Neuronen (Calbindin), Astrozyten (GFAP), Oligodendrozyten (MBP) und GABAerge Neuronen (GABAerge-Rezeptor) identifiziert werden.

Abbildung 1: Epr-SRS-Mikroskopie für hochgemultiplexte Proteinbildgebung. (A) Energiediagramm für spontanes Raman, nicht-resonantes SRS und elektronisches präresonantes SRS (epr-SRS). Die Schwingungsübergangsrate von Chromophoren wird in epr-SRS um das bis zu 1013-fache erhöht. (B) Epitop-basierte Immunbildgebung von α-Tubulin wurde in COS-7-Zellen gezeigt, die mit ATTO740 mit hohem Schwingungskontrast durch epr-SRS angefärbt wurden. Das epr-SRS-Signal verschwindet vollständig, wenn die Wellenlänge des Pumplasers nur um 2 nm (rechts) von der Resonanz abweicht. Maßstabsstäbe, 20 μm. (C) Epr-SRS-Spektren von NHS-Ester-konjugierten MARS-Sonden, wie in Supplementary Material aufgeführt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
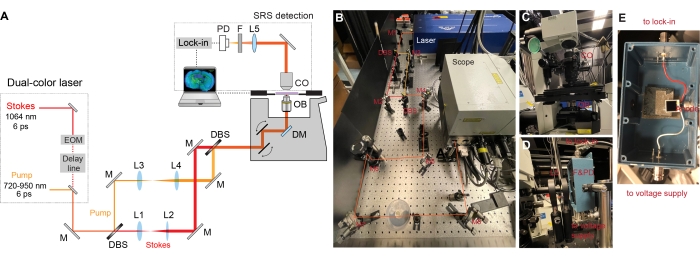
Abbildung 2: Das Design der SRS-Mikroskopeinrichtung. (A) Schematische Darstellung der SRS-Einrichtung. EOM = elektrooptischer Modulator, M = Spiegel, L = Linse, DBS = dichroitischer Strahlteiler, DM = dichroitischer Spiegel, OB = Objektivlinse, CO = Kondensator, F = Filter, PD = Fotodiode. (B) Dieses Panel zeigt den Laseranregungsteil. Der zweifarbige Strahl aus der Laserausgabe wird zunächst getrennt, wobei jeder Strahl kollimiert und erweitert und später kombiniert und in den Mikroskopkörper gerichtet wird. (C) Diese Tafel zeigt die übertragene Sammlung mit einem Kondensator. (D) Dieses Panel zeigt den SRS-Erkennungsteil. Fotodiode und Filter sind an einer geschirmten Box mit zwei BNC-Buchsen montiert. Der untere BNC-Anschluss ist für Reverse-Bias-Spannung und der höhere BNC-Anschluss ist für die Stromsignalausgabe an einen Lock-in-Verstärker, der mit 50 Ω abgeschlossen ist. (E) Dieses Panel zeigt, wie die Si-Fotodiode in der geschirmten Box montiert ist. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 3: Raman-Farbstoff-Bildgebung verschiedener Proteinmarker durch Immunmarkierung. (A) Immun-eprSRS-Bildgebung von α-Tubulin in HeLa-Zellen. (B) Immun-eprSRS-Bildgebung von NeuN im PFA-fixierten Hirnkortex der Maus. (C) Immun-eprSRS-Bildgebung von Vimentin in menschlichem Nieren-FFPE-Gewebe. (D) Volumengerendertes Bild von MARS2145 gefärbtem GFAP in 100 μm dickem Hirngewebe der Maus. Die Schrittweite in z betrug 2 μm. (E) Volumengerendertes Bild von MARS2228 färbte NeuN in 40 μm dickem Hirngewebe der Maus. Die Schrittweite in z betrug 1 μm. Maßstabsstäbe, 20 μm Zoll (A), 50 μm Zoll (B-C), 30 μm Zoll (D-E). Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 4: Repräsentative Ergebnisse der 7-farbigen Tandembildgebung von Hormonen und Transkriptionsfaktoren auf gefrorenem Mäuseinselgewebe. Epr-SRS: Insulin (nachgewiesen durch Cy5, β-Zell-Marker, grün), Pdx1 (nachgewiesen durch MARS2228, Transkriptionsfaktor, rot), Glucagon (nachgewiesen durch MARS2216, α-Zellmarker, gelb), PP (nachgewiesen durch MARS2147, PP-Zellmarker, blau). Fluoreszenz: Somatostatin (Alexa488, δ-Zellmarker, orange), Nkx2.2 (Cy3, Transkriptionsfaktor, Magenta), DAPI (Kern, dunkelblau). Maßstabsstab, 20 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
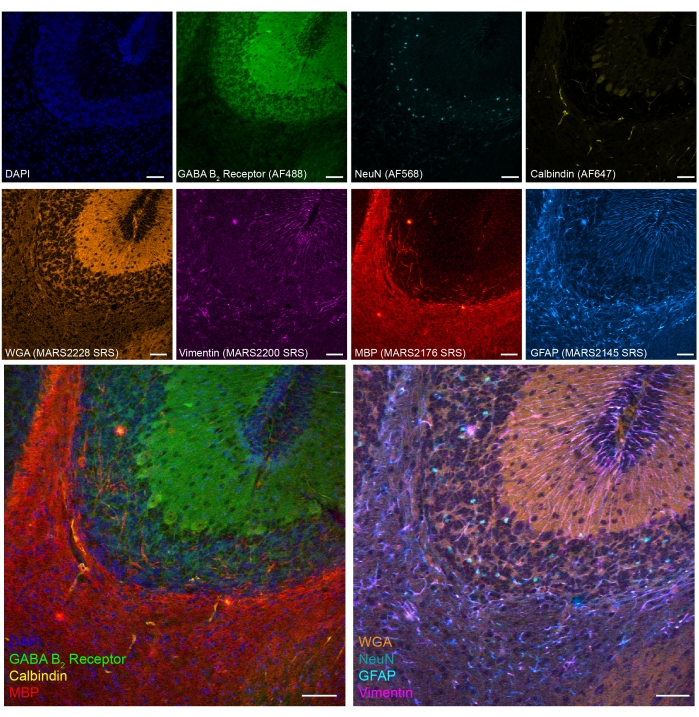
Abbildung 5: Repräsentative Ergebnisse der 8-Farben-Tandembildgebung von Zelltypmarkern auf PFA-fixiertem Hirnschnitt der Maus. Fluoreszenz: DNA (DAPI), GABA (γ-Aminobuttersäure) B-Rezeptor 2 (GABAerge Neuronen, Alexa Fluor 488), neuronale Kerne (NeuN; Neuronen, Alexa Fluor 568) und Calbindin (Purkinje-Neuronen, Alexa Fluor 647); epr-SRS: Weizenkeimagglutinin (WGA; MARS2228), Vimentin (MARS2200), Myelin Basic Protein (MBP; Oligodendrozyten, MARS2176) und GFAP (Astrozyten und neurale Stammzellen, MARS2145). Maßstabsstab, 50 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Tabelle 1: Validierte Antikörper für Immun-eprSRS. Weitere Informationen finden Sie in der Materialtabelle . Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Ergänzungsmaterial: Eigenschaften von 8 verwendeten NHS-Ester-funktionalisierten MARS-Sonden. λABS- und Anregungskoeffizienten von MARS-Farbstoffen wurden in DMSO-Lösung auf UV-Vis-Spektrometern mit einer 1-cm-Glasküvette als Behälter gemessen. Die absoluten Raman-Querschnitte von MARS-Farbstoffen wurden in DMSO bestimmt, indem das epr-SRS-Signal von MARS-Farbstoffen mit dem Standard-C−O-Dehnungsmodus (1030 cm-1) von Methanol verglichen wurde. Der absolute Raman-Querschnitt für den Standard-C−O-Dehnungsmodus (1030 cm-1) von Methanol wurde mit 2,1 x 10-30 cm2 bei 785 nm angegeben. Ein Querschnitt von 0,9 x 10-30 cm2 wurde unter 860 nm Pumpwellenlänge durch Extrapolation geschätzt. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Diskussion
Hier stellen wir das Immuno-eprSRS-Protokoll vor, das allgemein auf gängige Gewebetypen anwendbar ist, einschließlich frisch konservierter Mausgewebe, menschlicher FFPE-Gewebe und gefrorener Mausgewebe. Immuno-eprSRS wurde für ein Panel von Epitopen in Zellen und Geweben validiert, wie in Tabelle 1 aufgeführt. Diese One-Shot-Plattform eignet sich besonders für Anwendungen, bei denen zyklische Strategien nicht gut funktionieren. Zum Beispiel ist die zyklische Fluoreszenz für dickes Gewebe anspruchsvoll, da mehrere Runden der 3D-Immunmarkierung unpraktisch langwierig sind17. Es ist auch sehr wahrscheinlich, dass Registrierungsfehler aufgrund nichtlinearer histologischer 3D-Änderungenauftreten 11,17. Immuno-eprSRS überwindet in einem solchen Szenario praktische Barrieren der zyklischen Fluoreszenz und bietet die Möglichkeit, Proteininteraktionsnetzwerke über ein großes Volumen17 aufzudecken.
Die derzeitige Multiplexität wird hauptsächlich durch die Verfügbarkeit sekundärer Antikörper eingeschränkt. Während wir uns in diesem Protokoll auf die indirekte Immunmarkierung konzentrierten, bei der MARS-Sonden mit sekundären Antikörpern konjugiert werden, sind direkte Immunmarkierung und Lektinfärbungmachbar 17. Nach einer weiteren primären Antikörpervalidierung mit Raman-Farbstoffen werden 20 Kanäle mit den derzeit entwickelten Raman-Farbstoffen13,18,24 erwartet. Darüber hinaus könnte die Bildgebung von sehr niedrig frequentierten Zielen für epr-SRS aufgrund ihrer leicht beeinträchtigten Empfindlichkeit im Vergleich zum konfokalen Fluoreszenzsystem eine Herausforderung darstellen. In diesem Zusammenhang empfehlen wir, relativ niedrig vorkommende Targets helleren MARS-Farbstoffen und Low-Expression-Targets Fluoreszenzkanälen zuzuordnen.
Ein kritischer Aspekt des Protokolls ist die Zugänglichkeit von Instrumenten und Sonden. In Bezug auf die Instrumentierung besteht ein SRS-Mikroskop im Allgemeinen aus einer zweifarbigen Laserquelle mit einem optischen Modulator, einem Mikroskop, einem Photodiodendetektor und einem Lock-in-Verstärker für die Demodulation25. Jede Komponente ist mit etwas höheren Gesamtkosten als ein Zwei-Photonen-Laser-Scanning-Fluoreszenzmikroskop im Handel erhältlich. Ein voll integriertes multimodales SRS/Fluoreszenz-Forschungsmikroskopwurde 26 mit einem ähnlichen Pikosekundenlaser wie hier für SRS-Anregungs- und Dauerstrich-Lasersets (CW) für die Fluoreszenz kommerzialisiert. Dieses System ist für die Multiplex-Schwingungsbildgebung in der biologischen Alltagsforschung leicht anwendbar. Was die Sonde betrifft, so wurden MARS-Sonden noch nicht kommerzialisiert und erfordern einige Synthesefähigkeiten. Alternativ können viele kommerzielle fernrote Fluorophore (siehe Extended Data Table 1 in L. Wei et al. Nature 2017 13) für epr-SRS verwendet werden. Dennoch könnte die Multiplexität gefährdet sein. Da MARS-Sonden von Natur aus kleine organische Moleküle sind, ähnelt Immun-eprSRS der Immunfluoreszenz in Bezug auf die Gewebefärbung. Daher kann das Archiv validierter Affinitätsreagenzien wie Antikörper in der Immunfluoreszenz leicht in Immuno-eprSRS-Anwendungen übertragen werden.
Offenlegungen
Die Autoren haben nichts offenzulegen.
Danksagungen
Wir danken Ruth A. Singer und Richard K.P. Benninger für die Bereitstellung von Bauchspeicheldrüsengewebe für die Maus. W.M. dankt der Unterstützung von NIH R01 (GM128214), R01 (GM132860), R01 (EB029523) und US Army (W911NF-19-1-0214).
Materialien
| Name | Company | Catalog Number | Comments |
| 16% Paraformaldehyde, EM Grade | Electron Microscopy Sciences | 15710 | |
| α-tubulin | Abcam | ab18251 | Primary antibodies |
| α-tubulin | BioLegend | 625902 | Primary antibodies |
| β-III-tubulin | BioLegend | 657402 | Primary antibodies |
| β-III-tubulin | Abcam | ab41489 | Primary antibodies |
| β-tubulin | Abcam | ab131205 | Primary antibodies |
| Agarose, low gellling temperature | Sigma Aldrich | A9414 | For brain embedding |
| Anti-a-tubulin antibody produced in rabbit (α-tubulin) | Abcam | ab52866 | Primary antibodies |
| Anti-Calbindin antibody produced in mouse (Calbindin) | Abcam | ab82812 | Primary antibodies |
| Anti-GABA B receptor R2 antibody produced in guinea pig (GABA B receptor R2) | Millipore Sigma | AB2255 | Primary antibodies |
| Anti-GFAP antibody produced in goat (GFAP) | Thermo Scientific | PA5-18598 | Primary antibodies |
| Anti-Glucagon antibody produced in mouse (Glucagon) | Santa Cruz Biotechnology | sc-514592 | Primary antibodies |
| Anti-insulin antibody produced in guinea pig (insulin) | DAKO | IR00261-2 | Primary antibodies |
| Anti-MBP antibody produced in rat (MBP) | Abcam | ab7349 | Primary antibodies |
| Anti-NeuN antibody produced in rabbit (NeuN) | Thermo Scientific | PA5-78639 | Primary antibodies |
| Anti-Pancreatic polypeptide (PP) antibody produced in goat- Pancreatic polypeptide (PP) | Sigma Aldrich | SAB2500747 | Primary antibodies |
| Anti-Pdx1 antibody produced in rabbit (Pdx1) | Milipore | 06-1379 | Primary antibodies |
| Anti-Somatostatin antibody produced in rat (Somatostatin) | Abcam | ab30788 | Primary antibodies |
| Anti-Vimentin antibody produced in chicken (Vimentin) | Abcam | ab24525 | Primary antibodies |
| Band-pass filter | KR Electronics | KR2724 | 8 MHz |
| BNC 50 Ohm Terminator | Mini Circuits | STRM-50 | |
| BNC cable | Thorlabs | 2249-C | Coaxial Cable, BNC Male / Male |
| Broadband dielectric mirror | Thorlabs | BB1-E03 | 750 - 1100 nm |
| C57BL/6J mice | Jackson Laboratory | 000664 | |
| Centrifuge | |||
| Condenser | Olympus | oil immersion, 1.4 N.A. | |
| Cytokeratin 18 | Abcam | ab7797 | Primary antibodies |
| Cytokeratin 18 | Abcam | ab24561 | Primary antibodies |
| DC power supply | TopWard | 6302D | Bias voltage is 64 V |
| Dichroic mount | Thorlabs | KM100CL | Kinematic Mount for up to 1.3" (33 mm) Tall Rectangular Optics, Left Handed |
| Donkey anti-Chicken IgY (H+L) | Jackson ImmunoResearch | 703-005-155 | Secondary antibodies for MARS conjugation |
| Donkey anti-Goat IgG (H+L) | Jackson ImmunoResearch | 705-005-147 | Secondary antibodies for MARS conjugation |
| Donkey anti-Guinea Pig IgG (H+L) | Jackson ImmunoResearch | 706-005-148 | Secondary antibodies for MARS conjugation |
| Donkey anti-Mouse IgG (H+L) | Jackson ImmunoResearch | 715-005-151 | Secondary antibodies for MARS conjugation |
| Donkey anti-Rabbit IgG (H+L) | Jackson ImmunoResearch | 711-005-152 | Secondary antibodies for MARS conjugation |
| Donkey anti-Rat IgG (H+L) | Jackson ImmunoResearch | 712-005-153 | Secondary antibodies for MARS conjugation |
| Donkey anti-Sheep IgG (H+L) | Jackson ImmunoResearch | 713-005-147 | Secondary antibodies for MARS conjugation |
| DPBS | Fisher Scientific | 14-190-250 | |
| EpCAM | Abcam | ab71916 | Primary antibodies |
| Ethanol | Sigma Aldrich | 443611 | |
| Fast-speed look-in amplifier | Zurich Instruments | HF2LI | DC - 50 MHz |
| FFPE Kidney Sample | USBiomax | HuFPT072 | |
| Fibrillarin | Abcam | ab5821 | Primary antibodies |
| Giantin | Abcam | ab24586 | Primary antibodies |
| Glucagon | Santa Cruz Biotechnology | sc-514592 | Primary antibodies |
| H2B | Abcam | ab1790 | Primary antibodies |
| HeLa | ATCC | ATCC CCL-2 | |
| High O.D. bandpass filter | Chroma Technology | ET890/220m | Filter the Stokes beam and transmit the pump beam |
| Hydrophobic pen | Fisher Scientific | NC1384846 | |
| Insulin | ThermoFisher | 701265 | Primary antibodies |
| Integrated SRS laser system | Applied Physics & Electronics, Inc. | picoEMERALD | picoEMERALD provides an output pulse train at 1,064 nm with 6-ps pulse width and 80-MHz repetition rate, which serves as the Stokes beam. The frequency doubled beam at 532 nm is used to synchronously seed a picosecond optical parametric oscillator (OPO) to produce a mode-locked pulse train with five~6 ps pulse width (the idler beam of the OPO is blocked with an interferometric filter). The output wavelength of the OPO is tunable from 720–950 nm, which serves as the pump beam. The intensity of the 1,064-nm Stokes beam is modulated sinusoidally by a built-in EOM at 8 MHz with a modulation depth of more than 90%. The pump beam is spatially overlapped with the Stokes beam by using a dichroic mirror inside picoEMERALD. The temporal overlap between pump and Stokes pulse trains is achieved with a built-in delay stage and optimized by the SRS signal of pure D2O at the microscope. |
| Inverted laser-scanning microscope | Olympus | FV1200MPE | |
| Kinematic mirror mount | Thorlabs | POLARIS-K1-2AH | 2 Low-Profile Hex Adjusters |
| Lectin from Triticum vulgaris (wheat) | Sigma Aldrich | L0636-5 mg | |
| Long-pass dichroic beam splitter | Semrock | Di02-R980-25x36 | 980 nm laser BrightLine single-edge laser-flat dichroic beamsplitter |
| MAP2 | BioLegend | 801810 | Primary antibodies |
| Microscopy imaging software | Olympus | FluoView | |
| NanoQuant Plate | Tecan | For absorbance-based, small volume analyses in a plate reader. | |
| Normal donkey serum | Jackson ImmunoResearch | 017-000-121 | |
| NucBlue Fixed Cell ReadyProbes Reagent (DAPI) | Thermo Scientific | R37606 | |
| Nunc 4-Well Dishes | Fisher Scientific | 12-566-300 | |
| Objective lens | Olympus | XLPlan N | x25, 1.05-NA, MP, working distance = 2 mm |
| Paint brush | |||
| Periscope assembly | Thorlabs | RS99 | includes the top and bottom units, Ø1" post, and clamping fork. |
| pH meter | |||
| Plate reader | Tecan | Infinite 200 PRO | An easy-to-use multimode plate reader. Absorbance measurement capabilities over a spectral range of 230–1000 nm. |
| ProLong Gold antifade reagent | Thermo Scientific | P36930 | |
| PSD95 | Invitrogen | 51-6900 | Primary antibodies |
| Sephadex G-25 Medium | GE Life Sciences | 17-0033-01 | gel filtration resin for desalting and buffer exchange |
| Shielded box with BNC connectors | Pomona Electronics | 2902 | Aluminum Box With Cover, BNC Female/Female |
| Si photodiode | Thorlabs | FDS1010 | 350–1100 nm, 10 mm x 10 mm Active Area |
| Synapsin 2 | ThermoFisher | OSS00073G | Primary antibodies |
| Tissue Path Superfrost Plus Gold Slides | Fisher Scientific | 22-035813 | Adhesive slide to attract and chemically bond fresh or formalin-fixed tissue sections firmly to the slide surface (tiisue bindling glass slides) |
| Triton X-100 | Fisher Scientific | BP151-500 | |
| Vibratome | Leica | VT1000 | |
| Vimentin | Abcam | ab8069 | Primary antibodies |
| Xylenes | Sigma Aldrich | 214736 |
Referenzen
- Goltsev, Y., et al. Deep profiling of mouse splenic architecture with CODEX multiplexed imaging. Cell. 174 (4), 968-981 (2018).
- Taube, J. M., et al. The Society for Immunotherapy of Cancer statement on best practices for multiplex immunohistochemistry (IHC) and immunofluorescence (IF) staining and validation. Journal for Immunotherapy of Cancer. 8 (1), 000155 (2020).
- Lewis, S. M., et al. Spatial omics and multiplexed imaging to explore cancer biology. Nature Methods. 18 (9), 997-1012 (2021).
- Bodenmiller, B. Multiplexed epitope-based tissue imaging for discovery and healthcare applications. Cell Systems. 2 (4), 225-238 (2016).
- Hickey, J. W., et al. Spatial mapping of protein composition and tissue organization: a primer for multiplexed antibody-based imaging. Nature Methods. , (2021).
- Lin, J. -. R., et al. Highly multiplexed immunofluorescence imaging of human tissues and tumors using t-CyCIF and conventional optical microscopes. eLife. 7, 31657 (2018).
- Black, S., et al. CODEX multiplexed tissue imaging with DNA-conjugated antibodies. Nature Protocols. 16 (8), 3802-3835 (2021).
- Giesen, C., et al. Highly multiplexed imaging of tumor tissues with subcellular resolution by mass cytometry. Nature Methods. 11 (4), 417-422 (2014).
- Keren, L., et al. MIBI-TOF: A multiplexed imaging platform relates cellular phenotypes and tissue structure. Science Advances. 5 (10), 5851 (2019).
- Gerdes, M. J., et al. Highly multiplexed single-cell analysis of formalin-fixed, paraffin-embedded cancer tissue. Proceedings of the National Academy of Sciences of the United States of America. 110 (29), 11982 (2013).
- Angelo, M., et al. Multiplexed ion beam imaging of human breast tumors. Nature Medicine. 20 (4), 436-442 (2014).
- Radtke, A. J., et al. IBEX: A versatile multiplex optical imaging approach for deep phenotyping and spatial analysis of cells in complex tissues. Proceedings of the National Academy of Sciences of the United States of America. 117 (52), 33455 (2020).
- Wei, L., et al. Super-multiplex vibrational imaging. Nature. 544, 465 (2017).
- Wei, L., Min, W. Electronic preresonance stimulated Raman scattering microscopy. The Journal of Physical Chemistry Letters. 9 (15), 4294-4301 (2018).
- Shi, L., et al. Electronic resonant stimulated Raman scattering micro-spectroscopy. The Journal of Physical Chemistry B. 122 (39), 9218-9224 (2018).
- Fujioka, H., et al. Multicolor activatable Raman probes for simultaneous detection of plural enzyme activities. Journal of the American Chemical Society. 142 (49), 20701-20707 (2020).
- Shi, L., et al. Highly-multiplexed volumetric mapping with Raman dye imaging and tissue clearing. Nature Biotechnology. , (2021).
- Miao, Y., Qian, N., Shi, L., Hu, F., Min, W. 9-Cyanopyronin probe palette for super-multiplexed vibrational imaging. Nature Communications. 12 (1), 4518 (2021).
- Miao, Y., Shi, L., Hu, F., Min, W. Probe design for super-multiplexed vibrational imaging. Physical Biology. 16 (4), 041003 (2019).
- Qian, N., Min, W. Super-multiplexed vibrational probes: Being colorful makes a difference. Current Opinion in Chemical Biology. 67, 102115 (2022).
- Klimas, A., et al. Nanoscale imaging of biomolecules using molecule anchorable gel-enabled nanoscale in-situ fluorescence microscopy. Nature Portfolio. , (2021).
- Shi, L., et al. Super-resolution vibrational imaging using expansion stimulated Raman scattering microscopy. bioRxiv. , (2021).
- Benninger, R. K. P., Hodson, D. J. New understanding of β-cell heterogeneity and in situ islet function. Diabetes. 67 (4), 537 (2018).
- Hu, F., et al. Supermultiplexed optical imaging and barcoding with engineered polyynes. Nature Methods. 15 (3), 194-200 (2018).
- Hu, F., Shi, L., Min, W. Biological imaging of chemical bonds by stimulated Raman scattering microscopy. Nature Methods. 16 (9), 830-842 (2019).
- . Coherent Raman Scattering Microscope Available from: https://www.leica-microsystems.com/products/confocal-microscopes/p/leica-tcs-sp8-cars/ (2022)
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten