Method Article
تصوير الأنسجة متعددة الإرسال للغاية باستخدام أصباغ رامان
In This Article
Summary
يعد التصوير الإلكتروني الذي يحفز بالأشعة قبل الرنين (epr-SRS) لأصباغ رامان الشبيهة بقوس قزح منصة جديدة لتصوير البروتين القائم على الظهارة متعددة الإرسال للغاية. هنا ، نقدم دليلا عمليا بما في ذلك إعداد الأجسام المضادة ، وتلطيخ عينات الأنسجة ، وتجميع مجهر SRS ، وتصوير أنسجة epr-SRS.
Abstract
يلعب تصور نطاق واسع من المؤشرات الحيوية المحددة في الأنسجة دورا حيويا في استكشاف المنظمات المعقدة للأنظمة البيولوجية المعقدة. وبالتالي ، فقد تم تقدير تقنيات التصوير متعددة الإرسال بشكل متزايد. هنا ، نصف منصة ناشئة للتصوير الاهتزازي متعدد الإرسال للغاية لبروتينات محددة ذات حساسية مماثلة للتألق المناعي القياسي عبر التصوير الإلكتروني قبل الرنين الذي يحفز رامان (epr-SRS) لأصباغ رامان الشبيهة بقوس قزح. تتحايل هذه الطريقة على حد القنوات القابلة للحل طيفيا في التألق المناعي التقليدي وتوفر نهجا بصريا من طلقة واحدة لاستجواب علامات متعددة في الأنسجة ذات الدقة دون الخلوية. وهو متوافق بشكل عام مع مستحضرات الأنسجة القياسية ، بما في ذلك الأنسجة الثابتة بارافورمالديهايد ، والأنسجة المجمدة ، والأنسجة البشرية المدمجة في البارافين الثابت بالفورمالين (FFPE). نتوقع أن توفر هذه المنصة صورة أكثر شمولا لتفاعلات البروتين للعينات البيولوجية ، خاصة بالنسبة للأنسجة السليمة السميكة. يوفر هذا البروتوكول سير العمل من إعداد الأجسام المضادة إلى تلطيخ عينات الأنسجة ، إلى تجميع مجهر SRS ، إلى تصوير أنسجة epr-SRS.
Introduction
تتكون أنظمة الأنسجة المعقدة من مجموعات فرعية خلوية متميزة تتشابك مواقعها المكانية وشبكات التفاعل بعمق مع وظائفها واختلالاتها 1,2. للكشف عن بنية الأنسجة واستجواب تعقيدها ، من الضروري معرفة المواقع المكانية للبروتينات بدقة خلية واحدة. وبالتالي ، فإن تقنيات تصوير البروتين متعددة الإرسال للغاية قد تم تقديرها بشكل متزايد ويمكن أن تصبح حجر الزاوية لدراسة بيولوجيا الأنسجة3،4،5. يمكن تصنيف طرق تصوير البروتين متعددة الإرسال الشائعة الحالية إلى فئتين رئيسيتين. أحدهما هو التصوير المناعي التسلسلي الذي يعتمد على جولات متعددة من تلطيخ الأنسجة والتصوير ، والآخر هو تصوير قياس الكتلة الخلوية إلى جانب الأجسام المضادة الموسومة بالمعادن الثقيلة6،7،8،9،10،11،12.
هنا ، يتم تقديم استراتيجية بديلة لتصوير البروتين القائم على الأجسام المضادة متعددة الإرسال. على عكس طريقة التصوير الفلوري السائدة ، والتي يمكنها فقط تصور 4-5 قنوات في وقت واحد بسبب أطياف الإثارة والانبعاثات الواسعة (العرض الكامل عند نصف الحد الأقصى (FWHM) ~ 500 cm-1) ، يعرض مجهر Raman عرض خط طيفي أضيق بكثير (FWHM ~ 10 cm-1) وبالتالي يوفر تعدد الإرسال القابل للتطوير. في الآونة الأخيرة ، من خلال تسخير الطيف الضيق ، تم تطوير مخطط جديد لمجهر رامان يسمى الفحص المجهري الإلكتروني قبل الرنين الذي يحفز رامان (epr-SRS) ، مما يوفر استراتيجية قوية للتصوير متعدد الإرسال13. من خلال فحص أوضاع الاهتزاز المقترنة إلكترونيا لأصباغ رامان ، يحقق epr-SRS تأثيرا تعزيزيا جذريا يبلغ 10 13 ضعفا على مقاطع رامان العرضية ويتغلب على عنق الزجاجة الحساس لمجهر رامان التقليدي (الشكل 1A)13،14،15. ونتيجة لذلك ، تم دفع حد الكشف عن epr-SRS إلى sub-μM ، مما يمكن رامان من اكتشاف العلامات الجزيئية المثيرة للاهتمام مثل البروتينات والعضيات المحددة داخل الخلايا13,16. على وجه الخصوص ، باستخدام الأجسام المضادة المترافقة مع صبغة رامان ، تم إثبات تصوير epr-SRS لبروتينات محددة في الخلايا والأنسجة (تسمى eprSRS المناعية) بحساسية مماثلة للتألق المناعي القياسي (الشكل 1B)13,17. من خلال ضبط الطول الموجي للمضخة بمقدار 2 نانومتر فقط ، ستكون إشارة epr-SRS متوقفة تماما (الشكل 1B) ، والتي تعرض تباينا اهتزازيا عاليا.
على جانب المسبار ، تم تطوير مجموعة من مجسات رامان الشبيهة بقوس قزح تسمى أصباغ تشتت مانهاتن رامان (MARS) لاقتران الأجسام المضادة13،18،19،20. تتكون لوحة رامان الفريدة هذه من أصباغ جديدة تحمل روابط ثلاثية مترافقة π (مادة تكميلية) ، يعرض كل منها ذروة epr-SRS واحدة وضيقة في نطاق رامان الطيفي المتعامد الحيوي (الشكل 1C). من خلال تعديل بنية الكروموفور الأساسي وتحرير ذرتي الرابطة الثلاثية (المادة التكميلية) بشكل نظائري، تم تطوير مجسات رامان المنفصلة طيفيا. من خلال الاستفادة من تعدد الإرسال القابل للتطوير ، يوفر الفحص المجهري epr-SRS إلى جانب لوحة صبغة MARS استراتيجية بصرية لتصوير البروتين متعدد الإرسال بلقطة واحدة في الخلايا والأنسجة.
يوفر Immuno-eprSRS استراتيجية بديلة لطرق تصوير البروتين متعدد الإرسال الحالية ذات نقاط القوة الفريدة. بالمقارنة مع نهج التألق مع التلطيخ الدوري والتصوير وإزالة الإشارات ، تضمن هذه المنصة القائمة على Raman تلطيخا وتصويرا أحادي الجولة. لذلك ، فإنه يتحايل على التعقيد العملي في الإجراءات الدورية ويبسط البروتوكول إلى حد كبير ، وبالتالي يفتح مناطق جديدة لتصوير البروتين متعدد الإرسالات. على سبيل المثال ، من خلال تسخير بروتوكول إزالة الأنسجة المصمم خصيصا لصبغة رامان ، تم توسيع نطاق المناعي eprSRS إلى ثلاثة أبعاد لرسم خرائط البروتين متعددة الإرسال للغاية في الأنسجة السليمة السميكة17. تم تصور أكثر من 10 أهداف بروتينية على طول أنسجة دماغ الفئران التي يبلغ سمكها ملليمترا17. في الآونة الأخيرة ، تم أيضا عرض اقتران المناعي eprSRS مع بروتوكول مجهر توسيع الاحتفاظ بالجزيئات الحيوية (ExM)المحسن 21 ، والتصوير النانوي بطلقة واحدة لأهداف متعددة22. بالمقارنة مع التحليل الطيفي الكتلي للتصوير 4,9 ، فإن epr-SRS غير مدمر ولديه قدرة تقسيم بصرية جوهرية. علاوة على ذلك ، فإن epr-SRS أكثر كفاءة في الوقت في مسح الأنسجة. عادة ، تستغرق منطقة الأنسجة التي تبلغ 0.25 مم2 بحجم بكسل 0.5 ميكرومتر بضع دقائق فقط للتصوير لقناة epr-SRS واحدة. على سبيل المثال ، يبلغ إجمالي وقت التصوير لأربع قنوات SRS بالإضافة إلى أربع قنوات فلورية في الشكل 4 حوالي 10 دقائق.
Protocol
تم إجراء البروتوكول وفقا لبروتوكول التجارب على الحيوانات (AC-AABD1552) الذي وافقت عليه اللجنة المؤسسية لرعاية الحيوانات واستخدامها في جامعة كولومبيا.
1. إعداد الأجسام المضادة المترافقة مع صبغة رامان
- قم بإعداد المخزن المؤقت للاقتران على أنه ~ 0.1 M NaHCO 3 في المخزن المؤقت PBS ، الرقم الهيدروجيني =8.3 ، وتخزينها عند 4 درجات مئوية.
- تحضير محلول مسبار MARS (المواد التكميلية) N-hydroxysuccinimidy (NHS) الذي يعمل بالاستر على شكل 3 ملليمتر في DMSO اللامائي. يمكن الرجوع إلى توليف تحقيقات MARS إلى التقارير السابقة 13،17،18.
ملاحظة: لأغراض التخزين ، يجب حماية محلول استر NHS للصبغة من الضوء والاحتفاظ به عند -20 درجة مئوية. - تذوب المواد الصلبة للأجسام المضادة في المخزن المؤقت للاقتران بتركيز 2 ملغم/مل. بالنسبة للأجسام المضادة التي تذوب في مخازن مؤقتة أخرى ، استبدلها في مخزن الاقتران بتركيز 1-2 ملغ / مل مع مرشحات الطرد المركزي.
ملاحظة: يفضل استخدام الأجسام المضادة الثانوية الممتزجة بشكل كبير للتلطيخ المتعدد لتقليل التفاعل عبر الأنواع. وترد الأجسام المضادة الثانوية المستخدمة في الجدول 1 وجدول المواد. - أداء تفاعل الاقتران.
- بالنسبة للأجسام المضادة الثانوية ، أضف 15 ضعفا من محلول الصبغة إلى محلول الأجسام المضادة في قارورة زجاجية ببطء مع التحريك. على سبيل المثال ، في محلول الأجسام المضادة 0.5 مل 2 مجم / مل ، أضف محلول صبغة 35 ميكرولتر 3 ملليمتر.
- احتضن خليط التفاعل في درجة حرارة الغرفة (RT) مع التحريك لمدة 1 ساعة. حماية التفاعل من الضوء.
- تنقيه.
- قم بإعداد ملاط راتنج ترشيح الجل (جدول المواد) في مخزن PBS المؤقت ، باتباع الخطوات 1.5.2-1.5.4.
- أضف 10 مل من مسحوق راتنج ترشيح الجل إلى 40 مل من المخزن المؤقت PBS داخل أنبوب 50 مل.
- احتفظ بالمحلول في حمام مائي 90 درجة مئوية لمدة 1 ساعة.
- قم بتزيين السوبرناتانت وأعد إضافة PBS إلى 40 مل. تخزين الطين في 4 درجة مئوية.
- قم بتعبئة عمود استبعاد الحجم (قطر 1 سم ، أعمدة تدفق الجاذبية) بمحلول الطين على ارتفاع 10-15 سم.
- شطف وغسل العمود مع ~ 10 مل من PBS المخزن المؤقت لمزيد من التعبئة الراتنج.
- ضع خليط تفاعل الاقتران (~ 0.5 مل) على العمود. أضف على الفور 1 مل من المخزن المؤقت PBS كمخزن مؤقت للإزالة عند تحميل كل خليط التفاعل. أعد ملء المخزن المؤقت (PBS) باستمرار إلى العمود.
- اجمع استقامة المحلول المقترن من خلال النظر إلى اللون الموجود على العمود (صبغات MARS لها ألوان خضراء إلى زرقاء فاتحة) أو قياس الامتصاص عند 280 نانومتر (A280).
- ركز المحلول الذي تم جمعه على 1-2 ملغم / مل باستخدام مرشح طرد مركزي.
- حدد تركيز ومتوسط درجة وضع العلامات (DOL ، نسبة الصبغة إلى البروتين) عن طريق قياس طيف الأشعة فوق البنفسجية المرئية (UV-Vis) للمحلول المقترن باستخدام قارئ لوحة نانو.
ملاحظة: توفر المواد التكميلية خصائص استرات NHS لصبغة MARS للحساب. DOL الطبيعي للجسم المضاد الثانوي حوالي 3.
2. إعداد عينة الأنسجة
- بارافورمالديهايد أنسجة دماغ الفئران الثابتة.
- تخدير الفئران (C57BL/6J ، أنثى ، 25 د بعد الولادة) مع الأيزوفلوران. تقييم التخدير المناسب مع اختبار قرصة إصبع القدم.
- قتل الفئران عن طريق إزاحة عنق الرحم. قم بدمج الفئران على الفور مع 4٪ من بارافورمالدهيد (PFA) في PBS عبر القلب.
- جمع دماغ الماوس، باتباع الخطوات 2.1.4-2.1.5
- قطع لأعلى من جذع الدماغ على طول خياطة السهمي. قشر نصفي الجمجمة بعيدا إلى الجانب وأخرج الدماغ باستخدام الملقط.
- إصلاح الدماغ الذي تم جمعه في 4٪ PFA في PBS عند 4 درجات مئوية لمدة 24 ساعة. ثم ، اغسل الدماغ في مخزن PBS المؤقت عند 4 درجات مئوية لمدة 24 ساعة لإزالة PFA الزائد.
- ضع الأغاروز الصلب في الماء بتركيز نهائي قدره 7٪ (w / v) في كوب ، مع غطاء فضفاض. حرك المحلول بقضيب تحريك زجاجي. سخني الملاط في الميكروويف حتى يصبح المحلول واضحا.
- اترك الأغاروز ليبرد إلى 45-55 درجة مئوية.
- صب الأغاروز السائل في غرفة صغيرة ، ثم انقل الدماغ من PBS إلى الأغاروز السائل ووجهه باستخدام ملعقة لتضمين الدماغ. انتظر حتى تصلب كتلة الأغاروز الأنسجة.
- قسم الأنسجة المزروعة إلى شرائح إكليلية بسماكة 40 ميكرومتر باستخدام اهتزاز.
- انقل الأنسجة إلى صفيحة من 4 آبار للتلطيخ التالي. إزالة الأغاروز مع الملقط. اغسل المنديل مع 1 مل من PBS ، ثلاث مرات.
- أنسجة البنكرياس الفئران المجمدة الثابتة.
- إصلاح البنكرياس الماوس في 4٪ PFA في PBS في 4 درجة مئوية مع هزاز لمدة 16-20 ساعة.
- اغسل العينة في 1 مل من PBS (4 درجات مئوية) ثلاث مرات لإزالة PFA.
- قم بتضمين العينة (~ 0.3-0.5 سم في الحجم) في كتل مركبة ذات درجة حرارة القطع المثلى (OCT). ضع 2 قطرة من OCT في قالب تبريد بلاستيكي. ضع الأنسجة في الاتجاه الصحيح واسكب OCT فوق الأنسجة حتى لا يبقى أي من الأنسجة مكشوفا.
- قسم البنكرياس إلى شرائح بسماكة 8 ميكرومتر وقم بشل حركتها على شريحة زجاجية ملزمة للأنسجة ، وتخزينها في -80 درجة مئوية.
- قبل التلطيخ ، قم بموازنة العينة إلى RT. اغسل الأنسجة باستخدام PBS لإزالة كتل OCT.
- عينات FFPE.
- اخبز شريحة أنسجة FFPE على حرارة 60 درجة مئوية لمدة 10 دقائق.
- إزالة البارافين والإماهة: ضع العينات بالتتابع في المحاليل التالية في أنبوب سعة 50 مل في RT لمدة 3 دقائق في كل مرة مع اهتزاز خفيف:
الزيلين مرتين ،
الإيثانول مرتين ،
95 ٪ (المجلد / المجلد) الإيثانول في الماء منزوع الأيونات مرتين ،
70 ٪ (المجلد / المجلد) الإيثانول في الماء منزوع الأيونات مرتين ،
50 ٪ (المجلد / المجلد) الإيثانول في المياه منزوعة الأيونات مرة واحدة ،
الماء منزوع الأيونات مرة واحدة. - انقل العينة إلى سترات الصوديوم 20 mM (الرقم الهيدروجيني 8.0) عند 100 درجة مئوية في وعاء زجاجي. تأكد من غمر الأنسجة في المحلول.
- ضع الجرة في حمام مائي 60 درجة مئوية لمدة 45 دقيقة.
- اغسل العينة بالماء منزوع الأيونات في RT لمدة 5 دقائق.
3. الأنسجة المناعية eprSRS تلطيخ
- استخدم قلما مسعورا لرسم حدود حول أقسام الأنسجة على الشريحة.
ملاحظة: يتم استخدام جرة تلطيخ الشرائح لاتباع خطوات حضانة الأنسجة على الشريحة. الأنسجة العائمة (أقسام دماغ الفأر بسماكة 40 ميكرومتر) ملطخة بألواح الآبار. - احتضان الأنسجة مع 0.3-0.5٪ PBST (تريتون X-100 في PBS) لمدة 10 دقائق.
- احتضن الأنسجة باستخدام المخزن المؤقت المانع (مصل الحمير بنسبة 5٪ ، و 0.5٪ Triton X-100 في PBS) لمدة 30 دقيقة.
- تحضير محلول التلطيخ الأساسي: أضف جميع الأجسام المضادة الأولية إلى 200-500 ميكرولتر من المخزن المؤقت للتلطيخ (2٪ مصل الحمير ، 0.5٪ Triton X-100 في PBS) بالتركيزات المطلوبة. جهاز الطرد المركزي محلول التلطيخ الأساسي عند 13000 × g لمدة 5 دقائق. استخدم السوبرناتانت فقط إذا كان يعجل بالشكل.
- احتضان الأنسجة في محلول الأجسام المضادة الأولية عند 4 درجات مئوية لمدة 1-2 أيام.
ملاحظة: لتلطيخ أقسام الأنسجة على الشريحة، ضع العينة في صندوق تلطيخ مع مسح مبلل للحفاظ على الرطوبة. - اغسل الشرائح ثلاث مرات باستخدام 0.3-0.5٪ PBST في RT لمدة 5 دقائق لكل منها. استخدم 1 مل PBST للأنسجة العائمة. بالنسبة للأنسجة الموجودة على الشريحة ، اغسل الشرائح في جرة تلطيخ الشرائح وتأكد من غمر جميع الأنسجة في المحلول.
- احتضان الأنسجة في 200-500 ميكرولتر من المخزن المؤقت المانع لمدة 30 دقيقة.
- تحضير محلول التلطيخ الثانوي: أضف جميع الأجسام المضادة الثانوية (والليكتين إذا لزم الأمر) إلى 200-500 ميكرولتر من مخزن التلطيخ العازل مع التركيزات المطلوبة (عادة 10 ميكروغرام / مل). قم بالطرد المركزي لمحلول التلطيخ الثانوي عند 13000 × g لمدة 5 دقائق. استخدم السوبرناتانت فقط إذا كان يعجل بالشكل.
- احتضان الأنسجة في 200-500 ميكرولتر من محلول الأجسام المضادة الثانوي عند 4 درجات مئوية لمدة 1-2 أيام.
- اغسل الشرائح مرتين باستخدام 0.3-0.5٪ PBST في RT لمدة 5 دقائق لكل منهما.
- احتضان مع 200-500 ميكرولتر من محلول DAPI لمدة 30 دقيقة.
- اغسل الشرائح ثلاث مرات باستخدام PBS في RT لمدة 5 دقائق لكل منها.
- بالنسبة لأقسام الأنسجة العائمة ، انقلها إلى شرائح زجاجية باستخدام ماصة إسقاط الزجاج. انشر الأنسجة بفرشاة مناديل ورقية ونظف المناطق المحيطة بها بمناديل مبللة إذا لزم الأمر.
- قم بتركيب الأنسجة في قطرة من الكواشف المضادة للتلاشي باستخدام غطاء زجاجي وقم بتثبيته باستخدام طلاء الأظافر.
4. SRS المجهر التجمع
ملاحظة: يتم استخدام نظام التألق البؤري التجاري في التصوير الفلوري SRS جنبا إلى جنب. ويمكن الاطلاع على مزيد من الأوصاف في تقرير سابقرقم 17. سيركز هذا البروتوكول على جانب التصوير SRS باستخدام الإثارة ضيقة النطاق.
- قم بإعداد طاولة بصرية معزولة عن الاهتزاز في غرفة مع التحكم في درجة الحرارة.
- ضع نظام ليزر مزدوج متزامن (مضخة وستوكس) على الطاولة البصرية (الشكل 2A) مع مبرد متصل.
ملاحظة: يوفر الليزر الأساسي في نظام الليزر المزدوج قطار نبض خرج عند 1064 نانومتر مع عرض نبضة 6 ثوان ومعدل تكرار 80 ميجاهرتز. شعاع ستوكس هو من الليزر الأساسي. تم تعديل شدة شعاع ستوكس بالجيوب الأنفية بواسطة محول سعة كهروبصرية مدمج (EOM) عند 8 ميجاهرتز مع عمق تعديل يزيد عن 90٪. الجزء الآخر من الليزر الأساسي هو مضاعفة التردد إلى 532 نانومتر ، والذي يستخدم أيضا لزرع متزامن مذبذب بصري بارامتري بيكو ثانية (OPO) لإنتاج قطار نبض مغلق في الوضع بعرض نبضة 5-6 ps (يتم حظر شعاع الخمول من OPO بمرشح قياس التداخل). الطول الموجي الناتج من OPO قابل للضبط من 720-950 نانومتر ، والذي يعمل بمثابة شعاع المضخة. - قم بتركيب المرايا (نطاق الطول الموجي: 750-1100 نانومتر) ، ومقسمات الحزم ثنائية اللون (DBS ، مرشح 980 نانومتر طويل التمرير ، مستطيل) ، والعدسة (طلاء لوني ، AR ل 650-1050 نانومتر) على حواملها الخاصة. استخدم حوامل مرآة حركية مستقرة للغاية للمرايا ومقسمات الشعاع ثنائي الكروم.
- قياس ارتفاع خرج الليزر وأحجام الحزم للمضخة وحزم ستوكس. اضبط ارتفاع المرايا والعدسات لضمان وصول الضوء إلى مركز جميع العناصر البصرية.
- ضع المرآة M1 على الطاولة البصرية واجعلها ~ 45 درجة إلى إخراج الليزر (الشكل 2B). استخدم المقابض الموجودة على الحامل الحركي لإجراء تعديلات على الطرف والإمالة. تأكد من أن الضوء ينتقل على نفس الارتفاع على طول الطاولة وخط مستقيم فيما يتعلق بالطاولة.
- ضع ومحاذاة مقسمات الحزم ثنائية اللون (مرشحات التمرير الطويل 980 نانومتر) والمرايا لتقسيم المضخة وعوارض ستوكس (الشكل 2A-B).
- ضع وأحاذي أزواج العدسات (L1 و L2 و L3 و L4) على كل مسار من مسارات الحزم لتجميع الحزم وتوسيع أقطار الحزمة لتتناسب مع البؤبؤ الخلفي للهدف (الشكل 2A-B).
- استخدم مرايا M7 و M8 لمحاذاة أشعة الليزر المدمجة في المجهر (الشكل 2C). قم بمحاذاة شعاع واحد في المجهر أولا واستخدم أزواج المرآة على الشعاع الآخر لضمان التداخل المكاني للحزمتين.
- قم بإعداد جزء الكشف.
- ضع مكثف زيت مغلف بالأشعة تحت الحمراء (1.4-NA) لجمع المضخة الأمامية وعوارض ستوكس بعد المرور عبر العينات (الشكل 2C).
- قم بتركيب صمام ثنائي ضوئي Si كبير المساحة على صندوق محمي بموصلات BNC (الشكل 2E). أضف مصدر طاقة DC بجهد 64 فولت إلى الصمام الثنائي الضوئي المثبت لزيادة عتبة التشبع وعرض النطاق الترددي للاستجابة.
- عكس الضوء الأمامي مع مرآة مقاس 2 بوصة. أعد تركيز الضوء على الصمام الثنائي الضوئي بعد مرشح بصري لمنع شعاع ستوكس المعدل (الشكل 2D).
- أرسل تيار الإخراج الخاص بالصمام الثنائي الضوئي إلى مضخم صوت قفل سريع تم إنهاؤه ب 50 لإلغاء الإشارة. أرسل مشغل 8 ميجاهرتز إلى مضخم القفل كإشارة مرجعية.
- أرسل المكون X في المرحلة من مضخم القفل إلى مربع الواجهة التناظرية للمجهر.
- قم بتحسين التداخل الزمني مع مرحلة التأخير الآلية المدمجة عن طريق قياس إشارة SRS لسائل D2O النقي في المجهر.
5. الحصول على الصور وتحليلها
- قم بإجراء تصوير epr-SRS متعدد القنوات باستخدام ضبط الطول الموجي المتسلسل للمضخة.
- اضبط طاقة الليزر على مضخة P = 10-40 ميجاوات و PStokes = 40-80 ميجاوات على لوحة التحكم بالليزر.
- اضبط وقت سكن البكسل على 2-4 ميكروثانية واستخدم إطارات متعددة يبلغ متوسطها عادة 10-20 إطارا على برنامج الفحص المجهري.
ملاحظة: تجنب الاستخدام التوافقي لطاقة الليزر العالية (مضخة P > 40 ميجاوات ، PStokes > 80 ميجاوات) وحجم البكسل الصغير (<0.2 ميكرومتر) ، والتي من المحتمل أن تسبب "تأثير التبييض" لأصباغ رامان بسبب الإثارة متعددة الفوتونات. - اضبط ثوابت الوقت الخاصة بمضخم القفل على نصف وقت سكن البكسل.
- فك الخلط الطيفي الخطي.
ملاحظة: يتبع epr-SRS اعتمادا خطيا صارما على الإشارة إلى التركيز على نطاق التركيز بأكمله؛ وبالتالي ، فإن فك الخلط الطيفي الخطي فعال لإزالة أي محادثات متقاطعة محتملة بين القنوات. بالنسبة لقياس قناة N epr-SRS باستخدام مجسات N MARS ، يمكن التعبير عن الإشارات المقاسة (S) على أنها S = MC ، حيث C هي تركيزات مسبار MARS ، و M عبارة عن مصفوفة N x N تحددها مقاطع رامان العرضية لمجسات MARS.- قم بقياس المصفوفة M على عينات eprSRS المناعية أحادية اللون الموسومة بمجسات MARS مختلفة.
- استخدم المعادلة C = M−1· S لتحديد مصفوفة تركيز مسبار MARS باستخدام قياس إشارة العينة المتعددة S.
النتائج
ويبين الشكل 3 أمثلة على صور ل epr-SRS في عينات مختلفة، بما في ذلك الخلايا الثابتة (الشكل 3A)، وأنسجة الفئران الثابتة بارافورمالديهايد (PFA) (الشكل 3B)، والعينات البشرية المدمجة في البارافين الثابت بالفورمالين (FFPE) (الشكل 3C). الدقة المكانية للمجهر SRS محدودة الحيود ، والدقة الجانبية النموذجية هي ~ 300 نانومتر ، والدقة المحورية هي 1-2 ميكرومتر باستخدام ضوء الأشعة تحت الحمراء القريبة للإثارة. ونتيجة لذلك ، تم الكشف عن الهياكل تحت الخلوية الدقيقة مثل الأنابيب الدقيقة في خلايا HeLa بأمانة من خلال تصوير eprSRS المناعي α توبولين (الشكل 3A). علاوة على ذلك ، يتوافق epr-SRS بشكل عام مع أنسجة FFPE (الشكل 3C) ، وهو شكل شائع من عينات الخزعة للتشخيص السريري وأبحاث علم الأمراض. على غرار المجهر الفلوري ثنائي الفوتون ، كعملية غير خطية ، يتمتع epr-SRS بقدرة التقسيم البصري لتصور الأنماط ثلاثية الأبعاد بدقة دون الخلية (الشكل 3D-E).
لقد عرضنا أولا فائدة تصوير البروتين متعدد الإرسال ل epr-SRS على عينات الأنسجة المجمدة الثابتة من جزر الفئران في Langerhans في البنكرياس. يتم اختيار العديد من الأهداف المهتمة ، بما في ذلك التعبير الهرموني (على سبيل المثال ، الأنسولين ، ناهض الجلوكوز (الجلوكاجون) ، بولي ببتيد البنكرياس (PP) ، والسوماتوستاتين) لتصنيف نوع الخلية (الخلايا β والخلايا غير β (الخلايا α ، الخلايا δ)) وعوامل النسخ المعروفة بأنها مرتبطة بعدم تجانس الخلايا β23. تجدر الإشارة إلى أنه نظرا لأن الكشف عن التألق متعامد مع اكتشاف SRS ، فإن epr-SRS متوافق تماما مع التألق البؤري والتألق ثنائي الفوتون. وكدليل على المفهوم، تم بسهولة تحقيق التصوير الترادف الفلوري SRS المكون من 7 ألوان على جزيرة واحدة (الشكل 4) مع تباين جيد وأنماط صحيحة. تم تصوير الأهداف منخفضة التعبير مثل عامل النسخ Pdx1 بتباين كاف.
أظهرنا أيضا تصويرا ترادفيا من ثمانية ألوان SRS - التألق في أنسجة مخيخ الفئران الثابتة PFA (الشكل 5). من خلال المؤشرات الحيوية الراسخة ، يمكن تحديد أنواع مختلفة من الخلايا ، مثل الخلايا العصبية الحبيبية المخيخية (NeuN) ، والخلايا العصبية Purkinje (Calbindin) ، والخلايا النجمية (GFAP) ، والخلايا العصبية قليلة التغصن (MBP) ، والخلايا العصبية GABAergic (مستقبلات GABA B2 ).

الشكل 1: الفحص المجهري Epr-SRS لتصوير البروتين متعدد الإرسال للغاية. (A) مخطط الطاقة ل Raman التلقائي ، SRS غير الرنين ، و SRS الإلكتروني قبل الرنين (epr-SRS). سيتم تعزيز معدل الانتقال الاهتزازي للكروموفورات في epr-SRS بنسبة تصل إلى 1013 ضعفا. (ب) تم إثبات التصوير المناعي القائم على الظهارة α توبولين في خلايا COS-7 الملطخة ب ATTO740 مع تباين اهتزازي عال بواسطة epr-SRS. تختفي إشارة epr-SRS تماما عندما يكون الطول الموجي لليزر المضخة خارج الرنين بمقدار 2 نانومتر فقط (يمين). قضبان المقياس ، 20 ميكرومتر (C) أطياف Epr-SRS من مجسات MARS المترافقة مع استر NHS كما هو مدرج في المواد التكميلية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
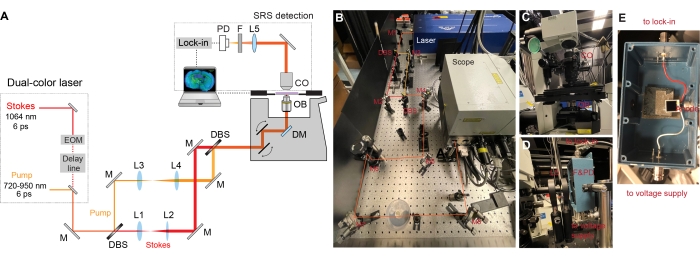
الشكل 2: تصميم إعداد مجهر SRS . (أ) مخطط تخطيطي لإعداد SRS. EOM = المغير الكهروبصري البصري ، M = المرآة ، L = العدسة ، DBS = مقسم الشعاع ثنائي اللون ، DM = المرآة ثنائية اللون ، OB = العدسة الموضوعية ، CO = المكثف ، F = المرشح ، PD = الصمام الثنائي الضوئي. (ب) تظهر هذه اللوحة جزء الإثارة بالليزر. يتم فصل الشعاع ثنائي اللون من إخراج الليزر أولا مع تجميع كل شعاع وتوسيعه ثم دمجه لاحقا وتوجيهه إلى جسم المجهر. (ج) تعرض هذه اللوحة المجموعة المرسلة بمكثف. (د) تعرض هذه اللوحة جزء الكشف عن SRS. يتم تثبيت الصمام الثنائي الضوئي والمرشح على صندوق محمي مع اثنين من موصلات BNC الأنثوية. موصل BNC السفلي مخصص لجهد التحيز العكسي ، وموصل BNC الأعلى مخصص لإخراج الإشارة الحالي لقفل مكبر الصوت الذي تم إنهاؤه ب 50 Ω. (E) توضح هذه اللوحة كيفية تثبيت الصمام الثنائي الضوئي Si داخل الصندوق المحمي. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3: تصوير صبغة رامان لعلامات البروتين المميزة عن طريق وضع العلامات المناعية. (أ) تصوير المناعي ل α-توبولين في خلايا هيلا. (ب) التصوير المناعي ل NeuN في قشرة دماغ الفأر الثابتة PFA. (ج) التصوير المناعي ل evmentin في أنسجة FFPE الكلوية البشرية. (د) صورة بحجم الصوت ل MARS2145 GFAP ملطخة في أنسجة دماغ الفئران السميكة 100 ميكرومتر. كان حجم الخطوة في z 2 ميكرومتر (E) صورة مقدمة من MARS2228 NeuN ملطخة في أنسجة دماغ الفئران السميكة 40 ميكرومتر. كان حجم الخطوة في z 1 ميكرومتر. أشرطة القياس، 20 ميكرومتر في (A)، 50 ميكرومتر في (B-C)، 30 ميكرومتر في (D-E). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 4: النتائج التمثيلية للتصوير الترادف المكون من 7 ألوان للهرمونات وعوامل النسخ على أنسجة جزيرة الفئران المجمدة. Epr-SRS: الأنسولين (تم اكتشافه بواسطة Cy5 ، علامة خلية β ، أخضر) ، Pdx1 (تم اكتشافه بواسطة MARS2228 ، عامل النسخ ، أحمر) ، الجلوكاجون (تم اكتشافه بواسطة MARS2216 ، علامة خلية α ، أصفر) ، PP (تم اكتشافه بواسطة MARS2147 ، علامة خلية PP ، أزرق). التألق: سوماتوستاتين (Alexa488 ، علامة خلية δ ، برتقالي) ، Nkx2.2 (Cy3 ، عامل النسخ ، أرجواني) ، DAPI (نواة ، أزرق داكن). شريط المقياس ، 20 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
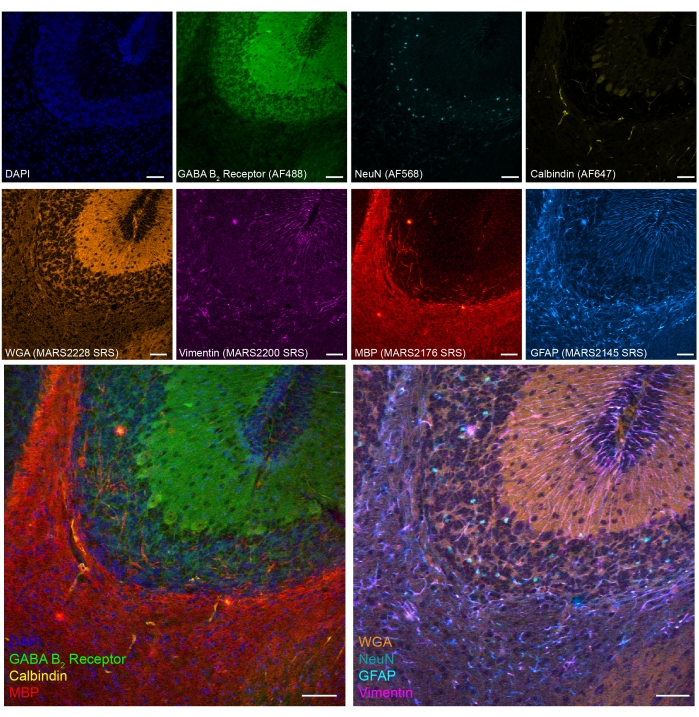
الشكل 5: النتائج التمثيلية للتصوير الترادف المكون من 8 ألوان لعلامات نوع الخلية على قسم دماغ الفأر الثابت PFA. التألق: الحمض النووي (DAPI) ، غابا (حمض γ-أمينوبوتيريك) B مستقبلات 2 (الخلايا العصبية GABAergic ، Alexa Fluor 488) ، النوى العصبية (NeuN ؛ الخلايا العصبية ، Alexa Fluor 568) و Calbindin (الخلايا العصبية Purkinje ، Alexa Fluor 647) ؛ epr-SRS: جرثومة القمح أغلوتينين (WGA; MARS2228) ، Vimentin (MARS2200) ، بروتين المايلين الأساسي (MBP ؛ oligodendrocytes ، MARS2176) و GFAP (الخلايا النجمية والخلايا الجذعية العصبية ، MARS2145). شريط المقياس ، 50 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
الجدول 1: الأجسام المضادة التي تم التحقق من صحتها ل eprSRS المناعية. ارجع إلى جدول المواد لمزيد من التفاصيل. يرجى النقر هنا لتنزيل هذا الجدول.
المواد التكميلية: خصائص 8 مجسات MARS مستخدمة تعمل بنظام NHS-ester. λ تم قياس معاملاتABS والإثارة لأصباغ MARS في محلول DMSO على مطياف UV-Vis باستخدام كوفيت زجاجي 1 سم كحاوية. تم تحديد مقاطع رامان العرضية المطلقة لأصباغ MARS في DMSO من خلال مقارنة إشارة epr-SRS لأصباغ MARS مع وضع التمدد C−O القياسي (1030 cm-1) من الميثانول. تم الإبلاغ عن المقطع العرضي المطلق لرامان لوضع التمدد C−O القياسي (1030 سم-1) من الميثانول على أنه 2.1 × 10-30 سم2 عند 785 نانومتر. وقدر المقطع العرضي ب 0.9 × 10-30 سم2 تحت الطول الموجي للمضخة 860 نانومتر عن طريق الاستقراء. يرجى النقر هنا لتنزيل هذا الملف.
Discussion
هنا ، نقدم بروتوكول eprSRS المناعي الذي ينطبق على نطاق واسع على أنواع الأنسجة الشائعة ، بما في ذلك أنسجة الفئران المحفوظة حديثا ، والأنسجة البشرية FFPE ، وأنسجة الفئران المجمدة. تم التحقق من صحة Immuno-eprSRS لمجموعة من الظواهر في الخلايا والأنسجة ، كما هو موضح في الجدول 1. هذه المنصة ذات اللقطة الواحدة مناسبة بشكل خاص للتطبيقات التي لا تعمل فيها الاستراتيجيات الدورية بشكل جيد. على سبيل المثال ، يتطلب التألق الدوري الأنسجة السميكة حيث أن جولات متعددة من وضع العلامات المناعية 3D غير عملية طويلة17. ومن المحتمل جدا أيضا أن تحدث أخطاء في التسجيل بسبب التغيرات النسيجية ثلاثية الأبعاد غير الخطية11,17. يتغلب Immuno-eprSRS على الحواجز العملية للتألق الدوري في مثل هذا السيناريو ويوفر فرصا للكشف عن شبكات تفاعل البروتين عبر حجم كبير17.
تعدد الإرسال الحالي مقيد بشكل رئيسي بتوافر الأجسام المضادة الثانوية. بينما في هذا البروتوكول ، ركزنا على وضع العلامات المناعية غير المباشرة ، حيث يتم اقتران تحقيقات MARS بالأجسام المضادة الثانوية ، ووضع العلامات المناعية المباشرة وتلطيخ اللكتين ممكنان17. بعد المزيد من التحقق من صحة الأجسام المضادة الأولية مع أصباغ رامان ، من المتوقع وجود 20 قناة مع أصباغ رامانالمطورة حاليا 13،18،24. علاوة على ذلك ، يمكن أن يكون تصوير الأهداف المنخفضة جدا الوفيرة تحديا ل epr-SRS بسبب حساسيته المعرضة للخطر قليلا مقارنة بنظام التألق البؤري. وفي هذا الصدد، نوصي بتعيين أهداف منخفضة الوفرة نسبيا لأصباغ MARS الأكثر سطوعا والأهداف منخفضة التعبير لقنوات التألق.
أحد الجوانب الحاسمة للبروتوكول هو إمكانية الوصول إلى الأدوات والتحقيقات. من ناحية الأجهزة ، يتكون مجهر SRS بشكل عام من مصدر ليزر ثنائي اللون مع مغير بصري ، ومجهر ، وكاشف صمام ثنائي ضوئي ، ومضخم صوت قفل للإزالة25. يتوفر كل مكون تجاريا بتكلفة إجمالية أعلى قليلا من المجهر الفلوري للمسح الضوئي بالليزر ثنائي الفوتون. تم تسويق مجهر بحثي متعدد الوسائط SRS / التألق متكامل تماما26 باستخدام ليزر بيكو ثانية مماثل كما هو الحال هنا لإثارة SRS ومجموعات ليزر الموجة المستمرة (CW) للتألق. هذا النظام قابل للتطبيق بسهولة للتصوير الاهتزازي متعدد الإرسال في الأبحاث البيولوجية اليومية. من ناحية التحقيق ، لم يتم تسويق تحقيقات MARS بعد وتتطلب بعض قدرات التوليف. بدلا من ذلك ، يمكن استخدام العديد من الفلوروفورات التجارية الحمراء البعيدة (راجع جدول البيانات الموسعة 1 في L. Wei et al. Nature 201713) ل epr-SRS. ومع ذلك ، قد يتم اختراق تعدد الإرسال. علاوة على ذلك ، نظرا لأن تحقيقات MARS بطبيعتها عبارة عن جزيئات عضوية صغيرة ، فإن eprSRS المناعي يشبه التألق المناعي من حيث تلطيخ الأنسجة. لذلك ، يمكن بسهولة نقل أرشيف كواشف التقارب التي تم التحقق منها مثل الأجسام المضادة في التألق المناعي إلى تطبيقات eprSRS المناعية.
Disclosures
ليس لدى المؤلفين ما يكشفون عنه.
Acknowledgements
نشكر روث أ. سينجر وريتشارد كيه بي بينينجر على تزويدهما بأنسجة البنكرياس الفأرية. يقر W.M. بالدعم المقدم من NIH R01 (GM128214) و R01 (GM132860) و R01 (EB029523) والجيش الأمريكي (W911NF-19-1-0214).
Materials
| Name | Company | Catalog Number | Comments |
| 16% Paraformaldehyde, EM Grade | Electron Microscopy Sciences | 15710 | |
| α-tubulin | Abcam | ab18251 | Primary antibodies |
| α-tubulin | BioLegend | 625902 | Primary antibodies |
| β-III-tubulin | BioLegend | 657402 | Primary antibodies |
| β-III-tubulin | Abcam | ab41489 | Primary antibodies |
| β-tubulin | Abcam | ab131205 | Primary antibodies |
| Agarose, low gellling temperature | Sigma Aldrich | A9414 | For brain embedding |
| Anti-a-tubulin antibody produced in rabbit (α-tubulin) | Abcam | ab52866 | Primary antibodies |
| Anti-Calbindin antibody produced in mouse (Calbindin) | Abcam | ab82812 | Primary antibodies |
| Anti-GABA B receptor R2 antibody produced in guinea pig (GABA B receptor R2) | Millipore Sigma | AB2255 | Primary antibodies |
| Anti-GFAP antibody produced in goat (GFAP) | Thermo Scientific | PA5-18598 | Primary antibodies |
| Anti-Glucagon antibody produced in mouse (Glucagon) | Santa Cruz Biotechnology | sc-514592 | Primary antibodies |
| Anti-insulin antibody produced in guinea pig (insulin) | DAKO | IR00261-2 | Primary antibodies |
| Anti-MBP antibody produced in rat (MBP) | Abcam | ab7349 | Primary antibodies |
| Anti-NeuN antibody produced in rabbit (NeuN) | Thermo Scientific | PA5-78639 | Primary antibodies |
| Anti-Pancreatic polypeptide (PP) antibody produced in goat- Pancreatic polypeptide (PP) | Sigma Aldrich | SAB2500747 | Primary antibodies |
| Anti-Pdx1 antibody produced in rabbit (Pdx1) | Milipore | 06-1379 | Primary antibodies |
| Anti-Somatostatin antibody produced in rat (Somatostatin) | Abcam | ab30788 | Primary antibodies |
| Anti-Vimentin antibody produced in chicken (Vimentin) | Abcam | ab24525 | Primary antibodies |
| Band-pass filter | KR Electronics | KR2724 | 8 MHz |
| BNC 50 Ohm Terminator | Mini Circuits | STRM-50 | |
| BNC cable | Thorlabs | 2249-C | Coaxial Cable, BNC Male / Male |
| Broadband dielectric mirror | Thorlabs | BB1-E03 | 750 - 1100 nm |
| C57BL/6J mice | Jackson Laboratory | 000664 | |
| Centrifuge | |||
| Condenser | Olympus | oil immersion, 1.4 N.A. | |
| Cytokeratin 18 | Abcam | ab7797 | Primary antibodies |
| Cytokeratin 18 | Abcam | ab24561 | Primary antibodies |
| DC power supply | TopWard | 6302D | Bias voltage is 64 V |
| Dichroic mount | Thorlabs | KM100CL | Kinematic Mount for up to 1.3" (33 mm) Tall Rectangular Optics, Left Handed |
| Donkey anti-Chicken IgY (H+L) | Jackson ImmunoResearch | 703-005-155 | Secondary antibodies for MARS conjugation |
| Donkey anti-Goat IgG (H+L) | Jackson ImmunoResearch | 705-005-147 | Secondary antibodies for MARS conjugation |
| Donkey anti-Guinea Pig IgG (H+L) | Jackson ImmunoResearch | 706-005-148 | Secondary antibodies for MARS conjugation |
| Donkey anti-Mouse IgG (H+L) | Jackson ImmunoResearch | 715-005-151 | Secondary antibodies for MARS conjugation |
| Donkey anti-Rabbit IgG (H+L) | Jackson ImmunoResearch | 711-005-152 | Secondary antibodies for MARS conjugation |
| Donkey anti-Rat IgG (H+L) | Jackson ImmunoResearch | 712-005-153 | Secondary antibodies for MARS conjugation |
| Donkey anti-Sheep IgG (H+L) | Jackson ImmunoResearch | 713-005-147 | Secondary antibodies for MARS conjugation |
| DPBS | Fisher Scientific | 14-190-250 | |
| EpCAM | Abcam | ab71916 | Primary antibodies |
| Ethanol | Sigma Aldrich | 443611 | |
| Fast-speed look-in amplifier | Zurich Instruments | HF2LI | DC - 50 MHz |
| FFPE Kidney Sample | USBiomax | HuFPT072 | |
| Fibrillarin | Abcam | ab5821 | Primary antibodies |
| Giantin | Abcam | ab24586 | Primary antibodies |
| Glucagon | Santa Cruz Biotechnology | sc-514592 | Primary antibodies |
| H2B | Abcam | ab1790 | Primary antibodies |
| HeLa | ATCC | ATCC CCL-2 | |
| High O.D. bandpass filter | Chroma Technology | ET890/220m | Filter the Stokes beam and transmit the pump beam |
| Hydrophobic pen | Fisher Scientific | NC1384846 | |
| Insulin | ThermoFisher | 701265 | Primary antibodies |
| Integrated SRS laser system | Applied Physics & Electronics, Inc. | picoEMERALD | picoEMERALD provides an output pulse train at 1,064 nm with 6-ps pulse width and 80-MHz repetition rate, which serves as the Stokes beam. The frequency doubled beam at 532 nm is used to synchronously seed a picosecond optical parametric oscillator (OPO) to produce a mode-locked pulse train with five~6 ps pulse width (the idler beam of the OPO is blocked with an interferometric filter). The output wavelength of the OPO is tunable from 720–950 nm, which serves as the pump beam. The intensity of the 1,064-nm Stokes beam is modulated sinusoidally by a built-in EOM at 8 MHz with a modulation depth of more than 90%. The pump beam is spatially overlapped with the Stokes beam by using a dichroic mirror inside picoEMERALD. The temporal overlap between pump and Stokes pulse trains is achieved with a built-in delay stage and optimized by the SRS signal of pure D2O at the microscope. |
| Inverted laser-scanning microscope | Olympus | FV1200MPE | |
| Kinematic mirror mount | Thorlabs | POLARIS-K1-2AH | 2 Low-Profile Hex Adjusters |
| Lectin from Triticum vulgaris (wheat) | Sigma Aldrich | L0636-5 mg | |
| Long-pass dichroic beam splitter | Semrock | Di02-R980-25x36 | 980 nm laser BrightLine single-edge laser-flat dichroic beamsplitter |
| MAP2 | BioLegend | 801810 | Primary antibodies |
| Microscopy imaging software | Olympus | FluoView | |
| NanoQuant Plate | Tecan | For absorbance-based, small volume analyses in a plate reader. | |
| Normal donkey serum | Jackson ImmunoResearch | 017-000-121 | |
| NucBlue Fixed Cell ReadyProbes Reagent (DAPI) | Thermo Scientific | R37606 | |
| Nunc 4-Well Dishes | Fisher Scientific | 12-566-300 | |
| Objective lens | Olympus | XLPlan N | x25, 1.05-NA, MP, working distance = 2 mm |
| Paint brush | |||
| Periscope assembly | Thorlabs | RS99 | includes the top and bottom units, Ø1" post, and clamping fork. |
| pH meter | |||
| Plate reader | Tecan | Infinite 200 PRO | An easy-to-use multimode plate reader. Absorbance measurement capabilities over a spectral range of 230–1000 nm. |
| ProLong Gold antifade reagent | Thermo Scientific | P36930 | |
| PSD95 | Invitrogen | 51-6900 | Primary antibodies |
| Sephadex G-25 Medium | GE Life Sciences | 17-0033-01 | gel filtration resin for desalting and buffer exchange |
| Shielded box with BNC connectors | Pomona Electronics | 2902 | Aluminum Box With Cover, BNC Female/Female |
| Si photodiode | Thorlabs | FDS1010 | 350–1100 nm, 10 mm x 10 mm Active Area |
| Synapsin 2 | ThermoFisher | OSS00073G | Primary antibodies |
| Tissue Path Superfrost Plus Gold Slides | Fisher Scientific | 22-035813 | Adhesive slide to attract and chemically bond fresh or formalin-fixed tissue sections firmly to the slide surface (tiisue bindling glass slides) |
| Triton X-100 | Fisher Scientific | BP151-500 | |
| Vibratome | Leica | VT1000 | |
| Vimentin | Abcam | ab8069 | Primary antibodies |
| Xylenes | Sigma Aldrich | 214736 |
References
- Goltsev, Y., et al. Deep profiling of mouse splenic architecture with CODEX multiplexed imaging. Cell. 174 (4), 968-981 (2018).
- Taube, J. M., et al. The Society for Immunotherapy of Cancer statement on best practices for multiplex immunohistochemistry (IHC) and immunofluorescence (IF) staining and validation. Journal for Immunotherapy of Cancer. 8 (1), 000155 (2020).
- Lewis, S. M., et al. Spatial omics and multiplexed imaging to explore cancer biology. Nature Methods. 18 (9), 997-1012 (2021).
- Bodenmiller, B. Multiplexed epitope-based tissue imaging for discovery and healthcare applications. Cell Systems. 2 (4), 225-238 (2016).
- Hickey, J. W., et al. Spatial mapping of protein composition and tissue organization: a primer for multiplexed antibody-based imaging. Nature Methods. , (2021).
- Lin, J. -. R., et al. Highly multiplexed immunofluorescence imaging of human tissues and tumors using t-CyCIF and conventional optical microscopes. eLife. 7, 31657 (2018).
- Black, S., et al. CODEX multiplexed tissue imaging with DNA-conjugated antibodies. Nature Protocols. 16 (8), 3802-3835 (2021).
- Giesen, C., et al. Highly multiplexed imaging of tumor tissues with subcellular resolution by mass cytometry. Nature Methods. 11 (4), 417-422 (2014).
- Keren, L., et al. MIBI-TOF: A multiplexed imaging platform relates cellular phenotypes and tissue structure. Science Advances. 5 (10), 5851 (2019).
- Gerdes, M. J., et al. Highly multiplexed single-cell analysis of formalin-fixed, paraffin-embedded cancer tissue. Proceedings of the National Academy of Sciences of the United States of America. 110 (29), 11982 (2013).
- Angelo, M., et al. Multiplexed ion beam imaging of human breast tumors. Nature Medicine. 20 (4), 436-442 (2014).
- Radtke, A. J., et al. IBEX: A versatile multiplex optical imaging approach for deep phenotyping and spatial analysis of cells in complex tissues. Proceedings of the National Academy of Sciences of the United States of America. 117 (52), 33455 (2020).
- Wei, L., et al. Super-multiplex vibrational imaging. Nature. 544, 465 (2017).
- Wei, L., Min, W. Electronic preresonance stimulated Raman scattering microscopy. The Journal of Physical Chemistry Letters. 9 (15), 4294-4301 (2018).
- Shi, L., et al. Electronic resonant stimulated Raman scattering micro-spectroscopy. The Journal of Physical Chemistry B. 122 (39), 9218-9224 (2018).
- Fujioka, H., et al. Multicolor activatable Raman probes for simultaneous detection of plural enzyme activities. Journal of the American Chemical Society. 142 (49), 20701-20707 (2020).
- Shi, L., et al. Highly-multiplexed volumetric mapping with Raman dye imaging and tissue clearing. Nature Biotechnology. , (2021).
- Miao, Y., Qian, N., Shi, L., Hu, F., Min, W. 9-Cyanopyronin probe palette for super-multiplexed vibrational imaging. Nature Communications. 12 (1), 4518 (2021).
- Miao, Y., Shi, L., Hu, F., Min, W. Probe design for super-multiplexed vibrational imaging. Physical Biology. 16 (4), 041003 (2019).
- Qian, N., Min, W. Super-multiplexed vibrational probes: Being colorful makes a difference. Current Opinion in Chemical Biology. 67, 102115 (2022).
- Klimas, A., et al. Nanoscale imaging of biomolecules using molecule anchorable gel-enabled nanoscale in-situ fluorescence microscopy. Nature Portfolio. , (2021).
- Shi, L., et al. Super-resolution vibrational imaging using expansion stimulated Raman scattering microscopy. bioRxiv. , (2021).
- Benninger, R. K. P., Hodson, D. J. New understanding of β-cell heterogeneity and in situ islet function. Diabetes. 67 (4), 537 (2018).
- Hu, F., et al. Supermultiplexed optical imaging and barcoding with engineered polyynes. Nature Methods. 15 (3), 194-200 (2018).
- Hu, F., Shi, L., Min, W. Biological imaging of chemical bonds by stimulated Raman scattering microscopy. Nature Methods. 16 (9), 830-842 (2019).
- . Coherent Raman Scattering Microscope Available from: https://www.leica-microsystems.com/products/confocal-microscopes/p/leica-tcs-sp8-cars/ (2022)
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved