Method Article
量化铁饥饿和厌氧生长后假 结核耶尔森 菌 III 型分泌系统活动
摘要
细菌定植于氧和铁生物利用度不同的宿主组织,但大多数研究细菌的方法都使用通气的丰富培养基。该方案描述了在不同铁浓度和氧分压下培养人类病原体 假结核耶尔森 菌,并量化 III 型 耶尔森菌 分泌系统的活性,这是一个重要的毒力因子。
摘要
许多革兰氏阴性病原体的一个关键毒力机制是 III 型分泌系统 (T3SS),这是一种针状附属物,可将细胞毒性或免疫调节效应蛋白转位到宿主细胞中。T3SS 是抗菌药物发现活动的靶标,因为它可以从细胞外进入,并且基本上不存在非致病性细菌。最近的研究表明, 耶尔森菌 和 沙门氏菌 的 T3SS 受对铁和氧有反应的因子的调节,这是哺乳动物感染过程中遇到的重要生态位特异性信号。这里描述的是假 结核耶尔森菌缺铁的方法,随后可选择补充无机铁。为了评估氧气可用性的影响,在好氧和厌氧条件下证明了这种铁饥饿过程。最后,在 37 °C 的哺乳动物宿主温度下孵育培养物可诱导 T3SS 表达,并通过可视化释放到上清液中的效应蛋白来定量耶 尔森氏 菌 T3SS 活性。在没有铁饥饿的情况下,此处详述的步骤比使用铁螯合剂具有优势,这不足以诱导强大的铁饥饿,这可能是由于有效的 耶尔森 铁吸收和清除系统。同样,酸洗实验室玻璃器皿也进行了详细说明,以确保去除残留的铁,这对于诱导严重的铁饥饿至关重要。此外,使用螯合剂可以去除培养基中的残余铁,并在缺铁的情况下培养细菌几代以消耗细菌中的铁储备。通过结合三氯乙酸诱导的蛋白质沉淀、SDS-PAGE 和银染的标准方案,该程序展示了测量 T3SS 活性的可行方法。虽然该程序针对 假结核耶尔马 菌进行了优化,但它为具有类似稳健铁摄取系统的病原体的研究提供了一个框架。在抗生素耐药性时代,这些方法可以扩展以评估在宿主相关条件下靶向 T3SS 的抗菌化合物的疗效。
引言
许多临床相关的革兰氏阴性病原体,如耶尔森氏菌、弧菌、埃希菌、假单胞菌和志贺氏菌,编码 III 型分泌系统 (T3SS),将效应蛋白注射到宿主细胞中 1。在许多细菌种类中,T3SS 受到严格的监管控制2。例如,耶尔森氏菌 T3SS 效应蛋白易位到靶宿主细胞中对于破坏宿主防御机制和实现宿主组织的细菌定植至关重要。然而,耶尔森菌 T3SS 活性代谢繁重,可触发宿主免疫受体的识别3。因此,感知特定环境线索的调节因子控制着许多细菌物种中 T3SS 基因的表达。由于耶尔森菌等病原体在其感染周期中会经历影响关键毒力因子表达的环境变化,因此开发模拟细菌病原体占据的宿主生态位显着特征的实验室条件非常重要。具体来说,氧张力和铁可用性在不同的组织部位以时空方式存在差异,并影响 T3SS 等毒力基因的表达 4,5,6。因此,该方法的目标是评估氧和铁如何影响耶尔森氏菌 T3SS 的表达。这将提供对宿主-病原体相互作用动力学的见解。
此处描述的方法详细说明了如何用需氧和厌氧培养假结核耶尔森菌,以及如何在好氧或厌氧生长过程中耗尽耶尔森菌铁储备。这里强调了在这些可变条件下成功培养细菌的一些重要考虑因素。首先,厌氧培养需要额外的葡萄糖补充,培养基配方中注明了这一修改。其次,由于假结核耶尔森菌采用铁载体和其他铁吸收系统,可以有效地从环境中清除铁,因此特别注意确保培养基和实验室玻璃器皿尽可能不含铁7。以前的研究使用铁螯合剂(如二吡啶基)来消耗富介质细菌培养物中的铁,以模拟铁饥饿 8,9。然而,耗尽耶尔森菌铁储存以诱发铁饥饿需要去除玻璃器皿和介质中的残余铁,并在没有铁的情况下延长生长时间。该协议详细说明了如何酸洗玻璃器皿和螯合介质以去除残留的铁,此外还培养细菌几代以确保彻底缺铁。可以通过测量不同条件下表征良好的铁反应基因的相对转录水平来确保铁饥饿,如此处用 yfeA 和 bfd 证明。
该方案的高潮展示了如何通过用三氯乙酸 (TCA) 处理培养上清液并通过 SDS-PAGE 可视化分泌的蛋白质,从这些条件中沉淀分泌的 T3SS 效应蛋白。最后,通过银染可视化分泌蛋白并定量 T3SS 效应蛋白(称为 耶尔森 氏菌外蛋白 (Yops)10)的相对水平,评估相对 T3SS 活性。
T3SS 活性测定通常利用特异性抗体来检测培养上清液中的 T3SS 效应蛋白水平。然而,针对 T3SS 效应蛋白的 western blotting 抗体通常无法在市场上买到。因此,已特别注意确保该方法中 T3SS 活性的最终可视化不需要特异性抗体,而是可以利用银染,从而允许所有分泌蛋白的可视化。虽然这种方法是专门为 假结核耶尔索尔曼菌量身定制和优化的,但它可以适应其他细菌种类,尽管确切的培养基条件和孵育时间会有所不同。
研究方案
试剂、培养基组成、引物序列和设备的详细信息列在 材料表中。 图 1 说明了整个实验工作流程。
1. 酸洗玻璃器皿和螯合 M9 培养基的制备
注意:在开始之前,请参阅材料部分,了解将使用的确切试剂和配方。M9 培养基在 Cheng 等人中首次用于耶 尔森氏菌 T3SS 测定11。
- 将 100 mL 6 N HCl 倒入 250 mL 玻璃瓶中。
注意:HCl 非常危险;确保在处理此物质时采取适当的预防措施。 - 用玻璃塞密封玻璃容器的口,小心地旋转培养瓶 1 分钟,以充分分布 HCl,偶尔改变方向。
- 适当处理 6 N HCl。
- 加入 100 mL 去离子 H2O,密封嘴巴,摇晃 20 秒,然后倒掉水,冲洗玻璃容器。
- 重复冲洗步骤,总共 3 次。
- 风干。高压灭菌器灭菌。
- 为了螯合培养基,将 M9 组分与螯合试剂混合,并在室温下用磁力搅拌棒搅拌 ~18 小时。过滤灭菌并添加 MgSO4 至终浓度为 1 mM。
2. 在不同铁水平和氧分压下培养假结核耶尔森菌
- 在溶原肉汤 (LB) 琼脂平板上划线 Y. 假结核 Y. 假结核 (本研究中使用菌株 IP2666pIB1) 并在室温下孵育。
注意:在 37 °C 下孵育耶尔森菌,特别是在低钙培养基中,导致 T3SS 活性、生长停滞,并最终选择编码 T3SS12 的 Yersinia vi规则 (pYV) 质粒的丢失。因此,该方案使用 26 °C 孵育耶尔森菌,直到需要测量 T3SS 活性。 - 48 小时后,一旦形成可见的菌落,接种 4 mL 含有 0.2% 葡萄糖、1 mg/L FeSO4.7H 2O 的 M9 培养基,并补充有来自单个分离菌落的酪蛋白氨基酸(此处称为 M9 培养基),并在 26 °C 下培养过夜,以 250 rpm 通气约 18 小时。
注意:从以下步骤开始,使用酸洗玻璃器皿,然后继续。 - 按照以下步骤在螯合的 M9 培养基中传代培养。
注:对于所有后续步骤,使用葡萄糖含量为 0.9% 的 M9 培养基,而不是标准的 0.2% 葡萄糖。- 使用分光光度计,测量过夜培养物的光密度 (OD600)。
- 在 250 mL 酸洗烧瓶中,将过夜培养物稀释至 OD600 值为 0.1,其中含有 0.9% 葡萄糖和无 FeSO 4.7H2O,无铁补充剂。
- 在 26 °C 下孵育 8 小时,并以 250 rpm 通气。
- 同时将传代培养物分为需氧和厌氧培养物。
- 测量生长培养物的 OD600 。
- 对于继续有氧孵育,在 250 mL 酸洗烧瓶中,在 14 mL 含有 0.9% 葡萄糖且不含 FeSO4.7H 2O 的无菌螯合 M9 培养基中,将生长的培养物传代培养至 OD600 值为 0.1,并在 26 °C 下曝气培养 12 小时,无铁补充。
- 对于厌氧培养,在 14 mL 无菌螯合 M9 培养基中传代培养至 OD600 值为 0.1,放入两个酸洗玻璃管中。在第一管中加入过滤灭菌(使用 0.22 μm 聚醚砜膜)FeSO4.7H 2O,终浓度为 1 mg/L(称为“高铁”)。在第二管中,加入 FeSO4.7H 2O,终浓度为 0.01 mg/L(称为“低铁”)。这可以通过使用 10 mg/mL FeSO4.7H 2O 储备液来完成。将两个管在室温下在厌氧室中厌氧孵育 12 小时。
注:1 mg/L FeSO4.7H 2O 为耶 尔森菌 的稳健生长提供了富含铁的条件。相反,仅向厌氧培养物中添加 0.01 mg/L FeSO4.7H 2O 可确保在厌氧条件下充分生长,但仍能实现铁饥饿反应,而需氧培养物在没有任何添加铁的情况下生长 12 小时以刺激 T3SS 活性之前刺激铁饥饿反应。
- 诱导 III 型分泌系统活动。
- 将厌氧培养物移至 37 °C 并继续厌氧孵育 4 小时以诱导 T3SS。
- 测量需氧生长培养物的 OD600 。
- 在两个酸洗培养瓶中,在 14 mL 无菌螯合 M9 培养基中将有氧生长的培养物传代培养至 OD600 值为 0.2。在第一个培养瓶中,加入过滤灭菌的 FeSO4.7H 2O,终浓度为 1 mg/L。在第二个培养瓶中,加入 FeSO 4.7H2O,终浓度为 0.01 mg/L。将两个培养瓶在 26 °C 下以 250 rpm 通气孵育 2 小时。
- 2 小时后,将需氧培养物移至 37 °C,以 250 rpm 通气并孵育 4 小时以诱导 T3SS。
3. T3SS 效应蛋白的三氯乙酸 (TCA) 沉淀
- 厌氧孵育完成后,测量培养物的 OD600 。
- 对所有厌氧样品进行标准化,以达到相等的细胞质量(参见 表 1 中提供的示例)。对于厌氧培养,通常预计缺铁培养物的 OD600 值为 ~0.5,而铁充足培养物的 OD 600 值为 ~1。在这种情况下,使用 6 mL 缺铁培养物和 3 mL 富含铁的培养物。
注:剩余的培养物可用于其他目的,例如收获总 RNA 和使用定量 PCR 测量靶 mRNA 的稳态水平(此处未描述)。 - 将每种培养物的标准化体积转移到 15 mL 试管中。
- 为了控制分泌蛋白沉淀的效率,向每个试管中加入 4 μL 0.5 mg/mL 牛血清白蛋白 (BSA)。
- 在 4 °C 下以 3200 x g 沉淀培养物 15 分钟。
- 将 0.22 μm PVDF 过滤器连接到 10 mL 注射器上,并将每种沉淀培养物的上清液过滤到新的 15 mL 试管中。
注:此过滤步骤可最大程度地减少转移整个细菌细胞的机会,这会导致样品中出现不需要的细胞质蛋白。 - 向每个样品中加入 10% 的 6.1 N TCA 上清液体积。
- 剧烈涡旋 1 分钟。将试管在 4 °C 的冷藏室中在冰上孵育过夜。
注意:孵化持续时间可根据需要进行优化。低至 1 小时的孵育可用于分泌旺盛的条件或菌株。 - 孵育 4 小时完成后,用好氧培养物重复沉淀收集和 TCA 沉淀步骤。
注:通过沉淀具有同等细胞质量的体积来标准化需氧培养物。 - 将每种样品的 2 mL 加入新的2 mL试管中,并在4 °C下以 21,000 x g 离心15 分钟。
- 使用真空附件吸出上清液,注意不要接触试管的底部或侧面。
注意:颗粒可能难以观察,并且可能沿着试管的长度表现为雾状。 - 重复步骤 3.10 和 3.11,直到每个沉淀反应物中的所有内容物沉淀到单个 2 mL 试管中。这可能需要 3 到 4 个连续的离心步骤,但可以将每个样品中所有分泌的蛋白质浓缩到 2 mL 试管中。
- 洗涤沉淀时,向每个试管中轻轻加入 1 mL 冰冷的 100% 丙酮。为避免样品损失,请勿重悬,也不要触摸试管的侧面。
- 将样品在 4 °C 下以 21,000 x g 离心 15 分钟。
- 吸出上清液,注意不要接触试管的底部或侧面。
- 重复冰冷的丙酮洗涤步骤 3.13 和 3.14。
- 最后一次吸出上清液后,打开试管,让沉淀在工作台上完全干燥约 1 小时。
- 向每个干燥的样品中加入 50 μL FSB:DTT 溶液。为避免蛋白质损失,请勿重悬。
- 将每个样品彻底涡旋 1 分钟,确保 FSB:DTT 溶液覆盖整个试管壁。这可以通过使用能够一次容纳多根试管的涡旋附件来优化。
- 将样品在 95 °C 下煮沸 15 分钟。
- 在室温下以最大速度将样品短暂离心 30 秒。
- 在 -80 °C 下储存以备将来使用。
4. SDS-PAGE 和银染以可视化 T3SS 效应蛋白
- 将 15 μL 每个厌氧样品和 10 μL 每个需氧样品加载到 12.5% SDS-PAGE 凝胶中,以及 3 μL 市售未染色标准品作为分子量标准品。
- 在 100 V 下运行凝胶约 90 分钟。这些设置可能因所使用的设备而异。
- 按照制造商的说明遵循银染方案,产生凝胶,如图 2 所示。
5. 量化相对 T3SS 活性
- 将凝胶放入成像系统中,确保所有用于定量的条带都在图像框中。
注:BSA 的分子量为 ~66 kDa,而 T3SS 效应蛋白 YopE 的分子量为 ~23 kDa。 - 在软件中,选择所有孔中的所有 YopE 条带 。
- 将参考 YopE 条带设置为适当的样品。
- 导出软件为所有 YopE 波段计算的相对定量值。
- 返回软件,选择所有孔中的所有 BSA 条带。
- 设置参比 BSA 谱带,以确保它与参比 YopE 谱带来自同一样品。
- 导出软件为所有 BSA 波段计算的相对定量值。
- 要计算相对 YopE 表达水平,请将每个样品的 YopE 相对数量值除以 BSA 相对数量值。
结果
该方法允许相对于感兴趣的参考条件在各种条件下对分泌的 Yops 进行相对比较。整个实验工作流程如图 1 所示。表 1 描述了在每种培养条件下细胞培养正常化通常如何进行,以及添加到每个上清液中的 TCA 体积。在这里,使用野生型 (WT) 假结核耶尔型 Y. ip2666pIB1 以及两个同源突变体 ΔyscNU 和 ΔyopE 显示了代表性结果。ΔyopE 突变体用作缺乏 YopE 的对照,而 ΔyscNU 突变体用作完整的 T3SS 阴性对照,因为它无法组装功能性 T3SS13,14。图 2 中描绘了含有分泌蛋白的银染 12.5% SDS-PAGE 凝胶的代表性图像。如上所述,每个样品都含有加标 BSA 作为蛋白质沉淀效率的对照。在分析数据时,厌氧和好氧数据集应被视为独立的数据集,因为每个数据集都是单独标准化的。在厌氧样品中,相对于高铁样品,低铁样品中的 YopE 多 ~38 倍,与之前的结果一致15,16。在好氧样品中,在低铁和高铁样品中观察到相似数量的分泌 YopE,与之前的结果一致16。通常,每种情况至少使用三个生物学重复来确定统计显著性。
为了确认该方案导致足够的铁饥饿,在所有条件下对野生型菌株中的铁反应基因 yfeA 和 bfd 进行了 qPCR 分析。YfeA 是负责铁转运的 ABC 转运系统的周质结合蛋白,而 Bfd 是一种细菌铁蛋白相关的铁氧还蛋白,参与铁储备的动员 17,18,19,20。如前所述21 分离 RNA,正如预期的那样,相对于缺铁条件,yfeA 和 bfd 在缺铁条件下显着上调,包括有氧和厌氧,如图 3 所示。此外,我们使用 qPCR 量化了 yopE mRNA 稳态水平,以确认在蛋白质水平上观察到的相对 YopE 结果与 yopE 转录水平一致(见图 3)。
最后,由于细菌在应激培养条件下容易裂解,因此重要的是要证明该方案中的步骤不会导致细菌裂解,这可能会混淆结果。为了证实这一点,对 TCA 沉淀的上清液样品进行蛋白质印迹,并探测 YopE 和 RpoA,RNA 聚合酶的亚基和细胞质蛋白。如图 4 所示,虽然 YopE 表达模式遵循 图 3 所示的表达模式,但没有证据表明样品上清液中存在 RpoA,这表明没有可观察到的裂解会将细胞质 RpoA 释放到上清液中。

图 1:在不同的铁和氧可用性下培养 假结核耶尔森 菌的实验工作流程。 培养步骤的图形表示。请注意,从第 4 天开始必须使用酸洗玻璃器皿。 请单击此处查看此图的较大版本。
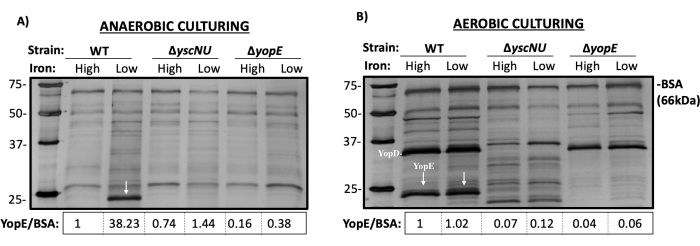
图 2:来自培养上清液的 TCA 沉淀蛋白的 12.5% SDS-PAGE 凝胶银染结果。 将沉淀的培养上清液上样到 12.5% SDS-PAGE 凝胶上并进行银染。(A) 厌氧生长的 WT、ΔyscNU 和 ΔyopE 菌株的分泌曲线。YopE 的代表性相对值归一化为厌氧 WT 充满铁的样品。(B) WT、ΔyscNU 和 ΔyopE 菌株的分泌曲线有氧生长。YopE 的代表性相对值归一化为需氧 WT 含铁样品。白色箭头表示 YopE (~23 kDa)。 请单击此处查看此图的较大版本。

图 3:铁反应基因的相对 mRNA 水平表明铁饥饿。从在图 1 中描述的条件下培养的 WT Y. 假结核中分离 RNA。qPCR 用于测量在厌氧 (A-C) 和需氧 (DF) 条件下归一化为 16S rRNA 的 yfeA、bfd 和 yopE 水平的相对表达。****p < 0.0001,由未配对的 t 检验确定。请单击此处查看此图的较大版本。
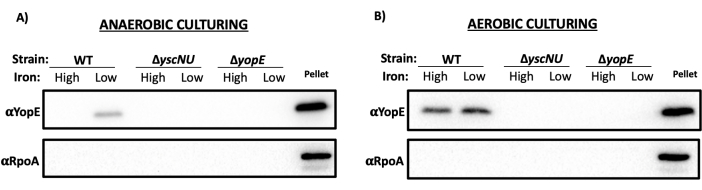
图 4:上清液样品中缺乏细胞质 RpoA,表明在培养条件下缺乏细胞裂解。将图 3 中 (A) 厌氧和 (B) 需氧样品的 5 μL 沉淀上清液与 12.5% SDS-PAGE 凝胶和沉淀对照一起运行。将蛋白质转印到 PVDF 膜上进行蛋白质印迹。切开膜,使用抗 RpoA 抗体探测上半部分的 RpoA,使用抗 YopE 抗体探测下半部分的 YopE。请单击此处查看此图的较大版本。
| (一) | |||
| 厌氧 | |||
| 条件 | 外径 | 收集体积 (mL) | 向 Sup 中添加的 6.1 N TCA 体积 (mL) |
| WT 低铁 | 0.5 | 6 | 0.6 |
| WT High Iron | 1 | 3 | 0.3 |
| (二) | |||
| 健美操 | |||
| 条件 | 外径 | 收集体积 (mL) | 向 Sup 中添加的 6.1N TCA 体积 (mL) |
| WT 低铁 | 0.9 | 6 | 0.6 |
| WT High Iron | 1.4 | 3.857 | 0.386 |
表 1:代表性样品采集工作流程。 在第 5 天,(A) 厌氧样品在 37 °C 下孵育 4 小时后,收集 6 mL 具有最低 OD600 值的样品,并相应地对其余样品体积进行归一化。过滤上清液后,加入 6.1 N TCA。(B) 需氧孵育(26°C 下 2 小时和 37°C 下 4 小时)完成后,收集 6 mL OD600 值最低的样品,其余样品体积相应归一化。过滤上清液后,加入 6.1 N TCA。
讨论
T3SS 是许多病原菌中的重要毒力因子;因此,开发实验室技术来研究其调节对于了解发病机制和开发潜在的治疗方法非常重要1。已知铁和氧是细菌病原体感知到的调节 T3SS 表达的重要宿主线索5;因此,该方法提出了一种在厌氧或需氧条件下培养 假结核耶尔 索尔病毒的策略,在缺铁或补铁的情况下,并展示了如何通过评估分泌的 YopE T3SS 效应蛋白水平的相对量来量化这些不同条件下的相对 T3SS 活性。
虽然此实验的工作流程相对简单,但要优化结果,必须仔细考虑几点。在 TCA 介导的蛋白质沉淀步骤中,避免吸出蛋白质沉淀非常重要,因为蛋白沉淀可能很难看到。采取额外的预防措施,不要让吸液器尖端接触管壁或管底,这一点至关重要。此外,当处理 T3SS 活性水平较低的突变菌株时,建议收集更大的样品进行处理。最后,如果在样品处理和凝胶染色后泳道出现拖尾,而不是产生明显的条带,这可能是由于培养过程中的细胞裂解或整个细菌从沉淀物中带入上清液组分。在这种情况下,应重复实验,并且在去除上清液时应更加小心避免吸收沉淀。需要注意的是,该方案可能不够灵敏,无法检测分泌量非常低的蛋白质,在这种情况下,可能需要采用其他检测方法。此外,由于许多螯合剂会从培养基中去除除铁和镁以外的二价阳离子,因此可以在螯合后将其他二价阳离子添加回培养基中,以确定它们对分泌的影响。
在这些实验中要考虑的另一个重要点是 M9 培养基中盐分的沉淀倾向,从而导致实验批次之间的差异。为了缓解这个问题,可以在培养前立即向培养基中添加过滤灭菌的 MgSO4 。
总体而言,这些方法为通过测量蛋白质水平来量化相对耶 尔森 T3SS 活性提供了一个强大的框架。除了旨在评估 T3SS 表达的平行方法外,这里介绍的方法可以全面了解 T3SS 动力学以响应宿主相关的环境线索。该方案也适用于可以在可以省略铁源的确定培养基中生长的其他细菌,以及测量分泌蛋白与科学问题相关的应用。
披露声明
作者声明没有竞争性的经济利益。
致谢
使用 BioRender.com 创建的图形图像。这项研究得到了美国国立卫生研究院 (www.NIH.gov) R01AI119082 资助的支持。
材料
| Name | Company | Catalog Number | Comments |
| 10 mL Luer-Lok Tip syringe | BD | 301029 | |
| 10x SDS Running Buffer | Home made | 0.25 M Tris base, 1.92 M Glycine, 1% SDS in 1 L volume | |
| 12.5% SDS-Page Gel | Home made | ||
| 15 mL culture tubes | Falcon | 352059 | For initial overnight |
| 15 mL Falcon tubes | Falcom | 352196 | For supernatant collection |
| 250 mL culture flask | Belco | 251000250 | |
| 500 mL Filter System | Corning | 431097 | |
| 6 N Hydrochloric acid solution | Fisher Scientific | 7732185 | |
| Acetone | Fisher Chemical | A949-4 | 4 L |
| Bio Rad ChemiDoc MP Imaging System | Bio Rad | Model Number: Universal Hood III | |
| Borosilicate glass culture tubes | Fisherbrand | 14-961-34 | For anaerobic culturing |
| Chelex 100 Resin | Bio Rad | 142-1253 | |
| Chelex M9 +0.9% Glucose media | Home made | 6 g/L Na2HPO4, 3 g/L KH2PO4, 0.5 g/L NaCl, 1 g/L NH4Cl, 1% casamino acids, 0.9% dextrose, 0.0005% thiamine, 5 g/L Chelex 100 Resin. Stir media for 18 h at room temp, filter using 500 mL Corning filtration unit, then add MgSO4 for 1 mM MgSO4 final solution | |
| Final Sample Buffer (FSB) | Home made | 0.1 M Tris-HCl, 4% SDS, 20% glycerol, 0.2% of Bromophenol Blue | |
| FSB:DTT solution | Home made | FSB+0.2M DTT | |
| Image Lab Software | Bio Rad | https://www.bio-rad.com/en-us/product/image-lab-software?ID=KRE6P5E8Z | Software |
| Isotemp Heat Block | Fisher Scientific | 88860021 | |
| LB Agar Plates | Home made | 10 g Tryptone, 5 g Yeast extract, 10 g NaCl, 15 g Agar in 1 L total volume. Autoclaved | |
| M9+0.2% Glucose Media | Home made | 6 g/L Na2HPO4, 3 g/L KH2PO4, 0.5 g/L NaCl, 1 g/L NH4Cl, 1 mM MgSO4, 1 mg/L FeSO47H2O, 1% casamino acids, 0.2% dextrose, 0.0005% thiamine | |
| Millex-GP PES 0.22um filter attachment for syringe | Millipore | SLGPR33RS | For FeSO47H2O filtration |
| Millex-GV PVDF 0.22um filter attachment for syringe | Millipore | SLGVR33RS | For supernatant filtration |
| Precision Plus Protein Unstained Standard | Bio Rad | 1610363 | |
| SDS-PAGE Gel Apparatus | Bio Rad | Model Number: Mini PROTEAN Tetra Cell | |
| SilverXpress Silver Staining Kit | Invitrogen | LC6100 | |
| The BellyDancer Shaker | IBI Scientific | BDRAA1155 | |
| Trichloroacetic acid solution 6.1N | Sigma Aldrich | T0699 | |
| Vinyl Anaerobic Chamber | Coy Lab Products | https://coylab.com/products/anaerobic-chambers/vinyl-anaerobic-chambers/#details | |
| qPCR Primer sequences | |||
| yfeA forward - CAC AGT CAG CAG ACC TTA TCT T | |||
| yfeA reverse - GGC AGA CGG GAC ATC TTT AAT A | |||
| bfd forward - ccagcatcagccccatacag | |||
| bfd reverse - tggcttgtcggatgcacttc | |||
| yopE forward - CCATAAACCGGTGGTGAC | |||
| yopE reverse - CTTGGCATTGAGTGATACTG |
参考文献
- Deng, W., et al. Assembly, structure, function regulation of type III secretion systems. Nat Rev Microbiol. 15 (6), 323-337 (2017).
- Springer International Publishing. . Bacterial Type III Protein Secretion Systems. 427, (2020).
- Schubert, K. A., Xu, Y., Shao, F., Auerbuch, V. The Yersinia type III secretion system as a tool for studying cytosolic innate immune surveillance. Annu Rev Microbiol. 74, 221-245 (2020).
- Cassat, J. E., Skaar, E. P. Iron in infection and immunity. Cell Host Microbe. 13 (5), 509-519 (2013).
- Singhal, R., Shah, Y. M. Oxygen battle in the gut: Hypoxia and hypoxia-inducible factors in metabolic and inflammatory responses in the intestine. J Biol Chem. 295 (30), 10493-10505 (2020).
- Marteyn, B., et al. Modulation of Shigella virulence in response to available oxygen in vivo. Nature. 465 (7296), 355-358 (2010).
- Rakin, A., Schneider, L., Podladchikova, O. Hunger for iron: the alternative siderophore iron scavenging systems in highly virulent Yersinia. Front Cell Infect Microbiol. 2, (2012).
- Lesic, B., Carniel, E. Horizontal Transfer of the high-pathogenicity island of Yersinia pseudotuberculosis. J Bacteriol. 187 (10), 3352-3358 (2005).
- Green, E. R., et al. Fis is essential for Yersinia pseudotuberculosis virulence and protects against reactive oxygen species produced by phagocytic cells during infection. PLOS Pathog. 12 (9), e1005898 (2016).
- Cornelis, G. R. The Yersinia Ysc-Yop "Type III" weaponry. Nat Rev Mol Cell Biol. 3 (10), 742-753 (2002).
- Cheng, L. W., Anderson, D. M., Schneewind, O. Two independent type III secretion mechanisms for YopE in Yersinia enterocolitica. Mol Microbiol. 24 (4), 757-765 (1997).
- Straley, S. C. The low-Ca2+ response virulence regulon of human-pathogenic yersiniae. Microbial Pathog. 10 (2), 87-91 (1991).
- Balada-Llasat, J. -. M., Mecsas, J. Yersinia has a tropism for B and T cell zones of lymph nodes that is independent of the type III secretion system. PLoS Pathog. 2 (9), e86 (2006).
- Adams, W., Morgan, J., Kwuan, L., Auerbuch, V. Yersinia pseudotuberculosis YopD mutants that genetically separate effector protein translocation from host membrane disruption: YopD central region promotes Yop translocation. Mol Microbiol. 96 (4), 764-778 (2015).
- Hooker-Romero, D., et al. Iron availability and oxygen tension regulate the Yersinia Ysc type III secretion system to enable disseminated infection. PLOS Pathog. 15 (12), e1008001 (2019).
- Balderas, D., et al. Genome scale analysis reveals IscR directly and indirectly regulates virulence factor genes in pathogenic Yersinia. mBio. 12 (3), e00633-00721 (2021).
- Bearden, S. W., Perry, R. D. The Yfe system of Yersinia pestis transports iron and manganese and is required for full virulence of plague. Mol Microbiol. 32 (2), 403-414 (1999).
- Zhou, D., et al. Global analysis of iron assimilation and fur regulation in Yersinia pestis: Global analysis of iron assimilation and fur regulation in Yersinia pestis. FEMS Microbiol Lett. 258 (1), 9-17 (2006).
- Wijerathne, H., et al. a new class of [2Fe-2S] protein that functions in bacterial iron homeostasis, requires a structural anion binding site. Biochemistry. 57 (38), 5533-5543 (2018).
- Bearden, S. W., Staggs, T. M., Perry, R. D. An ABC transporter system of Yersinia pestis allows utilization of chelated iron by Escherichia coli SAB11. J Bacteriol. 180 (5), 1135-1147 (1998).
- Miller, H. K., et al. IscR is essential for Yersinia pseudotuberculosis type III secretion and virulence. PLoS Pathog. 10 (6), e1004194 (2014).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。