Method Article
分离和斑马鱼胚胎单细胞的表征
摘要
This protocol describes a method for isolating single cells from zebrafish embryos, enriching for cells of interest, capturing zebrafish cells in microfluidic based single cell multiplex systems, and assessing gene expression from single cells.
摘要
The zebrafish (Danio rerio) is a powerful model organism to study vertebrate development. Though many aspects of zebrafish embryonic development have been described at the morphological level, little is known about the molecular basis of cellular changes that occur as the organism develops. With recent advancements in microfluidics and multiplexing technologies, it is now possible to characterize gene expression in single cells. This allows for investigation of heterogeneity between individual cells of specific cell populations to identify and classify cell subtypes, characterize intermediate states that occur during cell differentiation, and explore differential cellular responses to stimuli. This study describes a protocol to isolate viable, single cells from zebrafish embryos for high throughput multiplexing assays. This method may be rapidly applied to any zebrafish embryonic cell type with fluorescent markers. An extension of this method may also be used in combination with high throughput sequencing technologies to fully characterize the transcriptome of single cells. As proof of principle, the relative abundance of cardiac differentiation markers was assessed in isolated, single cells derived from nkx2.5 positive cardiac progenitors. By evaluation of gene expression at the single cell level and at a single time point, the data support a model in which cardiac progenitors coexist with differentiating progeny. The method and work flow described here is broadly applicable to the zebrafish research community, requiring only a labeled transgenic fish line and access to microfluidics technologies.
引言
细胞和分子生物学目前大多数研究是基于人群的平均水平。然而,重要的生物事件可能由这些传统的以人群为基础的分析被屏蔽,因为较小的群体可以在生物过程和疾病预后扮演着重要的角色。理解在不同的人群的基因表达在单细胞水平可以(有)导致相关的生物和临床见解1,2。关注胚胎发育研究,在细胞的人口较多,祖细胞往往代表性不足,使得它具有挑战性的检测基因表达微妙的变化,最终引发细胞命运决定3。同样地,一个单一的细胞类型可响应于微环境4具有不同的表达谱。例如,在相同的器官或在不同的器官( 例如 ,主动脉或肾)驻地内皮细胞表现显著异质尽管共享共同morphological和功能特点5。此外,癌细胞填充相同的肿瘤还可以在单细胞水平6不同分子型材或突变。
在模型系统中,单个细胞转录组已成功确定了新的细胞群,其特征细胞分化过程中发生的中间状态,并透露差细胞对刺激7,8,9。这样的见解会被掩盖了传统的基于人口的研究。斑马鱼的胚胎是干,祖的极大充分利用的源代码,并在开发过程中探索单细胞的异质性和细胞身份的分子调控问题分化细胞。他们的高度千篇一律, 体外发育和易于遗传操作使其成为这种方法10,11极好的模型系统。具体而言,主要的限制单细胞根的解释Ë表达数据是在开发过程中新的中间细胞状态的可靠的鉴定需要组织收集9非常小心时机。这是必要的,以确保捕获的细胞之间的异质性表示在单个时间点的组织内的异质性,而不是异质由年龄依赖性细胞分化呈现的基因表达。相比小鼠,斑马鱼胚胎发育可以精确在大量的胚胎12的同步。此外,具有大的离合器的尺寸,斑马鱼的胚胎可以用作干细胞和祖细胞的丰富来源。
这个协议描述来隔离从斑马鱼胚胎细胞和使用用于QRT-PCR的基因表达分析的市售集成微流体回路(IFC)芯片和Autoprep设备系统捕获单细胞的方法。该协议可迅速移植到任何高通量测定复包括全转录组测序,使细胞的异质性13的更全面的分析。它还提供了多种优势,传统的基因表达分析。单细胞分离协议产生的FACS后高存活率,这降低了包含在下游应用中受损细胞的比例。通过使用IFC,捕获细胞可以直接观察来评估捕获速率和形态学评估细胞的健康。此外,该协议是广泛适用于斑马鱼研究界,只需要一个标有转基因鱼线,并获得微流体细胞捕获技术。
作为一个原则的证明,从心脏祖细胞衍生的单细胞分离和IFC芯片上捕获,然后心脏分化标志物的相对丰度被定量RT-PCR检测。在单细胞水平的基因表达分析表明,心脏祖细胞与各色共存ntiating后代。从心脏祖细胞的单细胞分析的洞察力可以在脊椎动物的发育过程中心脏祖细胞中的基因表达模式的异质性,这可能在传统的基于人群的分析被掩盖线索。
研究方案
该协议要求使用的活,成年斑马鱼产生的胚胎。将胚收获组织收集。重要的是要获得相应的伦理审查委员会批准进行这项实验。
1.获取胚胎上演
- 在实验前一天,繁殖准备健康,成年斑马鱼。放置一个男性和一个养殖池一个明确的分隔两侧一名女性。
- 重复1.1所必需的足够胚胎生产下游应用尽可能多的养殖池。获得从野生型鱼和转基因鱼胚胎表达的感兴趣的细胞类型的荧光蛋白质。
注意:需要在步骤2-8下游应用胚胎数依赖于在感兴趣的时间点感兴趣的细胞的相对丰度。虽然这可能通过细胞类型而异,200胚胎产生2,000-5,000排序细胞当C感兴趣的厄尔代表<细胞总数的1.0%,在24 HPF(小时受精后)。 - 第二天早上,通过转移鱼到一个新的养殖池在面包屑槽换水和删除的分隔符。倾斜槽以一定的角度,鼓励养殖。
- 收集上演胚胎。
- 每15分钟,由成年人转移到一个新的养殖池,并通过这些留守通过滤茶鸡蛋收集胚胎。
注意:当保持在可比的密度和温度的斑马鱼胚胎的同步发展。 - 冲洗(在1L双蒸水0.21克/ L的即时海洋盐)与蛋水鸡蛋和转移到陪替氏培养皿。与空气循环转移培养皿在潮湿培养箱中于28.5℃。
- 每15分钟,由成年人转移到一个新的养殖池,并通过这些留守通过滤茶鸡蛋收集胚胎。
- 最后收集后两小时,排序受精,多细胞胚胎成10cm陪替皿并降低密度,以每皿50胚胎。从一个单一的,15选择胚胎用于下游应用集合分钟时间窗口。孵育28.5℃的胚胎。
注:例如,在8点半,8时45分,9:00 9:15,9:30,9时45,10:00,上午10点15分收集胚胎。跨越时间点相比较,如果受精胚胎人数最多的是从上午9时收集到的离合器,然后只使用这些胚胎下游应用。
2.设置单细胞分离
- 感兴趣(18 HPF)的时间点前约30分钟,从他们的绒毛膜手动用细镊子取出胚胎。
- 收集并标记为每个条件如下:2发2 ml微量离心管一40微米的细胞过滤网,一次35 MM细胞培养皿中,并用一个35微米的细胞滤网淋上2 FACS管。
- 冰浴的下列试剂:含有蛋水0.21克/ L即时海洋盐1L双蒸水;脱yolking含有55 mM氯化钠,1.8 mM的KCl和1.25毫碳酸氢钠缓冲液;和FACS缓冲液含有Leibovitz的L-15补充了5%热灭活的胎牛血清的介质。
- 每带细胞分离试剂1的样品1毫升RT。解冻1毫升细胞分离试剂2每个样品上冰。把使用前立即RT。
3.单细胞分离
- 使用大口径玻璃吸管,转移100-300胚胎2ml的微量离心管中蛋水的最小量。
- 通过在冰上用1ml冰冷的蛋水更换水和浸没管20分钟安乐死胚胎。
注意!关键是要取得适当的体制动物保护监督委员会批准,该安乐死方法(在冰上冷却后细胞分离二次安乐死)。标准安乐死通常需要胚胎<3天受精后它们被冷却后,这是不恰当的用于获得活细胞漂白。 - 用1毫升的冰冷蛋水冲洗胚胎两次。要洗,使用大口径玻璃吸管取出鸡蛋水和P1000加入鸡蛋水。
- 通过用1ml Deyolking缓冲器,带有一个P1000尖更换胚胎水和捣碎8-12次去除蛋黄,或直到蛋黄溶解并只胚胎的机构是可见的。
- 收集通过离心组织在300×g离心1分钟。用吸管轻轻地去除上清液而不破坏组织的沉淀。在1毫升鸡蛋水再挂起。
- 重复步骤3.5,共洗涤三次,但在最后的洗涤,在1毫升的RT细胞解离试剂1重新暂停。
- 孵育在细胞解离试剂1在RT 10分钟与管水平放置。每2-3分钟,轻轻地用吸管P1000防止结块磨碎。
注:在研磨步骤,轻拿轻放样品。有时一个单一的,大丛将形成胚体纠结管。这会与温和的研磨辅助附加消化分散。不要旋涡振荡。 - 离心300 XG 3分钟收集组织。在1毫升细胞分离试剂2取出上清,重悬。
- 在室温下孵育5-15分钟。水平放置的管子。每2-3分钟,轻轻磨碎,以防止结块。每5分钟,评估消化的进展。
- 为了评估消化进度,稀释2微升上清到18微升FACS缓冲液和吸管作为液滴到细胞培养皿。
- 将盖玻片在样品和10X 20X和放大倍率组织培养显微镜下观察。
注:编制应显示为单细胞,小集群,大集群,和偶尔的大多是原封胚胎体的混合。 - 视觉评估是单个细胞和小簇的制剂的比例。
注:在消化会减少可行性;在消化会减少单细胞产量。
- 收集通过离心细胞制剂在300×g离心5分钟。弃去上清液并在1ml再悬浮冷FACS缓冲液。
- 用浸湿FACS缓冲液40微米的细胞过滤。穿过40微米的细胞过滤细胞悬液到35毫米的细胞培养皿。用1ml的FACS分选缓冲液洗细胞过滤一次。
- 转移流通到2ml微量离心管中。在300 xg离心收集细胞离心5分钟,并在100μlFACS缓冲液重悬浮。
- 算使用血球细胞产量。进一步稀释样品建议选择的FACS机器每毫升,或最佳浓度5×10 6个细胞。可选当在血球计数细胞产量,用锥虫蓝染剂死细胞以确认之前FACS分选的细胞制剂的可行性。
注:准备被过度稀释,将需要大量的时间过量的排序。准备工作过于Çoncentrated易于聚集成多聚体,并为次优排序纯粹的人口。 - 储备各试样的10〜20%,以使用作为未染色对照。对于剩余的样品,加入染色死细胞荧光活/死(L / D)的歧视染料到每个样品。不洗。
注:穿透细胞用的核酸可以被用作的L / D染料受损细胞膜和污渍不限荧光染料,只要该荧光光谱是与感兴趣的选择和荧光标记的细胞的流式细胞仪机兼容。- 加入染料的一些细胞会在运输途中死FACS净化,应从排序人口被排除后,不要洗的准备。
- 皑皑浸湿FACS管20微升FACS缓冲的35微米的细胞过滤。加入细胞的过滤器,并通过重力收集。存储在冰上。
4. FACS富集
- 使用FACS来富集单,表达荧光标记的活细胞。
- 设置一个门上的前向散射(FSC-A)幅度VS侧散射幅度(SSC-A)的散点图从碎片区分细胞,都与线性缩放。
注意!斑马鱼细胞通常比小鼠或人类细胞小。这反映在细胞和碎片之间的下基底分离。 - 从在4.1.1设置栅极,设置一个门以富集单细胞和排除使用前向散射高度(FSC-H)和低侧散射高度(SSC-H)的散点图多体,既具有线性缩放。
注:具有不成比例的高FSC-H和低SSC-H细胞可能多聚体和排序被排除在外。 - 从4.1.2门设定,使用单一颜色控件,设置一个门包括使用FSA-A的散点图与线性缩放和通道的幅度只活细胞用于检测的L / D与污渍日志缩放。如:L / D阴性细胞。
- 从门在4.1.3设置,使用单一的色彩控制,采用FSA-A的散点图与用于检测荧光蛋白细胞标记物与日志缩放通道的线性缩放和幅度设置一个门只包括活细胞阳性荧光。包括阳性细胞。
- 设置任何补偿控制,如果需要的话,要占的L / D染色和荧光蛋白的光谱之间的干扰。
- 设置一个门上的前向散射(FSC-A)幅度VS侧散射幅度(SSC-A)的散点图从碎片区分细胞,都与线性缩放。
- 设置排序逻辑落入所有步骤设置4.1城门细胞。
- 采用双标记细胞,确认选通细胞分选。
注意:用于排序将细胞而不是碎屑,单个细胞而不是多聚L / D阴性和荧光阳性细胞的细胞。
- 采用双标记细胞,确认选通细胞分选。
- 排序2,000-4,000细胞从感兴趣的人口到在冰上的离心管5微升冷的FACS缓冲液中。为了在排序过程中尽量减少对细胞的剪切应变,用最低的压力可能使细胞分拣机。
注:FACS缓冲液的5微升液滴用作退出FACS机器的细胞的缓冲。收集2,000-4,000细胞直接进入FACS缓冲液消除装载到IFC芯片之前需要进行离心分离。建议采用此策略,因为离心可导致多聚形成的,如果细胞坚持颗粒彼此。 - 评估排序后的可行性分析。
- 转移1微升排序细胞与100微升FACS分类缓冲器和1个新鲜FACS管:1000稀释的L / D污点。通过FACS分拣机与步骤4.1浇注战略传递细胞。使用L的比例/ D负到正来估计分选的细胞的生存力。
5.称重传感器到微流控芯片
- 使用血细胞计数器,测量的浓度和分选的细胞的尺寸。
- 稀释排序细胞至少10微升。稀释5μ的等分试样; L细胞与5微升台盼蓝。加载到血球和应用盖玻片。
- 收集所有细胞的亮场图像,4×4格血细胞计数。计数活细胞的数量,并计算活细胞/ ml。活细胞不占用台盼蓝。
注意:使用任何标准的图像分析软件来测量所有活细胞的直径。计算小区大小的平均值和标准偏差,并选择适合于感兴趣的细胞尺寸范围内的IFC板。如果单元格大小范围横跨国际金融公司板单元尺寸范围内,使用多个板来捕捉全方位的利益细胞。
- 上根据制造商的说明IFC板负载细胞(见材料)。
- 稀释细胞至1×10 6个细胞/ ml,并执行浮力优化按照制造商的说明。
注:浮力优化确保细胞既不沉底也不漂浮到装载WEL的顶L为取得最佳装载到IFC芯片。缓冲器的细胞的比例可以由细胞类型而有所不同,但通常为6:4-7:3细胞:缓冲器。 - 加入细胞涂上底漆,IFC板。压板到兼容的流体机械,并运行一个小区负载脚本通过微流体电路进入采集通道,推动细胞。
- 稀释细胞至1×10 6个细胞/ ml,并执行浮力优化按照制造商的说明。
- 确认细胞在国际金融公司板捕获网站提出。
- 卸下流体机械IFC板。安装在配备有板适配器显微镜的IFC板。
- 在放大10倍收集亮场和荧光每次捕捉网站的快照。
注:明场捕获时间可能从10-50毫秒,这取决于灯泡的强度。荧光捕获时间可能从250-750毫秒,这取决于荧光亮度。以免过度曝光细胞光损伤预防。
6. cDNA合成
- 根据我在原地进行细胞裂解FC板制造商的说明。
- 加入裂解缓冲液对IFC板的孔中。压板上兼容的流体机械及运行细胞裂解脚本按照制造商的说明。
- 根据国际金融公司板制造商的说明书进行反转录。
- 加入反转录试剂IFC板。压板上兼容的流体机械。运行逆转录脚本。样品循环条件:在25℃1个循环10分钟,在42℃下1个周期为1小时,然后在1周期在85℃下5分钟。
- 根据国际金融公司板制造商的说明用基因特异性探针进行前置放大。
注:由于他们与低拷贝数更大的特异性,采用荧光标记探针,而不是用于嵌入染料的使用最优化的探头。- 池引物和稀释到每个最终180纳米。汇集引物添加到IFC板。压板上兼容fluidiCS机。前置放大运行脚本。
- 在95℃下在95℃变性15秒,然后退火和延伸在60℃下4分钟1个循环10分钟,然后18个循环:用下面的循环条件进行前置放大。在4℃直至收获商店预扩增的cDNA。嘉实cDNA的根据,直到使用制造商的说明和储存在-20℃微板。
7.从单目标定量RT-PCR单细胞基因选择
- 根据制造商的说明在25微升稀释试剂稀释的cDNA。
注:近似最终产量为28微升每单元前置放大cDNA的。保留稀释剂的等分试样用作定量RT-PCR检测的无模板对照。- 谈到明场,并记录在步骤5.3.2荧光图像,得分每个捕获点。手动计数并记录细胞的数目。评估和记录每一个细胞是否感orescent。
注:每个单独的网站可能包含0,1,或> 1的细胞,其中> 1单元包括包含多个细胞和/或无法识别的碎片捕获点。如果图像是足够的质量,像素值也可以被分配给量化荧光信号的强度。
- 谈到明场,并记录在步骤5.3.2荧光图像,得分每个捕获点。手动计数并记录细胞的数目。评估和记录每一个细胞是否感orescent。
- 对于定量RT-PCR分析选择样本。
- 从步骤7.2确定了包含具有积极的荧光确切1细胞捕获地点选择cDNA样品。从每个样品的cDNA的池1微升等份。
注意:这是用来确定是否感兴趣的基因中的任何选定单元格中表达了"池"阳性对照。 - 从包含恰好0细胞作为阴性对照的至少一个捕捉现场选择的cDNA。步骤7.1.2为无模板控制使用稀释剂。
- 从步骤7.2确定了包含具有积极的荧光确切1细胞捕获地点选择cDNA样品。从每个样品的cDNA的池1微升等份。
- 运行定量RT-PCR检测。
- 仅使用在步骤6.4.1用于预扩增探针。加载triplicat所有样品即1个循环50℃2分钟,1个循环95℃,10分钟,40个循环,在95℃下15秒的变性,然后退火和延伸,在60℃进行1:用于在384孔板10微升反应循环条件分钟。
8.数据分析
- 验证由标准凝胶电泳定量RT-PCR产物。确认产物是预期的分子量的单一条带(每个探头而异)。
注:如果探测器在不适当的大小产生多个频段或单波段,那么专一是值得怀疑的,这从排除分析基因。 - 检查有无异常14所有扩增曲线和帐号。计算每个样品/基因组合15的平均CT值。
注:阳性对照CT值通常从10-30不等。为阴性对照CT值范围通常为35-40(无放大)。 CT值30-35被认为是非常低的表达应谨慎14来解释。 - 报告数据
- 如果样品倒在CT = 10-30,数据也可以被报告为相对转录丰度对照样品倍数变化。
注:折叠变化等于2 ^( - ΔΔCT)其中ΔCT是相对于管家基因通过从管家基因减去样品的平均CT和ΔΔCT是样品和阳性对照15之间在ΔCT的差异。
- 如果样品倒在CT = 10-30,数据也可以被报告为相对转录丰度对照样品倍数变化。
结果
作为一个原则的证明,基因表达进行了评估心脏发育过程中,探索差异化的动态。在斑马鱼,心脏祖细胞从迁移到前侧板中胚层,他们融合形成线性心脏管细胞的中胚层人口出现。之前的融合,心脏祖细胞开始表达转录因子NKX2.5(NK 2同源5),它被认为是心脏祖16,17的最早特异性标记。在这里,先前描述的BAC转基因鱼的Tg(NKX2.5:ZsYellow)18,简称NKX2.5:ZSY用在18体节期,18小时受精后(HPF)12检查单细胞心脏分化标记。这是最早的时间点在该ZsYellow信号在视觉上可检测的。如前面对本转基因系中描述,ZsYellow标签心脏祖细胞,如我们LL作为引起咽拱内皮细胞在28 HPF 19几个额外的心脏细胞( 图1A-B中 ,数据未显示)。在18 HPF,NKX2.5:ZSY胚胎分离成单细胞悬浮液,然后用SYTOX蓝染色来排除死细胞。现场,ZsYellow阳性,SYTOX蓝阴性细胞FACS使用一个MoFloXDP还是索尼SH800Z分拣机配有100微米的喷嘴( 图1C-F)进行分类。为了评估排序人口和排序后生存能力的纯度,分选的细胞的等分试样用SYTOX蓝染色并评估事件的原始排序栅极( 图1G-J)的内下降的百分比。
排序后,将细胞根据制造商的说明被输入到一个集成的微流体回路(IFC)芯片的工作流程( 图2A)。血球,台盼蓝exclusio结合n为用来测量细胞直径,浓度和活力( 图2B中 ,和数据未显示)。细胞浮力进行了优化(6.5:3.5的细胞:缓冲液)根据制造商的指令,并且被装上一个IFC细胞捕获5-10微米直径的细胞。为了评估捕获效率,荧光和/或亮场信号在所有拍摄地点进行成像,在斐济平铺功能是用来缝合微流控板的单张照片。每个捕获站点包含0,1,或> 1的单个细胞( 图2C-F)。来自FACS富集预期,捕获细胞表达ZsYellow( 图2G)。捕获效率在使用NKX2.5 5个别实验超过90%:ZSY分选的细胞,以及捕获位点的至少70%是由一个单一的单元占用(未示出数据)。细胞溶解,RNA分离,cDNA的合成和特定的靶基因进行扩增,所有根据制造商的说明。
被选定为定量RT-PCR分析细胞捕获网站一个子集,如上述协议中所述。具体地,延伸因子1A(efl1a)20和甘油醛-3-磷酸(GAPDH)21进行测定按预期在每一个细胞中表达的持家基因; GATA结合蛋白4(GATA4)22和NK2同源5(NKX2.5)早心脏祖标记; ISL LIM同源盒1盒1(isl1)作为第二心脏区域的标记23,24;和肌球蛋白轻链(MYL7)和心室肌球蛋白重链(vmhc)25来标记心室肌细胞。利用cDNA从48 HPF胚胎( 图3)的基因特异性探针进行了验证。定量RT-PCR方法从18 HPF胚胎,无模板阴性对照评估这些基因在45单细胞相对的基因表达和汇集的人口阳性对照containi纳克的cDNA所有96捕获点。 40代表细胞和对照的原始的CT值示于表1中值得注意的是,从46细胞的检测池,6个细胞被排除在分析,因为所有的基因表达的CT值超过CT = 35.0,并且它是未知是否这些高的CT值是由于真正的,非常低的表达水平或样品降解。由于用于管家基因,EF1A CT值的范围内,太宽,无法比较样品之间的基因表达,和许多CT值超过30,CT值被可视化为热图( 图3)。跨样品比较,在基因表达的相当大的异质性,观察,和细胞分类细胞作为基于表达模式1-5类型( 图3)。

图斑马鱼1.单细胞分离 NKX2.5: 在18 HPF ZSY 阳性细胞代表的Tg(NKX2.5:ZsYellow)的整装图像。在18 HPF与(A)ZsYellow单独荧光或(B)的胚胎吸收合并亮场图像。 (CF)代表FACS门控策略,以丰富的ZsYellow阳性细胞(GJ)和(C,G)FSC / SSC的大小门,(D,H)双重歧视,(E,I)活/死门排序后的分析和(F,J),来分类群。比例尺为100微米。 请点击此处查看该图的放大版本。
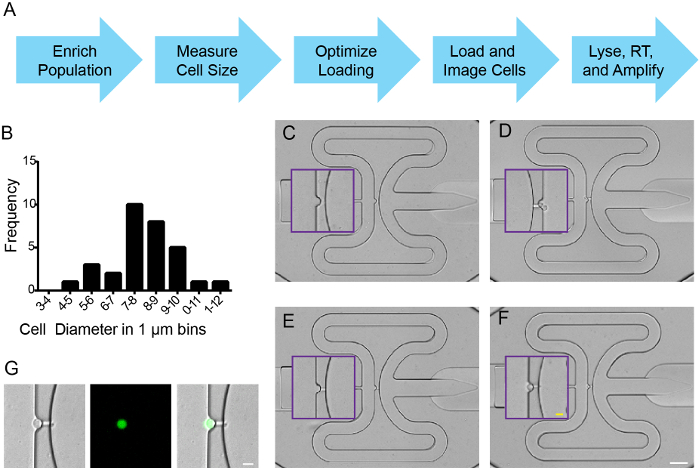
图2:斑马鱼 NKX2.5 的单细胞捕获 :ZSY 翁>阳性细胞。(A)工作流程。 (B)为选细胞细胞大小分布从的Tg(NKX2.5:ZsYellow)在18 HPF孤立胚胎。 (CF)在IFC板代表细胞捕获的事件,其中(C)是一种空井,(D)包含两个单元,(E)已在流体通道提出作为一个"通道俘获",和(F)的单个细胞单细胞捕获。紫箱大关插图捕获地点放大图。 (G)的单细胞捕获与明,ZsYellow和合并图像。 (CF)白比例尺是50微米;黄色的比例尺为10微米。 (G),比例尺为10微米。 请点击此处查看该图的放大版本。
igure 3"SRC ="/文件/ ftp_upload / 53877 / 53877fig3.jpg"/>
捕获单斑马鱼 NKX2.5 图3.基因表达分析 :ZSY阳性细胞的阳性对照的基因表达通过qRT-PCR(以2天后受精胚胎,从单个细胞汇集的cDNA),阴性对照(无模板)和40个单细胞(细胞01-40)。作为主要描述被编码为主色调的原始CT值。EF1A = 延伸因子1a中 ,GATA4 = GATA结合蛋白4,NKX2.5 = NK2同源5,MYL7 = 肌球蛋白轻链7,vmhc = 心室肌球蛋白重链 ,GAPDH = 甘油磷酸3,和isl1 = ISL LIM同源1。 请点击此处查看该图的放大版本。
| 循环阈值(CT) | ||||||||
| EF1A | GATA4 | nkx25 | MYL7 | vmhc | GAPDH | isl1 | ||
| 胎 | 20.69 | 20.92 | 28.59 | 32.87 | 26.30 | 27.00 | 33.57 | |
| 池 | 26.4 | 22.4 | 27.7 | 27.4 | 24.5 | 29.2 | 40.0 | |
| NTC | 40.0 | 40.0 | 40.0 | 40.0 | 40.0 | 40.0 | 40.0 | |
| 1型 | 细胞-01 | 25.1 | 40.0 | 40.0 | 40.0 | 40.0 | 40.0 | 40.0 |
| 细胞-02 | 25.4 | 40.0 | 40.0 | 40.0 | 40.0 | 40.0 | 40.0 | |
| 细胞-03 | 26.3 | 40.0 | 40.0 | 40.0 | 40.0 | 40.0 | 40.0 | |
| 细胞-04 | 27.4 | 40.0 | 40.0 | 40.0 | 40.0 | 40.0 | 40.0 | |
| 细胞-05 | 28.0 | 40.0 | 40.0 | 40.0 | 40.0 | 40.0 | 40.0 | |
| 细胞-06 | 28.2 | 40.0 | 40.0 | 40.0 | 40.0 | 40.0 | 40.0 | |
| 细胞-07 | 29.3 | 40.0 | 40.0 | 40.0 | 40.0 | 40.0 | 400.0 | |
| 细胞-08 | 30.7 | 40.0 | 40.0 | 40.0 | 40.0 | 40.0 | 40.0 | |
| 细胞-09 | 34.3 | 40.0 | 40.0 | 40.0 | 40.0 | 40.0 | 40.0 | |
| 类型2 | 细胞-10 | 23.5 | 28.0 | 40.0 | 40.0 | 40.0 | 26.3 | 40.0 |
| 小区11 | 23.5 | 27.2 | 40.0 | 40.0 | 40.0 | 40.0 | 40.0 | |
| 小区12 | 23.7 | 17.9 | 40.0 | 40.0 | 40.0 | 40.0 | 40.0 | |
| 小区13 | 24.1 | 32.4 | 40.0 | 40.0 | 40.0 | 40.0 | 40.0 | |
| 细胞-14 | 24.9 | 27.5 | 40.0 | 40.0 | 40.0 | 40.0 | 40.0 | |
| 细胞-15 | 25.9 | 28.6 | 40.0 | 40.0 | 40.0 | 40.0 | 40.0 | |
| 细胞-16 | 26.0 | 28.1 | 40.0 | 40.0 | 40.0 | 40.0 | 40.0 | |
| 细胞-17 | 27.0 | 27.7 | 40.0 | 40.0 | 40.0 | 38.5 | 40.0 | |
| 细胞-18 | 27.0 | 27.4 | 40.0 | 40.0 | 40.0 | 40.0 | 40.0 | |
| 细胞-19 | 27.0 | 30.2 | 40.0 | 40.0 | 40.0 | 38.2 | 40.0 | |
| 细胞-20 | 27.0 | 28.2 | 40.0 | 40.0 | 400.0 | 39.2 | 40.0 | |
| 小区21 | 27.7 | 30.3 | 40.0 | 40.0 | 40.0 | 38.6 | 40.0 | |
| 小区22 | 30.4 | 26.2 | 40.0 | 40.0 | 40.0 | 38.3 | 40.0 | |
| 小区23 | 31.3 | 22.4 | 40.0 | 40.0 | 40.0 | 39.7 | 40.0 | |
| 细胞-24 | 31.5 | 28.8 | 40.0 | 40.0 | 40.0 | 39.5 | 40.0 | |
| 细胞-25 | 33.8 | 27.4 | 40.0 | 40.0 | 40.0 | 37.3 | 40.0 | |
| 细胞-26 | 40.0 | 27.4 | 40.0 | 40.0 | 40.0 | 36.6 | 40.0 | |
| 类型3 | 细胞-27 | 24.7 | 19.9 | 28.8 | 40.0 | 40.0 | 40.0 | 40.0 |
| 细胞-28 | 24.8 | 28.4 | 26.3 | 40.0 | 40.0 | 40.0 | 40.0 | |
| 细胞-29 | 25.1 | 23.5 | 27.6 | 40.0 | 40.0 | 32.5 | 40.0 | |
| 细胞-30 | 26.3 | 21.4 | 27.5 | 40.0 | 40.0 | 39.9 | 40.0 | |
| 细胞-31 | 26.9 | 24.8 | 28.2 | 40.0 | 40.0 | 40.0 | 40.0 | |
| 细胞-32 | 27.0 | 22.5 | 23.8 | 40.0 | 40.0 | 40.0 | 40.0 | |
| 细胞-33 | 27.8 | 27.6 | 27。7 | 40.0 | 40.0 | 40.0 | 40.0 | |
| 细胞-34 | 28.1 | 21.9 | 26.6 | 40.0 | 40.0 | 37.7 | 40.0 | |
| 细胞-35 | 29.3 | 26.5 | 28.1 | 40.0 | 40.0 | 38.3 | 40.0 | |
| 4型 | 细胞-36 | 24.8 | 20.3 | 26.0 | 27.4 | 26.6 | 40.0 | 40.0 |
| 细胞-37 | 28.7 | 22.3 | 25.9 | 28.9 | 22.9 | 38.5 | 40.0 | |
| 5型 | 细胞-38 | 25.5 | 20.0 | 29.3 | 23.0 | 19.9 | 25.9 | 40.0 |
| 细胞-39 | 25.9 | 21.8 | 28.6 | 25.1 | 21.7 | 25.7 | 40.0 | |
| 细胞-40 | 28.9 | 22.0 | 27.0 | 23.0 | 21.3 | 27.6 | 40.0 | |
表1. 原始CT值。
讨论
本文所描述的方法使用荧光蛋白的表达下的细胞类型特异性启动子的控制,以丰富从斑马鱼胚胎中的微流体辅助单细胞捕获系统中使用的心脏祖细胞群,以评估在单个心动基因的一个子集的表达细胞。只要FACS激光激发和发射能力与所选择的荧光团(多个)相容,可以使用任何荧光报道线路此方法。许多斑马鱼记者线已经存在,并且可以在少至3个月后将产生携带新颖记者转基因鱼。此外,此工作流程可以适于从全转录为单细胞RNA测序产生的cDNA。这样做,步骤5-7将需要使用到稍加修改以制备的cDNA用于产生适合的RNA测序文库优化化学物质。然而,最好是要验证群体异质通过使用这里之前缩拢高通量测序应用所描述的方法。
需要注意的是有对所描述的方法有一些限制是重要的。首先,使用集成微流体通路(IFC)板需要专门的,昂贵的设备。但是,微流控芯片比传统的96孔和384孔板格式用于分析单个细胞巨大的优势。由流经微米尺度泳道细胞和试剂,单细胞被定位成在那里他们可以直接观察,以确认它们是单细胞的健康状况良好单个捕获位点。使用非常低量的每一个细胞RNA提取和cDNA合成发生在原地 IFC芯片上。集成流体芯片,在写这篇文章的时候,是市售的通过只有一个来源。虽然非商业制造已被几个小组进行的,它是最实验室的能力之外。步骤5月5-7日需要进行修改,由其他公司或内部捏造生产平台。其次,虽然市售IFC板最多可容纳96个基因,所选择的基因被证实在斑马鱼使用荧光标记的基因探针的可用性有限。三,斑马鱼的细胞通常比哺乳动物细胞小,这个小尺寸带来挑战来样加工。在细胞的直径小的变化转换成细胞体积大的变化,减少可用的材料,降低了检测低表达基因的可能性。
这有几个协议的其他注意事项。在步骤1中,它是一个短的时间范围内受精仅使用胚胎重要。保持温度恒定,无极限氧条件下,斑马鱼胚胎同步发展。该协议的最终读数(从单个细胞基因相对表达)不能区分heteroge源单个细胞间neity。出于这个原因,细胞间异质性的解释依赖于精心上演胚胎和同步发展。在步骤2-3中,有离解和生存能力之间的折衷。虽然第4步选择可行的细胞,第3步包含几个过滤步骤,可以帮助排除多聚体,过度的消化会减少可用FACS可行的材料,并可能减少排序的细胞产量。步骤来解决低存活率包括减少消化时间,减少研磨强度,并在起始材料优化胚胎数。的利息(步骤4)的细胞群的FACS富集可以说是在这个协议中最关键的步骤。严格排序标准是必不可少的,以产生含有单细胞制剂只活表达目的荧光蛋白的细胞。从污染其他人群的细胞可能导致细胞间异质性的虚假陈述。值得注意的是,感兴趣的群体的FACS富集并不限于在此协议中所示的两个颜色的策略。更复杂的策略可以产生更精致的细胞群,并扩大在原则上学习的证明报告的方法,快速的方式。在步骤5中,细胞可被直接观察,确认捕获的细胞,细胞的健康,和荧光蛋白的表达的数量。但是,这取决于细胞的大小和亮度,相关的荧光团可能不是目视检测到的,而不是一种可靠的读出。步骤6-8成功完成需要认真遵守制造商的协议。
作为原则证明,已知心脏标记物的子集的表达水平在单从先前所述的BAC转基因斑马鱼线NKX2.5衍生进行了评估:ZSY审查个别NKX2.5心肌分化标记:ZSY阳性细胞在18小时后受精(HPF)。探索heterogenei在捕获NKX2.5表达分化标记的TY:ZSY 表达细胞,基因的套件进行测定,包括持家基因(EF1A,GAPDH),已知在心脏规范(GATA4,NKX2.5)早期被接通转录因子,一个第二心脏祖领域标记(isl1),和已知基因稍后在心脏分化(MYL7,vmhc)被打开。每个基因的相对丰度,通过计算循环阈值(CT)通过qRT-PCR测定的。算出的最低CT值为17.9,最高为40,代表没有扩增(表1)。中> 35.0 CT值被认为低于检测。
46中的细胞的数据集,6被排除,由于任何基因的失败扩增。剩余的细胞子分类细胞转变成基于GATA4,NKX2.5,MYL7和vmhc和 WER表达5种e。通过组内EF1A值排序。虽然GAPDH最初包括作为一个可能的看家基因,表达跨单元充满变数,使得它不适合作为看家基因。GAPDH表达可能更代表了心脏分化在此单元格类型相关能量代谢的变化。有趣的是,有一个电池,其中EF1A是未检测到,但另一个基因检测(GATA1细胞26)。这表明,虽然EF1A通常是足够的管家基因成功和不成功的单细胞的逆转录反应来区分,它可能不是理想的所有应用程序。在小区26中的缺乏EF1A表达可能是由于单细胞转录动力学。最近单细胞的研究表明,基因转录是从根本上随机的,快速和可忽略的转录活性26的相之间交替。 ŧ他转录破裂模型表明,使用看家基因单细胞之间的定量比较,可能是完全不恰当的。
在类型1组,EF1A是唯一的基因检测。这些细胞可包括任一NKX2.5:ZSY阴性细胞或细胞与感兴趣的其它基因的非常低的表达。 2型细胞,用细胞-26的异常表达都EF1A和GATA4与这些基因的相对表达水平不相关。值得注意的是,在1型和2型细胞NKX2.5表达可能是由于次优的FACS严紧,转录爆破,转基因泄漏,或亚阈值的表达水平。类型3细胞中表达EF1A,GATA4和 NKX-2.5的可检测的水平。这些细胞是可能的心脏祖细胞,并且可以包括微分心房心肌细胞。 4型细胞表达EF1A,GATA4,NKX2.5,MYL7 <检测水平/ em>的和vmhc,并有可能细胞分化为心肌细胞。 5型细胞表达EF1A,GATA4,NKX2.5,MYL7,vmhc,和GAPDH。加入GAPDH可检测水平的表明,这些细胞具有分化的心肌细胞中发现增强糖酵解代谢的能力。这是令人感兴趣的是,尽管从Tg的分拣ZsYellow阳性细胞。(NKX2.5:ZsYellow),胚胎,21/40细胞已经在我们的qRT-PCR分析NKX2.5的亚阈值水平这可能是由于转录爆裂或可反映内源性NKX2.5和ZsYellow之间的成绩单不同的处理方式。重要的是,第二心脏外地标记isl1在任何细胞检测不到或cDNA从我们所有的拍摄地点汇集。总之,在整个样本进行比较,大幅度异质性明显在单细胞水平,这表明在18 HPF,NKX2.5:ZSY + CELLS包括在分化的不同阶段的心脏祖细胞以及子代。
披露声明
The authors have nothing to disclose.
致谢
We thank Dr. C. Geoffrey Burns for fish stock. The authors are grateful to UNC Flow Cytometry Core Facility, UNC-CGIBD AAC core for resources enabling this project, and the ZAC facility for animal care. L.S. is supported by NIH T32 grant HL069768-13 (PI, Nobuyo Maeda). N.F. is supported by NSF Graduate Research Fellowship NSF-DGE-1144081. This study was supported by NIH P30DK034987 grant (to UNC Advanced Analytics Core), American Heart Association Scientist Development Grant 13SDG17060010 and Ellison Medical Foundation New Scholar Grant AG-NS-1064-13 (to Dr. Qian), and NIH R00 HL109079 grant (to Dr. Liu).
材料
| Name | Company | Catalog Number | Comments |
| Supplies | |||
| Dumont #5 forceps | Fine Science Tools | 11254-20 | For removing the chorion from embryos |
| Microcentrifuge tube 2 ml | GeneMate | C-3261-1 | |
| 40 um cell strainer | Biobasic | SP104151 | |
| 35 mm culture dish | Falcon | 351008 | |
| FACS tubes topped with 35 um cell strainer | Falcon | 352235 | |
| P1000 and tips | Rainin | 17005089 | |
| P20 and tips | Rainin | 17005091 | |
| IFC chip manufacturer's protocol | Fluidigm | 100-6117 | Version 100-6117 E1 was used in representative experiment |
| Wide bore pastuer glass pippette | VWR | 14673-010 | For transferring embryos |
| Adult wild type zebrafish | N/A | We used AB line | |
| Adult transgenic zebrafish | N/A | We used Tg(nkx2.5:ZsYellow) | |
| Name | Company | Catalog Number | Comments |
| Reagents for cell dissociation | |||
| Double distilled water | N/A | ||
| Instant Ocean Sea Salt | Instant Ocean | SS15-10 | |
| NaCl | FisherScientific | S271-3 | make stock in water and use for de-yolking buffer |
| KCl | Sigma Aldrich | P5405 | make stock in water and use for de-yolking buffer |
| NaHCO3 | Sigma Aldrich | S6014 | make stock in water and use for de-yolking buffer |
| Leibovitz's L-15 | Gibco | 21083-027 | |
| FBS | FisherScientific | 03-600-511 | Heat inactivate; any brand of FBS should be fine |
| Cell Dissociation Reagent 1 -TrypLE | Life Technologies | 12605-010 | Store at room temperature. |
| Cell Dissociation Reagent 2 - FACSmax | Genlantis | T200100 | Store -20; thaw on ice; bring to room temp before use |
| pronase (optional) | Sigma | P5147 | |
| L/D Dye - Sytox Blue | Life Technologies | S34857 | Any live/dead stain suitable for flow cytometry will work |
| Trypan Blue | Gibco | 15250-061 | |
| Name | Company | Catalog Number | Comments |
| Reagents for IFC plate use and qRT-PCR | |||
| Gene-specific probes | Probes will vary by experiment | ||
| TaqMan Probe ef1a | Life Technologies | Dr03432748_m1 | |
| TaqMan Probe gata4 | Life Technologies | Dr03443262_g1 | |
| TaqMan Probe nk2-5 | Life Technologies | Dr03074126_m1 | |
| TaqMan Probe myl7 | Life Technologies | Dr03105700_m1 | |
| TaqMan Probe vmhc | Life Technologies | Dr03431136_m1 | |
| TaqMan Probe isl1 | Life Technologies | Dr03425734_m1 | |
| TaqMan Gene Expression Master Mix | Life Technologies | 4369016 | |
| Reagents listed in IFC manufacturer's protocol | |||
| C1 Reagent Kit | Fluidigm | 100-5319 | Reagents for loading cells onto IFC plate |
| Ambion Single Cell-to-CTTM | Life Technologies | 4458237 | Reagents for reverse transcription and pre-amplification steps |
| Molecular Biology Quality Water | Corning | 46-000CM | |
| C1 IFC for PreAmp (5-10 um) | Fluidigm | 100-5757 | IFC plate for small cells |
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| C1 AutoPrep machine | Fluidigm | 100-5477 | For IFC plate use |
| Hemocytometer | Sigma Aldrich | Z359629 | For counting cells and assessing cell size |
| Dissecting microscope | For removing embryos from chorion | ||
| Tissue culture microscope | For assessing single cell digestion | ||
| FACS machine | For isolating cells of interest |
参考文献
- Speicher, M. R. Single-cell analysis: toward the clinic. Genome medicine. 5, (2013).
- Macaulay, I. C., Voet, T. Single cell genomics: advances and future perspectives. PLoS genetics. 10, e1004126(2014).
- Marco, E., et al. Bifurcation analysis of single-cell gene expression data reveals epigenetic landscape. Proceedings of the National Academy of Sciences of the United States of America. 111, 5643-5650 (2014).
- Yin, H., Marshall, D. Microfluidics for single cell analysis. Current opinion in biotechnology. 23, 110-119 (2012).
- Garlanda, C., Dejana, E. Heterogeneity of endothelial cells. Specific markers. Arteriosclerosis, thrombosis, and vascular biology. 17, 1193-1202 (1997).
- Diaz-Cano, S. J. Tumor heterogeneity: mechanisms and bases for a reliable application of molecular marker design. International journal of molecular sciences. 13, 1951-2011 (2012).
- Guo, G., et al. Mapping cellular hierarchy by single-cell analysis of the cell surface repertoire. Cell stem cell. 13, 492-505 (2013).
- Guo, G., et al. Resolution of cell fate decisions revealed by single-cell gene expression analysis from zygote to blastocyst. Developmental cell. 18, 675-685 (2010).
- Treutlein, B., et al. Reconstructing lineage hierarchies of the distal lung epithelium using single-cell RNA-seq. Nature. 509, 371-375 (2014).
- Kimmel, C. B. Genetics and early development of zebrafish. Trends in genetics : TIG. 5, 283-288 (1989).
- Liu, J., Stainier, D. Y. Zebrafish in the study of early cardiac development. Circulation research. 110, 870-874 (2012).
- Kimmel, C. B., Ballard, W. W., Kimmel, S. R., Ullmann, B., Schilling, T. F. Stages of embryonic development of the zebrafish. Developmental dynamics : an official publication of the American Association of Anatomists. 203, 253-310 (1995).
- Zhao, S., Fung-Leung, W. P., Bittner, A., Ngo, K., Liu, X. Comparison of RNA-Seq and microarray in transcriptome profiling of activated T cells. PloS one. 9, e78644(2014).
- McCall, M. N., McMurray, H. R., Land, H., Almudevar, A. On non-detects in qPCR data. Bioinformatics. 30, 2310-2316 (2014).
- Schmittgen, T. D., Livak, K. J. Analyzing real-time PCR data by the comparative C(T) method. Nature. 3, 1101-1108 (2008).
- Lyons, I., et al. Myogenic and morphogenetic defects in the heart tubes of murine embryos lacking the homeo box gene Nkx2-5. Genes & development. 9, 1654-1666 (1995).
- Chen, J. N., Fishman, M. C. Zebrafish tinman homolog demarcates the heart field and initiates myocardial differentiation. Development. 122, 3809-3816 (1996).
- Zhou, Y., et al. Latent TGF-beta binding protein 3 identifies a second heart field in zebrafish. Nature. 474, 645-648 (2011).
- Paffett-Lugassy, N., et al. Heart field origin of great vessel precursors relies on nkx2.5-mediated vasculogenesis. Nature cell biology. 15, 1362-1369 (2013).
- McCurley, A. T., Callard, G. V. Characterization of housekeeping genes in zebrafish: male-female differences and effects of tissue type, developmental stage and chemical treatment. BMC molecular biology. 9, 102(2008).
- Tang, R., Dodd, A., Lai, D., McNabb, W. C., Love, D. R. Validation of zebrafish (Danio rerio) reference genes for quantitative real-time RT-PCR normalization. Acta biochimica et biophysica Sinica. 39, 384-390 (2007).
- Serbedzija, G. N., Chen, J. N., Fishman, M. C. Regulation in the heart field of zebrafish. Development. 125, 1095-1101 (1998).
- de Pater, E., et al. Distinct phases of cardiomyocyte differentiation regulate growth of the zebrafish heart. Development. 136, 1633-1641 (2009).
- Hami, D., Grimes, A. C., Tsai, H. J., Kirby, M. L. Zebrafish cardiac development requires a conserved secondary heart field. Development. 138, 2389-2398 (2011).
- Yelon, D., Horne, S. A., Stainier, D. Y. Restricted expression of cardiac myosin genes reveals regulated aspects of heart tube assembly in zebrafish. Developmental biology. 214, 23-37 (1999).
- Molina, N., et al. Stimulus-induced modulation of transcriptional bursting in a single mammalian gene. Proceedings of the National Academy of Sciences of the United States of America. 110, 20563-20568 (2013).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。