Method Article
تحليل وقت السكون أحادي الجزيء لانقسام الحمض النووي بوساطة نوكلياز التقييد
In This Article
Summary
باستخدام الحمض النووي المسمى بالنقاط الكمومية والمجهر الفلوري للانعكاس الداخلي الكلي ، يمكننا التحقيق في آلية تفاعل نوكلياز التقييد أثناء استخدام البروتين غير المسمى. تسمح تقنية الجزيء الواحد هذه بمراقبة متعددة الإرسال على نطاق واسع لتفاعلات البروتين والحمض النووي الفردية ، ويمكن تجميع البيانات لتوليد توزيعات وقت مكوث مكتظة بالسكان.
Abstract
يسهل هذا الفحص المجهري الفلوري الانعكاس الداخلي الكلي الجديد القياس المتزامن لطول الدورة التحفيزية لمئات من جزيئات نوكلياز التقييد الفردي (REase) في تجربة واحدة. لا يتطلب هذا الفحص وضع علامات على البروتين ويمكن إجراؤه باستخدام قناة تصوير واحدة. بالإضافة إلى ذلك ، يمكن تجميع نتائج التجارب الفردية المتعددة لإنشاء توزيعات وقت مكوث مكتظة بالسكان. يمكن أن يساعد تحليل توزيعات وقت السكون الناتجة في توضيح آلية انقسام الحمض النووي من خلال الكشف عن وجود خطوات حركية لا يمكن ملاحظتها مباشرة. مثال على البيانات التي تم جمعها باستخدام هذا الفحص مع REase المدروس جيدا ، EcoRV - وهو نوكلياز داخلي من النوع IIP من النوع الثاني يشق التسلسل التناظري GAT↓ATC (حيث ↓ هو موقع القطع) - تتفق مع الدراسات السابقة. تشير هذه النتائج إلى أن هناك ثلاث خطوات على الأقل في مسار انقسام الحمض النووي الذي يبدأ بإدخال المغنيسيوم بعد أن يربط EcoRV الحمض النووي في غيابه ، بمتوسط معدل 0.17 s-1 لكل خطوة.
Introduction
نوكلياز التقييد (REases) هي إنزيمات تؤثر على فواصل مزدوجة الشريط خاصة بالتسلسل في الحمض النووي. أدى اكتشاف REases في سبعينيات القرن العشرين إلى تطوير تكنولوجيا الحمض النووي المؤتلف ، وهذه الإنزيمات هي الآن أدوات مختبرية لا غنى عنها للتعديل الوراثي والتلاعب1. الإنزيمات من النوع الثاني هي الإنزيمات الأكثر استخداما في هذه الفئة؛ لأنها تشق الحمض النووي (DNA) في موقع ثابت إما داخل تتابع التعرف عليها أو بالقرب منه. ومع ذلك ، هناك قدر كبير من الاختلاف بين النوع الثاني من REases ، وهي مقسمة إلى عدة أنواع فرعية بناء على خصائص إنزيمية معينة بدلا من تصنيفها وفقا لعلاقاتها التطورية. من بين كل نوع فرعي ، هناك استثناءات متكررة لنظام التصنيف ، والعديد من الإنزيمات تنتمي إلى أنواع فرعية متعددة2. تم تحديد الآلاف من أنواع REases من النوع الثاني ، والمئات منها متاحة تجاريا.
ومع ذلك ، على الرغم من التنوع بين النوع الثاني من REases ، فقد تمت دراسة عدد قليل جدا من REases بالتفصيل. وفقا ل REBASE ، قاعدة بيانات إنزيم التقييد التي أنشأها السير ريتشارد روبرتس في 19753 ، تتوفر بيانات الحركية المنشورة لأقل من 20 من هذه الإنزيمات. علاوة على ذلك ، في حين أن بعض REases قد لوحظت مباشرة على مستوى الجزيء الواحد أثناء انتشارها على طول الحمض النووي قبل مواجهة تسلسل التعرف عليها4،5،6،7 والارتباط به ، إلا أن هناك عددا قليلا جدا من الدراسات أحادية الجزيء لحركية تفاعل الانقسام. الدراسات الحالية إما لا تبلغ عن إحصاءات كافية لإجراء تحليل مفصل للتباين في الأوقات التي تحدث فيها أحداث الانقسام الفردي8،9،10 أو أنها غير قادرة على التقاط التوزيع الكامل لأوقات الانقسام11. يمكن أن يكشف هذا النوع من التحليل عن وجود وسيطات حركية طويلة العمر نسبيا ويمكن أن يؤدي إلى فهم أفضل لآليات انقسام الحمض النووي بوساطة REase.
على مستوى الجزيء الواحد ، تكون العمليات الكيميائية الحيوية عشوائية - وقت الانتظار لحدوث مثيل واحد من العملية ، τ ، متغير. ومع ذلك ، يمكن توقع أن تطيع العديد من قياسات τ التوزيع الاحتمالي ، p (τ) ، الذي يدل على نوع العملية الجارية. على سبيل المثال ، ستخضع عملية من خطوة واحدة ، مثل إطلاق جزيء ناتج من إنزيم ، لإحصائيات بواسون ، وستتخذ p (τ) شكل توزيع أسي سالب:
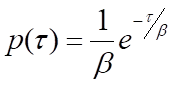
حيث β هو متوسط وقت الانتظار. لاحظ أن معدل العملية ، k ، سيكون مساويا ل 1/β ، معكوس متوسط وقت الانتظار. بالنسبة للعمليات التي تتطلب أكثر من خطوة واحدة ، ستكون p (τ) هي التفاف التوزيعات الأسية المفردة لكل خطوة من الخطوات الفردية. الحل العام لالتفاف دوال الاضمحلال الأسي الأحادي N مع متوسط أوقات انتظار متطابقة ، β ، هو توزيع احتمال جاما:

حيث Γ (N) هي دالة جاما ، التي تصف استيفاء مضروب N-1 إلى القيم غير الصحيحة ل N. على الرغم من أنه يمكن استخدام هذا الحل العام كتقدير تقريبي عندما يكون متوسط أوقات الانتظار للخطوات الفردية متشابهة ، يجب أن يكون مفهوما أن وجود خطوات سريعة نسبيا سيتم حجبه بخطوات ذات أوقات انتظار أطول بكثير. بمعنى آخر ، تمثل قيمة N حدا أدنى لعدد الخطوات12. مع وجود عدد كاف من قياسات وقت الانتظار ، يمكن تقدير المعلمات β و N عن طريق تجميع الأحداث وملاءمة توزيع جاما مع الرسم البياني الناتج أو باستخدام نهج تقدير الاحتمال الأقصى. وبالتالي يمكن أن يكشف هذا النوع من التحليل عن وجود خطوات حركية لا يمكن حلها بسهولة في مقايسات المجموعة ويتطلب عددا كبيرا من الملاحظات لتقدير المعلمات بدقة12,13.
تصف هذه الورقة طريقة لاستخدام الحمض النووي المسمى بالنقاط الكمومية والمجهر الفلوري الانعكاس الداخلي الكلي (TIRF) لمراقبة مئات من أحداث انقسام الحمض النووي الفردية بوساطة REase بالتوازي. يتيح تصميم الفحص تجميع نتائج العديد من التجارب ويمكنه إنشاء توزيعات في وقت الإقامة تحتوي على آلاف الأحداث. يسمح الثبات الضوئي العالي وسطوع النقاط الكمومية بدقة زمنية تبلغ 10 هرتز دون التضحية بالقدرة على مراقبة أحداث الانقسام التي تحدث حتى بعد دقائق عديدة من بدء التجربة. تسمح الدقة الزمنية الجيدة والنطاق الديناميكي الواسع ، جنبا إلى جنب مع القدرة على جمع مجموعة كبيرة من البيانات ، بالتوصيف الدقيق لتوزيعات وقت السكون للكشف عن وجود خطوات حركية متعددة في مسارات الانقسام في REases ، والتي لها معدلات دوران في نطاق 1 min-1 . في حالة EcoRV ، يمكن حل ثلاث خطوات حركية ، تم تحديدها جميعا من خلال وسائل أخرى ، مما يؤكد أن الفحص حساس لوجود مثل هذه الخطوات.
يتم إنتاج ركائز الحمض النووي المزدوجة التي تحتوي على تسلسل التعرف محل الاهتمام عن طريق تلدين قليل النوكليوتيد البيوتينيل إلى شريط مكمل موسوم بنقطة كمومية نانوية شبه موصلات واحدة متصلة تساهميا. يتم إدخال هذه الركائز في قناة تدفق مبنية فوق غطاء زجاجي مع عشب من جزيئات البولي إيثيلين جلايكول عالية الوزن الجزيئي (PEG) متصلة تساهميا بسطحه. يتم التقاط ركائز الحمض النووي عن طريق ارتباط البيوتين - الستربتافيدين - البيوتين بواسطة جزء صغير من جزيئات PEG التي تحتوي على البيوتين في نهايتها الحرة. في الفحص المجهري TIRF ، توفر الموجة المتلاشية التي تتحلل أضعافا مضاعفة مع المسافة من واجهة الزجاج والسائل الإضاءة. عمق الاختراق بترتيب الطول الموجي للضوء المستخدم. في ظل هذه الظروف ، سيتم إثارة النقاط الكمومية فقط المربوطة بالسطح بواسطة جزيء الحمض النووي الذي تم التقاطه على السطح الزجاجي الوظيفي. لن تكون النقاط الكمومية الحرة في المحلول مقيدة داخل المنطقة المضيئة وبالتالي لن تلمع. إذا كان الحمض النووي الذي يربط نقطة كمومية بالسطح مشقوقا ، فستكون هذه النقطة الكمومية حرة في الانتشار بعيدا عن السطح ، وستختفي من الصورة الفلورية.
على الرغم من أنه من المعروف أن العديد من أنواع REases من النوع الثاني تربط الحمض النووي في غياب المغنيسيوم14 ، إلا أن جميعها تتطلب المغنيسيوم للتوسط في انقسام الحمض النووي15. يمكن أن تربط هذه REases الحمض النووي المجمد على السطح في غياب المغنيسيوم. عندما يتم تدفق المخزن المؤقت المحتوي على المغنيسيوم عبر قناة مع ارتداد REase إلى الحمض النووي ، يبدأ الانقسام على الفور ، كما يتضح من اختفاء النقاط الكمومية. يسهل التزامن الذي يتحقق عن طريق الربط المسبق لجزيئات REase ، ثم بدء انقسام الحمض النووي عن طريق إدخال المغنيسيوم ، قياس وقت التأخر حتى اكتمال انقسام الحمض النووي بشكل مستقل لكل جزيء في مجموعة الإنزيمات التي لوحظت في التجربة. يتم تضمين الفلوريسئين كصبغة تتبع في المخزن المؤقت المحتوي على المغنيسيوم للإشارة إلى وصول المغنيسيوم إلى مجال الرؤية. نظرا لعدم تضمين أي إنزيم في المخزن المؤقت المحتوي على المغنيسيوم ، فإن وقت التأخر من وصول المخزن المؤقت المحتوي على المغنيسيوم إلى اختفاء كل نقطة كمومية يشير إلى الوقت الذي يستغرقه REase المرتبط بالفعل بالحمض النووي لشق الحمض النووي وإطلاق النقطة الكمومية من سطح الزجاج. يحدث اختفاء النقاط الكمومية بسرعة ويؤدي إلى انخفاض حاد في مسار الشدة ، مما يوفر مؤشرا واضحا على الوقت الذي يتم فيه شق جزيء الحمض النووي المعين. يتم تحديد أوقات الأحداث من خلال التحليل الرياضي لمسارات الشدة ، وتؤدي التجربة النموذجية إلى مئات من أحداث الانقسام التي يمكن تحديدها. يمكن تجميع نتائج التجارب المتعددة لتوفير إحصاءات كافية للسماح بتقدير المعلمات ، N و β ، إما عن طريق المربعات الصغرى غير الخطية أو تحليل الاحتمال الأقصى.
Protocol
1. معلومات عامة
- تصميم قليل النوكليوتيد
ملاحظة: تتكون ركيزة الحمض النووي ذات 60 زوجا من القواعد (bp) من زوج من قليل النيوكليوتيدات التكميلية بدرجة حرارة انصهار مزدوجة تبلغ 75 درجة مئوية في 100 مللي متر كلوريد الصوديوم.- اطلب واحد قليل النوكليوتيد المركب مع تعديل واحد 5 'البيوتين والآخر مع تعديل 5 'ثيول (مع فاصل سداسي الكربون). ضع موقع التعرف في وسط منطقة الدوبلكس.
ملاحظة: يتم عرض تسلسلات قليل النوكليوتيد للاستخدام مع EcoRV أدناه (موقع التعرف بالخط العريض).
5' البيوتين - AAA لجنة التنسيق الإدارية GAC ATG TTG ATT TCC TGA AAC زز ATA TCA TCA AAG CCA TGA ACA AAG CAG CCG - 3'
5' ثيول - سي جي جي سي تي جي تي جي تي جي تيجيإيه تي جي إيه تي
- اطلب واحد قليل النوكليوتيد المركب مع تعديل واحد 5 'البيوتين والآخر مع تعديل 5 'ثيول (مع فاصل سداسي الكربون). ضع موقع التعرف في وسط منطقة الدوبلكس.
- استخدم ماء عالي النقاء بمقاومة 18 MOhm لجميع الخطوات.
- حماية جميع المحاليل التي تحتوي على نقاط كمومية من الضوء لمنع التبييض الضوئي.
- استخدم مصدر هواء مضغوط لإكمال هذا البروتوكول.
2. تحضير مواد ركيزة الحمض النووي ذات النقاط الكمومية
ملاحظة: إلى جانب قليل النيوكليوتيدات الموصوفة أعلاه ، انظر جدول المواد للمواد الأخرى والجدول 1 للمخازن المؤقتة اللازمة لإعداد ركائز الحمض النووي ذات النقاط الكمومية.
- قلل مجموعات الثيول 5 بوصات على قليل النوكليوتيد لتقترن بالنقاط الكمومية.
- أعد تعليق كل قليل النوكليوتيد ثيوليتيد في الماء بتركيز 100 ميكرومتر.
- ماصة 650 ميكرولتر من الماء في عمود دوران استبعاد الحجم لكل عينة قليل النوكليوتيد ، ودوامة ل ~ 15 ثانية. اترك العمود ليحزم لمدة 30 دقيقة.
- قم بإعداد محلول ديثيوثريتول (DTT) طازج 100 مللي متر مباشرة قبل كل استخدام حيث يتحلل DTT في المحلول بسرعة. افتح بعناية قارورة واحدة تحتوي على 7.7 ملغ من DTT ، وماصة 500 ميكرولتر من المخزن المؤقت لفوسفات الصوديوم في القارورة ؛ دوامة لخلط جيدا.
- لكل قليل نيوكليوتيد معلق ، قم بإعداد أنبوب جديد ، وأضف 50 ميكرولتر من قليل النوكليوتيد و 50 ميكرولتر من محلول DTT إلى الأنبوب. ماصة صعودا وهبوطا لخلط. احتضان لمدة 30 دقيقة في درجة حرارة الغرفة لتقليل روابط ثاني كبريتيد بين مجموعات الثيول المؤكسدة على نهاية 5 'من oligonucleotides.
- قم بإزالة أغطية أعمدة الدوران ، وضع كل عمود في أنبوب التجميع. أجهزة الطرد المركزي أعمدة الدوران في 750 × غرام لمدة 2 دقيقة ، وتجاهل الشحم.
- نقل أعمدة الدوران إلى أنابيب طرد مركزي جديدة. قم بسحب الحجم الكامل (100 ميكرولتر) لعينة واحدة من خليط DNA / DTT برفق على كل عمود معد. أجهزة الطرد المركزي عند 750 × جم لمدة 2 دقيقة ، وقياس امتصاص الشطف عند 260 نانومتر للتأكد من أن التركيز حوالي 40 ميكرومتر.
- قم بتخزين أي عينات لن يتم استخدامها على الفور عند -20 درجة مئوية لمنع أكسدة مجموعات الثيول وتكوين روابط ثاني كبريتيد.
- اقتران الحمض النووي بالنقاط الكمومية
- ماصة واحدة من 50 ميكرولتر من مخزون النقاط الكمومية في جهاز غسيل الكلى لكل بناء يتم إجراؤه ، مع التأكد من عدم لمس الغشاء بطرف الماصة. الدياليز مقابل حجم N-cyclohexyl-2-aminoethanesulfonic acid (CHES) المخزن المؤقت الذي لا يقل عن 1000x حجم العينة مع التحريك عند ~ 100 دورة في الدقيقة لمدة 15 دقيقة.
- قم بإعداد محلول 6 مللي متر طازج من سلفوسوكسينيميدل-4- (N-ماليميدوميثيل) سيكلو هكسان-1-كربوكسيلات (سلفو-SMCC) في محلول CHES مباشرة قبل كل استخدام. افتح بعناية قارورة واحدة تحتوي على 2 ملغ من السلفو-SMCC ، وسحب 800 ميكرولتر من المخزن المؤقت CHES في القارورة. دوامة لخلط جيدا.
- باستخدام الماصة ، استرجع بعناية النقاط الكمومية المعلقة من جهاز غسيل الكلى ، ونقلها إلى أنبوب جديد يحتوي على حجم متساو من محلول sulfo-SMCC ؛ ماصة صعودا وهبوطا لخلط. احتضان لمدة 1 ساعة في درجة حرارة الغرفة مع الاهتزاز عند 1000 دورة في الدقيقة للسماح ل sulfo-SMCC بالتفاعل مع الأمينات الأولية على النقاط الكمومية.
- باستخدام الماصة ، انقل كل عينة بعناية إلى جهاز غسيل الكلى الجديد. لإزالة السلفو-SMCC الزائد، قم بغسيل الكلى مقابل حجم من المخزن المؤقت CHES لا يقل عن 1000 ضعف الحجم الموجود في جهاز (أجهزة) غسيل الكلى، مع التقليب، لمدة 15 دقيقة. استبدل المخزن المؤقت 2x ، وقم بإجراء غسيل الكلى باستخدام CHES buffer 3x في المجموع ، مما يسمح لغسيل الكلى بالمتابعة بعد 15 دقيقة من كل تبادل مؤقت.
- لتبادل المخزن المؤقت استعدادا للتفاعل الثاني، انقل أجهزة غسيل الكلى إلى كأس زجاجية تحتوي على حجم من محلول ملحي مخزن بالفوسفات (PBS) لا يقل عن 1000 ضعف الحجم الموجود في الجهاز (الأجهزة). قم بغسيل الكلى مع التحريك لمدة 15 دقيقة ، وقم باستبدال المخزن المؤقت 2x ، وقم بإجراء غسيل الكلى باستخدام برنامج تلفزيوني جديد 3x في المجموع ، مما يسمح لغسيل الكلى بالمتابعة لمدة 15 دقيقة بعد كل تبادل مؤقت.
- باستخدام الماصة ، استرجع بعناية المحلول الذي يحتوي على النقاط الكمومية من جهاز (أجهزة) غسيل الكلى ، وانقل كل عينة إلى أنبوب جديد يحتوي على كمية متساوية من قليل النوكليوتيد الثيولي المخفف في برنامج تلفزيوني. اجمع بين حجم متساو من PBS و 1/10th حجم عينة oligonucleotide المختزلة والمنقاة (حوالي تركيز 40 ميكرومتر) حيث أن تركيز النقطة الكمومية في هذه المرحلة هو ~ 4 μM. احتضان لمدة 2 ساعة في درجة حرارة الغرفة ، مع الاهتزاز عند 1000 دورة في الدقيقة.
- أضف ألبومين مصل الأبقار (BSA ، 10 مجم / مل) إلى كل عينة للحصول على تركيز BSA النهائي 0.5 مجم / مل. باستخدام الماصة، انقل كل عينة بعناية إلى جهاز غسيل كلى جديد، وقم بغسيل الكلى مقابل حجم مخزن مؤقت لا يقل عن 1000 ضعف الحجم الموجود في جهاز (أجهزة) غسيل الكلى. تبادل المخزن المؤقت 2x ، وإجراء غسيل الكلى مع المخزن المؤقت تخزين جديد 3x في المجموع ، مما يسمح لغسيل الكلى بالمضي قدما لمدة 15 دقيقة بعد كل تبادل المخزن المؤقت.
- باستخدام الماصة ، استرجع كل عينة بعناية ، وضعها في أنبوب جديد ، واحفظها في درجة حرارة 4 درجات مئوية.
ملاحظة: لا تخزن في درجة حرارة -20 درجة مئوية لأن النقاط الكمومية تتلف بسبب التجميد.
- تلدين قليل النوكليوتيد المسمى بالنقاط الكمومية إلى قليل النوكليوتيد البيوتينيل
- أعد تعليق كل قليل النوكليوتيد البيوتينيل في مخزن مؤقت بتركيز 100 ميكرومتر. قم بتخزين العينات غير المستخدمة في درجة حرارة -20 درجة مئوية.
- اجمع بين عينة من قليل النوكليوتيد المسمى بالنقاط الكمومية مع فائض مولاري بمقدار 10 أضعاف من قليل النوكليوتيد البيوتينيل. نظرا لأن التركيز المقدر للحمض النووي في العينة ذات النقاط الكمومية هو 2 ميكرومتر ، أضف 0.2 ميكرولتر من قليل النوكليوتيد البيوتينيل لكل 10 ميكرولتر من هذه العينة.
- سخني الخليط في كتلة حرارية إلى 75 درجة مئوية (درجة حرارة الانصهار للمنطقة التكميلية). امسك عند درجة الحرارة هذه لمدة 5 دقائق. أطفئ كتلة الحرارة واتركها لتبرد ببطء. تخزين البناء المكتمل في 4 درجات مئوية ؛ لا تجمد.
3. تشغيل السطح من أغطية
ملاحظة: تم وصف هذه العملية سابقا في بروتوكولات فيديو JoVE الأخرى16,17. يصف هذا البروتوكول نسخة معدلة من الإجراء مع تغييرات طفيفة لاستيعاب شريحة زجاجية أصغر. انظر جدول المواد لمعرفة المواد الأخرى المطلوبة لتشغيل سطح أغطية الغطاء.
- ضع 5 أغطية في كل حامل غطاء. تأكد من تخطي مسافة واحدة بين كل زوج من أغطية الغطاء حتى لا تلتصق ببعضها البعض. ضع أغطية الغطاء في حاملها في برطمان بغطاء ، وأضف الإيثانول إلى البرطمان حتى يتم تغطية أغطية الغطاء ، وقم بربط الجزء العلوي بإحكام. ضع الجرة بأكملها في الماء في صوتنة الحمام ، دون غمرها بالكامل ، وصوتنة لمدة 30 دقيقة.
- املأ دورقا أو برطمانا نظيفا بالماء عالي النقاء. استخدم ملاقط معدنية لإزالة أغطية الغطاء في حاملها من الإيثانول ، وغمرها في الماء لشطفها. بعد ذلك ، انقل أغطية الغطاء والحامل إلى برطمان يحتوي على محلول هيدروكسيد البوتاسيوم (KOH) 1 M. قم بربط الجزء العلوي بإحكام ، ضع الجرة في حمام الصوتنة ، وقم بصوتنة لمدة 30 دقيقة.
ملاحظة: توخ الحذر عند التعامل مع محلول KOH لأنه يسبب التآكل والمهيج. - كرر صوتنة في محلول الإيثانول و KOH ، وشطف أغطية في الماء كما هو موضح أعلاه بين كل خطوة.
- انقل أغطية الغطاء في حاملها إلى برطمان نظيف مملوء بالأسيتون النقي. قم بإنهاء التنظيف عن طريق صوتنة الجرة كما هو موضح أعلاه لمدة 30 دقيقة. لا تشطف بالماء بعد هذه الخطوة.
- باستخدام ملاقط معدنية ، انقل أغطية الغطاء في حاملها إلى دورق نظيف سعة 100 مل يحتوي على 80 مل من الأسيتون الطازج وقضيب تقليب صغير. ضع الدورق على لوحة تحريك مغناطيسية مضبوطة على 1000 دورة في الدقيقة على الأقل. أثناء تقليب الأسيتون بقوة ، قم بسحب 1.6 مل من 3-أمينوبروبيل ثلاثي إيثوكسيسيلان (APTES) في الدورق لصنع محلول 2٪ v / v.
ملاحظة: توخ الحذر عند سحب APTES لأنه يسبب التآكل. - اسمح لأغطية الغطاء بالاحتضان في المحلول لمدة 2 دقيقة ، ثم استخدم ملاقط معدنية لنقل أغطية الغطاء في حاملها إلى دورق من الماء لإخماد التفاعل. شطف الغطاءزلات مرتين أخريين ، واستبدال الماء في الدورق.
- يعالج الزجاج المسيلاني في الفرن على حرارة 120 درجة مئوية لمدة 75 دقيقة. إذا لم تستمر إلى الخطوة التالية على الفور ، فقم بتخزين أغطية الغطاء تحت المكنسة الكهربائية لمدة أقصاها بضعة أيام.
- قم بإذابة البولي إيثيلين جلايكول المشتق من الإستر N-hydroxysuccinimide (NHS) في بيكربونات الصوديوم 100 mM (الرقم الهيدروجيني 8.2). استخدم نسبة 10: 1 من PEG المنتهي بالميثوكسي إلى PEG المنتهي بالبيوتين ، مع ~ 100 مجم / مل من PEG المنتهي بالميثوكسي.
- ماصة 100 ميكرولتر من محلول PEG على نصف أغطية الغطاء الجافة ، وقم بتغطية كل واحدة بغطاء ثان. استخدم قطعا صغيرة من البارافيلم موضوعة في كل زاوية كفواصل لمنع أغطية الغطاء من الالتصاق ببعضها البعض.
- احتضان أغطية في بيئة رطبة لمدة 3.5 ساعة. افصل شطائر الغطاء. استخدم زجاجة بخ لغسل كل غطاء بماء غزير وتجفيفه بالهواء المضغوط.
- قم بتخزين أغطية وظيفية تحت المكنسة الكهربائية. تأكد من إبقاء الجانب المعالج ب PEG لأعلى لأن الجانب الآخر لن يلتقط ركيزة الحمض النووي.
4. بناء جهاز الموائع الدقيقة
ملاحظة: انظر جدول المواد للمواد الأخرى المطلوبة لبناء جهاز الموائع الدقيقة.
- باستخدام أداة دوارة متعددة الأدوات محمولة باليد مزودة بلقمة عجلة ماسية مدببة ، قم بحفر فتحتين في الزوايا المقابلة لشريحة الكوارتز لتكون بمثابة مدخل ومخرج. تأكد من تثبيت الشريحة في مكانها ، وتليين اللقمة ، والانزلاق باستمرار بالماء أثناء الحفر. بعد كل تجربة ، استرجع شريحة الكوارتز المعدة لإعادة استخدامها عن طريق نقع جهاز مستخدم في الأسيتون لإذابة المادة اللاصقة والإيبوكسي ؛ تجاهل المكونات المتبقية.
ملاحظة: يمكن إجراء الحفر يدويا ، لكن استخدام حامل نمط الضغط للأدوات المتعددة يجعل العملية أسهل. - الجمع بين 25 ميكرولتر من محلول الستربتافيدين مع 80 ميكرولتر من PBS و 20 ميكرولتر من المخزن المؤقت للحظر. قم بتغطية غطاء معالج ب PEG بهذا الخليط ، واحتضانه في بيئة رطبة لمدة 30 دقيقة.
- أثناء حضانة الغطاء ، قم بإعداد فاصل التصوير لإنشاء قناة تدفق. قم بقص قطعة مربعة بحجم 1 بوصة من مادة فاصل التصوير ، ثم حدد قناة بعرض 2 مم محاذاة إلى نهايات الثقوب المحفورة في شريحة الكوارتز (الشكل 2). اقطع القناة من مادة الفاصل بمشرط.
- قشر جانبا واحدا من الدعم من فاصل الصورة ، وضعه بعناية على شريحة الكوارتز ، مع الحرص على عدم تغطية فتحات المدخل والمخرج. تأكد من تنظيف شريحة الكوارتز جيدا باستخدام الأسيتون لإزالة أي بقايا من المادة اللاصقة من التجارب السابقة.
- اغسل غطاء الغطاء بالماء وجففه بالهواء المضغوط. قم بإزالة الجانب الآخر من الدعم من فاصل التصوير ، وقم بشطره بين شريحة الكوارتز وغطاء الغطاء الوظيفي المطلي بالستربتافيدين ، باستخدام الملقط البلاستيكي للضغط على المجموعة معا وإزالة فقاعات الهواء من المادة اللاصقة.
- أدخل أنبوبا واحدا من البولي إيثيلين بطول 30 سم في كل فتحة في شريحة الكوارتز. تأكد من قطع نهايات الأنبوب بزاوية لضمان التدفق الحر للمحلول. استخدم رفا أنبوبيا أو أي دعم آخر لتثبيت الأنابيب في مكانها ، وأغلق الأنابيب في مكانها وحواف الجهاز المجمع بالإيبوكسي.
ملاحظة: يعمل بشكل جيد لبناء الجهاز على قطعة من parafilm ، والتي يمكن تقشيرها بسهولة من القاع عندما يتم ضبط الإيبوكسي. - بمجرد ضبط الإيبوكسي ، أدخل الإبرة الحادة على المحقنة الفارغة في أنبوب مخرج الجهاز ، واغمر نهاية أنبوب المدخل في وعاء مملوء بمخزن مؤقت مانع. اسحب مكبس المحقنة لملء الجهاز بمخزن مؤقت للحظر. اترك الجهاز لاحتضانه لمدة 30 دقيقة على الأقل قبل الاستخدام.
5. الربط السطحي لركيزة الحمض النووي ذات النقاط الكمومية
ملاحظة: إلى جانب جهاز الموائع الدقيقة ، وركيزة الحمض النووي ، والمخزن المؤقت المانع الموصوف أعلاه ، انظر جدول المواد للمواد الأخرى والجدول 1 للمخازن المؤقتة المطلوبة للربط السطحي لركائز الحمض النووي ذات النقاط الكمومية.
- قم بتوصيل جهاز الموائع الدقيقة بلوحة مرحلة المجهر بشريط ، واجعل الهدف ملامسا لقاع الجهاز ، وضع الهدف بحيث يكون مجال الرؤية داخل قناة الموائع الدقيقة.
- اغسل قناة الموائع الدقيقة بمخزن مؤقت جديد عن طريق سحب مكبس المحقنة للخلف بعد توصيل أنبوب المخرج بمضخة المحقنة. تحقق للتأكد من عدم وجود فقاعات محاصرة في الأنبوب أو في القناة.
ملاحظة: من هذه النقطة فصاعدا ، تأكد من أن أنبوب المدخل في سائل حتى لا يتم إدخال فقاعات هواء في الجهاز. - تمييع 1 ميكرولتر من ركيزة الحمض النووي المحضرة إلى 1 مل من المخزن المؤقت للحظر. ضع أنبوب المدخل في ركيزة الحمض النووي المخففة ، واتدفق 800 ميكرولتر من محلول الركيزة عبر القناة بمعدل 200 ميكرولتر / دقيقة. اترك محلول الحمض النووي يحتضن في القناة دون عائق لمدة 15 دقيقة بعد توقف التدفق.
- تدفق ما لا يقل عن 800 ميكرولتر من المخزن المؤقت المانع عبر القناة بمعدل 200 ميكرولتر / دقيقة لشطف الحمض النووي غير المرتبط خارج القناة.
- اضبط طاقة الليزر وتركيز المجهر وزاوية TIRF بحيث تكون النقاط الكمومية المربوطة بالسطح مرئية بوضوح.
ملاحظة: على الرغم من أن النقاط الكمومية لا تبيض بسرعة ، فمن الأفضل الحفاظ على الطاقة منخفضة قدر الإمكان لتقليل الوميض.
6. انقسام الحمض النووي بوساطة REase
ملاحظة: انظر جدول المواد للمواد والجدول 1 للمخازن المؤقتة المطلوبة لانقسام الحمض النووي بوساطة REase.
- تأكد من تبريد الكاميرا إلى درجة حرارة التشغيل المثلى وإعدادها للبث عالي السرعة مع وقت تعرض يبلغ 0.10 ثانية. كن مستعدا لجمع البيانات لمدة ~ 4 دقائق.
- اغسل جهاز الموائع الدقيقة ب 800 ميكرولتر من المخزن المؤقت التجريبي بدون المغنيسيوم بمعدل تدفق 200 ميكرولتر / دقيقة.
- أضف REase إلى قسمة (1 مل) من المخزن المؤقت التجريبي بدون مغنيسيوم ، واخلطه برفق عن طريق الماصة. استخدم 4 ميكرولتر من مخزون 100000 وحدة / مل ، وهو ما يتوافق مع 400 وحدة / مل من EcoRV. تدفق 800 ميكرولتر من الإنزيم المخفف عبر القناة بمعدل تدفق 200 ميكرولتر / دقيقة.
- ابدأ التجربة بتدفق المخزن المؤقت التجريبي الذي يحتوي على المغنيسيوم والفلوريسئين بمعدل تدفق 200 ميكرولتر / دقيقة. ابدأ في التقاط البيانات فور بدء تشغيل مضخة المحقنة. بعد تدفق 800 ميكرولتر من المخزن المؤقت ، توقف عن الحصول على البيانات.
7. تحليل البيانات
ملاحظة: راجع جدول المواد الخاص ببرنامج تحليل البيانات المستخدم لهذا البروتوكول ، وقم بإجراء التعديلات في حالة استخدام نظام أساسي تحليل مختلف.
- تحديد نقطة زمنية صفرية
- اطرح مضان الخلفية من كل إطار من الفيلم التجريبي باستخدام وظيفة imtophat ، وهي وظيفة تصفية القبعة العلوية المورفولوجية المضمنة في مربع أدوات معالجة الصور. حدد قرصا بنصف قطر ثلاثة بكسل كعنصر هيكلي. احصل على كثافة الخلفية عن طريق طرح الصورة التي تمت تصفيتها من الصورة الأصلية.
ملاحظة: يحتفظ الفلتر فقط بميزات الصورة الأكثر سطوعا من الخلفية والأصغر من عنصر الهيكلة. - متوسط الخلفية المطروحة على كل إطار فيلم. استخدم مسارا لهذه القيمة لتحديد نقطة الصفر الزمنية للتجربة (الشكل 3 أ). حدد وقت البدء من خلال إيجاد الإطار الأول الذي يتجاوز فيه معدل الزيادة 3x الانحراف المعياري لمعدل التغيير أثناء تدفق الحجم الميت.
ملاحظة: تشير الزيادة الحادة في معدل التغير في متوسط قيمة الخلفية المطروحة لكل إطار فيلم إلى الوقت الذي دخل فيه المخزن المؤقت التجريبي النهائي الذي يحتوي على صبغة التتبع إلى خلية التدفق (الشكل 3B).
- اطرح مضان الخلفية من كل إطار من الفيلم التجريبي باستخدام وظيفة imtophat ، وهي وظيفة تصفية القبعة العلوية المورفولوجية المضمنة في مربع أدوات معالجة الصور. حدد قرصا بنصف قطر ثلاثة بكسل كعنصر هيكلي. احصل على كثافة الخلفية عن طريق طرح الصورة التي تمت تصفيتها من الصورة الأصلية.
- حساب وتحليل مسار كثافة النقاط الكمومية
- احسب الإسقاط الأقصى الكثافة لمجموعة إطارات الأفلام المصححة في الخلفية المسجلة قبل وصول صبغة التتبع. حدد مواقع النقاط الكمومية بدقة بكسل واحد في صورة الإسقاط هذه باستخدام دالة تحديد الذروة مثل pkfnd.
- قم بإنشاء مسارات كثافة للنقاط الكمومية الفردية عن طريق حساب متوسط الكثافة في كل إطار فيلم لمنطقة مربعة ثلاث بكسلات لكل جانب يحيط بالموقع الذي يتم إرجاعه بواسطة وظيفة تحديد الذروة.
ملاحظة: يزيل تصحيح الخلفية الموضح أعلاه القطع الأثرية التي أدخلتها صبغة التتبع. يجب أن تكون مسارات الشدة الناتجة مسطحة نسبيا ، ولكنها لا تزال تتضمن تقلبات شدة تحدث بشكل طبيعي (الشكل 4). - تحديد أحداث اختفاء النقاط الكمومية عن طريق التحليل الإحصائي لمسارات الشدة. لكل مسار كثافة نقطة كمومية ، احسب شدة عتبة أعلى من الحد الأدنى للقيمة بجزء مناسب من الفرق بين القيم القصوى والدنيا لهذا المسار ، اعتمادا على الضوضاء التي لوحظت في المسارات.
ملاحظة: عادة ما يكون تذبذب شدة النقطة الكمومية أكبر بكثير من تذبذب الخلفية. يمكن تحديد القيمة المناسبة من خلال مقارنة هذه القيم: يجب أن تكون العتبة المحددة أعلى من أعلى قيمة خلفية ، ولكن من الناحية المثالية تكون أقل من أدنى قيمة لتألق النقاط الكمومية. وبالنسبة للبيانات المقدمة، حسبت العتبة المستخدمة لتكون أعلى من القيمة الدنيا لكل مسار مضافا إليها ثلث الفرق بين القيم القصوى والدنيا لذلك المسار. يمكن اعتبار النقطة الكمومية تختفي في آخر نقطة زمنية كانت فيها الكثافة المرصودة في موقعها أعلى من هذه العتبة. - تأكيد أحداث الاختفاء المفترضة. قم بتضمين الأحداث في التحليل النهائي فقط إذا كانت الشدة المرصودة أعلى من نقطة المنتصف بين قيم الحد الأدنى والحد الأقصى للكثافة للمسار لأكثر من نصف إطارات الفيلم قبل وقت الاختفاء وانخفض الانحراف المعياري لمسار الشدة بعد الحدث.
ملاحظة: يمكن استخدام اختبارات إحصائية أخرى لضمان تسجيل أحداث الاختفاء الصالحة فقط.
النتائج
تقترن خلية التدفق مباشرة بهدف تكبير 60x بفتحة عددية عالية الفتحة على مجهر مقلوب مزود بإضاءة ليزر للتصوير من خلال الهدف TIRF (الشكل 5A). بعد إدخال ركيزة الحمض النووي والتخلص من الحمض النووي الزائد والنقاط الكمومية ، يوجد عادة الآلاف من النقاط الكمومية الفردية في مجال الرؤية (الشكل 5 ب). ترتبط هذه النقاط الكمومية بثبات بالسطح الزجاجي ، ولا تخضع لتعتيم ملحوظ أو ابيضاض كبير على النطاق الزمني للتجربة. ومع ذلك ، إذا تم تدفق مخزن مؤقت يحتوي على كل من المغنيسيوم و REase المناسب عبر قناة التدفق ، في نهاية فترة مراقبة نموذجية مدتها أربع دقائق ، فإن 30٪ على الأقل من النقاط الكمومية الموجودة في بداية التجربة ستختفي من مجال الرؤية. تأكيدا لمتطلبات المغنيسيوم ، عندما يتدفق REase عبر القناة في غياب المغنيسيوم ، لا يزال من الممكن رؤية 95٪ على الأقل من النقاط الكمومية الموجودة في بداية التجربة في نهاية فترة المراقبة (الشكل 5C). ومع ذلك ، عندما يتم تدفق المخزن المؤقت المحتوي على المغنيسيوم مباشرة بعد السماح ل REase بربط الحمض النووي المرتبط بالسطح في غياب المغنيسيوم ، فإن ما يصل إلى نصف النقاط الكمومية ستختفي بنهاية فترة المراقبة (الشكل 5D) ، على غرار ما لوحظ عندما تم تدفق REase والمغنيسيوم عبر القناة معا. يعتمد العائد الدقيق للأحداث على كفاءة الإنزيم في ظل الظروف المستخدمة. عندما يتم تدفق المخزن المؤقت المحتوي على المغنيسيوم دون إدخال REase المناسب مسبقا في قناة التدفق ، يختفي أقل من 5٪ من النقاط الكمومية خلال فترة المراقبة ، ولا توجد ذروة ملحوظة لرسم بياني للأحداث. تشير هذه النتيجة إلى أن جزيئات REase المسبقة تتوسط انقسام الحمض النووي الذي يربط النقاط الكمومية بسطح الزجاج ، وهذا الانقسام في الحمض النووي مسؤول عن الغالبية العظمى من أحداث اختفاء النقاط الكمومية المرصودة في هذه التجارب.
يحدث اختفاء النقاط الكمومية بسرعة ويؤدي إلى انخفاض حاد في مسار الشدة ، مما يوفر مؤشرا واضحا على الوقت الذي يتم فيه شق جزيء الحمض النووي المعين (الشكل 5E). يتم تحديد أوقات الأحداث عن طريق التحليل الرياضي لمسارات الشدة. تولد النقاط الكمومية المفردة مسارات شدة ذات تباين أعلى بكثير من الخلفية في ظل ظروف الصورة المستخدمة ، لذلك يتم تأكيد الأحداث المفترضة عندما ينخفض تباين مسار الشدة إلى مستوى مماثل لتباين الخلفية بعد انخفاض الكثافة المرصود. بالإضافة إلى ذلك ، يتم استبعاد المسارات التي تتضمن درجة كبيرة من الوميض قبل حدث الاختفاء المفترض من التحليل النهائي. ومع ذلك ، فإن التجربة النموذجية تؤدي إلى مئات الأحداث التي تفي بهذه المعايير ، ويمكن تجميع نتائج التجارب المتعددة لتوفير إحصائيات كافية للسماح بتقدير المعلمات N و β إما عن طريق تركيب منحنى المربعات الصغرى غير الخطية أو تقدير معلمة الاحتمال الأقصى.
تم جمع البيانات التمثيلية المقدمة من خلال إجراء هذه التجربة باستخدام النوع IIP REase المدروس جيدا ، EcoRV (الفيديو 1). تم إنشاء ركيزة الحمض النووي المزدوجة التي يبلغ طولها 60 نقطة أساس بجزيء بيوتين على طرف 5 'من شريط واحد من الازدواج ونقطة كمومية متصلة تساهميا بنهاية 5 'من الشريط الآخر. تحتوي ركيزة الحمض النووي على نسخة واحدة من تسلسل التعرف ، GAT↓ATC ، والتي يتم شقها بواسطة EcoRV في المنتصف ، كما هو موضح بالسهم المتجه لأسفل (↓). كان EcoRV مرتبطا بركيزة الحمض النووي في غياب المغنيسيوم ، ثم تم تدفق المخزن المؤقت المحتوي على المغنيسيوم لبدء انقسام الحمض النووي. تتضمن البيانات التمثيلية النتائج المجمعة لخمس تجارب منفصلة ، مما أسفر عن ما مجموعه 3451 حدث انشقاق ملحوظ. بعد استبعاد الأحداث التي وقعت قبل نقطة الصفر الزمنية أو خارج ذروة النشاط البارزة ، بقي 2987 حدثا ، والتي كانت كافية لملء مدرج تكراري بصناديق ثانية واحدة. تم استخدام كل من تركيب منحنى المربعات الصغرى غير الخطية وتقدير معلمة الاحتمال الأقصى لاستخراج قيم N و β من البيانات. كانت طريقتا تقدير المعلمات متفقتين (الشكل 6 أ) ، مع N = 3.52 (فاصل ثقة 95٪: 3.32-3.71) و β = 5.78 ثانية (فاصل ثقة 95٪: 5.41-6.15 ثانية) لتناسب المربعات الصغرى غير الخطية و N = 3.41 (فاصل ثقة 95٪: 3.25-3.58) و β = 6.06 ثانية (فاصل ثقة 95٪: 5.75-6.39 ثانية) لتقدير الاحتمال الأقصى.
تقدير ثلاث خطوات حركية على الأقل معقول بالنظر إلى ما هو معروف عن آلية EcoRV. من المعروف أن هذا الإنزيم يربط الحمض النووي بشكل غير محدد في غياب المغنيسيوم14. أشارت ملاحظات مرحلة الحل السائب للتغيرات في التألق الجوهري لبقايا التربتوفان في EcoRV في ظل ظروف التدفق المتوقف إلى أن EcoRV الذي ارتبط بالحمض النووي في غياب المغنيسيوم يجب أن يخضع لتغيير مطابق قبل دخول المغنيسيوم إلى الموقع النشط18. وتؤكد هذه الملاحظة بيانات البنية البلورية19. تشير نتائج دراسات مضان التربتوفان أيضا إلى أن انقسام الحمض النووي وإطلاق المنتج هما خطوتان منفصلتان تحدثان بمعدلات مماثلة18. لذلك ، فإن آلية التفاعل المعقولة لانقسام الحمض النووي بوساطة EcoRV في هذه التجربة هي:
ES → ES * → EP → E + P
في هذه الآلية ، يتم تشكيل ES ، مركب الإنزيم والركيزة الأولي ، عندما يتم ربط EcoRV بالحمض النووي في غياب المغنيسيوم. عندما يدخل المغنيسيوم إلى خلية التدفق ، يخضع مركب الإنزيم والركيزة لتغيير مطابق ليصبح ES * ، مركب الإنزيم والركيزة المنشط. ثم يشق هذا المركب المنشط الحمض النووي ، لكنه لا يطلق جزيئات المنتج على الفور ، ليصبح مركب إنزيم ناتج (EP). أخيرا ، يتم تحرير المنتج ، P ، في الخطوة الأخيرة. تتطلب هذه الآلية ثلاث خطوات ، والتي تتفق مع البيانات المقدمة. التقدير الناتج لمتوسط وقت الانتظار لكل خطوة هو ~ 6 s ، أي ما يعادل معدل 0.17 s-1 لكل خطوة. يتفق هذا الحساب بشكل عام مع التقديرات السابقة لمعدلات هذه العمليات - بترتيب 0.3-0.4 s-1 لانقسام الحمض النووي وإطلاق المنتج و ~ 0.5 s-1 لإعادة الترتيب المطابق.

الشكل 1: مخطط الحمض النووي (DNA) وتفاعل الإنزيم المشار إليهما. يتم ربط جزيئات الحمض النووي ذات النقاط الكمومية بالسطح الزجاجي الوظيفي عبر ارتباط البيوتين والستربتافيدين والبيوتين ويتم ملاحظتها باستخدام مجهر TIRF. تحتوي جزيئات الحمض النووي (DNA) على موقع التعرف على REase محل الاهتمام. عندما ينشق جزيء الحمض النووي بواسطة REase ، تكون النقطة الكمومية حرة في الانتشار بعيدا عن السطح وخارج منطقة الإضاءة. الاختصارات: REase = تقييد النوكلياز. PEG = البولي إيثيلين جلايكول ؛ TIRF = مضان الانعكاس الداخلي الكلي. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: جهاز خلية تدفق الموائع الدقيقة. (أ) منظر منفجر يوضح الطبقات الثلاث المستخدمة لإنشاء الجهاز: الغطاء الزجاجي الوظيفي في الأسفل ، وشريحة الكوارتز مع فتحات مدخل ومخرج في الأعلى ، وفاصل التصوير اللاصق على الوجهين مع قناة مقطوعة فيه محصورة في المنتصف. (ب) جهاز مكتمل مع أنابيب البولي إيثيلين محكمة الغلق في مكانها وحواف مطلية بالإيبوكسي. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
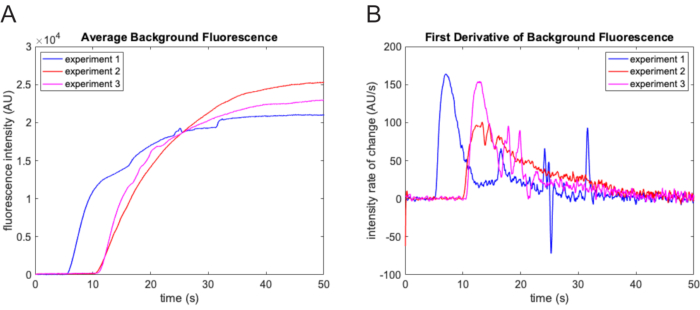
الشكل 3: تحديد نقطة زمنية صفرية. (أ) متوسط كثافة الخلفية كما هو محدد باستخدام وظيفة ترشيح القبعة العلوية المورفولوجية على كل إطار من الفيلم. تزداد كثافة الخلفية بشكل ملحوظ عندما يدخل المخزن المؤقت التجريبي الذي يحتوي على الفلوريسئين مجال الرؤية. نتائج ثلاث تجارب مختلفة موضحة هنا. هناك اختلاف كبير في وقت التأخير من تجربة إلى أخرى. (ب) تسهل الزيادة الحادة في معدل تغير مسار شدة مضان الخلفية التحديد الدقيق لنقطة الصفر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 4: تصحيح الخلفية. يمكن رؤية الزيادة في كثافة الخلفية بسبب صبغة تتبع الفلوريسئين التي تشير إلى وصول المغنيسيوم في مسارات شدة التألق الخام للنقاط الكمومية الفردية (المسار الرمادي). بعد طرح الخلفية باستخدام وظيفة ترشيح القبعة العلوية المورفولوجية ، تمت إزالة القطع الأثرية التي أدخلتها صبغة التتبع من المسار (المسار الأسود). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 5: تجربة TIRF أحادية الجزيء للملاحظات المتوازية لأحداث انقسام الحمض النووي. (أ) تقترن خلية التدفق المبنية على سطح زجاجي وظيفي مصمم لالتقاط الحمض النووي المسمى بالنقاط الكمومية مباشرة بمجهر غمر زيتي عالي الفتحة 60x لتصوير TIRF. (ب) صورة ممثلة من بداية التجربة. تم تحميل الحمض النووي المسمى بالنقاط الكمومية في خلية التدفق ، وتم غسل النقاط الكمومية الزائدة غير المرتبطة. يمكن حل النقاط الكمومية الفردية المربوطة بالحمض النووي من بعضها البعض. (ج) تم تدفق نفس مجال الرؤية بعد المخزن المؤقت الذي يحتوي على REase قادر على شق حبال الحمض النووي عبر قناة السريان في غياب المغنيسيوم لمدة أربع دقائق. لم يكن هناك فقدان كبير للنقاط الكمومية المربوطة بالحمض النووي. د: مجال الرؤية نفسه في ختام التجربة. تم تدفق المخزن المؤقت المحتوي على المغنيسيوم عبر قناة التدفق مباشرة بعد تدفق REase في مخزن مؤقت خال من المغنيسيوم. تم الحصول على هذه الصورة بعد حوالي أربع دقائق من تدفق المخزن المؤقت. قامت Reases Prebound بشق العديد من حبال الحمض النووي ، مما أدى إلى إطلاق النقاط الكمومية من السطح. لسهولة المشاهدة ، يتم عرض الربع المركزي فقط من مجال الرؤية الموضوعي في كل صورة. تم حساب متوسط عشرة إطارات فيلم (أي ما يعادل ثانية واحدة من وقت الرصد) لتقليل تأثيرات وميض النقاط الكمومية. تتطابق إعدادات السطوع والتباين لجميع الصور الثلاث. ه: مسارات شدة التألق التمثيلية من مواقع الصور التي توجد فيها نقطة كمومية في بداية التجربة. قد تعرض المسارات التي تم الحصول عليها من مواقع الصور المقابلة للنقاط الكمومية التي لم يتم إطلاقها من السطح (الرمادي) انخفاضات قصيرة إلى مستوى كثافة أقل ، لكنها تبدأ وتنتهي عند مستوى كثافة عالية. تظهر المسارات التي تم الحصول عليها من مواقع الصور ، المقابلة للنقاط الكمومية التي يتم إطلاقها من السطح (أسود) ، انخفاضا سريعا في الكثافة إلى مستوى خلفية منخفض يكون فوريا فيما يتعلق بالدقة الزمنية للتجربة (10 هرتز). لا تظهر النقاط الكمومية التي تم إطلاقها مرة أخرى خلال فترة المراقبة التي تبلغ أربع دقائق. الاختصارات: REase = تقييد النوكلياز. TIRF = مضان الانعكاس الداخلي الكلي. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 6: تحليل توزيع وقت السكون لانقسام الحمض النووي بوساطة EcoRV. (أ) الرسم البياني والمظاريف المتوقعة لأحداث الانقسام لعام 2987 التي تحدث داخل ذروة النشاط الرئيسي في مجموعة من خمس تجارب مجمعة مع EcoRV. المنحنيان المتوقعان متطابقان تقريبا ، ولا تشير بقايا الملاءمة (أسفل الرسم البياني) إلى خطأ منهجي في ملاءمة المربعات الصغرى غير الخطية. (ب) مدرج تكراري للمجموعة الكاملة المكونة من ٣٣٩٣ حدثا انشقاقا حدثت بعد نقطة الزمن الصفرية. المنحنى الذي تنبأ به تقدير الاحتمال الأقصى للمعلمات (الخط غير المنقطع ، منحنى MOLE) بافتراض أن توزيع احتمال جاما فشل في إحاطة الرسم البياني. المنحنى الذي تنبأ به تناسب المربعات الصغرى غير الخطية لصيغة توزيع احتمال جاما على ارتفاعات الحاوية (الخط المتقطع ، منحنى NLS) متفوق ، لكن بقايا الملاءمة (أسفل الرسم البياني) تكشف عن خطأ منهجي. الاختصارات: MLE: تقدير الاحتمال الأقصى. NLS = المربعات الصغرى غير الخطية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
| اسم المخزن المؤقت | مكون | تركيز | درجة الحموضة عند 25 درجة مئوية |
| عازلة فوسفات الصوديوم | فوسفات الصوديوم | 100 مللي متر | 8.3 |
| CHES buffer | N-سيكلوهيكسيل-2-أمينوإيثان سلفونيك حمض (CHES) | 10 مللي متر | 9.0 |
| برنامج تلفزيوني | فوسبات الصوديوم | 3 مللي متر | 7.2 - 7.6 |
| كلوريد الصوديوم | 150 مللي متر | ||
| فوسفات البوتاسيوم | 1.05 مللي متر | ||
| التخزين المؤقت | كلوريد الصوديوم | 100 مللي متر | 8.0 |
| تريس حمض الهيدروكلوريك | 50 مللي متر | ||
| ألبومين مصل الأبقار (BSA) | 0.5 مجم / مل | ||
| بيكربونات الصوديوم | بيكربونات الصوديوم | 100 مللي متر | 8.2 |
| حظر المخزن المؤقت | تريس حمض الهيدروكلوريك | 20 مللي متر | 7.5 |
| حمض الإيثيلين ديامينيترايتيك (EDTA) | 2 مللي متر | ||
| كلوريد الصوديوم | 50 مللي متر | ||
| توين -20 | 0.005٪ (فولت / حجم) | ||
| ألبومين مصل الأبقار (BSA) | 0.2 ملغم / مل | ||
| عازلة تجريبية بدون مغنيسيوم | كلوريد الصوديوم | 100 مللي متر | 7.9 |
| تريس حمض الهيدروكلوريك | 50 مللي متر | ||
| ديثيوثريتول (DTT) | 1 مللي متر | ||
| عازلة تجريبية مع المغنيسيوم | كلوريد الصوديوم | 100 مللي متر | 7.9 |
| تريس حمض الهيدروكلوريك | 50 مللي متر | ||
| كلوريد المغنيسيوم | 10 مللي متر | ||
| ديثيوثريتول (DTT) | 1 مللي متر | ||
| فلوريسئين | ضبط وفقا لظروف التصوير | ||
| DNase العازلة | كلوريد المغنيسيوم | 2.5 مللي متر | 7.6 |
| تريس حمض الهيدروكلوريك | 10 مللي متر | ||
| كلوريد الكالسيوم | 0.1 مللي متر |
الجدول 1: جدول المخازن المؤقتة.
فيديو 1: مثال على فيلم أحادي الجزيء. الرجاء الضغط هنا لتحميل هذا الفيديو.
Discussion
يتم تمييز ركيزة الحمض النووي لهذا الفحص بنقطة كمومية باستخدام مخطط تفاعل من خطوتين باستخدام sulfo-SMCC. يتكون هذا الرابط المتشابك ثنائي الوظيفة من مجموعة إستر NHS التي يمكن أن تتفاعل مع أمين أولي ، وجزء ماليميد يمكن أن يتفاعل مع مجموعة سلفهيدريل20. يتم شحن قليل النيوكليوتيدات الثيولية المستخدمة في تحضير الركيزة في شكلها المؤكسد. من المهم تقليلها وتنقيتها ، كما هو موضح ، قبل الشروع في إجراء الاقتران ، أو سيتم تقليل كفاءة تفاعل الاقتران. من الأهمية بمكان تحضير حلول DTT و sulfo-SMCC الجديدة مباشرة قبل الاستخدام. تتحلل هذه الجزيئات بسرعة في محلول مائي. توخ الحذر عند نقل المحاليل من وإلى أجهزة غسيل الكلى - إذا لامس طرف الماصة الغشاء ، فسوف يتسبب ذلك في تمزق ، وستفقد العينة. إنه مثالي لإكمال جميع الخطوات الواردة في القسم 2 دون انقطاع لتجنب فقدان العينة.
تفاعل الاقتران المستخدم لتوليد قليل النوكليوتيد المسمى بالنقاط الكمومية غير فعال. بعد الجمع بين قليل النوكليوتيد المسمى بالنقاط الكمومية وتلدينه مع قليل النوكليوتيد البيوتينيل ، سيكون هناك فائض من الحمض النووي غير المسمى في عينة الركيزة المعدة. على الرغم من أن هذه الأنواع يمكن أن ترتبط بالسطح الوظيفي ، إلا أنها غير مرئية في ظل ظروف التصوير الموصى بها ولا تساهم في قراءة التجربة. للتأكد من أن انشقاق البناء المكتمل يؤدي إلى إطلاق نقاط كمومية من السطح ، قم بإجراء ربط السطح كما هو موضح في القسم 5 من البروتوكول ، وقم بتصوير منطقة من السطح لتحديد عدد النقاط الكمومية الموجودة. بعد ذلك ، تدفق 800 ميكرولتر من حصة 1 مل من 10 وحدة / مل من DNase I في المخزن المؤقت DNase (2.5 mM MgCl2 ؛ 10 mM Tris-HCl ؛ 0.1 mM CaCl2 ، pH 7.6) عبر قناة الموائع الدقيقة. اسمح ل DNase I بالاحتضان في القناة لمدة 15 دقيقة ، واغسلها ب 800 ميكرولتر من المخزن المؤقت DNase (بدون إنزيم) ، وصور نفس المنطقة محل الاهتمام. يجب إطلاق ما يقرب من 90٪ من النقاط الكمومية من السطح إذا تم إعداد البناء والسطح بشكل صحيح.
لربط تساهمي بمزيج من جزيئات PEG المنتهية بالميثوكسي والمنتهية بالبيوتين ، يجب معالجة الأسطح الزجاجية لالتقاط ركيزة الحمض النووي ذات النقاط الكمومية على السطح للتصوير. من المهم للغاية تنفيذ جميع خطوات التنظيف بدقة. يلزم اتخاذ خطوات تنظيف متعددة لإزالة الشوائب السطحية وكشف مجموعات الهيدروكسيل على السطح الزجاجي التي ستتفاعل مع مجموعات الألكوكسي على السيلان لتشكيل روابط تساهمية. في حين أنه من المهم شطف الشرائح بالماء عالي النقاء بين الخطوات النظيفة باستخدام محاليل الإيثانول و KOH ، يجب عدم استخدام الماء بعد التنظيف النهائي باستخدام الأسيتون. إن وجود الماء الزائد أثناء خطوة التكسير سيشجع على تعدد السيلان في المحلول على حساب ربط السطح. بالإضافة إلى ذلك ، يجب عدم إعداد حل silane مسبقا. لإطالة عمرها الإنتاجي ، يجب تخزين مخزون silane في خزانة مجففة.
تم تصميم مقايسة الانقسام أحادي الجزيء ليتم تنفيذها في جهاز الموائع الدقيقة (الشكل 2). قم بتصنيع جهاز جديد قبل كل تجربة ، وأعد استخدام شريحة الكوارتز المحفورة التي تشكل الجزء العلوي من الجهاز. تم وصف هذا الإجراء سابقا16،17 وتستخدم اختلافاته على نطاق واسع في الفحص المجهري TIRF. تم تكييف الإجراء الموصوف هنا لاستيعاب شرائح مربعة مقاس 1 بوصة. من المهم العمل بسرعة لبناء الجهاز حتى لا يتحلل السطح الوظيفي أثناء تعرضه للهواء. الايبوكسي فلورسنت ، لذا احرص على تجنب تغطية القناة به. يمكن استرداد شريحة الكوارتز المحفورة لإعادة استخدامها عن طريق نقع الجهاز المستخدم في الأسيتون وتفكيكه.
تم تصميم هذا الفحص ليتم تنفيذه على مجهر مقلوب يتمتع بقدرات إضاءة انعكاس داخلي كلية موضوعية مزودة بكاميرا جهاز اقتران الشحنة المضاعفة بالإلكترون (EMCCD) لجمع البيانات. استخدم هدف فتحة عددية عالية 60x ، ومصدر إثارة ليزر 488 نانومتر ، واستخدم مكعب مرشح يتضمن مرشح انبعاث أحادي النطاق وثنائي اللون أحادي الحافة مناسب لليزر ، ومرشح انبعاث يسمح لكل من مضان النقاط الكمومية (ذروة الانبعاث عند 655 نانومتر) وعلى الأقل بعض مضان الفلوريسئين (ذروة الانبعاث عند 512 نانومتر) للمرور. على سبيل المثال ، تم جمع البيانات المقدمة هنا باستخدام مكعب مرشح مزود بمرشح إثارة أحادي النطاق 482/18 نانومتر ، وثنائي اللون أحادي الحافة 488 نانومتر ، ومرشح انبعاث نطاق واحد 675/67 نانومتر. يمكن إجراء الفحص عن طريق التصوير في قناة طيفية واحدة ، كما هو موضح في هذا البروتوكول. إذا رغبت في ذلك ، يمكن أيضا إجراء الفحص عن طريق تقسيم الصورة الفلورية إلى قناتين طيفيتين ، واحدة للنقاط الكمومية ، والأخرى لانبعاث الفلورسين. سيكون مقسم الصور المزود بمرآة ثنائية اللون أحادية الحافة 640 نانومتر مناسبا لهذا الغرض. ومع ذلك ، التصوير متعدد القنوات غير مطلوب.
من المهم غسل أي ركائز DNA غير مربوطة من القناة قبل بدء التجربة. يتم تضمين الفلوريسئين بتركيز 50 ميكرومتر في المخزن المؤقت النهائي للإشارة إلى وصول المغنيسيوم إلى مجال الرؤية. اعتمادا على إعداد المجهر ، قد يكون من الضروري ضبط تركيز الفلوريسئين بحيث لا يحجب انبعاثه النقاط الكمومية. تأكد من البدء في الحصول على البيانات فور بدء تدفق المخزن المؤقت المحتوي على المغنيسيوم. تسجيل البيانات خلال فترة التأخير قبل وصول المخزن المؤقت المحتوي على المغنيسيوم بحيث يمكن حساب المتوسط والانحراف المعياري لمعدل التغيير في شدة الخلفية لتسهيل التحديد الدقيق لنقطة الصفر. لاحظ أن النقطة الزمنية الصفرية الأكثر دقة هي الإطار الأول الذي يتجاوز فيه معدل تغير مضان الخلفية التقلبات الطبيعية في هذا القياس. تستمر شدة مضان الخلفية في الزيادة بعد هذه النقطة حيث ينتشر الفلوريسئين عبر الطبقة الحدودية التي أنشأها التدفق الصفحي في القناة. ينتشر المغنيسيوم ، وهو أصغر بكثير من الفلوريسئين ، بسرعة أكبر ، ويمكن توقع أن يصل تركيزه إلى التوازن بسرعة أكبر.
بالنسبة لمثال البيانات المقدمة ، يعرض الرسم البياني لجميع الأحداث ال 3393 التي حدثت بعد نقطة الصفر الزمنية قمة بارزة خلال أول 60 ثانية من التجارب. لا تحتوي العديد من الصناديق المقابلة لأوقات التأخير الأطول على أي أحداث ، وتلك الصناديق التي تحتوي على أحداث تحتوي على عدد قليل فقط ، على غرار ما يتم ملاحظته عند عدم وجود REase نشط. أدى تناسب منحنى المربعات الصغرى غير الخطي لتوزيع احتمال جاما على جميع البيانات المثبتة إلى تقديرات المعلمات N = 3.06 ، مع فاصل ثقة 95٪ من 2.94-3.18 ، و β = 7.04 ثانية ، مع فاصل ثقة 95٪ من 6.72-7.36 ثانية. ومع ذلك ، كانت تقديرات الاحتمال الأقصى للمعلمات N = 1.30 (فاصل الثقة 95٪: 1.24-1.35) و β = 26.7 ثانية (فاصل الثقة 95٪: 25.3-28.1 ثانية) ، ومن خلال الفحص البصري ، فإن المنحنى الذي تنبأ به تقدير معلمة الاحتمال الأقصى لا يتطابق مع البيانات جيدا (الشكل 6 ب). علاوة على ذلك ، على الرغم من أن المنحنى الذي تنبأت به المعلمات المقدرة بواسطة تركيب المربعات الصغرى غير الخطية يتبع شكل الرسم البياني لترددات الأحداث المرصودة بشكل جيد نسبيا ، فإن البقايا (الفرق بين ترددات الأحداث المرصودة والمتوقعة) تصبح إيجابية باستمرار للنقاط الزمنية التي تتجاوز حوالي 60 ثانية (الشكل 6 ب).
نظرا لأن تواتر الأحداث في النقاط الزمنية اللاحقة يمكن مقارنته بتكرار اختفاء النقاط الكمومية الذي لوحظ في غياب الإنزيم النشط ، فمن المحتمل أن تكون معظم هذه الأحداث اللاحقة جزءا من مستوى خلفية منخفض من فقدان النقاط الكمومية التي لا تسببها انقسام الحمض النووي بوساطة REase. لذلك من المعقول استبعاد تلك الصناديق من التركيب. عندما تم استبعاد جميع الأحداث التي وقعت بعد أكثر من 60 ثانية من نقطة الصفر الزمنية لكل تجربة ، كانت طريقتا تقدير المعلمات متفقتين (الشكل 6 أ). لذلك، لتحقيق أفضل تقديرات المعلمات، استبعد الأحداث خارج ذروة النشاط، وتأكد من أن تقدير معلمة الاحتمال الأقصى ونتائج ملاءمة منحنى المربعات الصغرى غير الخطية قد تقاربت.
يسمح النهج التجريبي الموضح في هذه الورقة بالملاحظات في الوقت الفعلي لانقسام الحمض النووي بوساطة REase على مستوى الجزيء الواحد. يمكن ملاحظة مئات الأحداث في كل تجربة فردية ، ويمكن تجميع نتائج العديد من التجارب للحصول على العدد الكبير من الملاحظات المطلوبة لتوصيف توزيع أوقات الانتظار عن طريق ملاءمة البيانات لتوزيع احتمال جاما. في حين أن هذا الفحص لا يمكن استخدامه إلا كما هو موضح مع REases التي ترتبط ولكن لا تشق الحمض النووي في غياب المغنيسيوم أو عامل مساعد آخر ، فإن العديد من REases تندرج في هذه الفئة. من المهم أن ندرك أن التفاصيل الدقيقة لجميع الخطوات الوسيطة لن يتم الكشف عنها من خلال هذا الفحص. لن تؤثر الخطوات الأسرع بكثير من خطوة تحديد المعدل على توزيع وقت السكون ولن تظهر في قيمة N المستخرجة من البيانات12. وبالمثل ، فإن قيمة β التي يمكن استخراجها من البيانات هي متوسط تقريبي لوقت الانتظار للخطوات التي تؤثر على توزيع وقت السكون. قد يختلف وقت الانتظار الفعلي لكل خطوة عن قيمة β12. ومع ذلك ، فإن مقايسة الانقسام أحادي الجزيء الموصوفة في هذه الورقة يمكن أن توفر دليلا على وجود خطوات وسيطة متعددة على طول مسار التفاعل ، حتى لو كان التفاعل الوسيط نفسه لا يمكن ملاحظته مباشرة.
Disclosures
ليس لدى المؤلفين مصالح مالية متنافسة أو تضارب مصالح آخر
Acknowledgements
تم دعم هذا العمل بالجائزة رقم K12GM074869 للتعليم الطبي المستمر من المعهد الوطني للعلوم الطبية العامة. المحتوى هو مسؤولية المؤلفين وحدهم ولا يمثل بالضرورة الآراء الرسمية للمعهد الوطني للعلوم الطبية العامة أو المعاهد الوطنية للصحة.
Materials
| Name | Company | Catalog Number | Comments |
| 3-aminopropyltriethoxysilane (APTS) | Sigma Aldrich | 440140-100ML | Store in dessicator box |
| 5 Minute Epoxy | Devcon | 20845 | use for sealing the microfluidic device |
| acetone | Pharmco | 329000ACS | use for cleaning coverslips |
| bath sonicator | Fisher Scientific | CPXH Model 2800 | catalog number 15-337-410 |
| Beaker, glass, 100 mL | |||
| Benchtop centrifuge | |||
| Biotin-PEG-Succinimidyl Valerate (MW 5,000) | Laysan Bio | BIO-SVA-5K | Succinimidyl valerate has a longer half-life than succinimidyl carbonate |
| biotinylated oligonucleotide | Integrated DNA Technologies | custom - see protocol for design considerations | Request 5' Biotin modification and HPLC purification |
| Bovine Serum Albumin (BSA) | VWR | 0903-5G | prepare a 10 mg/mL solution (aq) and heat to 95 °C before using |
| Centri-Spin-10 Size Exclusion Spin Columns | Princeton Separations | CS-100 or CS-101 | used to purify thiolated oligonucleotides after reducing the disulfide bond |
| Centrifuge tubes 1.5. mL | |||
| Coverslips, 1-inch square glass | |||
| coverslip holders | |||
| diamond point wheel | Dremel | 7134 | use for drilling holes in quartz flow cell topper |
| dithiothreitol (DTT) | Thermo Scientific | A39255 | No-Weigh Format, 7.7 mg/vial |
| drill press rotary tool workstation stand | Dremel | 220-01 | facilitates quartz drilling |
| EcoRV (REase used to generate example data) | New England Biolabs | R0195T or R0195M | Use 100,000 units/mL stock to avoid adding excess glycerol Check REBASE for suppliers of other REases |
| ethanol | various | CAS 64-17-5 | denatured or 95% are acceptable, use for cleaning coverslips |
| Ethylenediaminetetraacetic acid (EDTA) | Sigma Aldrich | EDS | BioUltra, anhydrous, store in dessicator box |
| Flea Micro Spinbar | Fisherbrand | 14-513-65 | 3 mm x 10 mm size to fit beneath coverslip rack |
| fluorescein | Acros Organics | 17324 | use to make experimental buffers |
| gravity convection oven | Binder | 9010-0131 | |
| handheld rotary multitool | Dremel | 8220 | use for drilling holes in quartz flow cell topper |
| ImagEM X2 EM-CCD Camera | Hamamatsu | C9100-23B | air cooling is adequate for this experiment, use HCImage software or similar to control |
| Imaging spacer, double-sided, adhesive | |||
| Jar, glass with screw cap, (approximately 50 mm diameter by 50 mm high) | |||
| magnesium chloride hexahydrate | Fisher Bioreagents | BP214-500 | use to make experimental buffer with magnesium |
| MATLAB software | Data analysis | ||
| metal tweezers | Fisher Brand | 16-100-110 | |
| methoxy-PEG-Succinimidyl Valerate (MW 5,000) | Laysan Bio | M-SVA-5K | Both PEGs should have the same NHS ester so that the rate of reaction is consistent |
| microcentrifuge | Eppendorf | 5424 | |
| multiposition magnetic stirrer | VWR | 12621-022 | |
| N-cyclohexyl-2-aminoethanesulfonic acid (CHES) | Acros Organics | AC20818 | CAS 103-47-9, use to make CHES buffer |
| orbital shaker and heater for microcentrifuge tubes | Q Instruments | 1808-0506 | with 1808-1061 adaptor for 24 x 2.0 mL or 15 x 0.5 mL tubes |
| Parafilm | |||
| PE60 Polyethylene tubing (inner diameter 0.76 mm, outer diameter 1.22 mm) | Intramedic | 6258917 | 22 G blunt needles are a good fit for this tubing size |
| Phosphate-Buffered Saline (PBS) 10x | Sigma Aldrich | P7059 | Use at 1x strength |
| potassium hydroxide | VWR Chemicals BDH | BDH9262 | use a 1 M solution to clean coverslips |
| Qdot 655 ITK Amino (PEG) Quantum Dots | Invitrogen | Q21521MP | |
| Quartz Slide, 1 inch square, 1 mm thick | Electron Microscopy Sciences | 72250-10 | holes must be drilled in the corners for inlet and outlet tubing insertion |
| reinforced plastic tweezers | Rubis | K35a | use for handling coverslips and building microfluidic device |
| SecureSeal Adhesive Sheets | Grace Biolabs | SA-S-1L | cut to form spacer for microfluidic device |
| Single channel syringe pump for microfluidics | New Era Pump Systems | NE-1002X-US | fitted with a 50 mL syringe and a 22 G blunt needle |
| Slide-a-Lyzer MINI Dialysis Devices, 10 kDa MWCO, 0.1 mL | Thermo Scientific | 69570 or 69572 | used for buffer exchange during quantum dot coupling to DNA |
| sodium bicarbonate | EMD Millipore | SX0320 | use to make buffer for surface functionalization; 100 mM, pH 8 |
| sodium chloride | Macron | 7581-12 | use to make experimental buffers |
| Sodium phosphate dibasic solution (BioUltra, 0.5 M in water) | Sigma Aldrich | 94046 | use to make 100 mM sodium phosphate buffer |
| Sodium phosphate monobasic solution (BioUltra, 5M in water) | Sigma Aldrich | 74092 | use to adjust pH of 100 mM sodium phosphate buffer |
| Streptavidin from Streptomyces avidinii | Sigma Aldrich | S4762 | dissolve at 1 mg/mL and store 25 mL aliqouts at -20 ? |
| Sulfosuccinimidyl-4-(N-maleimidomethyl) cyclohexane-1-carboxylate (sulfo-SMCC) | Thermo Scientific | A39268 | No-Weigh Format, 2 mg/vial |
| Syringe fitted with blunt 21 G needle | |||
| Syringe pump | |||
| thiolated oligonucleotide | Integrated DNA Technologies | custom - see protocol for design considerations | Request 5' Thiol Modifier C6 S-S and HPLC purificaiton |
| TIRF imaging system with 488 nm laser illumination | various | custom built | |
| Tris -HCl | Research Products International | T60050 | use to make experimental buffers |
| Tris base | JT Baker | 4101 | use to make experimental buffers |
| Tween-20 | Sigma | P7949 | use to make blocking buffer |
| Ultrapure water | |||
| vortex mixer | VWR | 10153-842 | |
| Wash-N-Dry Coverslip Rack | Electron Microscopy Sciences | 70366-16 | used for surface functionalization of coverslips |
References
- Roberts, R. J. How restriction enzymes became the workhorses of molecular biology. Proceedings of the National Academy of Sciences of the United States of America. 102 (17), 5905-5908 (2005).
- Loenen, W. A., Dryden, D. T., Raleigh, E. A., Wilson, G. G., Murray, N. E. Highlights of the DNA cutters: a short history of the restriction enzymes. Nucleic Acids Research. 42 (1), 3-19 (2014).
- Roberts, R. J., Vincze, T., Posfai, J., Macelis, D. REBASE--a database for DNA restriction and modification: enzymes, genes and genomes. Nucleic Acids Research. 43, Database issue 298-299 (2015).
- Bonnet, I., et al. Sliding and jumping of single EcoRV restriction enzymes on non-cognate DNA. Nucleic Acids Research. 36 (12), 4118-4127 (2008).
- Biebricher, A., Wende, W., Escude, C., Pingoud, A., Desbiolles, P. Tracking of single quantum dot labeled EcoRV sliding along DNA manipulated by double optical tweezers. Biophysical Journal. 96 (8), 50-52 (2009).
- Blainey, P. C., et al. Nonspecifically bound proteins spin while diffusing along DNA. Nature Structural & Molecular Biology. 16 (12), 1224-1229 (2009).
- Huang, C. -F., et al. Direct visualization of DNA recognition by restriction endonuclease EcoRI. Journal of Experimental & Clinical Medicine. 5 (1), 25-29 (2013).
- Palma, M., et al. Selective biomolecular nanoarrays for parallel single-molecule investigations. Journal of American Chemical Society. 133 (20), 7656-7659 (2011).
- Reinhard, B. M., Sheikholeslami, S., Mastroianni, A., Alivisatos, A. P., Liphardt, J. Use of plasmon coupling to reveal the dynamics of DNA bending and cleavage by single EcoRV restriction enzymes. Proceedings of the National Academy of Sciences of the United States of America. 104 (8), 2667-2672 (2007).
- van den Broek, B., Noom, M. C., Wuite, G. J. DNA-tension dependence of restriction enzyme activity reveals mechanochemical properties of the reaction pathway. Nucleic Acids Research. 33 (8), 2676-2684 (2005).
- Gambino, S., et al. A single molecule assay for measuring site-specific DNA cleavage. Analytical Biochemistry. 495, 3-5 (2016).
- Floyd, D. L., Harrison, S. C., van Oijen, A. M. Analysis of kinetic intermediates in single-particle dwell-time distributions. Biophysical Journal. 99 (2), 360-366 (2010).
- Loparo, J. J., van Oijen, A. Single-molecule enzymology. Handbook of Single-Molecule Biophysics. Hinterdorfer, P., Oijen, A. , Springer. New York, NY. 165-182 (2009).
- Taylor, J. D., Badcoe, I. G., Clarke, A. R., Halford, S. E. EcoRV restriction endonuclease binds all DNA sequences with equal affinity. Biochemistry. 30 (36), 8743-8753 (1991).
- Pingoud, A., Jeltsch, A. Structure and function of type II restriction endonucleases. Nucleic Acids Research. 29 (18), 3705-3727 (2001).
- Tanner, N. A., Loparo, J. J., van Oijen, A. M. Visualizing single-molecule DNA replication with fluorescence microscopy. Journal of Visualized Experiments: JoVE. (32), e1529(2009).
- Kulczyk, A. W., Tanner, N. A., Loparo, J. J., Richardson, C. C., van Oijen, A. M. Direct observation of enzymes replicating DNA using a single-molecule DNA stretching assay. Journal of Visualized Experiments: JoVE. (37), e1689(2010).
- Baldwin, G. S., Vipond, I. B., Halford, S. E. Rapid reaction analysis of the catalytic cycle of the EcoRV restriction endonuclease. Biochemistry. 34 (2), 705-714 (1995).
- Winkler, F. K., et al. The crystal-structure of Ecorv endonuclease and of Its complexes with cognate and non-cognate DNA fragments. EMBO Journal. 12 (5), 1781-1795 (1993).
- Sioss, J. A., Stoermer, R. L., Sha, M. Y., Keating, C. D. Silica-coated, Au/Ag striped nanowires for bioanalysis. Langmuir. 23 (22), 11334-11341 (2007).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved