Method Article
في المختبر تحليل سومويليشن لدراسة النشاط ليجاسى E3 السومو
In This Article
Summary
خلافا ليجاسيس أوبيكويتين، حددت القليلة سومو E3 ليجاسيس. هذا المعدل في المختبر البروتوكول سومويليشن غير قادرة على تحديد رواية E3 سومو ligases بمقايسة إعادة تشكيل في المختبر .
Abstract
تعديل صغير مثل ubiquitin المعدل (سومو) هو تعديل بوستترانسلاشونال هامة (PTM) الذي يتوسط توصيل الإشارة أساسا عن طريق تحوير تفاعلات البروتين البروتين. مماثلة لتعديل أوبيكويتين، سومويلاتيون من إخراج سلسلة متتابعة إنزيم منها E1-تفعيل إنزيم (SAE1/SAE2) وإنزيم E2-تصريف الأفعال (Ubc9) و E3-ليجاسى (أيالأسرة PIAS، RanBP2 و Pc2). يختلف عن أوبيكويتينيشن، ليجاسى E3 غير الضروري لرد فعل ولكن لا توفر الدقة والفعالية لتصريف السومو. يمكن تحديد البروتينات تعديله من قبل سومويليشن في فيفو مقايسة عبر إيمونوبريسيبيتيشن مع الأجسام المضادة الخاصة بالركيزة وإيمونوبلوتينج مع الأجسام المضادة سومو محددة. ومع ذلك، يتطلب مظاهرة E3 سومو البروتين ليجاسى النشاط في المختبر إعادة تشكيل لفحوصات سومويليشن باستخدام الإنزيمات المنقي والركيزة، والبروتينات السومو. منذ في ردود الفعل في المختبر ، عادة ما SAE1/SAE2 و Ubc9، وحدها كافية لتصريف سومو، تعزيز سومويلاتيون ليجاسى E3 المفترضة ليست دائماً سهلة الكشف. هنا، نحن تصف معدلة في المختبر سومويليشن بروتوكول يحدد استمرار تعديل سومو استخدام نظام في المختبر إعادة تشكيل. بروتوكول خطوة بخطوة لتنقية حفازة نشطة ك-"bzip"، ليجاسى سومو-2/3 E3 فيروسية، يرد أيضا. أنشطة سومويليشن المنقي ك-"bzip" ترد في p53، هدفا السومو معروفة جيدا. لا يمكن فقط استخدام هذا البروتوكول عملية لتوضيح الرواية E3 سومو ليجاسيس، ولكن أيضا للكشف عن خصوصيتها بارالوج "سومو".
Introduction
في البداية اعتبرت التعديل سومو تعديل بوستترانسلاشونال عكسها (PTM) الذي ينظم البروتين الاستقرار1. وبالإضافة إلى الاقتران المباشر، يمكن أيضا إرفاق السومو لبروتين من خلال التفاعل غير التساهمية سومو التفاعل زخارف (سيمز)2. مشابه لربط تيروسيل-الفسفرة من جزيئات إيواء Src التماثل 2 (SH2) أو ملزمة فوسفوتيروسيني (PTB) المجالات3،4، تعديل سومو يوفر منبرا تفاعل إضافي لانتقائية توظيف المحتوية على سيم المستجيب البروتينات5،6. بالإضافة إلى تنظيم توصيل الإشارة، تخدم سومويليشن عوامل النسخي والكروماتين يعيد البناء الجزيئات تعدل التعبير الجيني7،8. وأظهرت الدراسات على نطاق الجينوم سومويليشن أنماط أن التعديل سومو يرتبط ب إيجابية9،10 أو سلبية10،11،النسخ12 التنظيم، جزئيا بسبب خصوصية بارالوجوي سومويلاتيون.
وهناك ثلاثة isoforms السومو الكبرى للبروتين التصريف الحالي في خلايا الثدييات؛ وتشمل هذه سومو-1، وعالية مثلى سومو-2 سومو-3 (المشار إليها سومو-2/3)13. هو عادة مترافق السومو لبقايا يسين (ك) داخل فكرة توافق الآراء ψKxD/ه في البروتين الهدف. شريحة في ligases E3 سومو مسؤولة عن خصوصية بارالوجوي14. خلافا أوبيكويتينيشن المسارات التي تحتوي على مئات E3 ligases، كانت هناك فقط بضع E3 سومو ligases حددت15. سومو E3 ligases تتحدد بخصائص بما في ذلك قدرتها على (ط) ربط Ubc9 و (ثانيا) ربط moiety السومو عبر مجال سيم (ثالثا) تعزيز نقل السومو من Ubc9 على الركازة. غير مطلوب على الإطلاق ل تصريف سومو16ليجاسى E3، ولكن يوفر الركيزة وخصوصية سومو-بارالوجوي. منذ عادة فقط جزء صغير من الركازة مجموع البروتين تعديل سومو، الكشف عن سومويلاتيد البروتينات في فيفو دائماً تحديا. ولذلك، هناك حاجة إلى فحوصات دقيقة واستنساخه بغية توضيح الدالة دقيقة لتعديل السومو.
في المختبر الإنزيم سومويليشن، الذي يقوم بتقييم قدرة Ubc9 المنقي لتحفيز سومويليشن بروتينات الركازة، مقايسة مقبولة تماما لدراسة تعديل سومو17. ومع ذلك، E3 سومو ليجاسى النشاط في معظم الحالات لا يمكن الكشف عنها أو يمكن فقط اكتشاف مع تحور سومو ليجاسى مع نشاط ليجاسى E3 سومو عالية وخصوصية الركازة منخفضة ببروتوكول قياسي بسبب وجود كمية وفيرة من Ubc918 . النجاح الشامل لهذا الفحص يعتمد إلى حد كبير على معايرة دقيقة لتنقية Ubc9. يتم تعديل في المختبر سومويلاتيون المقايسة الموصوفة هنا من سومويلاتيون قياسية البروتوكول (انظر الجدول للمواد). ملاحظة زيادة تعديل سومو العالمية أثناء تنشيط هربس ساركومه كابوزي المرتبطة (كشف) حدا بنا إلى تحديد ليجاسى E3 سومو الفيروسية التي قد تكون مسؤولة عن المتابعة-تنظيم سومويلاتيون. وعقب عرض صغيرة من البروتينات المتفاعلة من الفيروسية E3 سومو ليجاسى ك-"bzip"، اعتبرت p53 الركازة رواية. في هذا البروتوكول، نعرض بالتفصيل في خلايا الحشرات الخطوات التي تشارك في التعبير وتنقية من البرية من نوع ك "bzip"، ليجاسى E3 سومو فيروسية مع خصوصية سومو-2/3. يتم تقييم قدرة المنقي ك-"bzip" لتعزيز سومويلاتيون p53، ركيزة سومو معروفة، حضور المبالغ المخفضة للإنزيمات E1 و E2. استخدام هذا الإنزيم سومويليشن المعدلة، يمكن تعريف الباحثين موثوق بها قدرات ليجاسى السومو E3 لرواية سومويلاتي أو ركائز معروفة، وخطوة أساسية في دراسة البروتين سومويليشن. وعلاوة على ذلك، يساعد هذا الأسلوب تحديد رواية E3 سومو ligases مع النشاط ليجاسى منخفضة ولكن خصوصية الركازة عالية.
Protocol
1-إعداد ثوابت التعبير باكولوفيروس
-
تنقية E3 سومو ليجاسى ك-"bzip" باستنساخ كدنا ك "bzip"19 إلى ناقل باكولوفيروس تعبير مزدوج (انظر الجدول للمواد) مع علامة حانمه الطرفي ن. وقد كان لدينا نجاح استخدام علامة أوكتابيبتيدي (المشار إليها في البروتوكول كناقل-العلامة-ك-"bzip").
ملاحظة: القالب الحمض النووي لاستنساخ ك "bzip" بوليميريز سلسلة من ردود الفعل (الاسترداد) كدنا عكس نسخها من الحمض النووي الريبي معزولة عن الخلايا TREx F3H3-كهيئه الطرق والمواصلات BCBL-1 عقب الدوكسي العلاج20.- نقل كدنا ك-"bzip" كامل طول19 إلى ناقل التعبير المزدوج مع Cpoالأول استنساخ المواقع. Cpo وأنا هضم المنتج بكر و 1 ميكروغرام من ناقلات التعبير المزدوج في 37 درجة مئوية ل 3 ح21.
- فصل واستخراج الحمض النووي هضمها بعد التفريد نسبة 0.8% [اغروس] هلام22. اضطر الإدراج (ك-"bzip") وناقلات بالحمض النووي T4 ليجاسى في 16 درجة مئوية لمدة 30 دقيقة وفقا لإرشادات الشركة المصنعة (انظر الجدول للمواد).
- إضافة 5 ميليلتر من ربط الحمض النووي إلى 50 ميليلتر الخلايا المختصة كولاي "أ" (انظر الجدول للمواد) في أنبوب 1.5 مل. وضعت على الثلج لمدة 30 دقيقة. ثم احتضان 1.5 مل الأنبوبة في حمام مائي 42 درجة مئوية ل 45 s وفورا الأنبوب على الجليد لمدة 3 دقائق.
- إضافة 600 ميليلتر S.O.C. المتوسطة (استخراج الخميرة 0.5% (w/v)، تريبتوني 2% (w/v)، 10 مم كلوريد الصوديوم، 2.5 ملم بوكل، 20 مم MgSO4، والجلوكوز 4% (w/v)) في الأنبوب واحتضان في 37 درجة مئوية ح 1. ثم الطرد المركزي الأنبوب في درجة حرارة الغرفة لمدة 3 دقائق في 600 x ز.
- إزالة المادة طافية، ريسوسبيند بيليه مع 60 ميليلتر لوريا بيرتاني المتوسطة (رطل؛ تريبتوني 1% (w/v)، الخميرة 0.5% (w/v) استخراج، و 85 ملم كلوريد الصوديوم) وانتشرت في رطل أجار لوحات تحتوي على 100 ميكروغرام/مل الأمبيسلّين. احتضان لوحة أجار في 37 درجة مئوية ح 1623،24.
- حدد 1 مستعمرة لتطعيم في المتوسط رطل 5 مل تحتوي على 100 ميكروغرام/مل الأمبيسلّين والثقافة في 37 درجة مئوية ح 16 مع 250 دورة في الدقيقة تهتز. بعد ذلك، استخراج بلازميد، ناقل-العلامة-ك-"bzip"، بمجموعة استخراج بلازميد وفقا لإرشادات الشركة المصنعة (انظر الجدول للمواد).
-
توليد باكميد المؤتلف إيواء العلامة، ك "bzip" بتحويل ناقلات الأمراض-العلامة-ك-"bzip" إلى المختصة كولاي الخلايا "B" (انظر الجدول للمواد).
- خلط 0.2 ميكروغرام المتجهات-العلامة-ك-"bzip" بلازميد و 100 ميليلتر المختصة هاء الخلايا القولونية "ب" في أنبوب 1.5 مل ووضع على الجليد للحد الأدنى 30 احتضان الأنبوب في حمام المياه 42 درجة مئوية ل 45 s وفورا الأنبوب على الجليد لمدة 3 دقائق.
- إضافة 900 ميليلتر من متوسطة S.O.C. في الأنبوب واحتضان في 37 درجة مئوية ح 4 مع تناوب 50 لفة في الدقيقة. بعد ذلك، تأخذ 10 ميليلتر من المتوسط، إضافة ميليلتر 50 إضافية S.O.C المتوسطة وتنتشر على لوحات أجار رطل يحتوي على 50 ميكروغرام/مل كاناميسين، 7 ميكروغرام/مل الجنتاميسين، 10 ميكروغرام/مل التتراسيكلين، 100 ميكروغرام/مل جالاكتوسيداسي الركيزة و 40 ميكروغرام/مل الأيزوبروبيل β-د-1-ثيوجالاكتوبيرانوسيدي (إيبتج )، واحتضان لوحات ل 48 ساعة عند 37 درجة مئوية.
- تطعيم مستعمرة بيضاء واحدة في المتوسط رطل 5 مل تحتوي على 50 ميكروغرام/مل كاناميسين و 7 ميكروغرام/مل الجنتاميسين و 10 ميكروغرام/مل التتراسيكلين. احتضان عند 37 درجة مئوية مع 250 دورة في الدقيقة تهتز ح 16.
- عزل باكميد المؤتلف الحمض النووي إيواء العلامة، ك "bzip" وقياسها كمياً، وإعادة تعليق بتركيز 1 ميكروغرام/ميليلتر25.
-
توليد المؤتلف باكولوفيروسيس الإعراب عن العلامة-ك-"bzip" ميكروغرام 1 ترانسفيكتينج من باكميد المؤتلف الحمض النووي الذي يحتوي على علامة-ك-"bzip" إلى الخلايا Sf9 في بئر واحدة للوحة 6-جيدا.
- البذور 2 × 106 Sf9 الخلايا (انظر الجدول للمواد) في "الحشرات المتوسطة" 2 مل نعمة الموردة مع 10% مصل بقرى الجنين (FBS) والجنتاميسين 1% في كل خير من صفيحة جيدا 6، ثم احتضانها في 27 درجة مئوية ح 1.
- الحفاظ على ثقافة مرحلة سجل الخلايا Sf9 في "الحشرات المتوسطة" لنعمة الموردة مع 10% FBS، الجنتاميسين 1%، والمنظفات 1% C (انظر الجدول للمواد) عند 27 درجة مئوية في تعليق المداري 140 لفة في الدقيقة. حساب عدد الخلايا باستخدام هيموسيتوميتير وتلطيخ تريبان الأزرق؛ خلية السلامة ينبغي أن يتجاوز 95 في المائة. الحفاظ على الخلايا باستخدام سوبكولتيفيشن بنسبة 1:3 كل 2-3 أيام (الكثافة الدنيا ~0.5 x 106 خلايا/مل).
- إضافة 2 ميليلتر باكميد الحمض النووي (1 ميكروغرام/ميليلتر) وخفضت 98 ميليلتر المصل وسائل الإعلام (انظر الجدول للمواد) في أنبوب 2 مل. ثم قم بإضافة 4 كاشف تعداء ميليلتر (انظر الجدول للمواد) إلى الأنبوبة ومزيج جيد. احتضان في درجة حرارة الغرفة لمدة 15 دقيقة.
- أضف هذا الخليط تعداء (104 ميليلتر) في كل بئر، واحتضان عند 27 درجة مئوية ح 12-16.
- قم بإزالة الوسائط استنفدت مع تطلع رقيقة، واستبدال مع 2 مل من "المتوسطة الحشرات" الطازجة النعمة المتوفرة مع الجنتاميسين FBS و 1% 10%. الخلايا Sf9 تلتزم فضفاضة على سطح لوحة ولن يكون مضطربا مع تطلع لطيف.
-
جمع المؤتلف باكولوفيروس بعد تعداء وتضخيم باكولوفيروس للحصول على مخزونات عالية-عيار (P1) لإجراء مزيد من التجارب.
- ح 72 بعد تغيير المتوسطة، كشط Sf9 الخلايا باستخدام رافعة خلية عقيمة، جمع المادة طافية من كل بئر الفردية في أنبوب 1.5 مل ودوامه لمدة 10 ق.
- الطرد المركزي في 4 درجات مئوية لمدة 3 دقائق في 150 غ. س جمع المادة طافية ك P0 باكولوفيروس وقاسمه في أنابيب 1.5 مل (1 مل باكولوفيروس في كل أنبوبة). مخزن في-80 درجة مئوية.
- البذور 1 × 107 Sf9 الخلايا في "متوسط حشرة" 10 مل النعمة المتوفرة مع الجنتاميسين FBS و 1% 10% في 10 سم طبق بيتري واحتضان عند 27 درجة مئوية ح 1.
- للتضخيم من باكولوفيروسيس المؤتلف وإذ تعرب عن العلامة-ك-"bzip"، إضافة 0.5 مل باكولوفيروس P0 إلى الخلايا Sf9 المصنف واحتضان عند 27 درجة مئوية ح 48.
- جمع المادة طافية باكولوفيروس P1 في أنبوب 15 مل ومخزن عند 4 درجة مئوية لمدة تصل إلى شهر واحد.
2-تنقية ك-"bzip"
- الحفاظ على ثقافة مرحلة سجل الخلايا Sf9 في "الحشرات المتوسطة" لنعمة الموردة مع 10% FBS، الجنتاميسين 1%، والمنظفات 1% C عند 27 درجة مئوية في تعليق المداري 140 لفة في الدقيقة كما هو موضح في الخطوة 1-3-2.
- في اليوم لتوصيل، أضف 1 مل من المادة طافية المحتوية على باكولوفيروس (P1) إلى 250 مل خلايا Sf9 بكثافة من 2 × 106 خلايا/مل.
- احتضان الخلايا Sf9 ح 72 في 27 درجة مئوية في شاكر مداري مع 140 لفة في الدقيقة تهتز، ثم جمع بالطرد المركزي في 2,740 س ز لمدة 15 دقيقة في 4 درجات مئوية.
- إزالة المادة طافية والكريات الخلية في المخزن المؤقت لتحلل 10 مل (20 مم هيبيس الأس الهيدروجيني 7.9، 0.5 م كلوريد الصوديوم، 1% المنظفات (انظر الجدول للمواد)، 2% الجلسرين، مثبط البروتياز الكوكتيل) وتدوير 50 لفة في الدقيقة باستخدام خلاط تعليق عند 4 درجة مئوية لمدة 30 دقيقة.
- أجهزة الطرد المركزي خلية ليساتي في 15,000 س ز لمدة 15 دقيقة لجمع المادة طافية.
- لتنقية العلامة-ك-"bzip"، احتضان ليساتيس الخلية (10 مل) مع 50 ميليلتر من حبات مغناطيسية الأضداد الموسومة في أنابيب البولي بروبلين 14 مل، وتدوير 50 لفة في الدقيقة ح 3 في 4 درجات مئوية باستخدام خلاط تعليق. عقب القبض على البروتين، بيليه الخرز 800 × ز الطرد المركزي لمدة 30 ثانية في 4 درجات مئوية. إزالة معظم المادة طافية وإعادة تعليق الخرز في حجم حوالي 1 مل المتبقية، ونقل إلى أنبوب 1.5 مل للغسيل.
- يغسل البروتين تم التقاطها عن طريق وضع أنبوب يحتوي على الخرز على الوقوف مغناطيسية، وإزالة المادة طافية بمجرد الخرز المغناطيسي انضمت تماما إلى جانب الأنبوب.
-
أغسل حبات مع المخزن المؤقت لتحلل أربع مرات.
- أضف 1 مل تحلل المخزن المؤقت إلى أنابيب 1.5 مل، وعكس الأنابيب 10 مرات. ضع أنبوب 1.5 مل على الوقوف مغناطيسية وإزالة المادة طافية كما هو موضح في 2.7.
- كرر الخطوة السابقة 3 مرات أخرى.
-
أغسل حبات مع الفوسفات مخزنة المالحة (PBS) مرة واحدة.
- أضف 1 مل برنامج تلفزيوني (ملم 137 كلوريد الصوديوم، 2.7 مم بوكل، 8 مم Na2HPO4، 1.5 مم KH2PO4) في أنابيب 1.5 مل، وعكس الأنابيب 10 مرات.
- وضع أنبوب 1.5 مل على الوقوف مغناطيسي ومن ثم إزالة المادة طافية.
- الوت البروتين العلامة-ك-"bzip" من الخرز المغناطيسي الأجسام المضادة الموسومة بإضافة 100 ميليلتر من 150 ميكروغرام/مل أوكتابيبتيدي المخفف في برنامج تلفزيوني في أنبوب 1.5 مل. تدوير الأنبوب لمدة 10 دقائق 50 لفة في الدقيقة بتعليق خلاط في درجة حرارة الغرفة. ثم، ضع الأنبوب مرة أخرى على موقف المغناطيسية وجمع المادة طافية في أنبوب نظيف 1.5 مل ك "bzip"--التي تحتوي على.
- تحليل 1-5 ميليلتر تنقية البروتين العلامة-ك-"bzip" من الحزب الديمقراطي الصربي صفحة يليه الأزرق أخذ تلطيخ26. تحميل 2 ميكروغرام، 1 ميكروغرام، و 0.5 ميكروغرام عينات من ألبومين المصل البقري (BSA) على نفس الجل واستخدامه للقياس الكمي باستخدام برنامج معالجة صور، مثل إيماجيج. تقدير تركيز ك-"bzip" بالمقارنة بالمعايير جيش صرب البوسنة.
- ك المنقي-"bzip" الآن جاهزة للاستخدام في كل من الإنزيم سومويليشن. تمييع ك-"bzip" في برنامج تلفزيوني بتركيز نهائي 100 نانوغرام/ميليلتر ومخزن في مختبرين الصغيرة في-80 درجة مئوية.
3-سومويلاتيون التحليل
- إضافة 3 ميليلتر من 100 نانوغرام/ميليلتر لتنقية العلامة-ك-"bzip" في مزيج الرئيسي لكل في المختبر سومويليشن رد فعل. تحتوي على مكونات في مزيج الرئيسي 1 ميليلتر البروتين المخزن المؤقت، 1 x سومويليشن المخزن المؤقت، 0.5 من البروتين p53 ميليلتر (0.5 ملغ/مل)، 25 نانومتر E1 تفعيل إنزيم (الأسفلت الأسهم: 1 ميكرومتر)، 50 نيوتن متر E2 التصريف إنزيم (الأسفلت الأسهم: 10 ميكرومتر)، و 250 نيوتن متر كل من الببتيدات سومو (سومو-1 ، سومو-2، أو سومو-3؛ الأسهم الأسفلت: 5 ميكرومتر) لوحدة تخزين نهائي من 17 ميليلتر.
- خلط المحتويات بلطف واحتضان رد فعل عند 30 درجة مئوية لوقف حاء 3 رد الفعل بإضافة 20 ميليلتر من 2 × تحميل الحزب الديمقراطي الصربي صفحة المخزن المؤقت (100 ملم تريس-HCL الأس الهيدروجيني 6.8، 0.2% (w/v) بروموفينول الأزرق ووالغليسيرول 20% (v/v)، 4% الصوديوم دوديسيل كبريتات و 200 ملم β-ميركابتوثانول) و تؤذي في العينات من 95 درجة مئوية لمدة 5 دقائق.
-
عينات منفصلة على صفحة الحزب الديمقراطي الصربي، نقل البروتينات المنفصلين عن ذويهم على الغشاء PVDF باستخدام جهاز نقل الغرواني الكهربي شبه جافة، وتحليلها بوصمة عار الغربية باستخدام الأجسام المضادة-p53.
- قم بإعداد جهاز هلام، كما هو الحال في الخطوة 2.11، وتحميل 20 ميكروليتر من عينة في جل الآبار.
- تشغيل جل 10% في ثابت الحالية في 80 الخامس لحوالي 120 دقيقة (حتى تصل الفرقة صبغ الجزء السفلي من الجل). بعد انتهاء التفريد، إيقاف الإمداد بالطاقة.
- افصل الجهاز جل وجل الأشرطة لإخراج الهلام، وتعويم الهلام في المخزن المؤقت نقل شبه الجاف (48 مم تريس-HCl، 39 مم جليكاين، 20% ميثانول) لمدة 5 دقائق.
- حاوية أخرى وامتصاص الغشاء PVDF في الميثانول لمدة 1 دقيقة. ثم تأخذ PVDF من الميثانول ووضعت في المخزن المؤقت لنقل شبه الجاف. بلطف تحرض الغشاء لمدة 5 دقائق.
- إزالة الغطاء سلامة الجهاز الغرواني الكهربي شبه الجاف.
- قبل الرطب ورق الترشيح، وإعداد شطيرة جل في اﻷنود السفلي البلاتين كما يلي: ورق الترشيح والغشاء PVDF وهلام وورق الترشيح.
- غطاء لوحة وسلامة الكاثود آمنة، ثم تشغيل وصمة عار في 15 ثابت الخامس الحالي عن 90 دقيقة بدوره قبالة إمدادات الطاقة، قم بقطع اتصال الجهاز شبه الجاف، وإخراج الغشاء PVDF.
- الغشاء PVDF كتلة مع المخزن المؤقت لحظر (الحليب الخالي من الدسم 5% في المخزن المؤقت تبست (137 مم2من كلوريد الصوديوم، 20 مم تريس-HCl، المنظفات 0.1% ب (انظر الجدول للمواد)، درجة الحموضة 7.6)) في درجة حرارة الغرفة ح 1 مع دورة في الدقيقة 30 تهز شاكر المداري.
- هجن غشاء PVDF مع p53 المضادة جسم المخفف (1:1، 000) في المخزن المؤقت حظر لح 12-16 في 4 درجات مئوية مع الهز 30 دورة في الدقيقة باستخدام خلاط تعليق.
- وضع تبست وتأخذ بها الغشاء PVDF في حاوية. شطف غشاء PVDF مع تبسة أكثر من مرتين.
- نقع الغشاء PVDF في تبست لمدة 30 دقيقة مع لفة في الدقيقة 45 تهز شاكر المداري.
- هجن الغشاء PVDF بجسم الأرنب المضادة مترافق مع الفجل البيروكسيديز (HRP) المخفف (1:4، 000) في المخزن المؤقت حظر لح 1 في درجة حرارة الغرفة مع 30 دورة في الدقيقة تهتز باستخدام خلاط تعليق.
- يغسل الغشاء PVDF تبسة 3 مرات كما هو موضح في الخطوة 3.4.10.
- نقع الغشاء PVDF في تبست لمدة 30 دقيقة مع الهز 45 لفة في الدقيقة باستخدام خلاط تعليق. إزالة تبسة وإضافة برنامج تلفزيوني للحفاظ على الغشاء PVDF في 4 درجات مئوية ليصل إلى 12 ساعة.
- خلط الكاشف تعزيز الركيزة تشيميلومينيسسينت (الركيزة مسافنة) 1 و 2 (1:1) (انظر الجدول للمواد). إزالة الغشاء PVDF من برنامج تلفزيوني، لطخة بإيجاز مع منشفة ورقية أو ممسحة الضوء-واجب امتصاص الرطوبة الزائدة، وفورا إضافة 400 ميليلتر من كاشف مسافنة لسطح كل غشاء للكاشف 3-5 دقيقة إزالة الزائدة القامة بإيجاز النشاف، ولكن لا تسمح m امبراني أن يجف تماما.
- كشف وصمة عار باستخدام نظام تصوير التﻷلؤ أو autoradiography الفيلم27.
النتائج
ووفقا للمعلومات المقدمة من الشركة المصنعة، هو مبلغ قياسي لأنزيم E1 و E2 في الإنزيم سومويلاتيون 50 نانومتر و 500 نانومتر، على التوالي. الحد الأدنى من E2 التصريف الإنزيم Ubc9 التي قادرة على سومويلاتي p53 أولاً تحددها الإنزيم سومويلاتيون في المختبر . منخفضة حيث تمكنت خمس مبلغ Ubc9 المستخدمة في القياسية في المختبر سومويلاتيون بروتوكول تحليل كفاءة سومويلاتي p53 (الشكل 1أ). ولذلك، نصف كمية الإنزيم E1 في تركيبة مع عشر مبلغ Ubc9 المستخدمة في البروتوكول القياسي استخدمت لآخر في المختبر الإنزيم سومويليشن. ولوحظ انخفاض كبير في كفاءة سومويلاتيون بالمقارنة مع بروتوكول قياسي (الشكل 1ب).
وهكذا، تعديل قدرة سومو E3 ليجاسى ك-"bzip" لتعزيز p53 سومويلاتيون مصممة على استخدام هذه الشروط سومويلاتيون في المختبر . واستخدمت المعلمة ك-"bzip" تنقيته من الخلايا Sf9 (الشكل 2ألف) في رد فعل سومويليشن التي تحتوي على كميات أقل من الإنزيمات E1 و E2 Ubc9. في ظل هذه الظروف المعدلة، ك-"bzip" كفاءة يمكن تحفيز سومويليشن p53 (الشكل 2ب). إيمونوبلوتينج مع الأجسام المضادة-p53 أكد المبالغ الإجمالية مماثلة من p53 في كل رد فعل، وأيضا تعديل سومو الكشف عن p53.

الشكل 1 : تحديد الحد الأدنى من السومو الإنزيمات المستخدمة في التحليل في المختبر سومويلاتيون. P53 (A) وتم تقييم سومويليشن في في المختبر سومويليشن مقايسة التي شملت الخامسة والنصف واحد وكمية الإنزيم Ubc9 المستخدمة في بروتوكول قياسي. بعد 3 ساعات في المختبر رد فعل سومويليشن، سومويلاتيد p53 الإنزيمات وفحصت الغربية لطخة مع الأجسام المضادة-p53. (ب) في المختبر سومويليشن من p53 وقد تم تحليل المزيد باستخدام نصف كمية الإنزيم E1 في تركيبة مع عشر مبلغ Ubc9 المستخدمة في البروتوكول القياسي. وأجرى وصمة عار غربية كما هو موضح في (A). الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
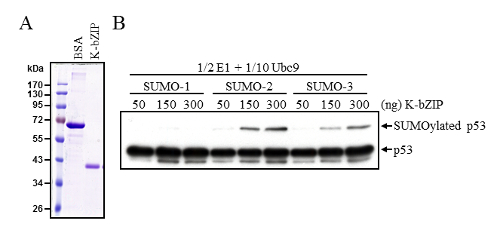
الشكل 2 : تحسين سومويليشن p53 من E3 سومو ليجاسى ك "bzip"- (أ) تنقية البروتين ك-"bzip" أعرب عن باكولوفيروس، تحليلها من قبل الحزب الديمقراطي الصربي صفحة تابع تلطيخ أخذ الأزرق. 1 ميكروغرام جيش صرب البوسنة و 10 ميليلتر تنقية ك-"bzip" تم تحميل لمقارنة كمية البروتين. (ب) ك-"bzip" تعزيز p53 وجرى تقييم سومويلاتيون باستخدام فعل سومويلاتيون في المختبر مع نصف كمية الإنزيم E1، وعشر مبلغ يوصي Ubc9 في بروتوكول قياسي. سومويلاتيد p53 بوصمة عار الغربية التحقيق كما هو موضح في الشكل 1ألف. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
Discussion
في المختبر بروتوكول سومويليشن الموصوفة هنا بشكل روتيني يستخدم لإنشاء مركز سومويليشن من ركائز Ubc9 التي تم تحديدها. القيد الرئيسي استخدام بروتوكول قياسي لدراسة وظيفة سومويلاتيون ليجاسى السومو E3 هو الوفرة من تفعيل E1 السومو والأنزيمات Ubc9 E2 التصريف إلى أقصى حد على تصريف السومو في النظم في المختبر . ونظرا لهذا التحدي، نعتقد أن معايرة كمية الإنزيمات سومو E1 و E2 للمستوى واحد بالكاد يمكن الكشف عن نشاطها في سومويليشن هو الطريق الوحيد المتاح لتحديد الأنشطة الحفازة ليجاسى E3 سومو استخدام هذه الأنابيب نظام سومويليشن. بعد هذه الفرضية، نحن بنجاح توضيح نشاط ليجاسى E3 ك-"bzip" واعتبرت أنه ليجاسى E3 سومو رواية مع خصوصية نحو سومو-2/3.
أن الخطوة الحاسمة ضمن البروتوكول يتمثل في إدخال كميات أقل من E1 و E2. باستخدام هذه المبالغ أقل، كما هو مبين في الشكل 2، الرواية سومو E3 ligases مع ليجاسى انخفاض النشاط قد تكون قادراً على تحديد مع الحفاظ على خصوصيتها نحو الركازة وبارالوجويس سومو. قيداً رئيسيا لهذه التقنية هو الشرط لجسم عالية الجودة الاعتراف الركيزة سومو، إذ يمكن إلا نسبة صغيرة جداً من الركازة سومو تعديل.
على الرغم من أن العديد من البروتينات إظهار القدرة على زيادة سومويليشن بعد أوفيريكسبريشن في فيفو، يجب إثبات تعريف ليجاسى E3 سومو التي أعيد تشكيلها في المختبر سومويليشن نظام استخدام تنقية الإنزيمات E1 و E2 و E3. بدلاً من المئات وربما الآلاف من ligases ubiquitin E3 المحددة، ثبت حتى الآن سوى بضعة ligases E3 سومو. قد يكون هذا يرجع جزئيا إلى استخدام التقليدية القياسية في المختبر سومويليشن الإنزيم الذي يزيد من كفاءة التصريف السومو ويعيق وظيفة سومويليشن المحتملة E3 سومو ligases وبالتالي. ويصف هذا البروتوكول مقايسة بسيطة ومتسقة للتحقيق سومويليشن تعززه ليجاسى سومو E3. الأسلوب وصف ضروري لتحديد وتوصيف لرواية E3 سومو ليجاسيس.
Disclosures
المؤلفون بالكشف عن لا تضارب محتمل في المصالح.
Acknowledgements
كان يؤيد هذا العمل من المنح المقدمة من وزارة العلوم والتكنولوجيا (105-2320-B-010-007-MY3 معظم، أن المجلس المركزي الفلسطيني)، والمعهد الوطني للبحوث الصحية (المؤسسات الوطنية-EX105-10215BC للمجلس المركزي الفلسطيني)، ومن وزارة العلوم والتكنولوجيا (الأكثر 105-2314-ب-400-019 على هيك) ومن معهد بحوث الصحة الوطنية (المؤسسات الوطنية ملغ-105-س-10، مؤسسة وطنية ملغ-106-س-10 إلى هيك). وأيد هذا العمل جزئيا مع جامعة يانغ مينغ الوطنية على نشر المخطوطات للمجلس المركزي الفلسطيني. وكان الممولين أي دور في تصميم الدراسة أو جمع البيانات والتحليل، وقرار نشر أو الجبر من المخطوطة.
Materials
| Name | Company | Catalog Number | Comments |
| pFastBac | Invitrogen | 10359-016 | dual expression baculovirus vector |
| pCR2.1-TOPO vector | Invitrogen | PCR product vector | |
| competent cell E. coli DH5α | Yeastern Biotech | FYE678-80VL | competent E. coli cells A |
| E. coli DH10Bac | Invitrogen | 10359-016 | competent E. coli cells B |
| FugeneHD | Roche | 04709705001 | transfection reagent |
| Opti-MEM | Gibco | 31985062 | reduced serum media |
| T4 Ligase | NEW England BioLabs | M0202S | |
| CpoI (RsrII) | Thermo Scientific | ER0741 | |
| Bluo-gal | Thermo Scientific | B1690 | galactosidase substrate |
| IPTG | Sigma-Aldrich | I6758-1G | |
| Grace’s Insect Medium | Gibco | 11605094 | |
| Fetal Bovine Serum | Gibco | 10082147 | |
| Gentamicin | Thermo Fisher | 15750060 | |
| Ampicillin | Sigma-Aldrich | A9393-25G | |
| Kanamycin | Sigma-Aldrich | K0254-20ML | |
| gentamicin | Gibco | 15710-064 | |
| tetracyclin | Sigma-Aldrich | 87128-25G | |
| LB Broth | Merk | 1.10285.0500 | |
| HEPES | Sigma-Aldrich | H4034-100G | |
| NaCl | Sigma-Aldrich | S9888-5KG | |
| KCl | Merk | 1.04936.1000 | |
| Na2HPO4 | Sigma-Aldrich | S5136-500G | |
| KH2PO4 | J.T.Baker | 3246-01 | |
| sodium dodecyl sulfate | Merk | 1.13760.1000 | |
| β-mercaptoethanol | Bio-Rad | 161-0710 | |
| TRIS (Base) | J.T.Baker | 4109-06 | |
| Non-fat milk | Fonterra | ||
| glycerol | J.T.Baker | 2136-01 | |
| Triton X-100 | Amresco | 0694-1L | detergent A |
| Tween 20 | Amresco | 0777-500ML | detergent B |
| Poloxamer 188 solution | Sigma-Aldrich | P5556-100ML | detergent C |
| Protease Inhibitor Cocktail Tablet | Roche | 04 693 132 001 | |
| 3x Flag peptide | Sigma | F4799 | |
| anti-FLAG m2 Magnetic beads | Sigma-Aldrich | M8823 | antibody-tagged magnetic beads |
| SUMOlink SUMO-1 Kit | Active Motif | 40120 | standard SUMOylation protocol |
| SUMOlink SUMO-2/3 Kit | Active Motif | 40220 | standard SUMOylation protocol |
| QIAquick Gel Extraction Kit | QIAGEN | 28704 | |
| QIAGEN Plasmid Mini Kit | QIAGEN | 12123 | plasmid extraction kit |
| Polypropylene tubes | Falcon | 352059 | |
| Petri Dish | Falcon | 351029 | |
| Cell lifter | Corning | CNG3008 | |
| Loading tip | Sorenson BioScience | 28480 | |
| PVDF | PerkinElmer | NEF1002 | |
| Blotting filter paper | Bio-Rad | 1703932 | |
| Mini slab gel apparatus (Bio-Rad Mini Protean II Cell) | Bio-Rad | 1658001 EDU | |
| Trans-Blot SD Semi-Dry Electrophoretic Transfer Cell | Bio-Rad | 1703940 | |
| Pierce ECL Western Blotting | Thermo | 32106 | ECL reagent |
| suspension mixer | Digisystem laboratory instruments Inc. | SM-3000 | |
| orbital shaker | Kansin instruments Co. | OS701 | |
| ImageQuant LAS 4000 biomolecular imager | GE Healthcare | 28955810 | |
| Sf9 | Thermo Scientific | B82501 | |
| anti-p53 antibody | Cell Signaling | #9282 | |
| anti-rabbit antibody | GE Healthcare | NA934-1ML |
References
- Bies, J., Markus, J., Wolff, L. Covalent attachment of the SUMO-1 protein to the negative regulatory domain of the c-Myb transcription factor modifies its stability and transactivation capacity. J Biol Chem. 277 (11), 8999-9009 (2002).
- Lin, D. Y., et al. Role of SUMO-interacting motif in Daxx SUMO modification, subnuclear localization, and repression of sumoylated transcription factors. Mol Cell. 24 (3), 341-354 (2006).
- Welsh, M., Jamalpour, M., Zang, G., Akerblom, B. The role of the Src Homology-2 domain containing protein B (SHB) in beta cells. J Mol Endocrinol. 56 (1), 21-31 (2016).
- Huang, W. Q., et al. Structure, function, and pathogenesis of SHP2 in developmental disorders and tumorigenesis. Curr Cancer Drug Targets. 14 (6), 567-588 (2014).
- Perry, J. J., Tainer, J. A., Boddy, M. N. A SIM-ultaneous role for SUMO and ubiquitin. Trends Biochem Sci. 33 (5), 201-208 (2008).
- Sun, H., Leverson, J. D., Hunter, T. Conserved function of RNF4 family proteins in eukaryotes: targeting a ubiquitin ligase to SUMOylated proteins. EMBO J. 26 (18), 4102-4112 (2007).
- Ouyang, J., Shi, Y., Valin, A., Xuan, Y., Gill, G. Direct binding of CoREST1 to SUMO-2/3 contributes to gene-specific repression by the LSD1/CoREST1/HDAC complex. Mol Cell. 34 (2), 145-154 (2009).
- Lyst, M. J., Stancheva, I. A role for SUMO modification in transcriptional repression and activation. Biochem Soc Trans. 35, Pt 6 1389-1392 (2007).
- Liu, H. W., et al. Chromatin modification by SUMO-1 stimulates the promoters of translation machinery genes. Nucleic Acids Res. 40 (20), 10172-10186 (2012).
- Rosonina, E., Duncan, S. M., Manley, J. L. SUMO functions in constitutive transcription and during activation of inducible genes in yeast. Genes Dev. 24 (12), 1242-1252 (2010).
- Chang, P. C., et al. The chromatin modification by SUMO-2/3 but not SUMO-1 prevents the epigenetic activation of key immune-related genes during Kaposi's sarcoma associated herpesvirus reactivation. BMC Genomics. 14, 824(2013).
- Neyret-Kahn, H., et al. Sumoylation at chromatin governs coordinated repression of a transcriptional program essential for cell growth and proliferation. Genome Res. 23 (10), 1563-1579 (2013).
- Tatham, M. H., et al. Polymeric chains of SUMO-2 and SUMO-3 are conjugated to protein substrates by SAE1/SAE2 and Ubc9. J Biol Chem. 276 (38), 35368-35374 (2001).
- Mattoscio, D., Segre, C. V., Chiocca, S. Viral manipulation of cellular protein conjugation pathways: The SUMO lesson. World J Virol. 2 (2), 79-90 (2013).
- Gareau, J. R., Lima, C. D. The SUMO pathway: emerging mechanisms that shape specificity, conjugation and recognition. Nat Rev Mol Cell Biol. 11 (12), 861-871 (2010).
- Bernier-Villamor, V., Sampson, D. A., Matunis, M. J., Lima, C. D. Structural basis for E2-mediated SUMO conjugation revealed by a complex between ubiquitin-conjugating enzyme Ubc9 and RanGAP1. Cell. 108 (3), 345-356 (2002).
- Knipscheer, P., et al. Ubc9 sumoylation regulates SUMO target discrimination. Mol Cell. 31 (3), 371-382 (2008).
- Vethantham, V., Manley, J. L. In vitro sumoylation of recombinant proteins and subsequent purification for use in enzymatic assays. Cold Spring Harb Protoc. 2009 (1), 5121(2009).
- Lin, S. F., Robinson, D. R., Miller, G., Kung, H. J. Kaposi's sarcoma-associated herpesvirus encodes a bZIP protein with homology to BZLF1 of Epstein-Barr virus. J Virol. 73 (3), 1909-1917 (1999).
- Yang, W. S., Hsu, H. W., Campbell, M., Cheng, C. Y., Chang, P. C. K-bZIP Mediated SUMO-2/3 Specific Modification on the KSHV Genome Negatively Regulates Lytic Gene Expression and Viral Reactivation. PLoS Pathog. 11 (7), 1005051(2015).
- Connor, C. D., Metcalf, E., Wrighton, C. J., Harris, T. J., Saunders, J. R. RsrII--a novel restriction endonuclease with a heptanucleotide recognition site. Nucleic Acids Res. 12 (17), 6701-6708 (1984).
- Helling, R. B., Goodman, H. M., Boyer, H. W. Analysis of endonuclease R-EcoRI fragments of DNA from lambdoid bacteriophages and other viruses by agarose-gel electrophoresis. J Virol. 14 (5), 1235-1244 (1974).
- Sezonov, G., Joseleau-Petit, D., D'Ari, R. Escherichia coli physiology in Luria-Bertani broth. J Bacteriol. 189 (23), 8746-8749 (2007).
- Gingold, E. B. Bacterial transformation. Methods Mol Biol. 2, 237-240 (1985).
- Brulois, K. F., et al. Construction and manipulation of a new Kaposi's sarcoma-associated herpesvirus bacterial artificial chromosome clone. J Virol. 86 (18), 9708-9720 (2012).
- Laemmli, U. K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature. 227 (5259), 680-685 (1970).
- Ahmed, S., Holt, M., Riedel, D., Jahn, R. Small-scale isolation of synaptic vesicles from mammalian brain. Nat Protoc. 8 (5), 998-1009 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved