Method Article
Farelerde Böbrek Hasarının Diyabetik Patogenezinde Tüm Böbrek, Medulla ve Kortikal Tübüllerin Karşılaştırmalı Proteomik Analizi
Bu Makalede
Özet
Burada, tüm böbrek, izole kortikal tübül ve medüller proteomların proteomik analizi için ayrıntılı bir protokol sunuyoruz. Çalışma ayrıca diyabetik bir fare modelinde ve diyabetik olmayan farelerde bölgesel proteomları karşılaştırır.
Özet
Böbrek hastalığındaki olayların sırasını tanımlamak, nefrolog araç setindeki klinik uygulamanın temel taşıdır. Doku proteomik analizleri, renal patofizyolojinin temel fizyolojik ve moleküler süreçlerini anlamak için önemli bir yaklaşımdır. Burada sunduğumuz yöntemler ve protokoller, hastalık sekelleri ile ilgili her bir spesifik ilgi bölgesinde böbreğin moleküler diseksiyonuna izin verecektir. Hastalığın belirli böbrek bölgeleri ve benzersiz işlevlere sahip yapılar üzerindeki etkilerini belirlemek için bu protokolün amacı, basitleştirilmiş fare böbrek bölümlendirme ve renal kortikal tübül izolasyon tekniklerini, kolaylaştırılmış, etiketsiz kantitatif proteomik iş akışlarıyla birlikte göstermektir. Bu yöntemlerin birleştirilmesi, patolojik bağlamlarda tek hücreli proteomiklerin nihai ve nihai hedefi ile tüm böbrek, medüller bölmeler ve böbreklerin kortikal tübül yapılarındaki bozulmuş moleküler modellerin tanımlanmasına yardımcı olacaktır. Bu yöntemlerin hemen hemen her hastalık modelinde uygulanması, böbrek fonksiyon bozukluğu ile ilgili patoloji mekanizmalarının tanımlanmasında yardımcı olacaktır.
Giriş
Kronik böbrek hastalığı (KBH), modern tıpta önemli bir endişe kaynağıdır ve yalnızca Amerika Birleşik Devletleri'nde 86 milyar doların üzerinde sağlık harcaması tutarındadır1. Dünya çapında, KBH insidansı, diyabet ve ilişkili renal komorbiditelerin prevalansı ile artmaktadır. ABD nüfusunun yaklaşık %14'ü KBH'ye sahiptir (USRDS 2024 yıllık raporu). Ayrıca, diyabetik nefropati KBH'nin bir şeklidir ve son dönem böbrek yetmezliğinin (SDBY) önde gelen nedenidir ve SDBY hastalarının %60'ında diyabet vardır 1,2,3. Diyabet, böbreklerin fonksiyonel birimi olan nefronların tüm böbrek yapılarını ve hücre tiplerini etkiler. Şekil 1'de gösterildiği gibi, böbrek korteksi ve medulla bölgelerinde nefronların farklı kısımları bulunur. Böbreğin büyük çoğunluğu tübüllerden oluşur. Renal tübül disfonksiyonu ve yapısal lezyonlar diyabetik nefropati (DN) gelişimine önemli ölçüde katkıda bulunur ve bu değişiklikler böbrek fonksiyonlarındaki azalma oranıile iyi ilişkilidir 4,5,6,7,8. Diyabetin erken dönemlerinde, tüm tübül segmentlerinde artan glikoz ve buna bağlı sodyum alımı ve membran taşıma proteini taleplerine yanıt olarak, tübüller hipertrofiye uğrar. Diyabetin ilerleyen dönemlerinde artan mikrovasküler yaralanma ile tübüller atrofi ve dilatasyon sergilerken, fibroz ve interstisyumungenişlemesi vardır 9. Laboratuvarımızdan yapılan önceki çalışmalar, diyabetik farelerin kortikal tübüllerinde değişmiş proteomlar ve bol miktarda stres yanıt proteini bulmuştur10,11. Medulla, idrar konsantrasyonunun düzenlenmesi için önemlidir ve böbrek hastalığı sırasındaki işlev bozukluğu oksidatif stres ile ilişkilidir, diyabet, metabolik aktivitelerden kaynaklanan oksijen tüketiminin artması, zar taşıma proteinlerinin aktivitesinin artması ve mikrovasküler yaralanma nedeniyle böbreğin bu bölgesinde oksijen gerginliğinin azalmasına neden olur 12,13,14.
DN'nin ayrıntılı gelişim ve ilerleme mekanizmalarını anlamak, hastalığın modellenmesini ve sinyalleme süreçlerinin moleküler profillenmesini, hücresel protein dinamiklerinde adaptif değişiklikleri ve kronik durumlarda yaralanmadan etkilenen böbrek hücresi ve doku bileşenlerinin kesin tanımını içeren yeni ve entegre yaklaşımlar gerektirecek devam eden bir çabadır. Proteomik, metabolomik ve transkriptomik, böbrek hastalıklarının moleküler mekanizmalarını analitik olarak inceleme imkanı sunar. Omik, biyolojik sistemler hakkında daha küresel bir anlayış kazanmak için sistem biyolojisi yaklaşımlarını kullanan nispeten yeni bir alandır. Proteomik, son yıllarda nefrolojide güçlü bir Omik aracı olmuştur. Biyobelirteç araştırmaları, yayınlardaki büyümede belirtildiği gibi son 20 yıl içinde genişlemiştir, ancak bu bulguları kliniğe tam olarak uygulamak için kapsamlı çalışmalar gereklidir15. Renal korteks ve medulla içindeki çok farklı tübül hücre popülasyonları ve ilgili fonksiyonel rollerle, tüm böbreklerin proteomik analizi, bu farklı bölgelerdeki belirli yapılarla ilişkili benzersiz değişiklikleri maskeleyebilir. Bu nedenle, bu çalışmanın amacı, renal korteks ve medullanın ayrılmasının yanı sıra kortikal tübüllerin glomerüllerden ayrılmasını ve ardından son teknoloji kütle spektrometresi ve biyoinformatik analizler için izole edilmiş yapılardan protein ekstraktlarının hazırlanması için ayrıntılı protokolleri göstermektir. Diyabetik nefropatinin fare modelleri, hastalığın ilerleme mekanizmalarını tanımlamada etkilidir. Bu çalışma için, erken başlangıçlı tip I diyabet geliştiren ve insanlarda erken ve geç evre DN özelliklerini gösteren OVE26 transgenik fareyi kullandık, bunlar arasında 1) glomerüler filtrasyon hızında erken bir artış ve daha sonra düşüş, 2) böbrek hipertrofisi, 3) glomerüler bazal membran kalınlaşması ve mezanjiyal genişleme, 4) şiddetli proteinüri ve 5) tubulointerstisyel fibroz9, 16,17. Açık yapısal lezyonlardan önce tübül kompartmanlarında proteomik değişiklikler göstermek için iki aylık fareler seçildi. Daha önce bildirildiği ve Şekil 2'de gösterildiği gibi, 2 aylık OVE26 fareleri, genç diyabetik farelerde proksimal tübüllerde açık histolojik değişiklikler olmaksızın (Şekil 2, sarı ok) glomerüler mezanjiyal matriks genişlemesi (Şekil 2, yeşil ok) ve şiddetli proteinüri17 sergiler. Burada, diyabetli her bir bölmedeki proteomdaki farklılıkları aydınlatmak ve göstermek için tüm böbrek, medulla ve kortikal tübüllerin karakterizasyonu için birleşik bir kantitatif proteomik yaklaşım sunuyoruz.
Protokol
OVE26 ve FVB fareleri ile yapılan çalışmalar, Louisville Üniversitesi Kurumsal Hayvan Bakımı ve Kullanımı Komitesi (IACUC) yönergeleri tarafından onaylanmıştır. Transgenik dişi OVE26 (diyabetik; Suş #:005564) ve FVB (diyabetik olmayan; arka plan suşu; Suş #:001800) fareler Jackson Laboratories'den (Bar Harbor, ME) satın alındı. Hayvanlar, 25 ° C'de 12 saatlik bir aydınlık / karanlık döngüsünde tutuldu ve su ve yiyeceğe serbest erişim sağlandı. Tüm çalışmalar 2 aylık fareler üzerinde yapılmıştır.
1. Hayvan modeli
- Böbrek izolasyonu
- İntraperitoneal olarak 80 mg / kg Ketamin ve 12 mg / kg Ksilazin uygulayarak fareleri uyuşturun.
- Küçük bir cerrahi makasla orta hat karın kesisi yapın ve vena kava'yı ortaya çıkarmak için swab kullanarak bağırsakları nazikçe farenin dışına ve yanına doğru hareket ettirin.
- Sağ böbreğin üzerindeki vena kavada küçük bir kesi yapın.
- Fareyi sol ventrikülden 20 mL soğuk fosfat tamponlu salin ile perfüze edin (PBS: pH 7.4; 210 mg / L KH2PO4, 9 g / L NaCl, 726 mg / L Na2HPO4 ·7H2O) 10 mL/dk hızında peristaltik bir pompa kullanarak.
NOT: Kan proteinlerinin ve hücrelerinin böbreklere dahil edilmesi, aşağı akış analizlerinde kritik bir faktör değilse bu adım gerekli değildir. - Küçük cerrahi makas kullanarak böbrekleri çıkarın. Böbreklerin dışındaki fazla yağı alın. Böbrekleri tartın ve buz üzerinde soğuk PBS'ye yerleştirin.
- Böbrek kapsülünü çıkarın.
- Böbrekleri bir cam tabağa veya buz üzerine yerleştirilmiş Petri kabına yerleştirin. Böbreklerin üst ve alt kutupları arasında 3-4 dilim elde etmek için bir tıraş bıçağı (Şekil 3) kullanarak böbreklerde birkaç enine kesim yapın.
- Her böbrekten 1-2 orta dilim ve iki kutbu ( Şekil 3'te daire içine alınmış böbrek dilimleri) "tam böbrek" örnekleri olarak hizmet etmek için bir kenara ayırın. Bir kısmını 1,5 mL'lik santrifüj tüplerine yerleştirin ve buz gibi soğuk homojenizasyon tamponu (%10 gliserol, 50 mM HEPES, 100 mM KCl, 2 mM EDTA, %0,1 NP40, 10 mM NaF, 0,25 mM NaVO3, 1x HALTS proteaz inhibitörü) yaklaşık 10 μL/mg doku örneğinde (edinilmiş böbrek ağırlığından elde edilen böbrek dilimlerinin tahmini kütlesine göre) ekleyin. Tüpü buzun üzerinde bırakın.
- Orta enine dilimlerin geri kalanı için, dilimi düz bir şekilde yatırın ve bir tıraş bıçağı veya neşter kullanarak her dilimden korteksi (dıştaki 1 mm) dikkatlice dilimleyin (Şekil 3, şematik iş akışı). Kortikal tübül izolasyon protokolü için korteksi medulla bölgelerinden ayrı tutun (aşağıda, adım 1.3).
- Diseke edilen medullanın bir kısmını 1.5 mL'lik santrifüj tüplerine yerleştirin, adım 1.1.8'deki gibi buz gibi soğuk homojenizasyon tamponu ekleyin ve tüpü buz üzerinde bırakın.
- Homojenizasyon için kullanılmayan kalan tüm tüm böbrek ve medulla parçalarını sıvı nitrojen içinde dondurun ve -80 °C'de saklayın.
- Alternatif olarak, ayrılmış tüm böbrek ve medulla bölmelerini dondurun ve adım 1.1.11'de açıklandığı gibi saklayın. Adım 1.1.8'de olduğu gibi homojenizasyon tamponunun eklenmesi için bunları daha sonra depodan çıkarın.
- Kortikal tübül izolasyonu
- Diseke korteksi bir cam tabak veya Petri kabı üzerinde bir jiletle 1-3 mm'lik parçalar halinde doğrayın ve bir macun oluşturun.
- Kıyılmış korteksi 1 mL tip IA kollajenaz (1 mg / mL) içinde 30 dakika, 37 ° C'de, sallanan bir su banyosunda sindirin.
- Buz üzerinde 50 mL'lik konik bir tüpün üzerine 100 μm'lik bir hücre süzgeci yerleştirin.
- Sindirilmiş kortikal süspansiyonu 100 μm hücre süzgecinin üzerine yerleştirin ve 10 mL'lik bir şırınganın pistonunu kullanarak süzgecin içinden hafifçe bastırın. Süzgecin üst kısmını 1 mL PBS ile ve süzgecin alt tarafını 1 mL PBS ile yıkayın.
- Süzüntüyü 50 mL'lik tüpte 100 μm'lik ek bir süzgeçten geçirin, ardından süzgecin üstünü 1 mL PBS ile yıkayın.
- Süzüntüyü, buz üzerinde 50 mL'lik konik bir tüp üzerine yerleştirilmiş 70 μm'lik bir hücre süzgecinden geçirin. Tübüller bu süzgeçten süzüntüye geçecektir (Glomerüller 70 μm'lik süzgeç üzerinde tutulacaktır). Süzgeci 1 mL PBS ile yıkayın.
- Son süzüntüyü 120 × g'da 4 °C'de 2 dakika döndürün. Tübül peletinden fazla PBS'yi atın.
- 10x objektif kullanarak mikroskop altında görselleştirerek kortikal tübül peletinin saflığını kontrol edin. Fraksiyonun %10'undan fazlası glomerül içeriyorsa, süzgeci 1 mL PBS ile yeniden süspanse edin ve süzgeci ilave yıkamadan temiz bir 70 μm hücre süzgecinden geçirin.
- Zenginleştirilmiş tübül fraksiyonunu 1.5 mL santrifüj tüplerine dağıtın ve 2000 × g'da 2 dakika boyunca 4 ° C'de döndürün. Süpernatanı atın.
- Tüm böbrek ve medullada olduğu gibi tübül peletine de homojenizasyon tamponu ekleyin (adım 1.1.8 ve 1.1.10).
- Doku homojenizasyonu/Protein ekstraksiyonu
- Her bir numune tipini, özellikle 1,5 mL tüpler için plastik bir tokmak kullanarak 1,5 mL mikrosantrifüj tüplerinde homojenize edin. Homojenize süspansiyon çok kalınsa, gerektiği kadar ilave homojenizasyon tamponu ekleyin.
- Homojenize süspansiyonu 15 dakika buz üzerinde bırakın, ardından bir banyo sonikatöründe (yalnızca açma / kapama düğmesi, ünitede ayarlanabilir ayar yok) 5 dakika boyunca sonikasyon, banyoda 25 ° C'de su ile. Numuneleri 10 dakika buz üzerinde bırakın.
- Kısa bir süre girdap (1000-1500 RPM) homojenleştirin, ardından bir pipetle 20 kez ezin ve 15 dakika daha buz üzerinde bırakın.
- Santrifüjlemeden önce numuneleri 13.000 × g'da 4 °C'de 20 dakika boyunca birkaç kez tritüre edin.
- Temizlenmiş protein ekstraktlarını temiz tüplere aktarın.
- Protein tahmini ve kütle spektrometresi analizi için numune hazırlama için 30 μL berraklaştırılmış ekstrakt. Numunelerin geri kalanını -80 °C'de saklayın.
2. Süspansiyon-Tuzak mini spin kolon sindirim protokolü
- Proteomik analizler için proteinlerin triptik parçalara proteolitik sindirimi
- ~ 40-50 μg numuneyi (~ 2 μg / μL'de) numune lizis tamponuna seyreltin (100 mM trietilamonyum bikarbonat (TEA-BC) pH 8.5, 40 mM tris (2-karboksietil) fosfin [TCEP]) içinde numune lizis tamponuna (% 10 w / v sodyum dodesil sülfat [SDS]) 46 μL'lik bir nihai hacme kadar.
- Proteinlerin azaltılması ve alkilasyonu
- 65 ° C'de 30 dakika inkübe edin (TCEP'nin nihai konsantrasyonu 20 mM'dir).
- Sıvı kromatografi-kütle spektrometresi (LC-MS) dereceli suya 4 μL 0.5 M iyodoasetamid ekleyin ve karanlıkta oda sıcaklığında (RT) 30 dakika inkübe edin (nihai iyodoasetamid konsantrasyonu 40 mM'dir).
- LC-MS dereceli suya 5 μL %12 w/w fosforik asit ekleyin (%12 çözelti için 141 μL %85 fosforik asidi 859 μL suya seyreltin).
- Fosforik aside alternatif olarak, fosfopeptit zenginleştirme18 yapıyorsanız trifloroasetik asit veya formik asit kullanın.
- 350 μL süspansiyon tuzağı bağlayıcı tampon ekleyin (%90 v/v metanol/%10 v/v su pH 7.55 içinde 100 mM TEA-BC).
- Süspansiyon tuzağı sütununa örnek ekleyin. Her hacmi kolondan geçirmek için sabit açılı bir rotorda RT'de 30 saniye boyunca 4.000 × g'da santrifüjleyin.
- 4x 400 μL süspansiyon tuzağı bağlayıcı tampon ile yıkayın. Her yıkamayı kolondan geçirmek için sabit açılı bir rotorda RT'de 30 saniye boyunca 4.000 x g'da santrifüjleyin.
NOT: SDS'nin çıkarılmasına yardımcı olmak için, her yıkamadan sonra rotordaki sütunu 180° döndürün. - Bağlayıcı tamponu tamamen çıkarmak için RT'de 1 dakika boyunca 4.000 g'da santrifüjleyin (sindirim sırasında damlamayı önler).
- Süspansiyon sifonu kolonunu temiz bir toplama tüpüne aktarın.
- 125 μL'lik 50 mM TEA-BC pH 8.5 içinde 2.5-5 μg tripsin ilave edin LC-MS dereceli suya (Tripsin Proteaz, MS-Grade). Tripsinin numuneye nihai oranı 1:20 ila 1:10'dur.
- 47 °C'de 2 saat inkübe edin (kapağı sıkmayın; 0 RPM'ye ayarlanmış bir termal karıştırıcı tercih edilir). Kapakta bir iğne ile bir delik açmak, süspansiyon kapanının üst bölmesinde basınç oluşmasını önleyebilir (artan basınç, tripsin çözeltisinin kolondan damlamasına neden olur).
- 80 μL 50 mM TEA-BC pH 8.5 seviyesini LC-MS dereceli suya ekleyin. RT'de 4.000 g'da sabit açılı bir rotorda 1 dakika santrifüjleyin ve her bir sindirimi kolondan geçirin.
- LC-MS dereceli suya 80 μL %0.2 v/v formik asit ekleyin. Adım 2.11'den itibaren sindirim ile toplamak için sabit açılı bir rotorda RT'de 1 dakika boyunca 4.000 g'da santrifüjleyin.
- LC-MS dereceli suya 80 μL %50 v/v asetonitril ekleyin. Adım 2.11'den itibaren sindirim ile toplamak için sabit açılı bir rotorda 1 dakika boyunca RT'de 4.000 g'da santrifüjleyin.
- Süspansiyon sifonu elüatını -80 °C'de saklayın.
- Numuneyi bir vakum yoğunlaştırıcıda kurutun.
- Kurutulmuş numuneyi -80 °C'de saklayın.
3. Hidrofilik-lipofilik denge (HLB) sütunu ile temizleme
- A (%2 v/v asetonitril/%0.1 v/v formik asit) ve B (%80 v/v asetonitril/%0.1 v/v formik asit) çözeltileri yapın.
- Numuneyi 500 μL çözelti A içinde çözün.
- Kolonu bir vakum manifolduna yerleştirin ve ~1-2 mL/dk'da gaz basıncı uygulayın.
- HLB kolonuna 500 μL çözelti B ekleyin ve 1-2 mL / dk'da boşaltın; İki kez tekrarlayın.
- HLB kolonuna 750 μL çözelti A ekleyin ve 1-2 mL / dk'da boşaltın; İki kez tekrarlayın.
- HLB kolonunun altındaki rafa temiz bir 2 mL mikrotüp yerleştirin, numuneyi 500 μL çözelti A'ya ve yukarıdaki gibi gaz basıncına yükleyin; Akışı sütuna ikinci kez geçirin.
- HLB kolonunu atık tüpünün üzerine yerleştirin, 500 μL çözelti A ekleyin ve yukarıdaki gibi boşaltın; İki kez tekrarlayın.
- Sütunu temiz bir 2 mL mikrotüpün üzerine yerleştirin, 500 μL B çözeltisi ekleyin ve yukarıdaki gibi boşaltın; İki kez tekrarlayın.
- Elüatı -80 °C'de dondurun, ardından bir vakum yoğunlaştırıcıda kurutun. Kurumuş kalıntıyı -80 °C'de saklayın.
- MS analizinden önce kalıntıyı 20 μL %2 v/v asetonitril /%0.1 v/v formik asit içinde çözün. 205 nm'lik bir absorbansta peptit konsantrasyonunu tahmin etmek için bir spektrofotometre kullanın.
4. Kütle spektrometresi analizi
- Tek boyutlu ters fazlı sıvı kromatografisi (LC)-MS/MS
- 1 boyutlu nano-LC üzerine eşit kütlede peptit (~ 600 ng) enjekte edin ve ters faz C18 sütunları üzerinde fraksiyonlayın.
- Peptitleri, 250 ° C'de tutulan bir iyon transfer tüpü ile 1.8 kV'luk bir püskürtme voltajında doğrudan MS'ye aktarın.
- Daha düşük bolluktaki iyonlarda iyon haritalama derinliğini iyileştirmek için en yoğun MS/MS fragmanının analiz kuyruğundan çıkarıldığı veriye bağlı ilk 20 iyon modunda spektrumları elde edin.
5. Veri analizi ve biyoinformatik
- Veri işleme prosedürleri
- PEAKS 12.0'da (LC-MS/MS veri analiz yazılımı) spektral atama ve peptit ve protein tanımlamasının ardından, tek faktörlü istatistiksel analiz yaklaşımını (https://www.metaboanalyst.ca/) kullanarak MetaboAnalyst 6.0'da (metabolomik veri analiz platformu) analiz için protein listelerini gönderin.
- Mouse Reviewed FASTA veritabanına karşı katı yanlış keşif oranı (FDR) kriterleri (%1 protein ve peptit) kullanarak spektrumları aramak ve filtrelemek için LC-MS/MS veri analiz yazılımını kullanın.
NOT: Kolayca bulunabilen alternatif arama programları, yaygın olarak kullanılan diğer seçeneklerin yanı sıra Maxquant, Proteome Discoverer'ı içerir. - Sisteinin karbamidometilasyonunu sabit bir modifikasyon olarak belirtin. Metiyoninin oksidasyonunu değişken bir modifikasyon olarak belirtin.
- Listeleri virgülle ayrılmış değerler (CSV) biçimine ve her sütun ve satıra atanan grup/örnek etiketlerine dönüştürün. Bu format, metabolomik veri analizi platformunda esnektir.
- Eksik değişkenler için 1/5 minimum değer kuralını kullanarak eksik değerleri atayın.
- Kesme için %40 varyansın kullanıldığı çeyrekler arası aralığı kullanarak yüksek değişkenli değerleri hariç tutmak için verileri filtreleyin.
- Değerleri medyan yoğunluğa normalleştirin,10'u dönüştürün ve ölçeklendirme için ortalamayı ortalayın. Sonuçların farklılık gösterebileceğini göz önünde bulundurarak diğer normalleştirme yaklaşımlarını kullanın.
- T testlerini, 0,05'lik bir p değeri kesme < eşleşmemiş bir şekilde gerçekleştirin. Bu aşamada birden fazla test düzeltmesi gerçekleştirin.
NOT: Bu çalışma, veri sunumu amacıyla temsili veri seti için bu düzeltmeyi gerçekleştirmemiştir. - 1.5 kat değişim (FC) için yanardağ grafiklerini ve 0.05 < p belirtin.
- Isı haritaları oluşturun ve örnek grupların kısmi en küçük kareler diskriminant analizi (PLSDA) ve istatistiksel (projeksiyonun önem değişkeni [VIP]) analizini gerçekleştirin.
- Takip için potansiyel adaylar, PLSDA analizinde belirtildiği gibi, 1.5FC ve p-val < 0.05'i veya VIP > 1.0'ı gölgede bırakacak kadar sağlamdır.
- OVE26 farelerinde tüm böbrek, tübül ve medullanın proteomundaki farklılıkları göstermek için Venn diyagramları oluşturun.
Sonuçlar
Genel olarak, her numune tipinden toplam protein tanımlamaları 1) tüm böbrek (1438), 2) medulla (2145) ve kortikal tübüller (1859) idi. MetaboAnalyst 6.0'da veri işleme, veri filtreleme ve atamanın ardından, son olarak her böbrek bölmesi için analiz edilen protein tanımlamaları şunlardı: tüm böbrek (455), medulla (997) ve kortikal tübüller (896). Şekil 4 , OVE26 diyabetik fare böbreğindeki küresel proteomik değişiklikleri göstermektedir. Etiketsiz kantitatif (LFQ) analiz, raportör iyon etiketlemesine (TMT, iTRAQ vb.) kıyasla toplam veri setinde daha fazla değişkenlik sağlarken yüksek derinlikli proteom kapsamına izin verir. LFQ değişkenliğinin üstesinden gelmeye yönelik bir yaklaşım, her koşul için analiz edilen numune sayısını artırmaktır. Burada, peptit ve protein atama düzeyinde% 1 yanlış keşif oranı (FDR) ile PEAKS arama algoritmalarından yoğunluğa dayalı bir niceleme yaklaşımı kullandık ve her durumda iki hayvanın teknik kopyalarla eşleştirilmiş karşılaştırmasında sağlam veri seti oluşturmaya izin verdik. Şekil 4A , ayarlanmamış p değerine (p değeri < 0.05) karşı çizilen log2FC'yi (kat değişimi) göstermektedir. Tipik olarak, amaç ortogonal takip için sağlam aday proteinleri doğrulamak olduğunda, p değeri çoklu karşılaştırma testi için düzeltilecektir. Burada, sunum amacıyla yanardağ grafiğinde OVE26 ve FVB arasındaki tüm ayarlanmamış proteom karşılaştırmasını gösteriyoruz. Kantitatif analize ilk genel bakış olarak, yanardağ grafikleri, biyolojik etkileri olan potansiyel olarak ilginç adayların anlık görüntü önizlemesini gösterir. Şekil 4A , tüm böbrek proteomlarında OVE26 protein miktar tayininin kontrol FVB suşuna karşı oranını göstermektedir. Özellikle, GAPDH, ALDH6A1 ile birlikte OVE26 böbreğinde sağlam bir şekilde yukarı regüle edilir, bu da metabolik yanıtların erken diyabetik böbreklerde oluştuğunu düşündürür. MetaboAnalyst 6.0 kullanılarak verilerin normalleştirilmesinin etkilerini ve değişkenliği göstermek için Şekil 4B'de bireysel keman grafikleri verilmiştir. OVE26 fare tüm böbreğindeki bir matris metalloendopeptidaz (MME) ve katepsin A'nın (CTSA) sağlam aşağı regülasyonuna dikkat edin. Tüm böbrekteki genel proteom farklılıklarını göstermek için, filtrelenmiş proteom veri seti, grup düzeyinde farklılıkları göstermek ve projeksiyonun önemine (VIP) sahip değişkenleri bulmak için boyutsal azaltma ve denetimli çok değişkenli analizler (PLSDA, sPLSDA, oPLSDA) için sunulabilir. Bunun için Şekil 4C'de gösterildiği gibi OVE26 ve FVB böbrek proteomu üzerinde PLSDA gerçekleştirdik ve VIP'ler Şekil 4D'de gösterilmiştir. PLSDA analizleri, kontrol FVB böbrek proteomu (kırmızı) ile karşılaştırıldığında OVE26 proteomunun (yeşil) sağlam bir şekilde ayrıldığını göstermektedir. VIP skorları > 1, Ek Şekillerdeki (Ek Şekil 1) grafiklerde gösterilen Gprofiler (https://biit.cs.ut.ee/gprofiler/gost) kullanılarak yol ontolojisi zenginleştirmesinde daha ileri analizler için tipik olarak iyi aday değişkenlerdir, bu durumda proteinlerdir. Özellikle, protein VIP'lerinin çoğu, Şekil 4A'daki yanardağ arsa analizlerinde bulunur. Daha ileri analizler için aday listelerin belirlenmesi, büyük kıvrım değişimine sahip proteinleri, istatistiksel olarak sağlam ve grup tabakalaşmasında yer alan önemli proteinleri içermelidir (VIPs>1). Grup düzeyinde ve bireysel protein düzeyinde proteomlardaki farklılıkların daha fazla gösterimi, Şekil 4E'de gösterildiği gibi, grup ve özellik kümelemesi ile hiyerarşik ısı haritalarında görselleştirilebilir.
Karşılaştırmalı amaçlar için, OVE26 ve FVB farelerinden izole edilmiş kortikal tübüller (Şekil 5) ve medulla (Şekil 6) üzerinde 1 boyutlu bir LC-MS/MS kantitatif proteomik analizi gerçekleştirdik ve daha yüksek bolluk bileşenlerinin yokluğunda etkili algılama derinliği ile böbreğin belirli bölgelerinin proteomunu delme yeteneğini gösterdik. Son olarak, proteomdaki örtüşme, bir Venn Şemasında gösterildiği gibi, toplam anlamlı tanımlamaların karşılaştırılması ve her durumda (tüm böbrek, tübüller ve medulla) istatistiksel olarak en önemli proteinlerin üst üste bindirilmesiyle gösterilebilir (Şekil 7). Özellikle, potansiyel takip adayı proteinleri belirlemek için PLSDA boyutsal indirgeme istatistiksel yaklaşımlarından (Şekil 4C, D, Şekil 5C, D ve Şekil 6C, D) t-testi ve VIP (projeksiyonun önem değişkeni) kombinasyon yaklaşımını kullanıyoruz. T-stat (T-testi) kriterlerinin (Şekil 7A), tüm böbrekte ve daha az ölçüde medulla ve tübüllerde eşiğin üzerinde daha fazla sayıda proteini tanımlamak için en uygun olduğunu unutmayın. Aday listesini genişletmek için Şekil 7B'deki başka bir istatistiksel eşik (VIP > 1) kullanılarak, medulla ve kortikal tübül proteomik analizlerinde daha eşit dağılmış ve yeni aday proteinler verilmiştir. Dikkate değer olan, 3 proteomun her birinde örtüşme olmamasıdır, çünkü her iki yaklaşım kullanılarak 0 veya 2 aday paylaşılmıştır. Böbrek proteomunun daha derine inmesini sağlamak için birden fazla yaklaşım uygulanabilir. Proteomun doku ve doku bölmesi seviyesinde izolasyonu ve fraksiyonlanması, t-testi ve VIP sıralama yaklaşımlarında Venn şeması karşılaştırmasında (Şekil 7) belirtildiği gibi, sağlam sonuçlar verebilen bir başlangıç yaklaşımıdır. Tüm ham dosyalar ve zirve listeleri, HUPO standartlarına göre MASSIVE'e (massive.ucsd.edu) yatırılacak ve yayınlandıktan sonra kısmi bir gönderim olarak herkese açık olarak paylaşılacaktır.
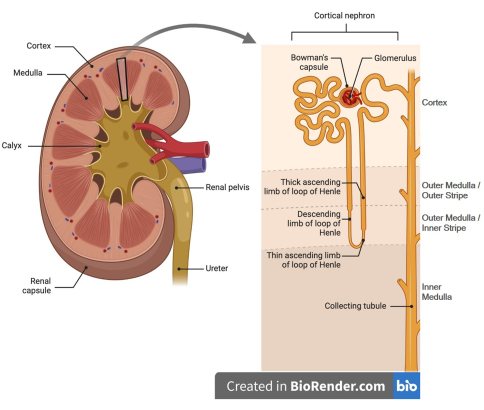
Resim 1: Böbrek nefronunun karikatürize görüntüsü. (Sol panel) Böbreklerin korteks (dış) ve medulla (iç) bölgeleri vardır. (Sağ panel) Böbrek korteksi, glomerüller ve ilgili Bowman kapsülü, proksimal kıvrımlı tübüller ve düz segmentinin çoğunu, Henle'nin kalın yükselen halkalarının bölümlerini, distal kıvrımlı tübülleri, toplama kanallarının kortikal segmentlerini ve peritübüler kılcal damarları (gösterilmemiştir) içerir. Medulla, Henle'nin alçalan ve çıkan halkalarından, Henle'nin kalın yükselen halkasının medüller kısmından ve toplama kanallarından ve bu tübül segmentlerini çevreleyen vasa rekta kılcal damarlardan oluşur (gösterilmemiştir). Figür Biorender kullanılarak oluşturulmuştur. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 2: 2 aylık FVB (diyabetik olmayan) ve OVE26 (diyabetik) farelerde histolojiyi göstermek için temsili PAS (periyodik asit Schiff) boyama. Diyabetik farelerden elde edilen glomerüller (yeşil ok), mezanjiyal genişlemeyi gösteren artmış pembe PAS boyaması gösterirken, genç diyabetik farelerde tubulointerstisyumdaki açık histolojik değişiklikler henüz belirgin değildir. Proksimal tübüller hafif/orta derecede genişleme/hipertrofi gösterir (sarı Ok). Ölçek çubukları: 30 μm. Orijinal büyütme 100x. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
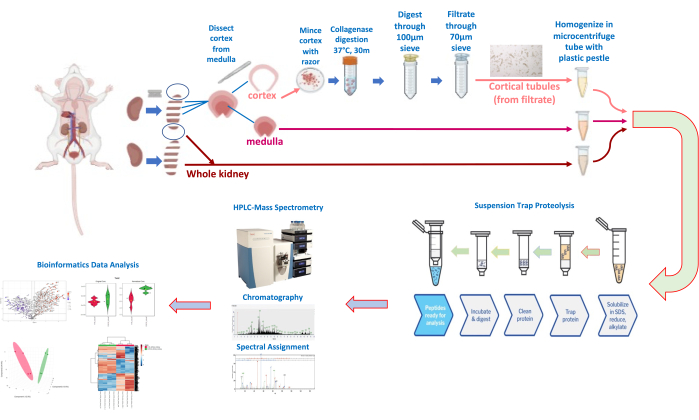
Şekil 3: Böbrek diseksiyonu ve tübül izolasyonu ve kantitatif proteomik iş akışı. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
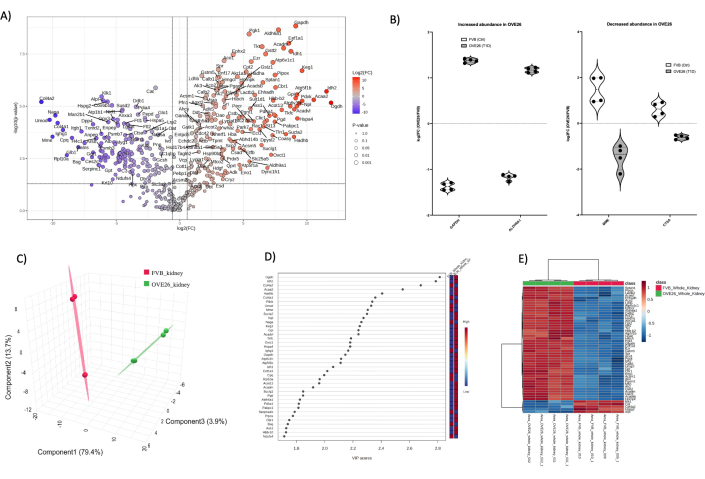
Şekil 4: OVE26 diyabetik tam fare böbrek proteomundaki küresel değişiklikler. (A) 1,5 kat negatif (mavi) veya pozitif (kırmızı) değişim ve dikey ve yatay çizgilerle gösterilen p < 0,05 kesme ile bir yanardağ grafiğinde düzeltilmemiş p-değerine (-log10 p-değeri) karşı çizilen log2FC'yi (OVE26/FVB'nin kat değişimi) gösterir, tüm önemli protein miktarları veri noktasında etiketlenir. (B) OVE26'da artan GAPDH ve ALDH6A1 ve OVE26 tam böbrekte azalan MME ve CTSA proteinleri için her bir replikasyon kantitasyonunun değişkenliğini gösteren keman grafikleri. (C) Kısmi en küçük kareler diskriminant analizi kullanılarak yapılan boyutsal indirgeme yaklaşımı, OVE26 (yeşil) ve FVB'nin (kırmızı) grup ayrımını gösterir. (D) Projeksiyon grafiğinin önem taşıyan değişkenleri, VIP skoru ile PLSDA analizlerinde bireysel proteinlerin katkısını gösterir. (E) Protein nicelemesinin yoğunluğundaki grup farklılıklarını gösteren üst modüle edilmiş proteinlerin hiyerarşik kümeleme ısı haritası. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
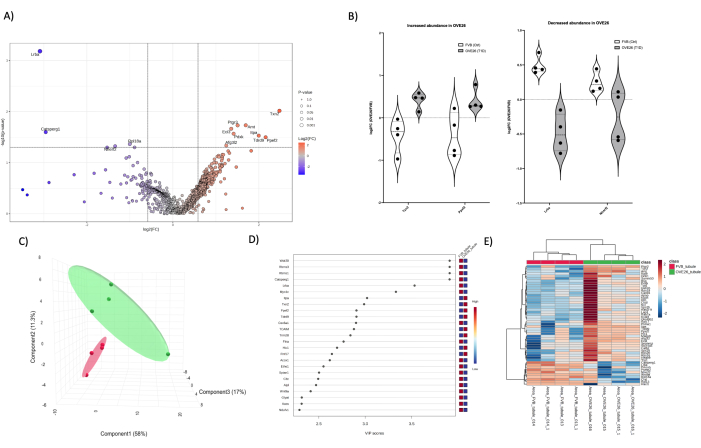
Şekil 5: OVE26 diyabetik kortikal tübül proteomundaki değişiklikler. (A) 1.5 kat negatif (mavi) veya pozitif (kırmızı) değişim ve p < 0.05 kesme ile bir yanardağ grafiğinde düzeltilmemiş p değerine (-log10 p değeri) karşı çizilen log2FC'yi (OVE26/FVB'nin kat değişimi) gösterir ve dikey ve yatay çizgilerle gösterilen p 0.05 kesmeler, tüm önemli protein miktarları veri noktasında etiketlenir. (B) OVE26'da artan ve OVE26'da azalan LRBA ve NHERF2 seçili proteinleri için her bir replike kantifikasyonunun değişkenliğini gösteren keman grafikleri. (C) Kısmi en küçük kareler diskriminant analizi kullanılarak yapılan boyutsal indirgeme yaklaşımı, OVE26 (yeşil) ve FVB'nin (kırmızı) grup ayrımını gösterir. (D) Projeksiyon grafiğinin önem değişkenleri, VIP skoru ile PLSDA analizlerinde bireysel proteinlerin katkısını gösterir. (E) Protein nicelemesinin yoğunluğundaki grup farklılıklarını gösteren üst modüle edilmiş proteinlerin hiyerarşik kümeleme ısı haritası. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
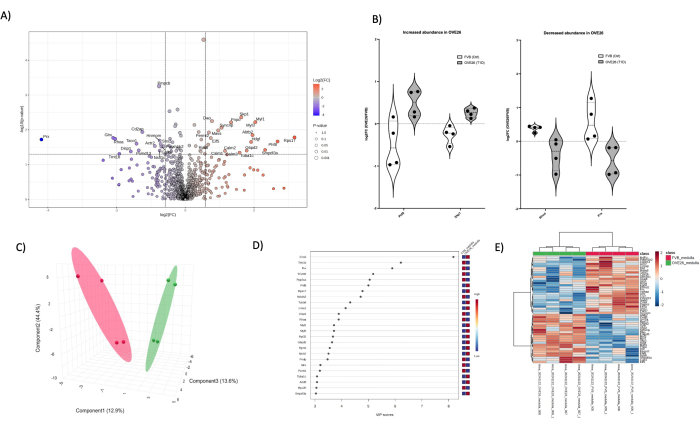
Şekil 6: OVE26 diyabetik medulla proteomundaki değişiklikler. (A) 1,5 kat negatif (mavi) veya pozitif (kırmızı) değişim ve dikey ve yatay çizgilerle gösterilen p 0,05 kesme < p değerine sahip bir yanardağ grafiğinde düzeltilmemiş p değerine (-log10 p değeri) karşı çizilen log2FC'yi (OVE26/FVB'nin kat değişimi) gösterir, tüm önemli protein miktarları veri noktasında etiketlenir. (B) OVE26'da artan ve OVE26 medüller proteomunda azalan RHOA ve PRX proteinleri PHF8 ve SKP1 için her bir replikat kantifikasyonunun değişkenliğini gösteren keman grafikleri. (C) Kısmi en küçük kareler diskriminant analizi kullanılarak yapılan boyutsal indirgeme yaklaşımı, OVE26 (yeşil) ve FVB'nin (kırmızı) grup ayrımını gösterir. (D) Projeksiyon grafiğinin önem değişkenleri, VIP skoru ile PLSDA analizlerinde bireysel proteinlerin katkısını gösterir. (E) Protein nicelemesinin yoğunluğundaki grup farklılıklarını gösteren üst modüle edilmiş proteinlerin hiyerarşik kümeleme ısı haritası. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 7: Tüm böbrek, tübül ve medüller proteomlarda diferansiyel olarak bol bulunan proteinlerin Venn diyagramı. Böbrek proteomları t-testi (p-val < 0.05) ve katlama değişim eşiği +/- 1.5FC ve VIP > 1.0 listeleri sonrasında karşılaştırıldı. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Ek Şekil 1: Panel 4D'de VIP protein listelerinin (VIP > 1) sunulmasıyla oluşturulan Gprofiler kullanılarak tüm böbrek proteom yolağı analizi. Şekil 4'teki PLSDA analizinden VIP skorları 1'den büyük olan proteinler için yol farklılıklarını analiz etmek için Gprofiler uygulandı. (A) Moleküler fonksiyonlar (MF), hücresel bileşen (CC) ve biyolojik süreç (BP) için p-değeri kesmeleri ile zenginleştirme grafiksel yolları gösterir. (B) Her spesifik süreç, işlev veya hücresel bölme için gen ontolojisi yolu zenginleştirme tablosu. (C) Tüm böbrek proteom moleküler fonksiyonları için spesifik protein zenginleştirme grafiği. Bu dosyayı indirmek için lütfen buraya tıklayın.
Tartışmalar
Bu teknik yaklaşımda sunulan yöntemler, böbreğin farklı bölgelerinin karşılaştırmalı proteom analizini göstermek için tasarlanmıştır. Burada, diyabetik (OVE26) ve kontrol (FVB) farelerinde medulla ve kortikal tübülleri izole etmek için yöntemler kullandık ve tüm böbreklerin proteomuna ek olarak böbreğin her bir bölümündeki proteomdaki temel farklılıkları göstermek için 1 boyutlu LC-MS/MS ve biyoinformatik analiz gerçekleştirdik.
Böbrek bölmelerinin izolasyonu, korteksin medulladan dikkatli bir şekilde diseksiyonunu gerektirir. Böbreklerin ilk enine dilimlenmesi ile ince dilimler korteksin daha güvenilir bir şekilde diseksiyonuna izin verecektir. Kortikal tübüllerin bir eleme yaklaşımı kullanılarak hazırlanması, glomerüllerin 70 μm eleklerden süzülmesine neden olabilir. Zenginleştirmeyi sağlamak için tübüllerin saflığını mikroskop altında kontrol etmek, ancak birbirini izleyen her yıkama adımında tübül kütlesi kaybını önlemek çok önemlidir. İlk eleme adımlarında sindirilmiş korteksin aşırı bastırılmasından kaçınmak, son tübül hazırlığındaki kontaminasyonu azaltabilir.
Süspansiyon yakalama yaklaşımları, kütle spektrometresi elüsyon adımlarında iyonik girişim olmaksızın çözündürme ve protein ekstraksiyon adımlarında büyük ölçüde esneklik sunar. Adım 2.10'da kritik derecede önemli olan, tripsinin (1:20 veya 1:10 çoğu uygulama için en uygun görünen) peptit konsantrasyonuna oranıdır. Proteinin etkili proteolizi, ancak spesifik olmayan bölünmelerin en aza indirilmesi daha tutarlı sonuçlar verecektir. Adım 2.4.1'deki alkilasyonu takip eden asitleştirme adımları, fosfopeptitlerin zenginleştirilmesi yapılacaksa formik veya trifloroasetik asit kullanabilir. Fosforik asit, metal afinite kromatografi reçinelerine bağlanan fosfopeptit ile rekabet edebilir.
Yolak analizi, temsili bir analizde gösterildiği gibi OVE26 böbreğindeki diyabetik hasarla ilgili yol farklılıklarını ve değişiklikleri belirtmek için kullanılabilir (Ek Şekil 1). Ontolojik açıklama ile gösterilen yolak analizindeki dikkate değer farklılıklar, renal nefronlardaki metabolizmanın heterojenliğini göstermektedir. Tüm böbrek proteomu, amino asit metabolik ve katabolik süreçlerinde, yağ asidi oksidasyonunda ve genel enerji yönetimi temalarında yer alan proteinler için belirgin şekilde zenginleştirilmiştir (Ek Şekil 1). Kortikal tübül proteomu, Şekil 5'te gösterildiği gibi, bu bölmede beklendiği gibi artan yapısal proteinlere ve iyon taşıyıcılarına sahipti. Medulla, karbonhidrat metabolizması proteinleri açısından zengindir (Şekil 6), çünkü bu bölge glikolitik enzimler açısından zengindir ve glukoz, glukoneogenez bölgesi olan renal korteks ile karşılaştırıldığında, dış medullada bir yakıt kaynağıdır ve glikoz, solunum için zayıf bir yakıttır19,20. Ayrıca, medulladaki kinaz sinyal yollarının zenginleşmesi, muhtemelen bu bölgedeki(21) interstisyel ozmolalite ve hücre boyutu dalgalanmalarını ve diyabet22 sırasında bu bölgeyle ilişkili metabolik bozuklukları ve oksidatif stresi yansıtmaktadır. Volkan grafiklerini, VIP grafiklerini ve ısı haritası sonuçlarını Gprofiler gibi bir yol zenginleştirme yaklaşımıyla birleştirmek, araştırmacıların yaralanma veya hastalığın farklı böbrek bölmelerindeki değişiklikler üzerindeki etkilerini daha iyi anlamalarına yardımcı olabilir. Ek analiz yazılımı seçenekleri arasında ontoloji ve yol karakterizasyonu için DAVID (https://davidbioinformatics.nih.gov/), Express Analyst (https://www.expressanalyst.ca/ExpressAnalyst/) ve PANTHERDB (https://www.pantherdb.org/) bulunur.
Sonuç olarak, total tüm böbrek proteomu (Şekil 4) ile kortikal tübül (Şekil 5) ve medulla (Şekil 6) kompartmanlarının proteomik olarak karşılaştırılması, böbreğin izole bölümleriyle karşılaştırıldığında tüm böbrek ekstraktlarındaki heterojenliği göstermek için yararlı bir yaklaşımdır. Ek olarak, izole edilmiş proteomlar, yüksek bolluklu (tüm doku) proteinlerin yokluğunda belirli yapıların proteomunun daha derine inilmesine izin verir, böylece orta bolluktaki (doku bölmeleri) ve son olarak düşük bolluktaki (tek hücreli) proteinlerin maskesini çıkarır. Sonuç olarak, ideal izolasyon, hücre dinamiklerinin ölçülmesine ve diyabet veya kronik böbrek hastalıkları gibi belirli bir patolojik durumla ilişkilendirilmesine izin vermek için tek hücre seviyelerinde olacaktır.
Açıklamalar
Yazarların herhangi bir açıklaması yoktur.
Teşekkürler
Bu proje için çalışmalar, MTB (NIH K01DK080951) ve TDC (NephCure-Pediatrik Nefroloji Araştırma Konsorsiyumu NKI-2023-04) ve Louisville Üniversitesi Böbrek Hastalığı Programı ve Proteomik Teknoloji Merkezi (TDC, MTB) için sağlanan fonlarla kısmen desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Collagenase type 1A | Millipore Signal | C9891 | |
| Exploris 480 Orbitrap | Thermofisher | https://www.thermofisher.com/order/catalog/product/BRE725539 | MS |
| Falcon Cell Strainer, 100 µm | VWR | 21008-950 | |
| Falcon Cell Strainer, 70 µm | VWR | 21008-952 | |
| Gibco PBS pH 7.4 | Thermo | 1001023 | |
| Halt Protease and Phosphatase Inhibitor Cocktail | VWR | PI78440 | |
| Iodoacetamide | Sigma Aldrich | I1149 | |
| MetaboAnalyst 6.0 | MetaboAnalyst 6.0 | https://www.metaboanalyst.ca/ | metabolomics data analysis platform |
| NanoDrop 2000 | Thermofisher | https://www.thermofisher.com/order/catalog/product/ND-2000 | |
| Oasis HLB column | Waters | 186002034 | |
| PEAKS 12.0 | Bioinformatics Solutions Inc | LC-MS/MS data analysis software | |
| Pestle for 1.5 mL Microtube | Fisher Scientific | NC0782485 | |
| Suspension Trap (S-trap) | Protifi | C02-micro-10 | |
| TCEP | ThermoFisher Scientific | 20490 | |
| TEABC | Sigma Aldrich | T7408 | |
| Trypsin Protease, MS-Grade | ThermoFisher Scientific | 90057 | |
| Ultrasonic Cleaner | Cole-Parmer | Model 0884900 |
Referanslar
- Ding, X., et al. Epidemiological patterns of chronic kidney disease attributed to type 2 diabetes from 1990-2019. Front Endocrinol. 15, 1383777 (2024).
- Liu, W., et al. Global trends in the burden of chronic kidney disease attributable to type 2 diabetes: an age-period-cohort analysis. Diabetes Obes Metab. 26 (2), 602-610 (2024).
- Xie, D., et al. Global burden and influencing factors of chronic kidney disease due to type 2 diabetes in adults aged 20-59 years, 1990-2019. Sci Rep. 13 (1), 20234 (2023).
- Giunti, S., Barit, D., Cooper, M. E. Mechanisms of diabetic nephropathy: role of hypertension. Hypertension. 48 (4), 519-526 (2006).
- Thomas, M. C., Burns, W. C., Cooper, M. E. Tubular changes in early diabetic nephropathy. Adv Chronic Kidney Dis. 12 (2), 177-186 (2005).
- Thomas, M. C., et al. Diabetic kidney disease. Nat Rev Dis Primers. 1, 15018 (2015).
- Nath, K. A. Tubulointerstitial changes as a major determinant in the progression of renal damage. Am J Kidney Dis. 20 (1), 1-17 (1992).
- Bonventre, J. V. Can we target tubular damage to prevent renal function decline in diabetes. Semin Nephrol. 32 (5), 452-462 (2012).
- Powell, D. W., et al. Renal tubulointerstitial fibrosis in OVE26 type 1 diabetic mice. Nephron Exp Nephrol. 111 (1), e11-e19 (2008).
- Cummins, T. D., et al. Quantitative mass spectrometry of diabetic kidney tubules identifies GRAP as a novel regulator of TGF-beta signaling. Biochim Biophys Acta. (4), 653-661 (2010).
- Barati, M. T., et al. Differential expression of endoplasmic reticulumstress-response proteins in different renal tubule subtypes of OVE26 diabetic mice. Cell Stress Chaperones. 21 (1), 155-166 (2016).
- Zheleznova, N. N., et al. Mitochondrial proteomic analysis reveals deficiencies in oxygen utilization in medullary thick ascending limb of Henle in the Dahl salt-sensitive rat. Physiol Genomics. 44 (17), 829-842 (2012).
- Nordquist, L., Palm, F. Diabetes-induced alterations in renal medullary microcirculation and metabolism. Curr Diabetes Rev. 3 (1), 53-65 (2007).
- dos Santos, E. A., Li, L. -. P., Ji, L., Prasad, P. V. Early changes with diabetes in renal medullary hemodynamics as evaluated by fiberoptic probes and BOLD magnetic resonance imaging. Invest Radiol. 42 (3), 157-162 (2007).
- Cummins, T. D., et al. Quantitative Mass Spectrometry Normalization in UrineBiomarker Analysis in Nephrotic Syndrome. Glomerular Dis. (3), 121-131 (2022).
- Carlson, E. C., Audette, J. L., Klevay, L. M., Nguyen, H., Epstein, P. N. Ultrastructural and functional analyses of nephropathy in calmodulin-induced diabetic transgenic mice. Anat Rec. 247 (1), 9-19 (1997).
- Zheng, S., et al. Development of late-stage diabetic nephropathy in OVE26 diabetic mice. Diabetes. 53 (12), 3248-3257 (2004).
- Wang, F., Veth, T., Kuipers, M., Altelaar, M., Stecker, K. E. Optimized suspension trapping method for phosphoproteomics sample preparation. Anal Chem. 95 (25), 9471-9479 (2023).
- Mather, A., Pollock, C. Glucose handling by the kidney. Kidney Int Suppl. 120, S1-S6 (2011).
- Ross, B. D., Espinal, J., Silva, P. Glucose metabolism in renal tubular function. Kidney Int. 29 (1), 54-67 (1986).
- Roger, F., Martin, P. Y., Rousselot, M., Favre, H., Féraille, E. Cell shrinkage triggers the activation of mitogen-activated protein kinases by hypertonicity in the rat kidney medullary thick ascending limb of the Henle's loop: requirement of p38 kinase for the regulatory volume increase response. J Biol Chem. 274 (48), 34103-34110 (1999).
- Yang, J., Lane, P. H., Pollock, J. S., Carmines, P. K. PKC-dependent superoxide production by the renal medullary thick ascending limb from diabetic rats. Am J Physiol Renal Physiol. 297 (5), F1220-F1228 (2009).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır