Method Article
Сравнительный протеомный анализ целых почек, мозгового вещества и корковых канальцев при диабетическом патогенезе повреждения почек у мышей
В этой статье
Резюме
Здесь мы представляем подробный протокол протеомного анализа всей почки, изолированных кортикальных канальцев и медуллярных протеомов. В исследовании также сравниваются регионарные протеомы в модели мышей с диабетом и мышей без диабета.
Аннотация
Определение последовательности событий при почечной недостаточности является краеугольным камнем клинической практики в инструментарии нефролога. Тканевые протеомные анализы являются важным подходом к пониманию фундаментальных физиологических и молекулярных процессов почечной патофизиологии. Методы и протоколы, которые мы представляем здесь, позволят проводить молекулярную диссекцию почки в каждой конкретной области, представляющей интерес в связи с последствиями заболевания. Чтобы определить влияние заболевания на конкретные области и структуры почек с уникальными функциями, целью данного протокола является демонстрация упрощенных методов компартментализации почек мышей и выделения канальцев коры почек почек в тандеме с оптимизированными количественными протеомными рабочими процессами без меток. Сочетание этих методов поможет в идентификации нарушенных молекулярных паттернов во всей почке, медуллярных компартментах и структурах корковых канальцев почек, с конечной и конечной целью протеомики одиночных клеток в патологических контекстах. Применение этих методов практически на любой модели заболевания будет полезно для определения механизмов патологии, связанной с дисфункцией почек.
Введение
Хроническая болезнь почек (ХБП) является серьезной проблемой в современной медицине, составляя более 86 миллиардов долларов расходов на здравоохранение только в Соединенных Штатах1. Во всем мире заболеваемость ХБП растет с распространением диабета и связанных с ним почечных заболеваний. Около 14 % населения США страдают ХБП (годовой отчет USRDS 2024). Кроме того, диабетическая нефропатия является формой ХБП и основной причиной терминальной стадии почечной недостаточности (ТХПН), и 60% пациентов с ТХПН имеют диабет 1,2,3. Диабет поражает все почечные структуры и типы клеток нефронов, функциональной единицы почек. Как показано на рисунке 1, различные участки нефронов содержатся в коре головного мозга почек и мозговом веществе. Большая часть почки состоит из канальцев. Дисфункция почечных канальцев и структурные поражения в значительной степени способствуют развитию диабетической нефропатии (ДН), и эти изменения хорошо коррелируют со скоростью снижения функции почек 4,5,6,7,8. На ранних стадиях сахарного диабета, в ответ на повышенное поглощение глюкозы и связанное с ним поглощение натрия, а также потребность в мембранном транспортном белке во всех сегментах канальцев, канальцы подвергаются гипертрофии. При повышенном микрососудистом повреждении на более поздних стадиях диабета канальцы демонстрируют атрофию и расширение, при этом наблюдается фиброз и расширение интерстиция9. Предыдущие исследования, проведенные в нашей лаборатории, обнаружили измененные протеомы и обилие белков реакции на стресс в корковых канальцах мышей с диабетом 10,11. Мозговое вещество играет важную роль в регулировании концентрации мочи, а дисфункция при заболевании почек связана с окислительным стрессом, при этом диабет приводит к снижению напряжения кислорода в этой области почки из-за повышенного потребления кислорода в результате метаболической активности, повышенной активности мембранных транспортных белков и микрососудистого повреждения 12,13,14.
Понимание детальных механизмов развития и прогрессирования ДН является постоянной работой, которая потребует новых и комплексных подходов, включающих моделирование заболевания и молекулярное профилирование сигнальных процессов, адаптивные изменения в динамике клеточных белков и точное определение компонентов почечных клеток и тканей, пострадавших от повреждения при хронических состояниях. Протеомика, метаболомика и транскриптомика дают возможность аналитического исследования молекулярных механизмов заболеваний почек. Омика — это относительно новая область, которая использует подходы системной биологии для получения более глобального понимания биологических систем. В последние десятилетия протеомика является мощным инструментом омиксов в нефрологии. За последние 20 лет исследования биомаркеров расширились, о чем свидетельствует рост числа публикаций, хотя для полного внедрения этих результатовв клинику необходима обширная работа. Учитывая различия в популяциях клеток канальцев и соответствующих функциональных ролях в коре и мозговом мозге почек, протеомный анализ целых почек может скрыть уникальные изменения, связанные со специфическими структурами в этих различных областях. Таким образом, целями данного исследования являются демонстрация разделения почечной коры и мозгового вещества, а также отделения корковых канальцев от клубочков с последующими подробными протоколами приготовления белковых экстрактов из изолированных структур для современных масс-спектрометрических и биоинформатических анализов. Мышиные модели диабетической нефропатии играют важную роль в определении механизмов прогрессирования заболевания. Для этого исследования мы использовали трансгенную мышь OVE26, у которой развивается сахарный диабет I типа с ранним началом и проявляются особенности ранней и поздней стадии ДН у человека, включая 1) раннее повышение и последующее снижение скорости клубочковой фильтрации, 2) гипертрофию почек, 3) утолщение базальной мембраны клубочков и расширение мезангиального пространства, 4) тяжелую протеинурию и 5) тубулоинтерстициальный фиброз9, 16,17. Двухмесячные мыши были отобраны для демонстрации протеомных изменений в компартментах канальцев до явных структурных поражений. Как сообщалось ранее и показано на рисунке 2, у 2-месячных мышей OVE26 наблюдалось расширение клубочкового мезангиального матрикса (рисунок 2, зеленая стрелка) и тяжелая протеинурия17 без явных гистологических изменений проксимальных канальцев (рисунок 2, желтая стрелка) у молодых мышей с диабетом. В данной работе мы представляем комбинированный подход к количественной протеомике для характеристики всей почки, мозгового вещества и корковых канальцев для выяснения и иллюстрации различий в протеоме в каждом отделе при диабете.
протокол
Исследования с мышами OVE26 и FVB были одобрены руководящими принципами Комитета по уходу за животными и их использованию (IACUC) Университета Луисвилля. Трансгенная женская OVE26 (диабетическая; Штамм #:005564) и FVB (недиабетический; фоновый штамм; Штамм #:001800) были приобретены в Jackson Laboratories (Bar Harbor, ME). Животных поддерживали в 12-часовом цикле свет/темнота при температуре 25 °C и предоставляли свободный доступ к воде и пище. Все исследования проводились на мышах в возрасте 2 месяцев.
1. Животная модель
- Выделение почек
- Обезболивайте мышей путем внутрибрюшинного введения 80 мг/кг кетамина и 12 мг/кг ксилазина.
- Сделайте разрез по средней линии живота маленькими хирургическими ножницами и аккуратно переместите кишечник наружу и в сторону мыши с помощью тампонов, чтобы обнажить полую вену.
- Сделайте небольшой надрез в полой вене над правой почкой.
- Перфузируйте мышь через левый желудочек 20 мл холодного фосфатно-солевого буфера (PBS: pH 7,4; 210 мг/л KH2PO4, 9 г/л NaCl, 726 мг/л Na2HPO4·7H2O) с помощью перистальтического насоса со скоростью 10 мл/мин.
ПРИМЕЧАНИЕ: Этот шаг не требуется, если включение белков и клеток крови в почки не является критическим фактором при последующих анализах. - Удалите почки с помощью небольших хирургических ножниц. Удалите лишний жир с внешней стороны почек. Взвесьте почки и поместите их в холодные ПБС на льду.
- Извлеките капсулу из почки.
- Поместите почки на стеклянную тарелку или чашку Петри, поставленную на лед. Сделайте несколько поперечных надрезов через почки с помощью лезвия бритвы (рисунок 3), чтобы в итоге получилось 3-4 надреза между верхним и нижним полюсами почек.
- Оставьте 1-2 средних среза и два полюса (обведенные кружками срезы почек на рисунке 3) из каждой почки, чтобы они служили образцами «целой почки». Поместите порцию в центрифужные пробирки объемом 1,5 мл и добавьте ледяной гомогенизационный буфер (10% глицерина, 50 мМ HEPES, 100 мМ KCl, 2 мМ ЭДТА, 0,1% NP40, 10 мМ NaF, 0,25 мМ NaVO3, 1x ингибитор протеазы HALTS) в количестве примерно 10 мкл/мг образца ткани (на основе расчетной массы срезов почки, полученной из приобретенной массы почки). Оставьте тюбик на льду.
- Для оставшейся части средних поперечных срезов положите срез ровно и аккуратно срежьте кору (внешний 1 мм) с каждого среза с помощью лезвия бритвы или скальпеля (рис. 3, схема рабочего процесса). Держите кору головного мозга отдельно от областей мозгового мозга для протокола выделения корковых канальцев (ниже, шаг 1.3).
- Поместите часть расчлененного мозгового вещества в центрифужные пробирки объемом 1,5 мл, добавьте ледяной гомогенизационный буфер, как в шаге 1.1.8, и оставьте пробирку на льду.
- Заморозьте в жидком азоте все оставшиеся целые почки и кусочки мозгового вещества, не используемые для гомогенизации, и храните при температуре -80 °С.
- В качестве альтернативы заморозьте все отделенные целые почечные и мозговые отделения и храните их, как описано в шаге 1.1.11. Извлеките их из хранилища на более позднее время для добавления буфера гомогенизации, как описано в шаге 1.1.8.
- Изоляция корковых канальцев
- Рассеченную кору измельчите на кусочки по 1-3 мм на стеклянной тарелке или чашке Петри лезвием бритвы, формируя пасту.
- Расщепите измельченный кору в 1 мл коллагеназы типа IA (1 мг/мл) в течение 30 мин при 37 °C на водяной бане.
- Поместите клеточное ситечко размером 100 мкм поверх конической трубки объемом 50 мл на льду.
- Поместите переваренную кортикальную суспензию на сетчатый фильтр 100 мкм и осторожно продавите через ситечко с помощью поршня шприца объемом 10 мл. Промойте верхнюю часть ситечка 1 мл PBS, а нижнюю часть ситечка — 1 мл PBS.
- Пропустите фильтрат в пробирке объемом 50 мл через дополнительное ситечко 100 мкм, затем промойте верхнюю часть фильтра 1 мл PBS.
- Пропустите фильтрат через сетчатое фильтр 70 мкм, помещенное на коническую пробирку объемом 50 мл на льду. Канальцы будут проходить через этот сетчатый фильтр в фильтрат (клубочки будут удерживаться на сетчатом фильтре 70 мкм). Промойте ситечко 1 мл PBS.
- Вращайте окончательный фильтрат при 120 × г в течение 2 минут при 4 °C. Выбросьте излишки PBS из гранул канальцев.
- Проверьте чистоту гранулы корковых канальцев с помощью визуализации под микроскопом с использованием объектива 10-кратного увеличения. Если более 10% фракции содержит клубочки, повторно суспендируйте фильтрат с 1 мл PBS и пропустите через чистое сетчатое фильтр размером 70 мкм без какой-либо дополнительной промывки фильтра.
- Распределите обогащенную фракцию канальцев по центрифужным пробиркам объемом 1,5 мл и вращайте при температуре 2000 × г в течение 2 мин при 4 °C. Выбросьте надосадочную жидкость.
- Добавьте гомогенизационный буфер в гранулу канальца как для целой почки и мозгового вещества (шаги 1.1.8 и 1.1.10).
- Гомогенизация тканей/экстракция белка
- Гомогенизируйте каждый тип образца в микроцентрифужных пробирках объемом 1,5 мл с помощью пластикового пестика, специально предназначенного для пробирок объемом 1,5 мл. Если гомогенизированная суспензия слишком густая, при необходимости добавьте дополнительный буфер для гомогенизации.
- Гомогенизированную суспензию оставить на льду на 15 минут, а затем провести ультразвуковую обработку в течение 5 минут в ультразвуковом аппарате для ванны (только выключатель, без регулируемых настроек на устройстве), с водой в ванне при температуре 25 °C. Оставьте образцы на льду на 10 минут.
- Кратковременно вихрь (1000-1500 об/мин) гомогенизировать, затем растирать пипеткой 20 раз и оставить на льду еще на 15 минут.
- Перед центрифугированием образцы измельчить несколько раз при 13 000 × г в течение 20 мин при 4 °C.
- Переложите очищенные белковые экстракты в чистые пробирки.
- Аликвота 30 мкл очищенного экстракта для оценки белка и пробоподготовки для масс-спектрометрического анализа. Храните остальные образцы при температуре -80 °C.
2. Протокол разложения в мини-колонке Suspension-Trap
- Протеолитическое расщепление белков в триптические фрагменты для протеомных анализов
- Развести ~40-50 мкг образца (в концентрации ~2 мкг/мкл) в буфере для лизиса образца (10% w/v додецилсульфата натрия [SDS] в 100 мМ триэтиламмония бикарбонате (TEA-BC) pH 8,5, 40 мМ трис (2-карбоксиэтил)фосфин [TCEP]) до конечного объема 46 мкл.
- Восстановление и алкилирование белков
- Инкубировать при температуре 65 °C в течение 30 мин (конечная концентрация TCEP составляет 20 мМ).
- Добавить 4 мкл 0,5 М йодоацетамида в воду жидкостного хромато-масс-спектрометрического качества (ЖХ-МС) и инкубировать при комнатной температуре (ОТ) в темноте в течение 30 мин (конечная концентрация йодоацетамида 40 мМ).
- Добавьте 5 мкл 12% мас.в/м фосфорной кислоты в воду класса LC-MS (разбавьте 141 мкл 85% фосфорной кислоты в 859 мкл воды для получения 12% раствора).
- В качестве альтернативы фосфорной кислоте используйте трифторуксусную кислоту или муравьиную кислоту при выполнении обогащения фосфопептидами18.
- Добавьте 350 мкл буфера, связывающего суспензию и ловушку (100 мМ ТЭА-БК в 90% v/v метанола/10% v/v воды pH 7,55).
- Добавьте образец в колонку суспензии-ловушки. Центрифугируйте при давлении 4 000 × g в течение 30 с при RT в роторе с фиксированным углом наклона, чтобы пропустить каждый объем через колонку.
- Промойте 4x 400 μл буфера для связывания суспензии-ловушки. Центрифугируйте при давлении 4 000 x g в течение 30 с при RT в роторе с фиксированным углом наклона для пропускания каждой промывки через колонну.
ПРИМЕЧАНИЕ: Чтобы облегчить удаление паспорта безопасности, поворачивайте колонку в роторе на 180° после каждой промывки. - Центрифугируйте при 4 000 г в течение 1 минуты при RT для полного удаления связывающего буфера (предотвращает капание во время разложения).
- Перенесите колонну суспензии-ловушки в чистую сборную трубку.
- Добавьте 2,5-5 мкг трипсина в 125 мкл 50 мкм TEA-BC pH 8,5 в воде класса LC-MS (Trypsin Protease, MS-Grade). Конечное соотношение трипсина к образцу составляет от 1:20 до 1:10.
- Выдерживать при температуре 47 °C в течение 2 ч (не затягивать крышку; предпочтительно использовать термомиксер, установленный на 0 об/мин). Протыкание иголкой отверстия в колпачке может помешать наращиванию давления в верхней камере суспензионной ловушки (повышенное давление приведет к тому, что раствор трипсина будет капать через колонку).
- Добавьте 80 μЛ 50 мМ TEA-BC pH 8,5 в воду класса LC-MS. Центрифугируйте при 4 000 g при RT в течение 1 минуты в роторе с фиксированным углом, чтобы пропустить каждый дигест через колонну.
- Добавьте 80 мкл 0,2% v/v муравьиной кислоты в воду класса LC-MS. Центрифугируйте при 4 000 g в течение 1 минуты при RT в роторе с фиксированным углом наклона для сбора с дигестом, начиная с шага 2.11.
- Добавьте 80 мкл 50% v/v ацетонитрила в воду класса LC-MS. Центрифугируйте при 4 000 g при RT в течение 1 мин в роторе с фиксированным углом наклона для сбора с дигезом из шага 2.11.
- Хранить суспензию в ловушке при температуре -80 °С.
- Высушите образец в вакуумном концентраторе.
- Храните высушенный образец при температуре -80 °C.
3. Очистка с помощью колонки гидрофильно-липофильного баланса (ГЛБ)
- Приготовьте растворы А (2% v/v ацетонитрила/0,1% v/v муравьиной кислоты) и B (80% v/v ацетонитрила/0,1% v/v муравьиной кислоты).
- Растворите образец в 500 мкл раствора А.
- Поместите колонку в вакуумный коллектор и подайте давление газа со скоростью ~1-2 мл/мин.
- Добавьте 500 мкл раствора Б в колонку ГЛБ и откачайте со скоростью 1-2 мл/мин; Повторите дважды.
- Добавьте 750 мкл раствора А в колонку ГЛБ и откачайте со скоростью 1-2 мл/мин; Повторите дважды.
- Поместите чистую микропробирку объемом 2 мл в штатив под колонкой HLB, загрузите образец в 500 мкл раствора А и давление газа, как указано выше; Пропустите проточный поток в колонку второй раз.
- Поместите колонну HLB над сливной трубкой, добавьте 500 μL раствора A и откачайте, как указано выше; Повторите дважды.
- Поместите колонку над чистой микропробиркой объемом 2 мл, добавьте 500 мкл раствора B и откачайте, как указано выше; Повторите дважды.
- Заморозьте элюат при температуре -80 °C, затем высушите в вакуумном концентраторе. Высушенный остаток хранить при температуре -80 °C.
- Растворите остаток в 20 мкл 2% v/v ацетонитрила/0,1% v/v муравьиной кислоты перед анализом MS. С помощью спектрофотометра оценивают концентрацию пептидов при поглощении 205 нм.
4. Масс-спектрометрический анализ
- Одномерная обратнофазовая жидкостная хроматография (ЖХ)-МС/МС
- Введите равное по массе количество пептидов (~600 нг) в 1-мерный нано-LC и фракционируйте его на колонках с обратной фазой C18.
- Выведите пептиды непосредственно в МС при напряжении распыления 1,8 кВ, при этом ионная передающая трубка поддерживается на уровне 250 °C.
- Получение спектров в режиме 20 верхних ионов, зависящем от данных, в котором наиболее интенсивный фрагмент MS/MS удаляется из очереди анализа, чтобы улучшить глубину картирования ионов на ионах с более низким содержанием.
5. Анализ данных и биоинформатика
- Порядок обработки данных
- После назначения спектров и идентификации пептидов и белков в PEAKS 12.0 (программное обеспечение для анализа данных LC-MS/MS) отправьте списки белков для анализа в MetaboAnalyst 6.0 (платформа анализа метаболомных данных) с использованием однофакторного статистического анализа (https://www.metaboanalyst.ca/).
- Используйте программное обеспечение для анализа данных LC-MS/MS для поиска и фильтрации спектров с использованием строгих критериев коэффициента ложных открытий (FDR) (1% белка и пептида) по базе данных FASTA Mouse Reviewed.
ПРИМЕЧАНИЕ: Альтернативные программы поиска, которые легко доступны, включают Maxquant, Proteome Discoverer и другие широко используемые варианты. - Укажите карбамидометилирование цистеина как фиксированную модификацию. В качестве переменной модификации укажите окисление метионина.
- Преобразуйте списки в формат значений, разделенных запятыми (CSV), и назначьте метки группировок и образцов для каждого столбца и строки. Этот формат является гибким в платформе анализа данных метаболомики.
- Импутируйте отсутствующие значения с помощью правила минимального значения 1/5 для отсутствующих переменных.
- Отфильтруйте данные, чтобы исключить сильно изменчивые значения с помощью межквартильного диапазона, где дисперсия 40% используется для отсечения.
- Нормализуйте значения до медианной интенсивности, преобразуйте логарифм10 и центрируйте среднее значение для масштабирования. Используйте другие подходы к нормализации, помня о том, что результаты могут отличаться.
- Выполняйте T-тесты в непарном режиме с отсечкой p-значения < 0,05. На этом этапе выполните несколько тестовых коррекций.
ПРИМЕЧАНИЕ: В данном исследовании не выполнялась эта коррекция для репрезентативного набора данных для целей представления данных. - Укажите графики вулканов для 1,5-кратного изменения (FC) и p < 0,05.
- Создание тепловых карт и выполнение дискриминантного анализа по методу частичных наименьших квадратов (PLSDA) и статистического анализа (переменная важности проекции [VIP]) выборочных групп.
- Потенциальные кандидаты на последующее наблюдение либо достаточно надежны, чтобы затмить 1,5FC и p-val < 0,05, либо VIP > 1,0, как показано в анализе PLSDA.
- Сгенерируйте диаграммы Венна, чтобы проиллюстрировать различия в протеоме всей почки, канальца и мозгового вещества у мышей OVE26.
Результаты
В целом, общая идентификация белков из каждого типа образцов была следующей: 1) цельная почка (1438) 2) мозговое вещество (2145) и корковые канальцы (1859). После обработки данных в MetaboAnalyst 6.0, фильтрации данных и условного расчета, окончательно проанализированы идентификации белков для каждого почечного компартмента: целая почка (455), мозговое вещество (997) и корковые канальцы (896). На рисунке 4 показаны глобальные протеомные изменения в почках мышей с диабетом OVE26. Количественный анализ без меток (LFQ) позволяет обеспечить глубокое покрытие протеома, обеспечивая при этом большую вариабельность в общем наборе данных по сравнению с репортерным ионным мечением (TMT, iTRAQ и т. д.). Одним из подходов к преодолению вариабельности LFQ является увеличение количества анализируемых образцов для каждого состояния. Здесь мы использовали подход к количественной оценке, основанный на интенсивности, из поисковых алгоритмов PEAKS с коэффициентом ложных открытий (FDR) 1% на уровне назначения пептидов и белков, чтобы обеспечить надежную генерацию набора данных в нашем парном сравнении двух животных в каждом состоянии с включенными техническими репликами. На рисунке 4A показано log2FC (изменение сворачивания), построенное относительно нескорректированного p-значения (p-значение < 0,05). Как правило, p-значение корректируется при многократном сравнительном тестировании, когда целью является валидация надежных белков-кандидатов для ортогонального наблюдения. Здесь мы показываем полное нескорректированное сравнение протеома между OVE26 и FVB на графике вулкана для целей презентации. В качестве первоначального обзора количественного анализа графики вулканов изображают предварительный просмотр потенциально интересных кандидатов с биологическими последствиями. На рисунке 4A показано соотношение количественного определения белка OVE26 в зависимости от контрольного штамма FVB в протеомах цельной почки. Примечательно, что GAPDH устойчиво активируется в почках OVE26 вместе с ALDH6A1, что позволяет предположить метаболические реакции в почках с ранним диабетом. На рисунке 4B представлены отдельные графики скрипки, иллюстрирующие вариабельность и эффекты нормализации данных с помощью MetaboAnalyst 6.0. Обратите внимание на стойкое подавление матриксной металлоэндопептидазы (MME) и катепсина А (CTSA) в целой почке мыши OVE26. Чтобы проиллюстрировать общие различия протеома во всей почке, отфильтрованный набор данных протеома может быть представлен для уменьшения размерности и контролируемого многомерного анализа (PLSDA, sPLSDA, oPLSDA), чтобы показать различия на уровне группы и найти переменные, имеющие значение проекции (VIP). Для этого мы выполнили PLSDA на протеоме почек OVE26 и FVB, как показано на рисунке 4C, а VIP показаны на рисунке 4D. Анализы PLSDA показывают надежное разделение протеома OVE26 (зеленый) по сравнению с контрольным протеомом почек FVB (красный). Баллы VIP > 1, как правило, являются хорошими переменными-кандидатами, в данном случае белками, для дальнейшего анализа обогащения онтологии путей с использованием Gprofiler (https://biit.cs.ut.ee/gprofiler/gost), показанных на графиках в разделе «Дополнительные рисунки» (дополнительный рисунок 1). Примечательно, что многие из белковых VIP-спектров обнаружены в анализе вулканических графиков на рисунке 4A. Идентификация списков кандидатов для дальнейшего анализа должна включать белки с большим кратным изменением, статистически достоверные и значимые белки, участвующие в групповой стратификации (VIPs>1). Дальнейшая иллюстрация различий в протеомах на групповом уровне и на уровне отдельных белков может быть визуализирована в виде иерархических тепловых карт с кластеризацией групп и признаков, как показано на рисунке 4E.
Для сравнения мы выполнили 1-мерный количественный протеомный анализ ЖХ-МС/МС на изолированных корковых канальцах (рис. 5) и мозговом веществе (рис. 6) у мышей OVE26 и FVB, чтобы проиллюстрировать способность сверлить протеом конкретных участков почки с эффективной глубиной обнаружения в отсутствие компонентов с более высоким содержанием. Наконец, перекрытие в протеоме может быть проиллюстрировано сравнением общих значимых идентификаций и наложением наиболее статистически значимых белков в каждом состоянии (целая почка, канальцы и мозговое вещество), как показано на диаграмме Венна (рис. 7). В частности, мы используем комбинированный подход t-критерия и VIP (переменная важности проекции) из статистических подходов PLSDA к уменьшению размерности (рисунок 4C, D, рисунок 5C, D и рисунок 6C, D) для определения потенциальных последующих белков-кандидатов. Следует отметить, что критерии t-stat (T-критерий) (рис. 7A) наиболее поддаются идентификации большего числа белков выше порогового значения во всей почке и, в меньшей степени, в мозговом веществе и канальцах. Использование другого статистического порога (VIP > 1) на рисунке 7B для расширения списка кандидатов дало более равномерно распределенные и новые белки-кандидаты в протеомного анализе мозгового вещества и корковых канальцев. Примечательно отсутствие перекрытия в каждом из 3 протеомов, так как либо 0, либо 2 кандидата были совместно использованы с использованием любого подхода. Для более глубокого сверления протеома почки можно применять несколько подходов. Выделение и фракционирование протеома на уровне ткани и тканевого компартмента является начальным подходом, который может дать надежные результаты, как показано сравнением диаграммы Венна (рис. 7) в подходах t-критерия и сортировки VIP. Все необработанные файлы и списки пиковых значений будут помещены в MASSIVE (massive.ucsd.edu) в соответствии со стандартами HUPO и опубликованы в качестве частичного представления после публикации.
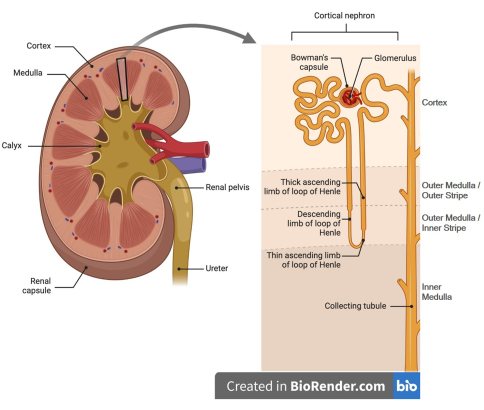
Рисунок 1: Мультяшное изображение почечного нефрона. (Левая панель) Почки имеют кору (внешнюю) и мозговое вещество (внутреннюю) области. (Правая панель) Кора почек содержит клубочки и соответствующую капсулу Боумана, проксимальные извилистые канальцы и большую часть его прямого сегмента, участки толстых восходящих петель Генле, дистальные извитые канальцы, корковые сегменты собирательных протоков и перитубулярные капилляры (не показаны). Мозговое вещество состоит из нисходящей и восходящей петель Генле, медуллярной части толстой восходящей петли Генле и собирающих протоков, а также капилляров vasa recta, окружающих эти сегменты канальцев (не показаны). Фигура была сгенерирована с помощью Biorender. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 2: Репрезентативное окрашивание PAS (периодическое кислотное окрашивание по Шиффу) для демонстрации гистологии у 2-месячных мышей FVB (без диабета) и OVE26 (диабетических). Клубочки (зеленая стрелка) у мышей с диабетом демонстрируют повышенное окрашивание розовым цветом PAS, демонстрируя расширение мезангиального пространства, в то время как явные гистологические изменения тубулоинтерстиция еще не очевидны у молодых мышей с диабетом. Проксимальные канальцы демонстрируют незначительное/умеренное увеличение/гипертрофию (желтая стрелка). Масштабные линейки: 30 μм. Оригинальное увеличение 100x. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
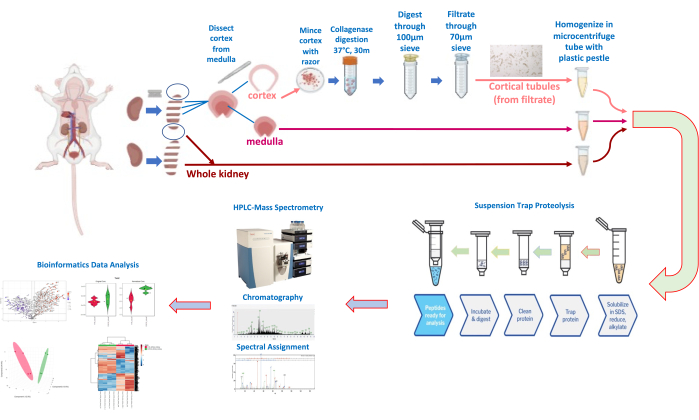
Рисунок 3: Диссекция почек и выделение канальцев и количественная протеомика. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
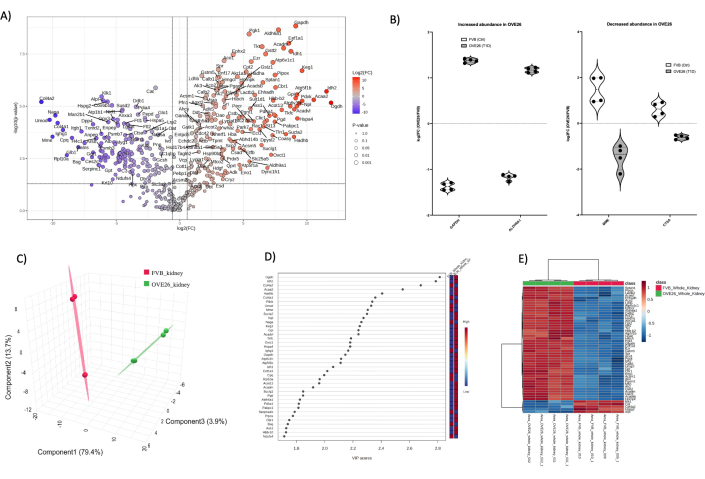
Рисунок 4: Глобальные изменения в протеоме целой почки мыши при диабете OVE26. (A) Показывает log2FC (кратное изменение OVE26/FVB) относительно нескорректированного p-значения (-log10 p-value) на графике вулкана с 1,5-кратным отрицательным (синим) или положительным (красным) изменением и p < 0,05 пределами, обозначенными вертикальными и горизонтальными линиями, все значимые количественные определения белков помечены в точке данных. (B) Графики Скрипки, показывающие вариабельность количественного определения каждой реплики для отдельных белков GAPDH и ALDH6A1 увеличение в OVE26 и MME, а также уменьшение CTSA в целой почке OVE26. (C) Подход к уменьшению размерности с использованием дискриминантного анализа по методу частичных наименьших квадратов показывает групповое разделение OVE26 (зеленый) и FVB (красный). (D) Переменные, имеющие значение для проекционного графика, показывают вклад отдельных белков в анализы PLSDA по оценке VIP. (E) Иерархическая кластерная тепловая карта верхних модулированных белков, указывающая на групповые различия в интенсивности количественного определения белка. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
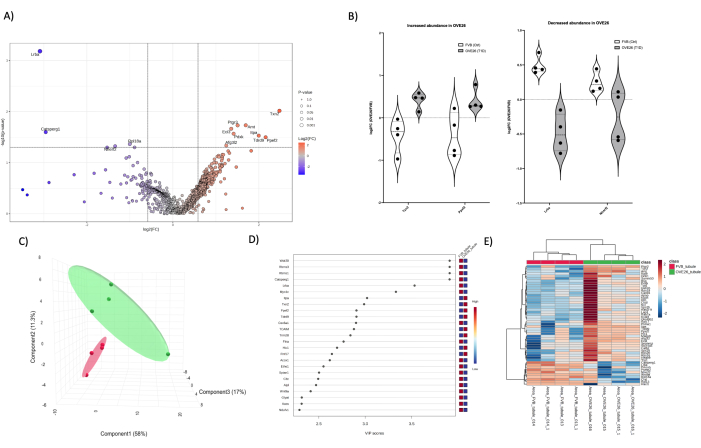
Рисунок 5: Изменения в протеоме диабетических канальцев коры головного мозга OVE26. (A) Показывает log2FC (кратное изменение OVE26/FVB), построенное относительно нескорректированного p-значения (-log10 p-значения) на графике вулкана с 1,5-кратным отрицательным (синим) или положительным (красным) изменением и p < 0,05 пределами, обозначенными вертикальными и горизонтальными линиями, все значимые количественные определения белков помечены в точке данных. (B) Графики Скрипки, показывающие вариабельность количественного определения каждой реплики для отдельных белков TXN2 и PPEF2, увеличение в OVE26 и LRBA и NHERF2, уменьшение в трубчатом протеоме OVE26. (C) Подход к уменьшению размерности с использованием дискриминантного анализа по методу частичных наименьших квадратов показывает групповое разделение OVE26 (зеленый) и FVB (красный). (D) Переменные важности проекционного графика показывают вклад отдельных белков в анализы PLSDA по шкале VIP. (E) Иерархическая кластерная тепловая карта верхних модулированных белков, указывающая на групповые различия в интенсивности количественного определения белка. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
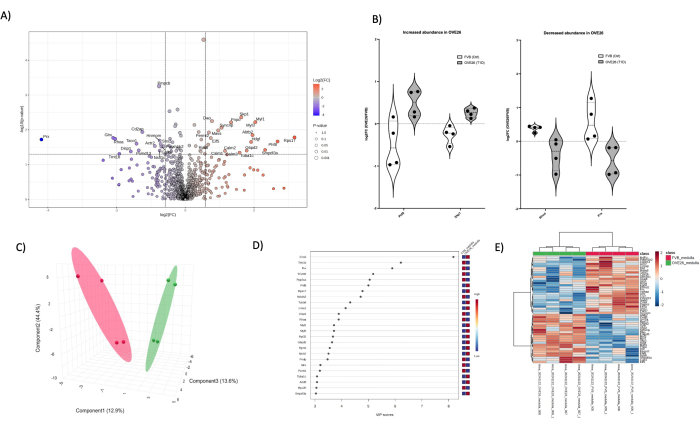
Рисунок 6: Изменения в протеоме диабетического мозгового мозга OVE26. (A) Показано log2FC (кратное изменение OVE26/FVB) относительно нескорректированного p-значения (-log10 p-значения) на графике вулкана с 1,5-кратным отрицательным (синим) или положительным (красным) изменением и p < 0,05 пределами, обозначенными вертикальными и горизонтальными линиями, все значимые количественные определения белков помечены в точке данных. (B) Графики Скрипки, показывающие вариабельность количественного определения каждой реплики для отдельных белков PHF8 и SKP1, увеличение в OVE26 и RHOA, а также уменьшение PRX в медуллярном протеоме OVE26. (C) Подход к уменьшению размерности с использованием дискриминантного анализа по методу частичных наименьших квадратов показывает групповое разделение OVE26 (зеленый) и FVB (красный). (D) Переменные важности проекционного графика показывают вклад отдельных белков в анализы PLSDA по шкале VIP. (E) Иерархическая кластерная тепловая карта верхних модулированных белков, указывающая на групповые различия в интенсивности количественного определения белка. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 7: Диаграмма Венна дифференциально распространенных белков в цельных почках, канальцах и медуллярных протеомах. Протеомы почек сравнивали по t-критерию (p-val < 0,05) и порогу кратного изменения +/- 1,5FC и спискам VIP > 1,0. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Дополнительный рисунок 1: Анализ протеомных путей всей почки с помощью Gprofiler, полученный путем представления списков белков VIP (VIP > 1) на панели 4D. Gprofiler был реализован для анализа различий в путях для белков с баллами VIP более 1 по результатам анализа PLSDA на рисунке 4. (A) Показывает графическое обогащение путей с помощью p-значений пороговых значений для молекулярных функций (MF), клеточного компонента (CC) и биологического процесса (BP). (B) Таблица обогащения онтологического пути генов для каждого конкретного процесса, функции или клеточного компартмента. (C) График специфического обогащения белками для молекулярных функций протеома цельной почки. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Обсуждение
Методы, представленные в данном техническом подходе, призваны проиллюстрировать сравнительный протеомный анализ различных областей почки. Здесь мы использовали методы выделения мозгового вещества и корковых канальцев у мышей с диабетом (OVE26) и контрольной (FVB) мышей, а также выполнили одномерный ЖХ-МС/МС и биоинформатический анализ, чтобы проиллюстрировать основные различия в протеоме в каждой части почки, в дополнение к протеому целых почек.
Изоляция почечных компартментов требует тщательного вскрытия коры головного мозга в сторону от мозгового вещества. При первоначальном поперечном срезе почек тонкие срезы позволят более надежно рассекать кору головного мозга. Подготовка корковых канальцев с использованием метода просеивания может привести к фильтрации клубочков через сита 70 мкм. Очень важно проверять чистоту канальцев под микроскопом, чтобы обеспечить обогащение, но не допускать потери массы канальцев при каждом последующем этапе промывки. Избегание чрезмерного давления на переваренную кору головного мозга на начальных этапах просеивания может уменьшить загрязнение при окончательной подготовке канальцев.
Подходы с захватом суспензии обеспечивают большую степень гибкости на этапах солюбилизации и экстракции белка без ионного вмешательства на этапах элюирования масс-спектрометрии. Критически важным на шаге 2.10 является отношение трипсина (1:20 или 1:10 представляются оптимальными для большинства применений) к концентрации пептида. Эффективный протеолиз белка при минимизации неспецифических расщеплений даст более стабильные результаты. На стадиях подкисления, следующих за алкилированием на стадии 2.4.1, можно использовать муравьиную или трифторуксусную кислоту, если будет выполняться обогащение фосфопептидами. Фосфорная кислота может конкурировать с фосфопептидом, связывающимся с металлическими аффинными хроматографическими смолами.
Анализ путей может быть использован для выявления различий в путях и изменений, связанных с диабетическим повреждением в почке OVE26, как показано в репрезентативном анализе (дополнительный рисунок 1). Заметные различия в анализе путей, обозначенные онтологической аннотацией, демонстрируют гетерогенность метаболизма в почечных нефронах. Протеом всей почки был заметно обогащен белками, участвующими в метаболических и катаболических процессах аминокислот, окислении жирных кислот и общем управлении энергией (дополнительный рисунок 1). Протеом корковых канальцев имел увеличенное количество структурных белков и транспортеров ионов, как и ожидалось в этом компартменте, как показано на рисунке 5. Мозговое вещество обогащено белками углеводного обмена (рис. 6), так как этот участок обогащен гликолитическими ферментами, а глюкоза является источником топлива во внешнем мозговом веществе, в отличие от почечной коры, которая является местом глюконеогенеза, а глюкоза является плохим топливом для дыхания19,20. Кроме того, обогащение сигнальных путей киназы в продолговатом мозге, вероятно, отражает интерстициальную осмоляльность и колебания размера клеток в этой области21, а также метаболические нарушения и окислительный стресс, связанные с этой областью во время диабета22. Использование графиков вулканов, VIP-графиков и результатов тепловых карт в сочетании с подходом к обогащению путей, таким как Gprofiler, может помочь исследователям лучше понять влияние травмы или болезни на изменения в различных почечных компартментах. Дополнительные опции программного обеспечения для анализа включают DAVID (https://davidbioinformatics.nih.gov/), Express Analyst (https://www.expressanalyst.ca/ExpressAnalyst/) и PANTHERDB (https://www.pantherdb.org/) для онтологии и определения характеристик путей.
В заключение, протеомное сравнение общего протеома всей почки (рис. 4) и компартментов корковых канальцев (рис. 5) и мозгового вещества (рис. 6) является полезным подходом для иллюстрации гетерогенности экстрактов цельной почки по сравнению с изолированными участками почки. Кроме того, выделенные протеомы позволяют глубже проникать в протеом специфических структур в отсутствие белков с высоким содержанием (целой ткани), тем самым выявляя среднее содержание (тканевые компартменты) и, наконец, низкое содержание (одноклеточные) белки. В конечном счете, идеальная изоляция должна быть на уровне отдельных клеток, чтобы можно было измерить клеточную динамику и связать ее с конкретным патологическим состоянием, таким как диабет или хронические заболевания почек.
Раскрытие информации
Авторы не раскрывают информацию.
Благодарности
Работа над этим проектом была частично поддержана за счет средств MTB (NIH K01DK080951) и TDC (NephCure-Pediatric Nephrology Research Consortium NKI-2023-04), а также Программы Университета Луисвилля по заболеваниям почек и Центра технологий протеомики (TDC, MTB).
Материалы
| Name | Company | Catalog Number | Comments |
| Collagenase type 1A | Millipore Signal | C9891 | |
| Exploris 480 Orbitrap | Thermofisher | https://www.thermofisher.com/order/catalog/product/BRE725539 | MS |
| Falcon Cell Strainer, 100 µm | VWR | 21008-950 | |
| Falcon Cell Strainer, 70 µm | VWR | 21008-952 | |
| Gibco PBS pH 7.4 | Thermo | 1001023 | |
| Halt Protease and Phosphatase Inhibitor Cocktail | VWR | PI78440 | |
| Iodoacetamide | Sigma Aldrich | I1149 | |
| MetaboAnalyst 6.0 | MetaboAnalyst 6.0 | https://www.metaboanalyst.ca/ | metabolomics data analysis platform |
| NanoDrop 2000 | Thermofisher | https://www.thermofisher.com/order/catalog/product/ND-2000 | |
| Oasis HLB column | Waters | 186002034 | |
| PEAKS 12.0 | Bioinformatics Solutions Inc | LC-MS/MS data analysis software | |
| Pestle for 1.5 mL Microtube | Fisher Scientific | NC0782485 | |
| Suspension Trap (S-trap) | Protifi | C02-micro-10 | |
| TCEP | ThermoFisher Scientific | 20490 | |
| TEABC | Sigma Aldrich | T7408 | |
| Trypsin Protease, MS-Grade | ThermoFisher Scientific | 90057 | |
| Ultrasonic Cleaner | Cole-Parmer | Model 0884900 |
Ссылки
- Ding, X., et al. Epidemiological patterns of chronic kidney disease attributed to type 2 diabetes from 1990-2019. Front Endocrinol. 15, 1383777 (2024).
- Liu, W., et al. Global trends in the burden of chronic kidney disease attributable to type 2 diabetes: an age-period-cohort analysis. Diabetes Obes Metab. 26 (2), 602-610 (2024).
- Xie, D., et al. Global burden and influencing factors of chronic kidney disease due to type 2 diabetes in adults aged 20-59 years, 1990-2019. Sci Rep. 13 (1), 20234 (2023).
- Giunti, S., Barit, D., Cooper, M. E. Mechanisms of diabetic nephropathy: role of hypertension. Hypertension. 48 (4), 519-526 (2006).
- Thomas, M. C., Burns, W. C., Cooper, M. E. Tubular changes in early diabetic nephropathy. Adv Chronic Kidney Dis. 12 (2), 177-186 (2005).
- Thomas, M. C., et al. Diabetic kidney disease. Nat Rev Dis Primers. 1, 15018 (2015).
- Nath, K. A. Tubulointerstitial changes as a major determinant in the progression of renal damage. Am J Kidney Dis. 20 (1), 1-17 (1992).
- Bonventre, J. V. Can we target tubular damage to prevent renal function decline in diabetes. Semin Nephrol. 32 (5), 452-462 (2012).
- Powell, D. W., et al. Renal tubulointerstitial fibrosis in OVE26 type 1 diabetic mice. Nephron Exp Nephrol. 111 (1), e11-e19 (2008).
- Cummins, T. D., et al. Quantitative mass spectrometry of diabetic kidney tubules identifies GRAP as a novel regulator of TGF-beta signaling. Biochim Biophys Acta. (4), 653-661 (2010).
- Barati, M. T., et al. Differential expression of endoplasmic reticulumstress-response proteins in different renal tubule subtypes of OVE26 diabetic mice. Cell Stress Chaperones. 21 (1), 155-166 (2016).
- Zheleznova, N. N., et al. Mitochondrial proteomic analysis reveals deficiencies in oxygen utilization in medullary thick ascending limb of Henle in the Dahl salt-sensitive rat. Physiol Genomics. 44 (17), 829-842 (2012).
- Nordquist, L., Palm, F. Diabetes-induced alterations in renal medullary microcirculation and metabolism. Curr Diabetes Rev. 3 (1), 53-65 (2007).
- dos Santos, E. A., Li, L. -. P., Ji, L., Prasad, P. V. Early changes with diabetes in renal medullary hemodynamics as evaluated by fiberoptic probes and BOLD magnetic resonance imaging. Invest Radiol. 42 (3), 157-162 (2007).
- Cummins, T. D., et al. Quantitative Mass Spectrometry Normalization in UrineBiomarker Analysis in Nephrotic Syndrome. Glomerular Dis. (3), 121-131 (2022).
- Carlson, E. C., Audette, J. L., Klevay, L. M., Nguyen, H., Epstein, P. N. Ultrastructural and functional analyses of nephropathy in calmodulin-induced diabetic transgenic mice. Anat Rec. 247 (1), 9-19 (1997).
- Zheng, S., et al. Development of late-stage diabetic nephropathy in OVE26 diabetic mice. Diabetes. 53 (12), 3248-3257 (2004).
- Wang, F., Veth, T., Kuipers, M., Altelaar, M., Stecker, K. E. Optimized suspension trapping method for phosphoproteomics sample preparation. Anal Chem. 95 (25), 9471-9479 (2023).
- Mather, A., Pollock, C. Glucose handling by the kidney. Kidney Int Suppl. 120, S1-S6 (2011).
- Ross, B. D., Espinal, J., Silva, P. Glucose metabolism in renal tubular function. Kidney Int. 29 (1), 54-67 (1986).
- Roger, F., Martin, P. Y., Rousselot, M., Favre, H., Féraille, E. Cell shrinkage triggers the activation of mitogen-activated protein kinases by hypertonicity in the rat kidney medullary thick ascending limb of the Henle's loop: requirement of p38 kinase for the regulatory volume increase response. J Biol Chem. 274 (48), 34103-34110 (1999).
- Yang, J., Lane, P. H., Pollock, J. S., Carmines, P. K. PKC-dependent superoxide production by the renal medullary thick ascending limb from diabetic rats. Am J Physiol Renal Physiol. 297 (5), F1220-F1228 (2009).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены