Method Article
ניתוח פרוטאומי השוואתי של כליות שלמות, מדולה וצינורות קליפת המוח בפתוגנזה סוכרתית של פגיעה בכליות בעכברים
In This Article
Summary
כאן, אנו מציגים פרוטוקול מפורט לניתוח פרוטאומי של הכליה כולה, צינורית קליפת המוח המבודדת ופרוטאומים מדולריים. המחקר גם משווה פרוטאומים אזוריים במודל עכבר סוכרתי ועכברים שאינם סוכרתיים.
Abstract
הגדרת רצף האירועים במחלת כליות היא אבן הפינה של הפרקטיקה הקלינית בארגז הכלים של הנפרולוג. ניתוחים פרוטאומיים של רקמות הם גישה משמעותית להבנת התהליכים הפיזיולוגיים והמולקולריים הבסיסיים של פתופיזיולוגיה של הכליות. השיטות והפרוטוקולים שאנו מציגים כאן יאפשרו דיסקציה מולקולרית של הכליה בכל אזור עניין ספציפי הקשור להשלכות המחלה. כדי לקבוע את השפעות המחלה על אזורי כליה ומבנים ספציפיים עם פונקציות ייחודיות, מטרות פרוטוקול זה הן להדגים טכניקות פשוטות של מידור כליות עכבר ובידוד צינוריות קליפת הכליה במקביל לתהליכי עבודה פרוטאומיים כמותיים יעילים ללא תוויות. שילוב שיטות אלה יסייע בזיהוי דפוסים מולקולריים מופרעים בכליה כולה, בתאים המדולריים ובמבני הצינוריות בקליפת המוח של הכליות, כאשר המטרה הסופית והסופית של פרוטאומיקה של תא בודד בהקשרים פתולוגיים. יישום שיטות אלה כמעט בכל מודל מחלה יעזור בתיאור מנגנוני פתולוגיה הקשורים לתפקוד לקוי של הכליות.
Introduction
מחלת כליות כרונית (CKD) היא דאגה מרכזית ברפואה המודרנית, בהיקף של למעלה מ-86 מיליארד דולר בהוצאות בריאות בארצות הברית לבדה1. ברחבי העולם, שכיחות CKD עולה עם שכיחות הסוכרת ומחלות נלוות לכליות הנלוות. קרוב ל-14% מאוכלוסיית ארה"ב סובלים מ-CKD (דוח שנתי של USRDS 2024). יתר על כן, נפרופתיה סוכרתית היא סוג של CKD והגורם המוביל למחלת כליות סופנית (ESRD), ו-60% מחולי ESRD סובלים מסוכרת 1,2,3. סוכרת משפיעה על כל מבני הכליות וסוגי התאים של הנפרונים, היחידה התפקודית של הכליות. כפי שמוצג באיור 1, חלקים שונים של נפרונים כלולים בקליפת הכליה ובאזורי המדולה. רוב הכליה מורכבת מצינורות. תפקוד לקוי של צינוריות הכליה ונגעים מבניים תורמים באופן משמעותי להתפתחות נפרופתיה סוכרתית (DN), ושינויים אלה מתאמים היטב עם קצב הירידה בתפקוד הכליות 4,5,6,7,8. בשלב מוקדם של סוכרת, בתגובה לעלייה בגלוקוז ולספיגת נתרן נלווית ודרישות חלבון הובלת ממברנה בכל מקטעי הצינוריות, הצינוריות עוברות היפרטרופיה. עם פגיעה מיקרו-וסקולרית מוגברת מאוחר יותר בסוכרת, צינוריות מציגות ניוון והתרחבות, בעוד שיש פיברוזיס והתרחבות של האינטרסטיציום9. מחקרים קודמים מהמעבדה שלנו מצאו פרוטאומים משתנים ושפע של חלבוני תגובת עקה בצינורות קליפת המוח של עכברים סוכרתיים10,11. המדולה חשובה לוויסות ריכוז השתן, ותפקוד לקוי במהלך מחלת כליות קשור לעקה חמצונית, כאשר סוכרת מובילה לירידה במתח החמצן באזור זה של הכליה עקב צריכת חמצן מוגברת מפעילויות מטבוליות, פעילות מוגברת של חלבוני הובלת ממברנה ופגיעה מיקרו-וסקולרית 12,13,14.
הבנת המנגנונים המפורטים של התפתחות והתקדמות DN היא מאמץ מתמשך שידרוש גישות חדשות ומשולבות המעוררות מודלים של מחלות ופרופיל מולקולרי של תהליכי איתות, שינויים אדפטיביים בדינמיקה של חלבון תאי תא והגדרה מדויקת של רכיבי תאי כליה ורקמות המושפעים מפגיעה במצבים כרוניים. פרוטאומיקה, מטבולומיקה וטרנסקריפטומיקה מציעים את האפשרות לחקור באופן אנליטי את המנגנונים המולקולריים של מחלות כליות. אומיקס הוא תחום חדש יחסית המשתמש בגישות של ביולוגיה מערכתית כדי להשיג הבנה גלובלית יותר של מערכות ביולוגיות. פרוטאומיקה הייתה כלי אומיקס רב עוצמה בנפרולוגיה בעשורים האחרונים. מחקר הסמנים הביולוגיים התרחב במהלך 20 השנים האחרונות, כפי שעולה מהגידול בפרסומים, אם כי נדרשת עבודה נרחבת כדי ליישם את הממצאים הללו במלואם במרפאה15. עם אוכלוסיות תאי הצינוריות השונות מאוד והתפקידים התפקודיים בהתאמה בתוך קליפת הכליה והמדולה, ניתוח פרוטאומי של כליות שלמות יכול להסוות שינויים ייחודיים הקשורים למבנים ספציפיים באזורים שונים אלה. לכן, מטרות מחקר זה הן להדגים את ההפרדה של קליפת הכליה והמדולה, כמו גם את ההפרדה של צינורות קליפת המוח מהגלומרולים, ואחריהם פרוטוקולים מפורטים להכנת תמציות חלבון ממבנים מבודדים לספקטרומטריית מסה מתקדמת וניתוחים ביואינפורמטיים. מודלים עכבריים של נפרופתיה סוכרתית הם חיוניים בהגדרת מנגנוני התקדמות המחלה. למחקר זה, השתמשנו בעכבר הטרנסגני OVE26, המפתח סוכרת מסוג I עם הופעה מוקדמת ומראה מאפיינים של DN בשלב מוקדם ומאוחר בבני אדם, כולל 1) עלייה מוקדמת וירידה מאוחרת יותר בקצב הסינון הגלומרולרי, 2) היפרטרופיה כלייתית, 3) עיבוי קרום הבסיס הגלומרולרי והתרחבות מזנגיאלית, 4) פרוטאינוריה חמורה, ו-5) פיברוזיס טובולואינטרסטיציאלי9, 16,17. עכברים בני חודשיים נבחרו כדי להדגים שינויים פרוטאומיים בתאי הצינוריות לפני נגעים מבניים גלויים. כפי שדווח בעבר ומוצג באיור 2, עכברי OVE26 בני חודשיים מציגים התרחבות מטריצה מזנגיאלית גלומרולרית (איור 2, חץ ירוק) ופרוטאינוריהחמורה 17, ללא שינויים היסטולוגיים גלויים בצינוריות הפרוקסימליות (איור 2, חץ צהוב) בעכברים סוכרתיים צעירים. כאן אנו מציגים גישה פרוטאומיקה כמותית משולבת לאפיון של כל הכליה, המדולה וצינורות קליפת המוח כדי להבהיר ולהמחיש את ההבדלים בפרוטאום בכל תא עם סוכרת.
Protocol
מחקרים עם עכברי OVE26 ו-FVB אושרו על ידי הנחיות הוועדה המוסדית לטיפול ושימוש בבעלי חיים של אוניברסיטת לואיוויל (IACUC). נקבה טרנסגנית OVE26 (סוכרת; זן #:005564) ו-FVB (לא סוכרתי; מתח רקע; זן #:001800) עכברים נרכשו ממעבדות ג'קסון (בר הרבור, מיין). בעלי החיים הוחזקו במחזור אור/חושך של 12 שעות בטמפרטורה של 25 מעלות צלזיוס, וניתנה להם גישה חופשית למים ולמזון. כל המחקרים נערכו על עכברים בני חודשיים.
1. מודל בעלי חיים
- בידוד כליות
- להרדים עכברים על ידי מתן תוך-צפקי של 80 מ"ג/ק"ג קטמין ו-12 מ"ג/ק"ג קסילזין.
- בצע חתך בטן בקו האמצע עם מספריים כירורגיות קטנות והזיז בעדינות את המעיים החוצה לצד העכבר באמצעות ספוגיות כדי לחשוף את הווריד הנבוב.
- בצע חתך קטן בווריד הנבוב מעל הכליה הימנית.
- החדרו את העכבר דרך החדר השמאלי עם 20 מ"ל של מי מלח קרים עם חוצץ פוספט (PBS: pH 7.4; 210 מ"ג/ליטר KH2PO4, 9 גרם/ליטר NaCl, 726 מ"ג/ליטר Na2HPO4·7H2O) באמצעות משאבה פריסטלטית, בקצב של 10 מ"ל לדקה.
הערה: שלב זה אינו נדרש אם הכללת חלבוני ותאי דם בכליות אינה גורם קריטי בניתוחים במורד הזרם. - הסר כליות באמצעות מספריים כירורגיות קטנות. הסר עודפי שומן מהחלק החיצוני של הכליות. שקלו את הכליות והניחו אותן ב-PBS קר על קרח.
- הסר את קפסולת הכליה.
- מניחים כליות על צלחת זכוכית או צלחת פטרי מונחת על קרח. בצעו כמה חתכים רוחביים דרך הכליות באמצעות סכין גילוח (איור 3) כדי להגיע ל-3-4 פרוסות בין הקוטב העליון והקוטב התחתון של הכליות.
- שמור 1-2 פרוסות אמצעיות ושני הקטבים (פרוסות כליה מעוגלות באיור 3) מכל כליה בצד כדי לשמש כדגימות "כליה שלמה". מניחים מנה לתוך צינורות צנטריפוגה של 1.5 מ"ל ומוסיפים מאגר הומוגניזציה קר כקרח (10% גליצרול, 50 מ"מ HEPES, 100 מ"מ KCl, 2 מ"מ EDTA, 0.1% NP40, 10 מ"מ NaF, 0.25 מ"מ NaVO3, 1x מעכב פרוטאז HALTS) בכ-10 מיקרוליטר/מ"ג של דגימת רקמה (בהתבסס על מסה משוערת של פרוסות כליה, הנגזרת ממשקל הכליה הנרכש). השאירו את הצינור על קרח.
- עבור שאר הפרוסות הרוחביות האמצעיות, הניחו את הפרוסה שטוחה ופרסו בזהירות את קליפת המוח (1 מ"מ חיצונית) מכל פרוסה באמצעות סכין גילוח או אזמל (איור 3, זרימת עבודה סכמטית). שמור על קליפת המוח מופרדת מאזורי המדולה לפרוטוקול בידוד צינוריות קליפת המוח (להלן, שלב 1.3).
- מניחים חלק מהמדולה המנותחת לתוך צינורות צנטריפוגה של 1.5 מ"ל, מוסיפים מאגר הומוגניזציה קר כקרח כמו בשלב 1.1.8, ומשאירים את הצינור על קרח.
- מקפיאים בחנקן נוזלי את כל חלקי הכליה והמדולה השלמים שנותרו שאינם משמשים להומוגניזציה ומאחסנים בטמפרטורה של -80 מעלות צלזיוס.
- לחלופין, הקפיאו את כל תאי הכליה והמדולה המופרדים ואחסנו אותם כמתואר בשלב 1.1.11. הסר אותם מהאחסון במועד מאוחר יותר להוספת מאגר הומוגניזציה כמו בשלב 1.1.8.
- בידוד צינוריות בקליפת המוח
- טוחנים את קליפת המוח המנותחת לחתיכות בגודל 1-3 מ"מ על צלחת זכוכית או צלחת פטרי בעזרת סכין גילוח, ויוצרים משחה.
- עכל את קליפת המוח הטחונה ב-1 מ"ל של קולגנאז מסוג IA (1 מ"ג/מ"ל) למשך 30 דקות, ב-37 מעלות צלזיוס, באמבט מים מתנדנד.
- הניחו מסננת תאים של 100 מיקרומטר על גבי צינור חרוטי של 50 מ"ל על קרח.
- הנח את התרחיף הקורטיקלי המעוכל על מסננת התאים של 100 מיקרומטר ולחץ בעדינות דרך המסננת באמצעות הבוכנה של מזרק 10 מ"ל. שוטפים את החלק העליון של המסננת עם 1 מ"ל PBS ואת החלק התחתון של המסננת עם 1 מ"ל PBS.
- העבירו את המסנן בצינור של 50 מ"ל דרך מסננת נוספת של 100 מיקרומטר, ולאחר מכן שטפו את החלק העליון של המסננת עם 1 מ"ל PBS.
- העבירו את המסנן דרך מסננת תאים של 70 מיקרומטר המונחת על צינור חרוטי של 50 מ"ל על קרח. צינורות יעברו דרך מסננת זו לתוך המסנן (גלומרולי יישמר על מסננת 70 מיקרומטר). שוטפים את המסננת עם 1 מ"ל PBS.
- סובב את המסנן הסופי ב-120 × גרם למשך 2 דקות ב-4 מעלות צלזיוס. השלך עודפי PBS מכדור הצינור.
- בדוק את טוהר גלולת הצינורית בקליפת המוח על ידי הדמיה במיקרוסקופ, באמצעות מטרה פי 10. אם יותר מ -10% מהשבר מכיל גלומרולי, השעו מחדש את המסנן עם 1 מ"ל PBS והעבירו דרך מסננת תאים נקייה של 70 מיקרומטר ללא כל שטיפה נוספת של המסננת.
- מחלקים שבר צינורי מועשר לצינורות צנטריפוגה של 1.5 מ"ל וסובבים ב-2000 × גרם למשך 2 דקות ב-4 מעלות צלזיוס. השליכו את הסופרנטנט.
- הוסף מאגר הומוגניזציה לגלולת הצינורית כמו עם כל הכליה והמדולה (שלבים 1.1.8 ו-1.1.10).
- הומוגניזציה/מיצוי חלבון
- הומוגניזציה של כל סוג דגימה בצינורות מיקרו-צנטריפוגה של 1.5 מ"ל באמצעות עלי פלסטיק במיוחד עבור צינורות של 1.5 מ"ל. אם המתלה ההומוגני עבה מדי, הוסף מאגר הומוגניזציה נוסף לפי הצורך.
- השאירו תרחיף הומוגני על קרח למשך 15 דקות ואחריו סוניקציה למשך 5 דקות בסוניקטור אמבטיה (מתג הפעלה/כיבוי בלבד, ללא הגדרות מתכווננות ביחידה), עם מים באמבטיה ב-25 מעלות צלזיוס. השאירו את הדגימות על קרח למשך 10 דקות.
- מערבולת קצרה (1000-1500 סל"ד) הומוגנית, ואז טריטורציה 20 פעמים עם פיפטה ומשאירה על קרח למשך 15 דקות נוספות.
- יש לשלש את הדגימות מספר פעמים לפני הצנטריפוגה ב-13,000 × גרם למשך 20 דקות ב-4 מעלות צלזיוס.
- העבירו תמציות חלבון מנוקות לצינורות נקיים.
- Aliquot 30 מיקרוליטר של תמצית מנוקה להערכת חלבון והכנת דגימה לניתוח ספקטרומטריית מסה. אחסן את שאר הדגימות בטמפרטורה של -80 מעלות צלזיוס.
2. פרוטוקול עיכול עמוד ספין מיני מלכודת השעיה
- עיכול פרוטאוליטי של חלבונים לשברים טריפטיים לאנליזות פרוטאומיות
- לדלל ~40-50 מיקרוגרם של דגימה (ב-~2 מיקרוגרם/מיקרוליטר) לתוך מאגר ליזה של דגימה (10% w/v נתרן דודציל סולפט [SDS] ב-100 מ"מ טריאתילאמוניום ביקרבונט (TEA-BC) pH 8.5, 40 מ"מ טריס (2-קרבוקסיאתיל)פוספין [TCEP]) לנפח סופי של 46 מיקרוליטר.
- הפחתה ואלקילציה של חלבונים
- דגירה בטמפרטורה של 65 מעלות צלזיוס למשך 30 דקות (הריכוז הסופי של TCEP הוא 20 מ"מ).
- הוסף 4 מיקרוליטר של 0.5 M יודואצטמיד במים בדרגת כרומטוגרפיה נוזלית-ספקטרומטריית מסה (LC-MS) ודגירה בטמפרטורת החדר (RT) בחושך למשך 30 דקות (הריכוז הסופי של יודואצטמיד הוא 40 מ"מ).
- הוסף 5 מיקרוליטר של 12% w/w חומצה זרחתית במים בדרגת LC-MS (לדלל 141 מיקרוליטר של 85% חומצה זרחתית ל-859 מיקרוליטר מים לתמיסה של 12%).
- חלופה לחומצה זרחתית, השתמש בחומצה טריפלואורואצטית או בחומצה פורמית אם מבצעים העשרת פוספופפטיד18.
- הוסף 350 מיקרוליטר של חוצץ קשירת מלכודת השעיה (100 מ"מ TEA-BC ב-90% מתנול/10% v/v מים pH 7.55).
- הוסף דוגמה לעמודת מלכודת המתלים. צנטריפוגה ב-4,000 × גרם למשך 30 שניות ב-RT ברוטור בעל זווית קבועה כדי להעביר כל נפח דרך העמודה.
- שטפו עם 4x 400 מיקרוליטר של מאגר קשירת מלכודת מתלה. צנטריפוגה ב-4,000 x g למשך 30 שניות ב-RT ברוטור בזווית קבועה כדי להעביר כל שטיפה דרך העמוד.
הערה: כדי לסייע בהסרת SDS, סובב את העמוד ברוטור 180° לאחר כל כביסה. - צנטריפוגה ב-4,000 גרם למשך דקה אחת ב-RT להסרה מלאה של מאגר הקישור (מונע טפטוף במהלך העיכול).
- העבירו את עמוד מלכודת המתלים לצינור איסוף נקי.
- הוסף 2.5-5 מיקרוגרם טריפסין ב-125 מיקרוליטר של 50 מ"מ תה-BC pH 8.5 במים בדרגת LC-MS (טריפסין פרוטאז, דרגת MS). היחס הסופי בין טריפסין לדגימה הוא 1:20 עד 1:10.
- דגירה בטמפרטורה של 47 מעלות צלזיוס למשך שעתיים (אין להדק את המכסה; עדיף מערבל תרמי המוגדר על 0 סל"ד). תקיעת חור במכסה עם מחט עשויה למנוע הצטברות לחץ בתא העליון של מלכודת המתלים (לחץ מוגבר יגרום לתמיסת טריפסין לטפטף דרך העמוד).
- הוסף 80 מיקרוליטר של 50 מ"מ TEA-BC pH 8.5 במים בדרגת LC-MS. צנטריפוגה ב-4,000 גרם ב-RT למשך דקה אחת ברוטור בעל זווית קבועה כדי להעביר כל תקציר דרך העמודה.
- הוסף 80 מיקרוליטר של 0.2% חומצה פורמית v/v במים בדרגת LC-MS. צנטריפוגה ב-4,000 גרם למשך דקה אחת ב-RT ברוטור בזווית קבועה לאיסוף עם תקציר משלב 2.11.
- הוסף 80 מיקרוליטר של 50% v/v אצטוניטריל במים בדרגת LC-MS. צנטריפוגה ב-4,000 גרם ב-RT למשך דקה אחת ברוטור בזווית קבועה לאיסוף עם תקציר משלב 2.11.
- אחסן את מלכודת המתלים בטמפרטורה של -80 מעלות צלזיוס.
- יבש את הדגימה ברכז ואקום.
- אחסן את הדגימה המיובשת בטמפרטורה של -80 מעלות צלזיוס.
3. ניקוי עם עמודת איזון הידרופילי-ליפופילי (HLB).
- הכינו תמיסות A (2% v/v acetonitrile/0.1% v/v חומצה פורמית) ו-B (80% v/v acetonitrile/0.1% v/v חומצה פורמית).
- ממיסים את הדגימה ב-500 מיקרוליטר של תמיסה A.
- הנח את העמוד בסעפת ואקום והפעל לחץ גז ב-~1-2 מ"ל/דקה.
- הוסף 500 מיקרוליטר של תמיסה B לעמודת HLB והתפנה במהירות של 1-2 מ"ל/דקה; חזור על הפעולה פעמיים.
- הוסף 750 מיקרוליטר של תמיסה A לעמודת HLB והתפנה במהירות של 1-2 מ"ל/דקה; חזור על הפעולה פעמיים.
- הנח מיקרו-צינור נקי של 2 מ"ל במדף מתחת לעמודת HLB, טען את הדגימה ב-500 מיקרוליטר של תמיסה A, ולחץ גז כאמור לעיל; העבירו את הזרימה לתוך העמודה בפעם השנייה.
- הנח את עמודת HLB מעל צינור הפסולת, הוסף 500 מיקרוליטר של תמיסה A ופנה כאמור לעיל; חזור על הפעולה פעמיים.
- הנח את העמוד מעל מיקרו-צינור נקי של 2 מ"ל, הוסף 500 מיקרוליטר של תמיסה B ופנה כאמור לעיל; חזור על הפעולה פעמיים.
- מקפיאים את הנוזל בטמפרטורה של -80 מעלות צלזיוס, ואז מייבשים ברכז ואקום. אחסן את השאריות המיובשות בטמפרטורה של -80 מעלות צלזיוס.
- ממיסים את השאריות ב-20 מיקרוליטר של 2% v/v אצטוניטריל/0.1% v/v חומצה פורמית לפני ניתוח MS. השתמש בספקטרופוטומטר כדי להעריך את ריכוז הפפטידים בספיגה של 205 ננומטר.
4. ניתוח ספקטרומטריית מסה
- כרומטוגרפיה נוזלית חד מימדית הפוכה (LC)-MS/MS
- הזרקו מסה שווה של פפטידים (~600 ננוגרם) על ננו-LC חד-ממדי ושברו אותה על עמודות פאזה C18 הפוכה.
- הוציא את הפפטידים ישירות לתוך MS במתח ריסוס של 1.8 קילו וולט, עם צינור העברת יונים הנשמר ב-250 מעלות צלזיוס.
- רכוש את הספקטרום במצב 20 היונים העליונים התלוי בנתונים שבו שבר ה-MS/MS האינטנסיבי ביותר מוסר מתור הניתוח כדי לשפר את עומק מיפוי היונים על יונים בשפע נמוך יותר.
5. ניתוח נתונים וביואינפורמטיקה
- נהלי טיפול בנתונים
- לאחר הקצאה ספקטרלית וזיהוי פפטידים וחלבונים ב-PEAKS 12.0 (תוכנת ניתוח נתונים LC-MS/MS), הגש את רשימות החלבונים לניתוח ב-MetaboAnalyst 6.0 (פלטפורמת ניתוח נתונים מטבולומיים) באמצעות גישת הניתוח הסטטיסטי החד-גורמי (https://www.metaboanalyst.ca/).
- השתמש בתוכנת ניתוח נתונים LC-MS/MS כדי לחפש ולסנן ספקטרום באמצעות קריטריונים מחמירים של שיעור גילוי שווא (FDR) (1% חלבון ופפטיד) מול מסד הנתונים של FASTA שנבדק על ידי עכבר.
הערה: תוכניות חיפוש חלופיות הזמינות כוללות את Maxquant, Proteome Discoverer, בין אפשרויות נפוצות אחרות. - ציין קרבמידומתילציה של ציסטאין כשינוי קבוע. ציין חמצון של מתיונין כשינוי משתנה.
- המר את הרשימות לתבנית ערכים מופרדים באמצעות פסיקים (CSV) ולתוויות קבוצתיות/דוגמאות שהוקצו לכל עמודה ושורה. פורמט זה גמיש בפלטפורמת ניתוח הנתונים המטבולומיים.
- ייחוס הערכים החסרים באמצעות כלל הערך המינימלי של 1/5 למשתנים חסרים.
- סנן את הנתונים כדי לא לכלול ערכים משתנים מאוד באמצעות הטווח הבין-רבעוני, שבו נעשה שימוש בשונות של 40% עבור החיתוך.
- נרמלו את הערכים לעוצמה חציונית,ל-log 10 שהשתנו וממוצע ממורכז לשינוי קנה מידה. השתמש בגישות נורמליזציה אחרות, תוך התחשבות בכך שהתוצאות עשויות להשתנות.
- בצע בדיקות T בצורה לא מותאמת עם חתך ערך p < 0.05. בצע תיקוני בדיקה מרובים בשלב זה.
הערה: מחקר זה לא ביצע תיקון זה עבור מערך הנתונים המייצג למטרות הצגת נתונים. - ציין עלילות הר געש לשינוי פי 1.5 (FC) ו-p < 0.05.
- צור מפות חום ובצע ניתוח מבחין חלקי של ריבועים מינימליים (PLSDA) וניתוח סטטיסטי (משתנה חשיבות ההקרנה [VIP]) של קבוצות המדגם.
- מועמדים פוטנציאליים למעקב חזקים מספיק כדי לעלות על 1.5FC ו-p-val <-0.05 או VIP >-1.0, כפי שמצוין בניתוח PLSDA.
- צור דיאגרמות ון כדי להמחיש את ההבדלים בפרוטאום של כל הכליה, הצינורית והמדולה בעכברי OVE26.
תוצאות
בסך הכל, זיהויי החלבון הכוללים מכל סוג דגימה היו 1) כליה שלמה (1438) 2) מדולה (2145) וצינורות קליפת המוח (1859). לאחר עיבוד נתונים ב-MetaboAnalyst 6.0, סינון נתונים וחישוב, זיהויי חלבון שנותחו לבסוף עבור כל תא כליה היו: כליה שלמה (455), מדולה (997) וצינורות קליפת המוח (896). איור 4 מראה שינויים פרוטאומיים גלובליים בכליות עכבר סוכרתי OVE26. ניתוח כמותי ללא תוויות (LFQ) מאפשר כיסוי פרוטאום מעמיק תוך הצגת שונות רבה יותר במערך הנתונים הכולל בהשוואה לתיוג יונים מדווח (TMT, iTRAQ וכו'). גישה אחת להתגברות על שונות LFQ היא להגדיל את מספר הדגימות שנותחו עבור כל מצב. כאן, השתמשנו בגישת כימות מבוססת עוצמה מאלגוריתמי החיפוש של PEAKS עם שיעור גילוי שווא של 1% (FDR) ברמת הקצאת הפפטידים והחלבונים כדי לאפשר יצירת מערכי נתונים חזקים בהשוואה הזוגית שלנו של שני בעלי חיים בכל מצב עם שכפולים טכניים כלולים. איור 4A ממחיש את log2FC (שינוי קיפול) המשורטט כנגד ערך p לא מותאם (ערך p < 0.05). בדרך כלל, ערך ה-p יתוקן לבדיקת השוואות מרובות כאשר הכוונה היא לאמת חלבונים מועמדים חזקים למעקב אורתוגונלי. כאן, אנו מראים את כל השוואת הפרוטאום הלא מותאמת בין OVE26 ל-FVB בתרשים הר הגעש למטרות הצגה. כסקירה ראשונית של הניתוח הכמותי, עלילות הר געש מתארות תצוגה מקדימה של מועמדים פוטנציאליים מעניינים עם השלכות ביולוגיות. איור 4A מציג את היחס בין כימות חלבון OVE26 לעומת זן הביקורת FVB בפרוטאומים של כליה שלמה. יש לציין כי GAPDH מווסת חזק בכליות OVE26 יחד עם ALDH6A1, מה שמצביע על כך שתגובות מטבוליות מורכבות בכליות סוכרתיות מוקדמות. עלילות כינור בודדות מסופקות באיור 4B כדי להמחיש את השונות ואת ההשפעות של נורמליזציה של הנתונים באמצעות MetaboAnalyst 6.0. שימו לב לוויסות החזק של מטריצת מטאלואנדופפטידאז (MME) וקתפסין A (CTSA) בכליה שלמה של עכבר OVE26. כדי להמחיש את ההבדלים הכוללים בין הפרוטאומים בכליה כולה, ניתן להגיש את מערך הנתונים המסונן של הפרוטאום להפחתת מימדים וניתוחים רב-משתנים בפיקוח (PLSDA, sPLSDA, oPLSDA) כדי להראות הבדלים ברמת הקבוצה ולמצוא משתנים של חשיבות ההקרנה (VIP). לשם כך, ביצענו PLSDA על פרוטאום הכליה OVE26 ו-FVB, כפי שמוצג באיור 4C, והאח"מים מוצגים באיור 4D. ניתוחי PLSDA מראים הפרדה חזקה של פרוטאום OVE26 (ירוק) בהשוואה לפרוטאום הכליה FVB (אדום). ציוני VIP > 1 הם בדרך כלל משתנים מועמדים טובים, חלבונים במקרה זה, לניתוחים נוספים בהעשרה אונטולוגית של מסלול באמצעות Gprofiler (https://biit.cs.ut.ee/gprofiler/gost) המוצג בתרשים באיורים משלימים (איור משלים 1). יש לציין שרבים מהחלבונים VIP נמצאים בניתוחי עלילת הר הגעש באיור 4A. זיהוי רשימות מועמדים לניתוחים נוספים צריך לכלול חלבונים עם שינוי קיפול גדול, חלבונים חזקים סטטיסטית וחשובים המעורבים בריבוד קבוצתי (VIPs>1). ניתן להמחיש המחשה נוספת של הבדלים בפרוטאומות ברמת הקבוצה וברמת החלבון הבודד במפות חום היררכיות עם אשכולות קבוצתיים ותכונות, כפי שמוצג באיור 4E.
למטרות השוואה, ביצענו ניתוח פרוטאומיקה כמותי חד-ממדי LC-MS/MS על צינורות קליפת המוח המבודדים (איור 5) ומדולה (איור 6) מעכברי OVE26 ו-FVB כדי להמחיש את היכולת לקדוח לתוך הפרוטאום של אזורים ספציפיים בכליה עם עומק זיהוי יעיל בהיעדר רכיבי שפע גבוהים יותר. לבסוף, ניתן להמחיש חפיפה בפרוטאום על ידי השוואה של סך הזיהויים המובהקים וכיסוי החלבונים המובהקים ביותר מבחינה סטטיסטית בכל מצב (כליה שלמה, צינוריות ומדולה) כפי שמודגם בדיאגרמת ון (איור 7). יש לציין כי אנו משתמשים בגישה משולבת של מבחן t ו-VIP (משתנה חשיבות ההקרנה) מגישות סטטיסטיות להפחתת מימדים של PLSDA (איור 4C,D, איור 5C,D ואיור 6C,D) כדי לקבוע חלבונים מועמדים פוטנציאליים למעקב. שימו לב שהקריטריונים של t-stat (מבחן T) (איור 7A) היו המתאימים ביותר לזיהוי מספר גדול יותר של חלבונים מעל הסף בכליה כולה, ובמידה פחותה, במדולה ובצינוריות. שימוש בסף סטטיסטי אחר (VIP > 1) באיור 7B כדי להרחיב את רשימת המועמדים נתן חלבונים מועמדים מפוזרים וחדשים יותר בניתוחים פרוטאומיים של מדולה וקליפת המוח. ראוי לציין את היעדר החפיפה בכל אחד משלושת הפרוטאומים, שכן 0 או 2 מועמדים חולקו בשתי הגישות. ניתן ליישם מספר גישות כדי לאפשר קידוח עמוק יותר לתוך פרוטאום הכליה. בידוד ופיצול של הפרוטאום ברמת הרקמה ותא הרקמות היא גישה ראשונית שיכולה להניב תוצאות חזקות, כפי שעולה מהשוואת דיאגרמת ון (איור 7) בגישות מבחן t ומיון VIP. כל הקבצים הגולמיים ורשימות השיא יופקדו ב-MASSIVE (massive.ucsd.edu) בהתאם לתקני HUPO וישותפו לציבור כהגשה חלקית עם הפרסום.
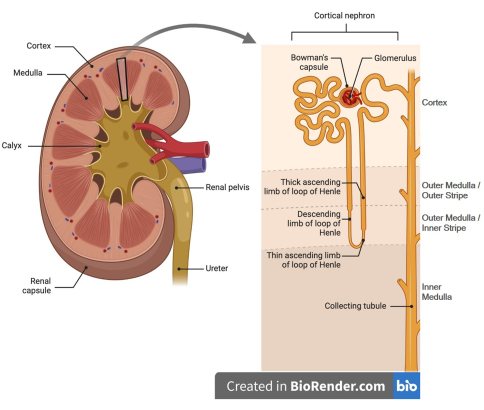
איור 1: עיבוד מצויר של נפרון הכליה. (פאנל שמאלי) לכליות יש אזורי קליפת המוח (החיצונית) והמדולה (הפנימית). (פאנל ימין) קליפת הכליה מכילה גלומרולי וקפסולה של באומן בהתאמה, צינורות מפותלים פרוקסימליים ורוב הקטע הישר שלה, חלקים של לולאות עולות עבות של הנלה, צינורות מפותלים דיסטליים, מקטעים קליפת המוח של צינורות האיסוף ונימים פריטובולריים (לא מוצגים). המדולה מורכבת מלולאות יורדות ועולות של הנלה, החלק המדולרי של הלולאה העולה העבה של הנלה ותעלות איסוף, ונימי ואסה רקטה המקיפים את מקטעי הצינוריות הללו (לא מוצג). הדמות נוצרה באמצעות Biorender. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 2: צביעת PAS מייצגת (חומצה תקופתית שיף) להדגמת היסטולוגיה בעכברים בני חודשיים FVB (לא סוכרתיים) ו-OVE26 (סוכרתיים). גלומרולי (חץ ירוק) מעכברים סוכרתיים מראים צביעת PAS ורודה מוגברת, מה שמדגים התרחבות מזנגיאלית, בעוד ששינויים היסטולוגיים גלויים בטובולואינטרסטיציום עדיין לא ניכרים בעכברים סוכרתיים צעירים. צינוריות פרוקסימליות מראות הגדלה/היפרטרופיה קלה/צנועה (חץ צהוב). פסי קנה מידה: 30 מיקרומטר. הגדלה מקורית פי 100. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
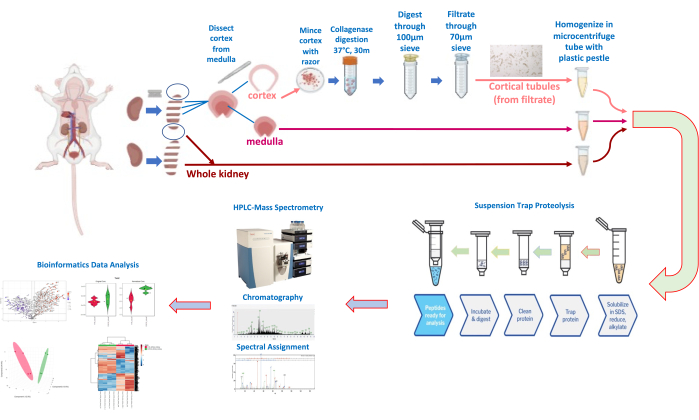
איור 3: דיסקציה של כליות ובידוד צינוריות וזרימת עבודה של פרוטאומיקה כמותית. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
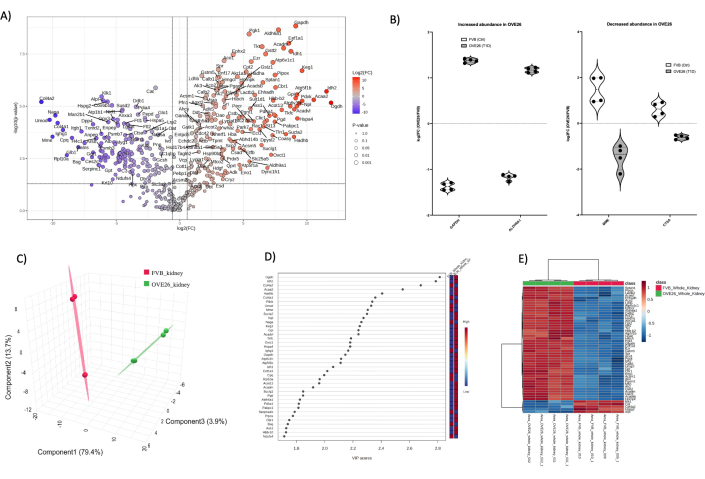
איור 4: שינויים גלובליים בפרוטאום הכליה של עכבר שלם סוכרתי OVE26. (A) מציג את ה-log2FC (שינוי קיפול של OVE26/FVB) המשורטט כנגד ערך ה-p הלא מותאם (-log10 p-value) בתרשים הר געש עם שינוי שלילי פי 1.5 (כחול) או חיובי (אדום) ו-p < 0.05 חתכים המסומנים על ידי הקווים האנכיים והאופקיים, כל כימות החלבונים המשמעותיים מסומנים בנקודת הנתונים. (B) תרשימי כינור שמראים את השונות של כל כימות שכפול עבור חלבונים נבחרים GAPDH ו-ALDH6A1 עלייה ב-OVE26 ו-MME ו-CTSA יורדת בכליה השלמה של OVE26. (C) גישת ההפחתה הממדית המשתמשת בניתוח מבחין של ריבועים מינימליים חלקיים מראה הפרדה קבוצתית של OVE26 (ירוק) ו-FVB (אדום). (D) משתנים בעלי חשיבות של תרשים הקרנה מראים את התרומה של חלבונים בודדים בניתוחי PLSDA לפי ציון VIP. (E) מפת חום היררכית של אשכולות של החלבונים המווסתים העליונים המצביעה על הבדלים קבוצתיים בעוצמת כימות החלבון. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
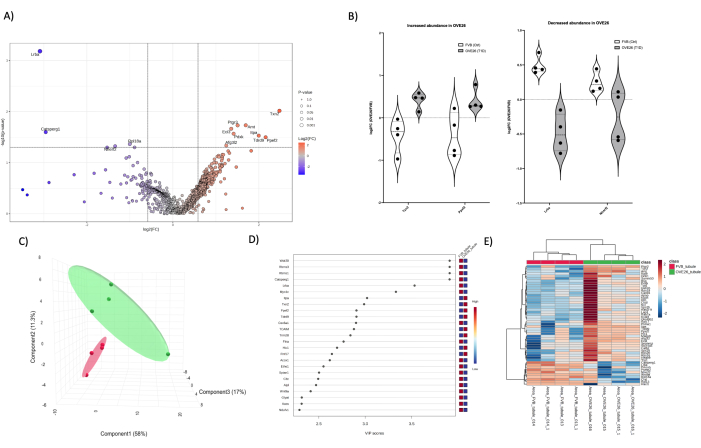
איור 5: שינויים בפרוטאום הצינורית בקליפת המוח הסוכרתית OVE26. (A) מציג את log2FC (שינוי קיפול של OVE26/FVB) המשורטט כנגד ערך ה-p הלא מותאם (-log10 p-value) בתרשים הר געש עם שינוי שלילי פי 1.5 (כחול) או חיובי (אדום) ו-p < 0.05 חתכים המסומנים על ידי הקווים האנכיים והאופקיים, כל כימות החלבונים המשמעותיים מסומנים בנקודת הנתונים. (B) תרשימי כינור המראים שונות של כל כימות שכפול עבור חלבונים נבחרים TXN2 ו-PPEF2 הגדלים ב-OVE26 ו-LRBA ו-NHERF2 יורדים בפרוטאום הצינורי OVE26. (C) גישת ההפחתה הממדית המשתמשת בניתוח מבחין של ריבועים מינימליים חלקיים מראה הפרדה קבוצתית של OVE26 (ירוק) ו-FVB (אדום). (D) משתנים בעלי חשיבות של תרשים הקרנה מראים את התרומה של חלבונים בודדים בניתוחי PLSDA לפי ציון VIP. (E) מפת חום היררכית של אשכולות של החלבונים המווסתים העליונים המצביעה על הבדלים קבוצתיים בעוצמת כימות החלבון. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
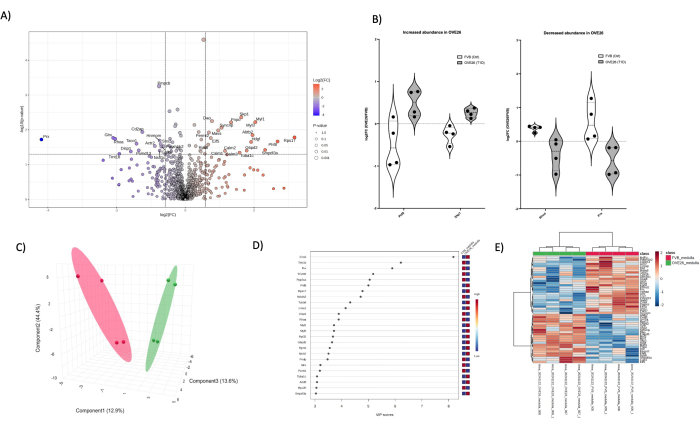
איור 6: שינויים בפרוטאום המדולה הסוכרתית OVE26. (A) מציג את ה-log2FC (שינוי קיפול של OVE26/FVB) המשורטט כנגד ערך ה-p הלא מותאם (-log10 p-value) בתרשים הר געש עם שינוי שלילי (כחול) או חיובי (אדום) פי 1.5 ו-p < 0.05 חיתוכים המסומנים על ידי הקווים האנכיים והאופקיים, כל כימות החלבונים המשמעותיים מסומנים בנקודת הנתונים. (B) תרשימי כינור שמראים את השונות של כל כימות שכפול עבור חלבונים נבחרים PHF8 ו-SKP1 גדלים ב-OVE26 ו-RHOA ו-PRX יורדים בפרוטאום המדולרי OVE26. (C) גישת ההפחתה הממדית המשתמשת בניתוח מבחין של ריבועים מינימליים חלקיים מראה הפרדה קבוצתית של OVE26 (ירוק) ו-FVB (אדום). (D) משתנים בעלי חשיבות של תרשים הקרנה מראים את התרומה של חלבונים בודדים בניתוחי PLSDA לפי ציון VIP. (E) מפת חום היררכית של אשכולות של החלבונים המווסתים העליונים המצביעה על הבדלים קבוצתיים בעוצמת כימות החלבון. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 7: דיאגרמת ון של החלבונים המצויים בשפע דיפרנציאלי בפרוטאומות שלמות של כליות, צינוריות ומדולריות. פרוטאומים בכליות הושוו לאחר בדיקת t (p-val < 0.05) וסף שינוי קיפול של +/- 1.5FC ורשימות VIP > 1.0. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
איור משלים 1: ניתוח מסלולי פרוטאום של כליה שלמה באמצעות Gprofiler שנוצר על ידי הגשת רשימות חלבוני VIP (VIP > 1) בפאנל 4D. Gprofiler יושם לניתוח הבדלי מסלולים עבור חלבונים עם ציוני VIP גדולים מ-1 מניתוח PLSDA באיור 4. (A) מציג העשרה של מסלולים גרפיים עם חתכי ערך p עבור פונקציות מולקולריות (MF), רכיב תאי (CC) ותהליך ביולוגי (BP). (B) טבלת העשרה של מסלול אונטולוגיה גנטית עבור כל תהליך, תפקוד או תא ספציפי. (C) תרשים העשרת חלבון ספציפי לתפקודים מולקולריים של פרוטאום כליה שלם. אנא לחץ כאן להורדת קובץ זה.
Discussion
השיטות המוצגות בגישה טכנית זו נועדו להמחיש ניתוח פרוטאום השוואתי של אזורים שונים בכליה. כאן, השתמשנו בשיטות לבידוד מדולה וצינוריות קליפת המוח בעכברים סוכרתיים (OVE26) ובקרה (FVB) וביצענו ניתוח LC-MS/MS וביואינפורמטיקה חד-ממדי כדי להמחיש את ההבדלים הבסיסיים בפרוטאום בכל חלק של הכליה, בנוסף לפרוטאום של כליות שלמות.
בידוד תאי הכליה דורש דיסקציה זהירה של קליפת המוח הרחק מהמדולה. עם חיתוך רוחבי ראשוני של כליות, פרוסות דקות יאפשרו דיסקציה אמינה יותר של קליפת המוח. הכנת הצינורות בקליפת המוח בגישת סינון יכולה לגרום לסינון של גלומרולי דרך מסננות של 70 מיקרומטר. זה קריטי לבדוק את טוהר הצינוריות תחת מיקרוסקופ כדי להבטיח העשרה אך למנוע אובדן מסת צינורית בכל שלב שטיפה עוקב. הימנעות מלחיצה מוגזמת של קליפת המוח המעוכלת באמצעות שלבי סינון ראשוניים יכולה להפחית את הזיהום בהכנת הצינורית הסופית.
גישות לכידת תרחיף מציעות מידה רבה של גמישות בשלבי המסיסות ומיצוי החלבון ללא הפרעה יונית בשלבי הפליטה של ספקטרומטריית המסה. חשוב ביותר בשלב 2.10 הוא היחס בין טריפסין (1:20 או 1:10 נראים אופטימליים לרוב היישומים) לריכוז הפפטיד. פרוטאוליזה יעילה של חלבון אך מזעור מחשופים לא ספציפיים תניב תוצאות עקביות יותר. שלבי החמצה לאחר אלקילציה בשלב 2.4.1 יכולים להשתמש בחומצה פורמית או טריפלואורואצטית אם תבוצע העשרה של פוספופפטידים. חומצה זרחתית יכולה להתחרות עם קשירת פוספופפטיד לשרפי כרומטוגרפיה של זיקה מתכתית.
ניתן להשתמש בניתוח מסלולים כדי להצביע על הבדלי מסלולים ושינויים הקשורים לפגיעה סוכרתית בכליה OVE26 כפי שמוצג בניתוח מייצג (איור משלים 1). הבדלים בולטים בניתוח המסלולים המצוינים על ידי ביאור אונטולוגי מדגימים את ההטרוגניות של חילוף החומרים בנפרונים כלייתיים. כל פרוטאום הכליה הועשר באופן ניכר לחלבונים המעורבים בתהליכים מטבוליים וקטבוליים של חומצות אמינו, חמצון חומצות שומן ונושאים כלליים של ניהול אנרגיה (איור משלים 1). לפרוטאום הצינורית בקליפת המוח היו חלבונים מבניים ומובילי יונים מוגברים, כצפוי בתא זה, כפי שמוצג באיור 5. המדולה מועשרת בחלבוני חילוף חומרים של פחמימות (איור 6) מכיוון שאתר זה מועשר באנזימים גליקוליטיים, וגלוקוז הוא מקור דלק במדולה החיצונית, בהשוואה לקליפת הכליה, שהיא אתר הגלוקונאוגנזה וגלוקוז הוא דלק גרוע לנשימה19,20. יתר על כן, העשרה של מסלולי איתות קינאז במדולה משקפת ככל הנראה אוסמולליות אינטרסטיציאלית ותנודות בגודל התא באזור זה21 והפרעות מטבוליות ומתח חמצוני הקשורים לאזור זה במהלך סוכרת22. שימוש בעלילות הר הגעש, עלילות VIP ותוצאות מפת חום בשילוב עם גישת העשרת מסלולים כמו Gprofiler יכול לעזור לחוקרים להבין טוב יותר את ההשפעות של פציעה או מחלה על שינויים בתאי הכליה השונים. אפשרויות נוספות של תוכנת ניתוח כוללות DAVID (https://davidbioinformatics.nih.gov/), Express Analyst (https://www.expressanalyst.ca/ExpressAnalyst/) ו-PANTHERDB (https://www.pantherdb.org/) לאונטולוגיה ואפיון מסלולים.
לסיכום, השוואה פרוטאומית של סך כל פרוטאום הכליה השלם (איור 4) וזה של הצינורית בקליפת המוח (איור 5) והמדולה (איור 6) היא גישה שימושית להמחשת הטרוגניות בתמציות כליה שלמות בהשוואה לחלקים מבודדים של הכליה. בנוסף, פרוטאומים מבודדים מאפשרים לקדוח עמוק יותר לתוך הפרוטאום של מבנים ספציפיים בהיעדר חלבונים בשפע גבוה (רקמה שלמה), ובכך לחשוף שפע בינוני (תאי רקמה) ולבסוף חלבונים בשפע נמוך (תא בודד). בסופו של דבר, הבידוד האידיאלי יהיה ברמות של תא בודד כדי לאפשר מדידה של דינמיקה תאית ולקשר אותה למצב פתולוגי ספציפי כגון סוכרת או מחלות כליות כרוניות.
Disclosures
למחברים אין גילוי נאות.
Acknowledgements
העבודה עבור פרויקט זה נתמכה באופן חלקי במימון MTB (NIH K01DK080951) ו-TDC (קונסורציום מחקר נפרולוגיה לילדים NephCure-Pediatric NKI-2023-04) והתוכנית למחלות כליות של אוניברסיטת לואיוויל והמרכז הטכנולוגי לפרוטאומיקה (TDC, MTB).
Materials
| Name | Company | Catalog Number | Comments |
| Collagenase type 1A | Millipore Signal | C9891 | |
| Exploris 480 Orbitrap | Thermofisher | https://www.thermofisher.com/order/catalog/product/BRE725539 | MS |
| Falcon Cell Strainer, 100 µm | VWR | 21008-950 | |
| Falcon Cell Strainer, 70 µm | VWR | 21008-952 | |
| Gibco PBS pH 7.4 | Thermo | 1001023 | |
| Halt Protease and Phosphatase Inhibitor Cocktail | VWR | PI78440 | |
| Iodoacetamide | Sigma Aldrich | I1149 | |
| MetaboAnalyst 6.0 | MetaboAnalyst 6.0 | https://www.metaboanalyst.ca/ | metabolomics data analysis platform |
| NanoDrop 2000 | Thermofisher | https://www.thermofisher.com/order/catalog/product/ND-2000 | |
| Oasis HLB column | Waters | 186002034 | |
| PEAKS 12.0 | Bioinformatics Solutions Inc | LC-MS/MS data analysis software | |
| Pestle for 1.5 mL Microtube | Fisher Scientific | NC0782485 | |
| Suspension Trap (S-trap) | Protifi | C02-micro-10 | |
| TCEP | ThermoFisher Scientific | 20490 | |
| TEABC | Sigma Aldrich | T7408 | |
| Trypsin Protease, MS-Grade | ThermoFisher Scientific | 90057 | |
| Ultrasonic Cleaner | Cole-Parmer | Model 0884900 |
References
- Ding, X., et al. Epidemiological patterns of chronic kidney disease attributed to type 2 diabetes from 1990-2019. Front Endocrinol. 15, 1383777 (2024).
- Liu, W., et al. Global trends in the burden of chronic kidney disease attributable to type 2 diabetes: an age-period-cohort analysis. Diabetes Obes Metab. 26 (2), 602-610 (2024).
- Xie, D., et al. Global burden and influencing factors of chronic kidney disease due to type 2 diabetes in adults aged 20-59 years, 1990-2019. Sci Rep. 13 (1), 20234 (2023).
- Giunti, S., Barit, D., Cooper, M. E. Mechanisms of diabetic nephropathy: role of hypertension. Hypertension. 48 (4), 519-526 (2006).
- Thomas, M. C., Burns, W. C., Cooper, M. E. Tubular changes in early diabetic nephropathy. Adv Chronic Kidney Dis. 12 (2), 177-186 (2005).
- Thomas, M. C., et al. Diabetic kidney disease. Nat Rev Dis Primers. 1, 15018 (2015).
- Nath, K. A. Tubulointerstitial changes as a major determinant in the progression of renal damage. Am J Kidney Dis. 20 (1), 1-17 (1992).
- Bonventre, J. V. Can we target tubular damage to prevent renal function decline in diabetes. Semin Nephrol. 32 (5), 452-462 (2012).
- Powell, D. W., et al. Renal tubulointerstitial fibrosis in OVE26 type 1 diabetic mice. Nephron Exp Nephrol. 111 (1), e11-e19 (2008).
- Cummins, T. D., et al. Quantitative mass spectrometry of diabetic kidney tubules identifies GRAP as a novel regulator of TGF-beta signaling. Biochim Biophys Acta. (4), 653-661 (2010).
- Barati, M. T., et al. Differential expression of endoplasmic reticulumstress-response proteins in different renal tubule subtypes of OVE26 diabetic mice. Cell Stress Chaperones. 21 (1), 155-166 (2016).
- Zheleznova, N. N., et al. Mitochondrial proteomic analysis reveals deficiencies in oxygen utilization in medullary thick ascending limb of Henle in the Dahl salt-sensitive rat. Physiol Genomics. 44 (17), 829-842 (2012).
- Nordquist, L., Palm, F. Diabetes-induced alterations in renal medullary microcirculation and metabolism. Curr Diabetes Rev. 3 (1), 53-65 (2007).
- dos Santos, E. A., Li, L. -. P., Ji, L., Prasad, P. V. Early changes with diabetes in renal medullary hemodynamics as evaluated by fiberoptic probes and BOLD magnetic resonance imaging. Invest Radiol. 42 (3), 157-162 (2007).
- Cummins, T. D., et al. Quantitative Mass Spectrometry Normalization in UrineBiomarker Analysis in Nephrotic Syndrome. Glomerular Dis. (3), 121-131 (2022).
- Carlson, E. C., Audette, J. L., Klevay, L. M., Nguyen, H., Epstein, P. N. Ultrastructural and functional analyses of nephropathy in calmodulin-induced diabetic transgenic mice. Anat Rec. 247 (1), 9-19 (1997).
- Zheng, S., et al. Development of late-stage diabetic nephropathy in OVE26 diabetic mice. Diabetes. 53 (12), 3248-3257 (2004).
- Wang, F., Veth, T., Kuipers, M., Altelaar, M., Stecker, K. E. Optimized suspension trapping method for phosphoproteomics sample preparation. Anal Chem. 95 (25), 9471-9479 (2023).
- Mather, A., Pollock, C. Glucose handling by the kidney. Kidney Int Suppl. 120, S1-S6 (2011).
- Ross, B. D., Espinal, J., Silva, P. Glucose metabolism in renal tubular function. Kidney Int. 29 (1), 54-67 (1986).
- Roger, F., Martin, P. Y., Rousselot, M., Favre, H., Féraille, E. Cell shrinkage triggers the activation of mitogen-activated protein kinases by hypertonicity in the rat kidney medullary thick ascending limb of the Henle's loop: requirement of p38 kinase for the regulatory volume increase response. J Biol Chem. 274 (48), 34103-34110 (1999).
- Yang, J., Lane, P. H., Pollock, J. S., Carmines, P. K. PKC-dependent superoxide production by the renal medullary thick ascending limb from diabetic rats. Am J Physiol Renal Physiol. 297 (5), F1220-F1228 (2009).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved