Method Article
マウスにおける腎障害の糖尿病発症機序における全腎臓・髄質・皮質尿細管の比較プロテオミクス解析
要約
ここでは、腎臓全体、単離された皮質尿細管、および髄質プロテオームのプロテオミクス解析のための詳細なプロトコールを紹介します。また、この研究では、糖尿病マウスモデルと非糖尿病マウスの局所プロテオームも比較しています。
要約
腎疾患におけるイベントの順序を定義することは、腎臓専門医ツールキットの臨床診療の基礎です。組織プロテオミクス解析は、腎病態生理学の基本的な生理学的および分子的プロセスを理解するための重要なアプローチです。ここで紹介する方法とプロトコルは、疾患の後遺症に関連する関心のある各特定の領域における腎臓の分子解剖を可能にします。疾患が特定の腎臓領域や独自の機能を持つ構造に及ぼす影響を判断するために、このプロトコルの目標は、簡素化されたマウス腎臓の区画化と腎皮質尿細管分離技術を、合理化されたラベルフリーの定量的プロテオミクスワークフローと並行して実証することです。これらの方法を組み合わせることで、腎臓全体、髄質コンパートメント、および腎臓の皮質尿細管構造における摂動分子パターンの同定に役立ち、病理学的状況におけるシングルセルプロテオミクスの究極的かつ最終的な目標を達成します。これらの方法をほぼすべての疾患モデルに適用することは、腎機能障害に関連する病理学のメカニズムを描写するのに役立ちます。
概要
慢性腎臓病(CKD)は現代医学における主要な懸念事項であり、米国だけでも860億ドル以上の医療費が支出されています1。世界中で、CKDの罹患率は、糖尿病の有病率および関連する腎併存疾患とともに増加しています。米国人口の14%近くがCKDを患っています(USRDS 2024年年次報告書)。また、糖尿病性腎症はCKDの一種であり、末期腎疾患(ESRD)の主な原因であり、ESRD患者の60%が糖尿病を患っています1,2,3。糖尿病は、腎臓の機能単位であるネフロンのすべての腎臓構造と細胞型に影響を及ぼします。図1に示すように、ネフロンのさまざまな部分が腎臓皮質と髄質領域に含まれています。腎臓の大部分は尿細管で構成されています。腎尿細管機能障害と構造的病変は、糖尿病性腎症(DN)の発症に大きく寄与しており、これらの変化は腎機能の低下率とよく相関しています4,5,6,7,8。糖尿病の初期には、すべての尿細管セグメントにおけるグルコースとそれに伴うナトリウムの取り込みおよび膜輸送タンパク質の要求の増加に反応して、尿細管は肥大します。糖尿病の後半で微小血管損傷が増加すると、尿細管は萎縮と拡張を示しますが、線維化と間質の拡張があります9。私たちの研究室からの以前の研究では、糖尿病マウスの皮質尿細管に変化したプロテオームと豊富なストレス応答タンパク質が見つかりました10,11。髄質は尿中濃度を調節するために重要であり、腎臓病中の機能障害は酸化ストレスと関連しており、糖尿病は代謝活動による酸素消費量の増加、膜輸送タンパク質の活性の増加、および微小血管損傷12,13,14により、腎臓のこの領域の酸素圧の低下につながります。
DNの発生と進行の詳細なメカニズムを理解することは、疾患のモデリングとシグナル伝達プロセスの分子プロファイリング、細胞タンパク質ダイナミクスの適応的変化、および慢性疾患の損傷の影響を受ける腎細胞および組織成分の正確な定義を呼び出す新しい統合的なアプローチを必要とする継続的な取り組みです。プロテオミクス、メタボロミクス、トランスクリプトミクスは、腎臓病の分子メカニズムを解析的に調べる可能性を提供します。オミクスは、システムバイオロジーのアプローチを利用して、生物学的システムをより包括的に理解する比較的新しい分野です。プロテオミクスは、ここ数十年で腎臓学における強力なオミクスツールとなっています。バイオマーカー研究は、出版物の増加に示されているように、過去20年間で拡大しましたが、これらの発見を臨床に完全に実装するには広範な作業が必要です15。尿細管細胞集団と、腎皮質と髄質内のそれぞれの機能的役割は大きく異なるため、腎臓全体のプロテオミクス分析では、これらの異なる領域内の特定の構造に関連する独自の変化を隠すことができます。したがって、この研究の目標は、腎皮質と髄質の分離、および糸球体からの皮質尿細管の分離を実証することであり、続いて、最先端の質量分析およびバイオインフォマティクス分析のための単離構造からのタンパク質抽出物の調製に関する詳細なプロトコルを示すことです。糖尿病性腎症のマウスモデルは、疾患の進行メカニズムを定義するのに役立ちます。本研究では、早期発症型のI型糖尿病を発症し、ヒトにおける早期および後期のDNの特徴であるOVE26トランスジェニックマウスを用いて、1)糸球体濾過率の早期上昇と後期低下、2)腎肥大、3)糸球体基底膜肥厚とメサンギウム拡大、4)重度のタンパク尿、5)尿細管間質性線維症9、16、17。生後2か月のマウスを選抜して、明白な構造病変の前に尿細管コンパートメントのプロテオミクス変化を示しました。以前に報告され、図2に示されているように、生後2か月のOVE26マウスは、若い糖尿病マウスでは、近位尿細管(図2、黄色の矢印)に明らかな組織学的変化を伴わずに、糸球体メサンギウムマトリックスの拡大(図2、緑の矢印)と重度のタンパク尿17を示します。ここでは、腎臓全体、髄質、および皮質尿細管の特性評価のための複合定量的プロテオミクスアプローチを提示し、糖尿病の各コンパートメントのプロテオームの違いを解明し、説明します。
プロトコル
OVE26マウスとFVBマウスを用いた研究は、ルイビル大学動物管理委員会(IACUC)のガイドラインによって承認されました。トランスジェニック女性OVE26(糖尿病;株#:005564)およびFVB(非糖尿病;バックグラウンド株;Strain #:001800)マウスをJackson Laboratories(メイン州バーハーバー)から購入しました。動物は、25°Cで12時間の明暗サイクルで維持され、水と食物への自由なアクセスが与えられました。すべての研究は、生後2ヶ月のマウスで実施されました。
1.動物モデル
- 腎臓の隔離
- 80 mg / kgケタミンと12 mg / kgキシラジンを腹腔内に投与することにより、マウスに麻酔をかけます。.
- 小さな手術用ハサミで腹部の正中線を切開し、綿棒を使用して腸をマウスの側面にゆっくりと移動させ、大静脈を露出させます。
- 右腎臓の上の大静脈に小さな切り込みを入れます。
- マウスを左心室に通して、20 mLのリン酸緩衝生理食塩水(PBS:pH 7.4; 210 mg/L KH2PO4, 9 g/L NaCl, 726 mg/L Na2HPO4·7H2O)蠕動ポンプを使用して、10 mL/分の速度で。
注:腎臓に血液タンパク質と血液細胞を含めることが下流の分析において重要な要素でない場合、この手順は必要ありません。 - 小さな手術用ハサミを使用して腎臓を取り出します。腎臓の外側から余分な脂肪を取り除きます。腎臓の重さを量り、氷の上の冷たいPBSに入れます。
- 腎臓嚢を取り出します。
- 腎臓をガラス皿または氷の上にセットしたシャーレに置きます。かみそりの刃(図3)を使用して腎臓にいくつかの横方向の切り込みを入れ、腎臓の上極と下極の間に3〜4スライスします。
- 各腎臓から1〜2個の中央のスライスと2つの極( 図3の丸で囲まれた腎臓スライス)を「腎臓全体」サンプルとして確保します。一部を1.5 mLの遠心チューブに入れ、氷冷ホモジナイズバッファー(10%グリセロール、50 mM HEPES、100 mM KCl、2 mM EDTA、0.1% NP40、10 mM NaF、0.25 mM NaVO3、1x HALTSプロテアーゼ阻害剤)を約10 μL/mgの組織サンプル(獲得腎臓重量から得られる腎臓切片の推定質量に基づく)に加えます。チューブを氷の上に置いておきます。
- 中央の横スライスの残りの部分については、スライスを平らに置き、かみそりの刃またはメスを使用して各スライスから皮質(外側1 mm)を慎重にスライスします(図3、概略ワークフロー)。皮質尿細管分離プロトコル(下記、ステップ1.3)のために、皮質を髄質領域から分離しておきます。
- 解剖した髄質の一部を1.5mLの遠心チューブに入れ、ステップ1.1.8のように氷冷均質化緩衝液を加え、チューブを氷上に置きます。
- 均質化に使用されなかった残りのすべての全腎臓および髄質片を液体窒素でスナップ凍結し、-80°Cで保存します。
- あるいは、分離した腎臓全体と髄質のコンパートメントをすべて凍結し、ステップ1.1.11の説明に従って保管します。.ステップ1.1.8のように均質化バッファーを追加するために、後でそれらを保管庫から取り出します。
- 皮質尿細管の分離
- 解剖した皮質をガラス皿またはシャーレの上でかみそりの刃で1〜3mmの小片に刻み、ペーストを形成します。
- 刻んだ皮質を1 mLのIA型コラゲナーゼ(1 mg/mL)で30分間、37°Cでロッキングウォーターバスで消化します。
- 氷上の50 mLコニカルチューブの上に100 μmのセルストレーナーを置きます。
- 消化した皮質懸濁液を100 μm細胞ストレーナーに置き、10 mLシリンジのプランジャーを使用してストレーナーを静かに押し込みます。ストレーナの上部を1mLのPBSで洗い、ストレーナの下側を1mLのPBSで洗います。
- 50 mLチューブ内の濾液を追加の100 μmストレーナに通し、ストレーナーの上部を1 mLのPBSで洗浄します。
- 濾液を70 μmのセルストレーナーに通し、氷上に50 mLのコニカルチューブの上に置きます。尿細管はこのストレーナを通過して濾液に入ります(糸球体は70μmのストレーナに保持されます)。ストレーナーを1mLのPBSで洗います。
- 最終濾液を120 × g で4°Cで2分間遠心します。 尿細管ペレットから余分なPBSを廃棄します。
- 皮質尿細管ペレットの純度は、10倍対物レンズを使用して顕微鏡で可視化します。画分の10%以上に糸球体が含まれている場合は、濾液を1 mLのPBSで再懸濁し、ストレーナーを追加で洗浄せずに清潔な70 μmセルストレーナーを通過します。
- 濃縮尿細管画分を1.5 mLの遠心チューブに分配し、2000 × g で4°Cで2分間遠心します。 上清を捨てます。
- 腎臓全体および髄質と同様に、尿細管ペレットに均質化バッファーを添加します(ステップ1.1.8および1.1.10)。
- 組織均質化/タンパク質抽出
- 1.5 mL チューブ専用のプラスチック製乳棒を使用して、1.5 mL 微量遠心チューブで各サンプルタイプを均質化します。均質化された懸濁液が厚すぎる場合は、必要に応じて均質化バッファーを追加します。
- 均質化された懸濁液を氷上に15分間放置し、続いてバスソニケーター(オン/オフスイッチのみ、ユニットの調整可能な設定なし)で5分間超音波処理し、25°Cのバスに水を入れます。 サンプルを氷上に10分間放置します。
- 短時間ボルテックス(1000-1500 RPM)でホモジネートし、次にピペットで20回回転させ、さらに15分間氷上に置きます。
- 13,000 × g で4°Cで20分間遠心分離する前に、サンプルを数回粉砕します。
- 透明化したタンパク質抽出物をきれいなチューブに移します。
- 30 μLの透明抽出物をアリコートして、タンパク質の推定と質量分析用のサンプル調製を行います。残りのサンプルは-80°Cで保存します。
2. Suspension-Trap mini スピンカラム消化プロトコール
- タンパク質のトリプシン断片へのタンパク質分解消化によるプロテオミクス解析
- ~40-50 μg のサンプル (~2 μg/ μL) をサンプル溶解バッファー (10% w/v ドデシル硫酸ナトリウム [SDS] 含有 100 mM 重炭酸トリエチルアンモニウム (TEA-BC) pH 8.5、40 mM トリス (2-カルボキシエチル) ホスフィン [TCEP]) に希釈し、最終容量 46 μL にします。
- タンパク質の還元とアルキル化
- 65°Cで30分間インキュベートします(TCEPの最終濃度は20 mMです)。
- 液体クロマトグラフィー-質量分析(LC-MS)グレードの水に 0.5 M ヨードアセアミド 4 μL を加え、暗所で室温 (RT) で 30 分間インキュベートします (ヨードアセトアミドの最終濃度は 40 mM です)。
- 5 μL の 12% w/w リン酸を LC-MS グレードの水に添加します (141 μL の 85% リン酸を 859 μL の水に希釈して 12% 溶液にします)。
- リン酸の代わりに、リン酸化ペプチド濃縮を行う場合は、トリフルオロ酢酸またはギ酸を使用してください18。
- 350 μL の懸濁液トラップ結合バッファー (100 mM TEA-BC 含有 90% v/v メタノール/10% v/v 水、pH 7.55) を添加します。
- サスペンショントラップ列にサンプルを追加します。固定角ローターでRTで4,000 × g で30秒間遠心分離し、各容量をカラムに通します。
- 4x 400 μLの懸濁液トラップ結合バッファーで洗浄します。固定角ローターでRTで4,000 x g で30秒間遠心分離し、各洗浄液をカラムに通過させます。
注意: SDSの除去を容易にするために、各洗浄後にローター内のカラムを180°回転させます。 - 4,000 g でRTで1分間遠心分離し、結合バッファーを完全に除去します(消化中の滴下を防ぎます)。
- サスペンショントラップカラムを清潔な収集チューブに移します。
- LC-MSグレードの水(トリプシンプロテアーゼ、MSグレード)中の50 mM TEA-BC pH 8.5の125 μLに2.5-5 μgのトリプシンを加えます。サンプルに対するトリプシンの最終的な比率は1:20から1:10までです。
- 47°Cで2時間インキュベートします(キャップを締めないでください。0 RPMに設定されたサーマルミキサーが推奨されます)。キャップに針で穴をあけると、サスペンショントラップの上部チャンバーに圧力がかかるのを防ぐことができます(圧力が増加すると、トリプシン溶液がカラムから滴り落ちます)。
- 50 mM TEA-BC pH 8.5 の 80 μL を LC-MS グレードの水に添加します。固定角ローターで室温 4,000 g で 1 分間遠心分離し、各消化物をカラムに通します。
- 80 μL の 0.2% v/v ギ酸を LC-MS グレードの水に添加します。4,000 g で固定角ローターのRTで1分間遠心分離し、ステップ2.11の消化物で回収します。
- 50% v/v アセトニトリル 80 μL を LC-MS グレードの水に添加します。4,000 gの室温で固定角ローターで1分間遠心分離し、ステップ2.11の消化物で回収します。
- 懸濁液トラップ溶出液は-80°Cで保存してください。
- サンプルを真空濃縮器で乾燥させます。
- 乾燥したサンプルを-80°Cで保存します。
3. HLB(Hydrophilic-Lipophilic Balance)カラムによるクリーンアップ
- 溶液A(2%v/vアセトニトリル/0.1%v/vギ酸)とB(80%v/vアセトニトリル/0.1%v/vギ酸)を作製します。
- サンプルを500μLの溶液Aに溶解します。
- カラムを真空マニホールドに置き、1~2 mL/minのガス圧を加えます。
- 500 μL の溶液 B を HLB カラムに加え、1 〜 2 mL/分でエキュートします。2回繰り返します。
- 750 μL の溶液 A を HLB カラムに加え、1 〜 2 mL/分で排気します。2回繰り返します。
- 清潔な 2 mL マイクロチューブを HLB カラムの下のラックに置き、サンプルを 500 μL の溶液 A にロードし、上記のようにガス圧をかけます。フロースルーを 2 回目にカラムに通します。
- HLBカラムを廃液チューブの上に置き、500 μLの溶液Aを加えて、上記のように排気します。2回繰り返します。
- 清潔な 2 mL マイクロチューブの上にカラムを置き、500 μL の溶液 B を加えて、上記のように排気します。2回繰り返します。
- 溶出液を-80°Cで凍結し、真空濃縮器で乾燥させます。乾燥した残留物を-80°Cで保存します。
- MS 分析の前に、残渣を 20 μL の 2% v/v アセトニトリル/0.1% v/v ギ酸に溶解します。分光光度計を使用して、205 nmの吸光度でペプチド濃度を推定します。
4. 質量分析
- 一次元逆相液体クロマトグラフィー(LC)-MS/MS
- 等質量のペプチド(~600 ng)を1次元ナノLCに注入し、逆相C18カラムで分画します。
- イオントランスファーチューブを 250 °C に維持し、1.8 kV のスプレー電圧でペプチドを直接 MS に溶出します。
- データ依存の上位 20 イオンモードでスペクトルを取得し、最も強度の高い MS/MS フラグメントを分析キューから除去して、存在量の少ないイオンのイオンマッピングの深さを改善します。
5. データ解析とバイオインフォマティクス
- データ処理手順
- PEAKS 12.0(LC-MS/MSデータ解析ソフトウェア)でスペクトルの割り当てとペプチドおよびタンパク質の同定を行った後、MetaboAnalyst 6.0(メタボロミクスデータ解析プラットフォーム)で単一因子統計解析アプローチ(https://www.metaboanalyst.ca/)を使用して、解析するタンパク質のリストを提出します。
- LC-MS/MS データ解析ソフトウェアを使用して、Mouse Reviewed FASTA データベースに対して厳密な偽発見率(FDR)基準(1% タンパク質およびペプチド)を使用してスペクトルを検索およびフィルタリングします。
注:すぐに利用できる代替検索プログラムには、Maxquant、Proteome Discovererなど、広く使用されているオプションがあります。 - システインのカルバミドメチル化を固定修飾として指定します。メチオニンの酸化を変数修飾として指定します。
- リストをカンマ区切り値 (CSV) 形式に変換し、各列と行に割り当てられたグループ/サンプル ラベルに変換します。このフォーマットは、メタボロミクスデータ解析プラットフォームにおいて柔軟性があります。
- 欠損変数の 1/5 最小値ルールを使用して、欠損値を代入します。
- データをフィルタリングし、カットオフに 40% の分散が使用される四分位範囲を使用して、変動の大きい値を除外します。
- 値を中央値強度、log10 変換、平均中心化に正規化します。他の正規化アプローチを使用しますが、結果が異なる場合があることに注意してください。
- 対応のない方法で t 検定を p 値のカットオフ値 0.05 <実行します。この段階では、複数のテスト修正を実行します。
注:この研究では、データ表示の目的で代表的なデータセットに対してこの補正は行われませんでした。 - 1.5倍変化(FC)とp<0.05の火山プロットを示します。
- ヒートマップを生成し、サンプルグループの部分最小二乗判別分析(PLSDA)および統計(投影の重要度変数[VIP])分析を実行します。
- フォローアップの潜在的な候補は、PLSDA分析で示されているように、1.5FCを上回るほど堅牢で、p-val < 0.05またはVIP>1.0のいずれかです。
- OVE26マウスの腎臓、尿細管、および髄質全体のプロテオームの違いを示すベン図を生成します。
結果
全体として、各サンプルタイプからの総タンパク質同定は、1)全腎臓(1438)、2)髄質(2145)、および皮質尿細管(1859)であった。MetaboAnalyst 6.0でのデータ処理、データフィルタリング、インピュテーションを経て、最終的に各腎臓コンパートメントのタンパク質同定を解析したのは、全腎臓(455)、髄質(997)、皮質尿細管(896)でした。 図4 は、OVE26糖尿病マウス腎臓の全体的なプロテオミクス変化を示しています。ラベルフリー定量(LFQ)分析により、レポーターイオン標識(TMT、iTRAQなど)と比較して、データセット全体により多くのばらつきをもたらしながら、詳細なプロテオームカバレッジが可能になります。LFQのばらつきを克服する1つの方法は、各条件で分析されるサンプル数を増やすことです。ここでは、PEAKS検索アルゴリズムの強度ベースの定量アプローチを利用し、ペプチドおよびタンパク質の割り当てレベルでの偽発見率(FDR)を1%に抑え、各条件の2匹の動物を技術的な反復を含めて対に比較することで、堅牢なデータセットの生成を可能にしました。 図 4A は、未調整の p 値 (p 値 < 0.05) に対してプロットされた log2FC (倍率変化) を示しています。通常、p値は、直交的なフォローアップのために堅牢な候補タンパク質を検証することが意図である場合に、多重比較テストのために補正されます。ここでは、プレゼンテーションの目的で、火山プロットにおけるOVE26とFVBの未調整のプロテオーム比較全体を示します。定量分析の最初の概要として、火山プロットは、生物学的な意味合いを持つ潜在的に興味深い候補のスナップショットプレビューを示しています。 図4A は、全腎臓プロテオームにおけるOVE26タンパク質の定量とコントロールFVB株の比率を示しています。特に、GAPDHはALDH6A1とともにOVE26腎臓で強力にアップレギュレーションされており、代謝反応が初期の糖尿病腎臓で開始されることを示唆しています。個々のバイオリンプロットを 図4B に示し、MetaboAnalyst 6.0を使用したデータの正規化の変動性と影響を示しています。OVE26マウス全腎臓におけるマトリックスメタロエンドペプチダーゼ(MME)とカテプシンA(CTSA)の強力なダウンレギュレーションに注意してください。腎臓全体の全体的なプロテオームの違いを示すために、フィルタリングされたプロテオームデータセットを次元削減および教師付き多変量解析(PLSDA、sPLSDA、oPLSDA)に提出して、グループレベルの違いを示し、投影の重要性の変数(VIP)を見つけることができます。このために、 図4Cに示すように、OVE26およびFVB腎臓プロテオームでPLSDAを実行し、VIPを 図4Dに示します。PLSDA分析では、コントロールのFVB腎臓プロテオーム(赤)と比較した場合、OVE26プロテオーム(緑)の堅牢な分離が示されています。VIP スコア > 1 は、通常、補足図(補足図 1)のプロットに示されている Gprofiler (https://biit.cs.ut.ee/gprofiler/gost) を使用したパスウェイオントロジーエンリッチメントのさらなる解析に適した候補変数 (この場合はタンパク質) です。 特に、多くのタンパク質VIPは、 図4Aの火山プロット分析で発見されています。さらなる解析のための候補リストの同定には、大きな倍率変化を持つタンパク質、統計的に頑健で、グループ層別化に関与する重要なタンパク質(VIP>1)を含める必要があります。グループレベルと個々のタンパク質レベルでのプロテオームの違いをさらに示すことは、 図4Eに示すように、グループと特徴のクラスタリングを備えた階層ヒートマップで視覚化できます。
比較のために、OVE26 マウスと FVB マウスから単離された皮質尿細管(図 5)と髄質(図 6)で 1 次元 LC-MS/MS 定量プロテオミクス分析を行い、存在量の多い成分がない場合に、腎臓の特定の領域のプロテオームに効果的な検出深度でドリルインする能力を示しました。最後に、プロテオームのオーバーラップは、ベン図に示すように、有意な同定の総数を比較し、各条件(腎臓全体、尿細管、髄質)で最も統計的に有意なタンパク質を重ね合わせることで説明できます(図7)。特に、PLSDA次元削減統計アプローチ(図4C、D、図5C、D、および図6C、D)のt検定とVIP(投影の重要度変数)の組み合わせアプローチを利用して、潜在的なフォローアップ候補タンパク質を決定します。t-stat(T検定)基準(図7A)は、腎臓全体、および髄質と尿細管において、閾値を超えるタンパク質の数が多いことを最も同定するのに適していたことに留意されたい。図7Bの別の統計的閾値(VIP > 1)を使用して候補リストを拡大すると、髄質および皮質尿細管のプロテオミクス解析において、より均等に分布した新規の候補タンパク質が得られました。注目すべきは、3つのプロテオームのそれぞれに重複がなく、0または2の候補がどちらのアプローチでも共有されたことです。腎臓プロテオームのより深い穴を開けるために、複数のアプローチを適用することができます。組織および組織コンパートメントレベルでのプロテオームの単離と分画は、t検定とVIPソーティングアプローチのベン図比較(図7)で示されるように、頑健な結果をもたらすことができる最初のアプローチです。すべてのRAWファイルとピークリストは、HUPO基準に従ってMASSIVE(massive.ucsd.edu)に寄託され、出版時に部分的な登録として公開されます。
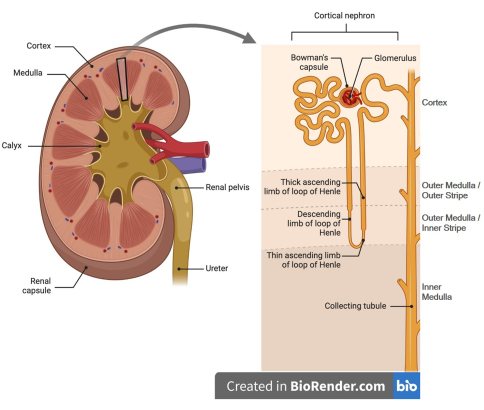
図1:腎臓腎の漫画のレンダリング( 左パネル)腎臓には皮質(外側)と髄質(内側)の領域があります。(右パネル)腎皮質には、糸球体とそれぞれのボウマン嚢、近位回旋尿細管とその直線セグメントの大部分、ヘンレの厚い上行ループの一部、遠位回旋尿細管、収集管の皮質セグメント、および尿細管周囲毛細血管(図示せず)が含まれています。髄質は、ヘンレの下降ループと上行ループ、ヘンレの厚い上昇ループと収集管の髄質部分、およびこれらの尿細管セグメントを囲む直腸血管(図示せず)で構成されています。この図はBiorenderを使用して生成されました。 この図の拡大版を表示するには、ここをクリックしてください。

図2:生後2ヶ月齢のFVB(非糖尿病)マウスおよびOVE26(糖尿病)マウスにおける組織型を実証するための代表的なPAS(過ヨウ素酸シッフ)染色。 糖尿病マウスの糸球体(緑の矢印)は、ピンク色のPAS染色の増加を示し、メサンギウムの拡大を示していますが、尿細管間質の明白な組織学的変化は、若い糖尿病マウスではまだ明らかではありません。近位尿細管は、軽度/中程度の拡大/肥大を示します(黄色の矢印)。スケールバー:30μm。オリジナルの倍率100倍。 この図の拡大版を見るには、ここをクリックしてください。
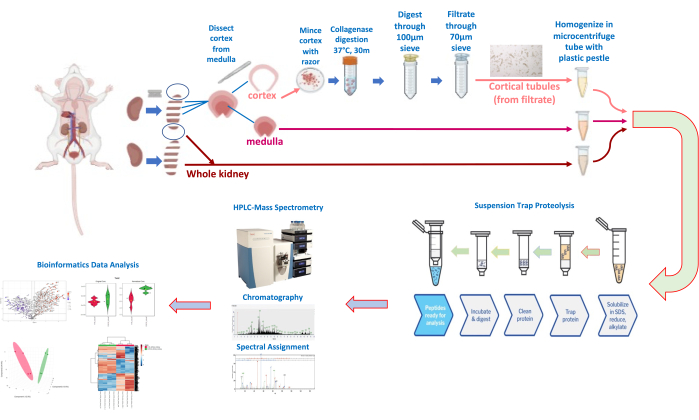
図3:腎臓の解剖と尿細管の分離、および定量的プロテオミクスのワークフロー。この図の拡大版を表示するには、ここをクリックしてください。
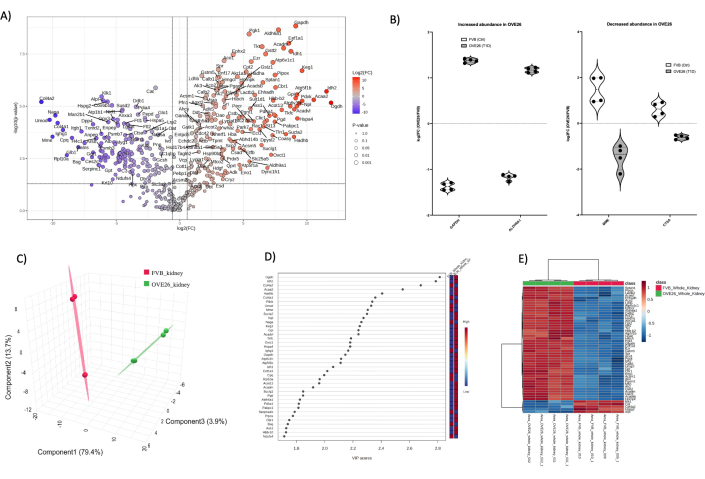
図4:OVE26糖尿病全マウス腎臓プロテオームの全球的な変化 (A) 1.5倍の陰性(青)または正(赤)の変化と<0.05のpカットオフを垂直線と水平線で示される火山プロットで、未調整のp値(-log10 p値)に対してプロットされたlog2FC(OVE26/FVBの倍率変化)を示しています。すべての重要なタンパク質の定量はデータポイントでラベル付けされています。(B)OVE26でGAPDHおよびALDH6A1が増加し、OVE26腎臓全体でMMEおよびCTSAが減少する特定のタンパク質の各反復定量の変動性を示すバイオリンプロット。(C)偏最小二乗判別分析を用いた次元削減アプローチでは、OVE26(緑)とFVB(赤)のグループ分離が示されています。(D)プロジェクションプロットの重要度変数は、VIPスコアによるPLSDA分析における個々のタンパク質の寄与を示しています。(E)タンパク質定量強度のグループ差を示す上位の調節タンパク質の階層クラスタリングヒートマップ。 この図の拡大版を表示するには、ここをクリックしてください。
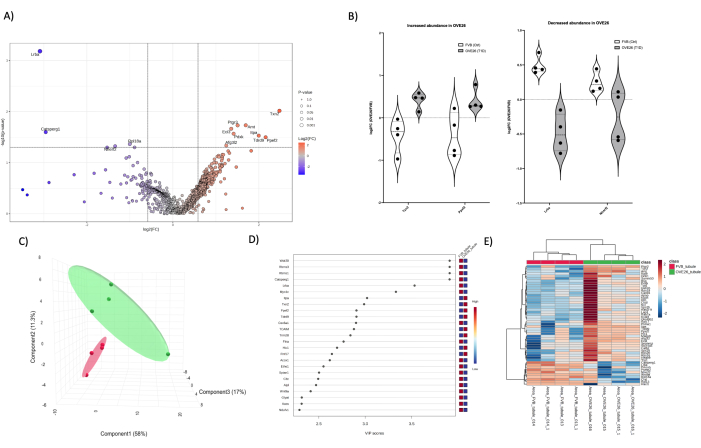
図5:OVE26糖尿病性皮質尿細管プロテオームの変化。 (A)1.5倍の負(青)または正(赤)の変化とp<0.05のカットオフを持つ火山プロットの未調整のp値(-log10 p値)に対してプロットされたlog2FC(OVE26 / FVBの倍率変化)を示しており、垂直線と水平線で示され、すべての重要なタンパク質定量がデータポイントでラベル付けされています。(B)選択したタンパク質TXN2およびPPEF2がOVE26で増加し、LRBAおよびNHERF2がOVE26管状プロテオームで減少する選択タンパク質の各反復定量の変動性を示すバイオリンプロット。(C)偏最小二乗判別分析を用いた次元削減アプローチでは、OVE26(緑)とFVB(赤)のグループ分離が示されています。(D)プロジェクションプロットの重要度変数は、VIPスコアによるPLSDA分析における個々のタンパク質の寄与を示しています。(E)タンパク質定量強度のグループ差を示す上位の調節タンパク質の階層クラスタリングヒートマップ。 この図の拡大版を表示するには、ここをクリックしてください。
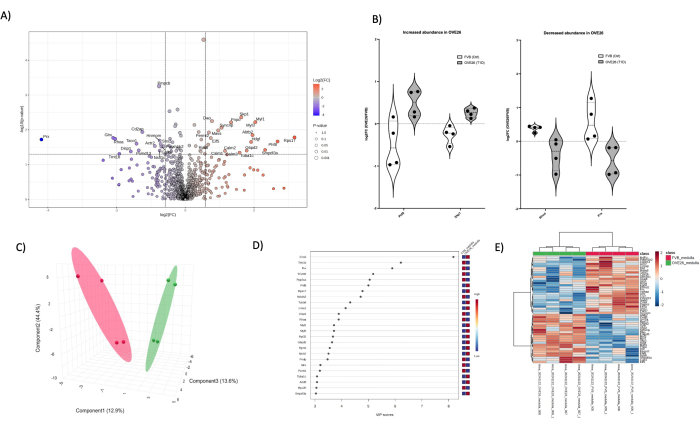
図6:OVE26糖尿病性髄質プロテオームの変化 (A) 1.5倍の陰性(青)または正(赤)の変化と<0.05のpカットオフを垂直線と水平線で示される火山プロットの未調整のp値(-log10 p値)に対してプロットされたlog2FC(OVE26/FVBの倍率変化)を示しています。すべての重要なタンパク質の定量はデータポイントでラベル付けされています。(B)OVE26で増加し、OVE26でRHOAとPRXが減少する特定のタンパク質PHF8およびSKP1の各反復定量の変動性を示すバイオリンプロット。(C)偏最小二乗判別分析を用いた次元削減アプローチでは、OVE26(緑)とFVB(赤)のグループ分離が示されています。(D)プロジェクションプロットの重要度変数は、VIPスコアによるPLSDA分析における個々のタンパク質の寄与を示しています。(E)タンパク質定量強度のグループ差を示す上位の調節タンパク質の階層クラスタリングヒートマップ。 この図の拡大版を表示するには、ここをクリックしてください。

図7:腎臓全体、尿細管、髄質プロテオームにおける異なる存在量のタンパク質のベン図。 腎臓プロテオームは、t検定(p-val < 0.05)と+/- 1.5FCの倍率変化閾値、およびVIP>1.0のリストに従って比較されました。 この図の拡大版を表示するには、ここをクリックしてください。
補足図1:パネル4DにVIPタンパク質リスト(VIP > 1)を提出して生成されたGprofilerを使用した全腎臓プロテオーム経路解析。 図 4のPLSDA解析でVIPスコアが1より大きいタンパク質の経路差を解析するために、Gprofilerを導入しました。(A)分子機能(MF)、細胞成分(CC)、および生物学的プロセス(BP)のp値カットオフによるグラフィカルな経路濃縮を示しています。(B)各特定のプロセス、機能、または細胞コンパートメントの遺伝子オントロジーパスウェイエンリッチメントテーブル。(C)全腎臓プロテオーム分子機能の特異的タンパク質濃縮プロット。 このファイルをダウンロードするには、ここをクリックしてください。
ディスカッション
この技術的アプローチで提示される方法は、腎臓のさまざまな領域の比較プロテオーム分析を説明するように設計されています。ここでは、糖尿病マウス(OVE26)および対照マウス(FVB)の髄質および皮質尿細管を単離する方法を利用し、1次元LC-MS/MSおよびバイオインフォマティクス解析を行い、腎臓全体のプロテオームに加えて、腎臓の各部分のプロテオームの基本的な違いを示しました。
腎臓コンパートメントを分離するには、髄質から離れた皮質を慎重に解剖する必要があります。腎臓を最初に横切開すると、薄いスライスにより、皮質のより信頼性の高い解剖が可能になります。ふるい分けアプローチを使用して皮質細管を調製すると、70μmのふるいを通して糸球体をろ過することができます。顕微鏡で尿細管の純度を確認し、濃縮を確保しながら、洗浄ステップを連続するたびに尿細管の質量が失われないようにすることが重要です。最初のふるい分けステップで消化された皮質を過度に圧迫しないようにすることで、最終的な尿細管調製における汚染を減らすことができます。
懸濁液トラッピングアプローチは、質量分析の溶出ステップにおけるイオン性干渉なしに、可溶化およびタンパク質抽出ステップにおいて大きな柔軟性を提供します。ステップ2.10で非常に重要なのは、ペプチド濃度に対するトリプシン(1:20または1:10がほとんどのアプリケーションに最適に見える)の比率です。タンパク質の効率的なタンパク質分解と非特異的な切断の最小化により、より一貫した結果が得られます。ステップ2.4.1のアルキル化に続く酸性化ステップでは、リン酸化ペプチドの濃縮が行われる場合、ギ酸またはトリフルオロ酢酸を利用できます。リン酸は、金属アフィニティークロマトグラフィー樹脂に結合するリン酸化ペプチドと競合する可能性があります。
パスウェイ解析は、代表的な解析で示されているように、OVE26腎臓の糖尿病性損傷に関連するパスウェイの違いと変化を示すために利用できます(補足図1)。 オントロジーアノテーションによって示される経路解析の顕著な違いは、腎ネフロンにおける代謝の不均一性を示しています。腎臓全体のプロテオームは、アミノ酸の代謝および異化プロセス、脂肪酸の酸化、および全体的なエネルギー管理のテーマに関与するタンパク質が著しく豊富でした(補足図1)。皮質尿細管プロテオームは、図5に示すように、このコンパートメントで予想されるように、構造タンパク質とイオントランスポーターを増加させていました。髄質は、この部位が解糖酵素に富んでいるため、炭水化物代謝タンパク質が豊富であり(図6)、グルコースは、糖新生の部位であり、グルコースは呼吸のための貧弱な燃料である腎皮質と比較して、外側の髄質の燃料源です19,20。さらに、髄質におけるキナーゼシグナル伝達経路の濃縮は、この領域21における間質性浸透圧および細胞サイズの変動、および糖尿病22におけるこの領域に関連する代謝障害および酸化ストレスを反映している可能性が高い。ボルケーノプロット、VIPプロット、ヒートマップの結果をGprofilerのような経路強化アプローチと組み合わせて使用することで、研究者はさまざまな腎コンパートメントの変化に対する怪我や病気の影響をよりよく理解することができます。その他の解析ソフトウェアオプションには、オントロジーおよびパスウェイの特性評価のためのDAVID(https://davidbioinformatics.nih.gov/)、Express Analyst(https://www.expressanalyst.ca/ExpressAnalyst/)、PANTHERDB(https://www.pantherdb.org/)などがあります。
結論として、全腎臓プロテオーム(図4)と皮質尿細管(図5)および髄質(図6)コンパートメントのプロテオミクス比較は、腎臓の孤立した部分と比較した場合の全腎臓抽出物の不均一性を示すための有用なアプローチです。さらに、単離されたプロテオームは、存在量の多い(組織全体の)タンパク質がない場合でも、特定の構造のプロテオームを深く掘り下げることができるため、中程度の存在量(組織コンパートメント)が明らかになり、最終的に存在量が少ない(シングルセル)タンパク質がマスクされます。最終的には、理想的な単離は、細胞動態を測定し、糖尿病や慢性腎臓病などの特定の病的状態に関連付けることができるように、単一細胞レベルでの分離です。
開示事項
著者は開示していません。
謝辞
このプロジェクトの作業の一部は、MTB(NIH K01DK080951)とTDC(NephCure-Pediatric Nephrology Research Consortium NKI-2023-04)、ルイビル大学腎臓病プログラムとプロテオミクス技術センター(TDC、MTB)の資金によって支援されました。
資料
| Name | Company | Catalog Number | Comments |
| Collagenase type 1A | Millipore Signal | C9891 | |
| Exploris 480 Orbitrap | Thermofisher | https://www.thermofisher.com/order/catalog/product/BRE725539 | MS |
| Falcon Cell Strainer, 100 µm | VWR | 21008-950 | |
| Falcon Cell Strainer, 70 µm | VWR | 21008-952 | |
| Gibco PBS pH 7.4 | Thermo | 1001023 | |
| Halt Protease and Phosphatase Inhibitor Cocktail | VWR | PI78440 | |
| Iodoacetamide | Sigma Aldrich | I1149 | |
| MetaboAnalyst 6.0 | MetaboAnalyst 6.0 | https://www.metaboanalyst.ca/ | metabolomics data analysis platform |
| NanoDrop 2000 | Thermofisher | https://www.thermofisher.com/order/catalog/product/ND-2000 | |
| Oasis HLB column | Waters | 186002034 | |
| PEAKS 12.0 | Bioinformatics Solutions Inc | LC-MS/MS data analysis software | |
| Pestle for 1.5 mL Microtube | Fisher Scientific | NC0782485 | |
| Suspension Trap (S-trap) | Protifi | C02-micro-10 | |
| TCEP | ThermoFisher Scientific | 20490 | |
| TEABC | Sigma Aldrich | T7408 | |
| Trypsin Protease, MS-Grade | ThermoFisher Scientific | 90057 | |
| Ultrasonic Cleaner | Cole-Parmer | Model 0884900 |
参考文献
- Ding, X., et al. Epidemiological patterns of chronic kidney disease attributed to type 2 diabetes from 1990-2019. Front Endocrinol. 15, 1383777 (2024).
- Liu, W., et al. Global trends in the burden of chronic kidney disease attributable to type 2 diabetes: an age-period-cohort analysis. Diabetes Obes Metab. 26 (2), 602-610 (2024).
- Xie, D., et al. Global burden and influencing factors of chronic kidney disease due to type 2 diabetes in adults aged 20-59 years, 1990-2019. Sci Rep. 13 (1), 20234 (2023).
- Giunti, S., Barit, D., Cooper, M. E. Mechanisms of diabetic nephropathy: role of hypertension. Hypertension. 48 (4), 519-526 (2006).
- Thomas, M. C., Burns, W. C., Cooper, M. E. Tubular changes in early diabetic nephropathy. Adv Chronic Kidney Dis. 12 (2), 177-186 (2005).
- Thomas, M. C., et al. Diabetic kidney disease. Nat Rev Dis Primers. 1, 15018 (2015).
- Nath, K. A. Tubulointerstitial changes as a major determinant in the progression of renal damage. Am J Kidney Dis. 20 (1), 1-17 (1992).
- Bonventre, J. V. Can we target tubular damage to prevent renal function decline in diabetes. Semin Nephrol. 32 (5), 452-462 (2012).
- Powell, D. W., et al. Renal tubulointerstitial fibrosis in OVE26 type 1 diabetic mice. Nephron Exp Nephrol. 111 (1), e11-e19 (2008).
- Cummins, T. D., et al. Quantitative mass spectrometry of diabetic kidney tubules identifies GRAP as a novel regulator of TGF-beta signaling. Biochim Biophys Acta. (4), 653-661 (2010).
- Barati, M. T., et al. Differential expression of endoplasmic reticulumstress-response proteins in different renal tubule subtypes of OVE26 diabetic mice. Cell Stress Chaperones. 21 (1), 155-166 (2016).
- Zheleznova, N. N., et al. Mitochondrial proteomic analysis reveals deficiencies in oxygen utilization in medullary thick ascending limb of Henle in the Dahl salt-sensitive rat. Physiol Genomics. 44 (17), 829-842 (2012).
- Nordquist, L., Palm, F. Diabetes-induced alterations in renal medullary microcirculation and metabolism. Curr Diabetes Rev. 3 (1), 53-65 (2007).
- dos Santos, E. A., Li, L. -. P., Ji, L., Prasad, P. V. Early changes with diabetes in renal medullary hemodynamics as evaluated by fiberoptic probes and BOLD magnetic resonance imaging. Invest Radiol. 42 (3), 157-162 (2007).
- Cummins, T. D., et al. Quantitative Mass Spectrometry Normalization in UrineBiomarker Analysis in Nephrotic Syndrome. Glomerular Dis. (3), 121-131 (2022).
- Carlson, E. C., Audette, J. L., Klevay, L. M., Nguyen, H., Epstein, P. N. Ultrastructural and functional analyses of nephropathy in calmodulin-induced diabetic transgenic mice. Anat Rec. 247 (1), 9-19 (1997).
- Zheng, S., et al. Development of late-stage diabetic nephropathy in OVE26 diabetic mice. Diabetes. 53 (12), 3248-3257 (2004).
- Wang, F., Veth, T., Kuipers, M., Altelaar, M., Stecker, K. E. Optimized suspension trapping method for phosphoproteomics sample preparation. Anal Chem. 95 (25), 9471-9479 (2023).
- Mather, A., Pollock, C. Glucose handling by the kidney. Kidney Int Suppl. 120, S1-S6 (2011).
- Ross, B. D., Espinal, J., Silva, P. Glucose metabolism in renal tubular function. Kidney Int. 29 (1), 54-67 (1986).
- Roger, F., Martin, P. Y., Rousselot, M., Favre, H., Féraille, E. Cell shrinkage triggers the activation of mitogen-activated protein kinases by hypertonicity in the rat kidney medullary thick ascending limb of the Henle's loop: requirement of p38 kinase for the regulatory volume increase response. J Biol Chem. 274 (48), 34103-34110 (1999).
- Yang, J., Lane, P. H., Pollock, J. S., Carmines, P. K. PKC-dependent superoxide production by the renal medullary thick ascending limb from diabetic rats. Am J Physiol Renal Physiol. 297 (5), F1220-F1228 (2009).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved