Method Article
Sepsiste Bağışıklık Durumlarını Ölçmek için Veriye Dayalı Bir Yaklaşım
Bu Makalede
Özet
Bu çalışma, sepsis hastalarında ve sağlıklı kontrollerde beyaz kan hücreleri, lenfositler ve nötrofiller arasındaki kantitatif ilişkileri, veri görselleştirme analizi ve üç boyutlu sayısal uydurma kullanarak matematiksel bir model oluşturmak için sepsiste immün durumu araştırmaktadır.
Özet
Sepsiste, beyaz kan hücreleri, lenfositler ve nötrofiller arasındaki etkileşimi anlamak, bağışıklık durumunu değerlendirmek ve tedavi stratejilerini optimize etmek için çok önemlidir. Sepsis tanısı alan 512 hasta ve 205 sağlıklı kontrolden toplam 717 kan örneği toplandı. Beyaz kan hücreleri, lenfositler ve nötrofiller arasındaki ilişkileri tanımlayan matematiksel bir model oluşturmak için veri görselleştirme analizi ve üç boyutlu sayısal uydurma yapıldı. Kendi kendini organize eden özellik haritası (SOFM), sepsis örnek verilerini model tarafından temsil edilen üç boyutlu uzayda otomatik olarak kümelemek için kullanıldı ve farklı bağışıklık durumları elde edildi.
Analiz, beyaz kan hücresi, lenfosit ve nötrofil sayılarının, aşağıdaki denklemle açıklandığı gibi üç boyutlu bir düzlemde kısıtlandığını ortaya koydu: WBC = 1.098 × Nötrofil + 1.046 × Lenfositler + 0.1645, %1'lik bir tahmin hatası (RMSE) verir. Bu denklem, mekansal dağılımlarındaki farklılıklara rağmen tüm örneklere evrensel olarak uygulanabilir. SOFM kümelemesi, sepsis hasta popülasyonu içinde farklı bağışıklık durumu seviyelerini, salınım dönemlerini ve iyileşme aşamalarını temsil eden dokuz farklı bağışıklık durumu tanımladı.
Yukarıdaki denklem ile temsil edilen önerilen matematiksel model, hem sepsis hastalarında hem de sağlıklı kontrollerde bağışıklık hücresi popülasyonları üzerinde temel bir kısıtlama sınırı ortaya koymaktadır. Ayrıca, SOFM kümeleme yaklaşımı, sepsis hastalarında bu kısıtlama sınırı içinde gözlemlenen farklı bağışıklık durumlarına kapsamlı bir genel bakış sağlar. Bu çalışma, sepsiste bağışıklık durumunun ölçülmesi ve sınıflandırılması konusunda gelecekteki çalışmaların temelini atmaktadır ve bu da sonuçta daha objektif tanı ve tedavi stratejilerinin geliştirilmesine katkıda bulunabilir.
Giriş
Enfeksiyona karşı düzensiz bir konak yanıtının neden olduğu yaşamı tehdit eden bir organ disfonksiyonu olan sepsis, yoğun bakım tıbbında önemli bir zorluk olmaya devam etmektedir1. Sepsisin patofizyolojisinin anlaşılmasındaki ilerlemelere rağmen, bağışıklık sistemi ve patojenler arasındaki karmaşık etkileşim, bu durumun etkili bir şekilde teşhis ve tedavisinde zorluklar yaratmaya devam etmektedir2. Mevcut klinik yaklaşımlar genellikle enfeksiyon göstergelerinin, organ fonksiyonunun, sitokinlerin, mikrobiyal tespitin ve bağırsak mikrobiyomunun izlenmesine odaklanmaktadır3. Bununla birlikte, sepsis4'ün ilerlemesinde ve çözülmesinde bağışıklık hücrelerinin, özellikle beyaz kan hücrelerinin, lenfositlerin ve nötrofillerin oynadığı önemli rolün giderek daha fazla tanınması söz konusudur.
Sepsis seyri sırasında, bağışıklık sistemi, başlangıçta hiperinflamatuar bir faz ve ardından uzun süreli bir immünosüpresif faz5 ile karakterize edilen karmaşık bir dizi değişikliğe uğrar. Erken faz, nötrofil sayımlarında bir artış ve lenfosit popülasyonlarında eşlik eden bir azalma ile işaretlenir, bu da doğuştan gelen bağışıklık tepkilerinin aktivasyonunu ve adaptif bağışıklığın baskılanmasını yansıtır6. Durum ilerledikçe, lenfosit sayıları azalmaya devam ederken nötrofil seviyeleri salınabilir veya tükenebilir, bu da hastaları ikincil enfeksiyonlara karşı savunmasız hale getiren bir immünosupresyon durumuna yol açar7. Bu bağışıklık hücresi popülasyonları arasındaki dinamik etkileşimi anlamak, sepsis hastalarının bağışıklık durumunu doğru bir şekilde değerlendirmek ve hedefe yönelik müdahaleler tasarlamak için çok önemlidir.
Sepsiste immün hücre sayımlarını analiz etmeye yönelik geleneksel yaklaşımlar, çoklu immün parametreler arasındaki karmaşık ilişkileri yakalayamayan tek değişkenli veya iki değişkenli analizlere dayanmaktadır8. Veri görselleştirme ve makine öğrenimi tekniklerindeki son gelişmeler, yüksek boyutlu immünolojik verileri keşfetmek için yeni olanaklar yaratmıştır9. Özellikle, üç boyutlu dağılım grafiği görselleştirme ve kendi kendini organize eden özellik haritaları (SOFM)10 , çeşitli hastalık bağlamlarında gizli kalıpları ortaya çıkarmada ve farklı bağışıklık durumlarını tanımlamada umut vaat etmiştir.
Bu çalışmanın amacı, beyaz kan hücreleri, lenfositler ve nötrofiller arasındaki kantitatif ilişkileri ileri veri görselleştirme ve kümeleme teknikleri kullanarak analiz ederek sepsis hastalarında immün durumu araştırmak. Hipotez, bu bağışıklık hücresi popülasyonlarının, altta yatan bir matematiksel ilişki tarafından yönetilen üç boyutlu bir alan içinde sınırlandırıldığıdır. Çalışma, bu ilişkiyi ortaya çıkararak ve SOFM kullanarak farklı bağışıklık durumlarını tanımlayarak, sepsiste bağışıklık dinamik durumlarını anlamak ve klinik karar vermeyi kolaylaştırmak için bir çerçeve sağlamayı amaçlamaktadır.
Yaklaşım, yoğun bakım ünitesine (YBÜ) kabul edilen 512 sepsis hastasından ve 205 sağlıklı bireyden toplam 717 örnek olmak üzere kan örneklerinin toplanmasını içerir. Çalışma popülasyonu, yaşları 35 ila 100 yıl arasında değişen (ortalama yaş: 73.5 yıl) hem erkek (%54.3) hem de kadın (%45.7) katılımcıları içeriyordu. Hem sepsis hastalarında hem de sağlıklı kontrollerde beyaz kan hücreleri, lenfositler ve nötrofiller arasındaki etkileşimi tanımlayan matematiksel bir model oluşturmak için üç boyutlu dağılım grafiği görselleştirme ve sayısal uydurma uygulanır. SOFM daha sonra sepsis örnek verilerini üç boyutlu uzayda otomatik olarak kümelemek için kullanılır ve farklı bağışıklık durumları elde edilir. Çalışma, sepsis hastalarının immün profillerini ve mekansal dağılımlarını, matematiksel modelin temsil ettiği kısıt sınırı içindeki sağlıklı bireylerinkilerle karşılaştırarak, sepsisin altında yatan patofizyolojik mekanizmalar hakkında bilgi edinmeyi ve immünomodülatör tedaviler için potansiyel hedefleri belirlemeyi amaçlamaktadır.
Sepsis hastalarının bağışıklık durumunu değerlendirmek için kantitatif bir yöntem sağlayarak, yaklaşım hastalığın daha kesin evrelemesini sağlayabilir ve uygun müdahalelerin seçimine rehberlik edebilir. Ayrıca, SOFM kullanılarak farklı bağışıklık durumlarının tanımlanması, bireysel hastaların spesifik bağışıklık profillerine göre uyarlanmış kişiselleştirilmiş immünoterapi yaklaşımları üzerine gelecekteki araştırmaların temelini oluşturabilir.
Özetle, bu çalışma, gelişmiş veri görselleştirme ve makine öğrenimi tekniklerinden yararlanarak sepsiste bağışıklık durumunu anlamak için bir yaklaşım sunmaktadır. Çalışma, sepsis hastalarında anahtar immün hücre popülasyonları ile sağlıklı kontroller arasındaki matematiksel ilişkiyi ortaya çıkararak ve sepsis hastalarında farklı immün durumları tanımlayarak, sepsiste karmaşık immün dinamikler hakkında yeni bir bakış açısı sunmaktadır. Bu yaklaşım, hastalık durumunun (Farklı Kümeler) daha kesin bir şekilde değerlendirilmesini sağlar ve uygun müdahalelerin seçimine rehberlik ederek sonuçta daha etkili tanı ve tedavi stratejilerinin geliştirilmesine katkıda bulunur.
Protokol
Bu çalışma, beyaz kan hücreleri, lenfositler ve nötrofiller arasındaki ilişkileri araştırarak sepsis hastalarında bağışıklık durumunu araştırmaktadır. Hastalar, Çin'in Pekin kentindeki Dongzhimen Hastanesi'nin yoğun bakım ünitesine (YBÜ) kaydedildi ve bilgilendirilmiş onam verildikten sonra standart kan testlerine tabi tutuldu. Çalışma, kurumsal insan araştırmaları etik kurulunun yönergelerine uygun olarak yürütülmüştür. Veri gruplaması ve ayrıntılı veri içeriği Ek Tablo 1'de bulunabilir. Bu çalışmada kullanılan yazılım araçları Malzeme Tablosu'nda numaralandırılmıştır.
1. Veri toplama ve hazırlama
NOT: Beyaz kan hücreleri, nötrofiller ve lenfositler, sepsis hastalarında bağışıklık durumunun temel göstergeleri olarak seçildi. Bu seçim, lenfosit sayımlarının baskılanma ve kademeli olarak azalma eğiliminde olduğu, nötrofil sayımlarının ise sepsis hastalarında sıklıkla salındığına dair iyi bilinen klinik gözlemlere dayanmaktadır. Bu iki hücre tipi, sepsis hasta popülasyonlarında immün durumun önemli belirteçleri olarak ampirik olarak kabul edilmiştir. Bununla birlikte, bu parametreler arasındaki kesin nicel ilişki literatürde net bir şekilde bildirilmemiştir. Bu nedenle, beyaz kan hücreleri, nötrofiller ve lenfositler, sepsis hastalarında bağışıklık durumunu ölçmek için bir başlangıç noktası olarak seçildi.
- Excel Eklentisi için MATLAB Elektronik Tablo Bağlantısını Yükleme.
- Microsoft Excel'i açın ve şeritteki Ekle sekmesine gidin.
- Eklentiler bölümünde Eklentileri Al'a tıklayın.
- Office Eklentileri iletişim kutusunda, arama çubuğunda MATLAB Elektronik Tablo Bağlantısı'nı arayın.
- Arama sonuçlarında MATLAB Elektronik Tablo Bağlantısı for Excel eklentisini bulun ve Ekle düğmesine tıklayın.
- Hüküm ve koşulları okuyup kabul edin, ardından yüklemeye devam etmek için Devam'a tıklayın.
- İstenirse, eklentiye erişmek için bir MathWorks hesabıyla oturum açın veya yeni bir hesap oluşturun.
- Yükleme tamamlandıktan sonra, Excel şeridinde MATLAB Elektronik Tablo Bağlantısı sekmesi görünecektir.
- Eklentinin yüklendiğini ve kullanıma hazır olduğunu doğrulamak için MATLAB Elektronik Tablo Bağlantısı sekmesine tıklayın.
- Verileri MATLAB çalışma alanına gönderin.
- Beyaz kan hücresi sayımları, lenfosit sayımları ve nötrofil sayıları dahil olmak üzere sepsis hastası verilerini içeren elektronik tabloyu açın.
- Verilerin, her değişken (beyaz kan hücresi sayısı, lenfosit sayısı ve nötrofil sayısı) ayrı bir sütunda ve her hasta ayrı bir satırda olacak şekilde yapılandırılmış bir biçimde düzenlendiğinden emin olun.
- Beyaz kan hücresi sayımlarını, lenfosit sayımlarını ve nötrofil sayımlarını içeren hücre aralığını seçin.
- Excel şeridindeki MATLAB Elektronik Tablo Bağlantısı sekmesine tıklayın.
- MATLAB Elektronik Tablo Bağlantısı sekmesinde, Verileri MATLAB'a Gönder düğmesini tıklatın.
- Verileri MATLAB'a Gönder iletişim kutusunda, birden çok örnek çalışıyorsa açılır menüden uygun MATLAB örneğini seçin.
- Değişken adı alanındaki veriler için değişken adını belirtin. Örneğin, sepsis_immune_data.
- MATLAB'da içe aktarılan veriler için istenen veri türünü seçin (örneğin, sayısal matris).
- Verileri MATLAB çalışma alanına göndermek için Tamam'ı tıklatın.
- MATLAB uygulamasına geçin ve belirtilen değişken adı (örn. sepsis_immune_data) için çalışma alanını kontrol ederek verilerin başarıyla içe aktarıldığını doğrulayın.
- MATLAB'da verilerin kontrol edilmesi
- Sepsis hasta verilerini (beyaz kan hücresi sayımları, lenfosit sayımları ve nötrofil sayımları) MATLAB Spreadsheet Link eklentisini kullanarak MATLAB'a gönderdikten sonra MATLAB uygulamasına geçin.
- İçe aktarılan verilerin içeriğini denetlemek için, MATLAB komut penceresine değişken adını yazın ve Enter tuşuna basın.
2. Beyaz kan hücrelerinin, lenfositlerin ve nötrofillerin üç boyutlu görselleştirilmesi
- Immune_scatter3 fonksiyonunu kullanarak grafiği oluşturma
- A değişkeni, sepsis hastalarının bağışıklık verilerini depolar. Şekil 1'de gösterildiği gibi, örneklerin üç boyutlu dağılım grafiğini gösteren bir grafik kullanıcı arabirimi (GUI) elde etmek için Immune_scatter3(A) işlevini çağırın.
NOT: Üç boyutlu düzlem ile çizimdeki örnek dağılımı arasındaki montaj hatası çok küçüktür. Bölüm 3 tam formülü sağlayacaktır.
- A değişkeni, sepsis hastalarının bağışıklık verilerini depolar. Şekil 1'de gösterildiği gibi, örneklerin üç boyutlu dağılım grafiğini gösteren bir grafik kullanıcı arabirimi (GUI) elde etmek için Immune_scatter3(A) işlevini çağırın.
- GUI kullanımı
- Oluşturulan GUI tarafından sağlanan etkileşimli özellikleri kullanarak üç boyutlu dağılım grafiğini keşfedin ve analiz edin.
- Döndür: Grafiği 3B alanda döndürmek için tıklayın ve sürükleyin, bu da örnek dağılımının farklı açılardan görüntülenmesine olanak tanır.
- Kaydırma: Grafiğin görünür alanını ayarlayarak yatay veya dikey olarak hareket ettirmek için grafiği sağ tıklayın ve sürükleyin.
- Yakınlaştırma: Belirli bölgelere veya örneklere odaklanarak grafiği yakınlaştırmak veya uzaklaştırmak için fare tekerleğini veya araç çubuğundaki yakınlaştırma kontrollerini kullanın.
- Veri imleci: Beyaz kan hücreleri, lenfositler ve nötrofiller için karşılık gelen değerlerini görüntülemek için tek tek örneklere tıklayın.
NOT: Klinisyenler, bu etkileşimli özellikleri kullanarak, sepsis hastalarında beyaz kan hücreleri, lenfositler ve nötrofiller arasındaki ilişkiler ve modeller hakkında bilgi edinebilir ve bağışıklık verilerinin araştırılmasını ve analizini kolaylaştırabilir.
- Oluşturulan GUI tarafından sağlanan etkileşimli özellikleri kullanarak üç boyutlu dağılım grafiğini keşfedin ve analiz edin.
3. Formül
- MATLAB çalışma alanında, nötrofil sayısını, lenfosit sayısını ve beyaz kan hücresi sayısını sırasıyla X, Y ve Z değişkenlerine atayın.
- Kesin matematiksel ifadeyi elde etmek için (formül 1; WBC = 1.098 × nötrofil + 1.046 × lenfosit + 0.1645 (RMSE:% 1)) Şekil 1'deki üç boyutlu düzlemin aşağıdaki komutunu çağırın:
[fitresult, gof, output] = fit ([X, Y], Z, 'poly11')
NOT: Bu formül, sepsis hastalarında beyaz kan hücreleri, nötrofiller ve lenfositler arasındaki ilişkiyi kantitatif olarak tanımlar ve bağışıklık verilerinin kısa ve doğru bir temsilini sağlar. - Uyumun iyiliğini değerlendirmek için, aşağıdaki komutu kullanarak normalleştirilmiş ortalama karekök hatasını (NRMSE) hesaplayın:
gof.rmse / (maks(Z) - min(Z))
NOT: Elde edilen %1'lik NRMSE değeri, takılan düzlemin (formül 1) üç boyutlu uzayda gerçek numune dağılımına çok yakın olduğunu gösterir. Bu düşük hata seviyesi, sepsis hastalarında immün parametreler arasındaki karmaşık ilişkileri yakalamada elde edilen matematiksel ifadenin güvenilirliğini ve geçerliliğini vurgulamaktadır.
4. Sepsiste bağışıklık durumu
NOT: Sepsis hastalarında immün durumları belirlemek için denetimsiz kümeleme için Kendi Kendini Organize Eden Özellik Haritaları (SOFM) kullanılmıştır.
- Immune_Condition fonksiyonunu çağırarak, Şekil 2'de gösterildiği gibi, formül 1 ile temsil edilen üç boyutlu düzlem üzerinde örnek nokta kümeleri oluşturun.
- Adım 2.2'de açıklandığı gibi Şekil 2 için etkileşimli görselleştirme özelliklerini kullanın.
NOT: Şekil 2'de , SOFM'nin denetimsiz makine öğrenimi yaklaşımından türetilen, Cluster1 ile Cluster9 arasında etiketlenmiş dokuz otomatik küme gösterilmektedir. Bu kümeleme tekniği, hem mekansal topolojiyi hem de örneklerin yoğunluğunu hesaba katarak, sepsis hasta popülasyonu içindeki farklı bağışıklık koşullarının tanımlanmasını sağlar.
5. Sepsiste tipik immün salınım yörüngeleri
- Şekil 2'ye dayanarak, şekli üst üste bindirilebilir bir durumda tutmak için hold on komutunu kullanın, ardından tipik hastanın yörünge verilerinin üç boyutlu bir grafiğini oluşturmak için aşağıdaki komutları kullanın.
Bekleyin
I=1 için: Boyut(P,1)-1
duraklama (3); plot3(p (i: i+1,2), p (i: i+1,3), p (i: i+1,1),'k','Çizgi genişliği',3);
son
Sonuçlar
Sepsisin ilerlemesi, insan bağışıklık sistemi ile istilacı patojenler arasında karmaşık bir etkileşimi içerir. Klinik tanı ve tedavide, enfeksiyon göstergeleri, organ fonksiyon belirteçleri, sitokinler, mikrobiyal tespit ve hatta bağırsak mikrobiyomuna çok dikkat edilir. Bununla birlikte, bu çalışma üç yaygın bağışıklık göstergesinin önemini vurgulamaktadır: beyaz kan hücreleri, nötrofiller ve lenfositler, temelsiz değildir. Araştırmalar, sepsisin patolojik sürecine lenfosit popülasyonlarının baskılanması ve tükenmesinin eşlik ettiğini, nötrofil seviyelerinin ise tekrarlanan dalgalanmalardan sonra ya tükendiğini ya da patojenlerin üstesinden geldiğini göstermiştir5. Bununla birlikte, bu sürecin altında yatan matematiksel kısıtlamalar ve dinamikler daha fazla nicelikleştirilmeyi ve açıklığa kavuşturulmayı beklemektedir.
Üç boyutlu uzayda 512 numunenin (mavi noktalarla temsil edilir) ve 205 sağlıklı kontrolün (yeşil artı işaretleriyle temsil edilir) dağılımını araştırırken (Şekil 1), beyaz kan hücrelerinin, nötrofillerin ve lenfositlerin numune noktalarının çok küçük bir hata ile bir düzlemde yer aldığı kolayca anlaşılır. Dağılım grafiğinde kullanılan farklı renkler ve işaretler, kısıt sınırı içinde sepsis ve sağlıklı kontrol grupları arasındaki önemli farklılıkları açıkça göstermektedir. Bu gözlem, bu bağışıklık hücresi popülasyonlarının, sağlık durumundan bağımsız olarak nesnel bir yasayı veya kısıtlamayı takip ettiğini göstermektedir. Daha fazla analiz aşağıdaki formülü ortaya çıkarır: WBC = 1.098 × Nötrofiller + 1.046 × Lenfositler + 0.1645 (formül 1), kök ortalama kare hatası (RMSE)% 1'dir. Bu denklem, nötrofillerin düzlem eğiminin lenfositlerinkinden daha büyük olduğunu gösterir, bu da nötrofil sayımlarındaki değişikliklerin, lenfosit sayımlarındaki değişikliklere kıyasla beyaz kan hücresi sayıları üzerinde daha belirgin bir etkiye sahip olduğunu ima eder. Basit olmasına rağmen, bu formül, bireysel varyasyonlarından bağımsız olarak, beyaz kan hücreleri, nötrofiller ve lenfositler arasındaki etkileşimi yöneten nesnel olarak var olan bir mekanizmayı veya kısıtlamayı ortaya çıkaran yeni bir bulguyu temsil eder. Daha da önemlisi, bu kısıtlama sınırı hem sepsis hastaları hem de sağlıklı bireyler için geçerlidir, bu da bağışıklık sisteminin temel bir özelliğini yansıttığını düşündürürken, bu sınır içindeki farklı mekansal dağılımlar sepsis ve sağlık arasındaki immünolojik farklılıkları ortaya koymaktadır.
Farklı bağışıklık koşullarını daha da ayırt etmek için, Şekil 2 , otomatik numune noktası kümelemesi için SOFM'yi kullanır. SOFM, bu analiz için özel olarak seçilmiştir, çünkü hem numuneler arasındaki mesafeyi hem de yoğunluk dağılımlarını göz önünde bulundururken topolojik ilişkileri korumada mükemmel olan, iyi kurulmuş, denetimsiz bir kümeleme algoritmasıdır. Algoritmanın komşuluk kontrol parametresi 1 olarak ayarlandı ve net sınır tanımlarını korurken bitişik kümeler arasında minimum örtüşme sağlandı. Dokuz kategorinin seçimi, dikkatli parametre optimizasyonu yoluyla belirlendi ve ayrıntılı durum alt bölümlerine olan ihtiyacı klinik olarak anlamlı ayrımların korunmasının pratik düşüncesiyle dengelendi. Bu yaklaşım, hem ince taneli bağışıklık durumu ayrımcılığına hem de biyolojik olarak uygun olduğunda bitişik durumları birleştirme potansiyeline izin verir, böylece hem aşırı segmentasyondan hem de durum ihmallerinden kaçınır.
Şekil 2'de, bağışıklık manzarasının kapsamlı bir karakterizasyonunu sağlamak ve herhangi bir önemli kategoriyi gözden kaçırma riskini en aza indirmek amacıyla, sepsis hastaları arasında farklı bağışıklık durumlarını otomatik olarak tanımlamak için SOFM kümelemesi kullanılmıştır. Küme 1, Küme2 ve Küme 4, hem lenfositlerin hem de nötrofillerin nispeten yüksek sayıları ile karakterize edilen daha yüksek bağışıklık aktivitesi seviyelerini temsil eder. Küme 3, Küme 5, Küme6 ve Küme9, lenfosit popülasyonlarının zaten baskılanmışken, nötrofil seviyelerinin dalgalanabileceği immün salınım dönemini gösterir. Küme 8, enfeksiyonun çözülmesini takiben immünosupresyon veya bir immün iyileşme dönemini yansıtabilen azalmış bir immün aktivite durumunu temsil eder. Küme7 muhtemelen yavaş yavaş iyileşen ve bağışıklık durumlarında iyileşme belirtileri gösteren hastaların küçük bir bölümünü temsil etmektedir.
Çoklu SOFM kümelerinin kullanılmasının, sepsis hastalarında gözlenen çeşitli bağışıklık durumlarının daha ayrıntılı bir temsiline izin verdiğini belirtmekte fayda var. Bu yaklaşım, bağışıklık profillerinin tüm spektrumunu yakalamayı ve herhangi bir kritik kategoriyi kaçırma olasılığını en aza indirmeyi amaçlar. Bununla birlikte, pratik doğrulama ve daha fazla analiz yoluyla, benzer bağışıklık durumlarını temsil eden kümeleri birleştirmek, kapsamlılığını korurken sınıflandırma şemasını düzene sokmak mümkündür. Bu arıtma işlemi, tanımlanan bağışıklık durumlarının hem biyolojik olarak anlamlı hem de klinik olarak anlamlı olmasını sağlar ve sepsiste karmaşık bağışıklık dinamiklerini anlamak için sağlam bir çerçeve sağlar.
Şekil 3, sonuçta iyileşmeden önce karmaşık bir bağışıklık düzensizliği seyri yaşayan tipik bir sepsis hastasının bağışıklık durumlarının yörüngesini göstermektedir. Hastanın yolculuğu, yüksek bağışıklık aktivitesi durumunu temsil eden Küme 2'de başladı ve daha sonra Küme 5, 7, 9 ve 8 dahil olmak üzere çeşitli bağışıklık durumlarında ilerledi. Bu geçişler, hastanın bağışıklık sistemi ile istilacı patojenler arasındaki dinamik etkileşimi, salınım dönemleri ve belirgin immünosupresyon dönemleri ile yansıtır.
Özellikle, hastanın sıralı organ yetmezliği değerlendirmesi (SOFA) skoru, hasta Küme 7'ye girmeden önce başlangıç değeri 7'den 2'ye düşerek iyileşmeye başlamıştı. Bu, hastanın bağışıklık sisteminin enfeksiyonu temizlemede önemli ilerleme kaydettiğini ve ardından Küme 7'ye geçişin, tam bir bağışıklık yorgunluğundan ziyade bir bağışıklık iyileşme dönemini temsil edebileceğini düşündürmektedir.
Küme 8'den geçildikten sonra, hastanın bağışıklık durumu yavaş yavaş daha sağlıklı bir bağışıklık profili ile ilişkili olan Küme 7'ye doğru ilerledi. Bu iyileşme aşaması, hem nötrofil hem de lenfosit sayılarında bir artış ile karakterize edildi ve değerler sağlıklı bireylerde gözlenenlere yaklaştı.
Klinik uygulamada, hastalar genellikle Şekil 3'te gösterilen tipik kırmızı çizgiye benzer immün salınım yörüngeleri sergilerler. Yörünge, sağlıklı numunelerin merkezinden uzak olan Küme 3, 5, 6 ve 9'da salındığında, hastanın durumu kötüleşir. Hastanın yörüngesi, sağlıklı örneklerin merkezine daha yakın olan Küme 7 ve 8'e döndüğünde, durum düzelir ve hatta bazı hastalar sağlıklı duruma geri döner. Küme 1, 2 ve 4, hastalığın erken evrelerinde yaygın olarak gözlenir ve artmış bağışıklık aktivitesi ile karakterize edilir. Bu durum geçiş kalıpları, sepsiste erken tanıma ve hastalık seyri yönetimi için bağışıklık temelli bir bakış açısı sağlar. Hasta durumu yönetimi perspektifinden bakıldığında, hastalar Küme 6'ya doğru eğilim gösterdikçe durumlarının kötüleştiği, sağlıklı duruma doğru ilerlemenin ise klinik iyileşmeyi gösterdiği açıktır.
Bu protokol, sepsis hastalarında immün durumları matematiksel bir model ve kümeleme analizi yoluyla değerlendirmek için nicel bir yaklaşım sağlayarak, hem farklı immün durum görselleştirmesi yoluyla sepsisin erken tanınmasını hem de klinik karar verme ve kişiselleştirilmiş tedavi stratejilerine rehberlik edebilen immün yörünge takibi yoluyla hastalık ilerlemesinin hassas bir şekilde izlenmesini sağlar.
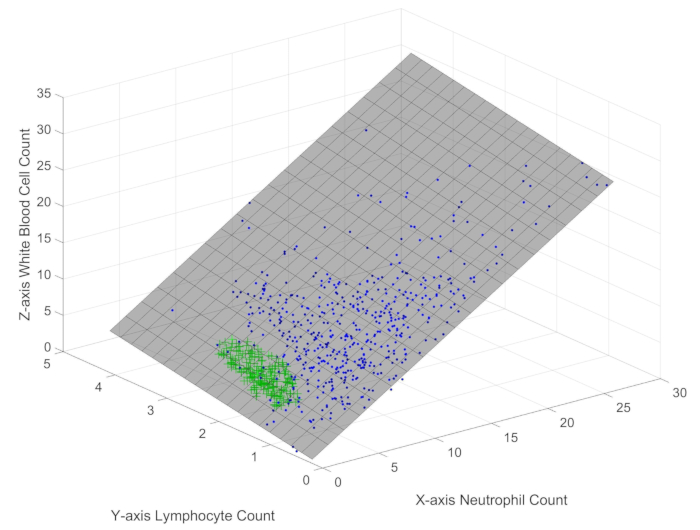
Şekil 1: Sepsis hasta örneklerinde beyaz kan hücrelerinin, lenfositlerin ve nötrofillerin üç boyutlu dağılım grafiği. Şekil, sepsis hastalarında ana bağışıklık göstergelerinin mekansal dağılımını göstermektedir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
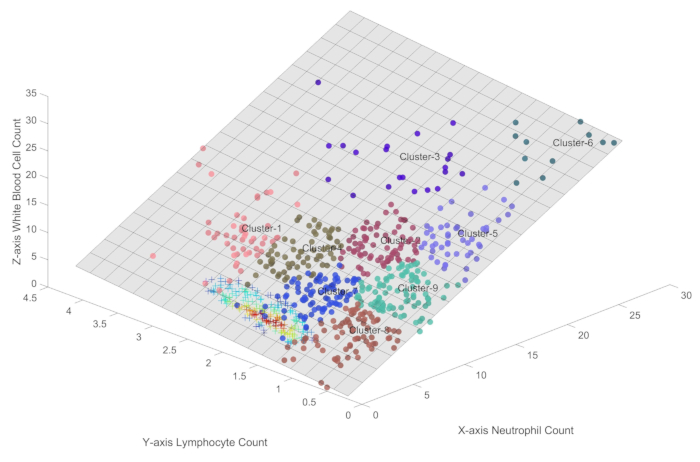
Şekil 2: Sepsiste farklı bağışıklık koşulları. Bu şekil, formül 1 ile temsil edilen üç boyutlu düzlem içinde sepsiste bağışıklık durumlarının kesin bir nicelliğini sağlar. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
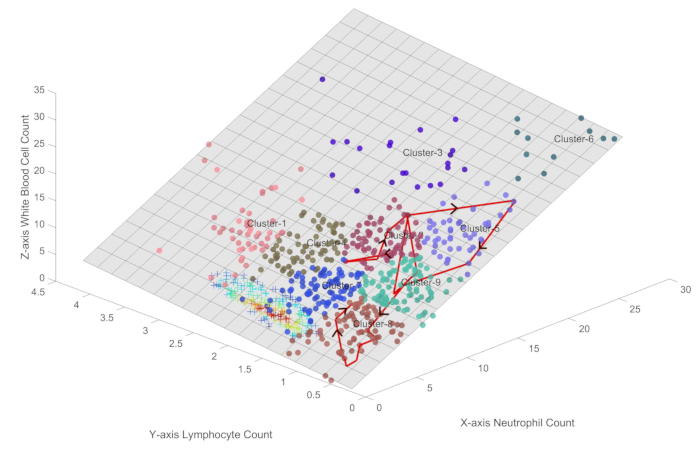
Şekil 3: Klinik iyileşme geçiren bir sepsis hastası için bağışıklık durumu yörüngesinin görselleştirilmesi. Şekil, sonuçta iyileşmeden önce karmaşık bir bağışıklık düzensizliği seyri yaşayan tipik bir sepsis hastasının bağışıklık durumlarının yörüngesini göstermektedir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Bu çalışma, gelişmiş veri görselleştirme ve makine öğrenimi tekniklerinden yararlanarak sepsiste bağışıklık durumunu anlamak için bir yaklaşım sunmaktadır. Çalışma, temel bağışıklık hücresi popülasyonları arasındaki matematiksel ilişkiyi ortaya çıkararak ve farklı bağışıklık durumlarını tanımlayarak, sepsiste karmaşık bağışıklık dinamikleri hakkında yeni bir bakış açısı sağlar ve daha etkili tanı ve tedavi stratejilerinin geliştirilmesine katkıda bulunur11,12. Anahtar bulgular arasında, bu bağışıklık hücresi popülasyonlarını üç boyutlu bir uzayda sınırlayan matematiksel bir ilişkinin keşfi (bölüm 3) (WBC = 1.098 × Nötrofil + 1.046 × Lenfositler + 0.1645) ve kendi kendini organize eden özellik haritaları (SOFM) kullanılarak dokuz farklı bağışıklık durumunun tanımlanması (bölüm 4) yer almaktadır. Bu sonuçlar, sepsis hastalarının bağışıklık durumunu değerlendirmek için kantitatif bir çerçeve sağlar ve erken sepsis hastalarını triyaj yapmak için potansiyel bir yöntem sunar13.
Burada sunulan bu araştırma, sepsiste yüksek boyutlu immünolojik verilerdeki gizli kalıpları ve ilişkileri ortaya çıkarmak için veri görselleştirme ve makine öğrenimi tekniklerini birleştirdi. Geleneksel tek değişkenli ve iki değişkenli analizlerin ötesine geçerek, bu çalışma çoklu immün parametreler arasındaki karmaşık etkileşimi yakalar ve sepsiste immün yanıtın ( Şekil 2'deki farklı kümeler) daha kapsamlı bir şekilde anlaşılmasını sağlar. SOFM10 kullanılarak farklı bağışıklık durumlarının tanımlanması, bireysel hastaların spesifik bağışıklık profillerine göre uyarlanmış kişiselleştirilmiş immünoterapi yaklaşımları üzerine gelecekteki araştırmalar için temel oluşturabilir.
Burada sunulan bulguları daha da doğrulamak ve iyileştirmek için daha büyük ve daha çeşitli kohortlarla gelecekteki çalışmalar gerekli olacaktır. Ek olarak, tanımlanan bağışıklık durumları ile prokalsitonin (PCT), C-reaktif protein (CRP) ve interlökin-6 (IL-6) gibi klinik olarak ilgili diğer biyokimyasal belirteçler arasındaki ilişki, derinlemesine araştırılmayı beklemektedir14,15. Bu belirteçlerin analize entegre edilmesi, sepsiste immün-inflamatuar yanıtın ve bunun klinik sonuçlarla ilişkisinin daha kapsamlı bir şekilde anlaşılmasını sağlayabilir ve önerilen yaklaşımın öngörücü gücünü ve klinik faydasını potansiyel olarak artırabilir. Ayrıca, bireysel hastalarda zaman içinde bağışıklık durumlarının dinamiklerini izleyen uzunlamasına çalışmalar, sepsisin gidişatı hakkında değerli bilgiler sunabilir ve kişiselleştirilmiş tedavi stratejilerini bilgilendirebilir.
Bir yandan, Şekil 1'de sunulan üç boyutlu görselleştirme yöntemi, sepsis hastalarının bağışıklık durumları ile sağlıklı kontroller arasında çarpıcı bir ayrım göstermekte ve sepsisin hızlı erken tanınması için yeni bir kantitatif immünolojik bakış açısı sağlamaktadır. Öte yandan, Şekil 3'te gösterilen tipik hasta bağışıklık yörüngelerinin tartışılması, hastalığın ilerlemesini izlemek ve yönetmek için nicel bir yöntem sunarak hasta durumu yönetimine yeni bir yaklaşım sunmaktadır.
Bu çalışmada önerilen yöntemin önemi ve potansiyel uygulamaları, sepsisin spesifik bağlamının çok ötesine uzanmaktadır. Veriye dayalı yaklaşımlar kullanarak hastalık durumlarını kesin olarak ölçme yeteneği, kişiselleştirilmiş tıp için derin etkileri olan klinik araştırmalarda bir paradigma kayması olma potansiyeline sahiptir16. Örneğin, sepsis hastalarının bağışıklık durumlarını izlemek, hastanın enfeksiyona karşı savaşının aşamalarının net bir değerlendirmesini sağlayabilir, bu da prognozu değerlendirmek ve tedavi planlarını iyileştirmek için çok önemlidir. Araştırmacılar, veri görselleştirme ve makine öğreniminin gücünden yararlanarak, karmaşık hastalıkların patofizyolojisine ilişkin yeni içgörüleri ortaya çıkarabilir ve daha hedefli tanı ve tedavi stratejileri geliştirebilir17.
Bu çalışmanın bulguları üzerine inşa etmek için, gelecekteki birkaç yön öngörülebilir. İlk olarak, sepsis hasta popülasyonunun örneklem büyüklüğünü ve çeşitliliğini arttırmak, burada tanımlanan matematiksel ilişkiyi ve bağışıklık durumlarını doğrulamak ve iyileştirmek için çok önemli olacaktır. Bu, birden fazla merkez arasında işbirliği ve veri toplama ve analizi için standartlaştırılmış protokollerin oluşturulmasını gerektirecektir. İkincisi, tanımlanan bağışıklık durumları ile PCT, CRP ve IL-6 gibi diğer biyokimyasal belirteçler arasındaki ilişkiyi araştırmak, sepsis18'deki immün-inflamatuar yanıtın daha kapsamlı bir şekilde anlaşılmasını sağlayabilir. Ek olarak, bağışıklık durumları, organ disfonksiyonu (SOFA skorları ile ölçüldüğü gibi) ve enfeksiyon şiddeti belirteçleri arasındaki karmaşık, doğrusal olmayan ilişkilerin araştırılması, farklı hastaların enfeksiyondan organ yetmezliğine ilerlediği değişen yolların aydınlatılmasına yardımcı olabilir. Bu enfeksiyon şiddeti göstergelerini bağışıklık durumu niceleme yaklaşımımızla entegre ederek, gelecekteki araştırmalar hastalık ilerleme kalıplarına ilişkin anlayışımızı geliştirebilir ve potansiyel olarak bireysel hastaların hem enfeksiyon şiddetini hem de bağışıklık durumunu dikkate alan daha kesin ve kişiselleştirilmiş tedavi stratejilerine yol açabilir. Son olarak, bu çalışmada önerilen araştırma yaklaşımı, hastalık durumlarının kesin olarak ölçülmesinin önemli klinik etkilere sahip olabileceği otoimmün hastalıklar, kanser ve transplantasyon gibi diğer tıbbi senaryolara genişletilebilir.
Sonuç olarak, bu çalışma, gelişmiş veri görselleştirme ve makine öğrenimi tekniklerinden yararlanarak sepsiste bağışıklık durumunu anlamak için bir yaklaşım sunmaktadır. Bu çalışma, temel bağışıklık hücresi popülasyonları arasındaki matematiksel ilişkiyi ortaya çıkararak ve farklı bağışıklık durumlarını tanımlayarak, sepsiste karmaşık bağışıklık durumuna yeni bir bakış açısı sunmaktadır. Örneklem büyüklüğü ve bağışıklık durumları ile diğer biyokimyasal belirteçler arasındaki ilişkinin daha fazla araştırılması ihtiyacı gibi çalışmanın sınırlamaları gelecekteki araştırmalarda ele alınmalıdır. Yöntemin kişiselleştirilmiş tıp gibi belirli araştırma alanlarındaki potansiyel uygulamaları ve örneklem büyüklüğünün artırılması ve yaklaşımın diğer tıbbi senaryolara genişletilmesi de dahil olmak üzere gelecekteki yönelimler, bu araştırma hattının önemini ve vaadini vurgulamaktadır.
Açıklamalar
Bağışıklık Durumları için Olasılıksal Dağılım Grafikleri V1.0 yazılım aracı, Beijing Intelligent Entropy Science & Technology Co., Ltd. tarafından geliştirilmiş ve sahip olunmuştur. Bu yazılımın tüm fikri mülkiyet hakları şirkete aittir. Yazarlar herhangi bir çıkar çatışması beyan etmemektedir.
Teşekkürler
Bu çalışma iki kaynaktan destek aldı: Çin Geleneksel Çin Tıbbı Ulusal İdaresi tarafından düzenlenen Usta-Çırak Miras Projesi'nin yedinci partisi (Proje numarası: [2021] No. 272) ve Shaanxi Geleneksel Çin Tıbbı İl İdaresi'nden Belediye Düzeyinde Çin Tıbbı Hastanesi'nin 2024 Çin Tıbbı Araştırma Kapasitesini Geliştirme Projesi (SZY-NLTL-2024-003).
Malzemeler
| Name | Company | Catalog Number | Comments |
| MATLAB | MathWorks | 2022B | Computing and visualization |
| Probabilistic Scatter Plots for Immune States | Intelligent Entropy | Immune States V1.0 | Beijing Intelligent Entropy Science & Technology Co Ltd. Modeling for CT/MRI fusion |
Referanslar
- Jarczak, D., Kluge, S., Nierhaus, A. Sepsis-pathophysiology and therapeutic concepts. Front Med (Lausanne). 8, 628302 (2021).
- Cheung, G. Y. C., Bae, J. S., Otto, M. Pathogenicity and virulence of Staphylococcus aureus. Virulence. 12 (1), 547-569 (2021).
- Adelman, M. W., et al. The gut microbiome's role in the development, maintenance, and outcomes of sepsis. Crit Care. 24 (1), 278 (2020).
- Kumar, V. Pulmonary innate immune response determines the outcome of inflammation during pneumonia and sepsis-associated acute lung injury. Front Immunol. 11, 1722 (2020).
- Nakamori, Y., Park, E. J., Shimaoka, M. Immune deregulation in sepsis and septic shock: Reversing immune paralysis by targeting PD-1/PD-L1 pathway. Front Immunol. 11, 624279 (2021).
- Van der Poll, T., Shankar-Hari, M., Wiersinga, W. J. The immunology of sepsis. Immunity. 54 (11), 2450-2464 (2021).
- Chaturvedi, V., et al. T-cell activation profiles distinguish hemophagocytic lymphohistiocytosis and early sepsis. Blood. 137 (17), 2337-2346 (2021).
- Reyes, M., et al. An immune-cell signature of bacterial sepsis. Nat Med. 26 (3), 333-340 (2020).
- Pant, A., Mackraj, I., Govender, T. Advances in sepsis diagnosis and management: a paradigm shift towards nanotechnology. J Biomed Sci. 28 (1), 6 (2021).
- Kohonen, T. Essentials of the self-organizing map. Neural Netw. 37, 52-65 (2013).
- Yang, X., et al. The role of type 1 interferons in coagulation induced by gram-negative bacteria. Blood. 135 (14), 1087-1100 (2020).
- Zhang, Y. Y., Ning, B. T. Signaling pathways and intervention therapies in sepsis. Signal Transduct Target Ther. 6 (1), 407 (2021).
- Baghela, A., et al. Predicting sepsis severity at first clinical presentation: The role of endotypes and mechanistic signatures. EBioMedicine. 75, 103776 (2022).
- Yao, R. Q., et al. Publication trends of research on sepsis and host immune response during 1999-2019: A 20-year bibliometric analysis. Int J Biol Sci. 16 (1), 27-37 (2020).
- Owen, A. M., et al. TLR agonists as mediators of trained immunity: Mechanistic insight and immunotherapeutic potential to combat infection. Front Immunol. 11, 622614 (2021).
- Jung, E., et al. The fetal inflammatory response syndrome: the origins of a concept, pathophysiology, diagnosis, and obstetrical implications. Semin Fetal Neonatal Med. 25 (4), 101146 (2020).
- Bruno, M., et al. Transcriptional and functional insights into the host immune response against the emerging fungal pathogen Candida auris. Nat Microbiol. 5 (12), 1516-1531 (2020).
- Barichello, T., et al. Biomarkers for sepsis: more than just fever and leukocytosis-a narrative review. Crit Care. 26 (1), 14 (2022).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır