Method Article
Основанный на данных подход к количественной оценке иммунных состояний при сепсисе
В этой статье
Резюме
В этом исследовании изучается иммунное состояние при сепсисе путем анализа количественных отношений между лейкоцитами, лимфоцитами и нейтрофилами у пациентов с сепсисом и здоровых контрольных групп с использованием анализа визуализации данных и трехмерной численной аппроксимации для создания математической модели.
Аннотация
При сепсисе понимание взаимодействия между лейкоцитами, лимфоцитами и нейтрофилами имеет решающее значение для оценки иммунного состояния и оптимизации стратегий лечения. Образцы крови были собраны у 512 пациентов с диагнозом сепсис и у 205 здоровых людей из контрольной группы, всего 717 образцов. Анализ визуализации данных и трехмерная численная аппроксимация были выполнены для создания математической модели, описывающей взаимоотношения между лейкоцитами, лимфоцитами и нейтрофилами. Самоорганизующаяся карта признаков (SOFM) была использована для автоматической кластеризации данных образца сепсиса в трехмерном пространстве, представленном моделью, что привело к различным иммунным состояниям.
Анализ показал, что количество лейкоцитов, лимфоцитов и нейтрофилов ограничено в трехмерной плоскости, как описано уравнением: WBC = 1,098 × нейтрофилов + 1,046 × лимфоцитов + 0,1645, что дает ошибку прогнозирования (RMSE) 1%. Это уравнение универсально применимо ко всем выборкам, несмотря на различия в их пространственном распределении. Кластеризация SOFM выявила девять различных иммунных состояний в популяции пациентов с сепсисом, представляющих различные уровни иммунного статуса, периоды колебаний и стадии восстановления.
Предложенная математическая модель, представленная приведенным выше уравнением, показывает базовую границу ограничения популяций иммунных клеток как у пациентов с сепсисом, так и у здоровых людей из контрольной группы. Кроме того, кластерный подход SOFM обеспечивает всесторонний обзор различных иммунных состояний, наблюдаемых в пределах этой границы ограничения у пациентов с сепсисом. Это исследование закладывает основу для будущей работы по количественной оценке и категоризации иммунного состояния при сепсисе, что в конечном итоге может способствовать разработке более объективных стратегий диагностики и лечения.
Введение
Сепсис, опасная для жизни дисфункция органов, вызванная нерегулируемой реакцией хозяина на инфекцию, остается серьезной проблемой в реанимации и интенсивной терапии1. Несмотря на успехи в понимании патофизиологии сепсиса, сложное взаимодействие между иммунной системой и патогенами продолжает создавать трудностив диагностике и эффективном лечении этого состояния. Современные клинические подходы часто сосредоточены на мониторинге показателей инфекции, функции органов, цитокинов, обнаружения микроорганизмов и микробиома кишечника3. Тем не менее, растет признание решающей роли, которую играют иммунные клетки, особенно белые кровяные тельца, лимфоциты и нейтрофилы, в прогрессировании и разрешении сепсиса4.
Во время сепсиса иммунная система претерпевает сложный ряд изменений, характеризующихся начальной гипервоспалительной фазой, за которой следует длительная иммуносупрессивная фаза5. Ранняя фаза характеризуется всплеском количества нейтрофилов и сопутствующим снижением популяций лимфоцитов, что отражает активацию врожденных иммунных реакций и подавление адаптивного иммунитета. По мере прогрессирования состояния уровни нейтрофилов могут колебаться или истощаться, в то время как количество лимфоцитов продолжает снижаться, что приводит к состоянию иммуносупрессии, которое делает пациентов уязвимыми к вторичным инфекциям7. Понимание динамического взаимодействия между этими популяциями иммунных клеток имеет решающее значение для точной оценки иммунного статуса пациентов с сепсисом и разработки целенаправленных вмешательств.
Традиционные подходы к анализу количества иммунных клеток при сепсисе основывались на одномерном или двумерном анализе, который не смог охватить сложные взаимосвязи между несколькими иммунными параметрами8. Последние достижения в области визуализации данных и методов машинного обучения открыли новые возможности для изучения многомерных иммунологических данных9. В частности, трехмерная визуализация диаграмм рассеяния и самоорганизующиеся карты признаков (SOFM)10 показали многообещающие результаты в выявлении скрытых закономерностей и идентификации различных иммунных состояний в различных контекстах заболевания.
Это исследование направлено на изучение иммунного состояния у пациентов с сепсисом путем анализа количественных отношений между лейкоцитами, лимфоцитами и нейтрофилами с использованием передовых методов визуализации данных и кластеризации. Гипотеза заключается в том, что эти популяции иммунных клеток ограничены трехмерным пространством, управляемым лежащими в основе математическими отношениями. Раскрывая эту взаимосвязь и определяя различные иммунные состояния с помощью SOFM, исследование стремится обеспечить основу для понимания иммунных динамических состояний при сепсисе и облегчить принятие клинических решений.
Подход включает в себя сбор образцов крови у 512 пациентов с сепсисом, госпитализированных в отделение интенсивной терапии (ОИТ), и 205 здоровых людей, всего 717 образцов. Исследуемая популяция включала как мужчин (54,3%), так и женщин (45,7%) в возрасте от 35 до 100 лет (средний возраст: 73,5 года). Трехмерная визуализация диаграммы рассеяния и численная аппроксимация применяются для создания математической модели, описывающей взаимодействие между лейкоцитами, лимфоцитами и нейтрофилами как у пациентов с сепсисом, так и у здоровых людей. Затем SOFM используется для автоматической кластеризации данных образца сепсиса в трехмерном пространстве, получая различные иммунные состояния. Сравнивая иммунные профили и пространственное распределение пациентов с сепсисом с таковыми у здоровых людей в пределах предельной границы, представленной математической моделью, исследование направлено на получение представления о патофизиологических механизмах, лежащих в основе сепсиса, и определение потенциальных мишеней для иммуномодулирующей терапии.
Предоставляя количественный метод оценки иммунного состояния пациентов с сепсисом, этот подход может позволить более точно определить стадию заболевания и помочь в выборе соответствующих вмешательств. Кроме того, идентификация различных иммунных состояний с помощью SOFM может заложить основу для будущих исследований персонализированных подходов к иммунотерапии, адаптированных к конкретным иммунным профилям отдельных пациентов.
Таким образом, в этом исследовании представлен подход к пониманию иммунного состояния при сепсисе с использованием передовых методов визуализации данных и машинного обучения. Раскрывая математическую взаимосвязь между ключевыми популяциями иммунных клеток у пациентов с сепсисом и здоровыми контрольными группами, а также выявляя различные иммунные состояния у пациентов с сепсисом, исследование дает новый взгляд на сложную иммунную динамику при сепсисе. Этот подход позволяет более точно оценить состояние заболевания (различные кластеры) и может помочь в выборе соответствующих вмешательств, что в конечном итоге способствует разработке более эффективных диагностических и терапевтических стратегий.
протокол
В этом исследовании изучается иммунное состояние у пациентов с сепсисом путем изучения взаимоотношений между лейкоцитами, лимфоцитами и нейтрофилами. Пациенты были зачислены в отделение интенсивной терапии (ОИТ) больницы Дунчжимэнь в Пекине, Китай, и сдали стандартные анализы крови после предоставления информированного согласия. Исследование проводилось в соответствии с руководящими принципами институционального комитета по этике исследований человека. Группировка данных и подробное содержание данных приведены в дополнительной таблице 1. Программные средства, использованные в данном исследовании, перечислены в Таблице материалов.
1. Сбор и подготовка данных
Лейкоциты, нейтрофилы и лимфоциты были выбраны в качестве ключевых индикаторов иммунного состояния у пациентов с сепсисом. Этот выбор основан на хорошо установленных клинических наблюдениях о том, что количество лимфоцитов имеет тенденцию к подавлению и постепенному снижению, в то время как количество нейтрофилов часто колеблется у пациентов с сепсисом. Эти два типа клеток были эмпирически признаны важными маркерами иммунного статуса в популяциях пациентов с сепсисом. Тем не менее, точная количественная связь между этими параметрами не была четко описана в литературе. Таким образом, лейкоциты, нейтрофилы и лимфоциты были выбраны в качестве отправной точки для количественной оценки иммунного состояния у пациентов с сепсисом.
- Установка надстройки MATLAB Spreadsheet Link для Excel.
- Откройте Microsoft Excel и перейдите на вкладку «Вставка» на ленте.
- Нажмите « Получить надстройки » в разделе « Надстройки ».
- В диалоговом окне « Надстройки Office» найдите в строке поиска ссылку на электронную таблицу MATLAB .
- Найдите надстройку MATLAB Spreadsheet Link для Excel в результатах поиска и нажмите кнопку « Добавить ».
- Прочтите и примите условия и положения, затем нажмите «Продолжить », чтобы продолжить установку.
- При появлении запроса войдите в систему с учетной записью MathWorks или создайте новую учетную запись для доступа к надстройке.
- После завершения установки на ленте Excel появится вкладка «Ссылка на таблицу MATLAB ».
- Перейдите на вкладку «Ссылка на электронную таблицу MATLAB », чтобы убедиться, что надстройка установлена и готова к использованию.
- Отправка данных в рабочее пространство MATLAB.
- Откройте таблицу, содержащую данные пациента с сепсисом, включая количество лейкоцитов, лимфоцитов и нейтрофилов.
- Убедитесь, что данные организованы в структурированном формате, где каждая переменная (количество лейкоцитов, лимфоцитов и нейтрофилов) находится в отдельном столбце, а каждый пациент — в отдельной строке.
- Выберите диапазон клеток, содержащих количество лейкоцитов, лимфоцитов и нейтрофилов.
- Перейдите на вкладку « Ссылка на таблицу MATLAB » на ленте Excel.
- На вкладке Ссылка на таблицу MATLAB нажмите кнопку Отправить данные в MATLAB .
- В диалоговом окне Отправить данные в MATLAB выберите соответствующий экземпляр MATLAB из раскрывающегося меню, если запущено несколько экземпляров.
- Укажите имя переменной для данных в поле Имя переменной . Например, sepsis_immune_data.
- Выберите нужный тип данных для импортируемых данных в MATLAB (например, числовая матрица).
- Нажмите OK , чтобы отправить данные в рабочую область MATLAB.
- Переключитесь на приложение MATLAB и убедитесь, что данные были успешно импортированы, проверив рабочее пространство на наличие указанного имени переменной (например, sepsis_immune_data).
- Проверка данных в MATLAB
- После отправки данных пациента с сепсисом (количество лейкоцитов, лимфоцитов и нейтрофилов) в MATLAB с помощью надстройки MATLAB Spreadsheet Link переключитесь на приложение MATLAB.
- Чтобы проверить содержимое импортируемых данных, введите имя переменной в командном окне MATLAB и нажмите клавишу Enter.
2. Трехмерная визуализация лейкоцитов, лимфоцитов и нейтрофилов
- Построение графика с помощью функции Immune_scatter3
- Переменная A хранит иммунные данные пациентов с сепсисом. Вызовите функцию Immune_scatter3(A) для получения графического интерфейса пользователя (GUI), отображающего трехмерную диаграмму рассеяния образцов, как показано на рисунке 1.
ПРИМЕЧАНИЕ: Ошибка подгонки между трехмерной плоскостью и распределением образцов на графике очень мала. В разделе 3 будет приведена точная формула.
- Переменная A хранит иммунные данные пациентов с сепсисом. Вызовите функцию Immune_scatter3(A) для получения графического интерфейса пользователя (GUI), отображающего трехмерную диаграмму рассеяния образцов, как показано на рисунке 1.
- Использование графического интерфейса пользователя
- Исследуйте и анализируйте трехмерную точечную диаграмму с помощью интерактивных функций, предоставляемых созданным графическим интерфейсом.
- Поворот: Щелкните и перетащите график, чтобы повернуть его в 3D-пространстве, что позволит рассмотреть распределение образцов под разными углами.
- Панорамирование: щелкните правой кнопкой мыши и перетащите график, чтобы переместить его по горизонтали или вертикали, регулируя видимую область графика.
- Масштабирование: используйте колесико мыши или элементы управления масштабированием на панели инструментов для увеличения или уменьшения масштаба графика, фокусируясь на определенных областях или образцах.
- Курсор данных: Нажмите на отдельные образцы, чтобы отобразить их соответствующие значения для лейкоцитов, лимфоцитов и нейтрофилов.
ПРИМЕЧАНИЕ: Используя эти интерактивные функции, клиницисты могут получить представление о взаимосвязи и закономерностях между лейкоцитами, лимфоцитами и нейтрофилами у пациентов с сепсисом, облегчая изучение и анализ иммунных данных.
- Исследуйте и анализируйте трехмерную точечную диаграмму с помощью интерактивных функций, предоставляемых созданным графическим интерфейсом.
3. Формула
- В рабочем пространстве MATLAB назначьте количество нейтрофилов, количество лимфоцитов и количество лейкоцитов переменным X, Y и Z соответственно.
- Для получения точного математического выражения (формула 1; WBC = 1,098 × нейтрофилов + 1,046 × лимфоцитов + 0,1645 (RMSE: 1%)) трехмерной плоскости на рисунке 1 вызовите следующую команду:
[fitresult, gof, output] = fit ([X, Y], Z, 'poly11')
Примечание: Эта формула количественно описывает взаимосвязь между лейкоцитами, нейтрофилами и лимфоцитами у пациентов с сепсисом, обеспечивая краткое и точное представление иммунных данных. - Чтобы оценить правильность аппроксимации, вычислите нормализованную среднеквадратическую ошибку (NRMSE) с помощью следующей команды:
gof.rmse / (max(Z) - min(Z))
ПРИМЕЧАНИЕ: Результирующее значение NRMSE 1% указывает на то, что подогнанная плоскость (формула 1) близко аппроксимируется к фактическому распределению образцов в трехмерном пространстве. Этот низкий уровень погрешностей подчеркивает надежность и валидность полученного математического выражения для выявления сложных взаимосвязей между иммунными параметрами у пациентов с сепсисом.
4. Иммунное состояние при сепсисе
ПРИМЕЧАНИЕ: Самоорганизующиеся карты признаков (SOFM) были использованы для неконтролируемой кластеризации с целью выявления иммунных состояний у пациентов с сепсисом.
- Вызывая функцию Immune_Condition , сгенерируйте кластеры опорных точек на трехмерной плоскости, представленной формулой 1, как показано на рисунке 2.
- Используйте функции интерактивной визуализации, показанные на рисунке 2 , как описано в шаге 2.2.
ПРИМЕЧАНИЕ: На рисунке 2 показаны девять автоматизированных кластеров, обозначенных как Cluster1 - Cluster9, полученных на основе неконтролируемого подхода машинного обучения SOFM. Этот метод кластеризации учитывает как пространственную топологию, так и плотность образцов, что позволяет идентифицировать различные иммунные условия в популяции пациентов с сепсисом.
5. Типичные траектории иммунных колебаний при сепсисе
- Как показано на рисунке 2, используйте команду hold on , чтобы сохранить рисунок в накладываемом состоянии, а затем используйте следующие команды для создания трехмерного графика типичных данных траектории пациента.
Подождать
для i=1: размер(p,1)-1
пауза (3); plot3(p (i: i+1,2), p (i: i+1,3), p (i: i+1,1),'k','Linewidth',3);
конец
Результаты
Прогрессирование сепсиса включает в себя сложное взаимодействие между иммунной системой человека и вторгшимися патогенами. В клинической диагностике и лечении большое внимание уделяется показателям инфекции, маркерам функции органов, цитокинам, обнаружению микроорганизмов и даже микробиому кишечника. Тем не менее, это исследование подчеркивает важность трех общих иммунных показателей: лейкоцитов, нейтрофилов и лимфоцитов, которые не лишены оснований. Исследования показали, что патологический процесс сепсиса сопровождается подавлением и истощением популяций лимфоцитов, при этом уровни нейтрофилов либо истощаются, либо одолевают возбудителей послеповторных колебаний5. Тем не менее, математические ограничения и динамика, лежащие в основе этого процесса, еще предстоит количественно оценить и прояснить.
При изучении распределения 512 образцов (обозначенных синими точками) и 205 здоровых образцов (обозначенных зелеными знаками плюса) в трехмерном пространстве (рис. 1) становится очевидным, что точки отбора образцов лейкоцитов, нейтрофилов и лимфоцитов лежат на плоскости с очень малой погрешностью. Отличительные цвета и маркеры, используемые на диаграмме рассеяния, ясно демонстрируют значительные различия между контрольной группой сепсиса и здоровой группой в пределах границы ограничения. Это наблюдение позволяет предположить, что эти популяции иммунных клеток подчиняются объективному закону или ограничению, независимо от состояния здоровья. Дальнейший анализ показывает следующую формулу: лейкоциты = 1,098 × нейтрофилы + 1,046 × лимфоциты + 0,1645 (формула 1), с среднеквадратичной ошибкой (RMSE) 1%. Это уравнение указывает на то, что наклон нейтрофилов на плоскости больше, чем у лимфоцитов, что означает, что изменения в количестве нейтрофилов оказывают более выраженное влияние на количество лейкоцитов по сравнению с изменениями в количестве лимфоцитов. Несмотря на свою простоту, эта формула представляет собой новое открытие, которое раскрывает объективно существующий механизм или ограничение, управляющее взаимодействием между лейкоцитами, нейтрофилами и лимфоцитами, независимо от их индивидуальных вариаций. Важно отметить, что эта граница ограничения применима как к пациентам с сепсисом, так и к здоровым людям, предполагая, что она отражает фундаментальное свойство иммунной системы, в то время как четкое пространственное распределение в пределах этой границы раскрывает иммунологические различия между сепсисом и здоровьем.
Чтобы еще больше различить различные иммунные состояния, на рисунке 2 используется SOFM для автоматической кластеризации точек выборки. SOFM был специально выбран для этого анализа, потому что это хорошо зарекомендовавший себя алгоритм кластеризации без учителя, который отлично справляется с сохранением топологических отношений при учете как расстояния между образцами, так и их распределения плотности. Параметр управления окрестностями алгоритма был установлен в 1, что обеспечивает минимальное перекрытие между соседними кластерами при сохранении четких определений границ. Выбор девяти категорий был определен путем тщательной оптимизации параметров, уравновешивающей необходимость детального деления состояний с практическим рассмотрением сохранения клинически значимых различий. Такой подход позволяет проводить как тонкую дискриминацию иммунных состояний, так и возможность слияния смежных состояний, когда это биологически целесообразно, тем самым избегая как чрезмерной сегментации, так и пропусков состояний.
На рисунке 2 кластеризация SOFM была использована для автоматической идентификации различных иммунных состояний у пациентов с сепсисом с целью обеспечения всесторонней характеристики иммунного ландшафта и минимизации риска пропуска каких-либо важных категорий. Кластеры 1, 2 и 4 представляют более высокие уровни иммунной активности, характеризующиеся относительно высоким количеством как лимфоцитов, так и нейтрофилов. Кластеры 3, 5, 6 и 9 отображают период иммунных колебаний, в течение которого популяции лимфоцитов уже подверглись подавлению, в то время как уровни нейтрофилов могут колебаться. Кластер 8 представляет собой состояние сниженной иммунной активности, которое может отражать либо иммуносупрессию, либо период восстановления иммунитета после разрешения инфекции. Кластер 7, вероятно, представляет собой небольшую долю пациентов, которые постепенно выздоравливают и демонстрируют признаки улучшения своего иммунного статуса.
Стоит отметить, что использование нескольких кластеров SOFM позволяет более детально представить различные иммунные состояния, наблюдаемые у пациентов с сепсисом. Этот подход направлен на охват всего спектра иммунных профилей и минимизацию вероятности пропуска каких-либо критических категорий. Тем не менее, благодаря практической валидации и дальнейшему анализу можно объединить кластеры, представляющие сходные иммунные состояния, оптимизируя схему классификации при сохранении ее полноты. Этот процесс уточнения гарантирует, что идентифицированные иммунные состояния являются как биологически значимыми, так и клинически значимыми, обеспечивая надежную основу для понимания сложной иммунной динамики при сепсисе.
На рисунке 3 показана траектория иммунных состояний типичного пациента с сепсисом, который испытал сложное течение иммунной дисрегуляции, прежде чем его состояние в конечном итоге улучшилось. Путешествие пациента началось в кластере 2, который представляет состояние повышенной иммунной активности, а затем прогрессировал через различные иммунные состояния, включая кластеры 5, 7, 9 и 8. Эти переходы отражают динамическое взаимодействие между иммунной системой пациента и вторгшимися патогенами с периодами колебаний и выраженной иммуносупрессии.
Примечательно, что оценка последовательной органной недостаточности (SOFA) пациента уже начала улучшаться, снизившись с исходного значения 7 до 2 до того, как пациент попал в кластер 7. Это говорит о том, что иммунная система пациента добилась значительного прогресса в избавлении от инфекции, и последующий переход к кластеру 7 может представлять собой период восстановления иммунитета, а не полного иммунного истощения.
После прохождения через кластер 8 иммунное состояние пациента постепенно прогрессировало в сторону кластера 7, что связано с более здоровым иммунным профилем. Эта фаза восстановления характеризовалась увеличением количества нейтрофилов и лимфоцитов, при этом значения приближались к тем, которые наблюдались у здоровых людей.
В клинической практике у пациентов обычно наблюдаются траектории иммунных колебаний, аналогичные типичной красной линии, показанной на рисунке 3. Когда траектория колеблется в кластерах 3, 5, 6 и 9, которые находятся далеко от центра здоровых образцов, состояние пациента ухудшается. Когда траектория пациента возвращается к кластерам 7 и 8, которые находятся ближе к центру здоровых образцов, состояние улучшается, а некоторые пациенты даже возвращаются к здоровому статусу. Кластеры 1, 2 и 4 обычно наблюдаются на ранних стадиях заболевания, характеризуются повышенной иммунной активностью. Эти модели переходов между состояниями обеспечивают иммунную перспективу для раннего распознавания и ведения течения заболевания при сепсисе. С точки зрения управления состоянием пациента очевидно, что по мере того, как пациенты имеют тенденцию к кластеру 6, их состояние ухудшается, в то время как прогрессирование к здоровому состоянию указывает на клиническое улучшение.
Этот протокол обеспечивает количественный подход к оценке иммунных состояний у пациентов с сепсисом с помощью математической модели и кластерного анализа, что позволяет как раннее распознавание сепсиса с помощью визуализации отчетливого иммунного состояния, так и точный мониторинг прогрессирования заболевания с помощью отслеживания иммунной траектории, что может служить руководством для принятия клинических решений и персонализированных стратегий лечения.
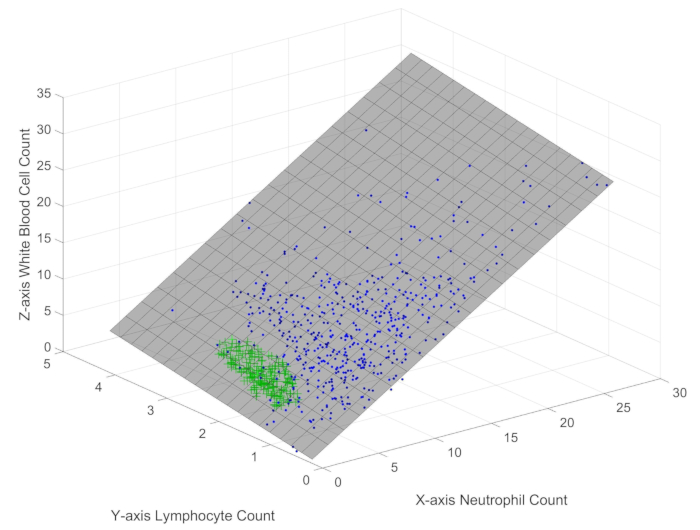
Рисунок 1: Трехмерная диаграмма рассеяния белых кровяных телец, лимфоцитов и нейтрофилов в образцах пациентов с сепсисом. На рисунке представлено пространственное распределение основных иммунных показателей у пациентов с сепсисом. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
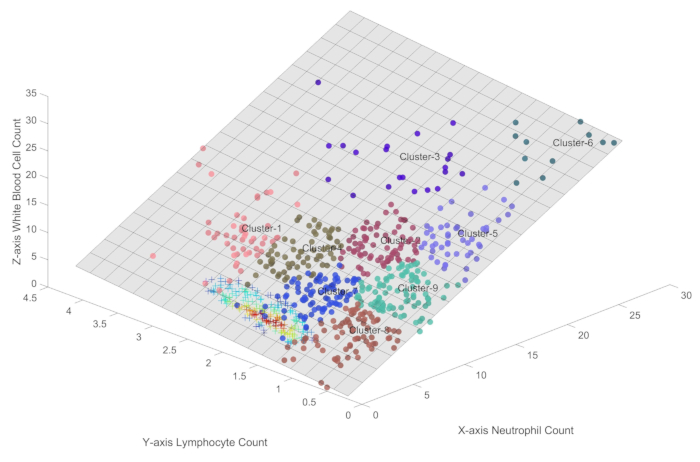
Рисунок 2: Различные иммунные состояния при сепсисе. Этот рисунок обеспечивает точную количественную оценку иммунных состояний при сепсисе в трехмерной плоскости, представленной формулой 1. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
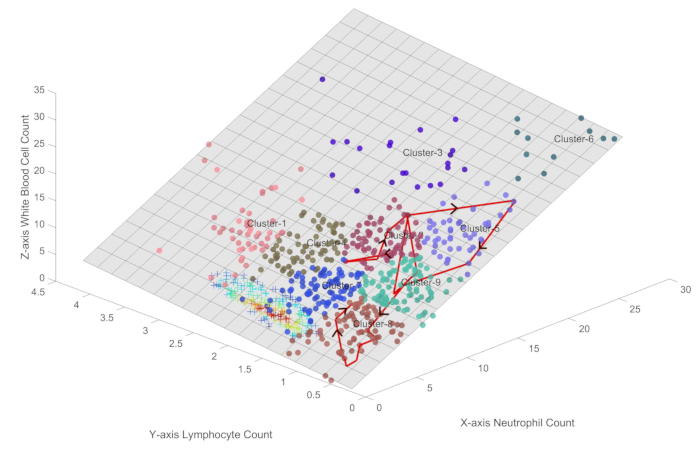
Рисунок 3: Визуализация траектории иммунного состояния пациента с сепсисом, проходящего клиническое улучшение. На рисунке показана траектория иммунных состояний типичного пациента с сепсисом, который испытал сложный ход иммунной дисрегуляции, прежде чем его состояние в конечном итоге улучшилось. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Обсуждение
В этом исследовании представлен подход к пониманию иммунного состояния при сепсисе с использованием передовых методов визуализации данных и машинного обучения. Раскрывая математическую взаимосвязь между ключевыми популяциями иммунных клеток и выявляя различные иммунные состояния, исследование дает новый взгляд на сложную иммунную динамику при сепсисе и способствует разработке более эффективных диагностических и терапевтическихстратегий. Основные результаты включают в себя открытие математической зависимости (раздел 3), ограничивающей эти популяции иммунных клеток в трехмерном пространстве (WBC = 1,098 × нейтрофилов + 1,046 × лимфоцитов + 0,1645) и идентификацию девяти различных иммунных состояний (раздел 4) с использованием карт самоорганизующихся признаков (SOFM). Эти результаты обеспечивают количественную основу для оценки иммунного статуса пациентов с сепсисом и предлагают потенциальный метод сортировки пациентов с ранним сепсисом13.
Это исследование, представленное здесь, сочетает в себе методы визуализации данных и машинного обучения для выявления скрытых закономерностей и взаимосвязей в многомерных иммунологических данных при сепсисе. Выходя за рамки традиционного одномерного и двумерного анализа, это исследование охватывает сложное взаимодействие между несколькими иммунными параметрами и обеспечивает более полное понимание иммунного ответа (различные кластеры на рисунке 2) при сепсисе. Идентификация различных иммунных состояний с помощью SOFM10 может заложить основу для будущих исследований персонализированных подходов к иммунотерапии, адаптированных к конкретным иммунным профилям отдельных пациентов.
Будущие исследования с еще более крупными и разнообразными когортами потребуются для дальнейшей проверки и уточнения представленных здесь результатов. Кроме того, взаимосвязь между идентифицированными иммунными состояниями и другими клинически значимыми биохимическими маркерами, такими как прокальцитонин (ПКТ), С-реактивный белок (СРБ) и интерлейкин-6 (ИЛ-6), еще предстоит глубоко изучить 14,15. Интеграция этих маркеров в анализ может обеспечить более полное понимание иммуновоспалительной реакции при сепсисе и ее связи с клиническими исходами, потенциально повышая прогностическую силу и клиническую полезность предложенного подхода. Кроме того, лонгитюдные исследования, которые отслеживают динамику иммунных состояний с течением времени у отдельных пациентов, могут дать ценную информацию о траектории сепсиса и помочь в разработке персонализированных стратегий лечения.
С одной стороны, метод трехмерной визуализации, представленный на рисунке 1 , демонстрирует поразительное различие между иммунными состояниями пациентов с сепсисом и здоровыми контрольными группами, обеспечивая новую количественную иммунологическую перспективу для быстрого раннего распознавания сепсиса. С другой стороны, обсуждение типичных иммунных траекторий пациента, показанное на рисунке 3 , представляет собой новый подход к управлению состоянием пациента, предлагая количественный метод мониторинга и управления прогрессированием заболевания.
Важность и потенциальное применение метода, предложенного в этом исследовании, выходят далеко за рамки конкретного контекста сепсиса. Возможность точной количественной оценки болезненных состояний с использованием подходов, основанных на данных, может стать сменой парадигмы в клинических исследованиях с глубокими последствиями дляперсонализированной медицины. Например, отслеживание иммунных состояний пациентов с сепсисом может обеспечить четкую оценку этапов борьбы пациента с инфекцией, что имеет решающее значение для оценки прогноза и улучшения планов лечения. Используя возможности визуализации данных и машинного обучения, исследователи могут открыть для себя новые идеи в области патофизиологии сложных заболеваний и разработать более целенаправленные диагностические и терапевтические стратегии17.
Основываясь на выводах этого исследования, можно предусмотреть несколько будущих направлений. Во-первых, увеличение размера выборки и разнообразия популяции пациентов с сепсисом будет иметь решающее значение для проверки и уточнения математической взаимосвязи и выявленных здесь иммунных состояний. Это потребует сотрудничества между несколькими центрами и создания стандартизированных протоколов для сбора и анализа данных. Во-вторых, изучение взаимосвязи между идентифицированными иммунными состояниями и другими биохимическими маркерами, такими как ПКТ, СРБ и IL-6, может обеспечить более полное понимание иммуновоспалительной реакции при сепсисе18. Кроме того, исследование сложных, нелинейных взаимосвязей между иммунными состояниями, дисфункцией органов (измеряемой по шкале SOFA) и маркерами тяжести инфекции может помочь пролить свет на различные пути, по которым разные пациенты прогрессируют от инфекции к органной недостаточности. Интегрируя эти показатели тяжести инфекции с нашим подходом к количественной оценке иммунного состояния, будущие исследования могут улучшить наше понимание моделей прогрессирования заболевания, что потенциально может привести к более точным и персонализированным стратегиям лечения, учитывающим как тяжесть инфекции, так и иммунный статус отдельных пациентов. Наконец, исследовательский подход, предложенный в этом исследовании, может быть распространен на другие медицинские сценарии, такие как аутоиммунные заболевания, рак и трансплантация, где точная количественная оценка болезненных состояний может иметь значительные клинические последствия.
В заключение, в этом исследовании представлен подход к пониманию иммунного состояния при сепсисе с использованием передовых методов визуализации данных и машинного обучения. Раскрывая математическую взаимосвязь между ключевыми популяциями иммунных клеток и определяя различные иммунные состояния, это исследование дает новый взгляд на сложное иммунное состояние при сепсисе. Ограничения исследования, такие как размер выборки и необходимость дальнейшего изучения взаимосвязи между иммунными состояниями и другими биохимическими маркерами, должны быть учтены в будущих исследованиях. Потенциальное применение метода в конкретных областях исследований, таких как персонализированная медицина, и будущие направления, включая увеличение размера выборки и распространение подхода на другие медицинские сценарии, подчеркивают важность и перспективность этого направления исследований.
Раскрытие информации
Программное обеспечение для вероятностных диаграмм рассеяния для иммунных состояний V1.0 разработано и принадлежит компании Beijing Intelligent Entropy Science & Technology Co., Ltd. Все права интеллектуальной собственности на это программное обеспечение принадлежат компании. Авторы заявляют об отсутствии конфликта интересов.
Благодарности
Это исследование получило поддержку из двух источников: седьмого пакета проекта наследования мастера-ученика, организованного Национальным управлением традиционной китайской медицины Китая (номер проекта: [2021] No 272) и проекта по повышению исследовательского потенциала китайской медицины в области китайской медицины на 2024 год Больницы китайской медицины муниципального уровня (SZY-NLTL-2024-003) от Управления традиционной китайской медицины провинции Шэньси.
Материалы
| Name | Company | Catalog Number | Comments |
| MATLAB | MathWorks | 2022B | Computing and visualization |
| Probabilistic Scatter Plots for Immune States | Intelligent Entropy | Immune States V1.0 | Beijing Intelligent Entropy Science & Technology Co Ltd. Modeling for CT/MRI fusion |
Ссылки
- Jarczak, D., Kluge, S., Nierhaus, A. Sepsis-pathophysiology and therapeutic concepts. Front Med (Lausanne). 8, 628302 (2021).
- Cheung, G. Y. C., Bae, J. S., Otto, M. Pathogenicity and virulence of Staphylococcus aureus. Virulence. 12 (1), 547-569 (2021).
- Adelman, M. W., et al. The gut microbiome's role in the development, maintenance, and outcomes of sepsis. Crit Care. 24 (1), 278 (2020).
- Kumar, V. Pulmonary innate immune response determines the outcome of inflammation during pneumonia and sepsis-associated acute lung injury. Front Immunol. 11, 1722 (2020).
- Nakamori, Y., Park, E. J., Shimaoka, M. Immune deregulation in sepsis and septic shock: Reversing immune paralysis by targeting PD-1/PD-L1 pathway. Front Immunol. 11, 624279 (2021).
- Van der Poll, T., Shankar-Hari, M., Wiersinga, W. J. The immunology of sepsis. Immunity. 54 (11), 2450-2464 (2021).
- Chaturvedi, V., et al. T-cell activation profiles distinguish hemophagocytic lymphohistiocytosis and early sepsis. Blood. 137 (17), 2337-2346 (2021).
- Reyes, M., et al. An immune-cell signature of bacterial sepsis. Nat Med. 26 (3), 333-340 (2020).
- Pant, A., Mackraj, I., Govender, T. Advances in sepsis diagnosis and management: a paradigm shift towards nanotechnology. J Biomed Sci. 28 (1), 6 (2021).
- Kohonen, T. Essentials of the self-organizing map. Neural Netw. 37, 52-65 (2013).
- Yang, X., et al. The role of type 1 interferons in coagulation induced by gram-negative bacteria. Blood. 135 (14), 1087-1100 (2020).
- Zhang, Y. Y., Ning, B. T. Signaling pathways and intervention therapies in sepsis. Signal Transduct Target Ther. 6 (1), 407 (2021).
- Baghela, A., et al. Predicting sepsis severity at first clinical presentation: The role of endotypes and mechanistic signatures. EBioMedicine. 75, 103776 (2022).
- Yao, R. Q., et al. Publication trends of research on sepsis and host immune response during 1999-2019: A 20-year bibliometric analysis. Int J Biol Sci. 16 (1), 27-37 (2020).
- Owen, A. M., et al. TLR agonists as mediators of trained immunity: Mechanistic insight and immunotherapeutic potential to combat infection. Front Immunol. 11, 622614 (2021).
- Jung, E., et al. The fetal inflammatory response syndrome: the origins of a concept, pathophysiology, diagnosis, and obstetrical implications. Semin Fetal Neonatal Med. 25 (4), 101146 (2020).
- Bruno, M., et al. Transcriptional and functional insights into the host immune response against the emerging fungal pathogen Candida auris. Nat Microbiol. 5 (12), 1516-1531 (2020).
- Barichello, T., et al. Biomarkers for sepsis: more than just fever and leukocytosis-a narrative review. Crit Care. 26 (1), 14 (2022).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены