Method Article
Ein datengestützter Ansatz zur Quantifizierung von Immunzuständen bei Sepsis
In diesem Artikel
Zusammenfassung
Diese Studie untersucht den Immunzustand bei Sepsis, indem sie die quantitativen Beziehungen zwischen weißen Blutkörperchen, Lymphozyten und Neutrophilen bei Sepsis-Patienten und gesunden Kontrollpersonen unter Verwendung von Datenvisualisierungsanalysen und dreidimensionaler numerischer Anpassung analysiert, um ein mathematisches Modell zu erstellen.
Zusammenfassung
Bei der Sepsis ist das Verständnis des Zusammenspiels zwischen weißen Blutkörperchen, Lymphozyten und Neutrophilen entscheidend für die Beurteilung des Immunzustands und die Optimierung von Behandlungsstrategien. Es wurden Blutproben von 512 Patienten mit Sepsis und 205 gesunden Kontrollpersonen entnommen, insgesamt 717 Proben. Die Analyse der Datenvisualisierung und die dreidimensionale numerische Anpassung wurden durchgeführt, um ein mathematisches Modell zu erstellen, das die Beziehungen zwischen weißen Blutkörperchen, Lymphozyten und Neutrophilen beschreibt. Die selbstorganisierende Merkmalskarte (SOFM) wurde verwendet, um die Sepsis-Probendaten automatisch in dem durch das Modell dargestellten dreidimensionalen Raum zu clustern, was zu unterschiedlichen Immunzuständen führte.
Die Analyse ergab, dass die Anzahl der weißen Blutkörperchen, Lymphozyten und Neutrophilen auf eine dreidimensionale Ebene beschränkt ist, wie durch die Gleichung beschrieben: Leukozyten = 1,098 × Neutrophile + 1,046 × Lymphozyten + 0,1645, was einen Vorhersagefehler (RMSE) von 1% ergibt. Diese Gleichung ist trotz unterschiedlicher räumlicher Verteilungen universell auf alle Stichproben anwendbar. Das SOFM-Clustering identifizierte neun verschiedene Immunzustände innerhalb der Sepsis-Patientenpopulation, die unterschiedliche Niveaus des Immunstatus, der Oszillationsperioden und der Erholungsstadien repräsentieren.
Das vorgeschlagene mathematische Modell, dargestellt durch die obige Gleichung, zeigt eine grundlegende Constraint-Grenze für die Immunzellpopulationen sowohl bei Sepsis-Patienten als auch bei gesunden Kontrollen. Darüber hinaus bietet der SOFM-Clustering-Ansatz einen umfassenden Überblick über die unterschiedlichen Immunzustände, die innerhalb dieser Constraint-Grenze bei Sepsis-Patienten beobachtet werden. Diese Studie legt den Grundstein für zukünftige Arbeiten zur Quantifizierung und Kategorisierung des Immunzustands bei Sepsis, die letztendlich zur Entwicklung objektiverer Diagnose- und Behandlungsstrategien beitragen können.
Einleitung
Die Sepsis, eine lebensbedrohliche Organdysfunktion, die durch eine fehlregulierte Wirtsreaktion auf eine Infektion verursacht wird, stellt nach wie vor eine große Herausforderung in der Intensivmedizindar 1. Trotz Fortschritten im Verständnis der Pathophysiologie der Sepsis stellt das komplexe Zusammenspiel zwischen dem Immunsystem und den Krankheitserregern weiterhin Schwierigkeiten bei der Diagnose und Behandlung dieser Erkrankung dar2. Aktuelle klinische Ansätze konzentrieren sich häufig auf die Überwachung von Infektionsindikatoren, Organfunktionen, Zytokinen, mikrobiellem Nachweis und Darmmikrobiom3. Es wird jedoch zunehmend anerkannt, dass Immunzellen, insbesondere weiße Blutkörperchen, Lymphozyten und Neutrophile, eine entscheidende Rolle bei der Progression und Auflösung der Sepsis spielen4.
Im Verlauf der Sepsis durchläuft das Immunsystem eine komplexe Reihe von Veränderungen, die durch eine anfängliche hyperinflammatorische Phase gekennzeichnet sind, gefolgt von einer verlängerten immunsuppressiven Phase5. Die frühe Phase ist gekennzeichnet durch einen Anstieg der Neutrophilenzahlen und eine gleichzeitige Abnahme der Lymphozytenpopulationen, was die Aktivierung der angeborenen Immunantwort und die Unterdrückung der adaptiven Immunität widerspiegelt6. Mit fortschreitender Erkrankung können die Neutrophilenspiegel oszillieren oder erschöpft werden, während die Lymphozytenzahl weiter abnimmt, was zu einem Zustand der Immunsuppression führt, der die Patienten anfällig für Sekundärinfektionen macht7. Das Verständnis des dynamischen Zusammenspiels zwischen diesen Immunzellpopulationen ist entscheidend, um den Immunstatus von Sepsis-Patienten genau zu beurteilen und gezielte Interventionen zu entwickeln.
Traditionelle Ansätze zur Analyse der Immunzellzahl bei Sepsis beruhen auf univariaten oder bivariaten Analysen, die die komplexen Beziehungen zwischen mehreren Immunparametern nicht erfassen8. Jüngste Fortschritte in der Datenvisualisierung und bei maschinellen Lerntechniken haben neue Möglichkeiten für die Erforschung hochdimensionaler immunologischer Daten eröffnet9. Insbesondere die dreidimensionale Visualisierung von Streudiagrammen und selbstorganisierende Merkmalskarten (SOFM)10 haben sich als vielversprechend erwiesen, um verborgene Muster aufzudecken und unterschiedliche Immunzustände in verschiedenen Krankheitskontexten zu identifizieren.
Ziel dieser Studie ist es, den Immunzustand bei Sepsis-Patienten zu untersuchen, indem die quantitativen Beziehungen zwischen weißen Blutkörperchen, Lymphozyten und Neutrophilen unter Verwendung fortschrittlicher Datenvisualisierungs- und Clustering-Techniken analysiert werden. Die Hypothese ist, dass diese Immunzellpopulationen in einem dreidimensionalen Raum gefangen sind, der von einer zugrunde liegenden mathematischen Beziehung bestimmt wird. Durch die Aufdeckung dieser Beziehung und die Identifizierung unterschiedlicher Immunzustände mittels SOFM versucht die Studie, einen Rahmen für das Verständnis der immundynamischen Zustände bei Sepsis zu schaffen und die klinische Entscheidungsfindung zu erleichtern.
Der Ansatz umfasst die Entnahme von Blutproben von 512 Sepsis-Patienten, die auf die Intensivstation (ICU) eingeliefert wurden, und 205 gesunden Personen, insgesamt 717 Proben. Die Studienpopulation umfasste sowohl männliche (54,3 %) als auch weibliche (45,7 %) Teilnehmer im Alter von 35 bis 100 Jahren (Durchschnittsalter: 73,5 Jahre). Dreidimensionale Scatterplot-Visualisierung und numerische Anpassung werden angewendet, um ein mathematisches Modell zu erstellen, das das Zusammenspiel zwischen weißen Blutkörperchen, Lymphozyten und Neutrophilen sowohl bei Sepsis-Patienten als auch bei gesunden Kontrollpersonen beschreibt. SOFM wird dann eingesetzt, um die Sepsis-Probendaten automatisch im dreidimensionalen Raum zu clustern, was zu unterschiedlichen Immunzuständen führt. Durch den Vergleich der Immunprofile und räumlichen Verteilungen von Sepsis-Patienten mit denen von gesunden Personen innerhalb der durch das mathematische Modell dargestellten Constraint-Grenze zielt die Studie darauf ab, Einblicke in die pathophysiologischen Mechanismen zu gewinnen, die der Sepsis zugrunde liegen, und potenzielle Angriffspunkte für immunmodulatorische Therapien zu identifizieren.
Durch die Bereitstellung einer quantitativen Methode zur Beurteilung des Immunzustands von Sepsis-Patienten könnte der Ansatz ein präziseres Staging der Krankheit ermöglichen und die Auswahl geeigneter Interventionen leiten. Darüber hinaus kann die Identifizierung unterschiedlicher Immunzustände mittels SOFM die Grundlage für die zukünftige Erforschung personalisierter Immuntherapieansätze legen, die auf die spezifischen Immunprofile einzelner Patienten zugeschnitten sind.
Zusammenfassend stellt diese Studie einen Ansatz zum Verständnis der Immunerkrankung bei Sepsis vor, indem fortschrittliche Datenvisualisierungs- und maschinelle Lerntechniken genutzt werden. Durch die Aufdeckung der mathematischen Beziehung zwischen wichtigen Immunzellpopulationen bei Sepsis-Patienten und gesunden Kontrollpersonen und die Identifizierung unterschiedlicher Immunzustände bei Sepsis-Patienten bietet die Studie eine neue Perspektive auf die komplexe Immundynamik bei Sepsis. Dieser Ansatz ermöglicht eine genauere Beurteilung des Krankheitszustands (verschiedene Cluster) und kann die Auswahl geeigneter Interventionen leiten, was letztendlich dazu beiträgt, effektivere diagnostische und therapeutische Strategien zu entwickeln.
Protokoll
Diese Studie untersucht den Immunzustand bei Sepsis-Patienten, indem sie die Beziehungen zwischen weißen Blutkörperchen, Lymphozyten und Neutrophilen untersucht. Die Patienten wurden auf die Intensivstation (ICU) des Dongzhimen-Krankenhauses in Peking, China, aufgenommen und nach Erteilung einer Einverständniserklärung Standard-Bluttests unterzogen. Die Studie wurde nach den Richtlinien der institutionellen Ethikkommission für die Humanforschung durchgeführt. Die Gruppierung der Daten und der detaillierte Dateninhalt finden Sie in der ergänzenden Tabelle 1. Die in dieser Studie verwendeten Softwaretools sind in der Materialtabelle aufgeführt.
1. Datenerhebung und -aufbereitung
HINWEIS: Weiße Blutkörperchen, Neutrophile und Lymphozyten wurden als Schlüsselindikatoren für den Immunzustand bei Sepsis-Patienten ausgewählt. Diese Wahl basiert auf den gut etablierten klinischen Beobachtungen, dass die Lymphozytenzahl tendenziell unterdrückt wird und allmählich abnimmt, während die Neutrophilenzahl bei Sepsis-Patienten häufig oszilliert. Diese beiden Zelltypen wurden empirisch als wichtige Marker für den Immunstatus in Sepsis-Patientenpopulationen anerkannt. Der genaue quantitative Zusammenhang zwischen diesen Parametern ist in der Literatur jedoch nicht eindeutig beschrieben. Daher wurden weiße Blutkörperchen, Neutrophile und Lymphozyten als Ausgangspunkt für die Quantifizierung des Immunzustands bei Sepsis-Patienten gewählt.
- Installieren des Add-Ins MATLAB Spreadsheet Link for Excel.
- Öffnen Sie Microsoft Excel , und navigieren Sie im Menüband zur Registerkarte Einfügen .
- Klicken Sie im Abschnitt Add-Ins auf Add-Ins abrufen.
- Suchen Sie im Dialogfeld Office-Add-Ins in der Suchleiste nach MATLAB Spreadsheet Link .
- Suchen Sie das Add-In MATLAB Spreadsheet Link for Excel in den Suchergebnissen und klicken Sie auf die Schaltfläche Hinzufügen .
- Lesen und akzeptieren Sie die Nutzungsbedingungen und klicken Sie dann auf Weiter , um mit der Installation fortzufahren.
- Wenn Sie dazu aufgefordert werden, melden Sie sich mit einem MathWorks-Konto an, oder erstellen Sie ein neues Konto, um auf das Add-In zuzugreifen.
- Sobald die Installation abgeschlossen ist, wird die Registerkarte MATLAB Spreadsheet Link (MATLAB Spreadsheet Link ) im Excel-Menüband angezeigt.
- Klicken Sie auf die Registerkarte MATLAB Spreadsheet Link , um zu überprüfen, ob das Add-In installiert und einsatzbereit ist.
- Senden Sie Daten an den MATLAB-Arbeitsbereich.
- Öffnen Sie die Tabelle mit den Daten des Sepsis-Patienten, einschließlich der Anzahl der weißen Blutkörperchen, der Lymphozytenzahl und der Neutrophilenzahl.
- Stellen Sie sicher, dass die Daten in einem strukturierten Format organisiert sind, wobei sich jede Variable (Anzahl der weißen Blutkörperchen, Lymphozyten und Neutrophilen) in einer separaten Spalte und jeder Patient in einer separaten Zeile befindet.
- Wählen Sie den Zellbereich aus, der die Anzahl der weißen Blutkörperchen, Lymphozyten und Neutrophilen enthält.
- Klicken Sie auf die Registerkarte MATLAB Spreadsheet Link im Excel-Menüband.
- Klicken Sie auf der Registerkarte MATLAB-Tabellenverknüpfung auf die Schaltfläche Daten an MATLAB senden .
- Wählen Sie im Dialogfeld "Daten an MATLAB senden " die entsprechende MATLAB-Instanz aus dem Dropdown-Menü aus, wenn mehrere Instanzen ausgeführt werden.
- Geben Sie den Variablennamen für die Daten im Feld Variablenname an. Beispiel: sepsis_immune_data.
- Wählen Sie den gewünschten Datentyp für die importierten Daten in MATLAB aus (z. B. numerische Matrix).
- Klicken Sie auf OK , um die Daten an den MATLAB-Arbeitsbereich zu senden.
- Wechseln Sie zur MATLAB-Anwendung und überprüfen Sie, ob die Daten erfolgreich importiert wurden, indem Sie den Arbeitsbereich auf den angegebenen Variablennamen (z. B. sepsis_immune_data) überprüfen.
- Überprüfen der Daten in MATLAB
- Nachdem Sie die Sepsis-Patientendaten (Anzahl der weißen Blutkörperchen, Lymphozytenzahlen und Neutrophilenzahlen) mit dem Add-In MATLAB Spreadsheet Link an MATLAB gesendet haben, wechseln Sie zur MATLAB-Anwendung.
- Um den Inhalt der importierten Daten zu überprüfen, geben Sie den Variablennamen in das MATLAB-Befehlsfenster ein und drücken Sie die Eingabetaste.
2. Dreidimensionale Visualisierung von weißen Blutkörperchen, Lymphozyten und Neutrophilen
- Generieren des Diagramms mit der Funktion Immune_scatter3
- Die Variable A speichert die Immundaten von Sepsis-Patienten. Rufen Sie die Funktion Immune_scatter3(A) auf, um eine grafische Benutzeroberfläche (GUI) zu erhalten, in der das dreidimensionale Streudiagramm der Stichproben angezeigt wird, wie in Abbildung 1 dargestellt.
HINWEIS: Der Anpassungsfehler zwischen der dreidimensionalen Ebene und der Stichprobenverteilung im Diagramm ist sehr gering. Abschnitt 3 enthält die genaue Formel.
- Die Variable A speichert die Immundaten von Sepsis-Patienten. Rufen Sie die Funktion Immune_scatter3(A) auf, um eine grafische Benutzeroberfläche (GUI) zu erhalten, in der das dreidimensionale Streudiagramm der Stichproben angezeigt wird, wie in Abbildung 1 dargestellt.
- Die Verwendung der GUI
- Erkunden und analysieren Sie das dreidimensionale Streudiagramm mit den interaktiven Funktionen, die von der generierten GUI bereitgestellt werden.
- Drehen: Klicken und ziehen Sie den Plot, um ihn im 3D-Raum zu drehen und die Probenverteilung aus verschiedenen Blickwinkeln zu betrachten.
- Verschieben: Klicken Sie mit der rechten Maustaste auf den Plot und ziehen Sie ihn, um ihn horizontal oder vertikal zu verschieben und den sichtbaren Bereich des Plots anzupassen.
- Zoom: Verwenden Sie das Mausrad oder die Zoom-Steuerelemente in der Symbolleiste, um das Diagramm zu vergrößern oder zu verkleinern und sich auf bestimmte Bereiche oder Beispiele zu konzentrieren.
- Datencursor: Klicken Sie auf einzelne Proben, um die entsprechenden Werte für weiße Blutkörperchen, Lymphozyten und Neutrophile anzuzeigen.
HINWEIS: Durch die Nutzung dieser interaktiven Funktionen können Ärzte Einblicke in die Beziehungen und Muster zwischen weißen Blutkörperchen, Lymphozyten und Neutrophilen bei Sepsis-Patienten gewinnen, was die Untersuchung und Analyse der Immundaten erleichtert.
- Erkunden und analysieren Sie das dreidimensionale Streudiagramm mit den interaktiven Funktionen, die von der generierten GUI bereitgestellt werden.
3. Die Formel
- Weisen Sie im MATLAB-Arbeitsbereich die Anzahl der Neutrophilen, die Anzahl der Lymphozyten und die Anzahl der weißen Blutkörperchen den Variablen X, Y bzw. Z zu.
- Um den präzisen mathematischen Ausdruck (Formel 1; Leukozyten = 1,098 × Neutrophile + 1,046 × Lymphozyten + 0,1645 (RMSE: 1%)) der dreidimensionalen Ebene in Abbildung 1 den folgenden Befehl auf:
[fitresult, gof, output] = fit ([X, Y], Z, 'poly11')
HINWEIS: Diese Formel beschreibt quantitativ die Beziehung zwischen weißen Blutkörperchen, Neutrophilen und Lymphozyten bei Sepsis-Patienten und bietet eine prägnante und genaue Darstellung der Immundaten. - Um die Güte der Anpassung zu bewerten, berechnen Sie den normalisierten Root-Mean-Square-Fehler (NRMSE) mit dem folgenden Befehl:
gof.rmse / (max(Z) - min(Z))
HINWEIS: Der resultierende NRMSE-Wert von 1 % zeigt an, dass die angepasste Ebene (Formel 1) der tatsächlichen Probenverteilung im dreidimensionalen Raum sehr nahe kommt. Dieses niedrige Fehlerniveau unterstreicht die Zuverlässigkeit und Validität des erhaltenen mathematischen Ausdrucks bei der Erfassung der komplizierten Beziehungen zwischen den Immunparametern bei Sepsis-Patienten.
4. Immunzustand bei Sepsis
HINWEIS: Self-Organizing Feature Maps (SOFM) wurden für unüberwachtes Clustering eingesetzt, um Immunzustände bei Sepsis-Patienten zu identifizieren.
- Generieren Sie durch Aufrufen der Funktion Immune_Condition Cluster von Abtastpunkten auf der dreidimensionalen Ebene, die durch Formel 1 dargestellt wird, wie in Abbildung 2 dargestellt.
- Verwenden Sie die interaktiven Visualisierungsfunktionen für Abbildung 2 , wie in Schritt 2.2 beschrieben.
HINWEIS: Abbildung 2 zeigt neun automatisierte Cluster mit den Bezeichnungen Cluster1 bis Cluster9, die vom unüberwachten Machine Learning-Ansatz von SOFM abgeleitet wurden. Diese Clustering-Technik berücksichtigt sowohl die räumliche Topologie als auch die Dichte der Proben und ermöglicht die Identifizierung unterschiedlicher Immunzustände innerhalb der Sepsis-Patientenpopulation.
5. Typische Immunoszillationsverläufe bei Sepsis
- Verwenden Sie in Anlehnung an Abbildung 2 den Befehl hold on , um die Figur in einem überlagerbaren Zustand zu halten, und verwenden Sie dann die folgenden Befehle, um ein dreidimensionales Diagramm der typischen Trajektoriendaten des Patienten zu erstellen.
Abwarten
für i=1: size(p,1)-1
Pause (3); plot3(p (i: i+1,2), p (i: i+1,3), p (i: i+1,1),'k','Linienbreite',3);
Ende
Ergebnisse
Das Fortschreiten der Sepsis ist ein komplexes Zusammenspiel zwischen dem menschlichen Immunsystem und eindringenden Krankheitserregern. Bei der klinischen Diagnose und Behandlung wird viel Wert auf Infektionsindikatoren, Organfunktionsmarker, Zytokine, mikrobiellen Nachweis und sogar das Darmmikrobiom gelegt. Diese Studie unterstreicht jedoch die Bedeutung von drei gängigen Immunindikatoren: weiße Blutkörperchen, Neutrophile und Lymphozyten, die nicht ohne Grundlage sind. Die Forschung hat gezeigt, dass der pathologische Prozess der Sepsis mit der Unterdrückung und Erschöpfung von Lymphozytenpopulationen einhergeht, während die Neutrophilenspiegel nach wiederholten Schwankungen entweder erschöpft sind oder Krankheitserreger überwinden5. Nichtsdestotrotz müssen die mathematischen Einschränkungen und Dynamiken, die diesem Prozess zugrunde liegen, weiter quantifiziert und aufgeklärt werden.
Bei der Untersuchung der Verteilung von 512 Proben (dargestellt durch blaue Punkte) und 205 gesunden Kontrollpersonen (dargestellt durch grüne Pluszeichen) im dreidimensionalen Raum (Abbildung 1) ist leicht zu erkennen, dass die Probenpunkte von weißen Blutkörperchen, Neutrophilen und Lymphozyten auf einer Ebene mit einem sehr kleinen Fehler liegen. Die unterschiedlichen Farben und Marker, die im Streudiagramm verwendet werden, zeigen deutlich die signifikanten Unterschiede zwischen der Sepsis- und der gesunden Kontrollgruppe innerhalb der Constraint-Grenze. Diese Beobachtung deutet darauf hin, dass diese Immunzellpopulationen unabhängig vom Gesundheitszustand einem objektiven Gesetz oder einer Einschränkung folgen. Weitere Analysen ergeben folgende Formel: Leukozyten = 1,098 × Neutrophile + 1,046 × Lymphozyten + 0,1645 (Formel 1), mit einem mittleren quadratischen Fehler (RMSE) von 1%. Diese Gleichung deutet darauf hin, dass die ebene Steigung von Neutrophilen größer ist als die von Lymphozyten, was bedeutet, dass Veränderungen der Neutrophilenzahl einen ausgeprägteren Einfluss auf die Anzahl der weißen Blutkörperchen haben als Veränderungen der Lymphozytenzahl. Obwohl diese Formel einfach ist, stellt sie eine neuartige Erkenntnis dar, die einen objektiv existierenden Mechanismus oder eine Einschränkung aufdeckt, die das Zusammenspiel zwischen weißen Blutkörperchen, Neutrophilen und Lymphozyten steuert, unabhängig von ihren individuellen Variationen. Wichtig ist, dass diese Einschränkungsgrenze sowohl für Sepsis-Patienten als auch für gesunde Personen gilt, was darauf hindeutet, dass sie eine grundlegende Eigenschaft des Immunsystems widerspiegelt, während die unterschiedlichen räumlichen Verteilungen innerhalb dieser Grenze die immunologischen Unterschiede zwischen Sepsis und Gesundheit offenbaren.
Um die verschiedenen Immunzustände weiter zu unterscheiden, wird in Abbildung 2 SOFM für das automatische Clustering von Probenahmepunkten verwendet. SOFM wurde speziell für diese Analyse ausgewählt, da es sich um einen etablierten unüberwachten Clustering-Algorithmus handelt, der sich durch die Beibehaltung topologischer Beziehungen auszeichnet und dabei sowohl den Abstand zwischen den Proben als auch deren Dichteverteilungen berücksichtigt. Der Parameter für die Nachbarschaftssteuerung des Algorithmus wurde auf 1 festgelegt, um eine minimale Überlappung zwischen benachbarten Clustern zu gewährleisten und gleichzeitig klare Grenzdefinitionen beizubehalten. Die Auswahl der neun Kategorien wurde durch sorgfältige Parameteroptimierung bestimmt, wobei die Notwendigkeit einer detaillierten Unterteilung der Bundesstaaten mit der praktischen Überlegung der Beibehaltung klinisch bedeutsamer Unterscheidungen in Einklang gebracht wurde. Dieser Ansatz ermöglicht sowohl eine feinkörnige Unterscheidung von Immunzuständen als auch das Potenzial, benachbarte Zustände zusammenzuführen, wenn dies biologisch angemessen ist, wodurch sowohl eine Übersegmentierung als auch Zustandsauslassungen vermieden werden.
In Abbildung 2 wurde SOFM-Clustering eingesetzt, um automatisch unterschiedliche Immunzustände bei Sepsis-Patienten zu identifizieren, mit dem Ziel, eine umfassende Charakterisierung der Immunlandschaft zu ermöglichen und das Risiko zu minimieren, wichtige Kategorien zu übersehen. Cluster1, Cluster2 und Cluster4 repräsentieren ein höheres Maß an Immunaktivität, das durch eine relativ hohe Anzahl von Lymphozyten und Neutrophilen gekennzeichnet ist. Cluster3, Cluster5, Cluster6 und Cluster9 stellen die Immunoszillationsperiode dar, in der die Lymphozytenpopulationen bereits unterdrückt wurden, während die Neutrophilenspiegel schwanken können. Cluster 8 stellt einen Zustand verminderter Immunaktivität dar, der entweder eine Immunsuppression oder eine Phase der Immunerholung nach dem Abklingen der Infektion widerspiegeln kann. Cluster7 stellt wahrscheinlich einen kleinen Teil der Patienten dar, die sich allmählich erholen und Anzeichen einer Verbesserung ihres Immunstatus zeigen.
Es ist erwähnenswert, dass die Verwendung mehrerer SOFM-Cluster eine detailliertere Darstellung der verschiedenen Immunzustände ermöglicht, die bei Sepsis-Patienten beobachtet werden. Dieser Ansatz zielt darauf ab, das gesamte Spektrum der Immunprofile zu erfassen und die Wahrscheinlichkeit zu minimieren, dass kritische Kategorien übersehen werden. Durch praktische Validierung und weitere Analyse ist es jedoch möglich, Cluster zusammenzuführen, die ähnliche Immunzustände repräsentieren, wodurch das Klassifikationsschema gestrafft und gleichzeitig seine Vollständigkeit erhalten bleibt. Dieser Verfeinerungsprozess stellt sicher, dass die identifizierten Immunzustände sowohl biologisch bedeutsam als auch klinisch relevant sind, und bietet einen robusten Rahmen für das Verständnis der komplexen Immundynamik bei Sepsis.
Abbildung 3 veranschaulicht den Verlauf der Immunzustände eines typischen Sepsis-Patienten, der einen komplexen Verlauf der Immundysregulation durchlief, bevor er sich schließlich besserte. Die Reise des Patienten begann in Cluster 2, das einen Zustand erhöhter Immunaktivität darstellt, und durchlief dann verschiedene Immunzustände, darunter Cluster 5, 7, 9 und 8. Diese Übergänge spiegeln das dynamische Zusammenspiel zwischen dem Immunsystem des Patienten und den eindringenden Krankheitserregern wider, mit Perioden der Oszillation und scheinbaren Immunsuppression.
Bemerkenswert ist, dass sich der SOFA-Score (Sequential Organ Failure Assessment) des Patienten bereits zu verbessern begann und von einem Anfangswert von 7 auf 2 sank, bevor der Patient in Cluster 7 kam. Dies deutet darauf hin, dass das Immunsystem des Patienten erhebliche Fortschritte bei der Beseitigung der Infektion gemacht hat, und der anschließende Übergang zu Cluster 7 könnte eher eine Phase der Immunerholung als eine vollständige Immunerschöpfung darstellen.
Nach der Passage durch Cluster 8 entwickelte sich der Immunzustand des Patienten allmählich in Richtung Cluster 7, was mit einem gesünderen Immunprofil verbunden ist. Diese Erholungsphase war gekennzeichnet durch einen Anstieg sowohl der Neutrophilen- als auch der Lymphozytenzahl, wobei sich die Werte denen annäherten, die bei gesunden Personen beobachtet wurden.
In der klinischen Praxis zeigen die Patienten im Allgemeinen Immunoszillationsverläufe, die der typischen roten Linie in Abbildung 3 ähneln. Wenn die Trajektorie in den Clustern 3, 5, 6 und 9 oszilliert, die weit vom Zentrum gesunder Proben entfernt sind, verschlechtert sich der Zustand des Patienten. Wenn der Verlauf des Patienten zu den Clustern 7 und 8 zurückkehrt, die näher am Zentrum gesunder Proben liegen, verbessert sich der Zustand, und einige Patienten erlangen sogar wieder einen gesunden Status. Die Cluster 1, 2 und 4 werden häufig in den frühen Stadien der Erkrankung beobachtet, die durch eine erhöhte Immunaktivität gekennzeichnet sind. Diese Muster von Zustandsübergängen bieten eine immunbasierte Perspektive für die Früherkennung und das Management des Krankheitsverlaufs bei Sepsis. Aus der Perspektive des Patientenzustandsmanagements ist es offensichtlich, dass sich der Zustand der Patienten verschlechtert, wenn sie zu Cluster 6 tendieren, während das Fortschreiten in Richtung eines gesunden Zustands auf eine klinische Verbesserung hindeutet.
Dieses Protokoll bietet einen quantitativen Ansatz zur Beurteilung des Immunzustands bei Sepsis-Patienten durch ein mathematisches Modell und eine Clustering-Analyse, der sowohl die Früherkennung von Sepsis durch eine eindeutige Visualisierung des Immunzustands als auch die präzise Überwachung des Krankheitsverlaufs durch die Verfolgung der Immuntrajektorie ermöglicht, die die klinische Entscheidungsfindung und personalisierte Behandlungsstrategien leiten kann.
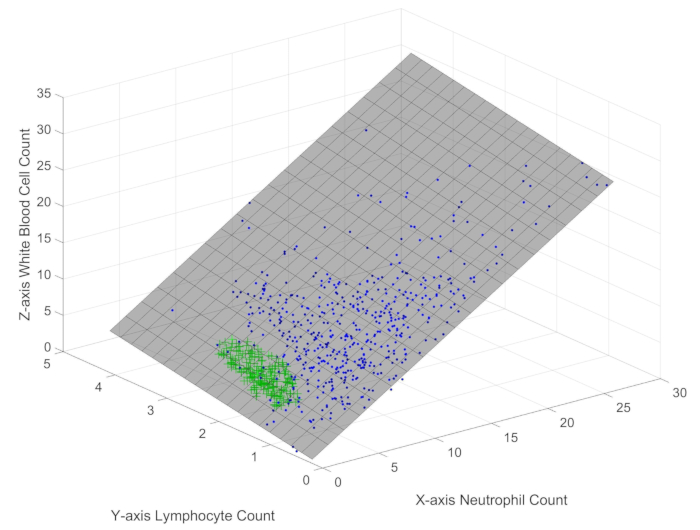
Abbildung 1: Dreidimensionales Streudiagramm von weißen Blutkörperchen, Lymphozyten und Neutrophilen in Proben von Sepsis-Patienten. Die Abbildung zeigt die räumliche Verteilung der wichtigsten Immunindikatoren bei Sepsis-Patienten. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
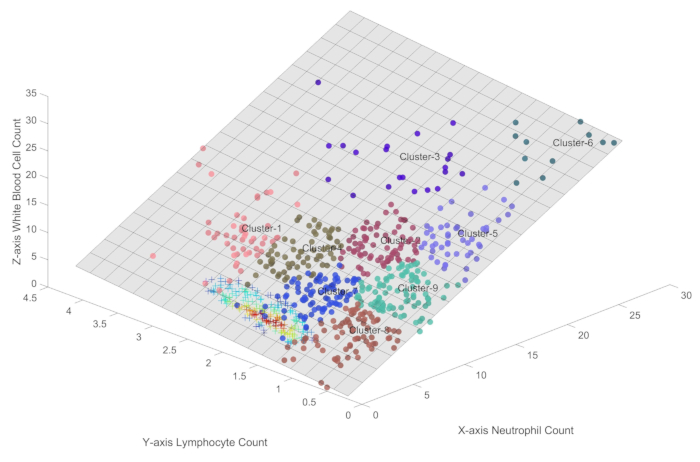
Abbildung 2: Unterschiedliche Immunzustände bei Sepsis. Diese Abbildung ermöglicht eine genaue Quantifizierung der Immunzustände bei Sepsis innerhalb der dreidimensionalen Ebene, die durch Formel 1 dargestellt wird. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
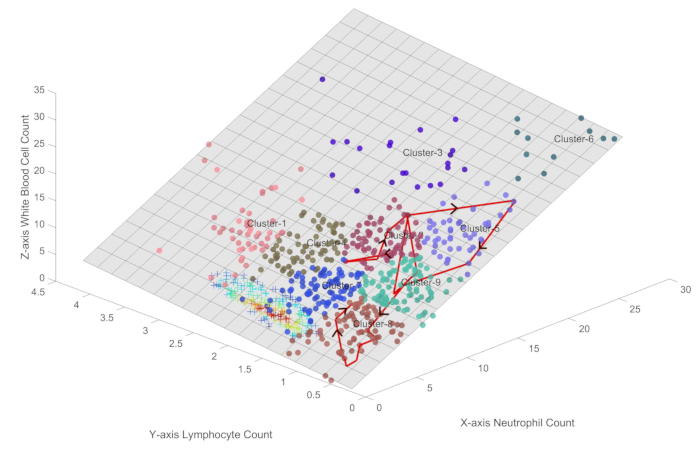
Abbildung 3: Visualisierung des Verlaufs des Immunzustands bei einem Sepsis-Patienten, der sich in einer klinischen Besserung befindet. Die Abbildung veranschaulicht den Verlauf der Immunzustände eines typischen Sepsis-Patienten, der einen komplexen Verlauf der Immundysregulation durchlief, bevor er sich schließlich besserte. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Diese Studie stellt einen Ansatz zum Verständnis des Immunzustands bei Sepsis vor, indem fortschrittliche Datenvisualisierungs- und maschinelle Lerntechniken genutzt werden. Durch die Aufdeckung der mathematischen Beziehung zwischen wichtigen Immunzellpopulationen und die Identifizierung unterschiedlicher Immunzustände bietet die Studie eine neue Perspektive auf die komplexe Immundynamik bei Sepsis und trägt zur Entwicklung effektiverer diagnostischer und therapeutischer Strategien bei11,12. Zu den wichtigsten Ergebnissen gehören die Entdeckung einer mathematischen Beziehung (Abschnitt 3), die diese Immunzellpopulationen in einem dreidimensionalen Raum einschränkt (WBC = 1,098 × Neutrophile + 1,046 × Lymphozyten + 0,1645) und die Identifizierung von neun verschiedenen Immunzuständen (Abschnitt 4) mit Hilfe von selbstorganisierenden Merkmalskarten (SOFM). Diese Ergebnisse bieten einen quantitativen Rahmen für die Beurteilung des Immunstatus von Sepsis-Patienten und bieten eine potenzielle Methode zur Triage von Sepsis-Patienten im Frühstadium13.
Diese hier vorgestellte Forschung kombinierte Datenvisualisierungs- und maschinelle Lerntechniken, um verborgene Muster und Beziehungen in hochdimensionalen immunologischen Daten bei Sepsis aufzudecken. Durch das Hinausgehen traditioneller univariater und bivariater Analysen erfasst diese Studie das komplexe Zusammenspiel mehrerer Immunparameter und liefert ein umfassenderes Verständnis der Immunantwort (verschiedene Cluster in Abbildung 2) bei Sepsis. Die Identifizierung unterschiedlicher Immunzustände mittels SOFM10 kann die Grundlage für die zukünftige Erforschung personalisierter Immuntherapieansätze legen, die auf die spezifischen Immunprofile einzelner Patienten zugeschnitten sind.
Zukünftige Studien mit noch größeren und vielfältigeren Kohorten werden notwendig sein, um die hier vorgestellten Ergebnisse weiter zu validieren und zu verfeinern. Darüber hinaus muss die Beziehung zwischen den identifizierten Immunzuständen und anderen klinisch relevanten biochemischen Markern wie Procalcitonin (PCT), C-reaktivem Protein (CRP) und Interleukin-6 (IL-6) noch eingehend untersucht werden14,15. Die Integration dieser Marker in die Analyse könnte zu einem umfassenderen Verständnis der Immun-Entzündungsreaktion bei Sepsis und ihrer Assoziation mit klinischen Ergebnissen führen, was möglicherweise die Vorhersagekraft und den klinischen Nutzen des vorgeschlagenen Ansatzes verbessert. Darüber hinaus könnten Längsschnittstudien, die die Dynamik der Immunzustände im Laufe der Zeit bei einzelnen Patienten verfolgen, wertvolle Einblicke in den Verlauf der Sepsis bieten und personalisierte Behandlungsstrategien ermöglichen.
Einerseits zeigt die in Abbildung 1 dargestellte dreidimensionale Visualisierungsmethode eine markante Unterscheidung zwischen den Immunzuständen von Sepsis-Patienten und gesunden Kontrollpersonen und bietet eine neue quantitative immunologische Perspektive für eine schnelle Früherkennung von Sepsis. Auf der anderen Seite stellt die in Abbildung 3 gezeigte Diskussion typischer Immunverläufe von Patienten einen neuen Ansatz für das Patientenzustandsmanagement dar und bietet eine quantitative Methode zur Überwachung und Steuerung des Krankheitsverlaufs.
Die Bedeutung und die Anwendungsmöglichkeiten der in dieser Studie vorgeschlagenen Methode gehen weit über den spezifischen Kontext der Sepsis hinaus. Die Fähigkeit, Krankheitszustände mithilfe datengesteuerter Ansätze präzise zu quantifizieren, hat das Potenzial, zu einem Paradigmenwechsel in der klinischen Forschung zu werden, mit tiefgreifenden Auswirkungen auf die personalisierte Medizin16. So kann beispielsweise die Verfolgung der Immunzustände von Sepsis-Patienten eine klare Einschätzung der Stadien des Kampfes des Patienten gegen die Infektion liefern, was für die Bewertung der Prognose und die Verbesserung der Behandlungspläne von entscheidender Bedeutung ist. Durch die Nutzung der Leistungsfähigkeit von Datenvisualisierung und maschinellem Lernen können Forscher neue Erkenntnisse über die Pathophysiologie komplexer Krankheiten gewinnen und gezieltere diagnostische und therapeutische Strategien entwickeln17.
Aufbauend auf den Ergebnissen dieser Studie können mehrere zukünftige Richtungen ins Auge gefasst werden. Erstens wird die Erhöhung der Stichprobengröße und -diversität der Sepsis-Patientenpopulation entscheidend sein, um die hier identifizierten mathematischen Beziehungen und Immunzustände zu validieren und zu verfeinern. Dies erfordert die Zusammenarbeit zwischen mehreren Zentren und die Etablierung standardisierter Protokolle für die Datenerfassung und -analyse. Zweitens könnte die Erforschung der Beziehung zwischen den identifizierten Immunzuständen und anderen biochemischen Markern wie PCT, CRP und IL-6 zu einem umfassenderen Verständnis der Immun-Entzündungsreaktion bei Sepsisführen 18. Darüber hinaus könnte die Untersuchung der komplexen, nichtlinearen Beziehungen zwischen Immunzuständen, Organfunktionsstörungen (gemessen anhand von SOFA-Scores) und Markern für den Schweregrad der Infektion dazu beitragen, die unterschiedlichen Wege aufzuklären, über die verschiedene Patienten von der Infektion bis zum Organversagen fortschreiten. Durch die Integration dieser Indikatoren für den Schweregrad der Infektion in unseren Ansatz zur Quantifizierung des Immunzustands könnte die zukünftige Forschung unser Verständnis der Krankheitsverlaufsmuster verbessern, was möglicherweise zu präziseren und personalisierten Behandlungsstrategien führt, die sowohl den Schweregrad der Infektion als auch den Immunstatus einzelner Patienten berücksichtigen. Schließlich könnte der in dieser Studie vorgeschlagene Forschungsansatz auf andere medizinische Szenarien wie Autoimmunerkrankungen, Krebs und Transplantation ausgeweitet werden, bei denen die genaue Quantifizierung von Krankheitszuständen erhebliche klinische Auswirkungen haben könnte.
Zusammenfassend stellt diese Studie einen Ansatz zum Verständnis der Immunerkrankung bei Sepsis vor, indem fortschrittliche Datenvisualisierungs- und maschinelle Lerntechniken genutzt werden. Durch die Aufdeckung der mathematischen Beziehung zwischen wichtigen Immunzellpopulationen und die Identifizierung unterschiedlicher Immunzustände bietet diese Studie eine neue Perspektive auf den komplexen Immunzustand bei Sepsis. Die Einschränkungen der Studie, wie z. B. die Stichprobengröße und die Notwendigkeit einer weiteren Erforschung des Zusammenhangs zwischen Immunzuständen und anderen biochemischen Markern, sollten in zukünftigen Forschungsarbeiten berücksichtigt werden. Die potenziellen Anwendungen der Methode in bestimmten Forschungsbereichen, wie z. B. der personalisierten Medizin, und die zukünftigen Richtungen, einschließlich der Erhöhung der Stichprobengröße und der Ausweitung des Ansatzes auf andere medizinische Szenarien, unterstreichen die Bedeutung und das Versprechen dieser Forschungsrichtung.
Offenlegungen
Das Software-Tool für probabilistische Streudiagramme für Immunzustände V1.0 wird von Beijing Intelligent Entropy Science & Technology Co., Ltd. entwickelt und ist im Besitz von Beijing Intelligent Entropy Science & Technology Co., Ltd. Alle geistigen Eigentumsrechte an dieser Software liegen beim Unternehmen. Die Autoren erklären, dass keine Interessenkonflikte bestehen.
Danksagungen
Diese Studie wurde von zwei Quellen unterstützt: der siebten Runde des Master-Apprentice Inheritance Project, das von der Nationalen Verwaltung für Traditionelle Chinesische Medizin Chinas organisiert wurde (Projektnummer: [2021] Nr. 272) und dem 2024 Chinese Medicine Research Capacity Enhancement Project of Municipal-level Chinese Medicine Hospital (SZY-NLTL-2024-003) von der Provinzverwaltung für Traditionelle Chinesische Medizin Shaanxi.
Materialien
| Name | Company | Catalog Number | Comments |
| MATLAB | MathWorks | 2022B | Computing and visualization |
| Probabilistic Scatter Plots for Immune States | Intelligent Entropy | Immune States V1.0 | Beijing Intelligent Entropy Science & Technology Co Ltd. Modeling for CT/MRI fusion |
Referenzen
- Jarczak, D., Kluge, S., Nierhaus, A. Sepsis-pathophysiology and therapeutic concepts. Front Med (Lausanne). 8, 628302 (2021).
- Cheung, G. Y. C., Bae, J. S., Otto, M. Pathogenicity and virulence of Staphylococcus aureus. Virulence. 12 (1), 547-569 (2021).
- Adelman, M. W., et al. The gut microbiome's role in the development, maintenance, and outcomes of sepsis. Crit Care. 24 (1), 278 (2020).
- Kumar, V. Pulmonary innate immune response determines the outcome of inflammation during pneumonia and sepsis-associated acute lung injury. Front Immunol. 11, 1722 (2020).
- Nakamori, Y., Park, E. J., Shimaoka, M. Immune deregulation in sepsis and septic shock: Reversing immune paralysis by targeting PD-1/PD-L1 pathway. Front Immunol. 11, 624279 (2021).
- Van der Poll, T., Shankar-Hari, M., Wiersinga, W. J. The immunology of sepsis. Immunity. 54 (11), 2450-2464 (2021).
- Chaturvedi, V., et al. T-cell activation profiles distinguish hemophagocytic lymphohistiocytosis and early sepsis. Blood. 137 (17), 2337-2346 (2021).
- Reyes, M., et al. An immune-cell signature of bacterial sepsis. Nat Med. 26 (3), 333-340 (2020).
- Pant, A., Mackraj, I., Govender, T. Advances in sepsis diagnosis and management: a paradigm shift towards nanotechnology. J Biomed Sci. 28 (1), 6 (2021).
- Kohonen, T. Essentials of the self-organizing map. Neural Netw. 37, 52-65 (2013).
- Yang, X., et al. The role of type 1 interferons in coagulation induced by gram-negative bacteria. Blood. 135 (14), 1087-1100 (2020).
- Zhang, Y. Y., Ning, B. T. Signaling pathways and intervention therapies in sepsis. Signal Transduct Target Ther. 6 (1), 407 (2021).
- Baghela, A., et al. Predicting sepsis severity at first clinical presentation: The role of endotypes and mechanistic signatures. EBioMedicine. 75, 103776 (2022).
- Yao, R. Q., et al. Publication trends of research on sepsis and host immune response during 1999-2019: A 20-year bibliometric analysis. Int J Biol Sci. 16 (1), 27-37 (2020).
- Owen, A. M., et al. TLR agonists as mediators of trained immunity: Mechanistic insight and immunotherapeutic potential to combat infection. Front Immunol. 11, 622614 (2021).
- Jung, E., et al. The fetal inflammatory response syndrome: the origins of a concept, pathophysiology, diagnosis, and obstetrical implications. Semin Fetal Neonatal Med. 25 (4), 101146 (2020).
- Bruno, M., et al. Transcriptional and functional insights into the host immune response against the emerging fungal pathogen Candida auris. Nat Microbiol. 5 (12), 1516-1531 (2020).
- Barichello, T., et al. Biomarkers for sepsis: more than just fever and leukocytosis-a narrative review. Crit Care. 26 (1), 14 (2022).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten