Method Article
Nörodejeneratif Hastalıkların Tedavisinde Yeniden Programlanmış Kök Hücre Kaynaklı Öncü Hücrelerde Kemogenetik Düzenleme
Bu Makalede
Özet
Burada, bu hücreleri dopaminerjik öncü hücrelere farklılaştırarak, bunları Parkinson hastalığının fare modellerine naklederek ve nakledilen hücrelerin başarılı entegrasyonunu ve fonksiyonel etkinliğini doğrulamak için davranışsal ve elektrofizyolojik sonuçları değerlendirerek hassas nöronal modülasyon elde etmek için kimyasal olarak yeniden programlanmış kök hücrelerin mühendisliği için bir protokol açıklıyoruz.
Özet
Tasarımcı ilaçlar (DREADD) tarafından özel olarak aktive edilen tasarımcı reseptörlerinin kök hücre bazlı tedavilerle entegrasyonu, hassas nöronal modülasyon için gelişmiş bir strateji sunar. Burada, Parkinson hastalığının (PD) bir fare modelinde nakledilen dopaminerjik öncüllerin fonksiyonel entegrasyonunu ve modülasyonunu değerlendirmek için uyarıcı (hM3Dq) veya inhibitör (hM4Di) DREADD reseptörlerini eksprese eden CRISPR tarafından tasarlanmış insan yeniden programlanmış kök hücreleri kullandık. Anahtar adımlar, füzyon olmayan DREADD eksprese eden kök hücre dizilerinin üretilmesini, bunların orta beyin dopaminerjik öncülerine ayrılmasını ve bu hücrelerin 6-hidroksidopamin (6-OHDA) lezyonlu farelerin striatumuna nakledilmesini içeriyordu. Nakledilen hücrelerin etkilerini analiz etmek için davranışsal değerlendirmeler ve elektrofizyolojik kayıtlar yaptık. Silindir testi gibi davranışsal testler, klozapin-N-oksit (CNO) uygulamasını takiben motor fonksiyonun önemli ölçüde modülasyonunu göstermiştir. Spesifik olarak, hM4Di'nin aktivasyonu kontralateral ön ayak hareketini azaltırken, hM3Dq'nun aktivasyonu gelişmiş motor davranış ile ilişkilendirildi. Elektrofizyolojik kayıtlar belirgin sinaptik yanıtlar ortaya çıkardı. hM4Di aktivasyonu, etkileşimler arası aralıkları arttırdı ve spontan uyarıcı postsinaptik akımların (sEPSC'ler) tepe genliklerini azaltırken, hM3Dq aktivasyonu, gelişmiş uyarıcı sinyallemeyi yansıtarak etkileşimler arası aralıkları azalttı ve tepe genliklerini artırdı. Özetle, davranışsal ve elektrofizyolojik değerlendirmelerin entegrasyonu, tasarlanmış kimyasal olarak yeniden programlanmış kök hücrelerin konakçı nöral devrelere kesin işlevsel olarak dahil edilmesini doğrular.
Giriş
Tasarımcı ilaçlar (DREADD) tarafından özel olarak aktive edilen tasarımcı reseptörleri, aksi takdirde inert sentetik ligandlar1 tarafından seçici olarak aktive edilebilen tasarlanmış G-proteinine bağlı reseptörlerdir. Kemogenetik yaklaşım, araştırmacıların nöral devre bağlantısını yüksek hassasiyetle araştırmalarını sağlayarak ve belirli beyin bölgelerinin veya hücre tiplerinin seçici aktivasyonu veya inhibisyonu yoluyla hem in vivo hem de in vitro hücresel işlevler hakkındaki anlayışımızı geliştirerek sinirbilimde önemli bir araç haline gelmiştir 2,3.
Kök hücre bazlı tedavi, nörodejeneratif hastalıkların tedavisi için umut verici bir strateji sunar. Greft hücrelerinin etkinliği, konak dokulara uygun entegrasyon, sağkalım ve fonksiyonel katkıya dayanır. Kontrolsüz hücresel aktivite, tümöroluşumu 4 dahil olmak üzere olumsuz sonuçlara yol açabilir; transplantasyon sonrası bu hücrelerin hassas kontrolünü gerektirir. İnsan tarafından yeniden programlanmış kök hücrelerde ve türetilmiş nöronlarda DREADD teknolojisinden yararlanmak, tasarımcı ilaç CNO 2,5'in uygulanması yoluyla nöronal aktiviteyi hassas bir şekilde kontrol etmek için bir araç sağlar. Dopaminerjik nöronların kaybı ile karakterize olan Parkinson hastalığı (PD) bağlamında, kök hücre kaynaklı dopaminerjik nöronların aktivitesini manipüle etmek, kemirgen modellerindesinaptik girdilerini ve projeksiyon modellerini araştırmak için çok önemlidir 6,7,8,9,10. Uyarıcı hM3Dq ve inhibitör hM4Di reseptörlerinin bu modellere dahil edilmesi, nöronal aktivitenin hassas modülasyonunu sağlar 11,12.
Hayvan davranışsal değerlendirmelerinin ve elektrofizyolojik kayıtların kombinasyonu, kemogenetik modülasyonun nakledilen hücreler üzerindeki etkilerinin in vivo13 kapsamlı bir değerlendirmesine olanak tanır. Apomorfin kaynaklı rotasyon, silindir testi ve rotarod testi dahil olmak üzere davranışsal değerlendirmeler, motor koordinasyonu değerlendirir ve PD14'ün deneysel modelleriyle ilişkili motor fonksiyondaki değişiklikler hakkında bilgi sağlar. Yama-kelepçe kayıtları gibi elektrofizyolojik teknikler, sinaptik tepkilerin ve aksiyon potansiyellerinin gerçek zamanlı olarak izlenmesini sağlayarak, nakledilen hücrelerin mevcut sinir ağlarına nasıl entegre olduğuna dair kapsamlı bir görünüm sağlar15. Davranışsal değerlendirmeleri elektrofizyolojik değerlendirmelerle birleştirerek, kemogenetik modülasyonun bu hücrelerin konak nöral devreleri içindeki entegrasyonunu ve işlevselliğini nasıl etkilediğini araştırabiliriz16. Ön bulgular, CNO uygulamasının nakledilen hücrelerde nöronal aktiviteyi etkili bir şekilde modüle ettiğini ve bunun da hayvan modellerinde daha iyi fonksiyonel sonuçlara yol açtığını göstermektedir.
Bu protokolde, insan tarafından yeniden programlanan kök hücreler, kümelenmiş düzenli aralıklı kısa palindromik tekrarlar (CRISPR) teknolojisi kullanılarak hM3Dq veya hM4Di reseptörlerini eksprese etmek üzere tasarlandı. Modifiye edilmiş yeniden programlanmış kök hücreleri orta beyin dopaminerjik öncü hücrelerine farklılaştırdıktan sonra, bu hücreler, davranışsal değerlendirmeler ve elektrofizyolojik kayıtlar kullanılarak konakçı sinir devreleri içindeki entegrasyonlarını ve fonksiyonel düzenlemelerini değerlendirmek için PD'nin fare modellerine nakledildi.
Protokol
Tüm hayvan deneyleri, Pekin Laboratuvar Hayvanları Bilimi Derneği ve Laboratuvar Hayvanlarının Bakımı ve Kullanımı için Ulusal Sağlık Enstitüleri tarafından belirlenen yönergelere uygun olarak gerçekleştirildi. İnsan periferik kan mononükleer hücreleri (PBMC'ler), önceki bir çalışmada açıklandığı gibi yazılı bilgilendirilmiş onam ile sağlıklı bir donörden elde edildi17.
1. Füzyon olmayan DREADD kök bazlı hücre hatlarının inşası
- DREADD donör plazmidini oluşturun.
NOT: Sindirim bölgeleri vektör dizisine göre tasarlanmalıdır. Parçalar, montaj verimliliğini artırmak için parça kollarına uygun 20-30 bp örtüşme ile sentezlenmeli ve büyütülmelidir.- T2A-ZsGreen parçasını (Fragman I) tasarlayın ve sentezleyin.
- PCR (Fragman II) kullanarak orijinal plazmitten hM3Dq/hM4Di-T2A fragmanını yükseltin. PCR reaksiyonunu (50 μL toplam hacim) 1x PCR tamponu, her dNTP karışımından 200 μM, 0.5 μM ileri ve geri primerler, 10-50 ng plazmit DNA şablonu ve 1.25 U yüksek kaliteli DNA polimeraz içerecek şekilde ayarlayın. Aşağıdaki koşullar altında termodöngü gerçekleştirin: şablonu tamamen denatüre etmek için 98 ° C'de 2.75 dakika boyunca ilk denatürasyon; 15 sn için 98 °C (denatürasyon), 30 sn için 60 °C (astar tavlama) ve 60 sn için 72 °C'den (uzatma) oluşan 32 amplifikasyon döngüsü; son uzatma 72 ° C'de 7 dakika.
- Doğrusallaştırılmış vektörü elde etmek için vektör plazmidini uygun enzimle sindirin. Tüm parçaları agaroz jel elektroforezi ile saflaştırın ve bir spektrofotometre kullanarak miktarını belirleyin.
NOT: Burada, orijinal plazmit MluI ve SalI ile sindirildi.
- 50-100 ng doğrusallaştırılmış vektör, Fragman I ve Fragman II'yi 1:3:3 molar oranında ve 2x Klonlama Karışımı ile nazikçe karıştırın. Gibson Assembly ile homolog rekombinasyonu kolaylaştırmak için karışımı 55 °C'de 1 saat inkübe edin.
- AAVS1 bölgesini hedefleyen kılavuz RNA'yı pX458 vektörünün BbsI bölgesine yerleştirin.
NOT: Sanger dizilemesini kullanarak oluşturulmuş tüm plazmitlerde dizi doğrulaması yapın. - 2-5 × 106 hücre / mL'lik bir hücre yoğunluğu hedefleyerek yeniden programlanmış kök hücreleri ortamda tutun.
NOT: Burada kullanılan yeniden programlanmış kök hücreler, önceki bir çalışmada açıklandığı gibi insan PBMC'lerinden indüklenmiştir17. Hücre durumu elektroporasyon verimliliğini önemli ölçüde etkilediği için hücre sağlığının izlenmesi çok önemlidir. Ortamların karşılaştırması için Malzeme Tablosuna bakın. - 2-5 × 106 hücre, her donör plazmidinden 2 μg (hM4Di-T2A-ZsGreen veya hM3Dq-T2A-ZsGreen) ve 2 μg gRNA plazmitini 100 μL elektroporasyon tamponunda karıştırın ve elektroporasyon için bir küvete aktarın.
NOT: Elektroporasyona devam etmeden önce karışımın iyice karıştığından ve kabarcık içermediğinden emin olun. Farklı cihazlar özel ayarlamalar gerektirebileceğinden, transfeksiyon verimliliğini en üst düzeye çıkarmak için elektroporasyon parametrelerini hücre tipine göre optimize edin. - Nükleofektörü B16 programına ayarlayın ve hedef iNSC'lerin verimli bir şekilde iletilmesini kolaylaştırmak için elektroporasyonu başlatın.
- 6 oyuklu bir plakanın her bir oyuğuna 1 mL 50 μg / mL poli-D-lizin (PDL) ekleyin ve oda sıcaklığında en az 2 saat inkübe edin. Tüm PDL'leri kuyucuklardan çıkarın ve her bir oyuğa 1.5 mL 5 μg / mL laminin ekleyin ve 37 ° C'de 2-4 saat inkübe edin. Kaplamalı plakayı hemen kullanın veya 2-8 °C'de 1 hafta saklayın.
- Elektroporasyonlu hücreleri, PDL ve laminin ile kaplanmış altı oyuklu plakalara aktarın. Kuyucuk başına 2 mL kültür ortamı hacminde kuyu başına yaklaşık 500.000 hücre dağıtın.
- 72 saatlik elektroporasyondan sonra, floresan pozitif hücreleri sıralamak için bir akış sitometresi kullanın.
- DPBS'de ayrışmış hücreleri yeniden askıya alın ve 70 μm'lik bir hücre süzgecinden süzün.
- ZsGreen algılaması için sıralayıcıyı FITC kanalıyla yapılandırın. Temel floresansı tanımlamak için işlenmemiş iNSC'leri negatif kontroller olarak dahil edin.
- Cihazı 20 psi kılıf basıncında 100 μm nozul kullanarak kalibre edin. Tek hücre onayı ile dört yönlü saflık sıralama modu uygulayın.
- PDL ve laminin ile önceden kaplanmış 96 oyuklu plakalarda tek ZsGreen + hücrelerini plakalayın ve ilk büyümeyi desteklemek için oyuk başına 200 μL kültür ortamı ekleyin. Kültür ortamında 7-14 gün koruyun
NOT: Başarılı entegrasyonu gösteren büyüme ve floresan belirtileri için kuyuları günlük olarak izleyin ve pozitif kuyuyu etiketleyin. - Bir GFP filtre seti ile donatılmış ters çevrilmiş bir floresan mikroskobu kullanarak floresan sergileyen tek klonları izole edin. 10x büyütmede ekran klonları. Monoklonal koloniler içeren kuyuları sürekli, tekdüze ZsGreen sinyali ile işaretleyin. Morfolojiyi ve floresan yoğunluğunu belgelemek için parlak alan ve floresan görüntüleri yakalayın.
NOT: Görüntülemeden önce, arka plan floresansını azaltmak için yeni ortamı değiştirin. Düzensiz morfolojiye veya otofloresansa sahip kolonileri hariç tutun. - Kaplanmış 48 oyuklu plakalar üzerindeki pozitif hücreleri genişletin. Daha sonra biri kültür, diğeri genotipleme için olmak üzere iki kısma bölün.
- Aday klonlardan genomik DNA'yı çıkarın. PCR reaksiyonlarını iki primer çifti ile hazırlayın: bir çift ilgilenilen genin yerleştirilmesini doğrulamak için, diğer primer homozigot ve heterozigot klonları ayırt etmek için. Aşağıdaki koşullar altında termosiklasyon gerçekleştirin: 95 ° C'de 5 dakika boyunca ilk denatürasyon; 30 sn için 95 °C, 30 sn için 60 °C ve 45 sn için 72 °C'de 38 döngü; son uzatma 72 ° C'de 7 dakika. PCR ürünlerini %2'lik bir agaroz jeli üzerinde çözün.
NOT: Astarlar için Malzeme Tablosuna bakınız. İlgilenilen genin tek bir 650 bp bandı (primer 1) tarafından yerleştirildiğini onaylayın. Heterozigot klonları tek bir 630 bp bandının varlığıyla ve homozigot klonları bu bandın yokluğuyla tanımlayın (primer 2). - Kaplanmış altı oyuklu plakalar üzerindeki pozitif hücreleri genişletin.
- Hücreleri sindirin ve 250 × g'da 3 dakika santrifüjleyerek fosfat tamponlu tuzlu su (PBS) içinde yıkayın. Hücreleri, flakon başına 2.5 × 106 hücre yoğunluğunda% 10 DMSO ile kriyoprezervasyon ortamında dondurun.
2. Nakledilen DREADD kök hücre türevi öncü hücreler PD model farelere
- Ameliyattan 30 dakika önce immün yetmezliği olan farelere 5 mg / mL (10 mg / kg) konsantrasyonda intraperitoneal desipramin enjeksiyonu uygulayın. Fareleri% 2 izofluran ile uyuşturun.
- 3 μL 6-hidroksidopamin (6-OHDA, 5 μg / μL) tek taraflı stereotaksik enjeksiyonlar yapın. Aşağıdaki koordinatları kullanarak sağ korpus striatumu hedefleyin: anteroposterior = 0.5 mm, lateral = 2.1 mm ve dikey = -3.2 mm.
NOT: 6-OHDA,% 0.2 askorbik asit içeren tuzlu su içinde çözülmelidir. Lezyon şiddetindeki değişkenliği en aza indirmek için hassas hedefleme sağlayın.
DİKKAT: 6-OHDA sitotoksiktir ve hücresel strese neden olan reaktif oksijen türleri üretir. Dikkatli tutun. - Ameliyattan 4 hafta sonra lezyonları doğrulamak için intraperitoneal apomorfin enjeksiyonu (1 mg / kg, salin içinde çözülmüş 0.5 mg / mL) uygulayın. Sonraki deneyler için 30 dakikalık bir gözlem süresi içinde 100'den fazla kontralateral rotasyon sergileyen lezyonlu fareleri seçin.
NOT: Apomorfin, denerve striatumdaki süper duyarlı postsinaptik reseptörleri doğrudan aktive eden ve bilateral nigrostriatal devre aktivitesini dengesiz hale getiren bir dopamin reseptörü agonistidir. Apomorfinin neden olduğu rotasyon, 6-OHDA ile tek taraflı dopaminerjik lezyonların şiddetini değerlendirmeye yarar. - Kaplanmış altı oyuklu plakalarda tohum ve kültür hücreleri (oyuk başına 150.000 hücre). Faz 1 farklılaşma ortamında 10 gün inkübe edin, ortamı her 2 günde bir yenileyin. 11. Günde, Faz 2 farklılaşma ortamına geçin ve her gün ortamı değiştirerek 13. güne kadar inkübasyona devam edin.
NOT: Farklılaşma ortamının karşılaştırması için Malzeme Tablosuna bakın. - Farklılaşmanın 10. ve 13. günlerinde hücreleri hasat edin, ardından 1: 7 oranında karıştırın. Karışımı 100.000 hücre / μL'lik bir konsantrasyonda transplantasyon tamponunda askıya alın.
NOT: Transplantasyon tamponunun karşılaştırması için Malzeme Tablosuna bakınız. - Hazırlanan hücre süspansiyonunun toplam hacmi 4 μL'lik bir stereotaksik enjeksiyonu bir PD faresine uygulayın.
- Hücre nakli sonrası silindir testini çeşitli zaman noktalarında gerçekleştirin. Düz, yansıtıcı olmayan bir yüzeye bir cam kab (çap: 20 cm, yükseklik: 30 cm) yerleştirin. Tam çapı yakalamak için silindirin üzerine bir üstten görüş kamerası yerleştirin.
NOT: Dış görsel uyaranları ortadan kaldırmak için silindiri siyah perdelerle kapatın. - Her fareyi silindirin ortasına yerleştirin ve eşzamanlı video kaydını başlatın (3 dk/oturum). Seanstan sonra fareyi ev kafesine geri koyun.
NOT: Fareleri ışık koşullarında 30 dakika boyunca test odasına alıştırın. Koku alma ipuçlarını ortadan kaldırmak için silindirleri denemeler arasında %70 etanol ile temizleyin. - Farelerin üst ekstremite hareket kabiliyetini 3 dakika boyunca değerlendirin. Bozulmuş ön ayak tarafından yapılan duvar temaslarının sayısını, her iki ön ayak tarafından yapılan toplam temas sayısına göre hesaplayın.
- İntraperitoneal enjeksiyon yoluyla 1.2 mg / kg'lık bir dozda salin veya CNO uygulayın. CNO uygulamasını takiben PD fare modelindeki davranışsal modülasyonu değerlendirmek için silindir testini yapın
NOT: Değerlendirmeye devam etmeden önce yaklaşık 40 dakikalık bir kurtarma süresi bekleyin.
3. Kemogenetik olarak modüle edilmiş hücrelerin in vivo elektrofizyolojik profillemesi
- 250 mg / kg pentobarbital intraperitoneal enjeksiyon ile fareleri uyuşturun. Beyni çıkarın ve hücresel bütünlüğü korumak için hemen buz gibi soğuk sükroz bazlı yapay beyin omurilik sıvısına (s-ACSF) yerleştirin. Bir vibratom kullanarak beyni 300-400 μm kalınlığında bölümlere ayırın.
NOT: Hücresel işlevi korumak için beyni düşük sıcaklıklarda tutmak için hızlı çalışın. Taze beyin kesiti hazırlığında kullanılan s-ACSF için Malzeme Tablosuna bakınız. - Numuneleri 34 °C'de %95O2 ve %5 CO2 ile dengelenmiş ACSF ile dolu bir odaya aktarın ve bu sıcaklığın deney boyunca korunmasını sağlayın.
NOT: ACSF için Malzeme Tablosuna bakın. - Cam pipetleri, elektrot direnci 7 ila 10 MΩ arasında değişen buzlu hücre içi çözelti ile yükleyin.
NOT: Hücre içi çözelti için Malzeme Tablosuna bakınız. Cam pipetler, bir mikropipet çektirmesi18 ile cam kılcal damarlardan yapılır. Deneylere başlamadan önce cam pipetlerde sızıntı olup olmadığını kontrol edin ve uçların hücre zarına nüfuz edecek kadar keskin olduğundan emin olun. Hücre içi çözeltideki sıcaklık dalgalanmalarını en aza indirmek için pipetleri hızlı bir şekilde hazırlayın. - Dilimleri, 34 °C'de oksijenli ACSF ile süper kaynaşmış (2 mL/dak) batık bir kayıt odasına monte edin. Pipetleri kızılötesi diferansiyel girişim kontrast mikroskobu altında motorlu mikromanipülatörler kullanarak konumlandırın. Greft bölgelerindeki yamalı nöronlara hafif emme (1 GΩ'> direnç) uygulayarak tüm hücre konfigürasyonunu oluşturun. Bir yama kelepçesi amplifikatörü kullanarak hücreleri -70 mV'de sıkıştırın; 10 kHz örnekleme hızında (2 kHz'de filtrelenmiş) 8 dakika boyunca temel sEPSC'leri alın ve erişim direncini sürekli olarak izleyin (hedef: <20 MΩ; >25 MΩ veya dalgalanıyorsa >%10) atın).
NOT: İstenmeyen hücre yer değiştirmesini veya yırtılmasını önlemek için emme uygularken uygun basınç kullanın ve iyi bir sızdırmazlık elde etmek için pipet konumunu dikkatlice ayarlayın. Sızdırmazlık kalitesi düşükse, pipeti atın ve tekrar deneyin. - Temel ölçümü tamamladıktan hemen sonra kayıt odasına 50 μM CNO ekleyin ve sEPSC frekansı veya genliğindeki değişiklikleri gözlemlerken 16 dakika daha veri kaydetmeye devam edin.
- CNO'yu kayıt odasından etkili bir şekilde çıkarmak için CNO solüsyonunu yeni ACSF ile değiştirerek bir yıkama prosedürü gerçekleştirin. Sinaptik aktivitedeki herhangi bir iyileşmeyi değerlendirmek için deneyin geri kalanı için veri kaydetmeye devam edin.
Sonuçlar
Şekil 1 , Parkinson hastalığının (PD) bir fare modelinde türetilmiş dopaminerjik öncüllerin fonksiyonel entegrasyonunu ve modülasyonunu değerlendirmek için uyarıcı (hM3Dq) veya inhibitör (hM4Di) DREADD reseptörlerini eksprese eden tasarlanmış insan yeniden programlanmış kök hücreler için bu metodolojik yaklaşımın temel adımlarını göstermektedir. Şekil 2 , hM4Di-T2A-ZsGreen ve hM3Dq-T2A-ZsGreen'in füzyon olmayan yapılarını yeniden programlanmış kök hücrelere dahil etmek ve genotipleme ile doğrulanmak için CRISPR/Cas9 aracılı gen knock-in stratejisini özetlemektedir.
Şekil 3, nakledilen hücrelerde kemogenetik modülasyonun fonksiyonel ve sinaptik etkilerini karakterize eder. Aşılanmış DREADD hücrelerinin etkilerini analiz etmek için davranışsal değerlendirmeler ve elektrofizyolojik kayıtlar yaptık. Şekil 3A, tuzlu su, CNO ve postCNO yıkama koşulları altında kontrol, hM4Di- ve hM3Dq grupları arasında bir silindir testinde kontralateral ön ekstremite hareketi sonuçlarının istatistiksel analizini göstermektedir. CNO uygulaması, hM4Di ile nakledilen hayvanlarda kontralateral ön ayak katılımını azalttı, ancak hM3Dq grubunda salin kontrollerine kıyasla motor performansı artırdı. Şekil 3B-D, spontan uyarıcı postsinaptik akımların (sEPSC'ler) elektrofizyolojik analizini göstermektedir. hM4Di ile nakledilen grup, sinaptik susturmanın göstergesi olan uzun süreli interolay aralıkları ve azalmış tepe genlikleri sergilerken, hM3Dq ile nakledilen hücreler, gelişmiş uyarıcı nörotransmisyon ile tutarlı olarak kısaltılmış aralıklar ve artmış genlikler gösterdi. Şekil 3E,F, nakledilen hücreleri in vivo immünofloresan ile karakterize eder.

Şekil 1: Bir fare modelinde nörodejeneratif hastalıkların tedavisi için yeniden programlanmış kök hücre kaynaklı öncü hücrelerde kemogenetik düzenleme. Bir PD fare modeli oluşturmak ve yeniden programlanmış kök hücre türevli öncü hücrelerde kemogenetik düzenleme yoluyla davranışsal sonuçları değerlendirmek için metodolojik yaklaşımı gösteren bir Akış diyagramı. Adım 1: CRISPR teknolojisini kullanan füzyon olmayan DREADD kök hücre hatlarının inşası. Adım 2: PD fare modelinin kurulması, ardından DREADD kök hücre türevi öncü hücrelerin beyne nakledilmesi. Adım 3: Aşılanmış hücrelerin başarılı entegrasyonunu ve fonksiyonel modülasyonunu doğrulamak için davranışsal ve elektrofizyolojik sonuçların değerlendirilmesi. Kısaltmalar: CRISPR = kümelenmiş düzenli aralıklarla kısa palindromik tekrar; DREADD = yalnızca tasarımcı ilaçlar tarafından aktive edilen tasarımcı reseptörleri; PD = Parkinson hastalığı; 6-OHDA = 6-hidroksidopamin; CNO = klozapin N-oksit. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 2: Füzyon olmayan DREADD eksprese eden kök hücrelerin CRISPR/Cas9 aracılı mühendisliği. (A) Füzyon olmayan hM4Di-T2A-ZsGreen veya hM3Dq-T2A-ZsGreen yapılarının yeniden programlanmış kök hücrelere entegrasyonu için CRISPR/Cas9 aracılı gen knock-in stratejisini gösteren akış şeması. (B) Füzyon olmayan hM4Di-T2A-ZsGreen veya hM3Dq-T2A-ZsGreen'in donör plazmidi, çok aşamalı bir klonlama stratejisi ile modifiye edildi. Hedefleme alel temsili, yeniden programlanmış kök hücrelerde füzyon olmayan hM4Di-T2A-ZsGreen veya hM3Dq-T2A-ZsGreen'in gen knock-in'ini gösterir. Floresan görüntüleri, tasarlanmış hücrelerin homojen yeşil floresan sergilediğini doğrular ve bu da başarılı transgen ekspresyonunu gösterir. Ölçek çubuğu = 200 μm. (C) Genotipleme sonuçları, DREADD yapılarının hedeflenen kök hücre hatlarının genomuna başarılı bir şekilde entegrasyonunu doğrulamaktadır. Bu rakam Wang ve ark.19'dan değiştirilmiştir. Kısaltmalar: gRNA = kılavuz RNA; FACS = floresanla aktive edilen hücre sıralaması; DREADD = yalnızca tasarımcı ilaçları tarafından aktive edilen tasarımcı reseptörleri. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
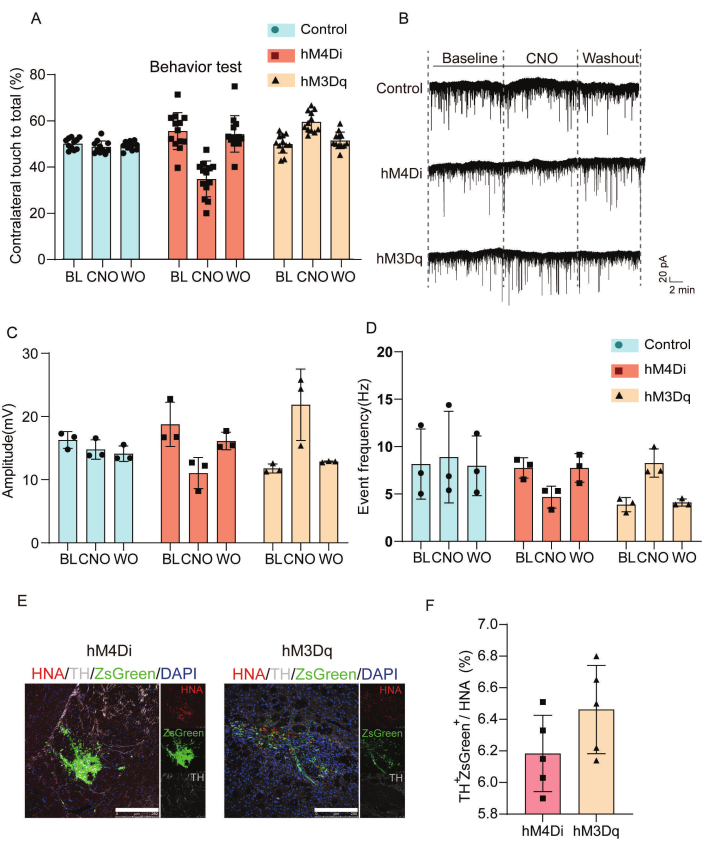
Şekil 3: Aşılanmış hücrelerin entegrasyonunu ve fonksiyonel modülasyonunu doğrulamak için davranışsal ve elektrofizyolojik sonuçların değerlendirilmesi. (A) CNO uygulamasını takiben PD fare modelinde davranışsal modülasyonun değerlendirilmesi; başlangıçta ve transplantasyondan 8 hafta sonra hM4Di, hM3Dq ve kontrol grupları arasında silindir testinde kontralateral ön ayak hareketi sonuçlarını karşılaştıran ayrıntılı istatistiksel analiz, salin ve CNO tedavisinin yanı sıra CNO sonrası yıkama sonrası değerlendirmeler ile karşılaştırılmıştır. (B) Başlangıçta ve CNO (50 μM) tedavisi sırasında analiz edilen kontrol, hM4Di veya hM3Dq gruplarının greftlerinden sEPSC'leri ve CNO yıkama fazlarını ortaya çıkaran tam hücre yama kelepçesi kayıtları. (C) Taban çizgisi, CNO ve CNO yıkaması boyunca sEPSC'ler için tepe genlik ölçümlerinin istatistiksel analizi. (D) Kontrol, hM4Di ve hM3Dq gruplarının greftlerinden kaydedilen sEPSC'lerin olay sıklığı istatistikleri. (E)Aşılanmış hücrelerin karakterizasyonu in vivo immünofloresan yoluyla. Ölçek çubukları = 250 μm. (F) İnsan nükleer antijen ekspresyonuna göre hM4Di ve hM3Dq gruplarında tirozin hidroksilaz ve ZsGreen ekspresyonunun kantitatif analizi. Bu rakam Wang ve ark.19'dan değiştirilmiştir. Kısaltmalar: BL = taban çizgisi; CNO = klozapin N-oksit (CNO, 50 μM) tedavisi; WO = CNO'yu yıkayın; PD = Parkinson hastalığı; sEPSC'ler = spontan uyarıcı postsinaptik akımlar; TH = tirozin hidroksilaz; HNA = insan nükleer antijeni. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Bu protokol, uyarıcı hM3Dq ve inhibitör hM4Di reseptörlerini eksprese etmek için insan yeniden programlanmış kök hücreleri tasarlamak için CRISPR teknolojisini kullandı. Nöronal aktivitenin CNO ile modülasyonu, davranışsal değerlendirmeler ve elektrofizyolojik kayıtlar eşliğinde Parkinson hastalığının fare modellerine hücre nakli yoluyla değerlendirildi.
Kemogenetik olarak yeniden programlanmış kök hücrelerde stabil bir şekilde eksprese edilen, füzyon olmayan DREADD yapılarının üretilmesinde ilk kritik adım, T2A-ZsGreen bisiktronik kaseti içerir. Bununla birlikte, hM3Dq-mCherry ve hM4Di-mCherry7 gibi füzyon proteini eksprese eden plazmitler, bu indüklenmiş nöral kök hücre hattı için etkisizdir. Bunu aşmak için, protokol adımları 1.1-1.2'de ayrıntılı olarak açıklandığı gibi Gibson düzeneği aracılığıyla bir donör plazmidi tasarladık.
İmmün yetmezliği olan farelerin korpus striatumuna tek taraflı olarak stereotaksik 6-OHDA enjeksiyonu uygulayarak bir PD modeli oluşturmak, kesin in vivo modülasyon için çok önemlidir. Hücre nakli ve ilaç tedavileri de dahil olmak üzere tüm çalışma süresi boyunca, bazı hayvanlar beklenmedik ölümler yaşayabilir. Bu nedenle, deney grupları15,17 için yeterli sayıyı sağlamak için ilk örneklem büyüklüğü dikkatli bir şekilde planlanmalıdır.
Hayvanların DREADD modülasyonuna davranışsal tepkilerini değerlendirmek için apomorfin kaynaklı rotasyon testi, silindir testi ve rotarod testi dahil olmak üzere motor fonksiyonla ilgili çeşitli davranışsal testler kullanılabilir. Burada, bir silindirin20 duvarları ile ön ayak temasını kantitatif olarak ölçen silindir testini kullandık. Silindir testi, nöral hasardan kaynaklanan üst ekstremite kullanımındaki değişiklikleri değerlendirerek, CNO'nun motor fonksiyonu nasıl geliştirebileceğine dair değerli bilgiler sağlar.
Konak nöral devresi içinde kemogenetik olarak yeniden programlanmış donör hücrelerin fonksiyonel entegrasyonu ve sinaptik bağlantısı, PD16 gibi nörodejeneratif bozukluklar için terapötik etkinliğin kritik belirleyicileridir. Transplantasyon sonrası beyin dilimleri üzerinde gerçekleştirilen tüm hücre yama-kelepçe kayıtları, bu tasarlanmış hücrelerin doğal nöronal devrelerle nasıl etkileşime girdiğine dair içgörüler sağlar. Striatumdaki orta dikenli nöronlar (MSN'ler), dopaminerjik sinyallemenin aşağı akış hedefleridir.
Yama kelepçesi kayıt MSN'lerini kullanarak, DREADD ile modifiye edilmiş hücrelerin nöral devrelere nasıl entegre olduğunu ve işlevlerini nasıl etkilediğini kesin olarak değerlendirebiliriz21. Farklı prosedürel aşamalar için yapay beyin omurilik sıvısı (ACSF) bileşimi, yama klemp için kritik öneme sahiptir. Dilim hazırlama sırasında, sükroz bazlı bir yapay beyin omurilik sıvısı (s-ACSF) şiddetle tavsiye edilir. Sükrozun hiperozmotik özellikleri, hücresel canlılık için gerekli olan iyonik gradyanları korurken, kesit alma sırasında nöronal şişmeyi azaltır. Elektrot üretimi ve kalite kontrolü, kayıt kararlılığını doğrudan belirler. 7-10 MΩ'luk uç dirençlerine çekilen borosilikat cam pipetler, sürekli sEPSC kayıtları için tartışılmaz bir ön koşulu temsil eder. 5 MΩ'un altındaki dirençlere sahip yetersiz pipetler, pipet çözeltisi ile sitoplazma arasında hızlandırılmış difüzyon değişimi sergiler ve bu da 3-5 dakika içinde aşamalı akım akışına yol açar.
Bununla birlikte, bu çalışma, tasarlanmış iNSC-DAP yoluyla PD farelerinde motor davranışın ve sinaptik aktivitenin kemogenetik modülasyonunu, çift stereotaksik girişimlerle ilgili önemli prosedürel yıpranmayı ve kronik CNO uygulamasını, özellikle cerrahi standardizasyon ile ilgili olarak, immün sistemi baskılanmış modellerde rafine ksenotransplantasyon paradigmalarına olan ihtiyacın altını çizmektedir. CRISPR/Cas9 aracılı DREADD reseptör mühendisliğini davranışsal testler (silindir testi) ve tüm hücre yama-kelepçe elektrofizyolojisi yoluyla devre düzeyinde sorgulama ile birleştiren bu strateji, nöron alt tipine özgü bir nöromodülasyon planı sunar ve nörodejeneratif bozukluklar için hassas hücre tedavilerini ilerletmek için çok yönlü bir araç seti sunar.
Açıklamalar
Yazarların açıklanacak herhangi bir çıkar çatışması yoktur.
Teşekkürler
Bu çalışma, Pekin Doğa Bilimleri Vakfı (7242068), Çin Ulusal Doğa Bilimleri Vakfı (82171250), Pekin Belediye Sağlık Komisyonu Fonu (PXM2020_026283_000005) ve Pekin'e bağlı Tıbbi Araştırma Enstitülerinin Teknoloji Geliştirme Projesi (11000023T000002036310) tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 2 x Rapid Taq Master Mix | Vazyme | P222-01 | used for genotyping analysis |
| 2×Seamless Cloning Mix | Biomed Gene Tech. | CL117-01 | used for plasmid construction |
| 6-OHDA | Sigma-Aldrich | H4381 | used for establishing PD mice model |
| AAVS1-Pur-CAG-EGFP | Addgene | 80945 | used as control |
| AAVS1-Pur-CAG-hM4Di-mCherry | Addgene | 80947 | original plasmid for construction of hM4Di-T2A-ZsGreen |
| AAVS1-Pur-CAG-hM3Dq-mCherry | Addgene | 80948 | original plasmid for construction of hM3Dq-T2A-ZsGreen |
| AAVS1-CAG-hM4Di-T2A-ZsGreen | N/A | N/A | Constructed donor plasmid based on #80947 |
| AAVS1-CAG-hM3Dq-T2A-ZsGreen | N/A | N/A | Constructed donor plasmid based on #80948 |
| Accutase | Invitrogen | A11105-01 | Used for digesting cells |
| AMAXA Nucleofector | Lonza | AAD-1001S | |
| Apomorphine | Sigma-Aldrich | A4393 | |
| Artificial cerebrospinal fluid (ACSF) | N/A | N/A | 125 mM NaCl, 2.5 mM KCl, 2 mM CaCl2, 1.25 mM NaH2PO4, 1 mM MgSO4, 25 mM glucose, and 26 mM NaHCO3 |
| Ascorbic acid | Sigma-Aldrich | 1043003 | |
| B-27 Supplement | Gibco | 17504044 | |
| BDNF | Peprotech | 450-02 | |
| cAMP | Sigma-Aldrich | D0627 | |
| CHIR99021 | Yeasen | 53003ES10 | |
| Clozapine-N-oxide | Enzo | BML-NS105 | |
| DAPT | Sigma-Aldrich | D5942 | |
| Desipramine | Sigma-Aldrich | D3900 | |
| D-glucose | Sigma-Aldrich | G5767 | |
| DMEM/F12 | Gibco | 11330-032 | |
| DMEM/F12 | Gibco | 11320-033 | |
| DMSO | Sigma-Aldrich | D2650 | |
| FGF8 | Peprotech | 100-25 | |
| GDNF | Peprotech | 450-10 | |
| GlutaMax | Gibco | 35050-061 | |
| Hank’s Balanced Salt Solution (HBSS) | Gibco | 14175095 | |
| Human leukemia inhibitory factor (hrLIF) | Millipore | LIF1010 | |
| Iced intracellular fluid | N/A | N/A | 130 mM K-gluconate, 16 mM KCl, 0.2 mM EGTA, 2 mM MgCl2, 10 mM HEPES, 4 mM Na2-ATP, 0.4 mM Na3-GTP, 0.3% of neurobiotin |
| KnockOut Serum Replacement | Gibco | 10828028 | |
| Laminin | Roche | 11243217001 | |
| Micropipette Puller | Sutter Instrument Company | P-1000 | |
| N-2 Supplement | Thermo Fisher | 17502048 | |
| Neurobasal-A Medium | Gibco | 10888-022 | |
| Non-essential amino acids (NEAA) | Gibco | 11140-050 | |
| PBS | Gibco | 10010023 | |
| pCLAMP 11 software suite | Molecular Devices | N/A | Patch-clamp electrophysiology data acquisition and analysis software |
| Phase 1 differentiation medium | N/A | N/A | 96% DMEM/F12 (Gibco, 11320-033), 1% B-27 Supplement, 1% N-2 Supplement, 1% NEAA, 1% GlutaMax, 1 µM SAG1, and 100 ng/mL FGF8 |
| Phase 2 differentiation medium | N/A | N/A | 96% DMEM/F12 (Gibco, 11320-033), 1% B-27 Supplement, 1% N-2 Supplement, 1% NEAA, and 1% GlutaMax, 10 ng/mL BDNF, 10 ng/mL GDNF, 1 ng/mL TGF-βIII, 10 µM DAPT, 0.2 mM ascorbic acid, and 0.5 mM cAMP. |
| Poly-D-lysine hydrobromide (PDL) | Sigma-Aldrich | P7886 | |
| Primers for genotyping | N/A | N/A | Insertion Foward: TCTTCACTCGCTGGGTTCCCTT; Insertion Reverse: CCTGTGGGAGGAAGAGAAGAGGT; Homozygosity Foward:CGTCTCCCTGGCTTTAGCCA; Homozygosity Reverse: GATCCTCTCTGGCTCCATCG |
| pX458 | Addgene | 152199 | |
| SAG1 | Enzo | ALX-270-426-M01 | |
| SB431542 | Yeasen | 53004ES50 | |
| sucrose-based artificial cerebrospinal fluid (s-ACSF) | 234 mM sucrose, 2.5 mM KCl, 26 mM NaHCO3, 1.25 mM NaH2PO4, 11 mM Dglucose, 0.5 mM CaCl2, and 10 mM MgSO4 | ||
| Stem cell culture media | N/A | N/A | 48% DMEM/F12 (Gibco, 11330-032) and 48% Neurobasal, with the addition of 1% B27, 1% N2, 1% NEAA, 1% GlutaMax, 10 ng/mL hrLIF, 2 µM SB431542, and 3 µM CHIR99021 |
| TGF-βIII | Peprotech | 100-36E | |
| Transplantation buffer | N/A | N/A | HBSS buffer with 5 g/L D-glucose, 100 ng/mL BDNF, 100 ng/mL GDNF, and 0.2 mM ascorbic Acid |
| Vibratome | Leica | VT1000 S | |
| Whole-cell patch-clamp | Molecular Devices | MultiClamp700B |
Referanslar
- Thiel, G. Designer receptors exclusively activated by designer drugs. Humana Press (2015).
- Roth, B. L. Dreadds for neuroscientists. Neuron. 89 (4), 683-694 (2016).
- Gomez, J. L. et al. Chemogenetics revealed: DREADD occupancy and activation via converted clozapine. Science. 357 (6350), 503-507 (2017).
- Chehelgerdi, M. et al. Exploring the promising potential of induced pluripotent stem cells in cancer research and therapy. Mol Cancer. 22 (1), 189 (2023).
- Song, J., Patel, R. V., Sharif, M., Ashokan, A., Michaelides, M. Chemogenetics as a neuromodulatory approach to treating neuropsychiatric diseases and disorders. Mol Ther. 30 (3), 990-1005 (2022).
- Parmar, M., Grealish, S., Henchcliffe, C. The future of stem cell therapies for Parkinson disease. Nat Rev Neurosci. 21 (2), 103-115 (2020).
- Dell'anno, M. T. et al. Remote control of induced dopaminergic neurons in Parkinsonian rats. J Clin Invest. 124 (7), 3215-3229 (2014).
- Chen, Y. et al. Chemical control of grafted human PSC-derived neurons in a mouse model of Parkinson's disease. Cell Stem Cell. 18 (6), 817-826 (2016).
- Bjorklund, A. Parmar, M. Dopamine cell therapy: From cell replacement to circuitry repair. J Parkinsons Dis. 11 (S2), S159-S165 (2021).
- Alcacer, C. et al. Chemogenetic stimulation of striatal projection neurons modulates responses to Parkinson's disease therapy. J Clin Invest. 127 (2), 720-734 (2017).
- Alexander, G. M. et al. Remote control of neuronal activity in transgenic mice expressing evolved G protein-coupled receptors. Neuron. 63 (1), 27-39 (2009).
- Stachniak, T. J., Ghosh, A., Sternson, S. M. Chemogenetic synaptic silencing of neural circuits localizes a hypothalamus midbrain pathway for feeding behavior. Neuron. 82 (4), 797-808 (2014).
- Kang, H. J., Minamimoto, T., Wess, J., Roth, B. L. Chemogenetics for cell-type-specific modulation of signalling and neuronal activity. Nat Rev Methods Primers. 3 (1), 93 (2023).
- Miyanishi, K. et al. Behavioral tests predicting striatal dopamine level in a rat hemi-Parkinson's disease model. Neurochem Int. 122, 38-46 (2019).
- Zheng, X. et al. Human IPSC-derived midbrain organoids functionally integrate into striatum circuits and restore motor function in a mouse model of Parkinson's disease. Theranostics. 13 (8), 2673-2692 (2023).
- Xiong, M. et al. Human stem cell-derived neurons repair circuits and restore neural function. Cell Stem Cell. 28 (1), 112-126.e116 (2021).
- Yuan, Y. et al. Dopaminergic precursors differentiated from human blood-derived induced neural stem cells improve symptoms of a mouse Parkinson's disease model. Theranostics. 8 (17), 4679 (2018).
- Zhu, M. et al. Preparation of acute spinal cord slices for whole-cell patch-clamp recording in substantia gelatinosa neurons. J Vis Exp. (143) (2019).
- Wang, X., Han, D., Zheng, T., Ma, J., Chen, Z. Modulation of human induced neural stem cell-derived dopaminergic neurons by DREADD reveals therapeutic effects on a mouse model of Parkinson's disease. Stem Cell Res Ther. 15 (1), 297 (2024).
- Iancu, R., Mohapel, P., Brundin, P., Paul, G. Behavioral characterization of a unilateral 6-OHDA-lesion model of Parkinson's disease in mice. Behav Brain Res. 162 (1), 1-10 (2005).
- Surmeier, D. J. et al. The role of dopamine in modulating the structure and function of striatal circuits. Prog Brain Res. 183, 148-167 (2010).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır