Method Article
神経変性疾患の治療における再プログラム幹細胞由来前駆細胞における化学遺伝学的制御
要約
ここでは、化学的に再プログラムされた幹細胞をドーパミン作動性前駆細胞に分化させ、パーキンソン病のマウスモデルに移植し、移植された細胞の成功した統合と機能的有効性を確認するために、これらの細胞を正確なニューロン調節を達成するためのプロトコルについて説明します。
要約
デザイナードラッグによって排他的に活性化されるデザイナー受容体(DREADD)と幹細胞ベースの治療の統合は、正確なニューロン調節のための高度な戦略を示しています。ここでは、興奮性(hM3Dq)または抑制性(hM4Di)DREADD受容体を発現するCRISPR改変ヒト再プログラム幹細胞を利用して、パーキンソン病(PD)のマウスモデルにおける移植されたドーパミン作動性前駆体の機能統合と調節を評価しました。主なステップには、非融合性DREADD発現幹細胞株の作製、中脳ドーパミン作動性前駆体への分化、およびこれらの細胞を6-ヒドロキシドーパミン(6-OHDA)損傷マウスの線条体への移植が含まれていました。移植した細胞の影響を解析するために、行動評価と電気生理学的記録を行いました。シリンダーテストなどの行動テストでは、クロザピン-N-オキシド(CNO)投与後の運動機能の有意な調節が示されました。.具体的には、hM4Diの活性化は対側の前肢の動きを減少させ、hM3Dqの活性化は運動行動の亢進と関連していました。電気生理学的記録により、明確なシナプス応答が明らかになりました。hM4Diの活性化は、自然興奮性シナプス後電流(sEPSC)のイベント間間隔を増加させ、ピーク振幅を減少させましたが、hM3Dqの活性化は、興奮性シグナル伝達の増強を反映して、イベント間間隔を減少させ、ピーク振幅を増加させました。要約すると、行動評価と電気生理学的評価の統合は、化学的に再プログラムされた幹細胞を宿主の神経回路に正確に機能的に組み込むことを検証します。
概要
デザイナー医薬品によって独占的に活性化されるデザイナー受容体(DREADD)は、他の方法では不活性な合成リガンド1によって選択的に活性化され得る遺伝子操作されたGタンパク質共役受容体です1。化学遺伝学的アプローチは、研究者が神経回路の接続性を高精度で調査し、特定の脳領域または細胞タイプの選択的な活性化または阻害を通じてin vivoおよびin vitroの両方の細胞機能の理解を深めることにより、神経科学において不可欠なツールとなっています2,3。
幹細胞ベースの治療は、神経変性疾患を治療するための有望な戦略です。移植片細胞の有効性は、適切な統合、生存、および宿主組織への機能的寄与に依存しています。制御されていない細胞活動は、腫瘍形成4を含む悪影響につながる可能性があります。移植後のこれらの細胞の正確な制御が必要です。ヒトの再プログラム幹細胞および誘導ニューロンにおけるDREADD技術を活用することで、デザイナー医薬品CNO 2,5の投与によりニューロンの活動を正確に制御する手段が得られます。ドーパミン作動性ニューロンの喪失を特徴とするパーキンソン病(PD)の文脈では、幹細胞由来のドーパミン作動性ニューロンの活動を操作することは、げっ歯類モデル6,7,8,9,10におけるシナプス入力と投射パターンを調査するために重要です。興奮性hM3Dq受容体と抑制性hM4Di受容体をこれらのモデルに組み込むことで、神経活動の精密な調節が可能になる11,12。
動物の行動評価と電気生理学的記録の組み合わせにより、 in vivo13の移植細胞に対する化学遺伝学的調節の影響を包括的に評価することができます。アポモルヒネ誘発性回転、シリンダー試験、およびロータロッド試験などの行動評価は、運動協調を評価し、PD14の実験モデルに関連する運動機能の変化に関する洞察を提供します。パッチクランプ記録などの電気生理学的技術は、シナプス応答と活動電位のリアルタイムモニタリングを可能にし、移植された細胞が既存の神経ネットワークにどのように統合されるかを包括的に把握することを可能にする15。行動評価と電気生理学的評価を組み合わせることにより、化学遺伝学的調節が宿主神経回路内のこれらの細胞の統合と機能にどのように影響するかを調べることができる16。予備的な知見は、CNO投与が移植細胞のニューロン活動を効果的に調節し、その結果、動物モデルで機能的転帰が改善されることを示唆しています。
このプロトコルでは、ヒトの再プログラム化された幹細胞を、クラスター化された規則的に間隔を空けた短い回文反復(CRISPR)技術を使用して、hM3DqまたはhM4Di受容体を発現するように操作しました。改変された再プログラム幹細胞を中脳ドーパミン作動性前駆細胞に分化させた後、これらの細胞をPDのマウスモデルに移植し、行動評価と電気生理学的記録を使用して宿主神経回路内での統合と機能調節を評価しました。
プロトコル
すべての動物実験は、北京実験動物科学協会および国立実験動物の管理と使用のための衛生研究所が定めたガイドラインに従って行われました。ヒト末梢血単核細胞(PBMC)は、以前の研究17で説明されているように、書面によるインフォームドコンセントを得て健康なドナーから入手されました。
1. 非融合DREADD幹細胞株の構築
- DREADD ドナープラスミドを構築します。
注:消化部位は、ベクター配列に従って設計する必要があります。フラグメントは、アセンブリ効率を高めるために、フラグメントアームに一致する20〜30 bpのオーバーラップで合成および増幅する必要があります。- T2A-ZsGreenフラグメント(フラグメントI)を設計および合成します。
- PCRを用いて、元のプラスミドからhM3Dq/hM4Di-T2Aフラグメントを増幅します(フラグメントII)。PCR 反応液 (総容量 50 μL ) を、1x PCR バッファー、各 dNTP ミックス 200 μM、0.5 μM のフォワードおよびリバースプライマー、10-50 ng のプラスミド DNA テンプレート、および 1.25 U のハイフィデリティ DNA ポリメラーゼを含むようにセットアップします。次の条件下で熱サイクルを実行します:テンプレートを完全に変性させるために、98°Cで2.75分間の初期変性。98 °C で 15 秒 (変性)、60 °C で 30 秒 (プライマーアニーリング)、72 °C で 60 秒 (延長) で構成される 32 回の増幅サイクル。72°Cで7分間の最終延長。
- ベクタープラスミドを適切な酵素で消化し、直鎖状化されたベクターを取得します。アガロースゲル電気泳動によりすべてのフラグメントを精製し、分光光度計を用いて定量します。
注:ここでは、元のプラスミドを MluI および SalIで消化しました。
- 50-100 ngの直鎖状ベクター、Fragment I、およびFragment IIを1:3:3のモル比で穏やかに混合し、2x Cloning Mixも併用します。混合物を55°Cで1時間インキュベートし、Gibson Assemblyによる相同組換えを促進します。
- AAVS1部位を標的とするガイドRNAをpX458ベクターの BbsI 部位に挿入します。
注:サンガーシーケンシングを使用して、構築したすべてのプラスミドの配列検証を実行します。 - 再プログラムされた幹細胞を培地に保持し、細胞密度が2〜5 × 106 細胞/mLを目指します。
注:ここで使用された再プログラム化された幹細胞は、以前の研究17で説明されているように、ヒトPBMCから誘導されました。細胞の状態はエレクトロポレーションの効率に大きく影響するため、細胞の健康状態を監視することは不可欠です。メディアの比較については、 資料の表 を参照してください。 - 2-5細胞×106 細胞、各ドナープラスミド(hM4Di-T2A-ZsGreenまたはhM3Dq-T2A-ZsGreen)2 μg、および2 μgのgRNAプラスミドを100 μLのエレクトロポレーションバッファーに混合し、エレクトロポレーション用のキュベットに移します。
注:エレクトロポレーションに進む前に、混合物が十分に混合され、気泡がないことを確認してください。細胞の種類に基づいてエレクトロポレーションパラメータを最適化し、トランスフェクション効率を最大化します。これは、デバイスによって特定の調整が必要な場合があるためです。 - NucleofectorをB16プログラムに設定し、エレクトロポレーションを開始して、標的iNSCの効率的なトランスフェクションを促進します。
- 50 μg/mL ポリ-D-リジン(PDL)1 mLを6ウェルプレートの各ウェルに1 mL加え、室温で少なくとも2時間インキュベートします。ウェルからすべてのPDLを取り出し、各ウェルに5 μg/mLラミニン1.5 mLを加え、37°Cで2〜4時間インキュベートします。コーティングされたプレートはすぐに使用するか、2〜8°Cで1週間保管してください。
- エレクトロポレーションされた細胞を、PDLとラミニンでコーティングされた6ウェルプレートに移します。ウェルあたり約500,000個の細胞を、ウェルあたり2 mLの培地に分配します。
- エレクトロポレーションの72時間後、フローサイトメーターを使用して蛍光陽性細胞を選別します。
- 解離した細胞をDPBSに再懸濁し、70 μmのセルストレーナーでろ過します。
- ZsGreen検出用のFITCチャネルを使用してソーターを構成します。未処理のiNSCをネガティブコントロールとして含め、ベースライン蛍光を定義します。
- 100 μmのノズルを使用して、20 psiのシース圧力で装置を校正します。シングルセル確認による4ウェイ純度ソートモードを実装します。
- PDLとラミニンでプレコートされた96ウェルプレートで単一のZsGreen+ 細胞をプレートし、ウェルあたり200 μLの培地を添加して初期増殖をサポートします。培地で7〜14日間保持します
注:ウェルを毎日監視して、成長の兆候と、統合が成功したことを示す蛍光がないか確認し、ポジティブウェルにラベルを付けます。 - GFPフィルターセットを装備した倒立型蛍光顕微鏡を使用して、蛍光を示す単一クローンを単離します。10倍の倍率でクローンをスクリーニングします。モノクローナルコロニーを含むウェルを、持続的で均一なZsGreenシグナルでマークします。明視野と蛍光の画像をキャプチャして、形態と蛍光強度を文書化します。
注:イメージングの前に、バックグラウンド蛍光を減らすために新しい培地を交換してください。不規則な形態または自家蛍光のコロニーを除外します。 - コーティングされた48ウェルプレート上のポジティブセルを増殖させます。次に、培養用とジェノタイピング用の2つの部分に分割します。
- 候補クローンからゲノムDNAを抽出します。2つのプライマーペアでPCR反応を調製します:1つのペアは目的の遺伝子の挿入を確認するため、もう1つのプライマーはホモ接合型とヘテロ接合型のクローンを区別するためです。次の条件下で熱サイクルを実行します:95°Cで5分間の初期変性。95 °C で 30 秒、60 °C で 30 秒、72 °C で 45 秒の 38 サイクル。72°Cで7分間の最終延長。PCR産物を2%アガロースゲルで分離します。
注意: プライマーについては 、材料の表 を参照してください。目的の遺伝子の挿入を単一の650 bpバンド(プライマー1)で確認します。ヘテロ接合型クローンは 630 bp の単一のバンドが存在することで同定され、ホモ接合型クローンはこのバンドが存在しないことで同定されます (プライマー 2)。 - コーティングされた6ウェルプレート上の陽性細胞を増殖させます。
- 細胞を消化し、リン酸緩衝生理食塩水(PBS)で250 × g で3分間遠心分離して洗浄します。バイアルあたり2.5×106 細胞の密度で、10% DMSOを含む凍結保存培地で細胞を凍結します。
2. DREADD幹細胞由来前駆細胞をPDモデルマウスに移植
- 手術の30分前に、免疫不全マウスに5 mg / mL(10 mg / kg)の濃度でデシプラミンの腹腔内注射を投与します。.マウスに2%イソフルランを麻酔します。
- 3 μL の 6-ヒドロキシドーパミン (6-OHDA、5 μg/μL) の片側定位固定注射を行います。右線条体を前後=0.5mm、横=2.1mm、垂直=-3.2mmの座標で狙いを定めます。
注:6-OHDAは、0.2%アスコルビン酸を含む生理食塩水に溶解する必要があります。病変の重症度のばらつきを最小限に抑えるために、正確なターゲティングを確保します。
注意:6-OHDAは細胞毒性があり、細胞ストレスを誘発する活性酸素種を生成します。取り扱いには注意してください。 - アポモルヒネ (1 mg/kg、生理食塩水に溶解した 0.5 mg/mL) の腹腔内注射を投与して、手術の 4 週間後に病変を検証します。その後の実験のために、30分間の観察期間内に100回以上の対側回転を示す病変マウスを選択します。
注:アポモルヒネはドーパミン受容体アゴニストであり、除神経線条体の超感受性シナプス後受容体を直接活性化し、両側の黒質線条体回路活性のバランスを崩します。.アポモルヒネ誘発性回転は、6-OHDAによる片側性ドーパミン作動性病変の重症度を評価するのに役立ちます。 - コーティングされた6ウェルプレート(ウェルあたり150,000細胞)内のシード細胞および培養細胞。フェーズ1分化培地で10日間インキュベートし、2日ごとに培地をリフレッシュします。11日目に、フェーズ2分化培地に切り替え、13日目までインキュベーションを続け、毎日培地を交換します。
注:差別化媒体の比較については、 材料の表 を参照してください。 - 分化の10日目と13日目に細胞を採取し、1:7の比率で混合します。混合物を移植緩衝液に100,000細胞/μLの濃度で懸濁します。
注:移植バッファーの比較については、 材料の表 を参照してください。 - 調製した細胞懸濁液の総容量4μLの定位固定剤をPDマウスに投与します。
- 細胞移植後のさまざまな時点でシリンダーテストを実行します。ガラスビーカー(直径20cm、高さ30cm)を反射しない平らな面に置きます。トップビューカメラをシリンダーの上に置いて、全径をキャプチャします。
注意: 外部の視覚刺激を排除するために、シリンダーを黒いカーテンで囲みます。 - 各マウスをシリンダーの中央に置き、同時ビデオ録画を開始します(3分/セッション)。セッション後、マウスをホームケージに戻します。
注:マウスを光条件下で30分間試験室に順応させます。試験の合間に70%エタノールでシリンダーを洗浄し、嗅覚の手がかりを排除します。 - マウスの上肢の動き能力を3分間評価します。障害のある前肢が行う壁の接触の数を、両方の前肢が行う接触の総数に対して計算します。
- 腹腔内注射により、生理食塩水またはCNOを1.2 mg / kgの用量で投与します。.CNO投与後のPDマウスモデルの行動調節を評価するためのシリンダーテストを実施します
注: 評価を続行する前に、約 40 分の回復時間を確保してください。
3. 化学遺伝学的に調節された細胞のin vivo 電気生理学的プロファイリング
- 250 mg / kgペントバルビタールの腹腔内注射によりマウスに麻酔をかけます。.脳を取り出し、すぐに氷のように冷たいショ糖ベースの人工脳脊髄液(s-ACSF)に入れて、細胞の完全性を維持します。ビブラートームを使用して、脳を300〜400μmの厚さのセクションにスライスします。
注:細胞機能を維持するために、脳を低温に保つために迅速に作業してください。フレッシュブレイン切片の作製に用いるs-ACSFについては 、表の資料 をご覧ください。 - サンプルを、95% O2 と 5% CO2 で平衡化した ACSF で満たされたチャンバーに 34 °C で移し、この温度が実験全体で維持されるようにします。
メモ: ACSF の 材料の表 を参照してください。 - ガラスピペットに、電極抵抗が7〜10MΩの範囲の氷細胞内溶液をロードします。
注:細胞内溶液の 材料表 を参照してください。ガラスピペットは、マイクロピペットプーラー18によってガラスキャピラリーから作られる。実験を始める前に、ガラスピペットに漏れがないか確認し、先端が細胞膜を貫通するほど鋭利であることを確認してください。細胞内溶液の温度変動を最小限に抑えるために、ピペットを迅速に調製してください。 - スライスを、34°Cで酸素化ACSFとスーパーフュージョン(2 mL/分)した水中記録チャンバーにマウントします。 電動マイクロマニピュレーターを使用して、赤外線微分干渉コントラスト顕微鏡下でピペットを配置します。グラフト領域内のパッチニューロンに穏やかな吸引(抵抗>1GΩ)を適用することにより、全細胞構成を確立します。パッチクランプアンプを使用してセルを-70mVでクランプします。ベースラインsEPSCを10kHzのサンプリングレートで8分間取得し(2kHzでフィルタリング)、アクセス抵抗を継続的に監視します(目標:<20MΩ、>25MΩまたは変動>10%)場合は破棄します。
注:吸引を適用するときは、望ましくない細胞の変位や破裂を避けるために適切な圧力を使用し、ピペットの位置を慎重に調整して良好なシールを実現します。シールの品質が悪い場合は、ピペットを廃棄して再試行してください。 - ベースライン測定が完了した直後に50 μM CNOを記録チャンバーに追加し、sEPSCの周波数または振幅の変化を観察しながら、さらに16分間データの記録を続けます。
- CNO溶液を新しいACSFに交換してウォッシュアウト手順を実行し、記録チャンバーからCNOを効果的に除去します。実験の残りの部分でデータの記録を続けて、シナプス活動の回復を評価します。
結果
図1 は、興奮性(hM3Dq)または抑制性(hM4Di)DREADD受容体を発現する人工ヒト再プログラム幹細胞に対するこの方法論的アプローチの主要なステップを示しており、パーキンソン病(PD)のマウスモデルにおいて、誘導されたドーパミン作動性前駆体の機能的統合と調節を評価しています。 図2 は、hM4Di-T2A-ZsGreenおよびhM3Dq-T2A-ZsGreenの非融合コンストラクトを再プログラムされた幹細胞に導入し、ジェノタイピングによって検証するためのCRISPR/Cas9を介した遺伝子ノックイン戦略の概要を示しています。
図3は、移植細胞における化学遺伝学的調節の機能的およびシナプス的効果を特徴付けています。私たちは、移植されたDREADD細胞の影響を分析するために、行動評価と電気生理学的記録を実施しました。図 3A は、生理食塩水、CNO、および CNO 後のウォッシュアウト条件下で、対照群、hM4Di-、および hM3Dq 群にわたるシリンダー試験における対側前肢運動の結果の統計分析を示しています。CNO投与は、hM4Di移植動物では対側前肢の関与を減少させたが、hM3Dq群では生理食塩水対照群と比較して運動能力が向上した。図3B-Dは、自発的な興奮性シナプス後電流(sEPSC)の電気生理学的解析を示しています。hM4Di移植群は、シナプスサイレンシングを示すイベント間間隔の延長とピーク振幅の減少を示したが、hM3Dq移植細胞は、興奮性神経伝達の亢進と一致する間隔の短縮と振幅の増加を示した。図3E、Fは、免疫蛍光法によりin vivoで移植された細胞を特徴付けています。

図1:マウスモデルにおける神経変性疾患の治療のための再プログラムされた幹細胞由来前駆細胞の化学遺伝学的調節。 PDマウスモデルを確立し、再プログラムされた幹細胞由来前駆細胞の化学遺伝学的調節による行動結果を評価するための方法論的アプローチを示すフロー図。 ステップ1:CRISPR技術を利用した非融合DREADD幹細胞株の構築。 ステップ2:PDマウスモデルの確立に続いて、DREADD幹細胞由来前駆細胞の脳への移植。 ステップ3:移植された細胞の成功した統合と機能調節を検証するための行動および電気生理学的結果の評価。略語:CRISPR =クラスター化された規則的に間隔を空けた短い回文反復。DREADD =デザイナードラッグによってのみ活性化されるデザイナー受容体。PD = パーキンソン病;6-OHDA = 6-ヒドロキシドーパミン;CNO =クロザピン N-オキシド。 この図の拡大版を表示するには、ここをクリックしてください。

図2:非融合性DREADD発現幹細胞のCRISPR/Cas9を介したエンジニアリング。 (A)非融合性hM4Di-T2A-ZsGreenまたはhM3Dq-T2A-ZsGreenコンストラクトを再プログラムされた幹細胞に統合するためのCRISPR/Cas9を介した遺伝子ノックイン戦略を示すフローチャート。(B)非融合hM4Di-T2A-ZsGreenまたはhM3Dq-T2A-ZsGreenのドナープラスミドを、多段階クローニング戦略により修飾した。ターゲティング対立遺伝子の表現は、再プログラムされた幹細胞における非融合hM4Di-T2A-ZsGreenまたはhM3Dq-T2A-ZsGreenの遺伝子ノックインを示しています。蛍光画像は、改変された細胞が均質な緑色蛍光を示すことを確認し、導入遺伝子の発現が成功したことを示しています。スケールバー = 200 μm. (C) ジェノタイピングの結果は、DREADDコンストラクトが標的幹細胞株のゲノムに成功したことを確認しています。この図は、Wang et al.19から修正されました。略語:gRNA =ガイドRNA;FACS = 蛍光活性化細胞ソーティング;DREADD = デザイナードラッグによってのみ活性化されるデザイナー受容体。 この図の拡大版を表示するには、ここをクリックしてください。
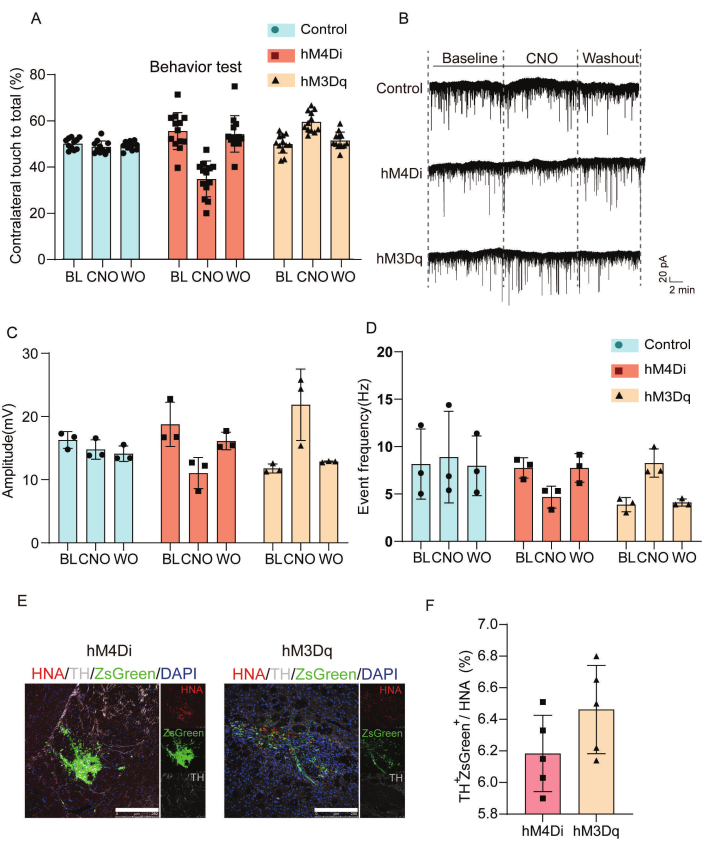
図3:移植細胞の統合と機能調節を確認するための行動および電気生理学的転帰の評価。 (A)CNO投与後のPDマウスモデルにおける行動調節の評価。ベースライン時および移植後8週間のhM4Di、hM3Dq、および対照群のシリンダーテストにおける対側前肢運動の結果と、生理食塩水およびCNO治療後、およびCNOウォッシュアウト後に実施された評価を比較した詳細な統計分析。(B)ベースライン時およびCNO(50μM)治療中に分析されたコントロール群、hM4Di、またはhM3Dq群の移植片からのsEPSCと、CNOウォッシュアウトフェーズを明らかにする全細胞パッチクランプ記録。(C)ベースライン、CNO、およびCNOウォッシュアウトにわたるsEPSCのピーク振幅測定値の統計分析。(D)コントロール群、hM4Di群、hM3Dq群のグラフトから記録されたsEPSCのイベント頻度統計。(E)免疫蛍光法による in vivo での移植細胞の特性評価。スケールバー = 250 μm. (F) ヒト核抗原発現に対する、hM4DiおよびhM3Dq基におけるチロシンヒドロキシラーゼおよびZsGreenの発現の定量的分析。この図は、Wang et al.19から修正されました。略語:BL =ベースライン;CNO = クロザピン N-オキシド (CNO, 50 μM) 処理;WO = CNO を洗い流します。PD = パーキンソン病;sEPSCs = 自発的な興奮性シナプス後電流;TH =チロシンヒドロキシラーゼ;HNA = ヒト核抗原。 この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
このプロトコルは、CRISPR技術を利用して、ヒトの再プログラムされた幹細胞を操作して、興奮性hM3Dqおよび抑制性hM4Di受容体を発現させました。CNOによるニューロン活動の調節は、パーキンソン病のマウスモデルへの細胞移植を通じて評価され、行動評価と電気生理学的記録が伴いました。
化学遺伝学的に再プログラムされた幹細胞で安定的に発現する非融合DREADDコンストラクトを生成するための最初の重要なステップは、T2A-ZsGreenバイシストロンカセットです。しかし、hM3Dq-mCherryやhM4Di-mCherry7などの融合タンパク質発現プラスミドは、この誘導神経幹細胞株には効果がありません。これを回避するために、プロトコルのステップ1.1-1.2で詳述されているように、Gibsonアセンブリを介してドナープラスミドを設計しました。
免疫不全マウスの線条体に6-OHDAの定位固定剤を一方的に投与することによりPDモデルを確立することは、正確な in vivo 調節にとって非常に重要です。細胞移植や薬物治療を含む研究期間全体を通じて、一部の動物は予期せぬ死亡を経験する可能性があります。したがって、初期サンプルサイズは、実験グループ15、17に十分な数を確保するために慎重に計画する必要があります。
運動機能に関連するいくつかの行動試験を使用して、アポモルヒネ誘発回転試験、シリンダー試験、およびロータロッド試験など、DREADD調節に対する動物の行動反応を評価することができます。ここでは、前肢と円柱20の壁との接触を定量的に測定する円柱試験を採用した。神経損傷に起因する上肢の使用の変化を評価することにより、シリンダーテストは、CNOが運動機能をどのように強化するかについての貴重な洞察を提供します。
宿主神経回路内の化学遺伝学的に再プログラムされたドナー細胞の機能統合とシナプス結合は、PD16のような神経変性疾患の治療効果の重要な決定要因です。移植後の脳切片で行われた全細胞パッチクランプ記録は、これらの操作された細胞が天然の神経回路とどのように相互作用するかについての洞察を提供します。線条体の中棘ニューロン(MSN)は、ドーパミン作動性シグナル伝達の下流の標的です。
パッチクランプ記録MSNを使用すると、DREADD修飾細胞が神経回路にどのように統合され、その機能に影響を与えるかを正確に評価できます21。異なる手続き段階のための人工脳脊髄液(ACSF)組成は、パッチクランプにとって重要です。スライス調製時には、ショ糖ベースの人工脳脊髄液(s-ACSF)を強く推奨します。ショ糖の高浸透圧特性は、細胞の生存に不可欠なイオン勾配を維持しながら、切片化中のニューロンの腫脹を軽減します。電極の製造と品質管理は、記録の安定性を直接左右します。7-10 MΩの先端抵抗まで引っ張られたホウケイ酸ガラスピペットは、持続的なsEPSC記録のための交渉の余地のない前提条件を表しています。抵抗が5MΩ未満の最適でないピペットは、ピペット溶液と細胞質との間の拡散交換が加速され、3〜5分以内に進行性の電流ランダウンにつながります。
しかし、この研究は、操作された iNSC-DAP を介した PD マウスの運動行動とシナプス活動の化学遺伝学的調節、二重定位固定装置による介入と慢性 CNO 投与に関連する大幅な手続き上の消耗を示しており、免疫不全モデル、特に外科的標準化に関して、洗練された異種移植パラダイムの必要性を強調しています。CRISPR/Cas9を介したDREADD受容体エンジニアリングと、行動アッセイ(シリンダーテスト)および全細胞パッチクランプ電気生理学による回路レベルの調査を組み合わせたこの戦略は、ニューロンサブタイプ特異的な神経調節の青写真を提供し、神経変性疾患の精密細胞治療を進歩させるための汎用性の高いツールキットを提供します。
開示事項
著者には、開示すべき利益相反はありません。
謝辞
この研究は、北京自然科学基金会(7242068)、中国国家自然科学基金会(82171250)、北京市衛生委員会基金(PXM2020_026283_000005)、北京関連医学研究機関技術開発プロジェクト(11000023T000002036310)の支援を受けました。
資料
| Name | Company | Catalog Number | Comments |
| 2 x Rapid Taq Master Mix | Vazyme | P222-01 | used for genotyping analysis |
| 2×Seamless Cloning Mix | Biomed Gene Tech. | CL117-01 | used for plasmid construction |
| 6-OHDA | Sigma-Aldrich | H4381 | used for establishing PD mice model |
| AAVS1-Pur-CAG-EGFP | Addgene | 80945 | used as control |
| AAVS1-Pur-CAG-hM4Di-mCherry | Addgene | 80947 | original plasmid for construction of hM4Di-T2A-ZsGreen |
| AAVS1-Pur-CAG-hM3Dq-mCherry | Addgene | 80948 | original plasmid for construction of hM3Dq-T2A-ZsGreen |
| AAVS1-CAG-hM4Di-T2A-ZsGreen | N/A | N/A | Constructed donor plasmid based on #80947 |
| AAVS1-CAG-hM3Dq-T2A-ZsGreen | N/A | N/A | Constructed donor plasmid based on #80948 |
| Accutase | Invitrogen | A11105-01 | Used for digesting cells |
| AMAXA Nucleofector | Lonza | AAD-1001S | |
| Apomorphine | Sigma-Aldrich | A4393 | |
| Artificial cerebrospinal fluid (ACSF) | N/A | N/A | 125 mM NaCl, 2.5 mM KCl, 2 mM CaCl2, 1.25 mM NaH2PO4, 1 mM MgSO4, 25 mM glucose, and 26 mM NaHCO3 |
| Ascorbic acid | Sigma-Aldrich | 1043003 | |
| B-27 Supplement | Gibco | 17504044 | |
| BDNF | Peprotech | 450-02 | |
| cAMP | Sigma-Aldrich | D0627 | |
| CHIR99021 | Yeasen | 53003ES10 | |
| Clozapine-N-oxide | Enzo | BML-NS105 | |
| DAPT | Sigma-Aldrich | D5942 | |
| Desipramine | Sigma-Aldrich | D3900 | |
| D-glucose | Sigma-Aldrich | G5767 | |
| DMEM/F12 | Gibco | 11330-032 | |
| DMEM/F12 | Gibco | 11320-033 | |
| DMSO | Sigma-Aldrich | D2650 | |
| FGF8 | Peprotech | 100-25 | |
| GDNF | Peprotech | 450-10 | |
| GlutaMax | Gibco | 35050-061 | |
| Hank’s Balanced Salt Solution (HBSS) | Gibco | 14175095 | |
| Human leukemia inhibitory factor (hrLIF) | Millipore | LIF1010 | |
| Iced intracellular fluid | N/A | N/A | 130 mM K-gluconate, 16 mM KCl, 0.2 mM EGTA, 2 mM MgCl2, 10 mM HEPES, 4 mM Na2-ATP, 0.4 mM Na3-GTP, 0.3% of neurobiotin |
| KnockOut Serum Replacement | Gibco | 10828028 | |
| Laminin | Roche | 11243217001 | |
| Micropipette Puller | Sutter Instrument Company | P-1000 | |
| N-2 Supplement | Thermo Fisher | 17502048 | |
| Neurobasal-A Medium | Gibco | 10888-022 | |
| Non-essential amino acids (NEAA) | Gibco | 11140-050 | |
| PBS | Gibco | 10010023 | |
| pCLAMP 11 software suite | Molecular Devices | N/A | Patch-clamp electrophysiology data acquisition and analysis software |
| Phase 1 differentiation medium | N/A | N/A | 96% DMEM/F12 (Gibco, 11320-033), 1% B-27 Supplement, 1% N-2 Supplement, 1% NEAA, 1% GlutaMax, 1 µM SAG1, and 100 ng/mL FGF8 |
| Phase 2 differentiation medium | N/A | N/A | 96% DMEM/F12 (Gibco, 11320-033), 1% B-27 Supplement, 1% N-2 Supplement, 1% NEAA, and 1% GlutaMax, 10 ng/mL BDNF, 10 ng/mL GDNF, 1 ng/mL TGF-βIII, 10 µM DAPT, 0.2 mM ascorbic acid, and 0.5 mM cAMP. |
| Poly-D-lysine hydrobromide (PDL) | Sigma-Aldrich | P7886 | |
| Primers for genotyping | N/A | N/A | Insertion Foward: TCTTCACTCGCTGGGTTCCCTT; Insertion Reverse: CCTGTGGGAGGAAGAGAAGAGGT; Homozygosity Foward:CGTCTCCCTGGCTTTAGCCA; Homozygosity Reverse: GATCCTCTCTGGCTCCATCG |
| pX458 | Addgene | 152199 | |
| SAG1 | Enzo | ALX-270-426-M01 | |
| SB431542 | Yeasen | 53004ES50 | |
| sucrose-based artificial cerebrospinal fluid (s-ACSF) | 234 mM sucrose, 2.5 mM KCl, 26 mM NaHCO3, 1.25 mM NaH2PO4, 11 mM Dglucose, 0.5 mM CaCl2, and 10 mM MgSO4 | ||
| Stem cell culture media | N/A | N/A | 48% DMEM/F12 (Gibco, 11330-032) and 48% Neurobasal, with the addition of 1% B27, 1% N2, 1% NEAA, 1% GlutaMax, 10 ng/mL hrLIF, 2 µM SB431542, and 3 µM CHIR99021 |
| TGF-βIII | Peprotech | 100-36E | |
| Transplantation buffer | N/A | N/A | HBSS buffer with 5 g/L D-glucose, 100 ng/mL BDNF, 100 ng/mL GDNF, and 0.2 mM ascorbic Acid |
| Vibratome | Leica | VT1000 S | |
| Whole-cell patch-clamp | Molecular Devices | MultiClamp700B |
参考文献
- Thiel, G. Designer receptors exclusively activated by designer drugs. Humana Press (2015).
- Roth, B. L. Dreadds for neuroscientists. Neuron. 89 (4), 683-694 (2016).
- Gomez, J. L. et al. Chemogenetics revealed: DREADD occupancy and activation via converted clozapine. Science. 357 (6350), 503-507 (2017).
- Chehelgerdi, M. et al. Exploring the promising potential of induced pluripotent stem cells in cancer research and therapy. Mol Cancer. 22 (1), 189 (2023).
- Song, J., Patel, R. V., Sharif, M., Ashokan, A., Michaelides, M. Chemogenetics as a neuromodulatory approach to treating neuropsychiatric diseases and disorders. Mol Ther. 30 (3), 990-1005 (2022).
- Parmar, M., Grealish, S., Henchcliffe, C. The future of stem cell therapies for Parkinson disease. Nat Rev Neurosci. 21 (2), 103-115 (2020).
- Dell'anno, M. T. et al. Remote control of induced dopaminergic neurons in Parkinsonian rats. J Clin Invest. 124 (7), 3215-3229 (2014).
- Chen, Y. et al. Chemical control of grafted human PSC-derived neurons in a mouse model of Parkinson's disease. Cell Stem Cell. 18 (6), 817-826 (2016).
- Bjorklund, A. Parmar, M. Dopamine cell therapy: From cell replacement to circuitry repair. J Parkinsons Dis. 11 (S2), S159-S165 (2021).
- Alcacer, C. et al. Chemogenetic stimulation of striatal projection neurons modulates responses to Parkinson's disease therapy. J Clin Invest. 127 (2), 720-734 (2017).
- Alexander, G. M. et al. Remote control of neuronal activity in transgenic mice expressing evolved G protein-coupled receptors. Neuron. 63 (1), 27-39 (2009).
- Stachniak, T. J., Ghosh, A., Sternson, S. M. Chemogenetic synaptic silencing of neural circuits localizes a hypothalamus midbrain pathway for feeding behavior. Neuron. 82 (4), 797-808 (2014).
- Kang, H. J., Minamimoto, T., Wess, J., Roth, B. L. Chemogenetics for cell-type-specific modulation of signalling and neuronal activity. Nat Rev Methods Primers. 3 (1), 93 (2023).
- Miyanishi, K. et al. Behavioral tests predicting striatal dopamine level in a rat hemi-Parkinson's disease model. Neurochem Int. 122, 38-46 (2019).
- Zheng, X. et al. Human IPSC-derived midbrain organoids functionally integrate into striatum circuits and restore motor function in a mouse model of Parkinson's disease. Theranostics. 13 (8), 2673-2692 (2023).
- Xiong, M. et al. Human stem cell-derived neurons repair circuits and restore neural function. Cell Stem Cell. 28 (1), 112-126.e116 (2021).
- Yuan, Y. et al. Dopaminergic precursors differentiated from human blood-derived induced neural stem cells improve symptoms of a mouse Parkinson's disease model. Theranostics. 8 (17), 4679 (2018).
- Zhu, M. et al. Preparation of acute spinal cord slices for whole-cell patch-clamp recording in substantia gelatinosa neurons. J Vis Exp. (143) (2019).
- Wang, X., Han, D., Zheng, T., Ma, J., Chen, Z. Modulation of human induced neural stem cell-derived dopaminergic neurons by DREADD reveals therapeutic effects on a mouse model of Parkinson's disease. Stem Cell Res Ther. 15 (1), 297 (2024).
- Iancu, R., Mohapel, P., Brundin, P., Paul, G. Behavioral characterization of a unilateral 6-OHDA-lesion model of Parkinson's disease in mice. Behav Brain Res. 162 (1), 1-10 (2005).
- Surmeier, D. J. et al. The role of dopamine in modulating the structure and function of striatal circuits. Prog Brain Res. 183, 148-167 (2010).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved