Method Article
Хемогенетическая регуляция в перепрограммированных клетках-предшественниках, полученных из стволовых клеток, в лечении нейродегенеративных заболеваний
В этой статье
Резюме
В данной статье мы описываем протокол инженерии химически перепрограммированных стволовых клеток для достижения точной модуляции нейронов путем дифференцировки этих клеток в дофаминергические клетки-предшественники, их трансплантации мышиным моделям болезни Паркинсона и оценки поведенческих и электрофизиологических результатов для подтверждения успешной интеграции и функциональной эффективности трансплантированных клеток.
Аннотация
Интеграция дизайнерских рецепторов, активируемых исключительно дизайнерскими препаратами (DREADD), с терапией на основе стволовых клеток представляет собой передовую стратегию для точной модуляции нейронов. В данной работе мы использовали CRISPR-инженерные перепрограммированные стволовые клетки человека, экспрессирующие возбуждающие (hM3Dq) или тормозные (hM4Di) рецепторы DREADD для оценки функциональной интеграции и модуляции трансплантированных дофаминергических предшественников в мышиной модели болезни Паркинсона (БП). Ключевые этапы включали создание линий стволовых клеток, экспрессирующих DREADD, дифференцировку их в дофаминергические предшественники среднего мозга и трансплантацию этих клеток в стриатум мышей, пораженных 6-гидроксидофамином (6-OHDA). Мы провели поведенческие оценки и электрофизиологические записи для анализа эффектов трансплантированных клеток. Поведенческие тесты, такие как цилиндрический тест, продемонстрировали значительную модуляцию моторной функции после введения клозапина-N-оксида (CNO). В частности, активация hM4Di снижала контралатеральную подвижность передних конечностей, в то время как активация hM3Dq была связана с улучшением двигательного поведения. Электрофизиологические записи выявили отчетливые синаптические реакции. Активация hM4Di увеличивала интервалы между событиями и уменьшала пиковые амплитуды спонтанных возбуждающих постсинаптических токов (sEPSC), в то время как активация hM3Dq уменьшала интервалы между событиями и увеличивала пиковые амплитуды, отражая усиление возбуждающей сигнализации. Таким образом, интеграция поведенческих и электрофизиологических оценок подтверждает точное функциональное включение сконструированных химически перепрограммированных стволовых клеток в нейронные цепи хозяина.
Введение
Дизайнерские рецепторы, активируемые исключительно дизайнерскими препаратами (DREADD), представляют собой сконструированные рецепторы, сопряженные с G-белком, которые могут избирательно активироваться инертнымисинтетическими лигандами. Хемогенетический подход стал важным инструментом в нейробиологии, позволив исследователям исследовать нейронные цепи с высокой точностью и улучшив наше понимание клеточных функций как in vivo, так и in vitro посредством селективной активации или ингибирования определенных областей мозга или типов клеток.
Терапия на основе стволовых клеток представляет собой многообещающую стратегию лечения нейродегенеративных заболеваний. Эффективность клеток трансплантата зависит от правильной интеграции, выживаемости и функционального вклада в ткани хозяина. Неконтролируемая клеточная активность может привести к негативным последствиям, в том числе к онкогенезу4; Это обуславливает необходимость точного контроля над этими клетками после трансплантации. Использование технологии DREADD в перепрограммированных стволовых клетках человека и производных нейронах дает возможность точно контролировать активность нейронов с помощью введения дизайнерского препарата CNO 2,5. В контексте болезни Паркинсона (БП), которая характеризуется потерей дофаминергических нейронов, манипулирование активностью дофаминергических нейронов, полученных из стволовых клеток, имеет решающее значение для исследования их синаптических входов и проекционных паттернов в моделях грызунов 6,7,8,9,10. Включение возбуждающих рецепторов hM3Dq и тормозных hM4Di в эти модели позволяет точно модулировать активность нейронов11,12.
Комбинация поведенческих оценок животных и электрофизиологических записей позволяет всесторонне оценить эффекты хемогенетической модуляции на трансплантированные клетки in vivo13. Поведенческие оценки, включая вращение, вызванное апоморфином, цилиндрический тест и тест ротарода, оценивают моторную координацию и дают представление об изменениях в двигательной функции, связанных с экспериментальными моделями PD14. Электрофизиологические методы, такие как запись с помощью патч-клэмпа, позволяют в режиме реального времени отслеживать синаптические реакции и потенциалы действия, обеспечивая всестороннее представление о том, как трансплантированные клетки интегрируются в существующие нейронные сети15. Комбинируя поведенческие оценки с электрофизиологическими оценками, мы можем исследовать, как хемогенетическая модуляция влияет на интеграцию и функциональность этих клеток внейронных цепях хозяина. Предварительные результаты свидетельствуют о том, что введение CNO эффективно модулирует активность нейронов в трансплантированных клетках, что приводит к улучшению функциональных результатов на животных моделях.
В этом протоколе перепрограммированные стволовые клетки человека были сконструированы для экспрессии рецепторов hM3Dq или hM4Di с использованием технологии кластеризованных регулярно чередующихся коротких палиндромных повторов (CRISPR). После дифференцировки модифицированных перепрограммированных стволовых клеток в дофаминергические клетки-предшественники среднего мозга эти клетки были трансплантированы мышиным моделям БП для оценки их интеграции и функциональной регуляции в нейронных цепях хозяина с использованием поведенческих оценок и электрофизиологических записей.
протокол
Все эксперименты на животных проводились в соответствии с руководящими принципами, установленными Пекинской ассоциацией науки о лабораторных животных и Национальными институтами здравоохранения по уходу и использованию лабораторных животных. Мононуклеарные клетки периферической крови человека (PBMC) были получены от здорового донора с письменного информированного согласия, как описано впредыдущем исследовании.
1. Построение не-слитых клеточных линий на основе DREADD
- Сконструируйте донорскую плазмиду DREADD.
ПРИМЕЧАНИЕ: Сайты разложения должны быть спроектированы в соответствии с векторной последовательностью. Фрагменты должны быть синтезированы и амплифицированы с перекрытиями 20-30.о., соответствующими плечам фрагментов, для повышения эффективности сборки.- Проектирование и синтез фрагмента T2A-ZsGreen (фрагмент I).
- Амплифицируйте фрагмент hM3Dq/hM4Di-T2A из исходной плазмиды с помощью ПЦР (фрагмент II). Настройте реакцию ПЦР (общий объем 50 мкл) так, чтобы она содержала 1x ПЦР-буфер, 200 мкМ каждой смеси dNTP, 0,5 мкМ прямых и обратных праймеров, 10-50 нг плазмидной ДНК-матрицы и 1,25 ЕД высокоточной ДНК-полимеразы. Термоциклирование проводят в следующих условиях: начальная денатурация при 98 °C в течение 2,75 мин для полной денатурации матрицы; 32 цикла амплификации, состоящих из 98 °C в течение 15 с (денатурация), 60 °C в течение 30 с (отжиг грунтовки) и 72 °C в течение 60 с (растяжение); окончательное выдержание при 72 °C в течение 7 мин.
- Расщепите векторную плазмиду с помощью соответствующего фермента для получения линеаризованного вектора. Очистите все фрагменты с помощью электрофореза в агарозном геле и количественно оцените их с помощью спектрофотометра.
Примечание: Здесь исходная плазмида была расщеплена с помощью MluI и SalI.
- Аккуратно смешайте 50-100 нг линеаризованного вектора, фрагмента I и фрагмента II в молярном соотношении 1:3:3, а также 2x Cloning Mix. Инкубируйте смесь при 55 °C в течение 1 ч, чтобы облегчить гомологичную рекомбинацию с помощью Gibson Assembly.
- Вставьте направляющую РНК, нацеленную на сайт AAVS1, в сайт BbsI вектора pX458.
ПРИМЕЧАНИЕ: Выполните верификацию последовательности всех сконструированных плазмид с помощью секвенирования по Сэнгеру. - Поддерживайте перепрограммированные стволовые клетки в среде, стремясь к плотности клеток 2-5 × 10-6 клеток/мл.
Примечание: Перепрограммированные стволовые клетки, использованные здесь, были индуцированы из человеческих PBMC, как описано в предыдущем исследовании. Мониторинг состояния клеток имеет важное значение, так как их статус значительно влияет на эффективность электропорации. Смотрите Таблицу материалов для сравнения носителей. - Смешайте 2-5 × 106 клеток, по 2 мкг каждой донорской плазмиды (hM4Di-T2A-ZsGreen или hM3Dq-T2A-ZsGreen) и 2 мкг гРНК-плазмиды в 100 мкл буфера для электропорации и перенесите в кювету для электропорации.
ПРИМЕЧАНИЕ: Убедитесь, что смесь хорошо перемешана и не содержит пузырьков, прежде чем приступать к электропорации. Оптимизируйте параметры электропорации в зависимости от типа ячейки, чтобы максимизировать эффективность трансфекции, так как для разных устройств могут потребоваться определенные настройки. - Установите Nucleofector на программу B16 и инициируйте электропорацию для обеспечения эффективной трансфекции целевых iNSCs.
- Добавьте 1 мл 50 мкг/мл поли-D-лизина (PDL) в каждую лунку 6-луночного планшета и инкубируйте при комнатной температуре не менее 2 ч. Удалите все PDL из лунок и добавьте 1,5 мл ламинина 5 мкг/мл в каждую лунку и инкубируйте при 37 °C в течение 2-4 часов. Используйте пластину с покрытием сразу или храните при температуре 2-8 °C в течение 1 недели.
- Перенесите электропорированные ячейки в шестилуночные планшеты, покрытые PDL и ламинином. Распределите приблизительно 500 000 клеток в лунке в объеме 2 мл питательной среды на лунку.
- После 72 ч электропорации используйте проточный цитометр для сортировки флуоресцентных положительных клеток.
- Ресуспендируйте диссоциированные клетки в DPBS и отфильтруйте через клеточный фильтр 70 мкм.
- Сконфигурируйте сортировщик с каналом FITC для обнаружения ZsGreen. Включите необработанные иНСК в качестве отрицательного контроля для определения исходной флуоресценции.
- Откалибруйте прибор с помощью сопел 100 μм при давлении оболочки 20 фунтов на квадратный дюйм. Реализуйте четырехсторонний режим сортировки по чистоте с подтверждением по одной ячейке.
- Поместите одиночные клетки ZsGreen+ в 96-луночные планшеты, предварительно покрытые PDL и ламинином, и добавьте 200 мкл питательной среды на лунку для поддержки начального роста. Выдерживать в питательной среде в течение 7-14 дней
ПРИМЕЧАНИЕ: Ежедневно контролируйте лунки на наличие признаков роста и флуоресценции, указывающих на успешную интеграцию, и помечайте положительную лунку. - Выделите отдельные клоны, проявляющие флуоресценцию, с помощью инвертированного флуоресцентного микроскопа, оснащенного набором фильтров GFP. Клонирование экрана с 10-кратным увеличением. Пометьте лунки, содержащие моноклональные колонии, устойчивым, равномерным сигналом ZsGreen. Захватывайте светлопольные и флуоресцентные изображения для документирования морфологии и интенсивности флуоресценции.
ПРИМЕЧАНИЕ: Перед получением изображения замените свежую среду, чтобы уменьшить фоновую флуоресценцию. Исключите колонии с неправильной морфологией или аутофлуоресценцией. - Расширьте положительные ячейки на 48-луночных планшетах с покрытием. Затем разделите на две части, одну для культуры, а другую для генотипирования.
- Извлечение геномной ДНК из клонов-кандидатов. Приготовьте ПЦР-реакции с двумя парами праймеров: одна пара для подтверждения вставки интересующего гена, другая праймер для различения гомозиготных и гетерозиготных клонов. Термоциклирование выполняют при следующих условиях: начальная денатурация при 95 °С в течение 5 мин; 38 циклов при температуре 95 °C в течение 30 с, 60 °C в течение 30 с и 72 °C в течение 45 с; окончательное выдержание при 72 °C в течение 7 мин. Рассосите продукты ПЦР на 2% агарозном геле.
ПРИМЕЧАНИЕ: Грунтовки см. в Таблице материалов . Подтвердите инсерцию интересующего гена с помощью одной полосы 650.о. (праймер 1). Идентификация гетерозиготных клонов по наличию одной полосы 630.о. и гомозиготных клонов по отсутствию этой полосы (праймер 2). - Расширьте положительные ячейки на покрытых шестилуночных планшетах.
- Расщепите клетки и промойте их в фосфатно-солевом буфере (PBS) центрифугированием при 250 × г в течение 3 минут. Заморозьте клетки в криоконсервирующей среде с 10% ДМСО плотностью 2,5 ×10 6 клеток во флаконе.
2. Трансплантированные клетки-предшественники стволовых клеток DREADD мышам с моделью БП
- Внутрибрюшинное введение дезипрамина в концентрации 5 мг/мл (10 мг/кг) мышам с иммунодефицитом за 30 минут до операции. Обезболите мышей 2% изофлураном.
- Проводят односторонние стереотаксические инъекции 3 мкл 6-гидроксидофамина (6-OHDA, 5 мкг/мкл). Нацеливайтесь на правое полосатое тело, используя следующие координаты: переднезадний = 0,5 мм, латеральный = 2,1 мм и вертикальный = -3,2 мм.
ПРИМЕЧАНИЕ: 6-OHDA следует растворять в физрастворе, содержащем 0,2% аскорбиновой кислоты. Обеспечьте точное нацеливание, чтобы свести к минимуму вариабельность тяжести поражения.
ВНИМАНИЕ: 6-OHDA является цитотоксичным и продуцирует активные формы кислорода, которые вызывают клеточный стресс. Обращайтесь с осторожностью. - Введите внутрибрюшинную инъекцию апоморфина (1 мг/кг, 0,5 мг/мл растворенного в физрастворе) для подтверждения поражений через 4 недели после операции. Выберите пораженных мышей, которые демонстрируют более 100 контралатеральных вращений в течение 30-минутного периода наблюдения для последующих экспериментов.
Апоморфин является агонистом дофаминовых рецепторов, который непосредственно активирует сверхчувствительные постсинаптические рецепторы в денервированном стриатуме, нарушая баланс двусторонней активности нигростриарного контура. Апоморфин-индуцированная ротация служит для оценки тяжести односторонних дофаминергических поражений 6-OHDA. - Затравочные и культуральные клетки в покрытых покрытием шестилуночных планшетах (150 000 клеток на лунку). Инкубировать в среде для дифференцировки фазы 1 в течение 10 дней, обновляя среду каждые 2 дня. На 11-й день переключитесь на среду для дифференцировки Фазы 2 и продолжайте инкубацию до 13-го дня, меняя среду каждый день.
ПРИМЕЧАНИЕ: См. Таблицу материалов для сравнения среды дифференцировки. - Соберите клетки на 10 и 13 день дифференцировки, затем смешайте их в соотношении 1:7. Суспендировать смесь в буфере для трансплантации в концентрации 100 000 клеток/мкл.
ПРИМЕЧАНИЕ: См. Таблицу материалов для сравнения буфера для трансплантации. - Ввести стереотаксическую инъекцию общего объема 4 мкл приготовленной клеточной суспензии мыши PD.
- Проведите тест с цилиндром в различные моменты времени после трансплантации клеток. Поместите стеклянный стакан (диаметр: 20 см, высота: 30 см) на плоскую неотражающую поверхность. Расположите камеру верхнего обзора над цилиндром, чтобы захватить весь диаметр.
ПРИМЕЧАНИЕ: Закройте цилиндр черными шторами, чтобы устранить внешние визуальные раздражители. - Поместите каждую мышь в центр цилиндра и начните одновременную запись видео (3 мин/сеанс). После сеанса верните мышь в домашнюю клетку.
ПРИМЕЧАНИЕ: Акклиматизируйте мышей в испытательной комнате в течение 30 минут при освещении. Очищайте цилиндр с помощью 70% этанола между испытаниями, чтобы устранить обонятельные сигналы. - Оцените способность мышей к передвижению верхних конечностей в течение 3 мин. Рассчитайте количество контактов со стенкой, сделанных поврежденной передней конечностью, по отношению к общему количеству контактов, сделанных обеими передними конечностями.
- Вводите физиологический раствор или ХНО в дозировке 1,2 мг/кг путем внутрибрюшинной инъекции. Проведите цилиндрический тест для оценки поведенческой модуляции в модели мыши PD после введения CNO
ПРИМЕЧАНИЕ: Подождите период восстановления примерно 40 минут, прежде чем приступать к оценке.
3. Электрофизиологическое профилирование хемогенетически модулированных клеток in vivo
- Обезболивайте мышей путем внутрибрюшинной инъекции 250 мг/кг пентобарбитала. Извлеките мозг и немедленно поместите его в ледяную искусственную спинномозговую жидкость на основе сахарозы (s-ACSF) для поддержания клеточной целостности. С помощью вибратома разрежьте мозг на участки толщиной 300-400 мкм.
ПРИМЕЧАНИЕ: Работайте быстро, чтобы поддерживать мозг при низких температурах для сохранения клеточной функции. Смотрите таблицу материалов для s-ACSF, используемого для подготовки свежего среза мозга. - Перенесите образцы в камеру, заполненную ACSF, уравновешенным 95%O2 и 5%CO2 при 34 °C, обеспечивая поддержание этой температуры на протяжении всего эксперимента.
ПРИМЕЧАНИЕ: См. Таблицу материалов для ACSF. - Загрузите стеклянные пипетки ледяным внутриклеточным раствором, с сопротивлением электродов в диапазоне от 7 до 10 МОм.
ПРИМЕЧАНИЕ: Для внутриклеточного раствора см. Таблицу материалов . Стеклянные пипетки изготавливаются из стеклянных капилляров с помощью микропипетки18. Перед началом экспериментов проверьте наличие утечек в стеклянных пипетках, убедившись, что наконечники достаточно острые, чтобы проникнуть в клеточную мембрану. Готовьте пипетки быстро, чтобы свести к минимуму колебания температуры внутриклеточного раствора. - Монтируйте слайсы в погружную записывающую камеру, переплавленную (2 мл/мин) кислородом ACSF при 34 °C. Позиционирование пипеток с помощью моторизованных микроманипуляторов в инфракрасной дифференциально-интерференционной контрастной микроскопии. Установите конфигурацию всей клетки путем применения мягкого отсасывания (сопротивление > 1 ГОм) к запатченным нейронам в областях трансплантата. Зажимные ячейки на -70 мВ с помощью патч-клэмплового усилителя; Сбор исходных данных sEPSC в течение 8 мин при частоте дискретизации 10 кГц (фильтрация на частоте 2 кГц) и непрерывный мониторинг сопротивления доступа (целевое значение: <20 МОм; отбрасывание при >25 МОм или колебаниях >10%).
ПРИМЕЧАНИЕ: Используйте соответствующее давление при применении всасывания, чтобы избежать нежелательного смещения или разрыва ячейки, и тщательно отрегулируйте положение пипетки для обеспечения хорошей прилегаемости. Если качество уплотнения оставляет желать лучшего, выбросьте пипетку и повторите попытку. - Добавьте 50 мкМ CNO в регистрирующую камеру сразу после завершения базового измерения и продолжайте запись данных еще 16 минут, наблюдая за изменениями частоты или амплитуды sEPSC.
- Выполните процедуру промывки, заменив раствор CNO свежим ACSF, чтобы эффективно удалить CNO из записывающей камеры. Продолжайте записывать данные до конца эксперимента, чтобы оценить любое восстановление синаптической активности.
Результаты
На рисунке 1 показаны ключевые этапы этого методологического подхода к модифицированным перепрограммированным стволовым клеткам человека, экспрессирующим возбуждающие (hM3Dq) или ингибирующие (hM4Di) рецепторы DREADD для оценки функциональной интеграции и модуляции производных дофаминергических предшественников в мышиной модели болезни Паркинсона (БП). На рисунке 2 показана CRISPR/Cas9-опосредованная стратегия нокаутинга генов для введения не-слитых конструкций hM4Di-T2A-ZsGreen и hM3Dq-T2A-ZsGreen в перепрограммированные стволовые клетки и валидации с помощью генотипирования.
На рисунке 3 охарактеризованы функциональные и синаптические эффекты хемогенетической модуляции в трансплантированных клетках. Мы провели поведенческие оценки и электрофизиологические записи для анализа эффектов пересаженных клеток DREADD. На рисунке 3A показан статистический анализ результатов контралатерального движения передних конечностей в цилиндрическом тесте в контрольной группе, hM4Di- и hM3Dq-группах в условиях физиологического раствора, CNO и вымывания после CNO. Введение CNO снижало поражение контралатеральных передних конечностей у животных, пересаженных с помощью hM4Di, но улучшало двигательные показатели в группе hM3Dq по сравнению с контролем физиологического раствора. На рисунке 3B-D показан электрофизиологический анализ спонтанных возбуждающих постсинаптических токов (sEPSCs). В группе, пересаженной с помощью hM4Di, наблюдались удлиненные интервалы между событиями и сниженные пиковые амплитуды, что свидетельствует о синаптическом сайленсинге, в то время как клетки, трансплантированные с помощью hM3Dq, продемонстрировали укороченные интервалы и увеличенные амплитуды, что согласуется с усилением возбуждающей нейротрансмиссии. Рисунки 3E,F характеризуют трансплантированные клетки in vivo с помощью иммунофлуоресценции.

Рисунок 1: Хемогенетическая регуляция в перепрограммированных клетках-предшественниках, полученных из стволовых клеток, для лечения нейродегенеративных заболеваний на мышиной модели. Блок-схема, иллюстрирующая методологический подход к созданию мышиной модели БП и оценке поведенческих результатов с помощью хемогенетической регуляции в перепрограммированных клетках-предшественниках, полученных из стволовых клеток. Шаг 1: Создание линий стволовых клеток DREADD без слияния с использованием технологии CRISPR. Шаг 2: Создание мышиной модели БП с последующей трансплантацией клеток-предшественников стволовых клеток DREADD в мозг. Шаг 3: Оценка поведенческих и электрофизиологических результатов для проверки успешной интеграции и функциональной модуляции пересаженных клеток. Сокращения: CRISPR = сгруппированный регулярно чередующийся короткий палиндромный повтор; DREADD = дизайнерские рецепторы, активируемые исключительно дизайнерскими препаратами; БП = болезнь Паркинсона; 6-OHDA = 6-гидроксидопамин; CNO = N-оксид клозапина. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 2: CRISPR/Cas9-опосредованная инженерия не-слиятельных DREADD-экспрессирующих стволовых клеток. (A) Блок-схема, иллюстрирующая CRISPR/Cas9-опосредованную стратегию нок-ина генов для интеграции не-слитых конструкций hM4Di-T2A-ZsGreen или hM3Dq-T2A-ZsGreen в перепрограммированные стволовые клетки. (B) Донорская плазмида не-фьюжн hM4Di-T2A-ZsGreen или hM3Dq-T2A-ZsGreen была модифицирована с помощью многоступенчатой стратегии клонирования. Представление аллеля-мишени иллюстрирует выбивание генов hM4Di-T2A-ZsGreen или hM3Dq-T2A-ZsGreen в перепрограммированных стволовых клетках. Флуоресцентные изображения подтверждают, что сконструированные клетки демонстрируют однородную зеленую флуоресценцию, что указывает на успешную экспрессию трансгенов. Масштабная линейка = 200 мкм. (C) Результаты генотипирования подтверждают успешную интеграцию конструкций DREADD в геном целевых линий стволовых клеток. Эта цифра была изменена по Wang et al.19. Сокращения: гРНК = направляющая РНК; FACS = сортировка клеток, активируемых флуоресценцией; DREADD = дизайнерские рецепторы, активируемые исключительно дизайнерскими препаратами. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
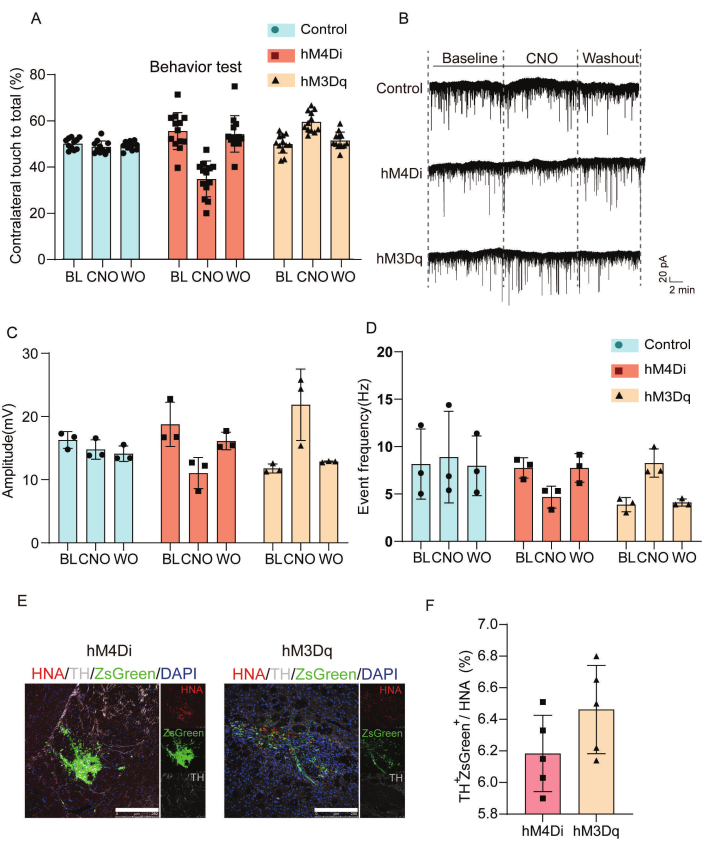
Рисунок 3: Оценка поведенческих и электрофизиологических исходов для подтверждения интеграции и функциональной модуляции трансплантированных клеток. (А) Оценка поведенческой модуляции в мышиной модели БП после введения НОУ; подробный статистический анализ, сравнивающий результаты контралатерального движения передних конечностей в цилиндрическом тесте среди hM4Di, hM3Dq и контрольных групп на исходном уровне и через 8 недель после трансплантации, с оценкой, проведенной после лечения физиологическим раствором и ХНО, а также после вымывания ХНО. (B) Записи патч-зажима для целых клеток, выявляющие sEPSC из трансплантатов контрольной группы, hM4Di или hM3Dq, проанализированных на исходном уровне и во время лечения CNO (50 мкМ), а также фазы вымывания CNO. (C) Статистический анализ измерений пиковой амплитуды для sEPSC по исходному уровню, размыву CNO и CNO. (D) Статистика частоты событий sEPSC, зарегистрированных из трансплантатов контрольной группы, hM4Di и hM3Dq. (Д)Характеристика привитых клеток in vivo с помощью иммунофлюоресценции. Масштабные линейки = 250 мкм. (F) Количественный анализ экспрессии тирозингидроксилазы и ZsGreen в группах hM4Di и hM3Dq по отношению к экспрессии ядерного антигена человека. Эта цифра была изменена по Wang et al.19. Сокращения: BL = базовый уровень; CNO = лечение клозапином N-оксидом (CNO, 50 мкМ); WO = вымывание CNO; БП = болезнь Паркинсона; sEPSCs = спонтанные возбуждающие постсинаптические токи; TH = тирозингидроксилаза; HNA = ядерный антиген человека. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Обсуждение
В этом протоколе использовалась технология CRISPR для создания перепрограммированных стволовых клеток человека для экспрессии возбуждающих рецепторов hM3Dq и ингибирующих hM4Di. Модуляцию нейрональной активности с помощью CNO оценивали путем трансплантации клеток мышиным моделям болезни Паркинсона, сопровождаемой поведенческими оценками и электрофизиологическими записями.
Первым важным шагом в создании стабильно экспрессируемых, не синтезируемых конструкций DREADD в хемогенетически перепрограммированных стволовых клетках является бицистронная кассета T2A-ZsGreen. Однако плазмиды, экспрессирующие гибридные белки, такие как hM3Dq-mCherry и hM4Di-mCherry7, неэффективны для этой индуцированной линии нейральных стволовых клеток. Чтобы обойти эту проблему, мы сконструировали донорскую плазмиду с помощью сборки Gibson, как подробно описано в шагах протокола 1.1-1.2.
Создание модели БП путем одностороннего введения стереотаксической инъекции 6-OHDA в полосатое тело иммунодефицитных мышей имеет решающее значение для точной модуляции in vivo. В течение всего периода исследования, включая трансплантацию клеток и медикаментозное лечение, некоторые животные могут столкнуться с неожиданной смертностью. Поэтому первоначальный размер выборки должен быть тщательно спланирован, чтобы обеспечить достаточное количество опытных групп15,17.
Несколько поведенческих тестов, связанных с двигательной функцией, могут быть использованы для оценки поведенческих реакций животных на модуляцию DREADD, включая тест на вращение, вызванное апоморфином, цилиндрический тест и тест ротарода. Здесь мы использовали цилиндрический тест, который количественно измеряет контакт передних конечностей со стенками цилиндра20. Оценивая изменения в использовании верхних конечностей в результате повреждения нервной системы, цилиндрический тест дает ценную информацию о том, как CNO может улучшить двигательную функцию.
Функциональная интеграция и синаптическая связь хемогенетически перепрограммированных донорских клеток в нейронных цепях хозяина являются критическими детерминантами терапевтической эффективности при нейродегенеративных расстройствах, таких как PD16. Записи целых клеток, проведенные на срезах мозга после трансплантации, дают представление о том, как эти сконструированные клетки взаимодействуют с нативными нейронными цепями. Средние шипастые нейроны (MSN) в стриатуме являются нисходящими мишенями дофаминергической сигнализации.
Используя MSN, записывающие патч-клэмпы, мы можем точно оценить, как модифицированные DREADD клетки интегрируются в нейронные цепи и влияют на их функцию. Состав искусственной спинномозговой жидкости (ACSF) для отдельных процедурных фаз имеет решающее значение для пластыря-зажима. Во время приготовления среза настоятельно рекомендуется использовать искусственную спинномозговую жидкость на основе сахарозы (s-ACSF). Гиперосмотические свойства сахарозы смягчают набухание нейронов во время разрезания, сохраняя при этом ионные градиенты, необходимые для жизнеспособности клеток. Изготовление электродов и контроль качества напрямую определяют стабильность записи. Дозаторы из боросиликатного стекла, натянутые на сопротивления наконечника 7-10 МОм, представляют собой не подлежащее обсуждению условие для устойчивой регистрации sEPSC. Субоптимальные пипетки с сопротивлением ниже 5 МОм демонстрируют ускоренный диффузионный обмен между раствором пипетки и цитоплазмой, что приводит к прогрессивному истощению тока в течение 3-5 минут.
Тем не менее, это исследование демонстрирует хемогенетическую модуляцию моторного поведения и синаптической активности у мышей с БП с помощью сконструированного iNSC-DAP, значительный процедурный отсеивание, связанный с двойными стереотаксическими вмешательствами и хроническим введением CNO, подчеркивает необходимость уточнения парадигм ксенотрансплантации в моделях с ослабленным иммунитетом, особенно в отношении хирургической стандартизации. Эта стратегия, сочетающая CRISPR/Cas9-опосредованную инженерию рецепторов DREADD с опросом на уровне цепи с помощью поведенческих анализов (цилиндрический тест) и электрофизиологии с использованием целых клеток, обеспечивает нейромодуляцию, специфичную для подтипа нейронов, и предлагает универсальный набор инструментов для продвижения прецизионной клеточной терапии нейродегенеративных заболеваний.
Раскрытие информации
У авторов нет конфликта интересов, который можно было бы раскрыть.
Благодарности
Эта работа была поддержана Пекинским фондом естественных наук (7242068), Национальным фондом естественных наук Китая (82171250), Фондом Пекинской муниципальной комиссии по здравоохранению (PXM2020_026283_000005) и Проектом по развитию технологий Пекинских медицинских научно-исследовательских институтов (11000023T000002036310).
Материалы
| Name | Company | Catalog Number | Comments |
| 2 x Rapid Taq Master Mix | Vazyme | P222-01 | used for genotyping analysis |
| 2×Seamless Cloning Mix | Biomed Gene Tech. | CL117-01 | used for plasmid construction |
| 6-OHDA | Sigma-Aldrich | H4381 | used for establishing PD mice model |
| AAVS1-Pur-CAG-EGFP | Addgene | 80945 | used as control |
| AAVS1-Pur-CAG-hM4Di-mCherry | Addgene | 80947 | original plasmid for construction of hM4Di-T2A-ZsGreen |
| AAVS1-Pur-CAG-hM3Dq-mCherry | Addgene | 80948 | original plasmid for construction of hM3Dq-T2A-ZsGreen |
| AAVS1-CAG-hM4Di-T2A-ZsGreen | N/A | N/A | Constructed donor plasmid based on #80947 |
| AAVS1-CAG-hM3Dq-T2A-ZsGreen | N/A | N/A | Constructed donor plasmid based on #80948 |
| Accutase | Invitrogen | A11105-01 | Used for digesting cells |
| AMAXA Nucleofector | Lonza | AAD-1001S | |
| Apomorphine | Sigma-Aldrich | A4393 | |
| Artificial cerebrospinal fluid (ACSF) | N/A | N/A | 125 mM NaCl, 2.5 mM KCl, 2 mM CaCl2, 1.25 mM NaH2PO4, 1 mM MgSO4, 25 mM glucose, and 26 mM NaHCO3 |
| Ascorbic acid | Sigma-Aldrich | 1043003 | |
| B-27 Supplement | Gibco | 17504044 | |
| BDNF | Peprotech | 450-02 | |
| cAMP | Sigma-Aldrich | D0627 | |
| CHIR99021 | Yeasen | 53003ES10 | |
| Clozapine-N-oxide | Enzo | BML-NS105 | |
| DAPT | Sigma-Aldrich | D5942 | |
| Desipramine | Sigma-Aldrich | D3900 | |
| D-glucose | Sigma-Aldrich | G5767 | |
| DMEM/F12 | Gibco | 11330-032 | |
| DMEM/F12 | Gibco | 11320-033 | |
| DMSO | Sigma-Aldrich | D2650 | |
| FGF8 | Peprotech | 100-25 | |
| GDNF | Peprotech | 450-10 | |
| GlutaMax | Gibco | 35050-061 | |
| Hank’s Balanced Salt Solution (HBSS) | Gibco | 14175095 | |
| Human leukemia inhibitory factor (hrLIF) | Millipore | LIF1010 | |
| Iced intracellular fluid | N/A | N/A | 130 mM K-gluconate, 16 mM KCl, 0.2 mM EGTA, 2 mM MgCl2, 10 mM HEPES, 4 mM Na2-ATP, 0.4 mM Na3-GTP, 0.3% of neurobiotin |
| KnockOut Serum Replacement | Gibco | 10828028 | |
| Laminin | Roche | 11243217001 | |
| Micropipette Puller | Sutter Instrument Company | P-1000 | |
| N-2 Supplement | Thermo Fisher | 17502048 | |
| Neurobasal-A Medium | Gibco | 10888-022 | |
| Non-essential amino acids (NEAA) | Gibco | 11140-050 | |
| PBS | Gibco | 10010023 | |
| pCLAMP 11 software suite | Molecular Devices | N/A | Patch-clamp electrophysiology data acquisition and analysis software |
| Phase 1 differentiation medium | N/A | N/A | 96% DMEM/F12 (Gibco, 11320-033), 1% B-27 Supplement, 1% N-2 Supplement, 1% NEAA, 1% GlutaMax, 1 µM SAG1, and 100 ng/mL FGF8 |
| Phase 2 differentiation medium | N/A | N/A | 96% DMEM/F12 (Gibco, 11320-033), 1% B-27 Supplement, 1% N-2 Supplement, 1% NEAA, and 1% GlutaMax, 10 ng/mL BDNF, 10 ng/mL GDNF, 1 ng/mL TGF-βIII, 10 µM DAPT, 0.2 mM ascorbic acid, and 0.5 mM cAMP. |
| Poly-D-lysine hydrobromide (PDL) | Sigma-Aldrich | P7886 | |
| Primers for genotyping | N/A | N/A | Insertion Foward: TCTTCACTCGCTGGGTTCCCTT; Insertion Reverse: CCTGTGGGAGGAAGAGAAGAGGT; Homozygosity Foward:CGTCTCCCTGGCTTTAGCCA; Homozygosity Reverse: GATCCTCTCTGGCTCCATCG |
| pX458 | Addgene | 152199 | |
| SAG1 | Enzo | ALX-270-426-M01 | |
| SB431542 | Yeasen | 53004ES50 | |
| sucrose-based artificial cerebrospinal fluid (s-ACSF) | 234 mM sucrose, 2.5 mM KCl, 26 mM NaHCO3, 1.25 mM NaH2PO4, 11 mM Dglucose, 0.5 mM CaCl2, and 10 mM MgSO4 | ||
| Stem cell culture media | N/A | N/A | 48% DMEM/F12 (Gibco, 11330-032) and 48% Neurobasal, with the addition of 1% B27, 1% N2, 1% NEAA, 1% GlutaMax, 10 ng/mL hrLIF, 2 µM SB431542, and 3 µM CHIR99021 |
| TGF-βIII | Peprotech | 100-36E | |
| Transplantation buffer | N/A | N/A | HBSS buffer with 5 g/L D-glucose, 100 ng/mL BDNF, 100 ng/mL GDNF, and 0.2 mM ascorbic Acid |
| Vibratome | Leica | VT1000 S | |
| Whole-cell patch-clamp | Molecular Devices | MultiClamp700B |
Ссылки
- Thiel, G. Designer receptors exclusively activated by designer drugs. Humana Press (2015).
- Roth, B. L. Dreadds for neuroscientists. Neuron. 89 (4), 683-694 (2016).
- Gomez, J. L. et al. Chemogenetics revealed: DREADD occupancy and activation via converted clozapine. Science. 357 (6350), 503-507 (2017).
- Chehelgerdi, M. et al. Exploring the promising potential of induced pluripotent stem cells in cancer research and therapy. Mol Cancer. 22 (1), 189 (2023).
- Song, J., Patel, R. V., Sharif, M., Ashokan, A., Michaelides, M. Chemogenetics as a neuromodulatory approach to treating neuropsychiatric diseases and disorders. Mol Ther. 30 (3), 990-1005 (2022).
- Parmar, M., Grealish, S., Henchcliffe, C. The future of stem cell therapies for Parkinson disease. Nat Rev Neurosci. 21 (2), 103-115 (2020).
- Dell'anno, M. T. et al. Remote control of induced dopaminergic neurons in Parkinsonian rats. J Clin Invest. 124 (7), 3215-3229 (2014).
- Chen, Y. et al. Chemical control of grafted human PSC-derived neurons in a mouse model of Parkinson's disease. Cell Stem Cell. 18 (6), 817-826 (2016).
- Bjorklund, A. Parmar, M. Dopamine cell therapy: From cell replacement to circuitry repair. J Parkinsons Dis. 11 (S2), S159-S165 (2021).
- Alcacer, C. et al. Chemogenetic stimulation of striatal projection neurons modulates responses to Parkinson's disease therapy. J Clin Invest. 127 (2), 720-734 (2017).
- Alexander, G. M. et al. Remote control of neuronal activity in transgenic mice expressing evolved G protein-coupled receptors. Neuron. 63 (1), 27-39 (2009).
- Stachniak, T. J., Ghosh, A., Sternson, S. M. Chemogenetic synaptic silencing of neural circuits localizes a hypothalamus midbrain pathway for feeding behavior. Neuron. 82 (4), 797-808 (2014).
- Kang, H. J., Minamimoto, T., Wess, J., Roth, B. L. Chemogenetics for cell-type-specific modulation of signalling and neuronal activity. Nat Rev Methods Primers. 3 (1), 93 (2023).
- Miyanishi, K. et al. Behavioral tests predicting striatal dopamine level in a rat hemi-Parkinson's disease model. Neurochem Int. 122, 38-46 (2019).
- Zheng, X. et al. Human IPSC-derived midbrain organoids functionally integrate into striatum circuits and restore motor function in a mouse model of Parkinson's disease. Theranostics. 13 (8), 2673-2692 (2023).
- Xiong, M. et al. Human stem cell-derived neurons repair circuits and restore neural function. Cell Stem Cell. 28 (1), 112-126.e116 (2021).
- Yuan, Y. et al. Dopaminergic precursors differentiated from human blood-derived induced neural stem cells improve symptoms of a mouse Parkinson's disease model. Theranostics. 8 (17), 4679 (2018).
- Zhu, M. et al. Preparation of acute spinal cord slices for whole-cell patch-clamp recording in substantia gelatinosa neurons. J Vis Exp. (143) (2019).
- Wang, X., Han, D., Zheng, T., Ma, J., Chen, Z. Modulation of human induced neural stem cell-derived dopaminergic neurons by DREADD reveals therapeutic effects on a mouse model of Parkinson's disease. Stem Cell Res Ther. 15 (1), 297 (2024).
- Iancu, R., Mohapel, P., Brundin, P., Paul, G. Behavioral characterization of a unilateral 6-OHDA-lesion model of Parkinson's disease in mice. Behav Brain Res. 162 (1), 1-10 (2005).
- Surmeier, D. J. et al. The role of dopamine in modulating the structure and function of striatal circuits. Prog Brain Res. 183, 148-167 (2010).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены