Method Article
신경퇴행성 질환 치료에서 재프로그래밍된 줄기세포 유래 전구세포의 화학유전학적 조절
요약
여기에서는 화학적으로 재프로그래밍된 줄기세포를 엔지니어링하여 이러한 세포를 도파민성 전구세포로 분화하고, 파킨슨병의 마우스 모델에 이식하고, 이식된 세포의 성공적인 통합 및 기능적 효과를 확인하기 위해 행동 및 전기생리학적 결과를 평가함으로써 정확한 신경 조절을 달성하기 위한 프로토콜에 대해 설명합니다.
초록
줄기세포 기반 치료법과 디자이너 약물(DREADD)에 의해 독점적으로 활성화되는 디자이너 수용체의 통합은 정확한 신경 세포 조절을 위한 고급 전략을 제시합니다. 여기에서는 파킨슨병(PD)의 쥐 모델에서 이식된 도파민 전구체의 기능적 통합 및 조절을 평가하기 위해 흥분성(hM3Dq) 또는 억제성(hM4Di) DREADD 수용체를 발현하는 CRISPR 엔지니어링 인간 재프로그래밍 줄기세포를 활용했습니다. 주요 단계에는 비융합 DREADD 발현 줄기세포주를 생성하고, 이를 중뇌 도파민 전구체로 분화하고, 이러한 세포를 6-하이드록시도파민(6-OHDA) 병변 마우스의 선조체에 이식하는 것이 포함되었습니다. 우리는 이식된 세포의 효과를 분석하기 위해 행동 평가와 전기 생리학적 기록을 수행했습니다. 실린더 테스트와 같은 행동 테스트는 클로자핀-N-옥사이드(CNO) 투여 후 운동 기능의 상당한 조절을 보여주었습니다. 구체적으로, hM4Di의 활성화는 반대쪽 앞다리 움직임을 감소시킨 반면, hM3Dq의 활성화는 향상된 운동 행동과 관련이 있었습니다. 전기생리학적 기록은 뚜렷한 시냅스 반응을 보여주었습니다. hM4Di 활성화는 자발적 흥분성 시냅스후 전류(sEPSC)의 상호 이벤트 간격을 증가시키고 피크 진폭을 감소시킨 반면, hM3Dq 활성화는 상호 이벤트 간격을 감소시키고 피크 진폭을 증가시켜 향상된 흥분성 신호를 반영했습니다. 요약하면, 행동 및 전기 생리학적 평가의 통합은 공학적으로 화학적으로 재프로그래밍된 줄기 세포가 숙주 신경 회로에 정확하게 기능적으로 통합되는 것을 검증합니다.
서문
디자이너 약물(DREADD)에 의해 독점적으로 활성화되는 디자이너 수용체는 불활성 합성 리간드에 의해 선택적으로 활성화될 수 있도록 설계된 G-단백질 결합 수용체입니다1. 화학유전학적 접근법은 연구자들이 높은 정밀도로 신경 회로 연결성을 조사할 수 있도록 하고, 특정 뇌 영역 또는 세포 유형의 선택적 활성화 또는 억제를 통해 생체 내 및 체외 모두에서 세포 기능에 대한 이해를 향상시킴으로써 신경 과학에서 필수적인 도구가 되었습니다 2,3.
줄기세포 기반 치료법은 신경퇴행성 질환을 치료하기 위한 유망한 전략을 제시합니다. 이식 세포의 효능은 적절한 통합, 생존 및 숙주 조직에 대한 기능적 기여에 달려 있습니다. 통제되지 않은 세포 활동은 종양 형성4; 이식 후 이러한 세포의 정밀한 제어가 필요합니다. 인간 재프로그래밍된 줄기세포 및 유래 뉴런에 DREADD 기술을 활용하면 디자이너 약물인 CNO 2,5의 투여를 통해 뉴런 활동을 정밀하게 제어할 수 있습니다. 도파민 뉴런의 손실을 특징으로 하는 파킨슨병(PD)의 맥락에서 줄기세포 유래 도파민 뉴런의 활동을 조작하는 것은 설치류 모델 6,7,8,9,10에서 시냅스 입력 및 투영 패턴을 조사하는 데 중요합니다. 흥분성 hM3Dq 및 억제성 hM4Di 수용체를 이러한 모델에 통합하면 신경 세포 활동의 정확한 조절이 가능합니다11,12.
동물 행동 평가와 전기생리학적 기록의 결합을 통해 in vivo 이식된 세포에 대한 화학유전학적 조절의 효과를 종합적으로 평가할 수 있습니다 13. 아포모르핀 유도 회전, 실린더 테스트 및 로타로드 테스트를 포함한 행동 평가는 모터 협응을 평가하고 PD14의 실험 모델과 관련된 운동 기능의 변화에 대한 통찰력을 제공합니다. 패치 클램프 기록과 같은 전기생리학적 기술은 시냅스 반응 및 활동 전위의 실시간 모니터링을 가능하게 하여 이식된 세포가 기존 신경망에 어떻게 통합되는지에 대한 포괄적인 관점을 제공합니다15. 행동 평가와 전기생리학적 평가를 결합함으로써, 우리는 화학유전학적 조절이 숙주 신경 회로 내에서 이러한 세포의 통합 및 기능에 어떤 영향을 미치는지 조사할 수 있습니다16. 예비 연구 결과에 따르면 CNO 투여는 이식된 세포의 신경 활동을 효과적으로 조절하여 동물 모델에서 기능적 결과를 개선한다.
이 프로토콜에서 인간 재프로그래밍된 줄기세포는 CRISPR(Clustered Regularly Interspaced Short Palindromic Repeats) 기술을 사용하여 hM3Dq 또는 hM4Di 수용체를 발현하도록 조작되었습니다. 변형된 재프로그래밍된 줄기세포를 중뇌 도파민 전구세포로 분화시킨 후, 이 세포를 PD의 마우스 모델에 이식하여 행동 평가 및 전기생리학적 기록을 사용하여 숙주 신경 회로 내 통합 및 기능 조절을 평가했습니다.
프로토콜
모든 동물 실험은 베이징 실험동물과학협회(Beijing Association for Laboratory Animal Science)와 국립보건원(National Institutes of Health)에서 정한 실험 동물의 관리 및 사용에 관한 지침에 따라 수행되었습니다. 인간 말초 혈액 단핵 세포(PBMC)는 이전 연구에서 설명한 바와 같이 서면 동의서를 받은 건강한 기증자로부터 획득하였다17.
1. non-fusion DREADD 줄기 기반 세포주 구축
- DREADD 공여체 플라스미드를 구성합니다.
참고: 소화 부위는 벡터 서열에 따라 설계되어야 합니다. 단편은 조립 효율성을 향상시키기 위해 단편 암과 일치하는 20-30bp 겹침으로 합성 및 증폭되어야 합니다.- T2A-ZsGreen 조각(조각 I)을 설계하고 합성합니다.
- PCR(Fragment II)을 사용하여 원래 플라스미드에서 hM3Dq/hM4Di-T2A 단편을 증폭합니다. PCR 반응(총 부피 50μL)을 설정하여 PCR 완충액 1개, 각 dNTP 혼합물 200μM, 정방향 및 역방향 프라이머 0.5μM, 플라스미드 DNA 템플릿 10-50ng 및 고충실도 DNA 중합효소 1.25U를 포함합니다. 뒤에 오는 조건 하에서 thermocycling를 실행하십시오: 템플렛을 완전히 변성시키기 위하여 2.75 분 동안 98 °C에 처음 변성; 15 초 동안 98 ° C (변성), 30 초 동안 60 ° C (프라이머 어닐링) 및 60 초 (연장) 동안 72 ° C로 구성된 32 증폭주기; 72°C에서 7분 동안 최종 연장.
- 벡터 플라스미드를 적절한 효소로 분해하여 선형화된 벡터를 얻습니다. 아가로스 젤 전기영동으로 모든 단편을 정제하고 분광 광도계를 사용하여 정량화합니다.
참고: 여기서, 원래의 플라스미드는 MluI 및 SalI로 소화되었습니다.
- 50-100 ng의 선형화된 벡터, Fragment I 및 Fragment II를 2x Cloning Mix와 함께 1:3:3 몰비로 부드럽게 혼합합니다. 혼합물을 55°C에서 1시간 동안 배양하여 Gibson Assembly를 통한 상동 재결합을 촉진합니다.
- AAVS1 부위를 타겟으로 하는 guide RNA를 pX458 벡터의 BbsI 부위에 삽입합니다.
참고: Sanger 염기서열분석을 사용하여 구성된 모든 플라스미드에 대해 염기서열 검증을 수행합니다. - 배지에서 2-5 × 106 cells/mL의 세포 밀도를 목표로 재프로그래밍된 줄기세포를 유지합니다.
참고: 여기에 사용된 재프로그래밍된 줄기세포는 이전 연구17에서 설명한 바와 같이 인간 PBMC에서 유도되었습니다. 세포 상태가 electroporation 효율에 큰 영향을 미치기 때문에 세포 건강 모니터링이 필수적입니다. 미디어 비교는 Table of Materials 를 참조하십시오. - 100 μL의 전기천공법 완충액에 2-5 × 106 cells, 2 μg의 donor plasmid (hM4Di-T2A-ZsGreen 또는 hM3Dq-T2A-ZsGreen) 및 2 μg의 gRNA plasmid를 혼합하고 전기천공을 위해 큐벳으로 옮깁니다.
참고: 전기천공법을 진행하기 전에 혼합물이 잘 섞이고 기포가 없는지 확인하십시오. 세포 유형에 따라 electroporation 파라미터를 최적화하여 transfection 효율을 극대화할 수 있으며, 이는 장치에 따라 특정 조정이 필요할 수 있기 때문입니다. - Nucleofector를 B16 프로그램으로 설정하고 전기천공을 시작하여 타겟 iNSC의 효율적인 transfection을 촉진합니다.
- 6-well 플레이트의 각 웰에 50μg/mL poly-D-lysine(PDL) 1mL를 추가하고 실온에서 최소 2시간 동안 배양합니다. 웰에서 모든 PDL을 제거하고 각 웰에 1.5mL의 5μg/mL 라미닌을 첨가하고 37°C에서 2-4시간 동안 배양합니다. 코팅된 플레이트를 즉시 사용하거나 2-8°C에서 1주일 동안 보관하십시오.
- 전기천공된 세포를 PDL과 라미닌으로 코팅된 6웰 플레이트로 옮깁니다. 웰당 약 500,000개의 세포를 웰당 2mL 부피의 배양 배지에 분배합니다.
- 72시간의 전기천공 후 유세포 분석기를 사용하여 형광 양성 세포를 분류합니다.
- DPBS에서 해리된 세포를 재현탁하고 70μm 세포 스트레이너를 통해 필터링합니다.
- ZsGreen 검출을 위해 FITC 채널로 분류기를 구성합니다. 처리되지 않은 iNSC를 negative control로 포함하여 baseline 형광을 정의합니다.
- 20psi 피복 압력에서 100μm 노즐을 사용하여 기기를 보정합니다. single-cell confirmation을 통한 4방향 순도 정렬 모드를 구현합니다.
- PDL과 라미닌이 사전 코팅된 96웰 플레이트에 단일 ZsGreen+ 세포를 플레이트화하고 웰당 200μL의 배양 배지를 추가하여 초기 성장을 지원합니다. 7-14일 동안 배양 배지에서 유지
참고: 성공적인 통합을 나타내는 성장 및 형광의 징후가 있는지 매일 우물을 모니터링하고 긍정적인 우물에 레이블을 지정합니다. - GFP 필터 세트가 장착된 도립 형광 현미경을 사용하여 형광을 보이는 단일 클론을 분리합니다. 10배 배율로 복제된 화면. 지속적이고 균일한 ZsGreen 신호로 단클론 콜로니를 포함하는 우물을 표시합니다. 명시야 및 형광 이미지를 캡처하여 형태와 형광 강도를 문서화합니다.
참고: 이미징하기 전에 배경 형광을 줄이기 위해 새 배지를 교체하십시오. 불규칙한 형태 또는 자가형광이 있는 집락을 제외합니다. - 코팅된 48웰 플레이트에서 positive cells를 확장합니다. 그런 다음 두 부분으로 나뉘는데, 하나는 배양용이고 다른 하나는 유전형 분석용입니다.
- 후보 클론에서 게놈 DNA를 추출합니다. 두 개의 프라이머 쌍으로 PCR 반응을 준비합니다: 한 쌍은 관심 유전자의 삽입을 확인하기 위해, 다른 한 쌍은 동형접합 클론과 이형접합 클론을 구별하기 위한 프라이머. 다음 조건에서 열순환을 수행하십시오 : 95 °C에서 5 분 동안 초기 변성; 30초 동안 95°C, 30초 동안 60°C, 45초 동안 72°C의 38 사이클; 72°C에서 7분 동안 최종 연장. PCR 산물을 2% 아가로스 겔로 분해합니다.
참고: 프라이머에 대해서는 재료 표를 참조하십시오. 단일 650 bp 밴드(primer 1)에 의한 관심 유전자의 삽입을 확인합니다. 이형접합 클론은 단일 630 bp 밴드의 존재로 식별하고 동형접합 클론은 이 밴드의 부재로 식별합니다(primer 2). - 코팅된 6웰 플레이트에서 positive cells를 확장합니다.
- 세포를 소화하고 250 ×g에서 3 분 동안 원 심분리하여 인산염 완충 식염수(PBS)로 세척합니다. 바이알당 2.5 × 106 개 세포의 밀도로 10% DMSO를 사용하는 동결 보존 배지에서 세포를 동결합니다.
2. DREADD 줄기세포 유래 전구세포를 PD 모델 마우스에 이식
- 수술 30분 전에 면역 결핍 마우스에게 5mg/mL(10mg/kg) 농도의 데시프라민을 복강내 주사합니다. 2% 이소플루란으로 마우스를 마취합니다.
- 3μL의 6-하이드록시도파민(6-OHDA, 5μg/μL)을 일방적으로 입체 주사합니다. 전방 = 0.5mm, 측면 = 2.1mm, 수직 = -3.2mm 좌표를 사용하여 오른쪽 말뭉치 선조체를 대상으로 합니다.
참고: 6-OHDA는 0.2% 아스코르브산을 함유한 식염수에 용해되어야 합니다. 병변 중증도의 변동성을 최소화하기 위해 정확한 표적화를 보장합니다.
주의: 6-OHDA는 세포 독성이 있으며 세포 스트레스를 유발하는 활성 산소 종을 생성합니다. 조심히 다루십시오. - 수술 후 4주 후에 병변을 확인하기 위해 아포모르핀(1mg/kg, 식염수에 용해된 0.5mg/mL)의 복강내 주사를 투여합니다. 후속 실험을 위해 30분의 관찰 기간 내에 100회 이상의 반대쪽 회전을 보이는 병변 마우스를 선택합니다.
참고: 아포모르핀은 도파민 수용체 작용제로, 탈신경화된 선조체에서 초민감성 시냅스후 수용체를 직접 활성화하여 양측 흑질선조체 회로 활성의 균형을 깨뜨립니다. 아포모르핀 유도 회전은 6-OHDA에 의한 편측 도파민 병변의 중증도를 평가하는 역할을 합니다. - 코팅된 6웰 플레이트의 종자 및 배양 세포(웰당 150,000개 세포). Phase 1 분화 배지에서 10일 동안 배양하고 2일마다 배지를 새로 고칩니다. 11일째에 2상 분화 배지로 전환하고 13일까지 배양을 계속하면서 매일 배지를 변경합니다.
참고: 분화 매체의 비교는 Table of Materials 를 참조하십시오. - 분화 10일과 13일에 세포를 수확한 다음 1:7의 비율로 혼합합니다. 혼합물을 100,000 cells/μL의 농도로 이식 완충액에 현탁시킵니다.
참고: 이식 완충액의 비교는 재료 표를 참조하십시오. - 준비된 세포 현탁액의 총 부피 4 μL를 PD 마우스에 입체주사 주입합니다.
- 세포 이식 후 다양한 시점에서 실린더 테스트를 수행합니다. 유리 비커(직경: 20cm, 높이: 30cm)를 평평하고 반사되지 않는 표면에 놓습니다. 원통 위에 평면도 카메라를 배치하여 전체 지름을 캡처합니다.
알림: 외부의 시각적 자극을 제거하기 위해 실린더를 검은색 커튼으로 둘러쌉니다. - 각 마우스를 실린더 중앙에 놓고 동시 비디오 녹화를 시작합니다(3분/세션). 세션이 끝나면 마우스를 홈 케이지로 되돌립니다.
참고: 밝은 조건에서 30분 동안 마우스를 시험장에 적응시킵니다. 후각 신호를 제거하기 위해 시험 사이에 70% 에탄올로 실린더를 청소하십시오. - 3분 동안 마우스의 상지 운동 능력을 평가합니다. 두 앞다리가 만든 총 접촉 수에 대해 손상된 앞다리가 만든 벽 접촉 수를 계산합니다.
- 복강내 주사를 통해 식염수 또는 CNO를 1.2mg/kg의 용량으로 투여합니다. CNO 투여 후 PD 마우스 모델의 행동 조절을 평가하기 위해 실린더 테스트를 수행합니다.
참고: 평가를 진행하기 전에 약 40분의 복구 기간을 허용합니다.
3. 화학유전학적으로 조절된 세포의 생체 내 전기생리학적 프로파일링
- 250mg/kg 펜토바르비탈의 복강내 주사로 마우스를 마취합니다. 뇌를 추출하여 즉시 얼음처럼 차가운 자당 기반 인공 뇌척수액(s-ACSF)에 넣어 세포의 무결성을 유지합니다. 비브라톰을 사용하여 뇌를 300-400μm 두께의 부분으로 자릅니다.
알림: 세포 기능을 보존하기 위해 뇌를 저온으로 유지하기 위해 신속하게 작업하십시오. 신선한 뇌 절개 준비에 사용되는 s-ACSF에 대해서는 재료 표를 참조하십시오. - 34°C에서 95% O2 및 5% CO2 로 평형을 이룬 ACSF로 채워진 챔버로 샘플을 옮기고 실험 내내 이 온도가 유지되도록 합니다.
참고: ACSF 에 대한 재료 표를 참조하십시오. - 유리 피펫에 얼음 세포 내 용액을 주입하며, 전극 저항 범위는 7 - 10 MΩ입니다.
참고: 세포 내 용액에 대한 재료 표를 참조하십시오. 유리 피펫은 마이크로 피펫 풀러(18)에 의해 유리 모세관으로 만들어집니다. 실험을 시작하기 전에 유리 피펫에 누출이 있는지 확인하고 팁이 세포막을 관통할 수 있을 만큼 충분히 날카로운지 확인하십시오. 세포 내 용액의 온도 변동을 최소화하기 위해 피펫을 신속하게 준비합니다. - 34°C에서 산소화된 ACSF와 중첩된(2mL/분) 수침된 기록 챔버에 슬라이스를 장착합니다. 전동 micromanipulator를 사용하여 적외선 미분 간섭 대비 현미경 검사에서 피펫을 배치합니다. 이식 영역 내의 패치된 뉴런에 부드러운 흡입(저항 > 1GΩ)을 적용하여 전체 세포 구성을 확립합니다. 패치 클램프 증폭기를 사용하여 -70mV에서 셀 클램프; 10kHz 샘플링 속도(2kHz에서 필터링)에서 8분 동안 기준선 sEPSC를 획득하고 액세스 저항(목표: <20MΩ, >25MΩ 또는 변동>10%)인 경우 폐기)을 지속적으로 모니터링합니다.
참고: 원치 않는 세포 변위나 파열을 방지하기 위해 흡입을 적용할 때 적절한 압력을 사용하고 우수한 밀봉을 위해 피펫 위치를 조심스럽게 조정하십시오. 밀봉 품질이 좋지 않으면 피펫을 버리고 다시 시도하십시오. - 기준선 측정을 완료한 직후 기록 챔버에 50μM CNO를 추가하고 sEPSC 주파수 또는 진폭의 변화를 관찰하면서 추가로 16분 동안 데이터를 계속 기록합니다.
- CNO 용액을 새 ACSF로 교체하여 세척 절차를 수행하여 기록 챔버에서 CNO를 효과적으로 제거합니다. 시냅스 활동의 회복을 평가하기 위해 실험의 나머지 부분에 대한 데이터를 계속 기록합니다.
결과
그림 1 은 파킨슨병(PD)의 마우스 모델에서 파생된 도파민 전구체의 기능적 통합 및 조절을 평가하기 위해 흥분성(hM3Dq) 또는 억제성(hM4Di) DREADD 수용체를 발현하는 공학적 인간 재프로그래밍 줄기세포에 대한 이 방법론적 접근 방식의 주요 단계를 보여줍니다. 그림 2 는 hM4Di-T2A-ZsGreen 및 hM3Dq-T2A-ZsGreen의 비융합 구조를 재프로그래밍된 줄기세포에 도입하고 유전형 분석을 통해 검증하기 위한 CRISPR/Cas9 매개 유전자 knock-in 전략을 간략하게 설명합니다.
그림 3은 이식된 세포에서 화학유전학적 조절의 기능적 및 시냅스 효과를 특성화합니다. 우리는 이식된 DREADD 세포의 효과를 분석하기 위해 행동 평가와 전기 생리학적 기록을 수행했습니다. 그림 3A는 식염수, CNO 및 CNO 유실 후 조건에서 대조군, hM4Di 및 hM3Dq-그룹 전반에 걸친 실린더 테스트에서 반대쪽 앞다리 움직임 결과의 통계 분석을 보여줍니다. CNO 투여는 hM4Di 이식 동물에서 반대쪽 앞다리 관여를 감소시켰지만 식염수 대조군에 비해 hM3Dq 그룹에서 운동 성능을 향상시켰습니다. 그림 3B-D는 자발적 흥분성 시냅스후 전류(sEPSC)의 전기생리학적 분석을 보여줍니다. hM4Di 이식 그룹은 시냅스 침묵을 나타내는 연장된 이벤트 간격과 감소된 피크 진폭을 보인 반면, hM3Dq 이식 세포는 향상된 흥분성 신경 전달과 일치하는 단축된 간격과 증가된 진폭을 보여주었습니다. 그림 3E,F는 면역형광에 의해 in vivo에 이식된 세포를 특성화합니다.

그림 1: 마우스 모델에서 신경퇴행성 질환 치료를 위한 재프로그래밍된 줄기세포 유래 전구세포의 화학유전학적 조절. PD 마우스 모델을 확립하고 재프로그래밍된 줄기세포 유래 전구세포에서 화학유전학적 조절을 통해 행동 결과를 평가하기 위한 방법론적 접근 방식을 보여주는 흐름도. 1단계: CRISPR 기술을 활용한 비융합 DREADD 줄기세포주 구축. 2단계: PD 마우스 모델 확립 후 DREADD 줄기세포 유래 전구 세포를 뇌에 이식합니다. 3단계: 이식된 세포의 성공적인 통합 및 기능적 조절을 확인하기 위한 행동 및 전기생리학적 결과 평가. 약어: CRISPR = 군집된 규칙적으로 interspaced 짧은 회문 반복; DREADD = 디자이너 약물에 의해 독점적으로 활성화되는 디자이너 수용체; PD = 파킨슨병; 6-OHDA = 6-하이드록시도파민; CNO = 클로자핀 N-옥사이드. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: 비융합 DREADD 발현 줄기세포의 CRISPR/Cas9 매개 엔지니어링. (A) 비융합 hM4Di-T2A-ZsGreen 또는 hM3Dq-T2A-ZsGreen 구조를 재프로그래밍된 줄기세포에 통합하기 위한 CRISPR/Cas9 매개 유전자 넉인 전략을 보여주는 순서도. (B) 비융합 hM4Di-T2A-ZsGreen 또는 hM3Dq-T2A-ZsGreen의 공여체 플라스미드를 다단계 클로닝 전략을 통해 변형시켰다. 표적 대립유전자 발현은 재프로그래밍된 줄기세포에서 비융합 hM4Di-T2A-ZsGreen 또는 hM3Dq-T2A-ZsGreen의 유전자 넉인(knock-in)을 보여줍니다. 형광 이미지는 엔지니어링된 세포가 균일한 녹색 형광을 나타내어 성공적인 전이유전자 발현을 나타내는 것을 확인합니다. 스케일 바 = 200 μm. (C) 유전형 분석 결과는 DREADD 구조체가 표적 줄기 세포주의 게놈에 성공적으로 통합되었음을 확인합니다. 이 그림은 Wang et al.19에서 수정되었습니다. 약어: gRNA = 가이드 RNA; FACS = 형광 활성화 세포 분류; DREADD = 디자이너 약물에 의해 독점적으로 활성화되는 디자이너 수용체. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
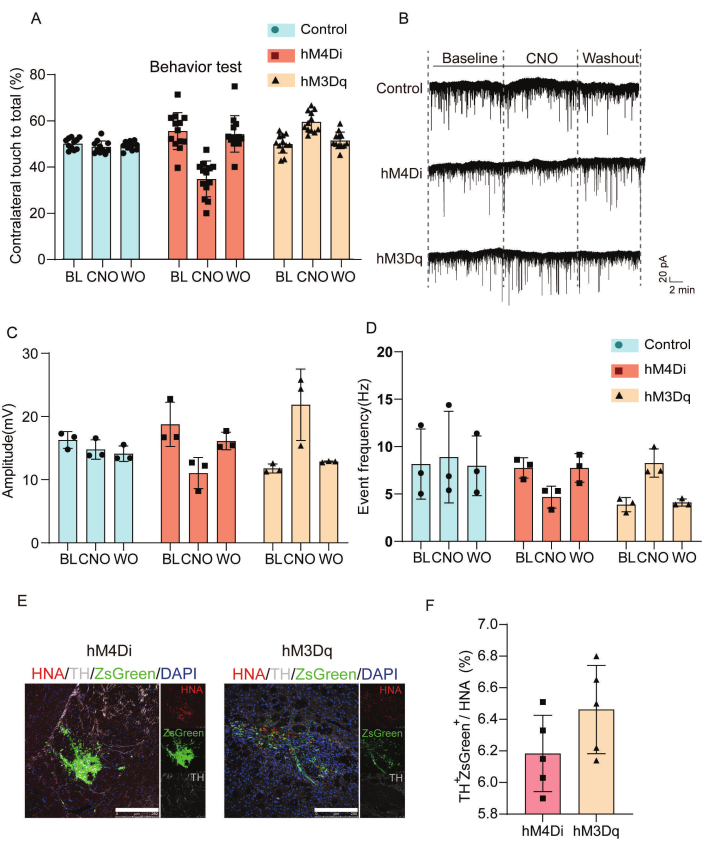
그림 3: 이식된 세포의 통합 및 기능적 조절을 확인하기 위한 행동 및 전기생리학적 결과 평가. (A) CNO 투여 후 PD 마우스 모델의 행동 변조 평가; 기준선 및 이식 후 8주에 hM4Di, hM3Dq 및 대조군 간의 실린더 테스트에서 반대쪽 앞다리 움직임 결과를 식염수 및 CNO 치료 후 수행된 평가와 CNO 세척 후 평가와 비교하는 상세한 통계 분석. (B) CNO 세척 단계와 함께 기준선 및 CNO (50 μM) 처리 중에 분석 된 대조군, hM4Di 또는 hM3Dq 그룹의 이식편에서 sEPSC를 보여주는 전체 세포 패치 클램프 기록. (C) 베이스라인, CNO 및 CNO 워시아웃에 걸쳐 sEPSC에 대한 피크 진폭 측정의 통계 분석. (D) 대조군, hM4Di 및 hM3Dq 그룹의 그래프트에서 기록된 sEPSC의 이벤트 빈도 통계. (E)면역형광을 통한 in vivo 이식된 세포의 특성화. 스케일 바 = 250μm. (F) 인간 핵 항원 발현과 관련하여 hM4Di 및 hM3Dq 그룹에서 티로신 하이드록실라제 및 ZsGreen의 발현에 대한 정량 분석. 이 그림은 Wang et al.19에서 수정되었습니다. 약어: BL = 기준선; CNO = 클로자핀 N-옥사이드(CNO, 50μM) 처리; WO = CNO를 씻어냅니다. PD = 파킨슨병; sEPSCs = 자발적인 흥분성 시냅스 후 전류; TH = 티로신 하이드록실라제; HNA = 인간 핵 항원. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
이 프로토콜은 CRISPR 기술을 활용하여 흥분성 hM3Dq 및 억제성 hM4Di 수용체를 발현하도록 인간 재프로그래밍된 줄기세포를 엔지니어링했습니다. CNO에 의한 뉴런 활동의 조절은 파킨슨병의 마우스 모델로의 세포 이식을 통해 평가되었으며, 행동 평가 및 전기생리학적 기록이 수반되었습니다.
화학유전학적으로 재프로그래밍된 줄기세포에서 안정적으로 발현된 비융합 DREADD 구조체를 생성하는 첫 번째 중요한 단계는 T2A-ZsGreen bicistronic 카세트와 관련이 있습니다. 그러나 hM3Dq-mCherry 및 hM4Di-mCherry7과 같은 융합 단백질 발현 플라스미드는 이러한 유도 신경 줄기 세포주에 효과적이지 않습니다. 이를 피하기 위해 프로토콜 단계 1.1-1.2에 자세히 설명된 대로 Gibson 어셈블리를 통해 공여체 플라스미드를 설계했습니다.
면역결핍 마우스의 선조체에 6-OHDA의 입체 주사를 일방적으로 투여하여 PD 모델을 확립하는 것은 정확한 in vivo 조절에 매우 중요합니다. 세포 이식 및 약물 치료를 포함한 전체 연구 기간 동안 일부 동물은 예상치 못한 폐사를 경험할 수 있습니다. 따라서 실험군15,17에 대한 충분한 수를 확보하기 위해 초기 표본 크기를 신중하게 계획해야 합니다.
아포모르핀 유도 회전 테스트, 실린더 테스트 및 로타로드 테스트를 포함하여 DREADD 조절에 대한 동물의 행동 반응을 평가하기 위해 운동 기능과 관련된 여러 행동 테스트를 사용할 수 있습니다. 여기서 우리는 실린더20의 벽과 앞다리 접촉을 정량적으로 측정하는 실린더 테스트를 사용했습니다. 신경 손상으로 인한 상지 사용의 변화를 평가함으로써 실린더 테스트는 CNO가 운동 기능을 향상시킬 수 있는 방법에 대한 귀중한 통찰력을 제공합니다.
숙주 신경 회로 내에서 화학유전학적으로 재프로그래밍된 기증자 세포의 기능적 통합과 시냅스 연결성은 PD16과 같은 신경퇴행성 질환에 대한 치료 효능의 중요한 결정 요인입니다. 이식 후 뇌 절편에 대해 수행된 전체 세포 패치 클램프 기록은 이러한 조작된 세포가 기본 신경 회로와 어떻게 상호 작용하는지에 대한 통찰력을 제공합니다. 선조체의 중간 가시 뉴런(Medium spiny neuron, MSN)은 도파민 신호전달의 다운스트림 표적입니다.
MSN을 기록하는 패치 클램프를 사용하여 DREADD 변형 세포가 신경 회로에 통합되고 기능에 영향을 미치는 방법을 정확하게 평가할 수 있습니다21. 뚜렷한 시술 단계를 위한 인공 뇌척수액(ACSF) 구성은 패치 클램프에 매우 중요합니다. 슬라이스를 준비하는 동안 자당 기반 인공 뇌척수액(s-ACSF)을 사용하는 것이 좋습니다. 자당의 과삼투압 특성은 세포 생존력에 필수적인 이온 구배를 유지하면서 절편 중 신경 세포 팽창을 완화합니다. 전극 제작 및 품질 관리는 기록 안정성을 직접적으로 좌우합니다. 7-10MΩ의 팁 저항으로 당겨진 붕규산 유리 피펫은 지속적인 sEPSC 기록을 위한 타협할 수 없는 전제 조건을 나타냅니다. 저항이 5 MΩ 미만인 최적이 아닌 피펫은 피펫 용액과 세포질 사이의 확산 교환이 가속화되어 3-5분 내에 점진적인 전류 런다운을 초래합니다.
그러나 본 연구는 조작된 iNSC-DAP를 통해 PD 마우스의 운동 행동 및 시냅스 활성의 화학유전학적 조절을 보여주고, 이중 입체택시 중재 및 만성 CNO 투여와 관련된 상당한 절차적 감소는 특히 외과적 표준화와 관련하여 면역 저하 모델에서 정교한 이종 이식 패러다임의 필요성을 강조합니다. CRISPR/Cas9 매개 DREADD 수용체 엔지니어링과 행동 분석(실린더 테스트) 및 전체 세포 패치 클램프 전기생리학을 통한 회로 수준 조사를 결합한 이 전략은 뉴런 하위 유형 특이적 신경 조절 청사진을 제공하고 신경 퇴행성 질환에 대한 정밀 세포 치료를 발전시킬 수 있는 다재다능한 툴킷을 제공합니다.
공개
저자는 공개할 이해 상충이 없습니다.
감사의 말
이 연구는 베이징자연과학재단(7242068), 중국국립자연과학재단(82171250), 베이징시 보건위원회 기금(PXM2020_026283_000005) 및 베이징 산하 의학연구소 기술개발프로젝트(11000023T000002036310)의 지원을 받았다.
자료
| Name | Company | Catalog Number | Comments |
| 2 x Rapid Taq Master Mix | Vazyme | P222-01 | used for genotyping analysis |
| 2×Seamless Cloning Mix | Biomed Gene Tech. | CL117-01 | used for plasmid construction |
| 6-OHDA | Sigma-Aldrich | H4381 | used for establishing PD mice model |
| AAVS1-Pur-CAG-EGFP | Addgene | 80945 | used as control |
| AAVS1-Pur-CAG-hM4Di-mCherry | Addgene | 80947 | original plasmid for construction of hM4Di-T2A-ZsGreen |
| AAVS1-Pur-CAG-hM3Dq-mCherry | Addgene | 80948 | original plasmid for construction of hM3Dq-T2A-ZsGreen |
| AAVS1-CAG-hM4Di-T2A-ZsGreen | N/A | N/A | Constructed donor plasmid based on #80947 |
| AAVS1-CAG-hM3Dq-T2A-ZsGreen | N/A | N/A | Constructed donor plasmid based on #80948 |
| Accutase | Invitrogen | A11105-01 | Used for digesting cells |
| AMAXA Nucleofector | Lonza | AAD-1001S | |
| Apomorphine | Sigma-Aldrich | A4393 | |
| Artificial cerebrospinal fluid (ACSF) | N/A | N/A | 125 mM NaCl, 2.5 mM KCl, 2 mM CaCl2, 1.25 mM NaH2PO4, 1 mM MgSO4, 25 mM glucose, and 26 mM NaHCO3 |
| Ascorbic acid | Sigma-Aldrich | 1043003 | |
| B-27 Supplement | Gibco | 17504044 | |
| BDNF | Peprotech | 450-02 | |
| cAMP | Sigma-Aldrich | D0627 | |
| CHIR99021 | Yeasen | 53003ES10 | |
| Clozapine-N-oxide | Enzo | BML-NS105 | |
| DAPT | Sigma-Aldrich | D5942 | |
| Desipramine | Sigma-Aldrich | D3900 | |
| D-glucose | Sigma-Aldrich | G5767 | |
| DMEM/F12 | Gibco | 11330-032 | |
| DMEM/F12 | Gibco | 11320-033 | |
| DMSO | Sigma-Aldrich | D2650 | |
| FGF8 | Peprotech | 100-25 | |
| GDNF | Peprotech | 450-10 | |
| GlutaMax | Gibco | 35050-061 | |
| Hank’s Balanced Salt Solution (HBSS) | Gibco | 14175095 | |
| Human leukemia inhibitory factor (hrLIF) | Millipore | LIF1010 | |
| Iced intracellular fluid | N/A | N/A | 130 mM K-gluconate, 16 mM KCl, 0.2 mM EGTA, 2 mM MgCl2, 10 mM HEPES, 4 mM Na2-ATP, 0.4 mM Na3-GTP, 0.3% of neurobiotin |
| KnockOut Serum Replacement | Gibco | 10828028 | |
| Laminin | Roche | 11243217001 | |
| Micropipette Puller | Sutter Instrument Company | P-1000 | |
| N-2 Supplement | Thermo Fisher | 17502048 | |
| Neurobasal-A Medium | Gibco | 10888-022 | |
| Non-essential amino acids (NEAA) | Gibco | 11140-050 | |
| PBS | Gibco | 10010023 | |
| pCLAMP 11 software suite | Molecular Devices | N/A | Patch-clamp electrophysiology data acquisition and analysis software |
| Phase 1 differentiation medium | N/A | N/A | 96% DMEM/F12 (Gibco, 11320-033), 1% B-27 Supplement, 1% N-2 Supplement, 1% NEAA, 1% GlutaMax, 1 µM SAG1, and 100 ng/mL FGF8 |
| Phase 2 differentiation medium | N/A | N/A | 96% DMEM/F12 (Gibco, 11320-033), 1% B-27 Supplement, 1% N-2 Supplement, 1% NEAA, and 1% GlutaMax, 10 ng/mL BDNF, 10 ng/mL GDNF, 1 ng/mL TGF-βIII, 10 µM DAPT, 0.2 mM ascorbic acid, and 0.5 mM cAMP. |
| Poly-D-lysine hydrobromide (PDL) | Sigma-Aldrich | P7886 | |
| Primers for genotyping | N/A | N/A | Insertion Foward: TCTTCACTCGCTGGGTTCCCTT; Insertion Reverse: CCTGTGGGAGGAAGAGAAGAGGT; Homozygosity Foward:CGTCTCCCTGGCTTTAGCCA; Homozygosity Reverse: GATCCTCTCTGGCTCCATCG |
| pX458 | Addgene | 152199 | |
| SAG1 | Enzo | ALX-270-426-M01 | |
| SB431542 | Yeasen | 53004ES50 | |
| sucrose-based artificial cerebrospinal fluid (s-ACSF) | 234 mM sucrose, 2.5 mM KCl, 26 mM NaHCO3, 1.25 mM NaH2PO4, 11 mM Dglucose, 0.5 mM CaCl2, and 10 mM MgSO4 | ||
| Stem cell culture media | N/A | N/A | 48% DMEM/F12 (Gibco, 11330-032) and 48% Neurobasal, with the addition of 1% B27, 1% N2, 1% NEAA, 1% GlutaMax, 10 ng/mL hrLIF, 2 µM SB431542, and 3 µM CHIR99021 |
| TGF-βIII | Peprotech | 100-36E | |
| Transplantation buffer | N/A | N/A | HBSS buffer with 5 g/L D-glucose, 100 ng/mL BDNF, 100 ng/mL GDNF, and 0.2 mM ascorbic Acid |
| Vibratome | Leica | VT1000 S | |
| Whole-cell patch-clamp | Molecular Devices | MultiClamp700B |
참고문헌
- Thiel, G. Designer receptors exclusively activated by designer drugs. Humana Press (2015).
- Roth, B. L. Dreadds for neuroscientists. Neuron. 89 (4), 683-694 (2016).
- Gomez, J. L. et al. Chemogenetics revealed: DREADD occupancy and activation via converted clozapine. Science. 357 (6350), 503-507 (2017).
- Chehelgerdi, M. et al. Exploring the promising potential of induced pluripotent stem cells in cancer research and therapy. Mol Cancer. 22 (1), 189 (2023).
- Song, J., Patel, R. V., Sharif, M., Ashokan, A., Michaelides, M. Chemogenetics as a neuromodulatory approach to treating neuropsychiatric diseases and disorders. Mol Ther. 30 (3), 990-1005 (2022).
- Parmar, M., Grealish, S., Henchcliffe, C. The future of stem cell therapies for Parkinson disease. Nat Rev Neurosci. 21 (2), 103-115 (2020).
- Dell'anno, M. T. et al. Remote control of induced dopaminergic neurons in Parkinsonian rats. J Clin Invest. 124 (7), 3215-3229 (2014).
- Chen, Y. et al. Chemical control of grafted human PSC-derived neurons in a mouse model of Parkinson's disease. Cell Stem Cell. 18 (6), 817-826 (2016).
- Bjorklund, A. Parmar, M. Dopamine cell therapy: From cell replacement to circuitry repair. J Parkinsons Dis. 11 (S2), S159-S165 (2021).
- Alcacer, C. et al. Chemogenetic stimulation of striatal projection neurons modulates responses to Parkinson's disease therapy. J Clin Invest. 127 (2), 720-734 (2017).
- Alexander, G. M. et al. Remote control of neuronal activity in transgenic mice expressing evolved G protein-coupled receptors. Neuron. 63 (1), 27-39 (2009).
- Stachniak, T. J., Ghosh, A., Sternson, S. M. Chemogenetic synaptic silencing of neural circuits localizes a hypothalamus midbrain pathway for feeding behavior. Neuron. 82 (4), 797-808 (2014).
- Kang, H. J., Minamimoto, T., Wess, J., Roth, B. L. Chemogenetics for cell-type-specific modulation of signalling and neuronal activity. Nat Rev Methods Primers. 3 (1), 93 (2023).
- Miyanishi, K. et al. Behavioral tests predicting striatal dopamine level in a rat hemi-Parkinson's disease model. Neurochem Int. 122, 38-46 (2019).
- Zheng, X. et al. Human IPSC-derived midbrain organoids functionally integrate into striatum circuits and restore motor function in a mouse model of Parkinson's disease. Theranostics. 13 (8), 2673-2692 (2023).
- Xiong, M. et al. Human stem cell-derived neurons repair circuits and restore neural function. Cell Stem Cell. 28 (1), 112-126.e116 (2021).
- Yuan, Y. et al. Dopaminergic precursors differentiated from human blood-derived induced neural stem cells improve symptoms of a mouse Parkinson's disease model. Theranostics. 8 (17), 4679 (2018).
- Zhu, M. et al. Preparation of acute spinal cord slices for whole-cell patch-clamp recording in substantia gelatinosa neurons. J Vis Exp. (143) (2019).
- Wang, X., Han, D., Zheng, T., Ma, J., Chen, Z. Modulation of human induced neural stem cell-derived dopaminergic neurons by DREADD reveals therapeutic effects on a mouse model of Parkinson's disease. Stem Cell Res Ther. 15 (1), 297 (2024).
- Iancu, R., Mohapel, P., Brundin, P., Paul, G. Behavioral characterization of a unilateral 6-OHDA-lesion model of Parkinson's disease in mice. Behav Brain Res. 162 (1), 1-10 (2005).
- Surmeier, D. J. et al. The role of dopamine in modulating the structure and function of striatal circuits. Prog Brain Res. 183, 148-167 (2010).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유