Method Article
Sıçan Miyokardiyal İskemi-Reperfüzyon Yaralanması Modelinde Diferansiyel Genlerin Analizi ve Disülfideptozun Validasyonu
Bu Makalede
Özet
Protokol, biyoinformatik analiz ve deneysel doğrulama ile miyokardiyal iskemi-reperfüzyon hasarı ile ilişkili birkaç yeni disülfideptozla ilişkili diferansiyel genin tanımlanmasını açıklar.
Özet
Miyokardiyal iskemi-reperfüzyon hasarı (MIRI), iskemiye bağlı yaralanma sonrası kalp dokusu kan akışını eski haline getirme sürecinde ortaya çıkan ek bir yaralanmadır. MIRI, miyokard infarktüsü sonrası reperfüzyonun etkinliğini, kısa ve uzun dönem prognozunu ciddi şekilde etkiler. Şu anda, MIRI'nin mekanizması tam olarak açık değildir. Disülfideptoz, yeni bir hücre ölümü şeklidir ve MIRI ile disülfideptozla ilişkili genler (DRG'ler) ekspresyonu arasındaki ilişki hala belirsizdir. İlk olarak, bu çalışma biyoinformatik analiz yoluyla MIRI'de disülfideptoz ile ilişkili diferansiyel olarak eksprese edilen genleri araştırmaktadır. İkinci olarak, MIRI'nin bir sıçan modeli oluşturularak, DRG'ler daha fazla tespit edildi. Bu çalışma, Myh9, SLC7A11, SLC3A2, Myh7b, ACTB, FLNB, Actn1, Actn4, Flnc, Dbn1 ve Pdlim1 dahil olmak üzere 12 ilgili geni tanımladı. MIRI'li sıçanların miyokard dokusu belirgin patolojik hasar ve apoptoz olayları gösterir. İmmünohistokimya sonuçları, MIRI stimülasyonunun miyokard dokusunda GLUT1 proteininin ekspresyonunu arttırdığını, ancak F-aktin proteininin ekspresyonunu kısıtladığını gösterdi. Ek olarak, üç proteinin ekspresyonundaki önemli farklılıklar, harici veri setleri ve MIRI sıçan modelleri kullanılarak doğrulandı. Bu çalışma, DRG'lerin MIRI'de önemli bir prediktif değere sahip olduğunu ve MIRI'nin biyobelirteçlerini ve potansiyel terapötik hedeflerini keşfetmek için yeni beklentiler sağladığını göstermiştir.
Giriş
Akut miyokard enfarktüsü (AMİ) ciddi bir kardiyovasküler hastalıktır ve önde gelen küresel mortalite nedeni olmaya devam etmektedir. Perkütan koroner girişim hastalarında mortalite oranlarını önemli ölçüde azaltmıştır1. Bununla birlikte, miyokardiyal kan akışını geri kazanmayı amaçlayan reperfüzyon tedavisine bir dizi olumsuz patolojik ve fizyolojik yanıt eşlik eder. Bu süreçler enfarktüs boyutunun artmasına, miyokard hücre ölümüne, sürekli ventriküler aritmilere ve ani ölüme neden olabilir2. Miyokardiyal iskemi-reperfüzyon hasarı (MIRI), sitokinler, kemokinler, büyüme faktörleri, oksidatif stres ve aşırı kalsiyum yükü gibi faktörlerden etkilenen karmaşık bir kardiyovasküler durumdur3. MIRI'yi azaltmak önemli bir zorluk olmaya devam etmektedir.
Son zamanlarda, disülfideptoz, NADPH + tükenmesinden kaynaklanan hücreler içinde sistein de dahil olmak üzere disülfidlerin aşırı birikimi nedeniyle hücre iskeleti aktin ağının hızlı bir şekilde çökmesi ile karakterize yeni bir hücre ölümü şekli olarak ortaya çıkmıştır. Aşırı disülfid birikimi, hücre iskeleti proteinleri arasındaki disülfid bağlarını bozarak aktin göçüne ve hücre ölümüne yol açar 4,5. Apoptoz, nekroz, piroptoz ve ferroptoz gibi daha önce bildirilen hücre ölümü formlarının aksine, disülfideptoz, hücre içi disülfidlerin aşırı agregasyonu ile başlatılır ve diğer hücre ölüm yollarının spesifik inhibitörleri tarafından antagonize edilmez. Ayırt edici bir hücre ölümü olarak, kanıtlar hücresel glukoz eksikliğinin uyardığı SLC7A11 aşırı eksprese edilmesinin disülfidpttozutetikleyebileceğini göstermiştir 4. MIRI'den sonra, yetersiz insülin sekresyonu hipoglisemiyi ve ardından disülfidtozu indükleyebilir, bu da miyokard hücrelerinde daha fazla hasara neden olabilir ve MIRI5'in yeni mekanizmalarından biri olabilir.
Bu çalışmada birincil amaç, normal ve MIRI örnekleri arasındaki diferansiyel gen ekspresyonunu analiz etmek için Gene Expression Omnibus (GEO) gibi kapsamlı gen ekspresyon veritabanlarını kullanmaktı. MIRI'da diferansiyel ekspresyon sergileyen disülfideptozla ilişkili genleri (DRG'ler) tanımlamak amacıyla, diferansiyel olarak ifade edilen genler ve disülfideptoz ile ilişkili genler arasında çapraz referanslı bir analiz gerçekleştirdik. Anahtar genleri tanımlamak için makine öğrenimi algoritmaları kullanıldı ve bir hayvan modeli kullanarak seçilen diferansiyel genlerin ifade modellerini doğruladık. Bu yaklaşım, MIRI'nin başlangıcı ve ilerlemesinin altında yatan potansiyel mekanizmaların daha derin bir şekilde anlaşılmasına yönelik yeni bir bakış açısı sağlar. Bu araştırmanın birincil odak noktası, MIRI içinde yeni bir hücre ölüm mekanizmasını araştırmak, ilişkili diferansiyel genleri ortaya çıkarmak ve bu bulguları doğrulamak için ön deneyler yapmaktı. Nihai hedef, ortaya çıkan bu hücre ölümü mekanizmasına dayalı olarak MIRI'yi hafifletmek için yeni terapötik hedefler belirlemekti.
Protokol
Bu çalışma için, 6-8 haftalık ve 180-220 g ağırlığındaki dokuz Sprague-Dawley (SD) erkek sıçan, Hubei Deneysel Hayvan Araştırma Merkezi'nden [SCXK (Hubei) 20200018] seçildi. Sıçanlar, 12 saat / 12 saat aydınlık ve karanlık döngüsü, serbest içme ve yeme ile 1 hafta boyunca iklimlendirmek için belirli patojen içermeyen hayvan barınaklarında tutuldu. Bu çalışma, Zunyi Tıp Üniversitesi Üçüncü Bağlı Hastanesi Hayvan Etik Kurulu'nun onayı ile gerçekleştirilmiştir (onay numarası: (2016)-1-56). Tüm prosedürler, ABD Ulusal Sağlık Enstitüleri tarafından yayınlanan Laboratuvar Hayvanlarının Bakımı ve Kullanımı Kılavuzu'nda belirtilen önerilere uygun olarak gerçekleştirildi. Kullanılan hayvan sayısını en aza indirmek ve acılarını hafifletmek için sıkı önlemler alındı.
1. MIRI ve disülfideptoz ile ilgili genlerin diferansiyel ekspresyon analizi
NOT: Literatür raporu6'ya göre disülfideptoz ile ilişkili genleri taramak için GSE214122 adlı MIRI'den alınan RNA dizileme verileri seçilmiştir.
- GEO veritabanını açın, Arama kutusuna GSE214122 yazın ve Enter'a tıklayın. Oluşturulan Seri Matris Dosyalarını İndir bölümünün altındaki TXT formatında indirin.
NOT: Veri analizi yapmadan önce, indirilen verilerin genellikle önceden işlenmesi gerekir. Bu, eksik değerlerin kontrol edilmesini, düşük kaliteli örneklerin ve genlerin çıkarılmasını ve veriler üzerinde normalleştirme veya standardizasyon yapılmasını içerir. Alınan GSE214122 veri seti, sahte olarak işletilen ve MIRI gruplarından örnekler içeriyordu. - DESeq2 paket7'yi kullanarak numunelerin diferansiyel gen ekspresyon analizini gerçekleştirin. |log2FC|>1 (2'den büyük kat değişimi) ve FDR<0.05 olan genleri istatistiksel olarak anlamlı olarak düşünün, bu da MIRI ile ilişkili diferansiyel olarak ifade edilen genlerin tanımlanmasıyla sonuçlanır. R'nin pheatmap paketi7'yi kullanarak adım 1.2'de diferansiyel gen ekspresyonunun bir ısı haritasını oluşturun.
- R'nin VennDiagram paketi7'yi kullanarak bir Venn şeması oluşturun (Malzeme Tablosuna bakın). R7'de bir EnhancedVolcano paketi kullanarak disülfideptozla ilgili genleri görselleştirmek için Volkan grafikleri oluşturun.
- STRING veritabanını7 kullanarak MIRI'nin diferansiyel olarak ifade edilen genlerini disülfideptoz genleriyle birleştiren bir PPI ağı oluşturun (bkz. Malzeme Tablosu).
2. Sıçan MIRI modelinin inşası
- Anestezi yapmadan önce fareleri gece boyunca oruç tutun. Sıçanları% 2 sodyum pentobarbital (40 mg / kg) intraperitoneal enjeksiyonu ile uyuşturun ve uzuvları sırtüstü pozisyonda bir sıçan tahtasına sabitleyin. Ayak parmağını sıkıştırmaya, sağa çevirme refleksinin kaybına ve göz kırpma refleksine yanıt vermeyerek anestezi derinliğini onaylayın. Anestezi altındayken kuruluğu önlemek için veteriner merhemi kullanın.
- Boyun ve göğüs derisini iyodofor ile dezenfekte edin ve% 75 alkol ile deiyodinat edin. Boynun kürkünü ve sol göğsü elektrikli bir tıraş bıçağıyla tıraş edin ve bir neşter ile yaklaşık 2,5 cm uzunluğunda medyan bir boyun kesisi yapın (bkz.
- Trakeayı forseps ile ayırın ve küçük bir hayvan ventilatörüne3 bağlantı ile endotrakeal entübasyon yapın (bkz. Malzeme Tablosu).
- Oftalmik makasla sternumun sol tarafı boyunca uzunlamasına 4 cm kesin ve üçüncü ve dördüncü kaburgalar arasındaki plevrayı ortaya çıkarmak için deri altı kasları forseps ile künt bir şekilde ayırın.
- Neşteri 45°'lik bir açıyla tutarken ksifoid prosesten sol ikinci interkostal boşluğun ortasına kadar 4-5 cm'lik bir kesi yapın. İnterkostal boşluğa erişmek için oftalmik forseps kullanarak pektoralis majör ve ön serratus kaslarını nazikçe ve yavaşça ayırın.
- Oftalmik makas kullanarak sol, üçüncü ve dördüncü kaburgalar arasında 1,5 cm'lik enine bir kesi yapın. Oftalmik forseps kullanarak perikardın disekeksiyonundan sonra, aort kökündeki koroner ostium'u tanımlamak için sol atriyal apendiksleri forseps ile kaldırın.
- Pulmoner koni ile sol atriyal apendiks arasındaki sol ön inen koroner arteri 6-0 sütür kullanarak ligatür yapın (bkz.
- 30 dakika sonra, 120 dakika boyunca reperfüzyona izin vermek için dikişi gevşetin, ardından 6-0 sütür kullanarak kas ve cilt katmanlarını kapatın. Penisilini (Malzeme Tablosuna bakınız) intraperitoneal olarak 80.000-100.000 ünite enjekte ederek uygulayın.
- Sahte grupta, model grup için yapılan tüm prosedürleri gerçekleştirin, ancak ligasyon veya reperfüzyon olmadan sadece sol ön inen koroner arteri geçirin.
- Sıçanlar bilincini geri kazandığında, endotrakeal tüpleri çıkarın. Fareleri, yiyecek ve suya ücretsiz erişime sahip olacakları kurtarma için hayvan tesisine geri koyun. Ameliyata tabi tutulan fareyi steril bir laboratuvarda bağımsız bir havalandırma sistemine sahip tek bir kafeste barındırın.
- 30 dakika iskemi ve 120 dakika reperfüzyon sırasında ekokardiyografi yapın. Sol ventrikül ejeksiyon fraksiyonu %50'den az ölçüldüğünde modelleme başarılı kabul edildi1,6.
3. Kalp dokusunu hasatedin 3
- 120 dakikalık reperfüzyondan sonra, karbondioksitin solunmasıyla ötenazi uygulamak için fareleri ötenazi kabına yerleştirin. Sıçanın kalp dokularını hemen toplayın.
- Farelerin karın kıllarını bir tıraş cihazıyla çıkarın ve göğsün ön bölgesini iyot ve% 75 alkol ile sterilize edin. Sıçanın karın boşluğunu karnın orta hattı boyunca bir neşter ile inceleyin.
- Cildi ksifoid süreçten yukarı doğru cerrahi makasla submandibular boşluğa doğru kesin ve torasik kafesi ve yüzeysel servikal kas tabakasını ortaya çıkarmak için cildi ve deri altı dokusunu her iki tarafa forseps ile künt bir şekilde soyun (bkz.
- Kalbi ortaya çıkarmak için orta hat boyunca göğüs ve plevrayı cerrahi bir makasla açın, aortu vasküler bir klipsle klempleyin ve arteri oftalmik makasla kesin. Kalbi çıkarın ve buz banyosunda soğuk tuzlu su içinde 1 mm'lik3 doku bloğuna diseke edin ve 48 saat boyunca% 4 paraformaldehit ile sabitleyin (bkz.
4. Hematoksilen-eozin (H & E) boyaması
- Dehidrasyon ve gömme: Her solüsyonda 1 saat boyunca sırayla %75 alkol, %85 alkol, %95 alkol (I), %95 alkol (II), %100 alkol (I) ve %100 alkol (II) içinde ıslatarak kalp dokusu bloğunu kurutun. Her çözeltiye 15 dakika daldırarak ksilen (I) ve ksilen (II) ile şeffaflaştırın. Kalp dokusu bloğunu sırayla 20-30 dakika boyunca sıvı parafin (I), parafin (II) ve parafin (III) içine yerleştirin. Parafin bloğunun katılaşana kadar doğal olarak soğumasına izin verin.
- Parafine gömülü kalp dokusu bloğunu bir parafin dilimleme makinesi kullanarak 4 μm'lik bölümlere ayırın (bkz. Malzeme Tablosu). Bölümleri 45 ° C'lik bir su banyosunda yumuşak bir fırça ile düz bir şekilde yerleştirin ve ardından tamamen genişlemiş bölümleri bir sürgü ile alın.
- Mum alma: Dilimleri 55 °C'de 30-60 dakika fırında pişirin ve ksilen (I) ile 5-10 dakika ve ksilen (II) ile 5-10 dakika mumdan arındırın. Daha sonra ksileni mutlak etanol ile 1-5 dakika, %95 etanol ile 1-5 dakika ve %75 etanol ile 1-5 dakika yıkayın ve musluk suyu ile 1-5 dakika durulayın.
- Boyama: 5-20 dakika hematoksilen solüsyonu ile boyayın, 5-10 saniye musluk suyu ile durulayın, 15-30 saniye eozin solüsyonu ile boyayın ve 30 saniye boyunca% 75 -% 85 etanol ile yıkayın.
- Dehidrasyon, şeffaf ve sızdırmazlık: 0,5-2 dakika boyunca% 95 etanol (I) ve% 95 etanol (II) 2-5 dakika dehidre edin, ardından 2-5 dakika boyunca mutlak etanol (I) ve 2-5 dakika boyunca mutlak etanol (II) . Ksilen (I) ile 1 dakika ve ksilen (II) ile 1 dakika şeffaflaştırın ve ardından dilimin üzerine iki damla nötr reçine ekleyerek dilimi kapatın ve bir kapak camı yerleştirin. Dilimi nötr reçine ile doldurmak için kapak camına hafifçe bastırın (Malzeme Tablosuna bakın).
- Her dilimi optik mikroskop altında 200x büyütmede iki bağımsız teknisyen tarafından çift kör bir şekilde gözlemleyin.
- Miyokard tıkanıklığı, kanama, fibroz, nekroz ve dejenerasyonu değerlendirmek için rastgele üç görsel alan seçin. Aşağıdaki puanlama kriterlerini kullanın: 0 lezyon olmadığını gösterdi; 0-1 belirtilen lezyonlar belirlenen alanın 1 / 4'ünden daha azdı; 1-2 belirtilen lezyonlar, belirlenen alanın yaklaşık 1/4−1/2'si arasında değişmektedir; Belirtilen 2-3 lezyon, belirlenen alanın yaklaşık 1/2−3/4'ü arasında değişmektedir; ve belirtilen 3-4 lezyon belirlenen alanın 3/4'ünden daha büyüktü.
5. TUNEL testi
- Proteinaz K'yi fosfat tampon çözeltisi (PBS) ile 40 μg/mL'ye seyreltin ve tüm numune alanını kaplayacak şekilde adım 4.3'te hazırlanan 4 μm'lik bölümlere 100 μL proteinaz K ekleyin ve oda sıcaklığında 10 dakika inkübe edin.
NOT: Proteinaz K, TUNEL apoptoz tespit kitine dahildir (bkz. Malzeme Tablosu). - Bölümü 2x PBS ile her biri 5 dakika yıkayın, fazla sıvıyı filtre kağıdı ile emerek çıkarın ve bölümü ıslak bir kutuda nemli tutun.
NOT: Proteinaz K, sonraki etiketleme reaksiyonlarına müdahale etmemek için yıkanarak temizlenmelidir. - 2 μL TdT enzimi ve 48 μL TUNEL reaksiyon tamponu içeren 50 μL TUNEL reaksiyon solüsyonunu homojen bir şekilde ekleyin ve bölümü karanlıkta 37 ° C'de 2 saat inkübe etmek için ıslak bir kutuya yerleştirin.
NOT: TdT enzimi ve TUNEL reaksiyon tamponu, TUNEL apoptoz tespit kitine dahildir. - TUNEL reaksiyon solüsyonunu atın ve 2x'i PBS ile her biri 5 dakika durulayın. Bölümü 3x'i her biri 5 dakika boyunca %0.1 Triton X-100 ve 5 mg/mL BSA içeren PBS ile yıkayın.
- Düzgün bir şekilde 50 μL DAPI boyama solüsyonu ekleyin ve karanlıkta oda sıcaklığında 10 dakika inkübe edin. DAPI boyama solüsyonunu atın ve bölümü her seferinde 3x, 5 dakika PBS'ye batırın.
- Sırasıyla 593/614 nm ve 364/454 nm uyarma ve emisyon dalga boylarında TUNEL kırmızı ve DAPI mavi sinyalleri elde edin. Floresan mikroskobu altında 200x büyütmede görüntü yakalayın (bkz. Malzeme Tablosu).
6. İmmünohistokimyasal boyama
- Adım 4.3'teki bölüme 200 μL gelişmiş endojen peroksidaz bloke edici tampon ekleyin ve karanlıkta oda sıcaklığında 10 dakika inkübe edin. Bölüm 2x'i her biri 5 dakika damıtılmış suyla yıkayın.
- Antikor inkübasyon kutusuna 1 mL geliştirilmiş sitrat antijen alma solüsyonu ve 49 mL çift damıtılmış su ekleyin ve hafifçe karıştırın. Bölümü antijen alma solüsyonuna daldırın ve oda sıcaklığına soğutmadan önce 20 dakika boyunca 95 °C'de ısıtın (bkz. Malzeme Tablosu).
- Bölümü 2x PBS ile her biri 5 dakika yıkayın. F-aktin (1:100), GLUT1 (1:200), Myh9 (1:200), SLC7A11 (1:200) ve SLC3A2'ye (1:200) karşı 100 μL birincil antikorlarla inkübe etmek için bölümü antikor inkübasyon kutusuna yerleştirin 4 ° C'de gece boyunca.
- Bölümü 2x PBS ile her biri 5 dakika yıkayın. Bölüme 100 μL ikincil antikor ekleyin ve oda sıcaklığında 20 dakika inkübe edin.
- Bölümü 2x PBS ile her biri 5 dakika yıkayın. 100 μL DAB çalışma solüsyonu ile oda sıcaklığında 5 dakika boyayın ve arıtılmış su ile yıkayarak renk reaksiyonunu durdurun.
NOT: DAB çalışma solüsyonu, DAB kromojenik solüsyon A ve DAB kromojenik solüsyon B'nin, DAB yaban turpu peroksidaz renk geliştirme kitinde bulunan 1:1 oranında karıştırılmasıyla hazırlanmıştır (bkz. Malzeme Tablosu). - Kesiti 100 μL hematoksilen boyama solüsyonu ile 3 dakika boyayın ve 3 dakika akan su ile yıkayın (bkz. Malzeme Tablosu).
NOT: Hematoksilen ve eozin boyama kiti, bir hematoksilen boyama solüsyonu içerir. - Bölümü her birine 2 dakika boyunca %75 etanol, %95 etanol ve %100 etanole daldırın.
- Kesiti nötr reçine ile kapatın, bir kapak fişi ile örtün ve kesiti 200x büyütmede optik mikroskop altında inceleyin (bkz. Malzeme Tablosu). Kahverengi renk sergileyen dokular pozitif reaksiyonlardır. Pozitif ifade oranını, lekeli alanın görüş alanının toplam alanına oranı olarak hesaplayın. Image J yazılımını kullanarak kantitatif analiz yapın.
7. Batı lekesi tespiti
NOT: Lizis tamponu ve proteaz inhibitörü, bir BCA protein miktar tayin kitine dahil edilmiştir (bkz. Malzeme Tablosu).
- Adım 3.5'ten 0.1 g taze miyokard numunesini tartın ve 1 mL lizis tamponu ve 10 μL proteaz inhibitörü ile karıştırın, ardından bir cam öğütme kabında öğütün ve 4 ° C'de 10 dakika boyunca 10.304 x g'da santrifüjleyin.
- Süpernatanı toplayın ve üreticinin talimatlarına göre BCA yöntemini kullanarak protein miktar tayini yapın8. Süpernatanı 95 °C'de 5 dakika kaynatın.
- 80/120 V'ta protein elektroforezi için 10 μL numune yükleyerek %10 ayırma jeli kullanarak farklı moleküler ağırlıktaki proteinleri ayırın.
- Jel üzerindeki proteinleri bir PVDF membranınaaktarın 9. Daha sonra, zarı 1 saat boyunca% 5 yağsız süt tozu ile bloke edin ve gece boyunca 4 ° C'de Myh9, SLC7A11, SLC3A2 ve β-tubulin birincil antikorları ile 1:1000'lik bir seyreltmede inkübe edin (bkz.
- PBS 3x ile her biri 5 dakika boyunca yıkadıktan sonra, zarı ikincil antikor (1:5000; Malzeme Tablosuna bakınız) ile oda sıcaklığında 2 saat inkübe edin, ardından bir protein görselleştirme cihazı ile görselleştirmeden önce PBS 3x ile her biri 5 dakika boyunca yıkayın (bkz.
- Image J yazılımı 8,9'u kullanarak bantların gri tonlamalı β-tubulin oranını hesaplayın.
8. İstatistiksel analiz
- Verileri ortalama ± standart sapma olarak ifade edin. Tek yönlü varyans analizini ve ardından en az anlamlı farkı post hoc testini kullanarak verileri analiz edin. Ticari bir istatistiksel analiz aracı kullanarak istatistiksel analiz yapın (bkz . Malzeme Tablosu) ve p < 0.05'i istatistiksel olarak anlamlı olarak kabul edin.
Sonuçlar
DRG'lerin MIRI'de taranması
Gene Expression Omnibus'tan alınan GSE214122 veri seti, üç sahte ve üç MIRI örnek verisi içeriyordu. R'de DESeq2 paketi kullanılarak, MIRI ve sahte örnekler arasında 1233 diferansiyel olarak eksprese edilen gen (DEG) tanımlandı. |log2FC|>2 ve FDR<0.05'e dayanarak, R'nin pheatmap paketi kullanılarak 417 önemli ölçüde farklı gen daha fazla seçildi (Şekil 1A). Daha sonra, bu 1233 DEG ve 106 DRG arasındaki 15 kesişim geni Şekil 1B'de sunuldu. Diferansiyel olarak ifade edilen 15 DRG, Şekil 1C'de gösterildiği gibi yanardağ haritasında 12 DRG ile etiketlenen bir yanardağ grafiği ile daha da açıklandı. 15 DRG için bir PPI ağı daha sonra ağdaki üç genin bağlı olmadığı ve sonuç olarak çıkarıldığı STRING kullanılarak inşa edildi. Son PPI ağı, Şekil 1D'de gösterildiği gibi 12 gen içeriyordu.
MIRI, sıçan miyokard hücresi hasarını teşvik eder
HE boyama sonuçları, kontrol (cerrahi prosedür yok) ve sahte (model grubuyla aynı cerrahi prosedürlere sahip ancak iskemi-reperfüzyon prosedürleri yok) gruplarda, miyokard hücrelerinin düzenli morfoloji, iyi organize edilmiş miyokard lifleri sergilediğini ve belirgin bir ödem veya inflamatuar hücre infiltrasyonu belirtisi olmadığını gösterdi. Buna karşılık, model grubu düzensiz miyokard hücre düzenlemesi, şişme, azalmış hücre sayısı, miyokardiyal lif parçalanması ve köpüklü hücrelerin ve çok sayıda inflamatuar hücrenin gözle görülür şekilde infiltrasyonunu sergiledi (Şekil 2A).
TUNEL boyama sonuçları, kontrol ve sahte gruplarla karşılaştırıldığında, model grubunun sıçan miyokard dokuları içinde kırmızı floresan işaretli apoptotik hücrelerde önemli bir artış gösterdiğini ortaya koydu (Şekil 2B). Model grubunda apoptoz oranı belirgin şekilde yükselmiştir (Şekil 2C, p < 0.01), kontrol ve sahte gruplar arasında istatistiksel olarak anlamlı bir fark gözlenmemiştir.
MIRI'nin sıçan miyokard dokusunda F-aktin ve GLUT1'in ekspresyonu
Kontrol ve sham gruplarıyla karşılaştırıldığında, model grubu GLUT1 ekspresyonunda anlamlı bir artış (Şekil 3A,B, p < 0.01) ve F-aktin ekspresyonunda anlamlı bir azalma (Şekil 3C,D, p < 0.01) sergiledi. GLUT1 ve F-aktin protein ekspresyonu için kontrol ve sahte gruplar arasında anlamlı bir fark gözlenmedi.
MIRI'nin sıçan miyokard dokusunda Myh9, SLC7A11 ve SLC3A2'nin ekspresyonu
İmmünohistokimyasal analiz ilk olarak sıçan MIRI modelinde DRG'lerin ekspresyon seviyelerini değerlendirmek için kullanıldı. Sonuçlar, kontrol ve sahte gruplarla karşılaştırıldığında, model grubunun Myh9 (Şekil 4A,B, p < 0.01) ve SLC3A2 (Şekil 4E,F, p < 0.01) ekspresyon düzeylerini önemli ölçüde artırdığını göstermiştir. Buna karşılık, SLC7A11 ekspresyonu önemli ölçüde azalmıştır (Şekil 4C,D, p < 0.01). Buna uygun olarak, western blotting sonuçları, kontrol ve sham gruplarına kıyasla, model grubunun Myh9 (Şekil 5A,B, p < 0.01) ve SLC3A2 (Şekil 5A,D, p < 0.01) ekspresyon seviyelerini önemli ölçüde artırdığını, SLC7A11 ekspresyonunun (Şekil 5A,C, p < 0.01) önemli ölçüde azaldığını göstermiştir.

Şekil 1: MIRI'de disülfideptozla ilişkili genlerin taranması. (A) MIRI ve sahte numunelerde diferansiyel ekspresyon analizi için 1233 genin ısı haritası. (B) DEG'lerin ve DRG'lerin Venn şeması. Kutuda gösterildiği gibi 1233 DEG ve 99 DRG arasında 15 ortak gen vardı. (C) GSE214122 veri setindeki DEG'lerin volkan grafikleri. Çizim üzerindeki kırmızı ve yeşil noktalar, sırasıyla, yukarı ve aşağı regüle edilmiş genleri gösterir. (D) 12 hub DRG'lerin PPI ağı, STRING veritabanı kullanılarak oluşturulmuştur. DEG'ler, diferansiyel olarak ifade edilen genler; DRG'ler, disülfideptoz ile ilişkili genler. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 2: MIRI, miyokard hücre hasarını teşvik eder. (A) H&E boyaması ile değerlendirilen miyokard yaralanmalarının temsili görüntüleri (ölçek çubuğu = 50 μm). (B) TUNEL testi ile tespit edilen kardiyomiyositlerin apoptozu. Model grubu, sıçan miyokard dokuları içinde kırmızı floresan işaretli apoptotik hücrelerde önemli bir artış sergiledi (ölçek çubuğu = 50 μm). (C) Image J yazılımı kullanılarak kırmızı floresan sinyal yoğunluğunun analiz edilmesiyle apoptoz oranının istatistiksel sonuçları. **P < 0.01, model grubu ile sahte grup, n=3. Veriler ortalama ± standart sapma olarak ifade edilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
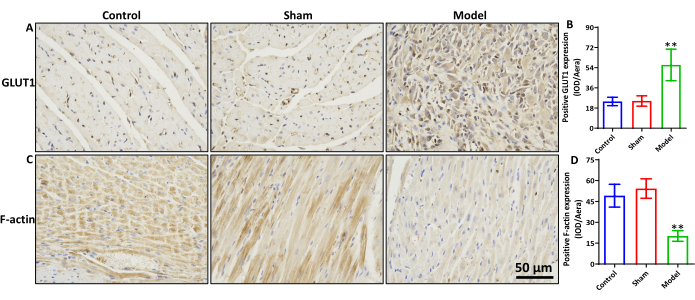
Şekil 3: Sıçan MIRI'nin miyokard dokusunda F-aktin ve GLUT1 ekspresyonu. (A) GLUT1'in IHC boyaması ve (B) protein ekspresyonunun istatistiksel sonuçları. (C) F-aktinin IHC boyaması ve (D) protein ekspresyonunun istatistiksel sonuçları. ölçek çubuğu = 50 μm. **p < 0.01, model grubu ve sahte grup, n=6. Veriler ortalama ± standart sapma olarak ifade edilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 4: Sıçan MIRI'nin miyokard dokusunda disülfideptozla ilişkili proteinler Myh9, SLC7A11 ve SLC3A2'nin ekspresyonunun IHC boyama analizi. (A) Myh9'un IHC boyaması ve (B) protein ekspresyonunun istatistiksel sonuçları. (C) SLC7A11'ın IHC boyanması ve (D) protein ekspresyonunun istatistiksel sonuçları. (E) SLC3A2'nin IHC boyaması ve (F) protein ekspresyonunun istatistiksel sonuçları. Ölçek çubuğu = 50 μm. **P < 0.01, model grubu ve sahte grup, n=3. Veriler ortalama ± standart sapma olarak ifade edilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 5: Sıçan MIRI'nin miyokard dokusunda disülfideptozla ilişkili proteinler Myh9, SLC7A11 ve SLC3A2'nin ekspresyonunun Western blot analizi. (A) Temsili protein bantları. (B) Myh9, (C) SLC7A11 ve (D) SLC3A2 protein ekspresyonunun istatistiksel sonuçları. **P < 0.01, model grubu ile sahte grup, n=3. Proteinlerin gri tonlama değerleri Image J yazılımı kullanılarak analiz edildi. Veriler ortalama ± standart sapma olarak ifade edilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Disülfideptoz, hücre şeklini ve canlılığını korumak için gerekli olan kritik bir hücresel yapı olan aktin hücre iskeleti ile yakından ilişkilidir. Aktin filamentlerinden oluşan aktin hücre iskeleti, genel hücresel şekil ve yapı verir. F-aktin, hücresel hücre iskeleti için bir belirteç görevi görür ve glikoz açlığı koşulları altında, disülfür bağları önemli ölçüde artar ve bu da F-aktinin aşağı regülasyonuna yol açar. Bu fenomen öncelikle aktin hücre iskeleti ve hücre yapışması ile ilgili süreçleri ve yolları etkiler10,11.
Glikoz metabolizması bağlamında, glikoz taşıyıcıları (GLUT'lar), glikozun dinamik dengesinin korunmasında hayati bir rol oynar. GLUT ailesinin en erken keşfedilen üyelerinden biri olan GLUT1, yaygın doku dağılımına sahip glikoz alımıyla ilgili bir proteindir. Esas olarak kırmızı kan hücrelerinde12 ve kan-beyin bariyerinin13 endotel hücrelerinde eksprese edilir, burada glikozun transmembran taşınmasına katılır. GLUT1, anormal glikoz metabolizması ile ilişkili hastalıkların gelişimi ile yakından ilişkili olabilir. Glikoz açlığı modellerinde, GLUT1 ekspresyonu yukarı regüle edilir ve tümör hücresi ölümünü teşvik eder. MIRI modelinde, GLUT1 ekspresyonunun yukarı regülasyonu MIRI'yi kötüleştirir, ancak GLUT1 aşağı regüle edildiğinde iyileşmeler gözlenir ve bu da onu glikoz açlığı altında önemli bir hedef haline getirir14. İmmünohistokimya, MIRI modelinde glukoz taşıyıcı protein GLUT1'de kontrol ve sham gruplarına kıyasla hücre içi anlamlı bir artış olduğunu ortaya koydu. Aynı zamanda, F-aktin, kontrol ve sahte gruplara kıyasla hücre içi olarak önemli ölçüde azaldı. Bu, aktin hücre iskeletinin glikoz açlığı koşulları altında çökmesinin, MIRI'nin kötüleşmesine katkıda bulunabileceğini ve aktin hücre iskeletinin çöküşünü disülfideptozun birincil mekanizması haline getirebileceğini düşündürmektedir. Bu nedenle, MIRI modelinde GLUT1'in yukarı regülasyonunun disülfideptozu indüklediğini ve ağırlaştırılmış iskemi-reperfüzyon hasarına yol açtığını tahmin ediyoruz.
Myh9 geni, hücre içi mekanik kuvvetlerin oluşturulmasını ve aktin hücre iskeletinin yeniden konumlandırılmasını gerektiren çeşitli işlemlerde yer alan, yaygın olarak eksprese edilen bir sitoplazmik miyozin olan kas dışı miyozin IIA'nın ağır zincirini kodlar15. Myh9 gen mutasyonlarına bağlı konjenital trombositopenisi olan hastalar trombüs oluşumuna ve akut miyokard enfarktüsüneyatkındır 16. Bu nedenle, Myh9, veya MIRI için öngörücü bir faktör olabilir. SLC7A11 ve SLC3A2, hücre sağlığını ve dengesini korumak için gerekli olan sistein ve glutatyon elde etmede hücrelere yardımcı olan proteinlerdir. SLC7A11, MIRI17'de koruyucu bir rol oynamak için lipid peroksidasyonunu ve oksidatif stresi azaltabilir. Çalışmamız, GEO veri tabanı aracılığıyla disülfideptoz ile ilgili genlerin potansiyel biyolojik fonksiyonlarını ve terapötik önemini araştırdı. MIRI ve disülfideptoz ile ilişkili genler arasında, toplam 12 örtüşen gen ile sınırlı bir örtüşme bulduk. P-değeri ve Log2Fold Change analizi sayesinde, MIRI modelinde en yakından ilişkili olan dört geni belirledik. Sonuçlar, MIRI grubunda Myh9 ekspresyonunun önemli ölçüde yukarı regülasyonunu ve SLC7A11 ekspresyonunun önemli ölçüde aşağı regülasyonunu gösterdi. Ancak ACTB ekspresyonunda istatistiksel olarak anlamlı bir fark gözlenmedi. Deneysel sonuçlar, Myh9 ve SLC7A11'nin MIRI'de yer aldığını ve mekanizmalarının NADPH tükenmesinin aracılık ettiği disülfideptoz ile yakından ilişkili olabileceğini doğruladı. Bu bulgular, MIRI için yeni prediktif faktörlerin ve kişiselleştirilmiş tedavi stratejilerinin belirlenmesi için önemli ipuçları sağlamaktadır (Şekil 5).
Özetle, hücre ölüm mekanizmalarının tanımlanması ve karakterizasyonu sadece hücresel homeostaz hakkındaki temel anlayışımızı teşvik etmekle kalmaz, aynı zamanda MIRI'de disülfideptozun oynadığı önemli rolü de vurgular. Bu yöntemin eksikliği, disülfideptoz için kritik doğrulama deneylerinin olmamasıdır. Şu anda, disülfid bağlarına bağlanan, hücre içi ve hücre dışı disülfidleri etiketleyen ve hücrelerde veya dokularda disülfidlerin gözlemlenmesini kolaylaştıran floresan probu DCP-Bio1 kullanılarak disülfidepizi tespit etmek ve tanımlamak mümkündür18. Bu tür yeni problar, disülfideptoz ve MIRI arasındaki uzay-zamansal dinamikleri incelemek için kullanılabilir.
Açıklamalar
Yazarların ifşa edecek hiçbir şeyi yok.
Teşekkürler
Bu araştırma, Guizhou İl Bilim ve Teknoloji Bürosu (Qiankehe [2022]-583) ve Guizhou İl Geleneksel Çin Tıbbı İdaresi (QZYY-2016-019) tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 75% alcohol | Hunan Tongruijian Pharmaceutical Co. Ltd., Hunan, China | 85026 | |
| 6-0 nylon suture | Shanghai Pudong Jinhuan Medical Supplies Co. Ltd., Shanghai, China | CS002 | |
| BCA protein quantification kit | Beyotime Biotechnology, Shanghai, China | P0011 | |
| Bull serum albumin | Beyotime Biotechnology, Shanghai, China | ST2254 | |
| Centrifuge | Hunan Kaida Scientific Instrument Co. Ltd., Hunan, China | KH19A | |
| DAB horseradish peroxidase color development kit | Beyotime Biotechnology, Shanghai, China | P0203 | |
| DAPI staining solution | Beyotime Biotechnology, Shanghai, China | C1006 | |
| DESeq2 package | Version 4.1 | ||
| Electric razor | Kelmerpp | 235376 | |
| Enhanced endogenous peroxidase blocking buffer | Beyotime Biotechnology, Shanghai, China | P0100B | |
| Filter paper | Nanjing Keruicai Equipment Co., Ltd., Nanjing, China | 1.00049E+11 | |
| Fluorescence microscope | Nikon | ECLIPSE Ci | |
| GEO database | https://www.ncbi.nlm.nih.gov/geo/ | ||
| Glass grinder | Shanghai Leigu Instrument Co. Ltd., Shanghai, China | B-013002 | |
| GraphPad Prism | GraphPad Software | V8.0 | |
| Hematoxylin and eosin staining kit | Beyotime Biotechnology, Shanghai, China | C0105M | |
| Image J software | National Institutes of Health, Bethesda, USA | v1.8.0 | |
| Improved citrate antigen retrieval solution (50X) | Beyotime Biotechnology, Shanghai, China | P0083 | |
| Iodophor | Folca, Shenzhen, China | 1.00077E+11 | |
| Optical microscope | Nikon | ECLIPSE Ci | |
| Phosphate buffer solution | Beyotime Biotechnology, Shanghai, China | C0221A | |
| Primary antibodies against GLUT1 | Proteintech Group, Inc, Wuhan, China | 21829-1-AP | |
| Primary antibodies against MYH9 | Proteintech Group, Inc, Wuhan, China | 11128-1-AP | |
| Primary antibodies against SLC3A2 | Wuhan Lingsi Biotechnology Co., Ltd., Wuhan, China | LJS-D-7468 | |
| Primary antibodies against SLC7A11 | Proteintech Group, Inc, Wuhan, China | 26864-1-AP | |
| Protein visualization instrument | Thermo Fisher Scientific Inc. | iBright CL750 | |
| Rat board | Zhengzhou Haopai Biotechnology Co. Ltd., Zhengzhou, China | JPB-E | |
| Scalpel | Shanghai Lianhui Medical Supplies Co., Ltd., Shanghai, China | 1.00471E+13 | |
| Secondary antibody | Wuhan Boster Biological Technology, Ltd., Wuhan, China | BA1054 | |
| STRING database | https://cn.string-db.org/ | Version 12.0 | |
| Triton X-100 | Beyotime Biotechnology, Shanghai, China | ST1722 | |
| TUNEL apoptosis detection kit | Proteintech Group, Inc., Wuhan, China | PF00009 |
Referanslar
- Lu, Z., et al. Tripartite motif 38 attenuates cardiac fibrosis after myocardial infarction by suppressing TAK1 activation via TAB2/3 degradation. iScience. 25 (8), 104780(2022).
- Tu, Q., et al. EGCG decreases myocardial infarction in both I/R and MIRI rats through reducing intracellular Ca2+ and increasing TnT levels in cardiomyocytes. Adv Clin Exp Med. 30 (6), 607-616 (2021).
- Li, Q., et al. Histone deacetylase HDAC4 participates in the pathological process of myocardial ischemia-reperfusion injury via MEKK1/JNK pathway by binding to miR-206. Cell Death Dis. 7 (1), 240(2021).
- Liu, X., et al. Actin cytoskeleton vulnerability to disulfide stress mediates disulfidptosis. Nat Cell Biol. 25 (3), 404-414 (2023).
- Yang, L., et al. Analysis of risk genes associated with disulfidptosis-related myocardial ischemia-reperfusion injury. J Chongqing Med Univ. 49 (4), 401-408 (2024).
- Xiao, G., et al. CXCR1 and its downstream NF-κB inflammation signaling pathway as a key target of Guanxinning injection for myocardial ischemia/reperfusion injury. Front Immunol. 13, 1007341(2022).
- Zhu, E. Y., et al. Screening of immune-related secretory proteins linking chronic kidney disease with calcific aortic valve disease based on comprehensive bioinformatics analysis and machine learning. J Transl Med. 21, 359(2023).
- Shi, D. C., et al. Potential of Dendrobium officinale oligosaccharides to alleviate chronic colitis by modulating inflammation and gut microbiota. FoodMedHomo. 2, 9420077(2025).
- Ning, E. J., et al. Artemisia argyi polysaccharide alleviates intestinal inflammation and intestinal flora dysbiosis in lipopolysaccharide-treated mice. FoodMedHomo. 1 (1), 9420008(2024).
- Zhou, H., Wang, J., Zhu, P., Hu, S., Ren, J. Ripk3 regulates cardiac microvascular reperfusion injury: The role of IP3R-dependent calcium overload, XO-mediated oxidative stress and F-action/filopodia based cellular migration. Cell Signal. 45, 12-22 (2018).
- Antonipillai, J., Rigby, S., Bassler, N., Peter, K., Bernard, O. Pharmacological inhibition of LIM kinase pathway impairs platelets functionality and facilitates thrombolysis. Exp Cell Res. 382 (2), 111458(2019).
- Kaumeyer, B. A., et al. GLUT1 immunohistochemistry is a highly sensitive and relatively specific marker for erythroid lineage in benign and malignant hematopoietic tissues. Am J Clin Pathol. 158 (2), 228-234 (2022).
- Patching, S. G. Glucose transporters at the blood-brain barrier: Function, regulation and gateways for drug delivery. Mol Neurobiol. 54 (2), 1046-1077 (2017).
- Zhou, H., et al. 3-iodothyronamine inhibits apoptosis induced by myocardial ischemia reperfusion via the Akt/FoxO1 signaling pathway. Ann Trans Med. 10 (4), 168(2022).
- Pecci, A., et al. MYH9: Structure, functions and role of non-muscle myosin IIA in human disease. Gene. 664, 152-167 (2018).
- Girolami, A., et al. Occurrence of thrombosis in congenital thrombocytopenic disorders: A critical annotation of the literature. Blood Coagulat Fibrino. 24 (1), 18-22 (2013).
- Li, P., et al. SLC7A11-associated ferroptosis in acute injury diseases: Mechanisms and strategies. Eur Rev Med Pharmaco Sci. 27 (10), 4386-4398 (2023).
- Wu, X., et al. Dihydrotanshinone I preconditions myocardium against ischemic injury via PKM2 glutathionylation sensitive to ROS. Acta Pharma Sinica B. 13 (1), 113-127 (2023).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır