Method Article
ניתוח גנים דיפרנציאליים ואימות של דיסולפידפטוזיס במודל פגיעה בשריר הלב של חולדה
In This Article
Summary
הפרוטוקול מתאר זיהוי של מספר גנים דיפרנציאליים חדשים הקשורים לדיסולפידפטוזיס הקשורים לפגיעה באיסכמיה-רפרפוזיה בשריר הלב על ידי ניתוח ביואינפורמטי ואימות ניסיוני.
Abstract
פגיעה באיסכמיה-רפרפוזיה של שריר הלב (MIRI) היא פגיעה נוספת המתרחשת במהלך תהליך שחזור זרימת הדם ברקמת הלב לאחר פגיעה הנגרמת על ידי איסכמיה. MIRI משפיע באופן רציני על היעילות ועל הפרוגנוזה לטווח הקצר והארוך של רפרפוזיה, לאחר אוטם שריר הלב. נכון לעכשיו, המנגנון של MIRI אינו ברור לחלוטין. דיסולפידפטוזיס הוא מצב חדש של מוות תאי, והקשר בין MIRI לביטוי גנים הקשורים לדיסולפידפטוזיס (DRGs) עדיין לא ברור. ראשית, מחקר זה בוחן את הגנים המתבטאים באופן דיפרנציאלי הקשורים לדיסולפידפטוזיס ב-MIRI באמצעות ניתוח ביואינפורמטיקה. שנית, על ידי בניית מודל חולדה של MIRI, זוהו DRGs נוספים. מחקר זה זיהה 12 גנים קשורים, כולל Myh9, SLC7A11, SLC3A2, Myh7b, ACTB, FLNB, Actn1, Actn4, Flnc, Dbn1 ו-Pdlim1. רקמת שריר הלב של חולדות עם MIRI מראה נזק פתולוגי ברור ואירועי אפופטוזיס. תוצאות האימונוהיסטוכימיה הצביעו על כך שגירוי MIRI הגביר את הביטוי של חלבון GLUT1 ברקמת שריר הלב אך הגביל את הביטוי של חלבון F-actin. בנוסף, הבדלים משמעותיים בביטוי של שלושה חלבונים אומתו באמצעות מערכי נתונים חיצוניים ומודלים של חולדות MIRI. מחקר זה הראה כי ל-DRGs יש ערך ניבוי משמעותי ב-MIRI, מה שמספק סיכויים חדשים לחקר סמנים ביולוגיים ומטרות טיפוליות פוטנציאליות של MIRI.
Introduction
אוטם שריר הלב החריף (AMI) הוא מצב קרדיווסקולרי חמור ונותר גורם תמותה עולמי מוביל. התערבות כלילית מלעורית הפחיתה משמעותית את שיעורי התמותה בחולי AMI1. עם זאת, טיפול רפרפוזיה שמטרתו להחזיר את אספקת הדם לשריר הלב מלווה בסדרה של תגובות פתולוגיות ופיזיולוגיות שליליות. תהליכים אלה יכולים לגרום להגדלת גודל האוטם, מוות של תאי שריר הלב, הפרעות קצב חדריות מתמשכות ומוות פתאומי2. פגיעה באיסכמיה-רפרפוזיה של שריר הלב (MIRI) היא מצב קרדיווסקולרי מורכב המושפע מגורמים כגון ציטוקינים, כימוקינים, גורמי גדילה, מתח חמצוני ועומס יתר של סידן3. הפחתת MIRI נותרה אתגר משמעותי.
לאחרונה, דיסולפידפטוזיס התגלה כצורה חדשה של מוות תאי המאופיינת בקריסה מהירה של רשת האקטין הציטו-שלד עקב הצטברות מוגזמת של דיסולפידים, כולל ציסטאין, בתוך התאים, הנובעת מדלדול NADPH+. הצטברות מוגזמת של דיסולפיד משבשת קשרי דיסולפיד בין חלבוני שלד תאים, מה שמוביל לנדידת אקטין ולמוות תאים 4,5. בניגוד לצורות שדווחו בעבר של מוות תאי כגון אפופטוזיס, נמק, פירופטוזיס ופרופטוזיס, דיסולפידפטוזיס מתחיל על ידי צבירה מוגזמת של דיסולפידים תוך-תאיים ואינו מנוגד על ידי מעכבים ספציפיים של מסלולי מוות תאים אחרים. כמוות תאי מובהק, עדויות הצביעו על כך שביטוי יתר של SLC7A11 המעורר מחסור בגלוקוז בתאים יכול לעורר דיסולפידפטוזיס4. לאחר MIRI, הפרשת אינסולין לא מספקת עלולה לגרום להיפוגליקמיה ולדיסולפידפטוזיס שלאחר מכן, מה שעלול לגרום לנזק נוסף לתאי שריר הלב ועשוי להיות אחד המנגנונים החדשים של MIRI5.
במחקר זה, המטרה העיקרית הייתה להשתמש במאגרי ביטוי גנים מקיפים, כגון Gene Expression Omnibus (GEO), כדי לנתח ביטוי גנים דיפרנציאלי בין דגימות נורמליות לדגימות MIRI. ערכנו ניתוח צולב בין גנים המתבטאים באופן דיפרנציאלי וגנים הקשורים לדיסולפידפטוזיס, במטרה לזהות גנים הקשורים לדיסולפידפטוזיס (DRGs) המציגים ביטוי דיפרנציאלי ב-MIRI. אלגוריתמים של למידת מכונה שימשו לזיהוי גנים מרכזיים, ואימתנו את דפוסי הביטוי של הגנים הדיפרנציאליים המעניינים שנבחרו באמצעות מודל של בעלי חיים. גישה זו מספקת נקודת מבט רעננה לקראת השגת הבנה מעמיקה יותר של המנגנונים הפוטנציאליים העומדים בבסיס הופעת והתקדמות MIRI. המוקד העיקרי של מחקר זה היה לחקור מנגנון מוות תאי חדש בתוך MIRI, לחשוף גנים דיפרנציאליים קשורים ולערוך ניסויים ראשוניים כדי לאמת את הממצאים הללו. המטרה הסופית הייתה לזהות מטרות טיפוליות חדשות להפחתת MIRI בהתבסס על מנגנון מוות תאי מתפתח זה.
Protocol
עבור מחקר זה, תשע חולדות זכרות Sprague-Dawley (SD), בגילאי 6-8 שבועות ובמשקל 180-220 גרם, נבחרו מהמרכז לחקר חיות ניסוי בחוביי [SCXK (Hubei) 20200018]. החולדות הוחזקו בבתי חיות ספציפיים ללא פתוגנים כדי להתאקלם במשך שבוע, עם מחזור אור וחושך של 12 שעות ו-12 שעות, שתייה ואכילה חופשיות. המחקר הנוכחי נערך באישור ועדת האתיקה של בעלי חיים של בית החולים המסונף השלישי של האוניברסיטה הרפואית Zunyi (מספר אישור: (2016)-1-56). כל ההליכים בוצעו בהתאם להמלצות המפורטות במדריך לטיפול ושימוש בחיות מעבדה שפורסם על ידי מכוני הבריאות הלאומיים של ארה"ב. אמצעים מחמירים ננקטו כדי למזער את מספר בעלי החיים שנעשה בהם שימוש ולהפחית את סבלם.
1. ניתוח ביטוי דיפרנציאלי של גנים הקשורים ל-MIRI ו-disulfideptosis
הערה: נתוני ריצוף RNA מ-MIRI בשם GSE214122 נבחרו לסינון גנים הקשורים לדיסולפידפטוזיס על פי דוח ספרות6.
- פתח את מסד הנתונים GEO, הקלד GSE214122 בתיבת החיפוש ולחץ על Enter. הורד את קבצי מטריצת הסדרה שנוצרו בפורמט TXT תחת הקטע הורדה.
הערה: לפני ביצוע ניתוח נתונים, בדרך כלל יש צורך לעבד מראש את הנתונים שהורדת. זה כולל בדיקת ערכים חסרים, הסרת דגימות וגנים באיכות נמוכה וביצוע נורמליזציה או סטנדרטיזציה של הנתונים. מערך הנתונים GSE214122 שאוחזר הכיל דגימות מקבוצות המופעלות על ידי דמה ו-MIRI. - בצע ניתוח ביטוי גנים דיפרנציאלי של הדגימות באמצעות חבילת DESeq27. קחו בחשבון גנים עם |log2FC|>1 (שינוי קפל גדול מ-2) ו-FDR<0.05 כמובהקים סטטיסטית, וכתוצאה מכך זיהוי של גנים המתבטאים באופן דיפרנציאלי הקשורים ל-MIRI. צור מפת חום של ביטוי גנים דיפרנציאלי בשלב 1.2באמצעות חבילת מפת הצ'יט 7 של R.
- בנה דיאגרמת Venn באמצעות חבילת VennDiagram7 של R (ראה טבלת חומרים). צור עלילות הר געש כדי להמחיש גנים הקשורים לדיסולפידפטוזיס באמצעות חבילת EnhancedVolcano ב-R7.
- בנה רשת PPI המחברת את הגנים המתבטאים באופן דיפרנציאלי של MIRI עם גנים של דיסולפידפטוזיס באמצעות מסד הנתונים STRING7 (ראה טבלת חומרים).
2. בניית מודל החולדה MIRI
- צום את החולדות למשך הלילה לפני ביצוע ההרדמה. הרדמת חולדות על ידי הזרקה תוך-צפקית של 2% נתרן פנטוברביטל (40 מ"ג/ק"ג) ואבטח את הגפיים ללוח חולדה במצב שכיבה. אשר את עומק ההרדמה על ידי אי תגובה לצביטה בבוהן, אובדן רפלקס היישור ורפלקס קריצה. השתמש במשחה וטרינרית למניעת יובש בזמן הרדמה.
- יש לחטא את עור הצוואר והחזה ביודופור ולדאודינאט עם 75% אלכוהול. לגלח את פרוות הצוואר והחזה השמאלי בעזרת סכין גילוח חשמלי ולבצע חתך צוואר חציוני באורך של כ-2.5 ס"מ בעזרת אזמל (ראה טבלת חומרים).
- הפרד קנה הנשימה בעזרת מלקחיים ובצע אינטובציה אנדוטרכיאלית עם חיבור למאוורר בעל חיים קטן3 (ראה טבלת חומרים).
- חותכים 4 ס"מ לאורך הצד השמאלי של עצם החזה בעזרת מספריים עיניים ומפרידים בצורה בוטה את השרירים התת עוריים בעזרת מלקחיים כדי לחשוף את הצדר בין הצלעות השלישית לרביעית.
- בצע חתך של 4-5 ס"מ מתהליך ה-xiphoid לאמצע החלל הבין-צלעי השני השמאלי תוך החזקת האזמל בזווית של 45°. הפרד בעדינות ובאיטיות את שרירי החזה הגדול ושרירי הסרטוס הקדמיים באמצעות מלקחיים עיניים כדי לגשת לחלל הבין-צלעי.
- בצע חתך רוחבי של 1.5 ס"מ בין הצלעות השמאלית, השלישית והרביעית בעזרת מספריים עיניים. לאחר ניתוח קרום הלב באמצעות מלקחיים עיניים, הרם את נספח הפרוזדורים השמאלי בעזרת מלקחיים כדי לזהות את האוסטיום הכלילי בשורש אבי העורקים.
- קשרו את העורק הכלילי היורד הקדמי השמאלי בין חרוט הריאה לתוספתן הפרוזדורי השמאלי באמצעות תפר 6-0 (ראה טבלת חומרים).
- לאחר 30 דקות, שחררו את התפר כדי לאפשר עירוי חוזר למשך 120 דקות, ולאחר מכן סגרו את שכבות השריר והעור באמצעות תפר 6-0. יש למרוח פניצילין (ראה טבלת חומרים) על ידי הזרקה תוך-צפקית עם 80,000-100,000 יחידות.
- בקבוצת הדמה, בצע את כל ההליכים כפי שנעשה עבור קבוצת המודל, אך רק השחיל את העורק הכלילי היורד הקדמי השמאלי ללא קשירה או רפרפוזיה.
- ברגע שהחולדות חוזרות להכרה, הסר את הצינורות האנדוטרכיאליים. החזירו את החולדות למתקן לבעלי חיים להתאוששות, שם תהיה להן גישה חופשית למזון ומים. שיכנו את החולדה שעברה ניתוח בכלוב יחיד עם מערכת אוורור עצמאית במעבדה סטרילית.
- במהלך 30 דקות של איסכמיה ו-120 דקות של רפרפוזיה, בצע אקו לב. המודלים נחשבים מוצלחים אם מקטע הפליטה של החדר השמאלי נמדד פחות מ-50%1,6.
3. קציר רקמת לב3
- לאחר 120 דקות של זלוף, הניחו את החולדות במיכל המתת החסד כדי ליישם המתת חסד על ידי שאיפת פחמן דו חמצני. אסוף מיד את רקמות הלב של החולדה.
- הסר את שיער הבטן של החולדות בעזרת מכשיר גילוח ועקר את אזור החזה הקדמי ביוד ו-75% אלכוהול. נתח את חלל הבטן של החולדה לאורך קו האמצע של הבטן בעזרת אזמל.
- חותכים את העור מתהליך ה-xiphoid כלפי מעלה לחלל התת-לסתי בעזרת מספריים כירורגיים ומקלפים בבוטות את העור והרקמה התת עורית בעזרת מלקחיים משני הצדדים כדי לחשוף את כלוב בית החזה ושכבת שריר צוואר הרחם השטחית (ראה טבלת חומרים).
- פתח את בית החזה והצדר לאורך קו האמצע בעזרת מספריים כירורגיים כדי לחשוף את הלב, מהדק את אבי העורקים בעזרת קליפ כלי דם וחתוך את העורק במספריים עיניים. יש להוציא את הלב ולנתח לגושטישו בקוטר 1 מ"מ 3 במי מלח קרים על אמבט קרח ולקבע עם 4% פרפורמלדהיד למשך 48 שעות (ראה טבלת חומרים).
4. צביעת המטוקסילין-אאוזין (H&E)
- ייבוש והטמעה: ייבשו את גוש רקמת הלב על ידי השרייה ברצף ב-75% אלכוהול, 85% אלכוהול, 95% אלכוהול (I), 95% אלכוהול (II), 100% אלכוהול (I) ו-100% אלכוהול (II) למשך שעה אחת בכל תמיסה. שקוף עם קסילן (I) וקסילן (II) על ידי טבילה למשך 15 דקות בכל תמיסה. הנח את גוש רקמת הלב בפרפין נוזלי (I), פרפין (II) ופרפין (III) למשך 20-30 דקות ברצף. הניחו לגוש הפרפין להתקרר באופן טבעי עד להתמצקות.
- פורסים את גוש רקמת הלב המוטבע בפרפין לחלקים של 4 מיקרומטר באמצעות מכונת חיתוך פרפין (ראה טבלת חומרים). הניחו חלקים שטוחים בעזרת מברשת רכה באמבט מים של 45 מעלות צלזיוס ולאחר מכן הרימו את החלקים המורחבים לחלוטין בעזרת שקופית.
- הסרת שעווה: אופים את הפרוסות בתנור למשך 30-60 דקות בחום של 55 מעלות צלזיוס, ומסירים שעווה עם קסילן (I) למשך 5-10 דקות וקסילן (II) למשך 5-10 דקות. לאחר מכן, שטפו קסילן עם אתנול מוחלט למשך 1-5 דקות, 95% אתנול למשך 1-5 דקות ו-75% אתנול למשך 1-5 דקות, ושטפו במי ברז למשך 1-5 דקות.
- מכתים: מכתימים בתמיסת המטוקסילין למשך 5-20 דקות, שוטפים במי ברז למשך 5-10 שניות, מכתימים בתמיסת אאוזין למשך 15-30 שניות, ושוטפים עם אתנול 75%-85% למשך 30 שניות.
- מייבש, שקוף ואוטם: יש לייבש עם 95% אתנול (I) למשך 0.5-2 דקות, ו-95% אתנול (II) למשך 2-5 דקות, ולאחר מכן אתנול מוחלט (I) למשך 2-5 דקות, ואתנול מוחלט (II) למשך 2-5 דקות. שקוף עם קסילן (I) למשך דקה אחת וקסילן (II) למשך דקה אחת, ולאחר מכן אטום את הפרוסה על ידי הוספת שתי טיפות שרף ניטרלי על הפרוסה והנח כיסוי. לחץ קלות על זכוכית הכיסוי כדי למלא את הפרוסה בשרף ניטרלי (ראה טבלת חומרים).
- התבונן בכל פרוסה תחת מיקרוסקופ אופטי בהגדלה של פי 200 בצורה כפולת סמיות על ידי שני טכנאים עצמאיים.
- בחר שלושה שדות ראייה אקראיים כדי להעריך גודש בשריר הלב, דימום, פיברוזיס, נמק וניוון. השתמש בקריטריוני הניקוד הבאים: 0 לא ציין נגע; 0-1 הצביעו על נגעים שהיו פחות מ-1/4 מהשטח המיועד; 1-2 נגעים שצוינו נעו בין כ-1/4−1/2 מהשטח המיועד; 2-3 נגעים שצוינו נעו בין כ-1/2-3/4 מהשטח המיועד; ו-3-4 נגעים שצוינו היו גדולים מ-3/4 מהשטח המיועד.
5. בדיקת TUNEL
- מדללים פרוטאינאז K עם תמיסת חיץ פוספט (PBS) ל-40 מיקרוגרם/מ"ל ומוסיפים 100 מיקרוליטר של פרוטאינאז K ל-4 מיקרומטר חלקים שהוכנו בשלב 4.3 כדי לכסות את כל שטח הדגימה ולדגור במשך 10 דקות בטמפרטורת החדר.
הערה: פרוטאינאז K כלול בערכת זיהוי האפופטוזיס של TUNEL (ראה טבלת חומרים). - שטפו את החלק פעמיים עם PBS למשך 5 דקות כל אחד, הסירו את עודפי הנוזל על ידי יניקה עם נייר פילטר ושמרו על החלק לח בקופסה רטובה.
הערה: יש לשטוף את Proteinase K כדי לא להפריע לתגובות התיוג הבאות. - הוסף באופן אחיד 50 מיקרוליטר של תמיסת תגובת TUNEL המכילה 2 מיקרוליטר של אנזים TdT ו-48 מיקרוליטר של מאגר תגובה TUNEL והנח את החלק בקופסה רטובה כדי לדגור ב-37 מעלות צלזיוס בחושך למשך שעתיים.
הערה: אנזים TdT ומאגר תגובה TUNEL כלולים בערכת זיהוי האפופטוזיס של TUNEL. - השליכו את תמיסת התגובה של TUNEL ושטפו פעמיים עם PBS למשך 5 דקות כל אחד. שטפו את החלק 3 פעמים למשך 5 דקות כל אחד עם PBS המכיל 0.1% טריטון X-100 ו-5 מ"ג/מ"ל BSA.
- הוסף באופן אחיד 50 מיקרוליטר של תמיסת צביעה DAPI ודגירה למשך 10 דקות בטמפרטורת החדר בחושך. השליכו את תמיסת הצביעה DAPI והשרו את החלק ב-PBS, 3x, 5 דקות בכל פעם.
- השג אותות אדומים וכחולים של TUNEL באורכי גל עירור ופליטה של 593/614 ננומטר ו-364/454 ננומטר, בהתאמה. צלם תמונות תחת מיקרוסקופ פלואורסצנטי בהגדלה של פי 200 (ראה טבלת חומרים).
6. צביעה אימונוהיסטוכימית
- הוסף 200 מיקרוליטר של מאגר חוסם פרוקסידאז אנדוגני משופר לקטע בשלב 4.3 ודגר למשך 10 דקות בטמפרטורת החדר בחושך. שטפו את החלק 2x במים מזוקקים למשך 5 דקות כל אחד.
- הוסף 1 מ"ל של תמיסת אחזור אנטיגן ציטראט משופרת ו-49 מ"ל מים מזוקקים כפולים לקופסת הדגירה של הנוגדנים וערבב בעדינות. טבלו את החלק בתמיסת אחזור האנטיגן וחממו ב-95 מעלות צלזיוס למשך 20 דקות לפני הקירור לטמפרטורת החדר (ראה טבלת חומרים).
- שטפו את החלק פעמיים עם PBS למשך 5 דקות כל אחד. הנח את החלק בתיבת הדגירה של הנוגדנים כדי לדגור עם 100 מיקרוליטר של נוגדנים ראשוניים כנגד F-actin (1:100), GLUT1 (1:200), Myh9 (1:200), SLC7A11 (1:200) ו-SLC3A2 (1:200) למשך הלילה ב-4 מעלות צלזיוס.
- שטפו את החלק פעמיים עם PBS למשך 5 דקות כל אחד. הוסף 100 מיקרוליטר של נוגדן משני לקטע ודגירה למשך 20 דקות בטמפרטורת החדר.
- שטפו את החלק פעמיים עם PBS למשך 5 דקות כל אחד. מכתים עם 100 מיקרוליטר של תמיסת עבודה DAB למשך 5 דקות בטמפרטורת החדר ועצור את תגובת הצבע על ידי שטיפה במים מטוהרים.
הערה: פתרון העבודה של DAB הוכן על ידי ערבוב תמיסה כרומוגנית DAB A ותמיסה כרומוגנית DAB B ביחס של 1:1, הכלול בערכת פיתוח הצבע של חזרת DAB (ראה טבלת חומרים). - מכתים את החלק ב-100 מיקרוליטר של תמיסת מכתים המטוקסילין למשך 3 דקות ושוטפים במים זורמים למשך 3 דקות (ראה טבלת חומרים).
הערה: ערכת הצביעה של המטוקסילין ואאוזין כוללת תמיסת צביעה של המטוקסילין. - טבלו את הקטע ב-75% אתנול, 95% אתנול ו-100% אתנול למשך 2 דקות בכל אחד.
- אטום את החלק בשרף ניטרלי, כסה בהחלקת כיסוי ובדוק את הקטע במיקרוסקופ אופטי בהגדלה של פי 200 (ראה טבלת חומרים). רקמות המציגות צבע חום הן תגובות חיוביות. חשב את שיעור הביטוי החיובי כיחס בין השטח המוכתם לשטח הכולל של שדה הראייה. לבצע ניתוח כמותי באמצעות תוכנת Image J.
7. זיהוי כתמים מערביים
הערה: מאגר ליזה ומעכב פרוטאז נכללו בערכת כימות חלבון BCA (ראה טבלת חומרים).
- שקלו 0.1 גרם דגימות שריר הלב טריות משלב 3.5 וערבבו עם 1 מ"ל של מאגר ליזה ו-10 מיקרוליטר של מעכב פרוטאז, ולאחר מכן טחינה במיכל טחינה מזכוכית וצנטריפוגה ב-10,304 x גרם למשך 10 דקות ב-4 מעלות צלזיוס.
- אוספים את הסופרנטנט ומבצעים כימות חלבון בשיטת BCA לפי הוראות היצרן8. מרתיחים את הסופרנטנט בחום של 95 מעלות צלזיוס למשך 5 דקות.
- הפרד חלבונים במשקלים מולקולריים שונים באמצעות ג'ל הפרדה של 10% על ידי טעינת דגימה של 10 מיקרוליטר לאלקטרופורזה של חלבון ב-80/120 וולט.
- העבירו את החלבונים על הג'ל לקרום PVDF9. לאחר מכן, יש לחסום את הממברנה עם אבקת חלב דל שומן 5% למשך שעה אחת ולדגור למשך הלילה ב-4 מעלות צלזיוס עם נוגדנים ראשוניים Myh9, SLC7A11, SLC3A2 ו-β-tubulin בדילול של 1:1000 (ראה טבלת חומרים).
- לאחר שטיפה עם PBS 3x למשך 5 דקות כל אחד, דגרו את הממברנה עם נוגדן משני (1:5000; ראה טבלת חומרים) בטמפרטורת החדר למשך שעתיים, ולאחר מכן שטיפה עם PBS 3x למשך 5 דקות כל אחד לפני הדמיה עם מכשיר הדמיית חלבון (ראה טבלת חומרים).
- חשב את יחס גווני האפור של הרצועות ל-β-טובולין באמצעות תוכנת Image J 8,9.
8. ניתוח סטטיסטי
- בטא נתונים כממוצע ± סטיית תקן. נתח נתונים באמצעות ניתוח שונות חד כיווני ואחריו מבחן פוסט הוק ההבדל הכי פחות משמעותי. בצע ניתוח סטטיסטי באמצעות כלי ניתוח סטטיסטי מסחרי (ראה טבלת חומרים) ושקול את p < 0.05 כמובהק סטטיסטית.
תוצאות
בדיקת DRGs ב-MIRI
מערך הנתונים GSE214122 מ-Gene Expression Omnibus כלל שלושה נתוני דגימות דמה ושלוש דגימות MIRI. באמצעות חבילת DESeq2 ב-R, זוהו 1233 גנים המתבטאים באופן דיפרנציאלי (DEGs) בין דגימות MIRI ודגימות דמה. בהתבסס על |log2FC|>2 ו-FDR<0.05, נבחרו 417 גנים שונים באופן משמעותי באמצעות חבילת מפת הצ'יטים של R (איור 1A). לאחר מכן, 15 גנים מצטלבים בין 1233 DEGs אלה ל-106 DRGs הוצגו באיור 1B. 15 ה-DRGs המבוטאים באופן דיפרנציאלי סומנו עוד יותר על ידי תרשים הר געש, כאשר 12 DRGs סומנו על מפת הר הגעש, כפי שמתואר באיור 1C. לאחר מכן נבנתה רשת PPI עבור 15 DRGs באמצעות STRING כאשר שלושה גנים ברשת לא חוברו וכתוצאה מכך הוסרו. רשת ה-PPI הסופית כללה 12 גנים, כפי שמוצג באיור 1D.
MIRI מקדם נזק לתאי שריר הלב של חולדות
תוצאות צביעת HE הראו כי בקבוצות ביקורת (ללא פרוצדורות כירורגיות) ודמה (עם אותם פרוצדורות כירורגיות כמו קבוצת המודל אך ללא הליכי איסכמיה-רפרפוזיה), תאי שריר הלב הראו מורפולוגיה קבועה, סיבי שריר הלב מאורגנים היטב, וללא סימנים ברורים של בצקת או חדירת תאים דלקתיים. לעומת זאת, קבוצת המודל הראתה סידור תאי שריר הלב לא מאורגן, נפיחות, ספירת תאים מופחתת, פיצול סיבי שריר הלב וחדירה ניכרת של תאים מוקצפים ומספר רב של תאים דלקתיים (איור 2A).
תוצאות צביעת TUNEL חשפו כי בהשוואה לקבוצות הביקורת והדמה, קבוצת המודל הראתה עלייה משמעותית בתאים אפופטוטיים אדומים עם תווית פלואורסצנטית בתוך רקמות שריר הלב של חולדות (איור 2B). שיעור האפופטוזיס היה גבוה באופן ניכר (איור 2C, עמ' < 0.01) בקבוצת המודל, ללא הבדלים מובהקים סטטיסטית בין קבוצת הביקורת לקבוצת הדמה.
ביטוי של F-actin ו-GLUT1 ברקמת שריר הלב של חולדות של MIRI
בהשוואה לקבוצות הביקורת והדמה, קבוצת המודל הראתה עלייה משמעותית בביטוי GLUT1 (איור 3A,B, עמ' < 0.01) וירידה משמעותית בביטוי F-actin (איור 3C,D, עמ' < 0.01). לא נצפו הבדלים משמעותיים בין קבוצת הביקורת לקבוצת הדמה עבור ביטוי חלבון GLUT1 ו-F-actin.
ביטוי של Myh9, SLC7A11 ו-SLC3A2 ברקמת שריר הלב של חולדה של MIRI
ניתוח אימונוהיסטוכימי שימש לראשונה כדי להעריך את רמות הביטוי של DRGs במודל MIRI של חולדות. התוצאות הראו כי בהשוואה לקבוצת הביקורת ולקבוצת הדמה, לקבוצת המודל היו רמות ביטוי מוגברות משמעותית של Myh9 (איור 4A,B, עמ' < 0.01) ו-SLC3A2 (איור 4E,F, עמ' < 0.01). לעומת זאת, הביטוי של SLC7A11 הופחת באופן משמעותי (איור 4C,D, עמ' < 0.01). באופן תואם, התוצאות של Western Blotting הראו כי בהשוואה לקבוצות הביקורת והדמה, בקבוצת המודל היו רמות ביטוי מוגברות משמעותית של Myh9 (איור 5A,B, p < 0.01) ו-SLC3A2 (איור 5A,D, עמ' < 0.01) בעוד שהביטוי של SLC7A11 (איור 5A,C, עמ' < 0.01) הופחת באופן משמעותי.

איור 1: סינון גנים הקשורים לדיסולפידפטוזיס ב-MIRI. (A) מפת חום של 1233 גנים לניתוח ביטוי דיפרנציאלי בדגימות MIRI ודמה. (B) דיאגרמת ון של DEGs ו-DRGs. היו 15 גנים נפוצים בין 1233 DEGs ו-99 DRGs, כפי שמוצג בתיבה. (C) עלילות הר געש של DEGs במערך הנתונים של GSE214122. נקודות אדומות וירוקות על העלילה, בהתאמה, מצביעות על גנים מווסתים ומווסתים. (D) רשת PPI של 12 ה-DRGs של הרכזת נבנתה באמצעות מסד הנתונים STRING. DEGs, גנים המתבטאים באופן דיפרנציאלי; DRGs, גנים הקשורים לדיסולפידפטוזיס. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 2: MIRI מקדם נזק לתאי שריר הלב. (A) תמונות מייצגות של פגיעות שריר הלב שהוערכו על ידי צביעת H&E (סרגל קנה מידה = 50 מיקרומטר). (B) אפופטוזיס של קרדיומיוציטים שזוהה על ידי בדיקת TUNEL. קבוצת המודל הראתה עלייה משמעותית בתאים אפופטוטיים אדומים המסומנים בפלואורסצנט בתוך רקמות שריר הלב של חולדות (סרגל קנה מידה = 50 מיקרומטר). (C) התוצאות הסטטיסטיות של קצב האפופטוזיס על ידי ניתוח עוצמת אות הקרינה האדומה באמצעות תוכנת Image J. **p < 0.01, קבוצת המודל לעומת קבוצת הדמה, n=3. הנתונים מבוטאים כממוצע ± סטיית תקן. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
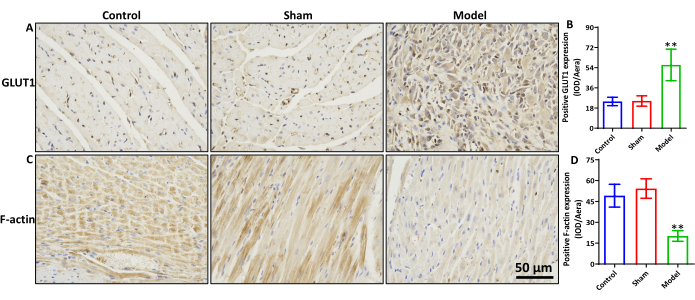
איור 3: ביטוי של F-actin ו-GLUT1 ברקמת שריר הלב של MIRI של חולדה. (A) צביעת IHC של GLUT1 ו-(B) תוצאות סטטיסטיות של ביטוי החלבון שלו. (C) צביעת IHC של F-actin ו-(D) תוצאות סטטיסטיות של ביטוי החלבון שלו. סרגל קנה מידה = 50 מיקרומטר. **p < 0.01, קבוצת המודל לעומת קבוצת הדמה, n=6. הנתונים מבוטאים כממוצע ± סטיית תקן. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 4: ניתוח צביעת IHC של ביטוי חלבונים הקשורים לדיסולפידפטוזיס Myh9, SLC7A11 ו-SLC3A2 ברקמת שריר הלב של חולדה MIRI. (A) צביעת IHC של Myh9 ו-(B) תוצאות סטטיסטיות של ביטוי החלבון שלו. (C) צביעת IHC של SLC7A11 ו-(D) תוצאות סטטיסטיות של ביטוי החלבון שלו. (E) צביעת IHC של SLC3A2 ו-(F) תוצאות סטטיסטיות של ביטוי החלבון שלו. סרגל קנה מידה = 50 מיקרומטר. **p < 0.01, קבוצת המודל לעומת קבוצת הדמה, n=3. הנתונים מבוטאים כממוצע ± סטיית תקן. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 5: ניתוח כתמים מערביים של ביטוי חלבונים הקשורים לדיסולפידפטוזיס Myh9, SLC7A11 ו-SLC3A2 ברקמת שריר הלב של חולדה MIRI. (A) רצועות חלבון מייצגות. תוצאות סטטיסטיות של ביטוי חלבון (B) Myh9, (C) SLC7A11 ו-(D) SLC3A2. **p < 0.01, קבוצת המודל לעומת קבוצת הדמה, n=3. ערכי גווני האפור של החלבונים נותחו באמצעות תוכנת Image J. הנתונים מבוטאים כממוצע ± סטיית תקן. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
Discussion
דיסולפידפטוזיס קשור קשר הדוק לשלד התא אקטין, מבנה תאי קריטי החיוני לשמירה על צורת התא וחיוניותו. מורכב מחוטי אקטין, שלד הציטו של האקטין מעניק צורה ומבנה תאים כלליים. F-actin משמש כסמן לשלד התא, ובתנאים של רעב גלוקוז, קשרי דיסולפיד גדלים משמעותית, מה שמוביל לוויסות נמוך של F-actin. תופעה זו משפיעה בעיקר על תהליכים ומסלולים הקשורים לשלד התא של האקטין והידבקות התאים10,11.
בהקשר של חילוף חומרים של גלוקוז, מובילי גלוקוז (GLUTs) ממלאים תפקיד חיוני בשמירה על האיזון הדינמי של הגלוקוז. GLUT1, אחד החברים המוקדמים ביותר שהתגלו במשפחת GLUT, הוא חלבון הקשור לספיגת גלוקוז עם תפוצה נרחבת של רקמות. הוא מתבטא בעיקר בתאי דם אדומים12 ובתאי אנדותל של מחסום הדם-מוח13, שם הוא משתתף בהובלה טרנסממברנית של גלוקוז. GLUT1 עשוי להיות קשור קשר הדוק להתפתחות מחלות הקשורות למטבוליזם לא תקין של גלוקוז. במודלים של רעב גלוקוז, ביטוי GLUT1 מווסת ומקדם מוות של תאי גידול. במודל MIRI, ויסות מוגבר של ביטוי GLUT1 מחמיר את MIRI, אך שיפורים נצפים כאשר GLUT1 מווסת, מה שהופך אותו ליעד מרכזי תחת רעב גלוקוז14. אימונוהיסטוכימיה חשפה עלייה תוך-תאית משמעותית בחלבון טרנספורטר הגלוקוז GLUT1 במודל MIRI בהשוואה לקבוצות הביקורת והדמה. במקביל, F-actin ירד באופן משמעותי תוך תאית בהשוואה לקבוצות הביקורת והדמה. זה מצביע על כך שקריסת שלד הציטו של האקטין בתנאי רעב של גלוקוז עשויה לתרום להחמרה של MIRI, מה שהופך את קריסת שלד הציטין של האקטין למנגנון העיקרי של דיסולפידפטוזיס. לכן, אנו משערים כי הוויסות המוגבר של GLUT1 במודל MIRI גורם לדיסולפידפטוזיס, מה שמוביל לפגיעה מחמירה באיסכמיה-רפרפוזיה.
הגן Myh9 מקודד את השרשרת הכבדה של מיוזין IIA שאינו שריר, מיוזין ציטופלזמי בעל ביטוי נרחב המעורב בתהליכים שונים הדורשים יצירת כוחות מכניים תוך תאיים ומיקום מחדש של שלד התא15. חולים עם טרומבוציטופניה מולדת עקב מוטציות בגן Myh9 מועדים להיווצרות פקקת ואוטם שריר הלב חריף16. לכן, Myh9 עשוי להיות גורם מנבא עבור AMI או MIRI. SLC7A11 ו-SLC3A2 הם חלבונים המסייעים לתאים בהשגת ציסטאין וגלוטתיון, החיוניים לשמירה על בריאות התאים ואיזון. SLC7A11 יכול להפחית את חמצון השומנים ומתח חמצוני כדי למלא תפקיד מגן ב-MIRI17. המחקר שלנו חקר את הפונקציות הביולוגיות הפוטנציאליות ואת המשמעות הטיפולית של גנים הקשורים לדיסולפידפטוזיס באמצעות מסד הנתונים GEO. מצאנו חפיפה מוגבלת בין MIRI לגנים הקשורים לדיסולפידפטוזיס, עם סך של 12 גנים חופפים. באמצעות ניתוח P-value ו-Log2Fold Change, זיהינו ארבעה גנים שהיו קרובים ביותר במודל MIRI. התוצאות הצביעו על ויסות מוגבר משמעותי של ביטוי Myh9 והפחתה משמעותית של ביטוי SLC7A11 בקבוצת MIRI. עם זאת, לא נצפה הבדל מובהק סטטיסטית בביטוי ACTB. תוצאות הניסוי אישרו כי Myh9 ו-SLC7A11 מעורבים ב-MIRI, והמנגנונים שלהם עשויים להיות קשורים קשר הדוק לדיסולפידפטוזיס המתווך על ידי דלדול NADPH. ממצאים אלה מספקים רמזים חשובים לזיהוי גורמי חיזוי חדשים ואסטרטגיות טיפול מותאמות אישית עבור MIRI (איור 5).
לסיכום, הזיהוי והאפיון של מנגנוני מוות תאי לא רק מקדמים את ההבנה הבסיסית שלנו לגבי הומאוסטזיס תאי, אלא גם מדגישים את התפקיד המשמעותי שממלא דיסולפידפטוזיס ב-MIRI. החיסרון של שיטה זו הוא היעדר ניסויי אימות קריטיים לדיסולפידפטוזיס. נכון לעכשיו, ניתן לזהות ולזהות דיסולפידפטוזיס באמצעות הגשושית הפלואורסצנטית DCP-Bio1, הנקשרת לקשרים דיסולפידים, מסמנת דיסולפידים תוך-תאיים וחוץ-תאיים ומקלה על התבוננות בדיסולפידים בתאים או ברקמות18. ניתן להשתמש בבדיקות חדשות כאלה כדי לחקור את הדינמיקה המרחבית-זמנית בין דיסולפידפטוזיס ל-MIRI.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
מחקר זה נתמך על ידי הלשכה המחוזית למדע וטכנולוגיה של גוויג'ואו (Qiankehe [2022]-583) והמינהל המחוזי של גוויג'ואו לרפואה סינית מסורתית (QZYY-2016-019).
Materials
| Name | Company | Catalog Number | Comments |
| 75% alcohol | Hunan Tongruijian Pharmaceutical Co. Ltd., Hunan, China | 85026 | |
| 6-0 nylon suture | Shanghai Pudong Jinhuan Medical Supplies Co. Ltd., Shanghai, China | CS002 | |
| BCA protein quantification kit | Beyotime Biotechnology, Shanghai, China | P0011 | |
| Bull serum albumin | Beyotime Biotechnology, Shanghai, China | ST2254 | |
| Centrifuge | Hunan Kaida Scientific Instrument Co. Ltd., Hunan, China | KH19A | |
| DAB horseradish peroxidase color development kit | Beyotime Biotechnology, Shanghai, China | P0203 | |
| DAPI staining solution | Beyotime Biotechnology, Shanghai, China | C1006 | |
| DESeq2 package | Version 4.1 | ||
| Electric razor | Kelmerpp | 235376 | |
| Enhanced endogenous peroxidase blocking buffer | Beyotime Biotechnology, Shanghai, China | P0100B | |
| Filter paper | Nanjing Keruicai Equipment Co., Ltd., Nanjing, China | 1.00049E+11 | |
| Fluorescence microscope | Nikon | ECLIPSE Ci | |
| GEO database | https://www.ncbi.nlm.nih.gov/geo/ | ||
| Glass grinder | Shanghai Leigu Instrument Co. Ltd., Shanghai, China | B-013002 | |
| GraphPad Prism | GraphPad Software | V8.0 | |
| Hematoxylin and eosin staining kit | Beyotime Biotechnology, Shanghai, China | C0105M | |
| Image J software | National Institutes of Health, Bethesda, USA | v1.8.0 | |
| Improved citrate antigen retrieval solution (50X) | Beyotime Biotechnology, Shanghai, China | P0083 | |
| Iodophor | Folca, Shenzhen, China | 1.00077E+11 | |
| Optical microscope | Nikon | ECLIPSE Ci | |
| Phosphate buffer solution | Beyotime Biotechnology, Shanghai, China | C0221A | |
| Primary antibodies against GLUT1 | Proteintech Group, Inc, Wuhan, China | 21829-1-AP | |
| Primary antibodies against MYH9 | Proteintech Group, Inc, Wuhan, China | 11128-1-AP | |
| Primary antibodies against SLC3A2 | Wuhan Lingsi Biotechnology Co., Ltd., Wuhan, China | LJS-D-7468 | |
| Primary antibodies against SLC7A11 | Proteintech Group, Inc, Wuhan, China | 26864-1-AP | |
| Protein visualization instrument | Thermo Fisher Scientific Inc. | iBright CL750 | |
| Rat board | Zhengzhou Haopai Biotechnology Co. Ltd., Zhengzhou, China | JPB-E | |
| Scalpel | Shanghai Lianhui Medical Supplies Co., Ltd., Shanghai, China | 1.00471E+13 | |
| Secondary antibody | Wuhan Boster Biological Technology, Ltd., Wuhan, China | BA1054 | |
| STRING database | https://cn.string-db.org/ | Version 12.0 | |
| Triton X-100 | Beyotime Biotechnology, Shanghai, China | ST1722 | |
| TUNEL apoptosis detection kit | Proteintech Group, Inc., Wuhan, China | PF00009 |
References
- Lu, Z., et al. Tripartite motif 38 attenuates cardiac fibrosis after myocardial infarction by suppressing TAK1 activation via TAB2/3 degradation. iScience. 25 (8), 104780(2022).
- Tu, Q., et al. EGCG decreases myocardial infarction in both I/R and MIRI rats through reducing intracellular Ca2+ and increasing TnT levels in cardiomyocytes. Adv Clin Exp Med. 30 (6), 607-616 (2021).
- Li, Q., et al. Histone deacetylase HDAC4 participates in the pathological process of myocardial ischemia-reperfusion injury via MEKK1/JNK pathway by binding to miR-206. Cell Death Dis. 7 (1), 240(2021).
- Liu, X., et al. Actin cytoskeleton vulnerability to disulfide stress mediates disulfidptosis. Nat Cell Biol. 25 (3), 404-414 (2023).
- Yang, L., et al. Analysis of risk genes associated with disulfidptosis-related myocardial ischemia-reperfusion injury. J Chongqing Med Univ. 49 (4), 401-408 (2024).
- Xiao, G., et al. CXCR1 and its downstream NF-κB inflammation signaling pathway as a key target of Guanxinning injection for myocardial ischemia/reperfusion injury. Front Immunol. 13, 1007341(2022).
- Zhu, E. Y., et al. Screening of immune-related secretory proteins linking chronic kidney disease with calcific aortic valve disease based on comprehensive bioinformatics analysis and machine learning. J Transl Med. 21, 359(2023).
- Shi, D. C., et al. Potential of Dendrobium officinale oligosaccharides to alleviate chronic colitis by modulating inflammation and gut microbiota. FoodMedHomo. 2, 9420077(2025).
- Ning, E. J., et al. Artemisia argyi polysaccharide alleviates intestinal inflammation and intestinal flora dysbiosis in lipopolysaccharide-treated mice. FoodMedHomo. 1 (1), 9420008(2024).
- Zhou, H., Wang, J., Zhu, P., Hu, S., Ren, J. Ripk3 regulates cardiac microvascular reperfusion injury: The role of IP3R-dependent calcium overload, XO-mediated oxidative stress and F-action/filopodia based cellular migration. Cell Signal. 45, 12-22 (2018).
- Antonipillai, J., Rigby, S., Bassler, N., Peter, K., Bernard, O. Pharmacological inhibition of LIM kinase pathway impairs platelets functionality and facilitates thrombolysis. Exp Cell Res. 382 (2), 111458(2019).
- Kaumeyer, B. A., et al. GLUT1 immunohistochemistry is a highly sensitive and relatively specific marker for erythroid lineage in benign and malignant hematopoietic tissues. Am J Clin Pathol. 158 (2), 228-234 (2022).
- Patching, S. G. Glucose transporters at the blood-brain barrier: Function, regulation and gateways for drug delivery. Mol Neurobiol. 54 (2), 1046-1077 (2017).
- Zhou, H., et al. 3-iodothyronamine inhibits apoptosis induced by myocardial ischemia reperfusion via the Akt/FoxO1 signaling pathway. Ann Trans Med. 10 (4), 168(2022).
- Pecci, A., et al. MYH9: Structure, functions and role of non-muscle myosin IIA in human disease. Gene. 664, 152-167 (2018).
- Girolami, A., et al. Occurrence of thrombosis in congenital thrombocytopenic disorders: A critical annotation of the literature. Blood Coagulat Fibrino. 24 (1), 18-22 (2013).
- Li, P., et al. SLC7A11-associated ferroptosis in acute injury diseases: Mechanisms and strategies. Eur Rev Med Pharmaco Sci. 27 (10), 4386-4398 (2023).
- Wu, X., et al. Dihydrotanshinone I preconditions myocardium against ischemic injury via PKM2 glutathionylation sensitive to ROS. Acta Pharma Sinica B. 13 (1), 113-127 (2023).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved