Method Article
Дифференциальный анализ генов и валидация дисульфидептоза в модели ишемии-реперфузионного повреждения миокарда у крыс
В этой статье
Резюме
Протокол описывает идентификацию нескольких новых дифференциальных генов, связанных с дисульфидептозом, ассоциированных с ишемическим повреждением миокарда с помощью биоинформатического анализа и экспериментальной валидации.
Аннотация
Ишемия-реперфузионное повреждение миокарда (МИРИ) – это дополнительное повреждение, возникающее в процессе восстановления кровотока сердечной ткани после ишемического повреждения. МИРИ серьезно влияет на эффективность и краткосрочный и долгосрочный прогноз реперфузии после инфаркта миокарда. В настоящее время механизм работы MIRI до конца не ясен. Дисульфидептоз является новым способом клеточной смерти, и связь между MIRI и экспрессией генов, связанных с дисульфидептозом (DRG), до сих пор неясна. Во-первых, в этом исследовании изучаются дифференциально экспрессируемые гены, связанные с дисульфидептозом в MIRI, с помощью биоинформатического анализа. Во-вторых, путем построения крысиной модели MIRI были дополнительно обнаружены ДРГ. В этом исследовании было выявлено 12 родственных генов, включая Myh9, SLC7A11, SLC3A2, Myh7b, ACTB, FLNB, Actn1, Actn4, Flnc, Dbn1 и Pdlim1. В ткани миокарда крыс с MIRI наблюдаются явные патологические повреждения и апоптозы. Результаты иммуногистохимии показали, что стимуляция MIRI увеличивает экспрессию белка GLUT1 в ткани миокарда, но ограничивает экспрессию белка F-актина. Кроме того, значительные различия в экспрессии трех белков были проверены с использованием внешних наборов данных и моделей MIRI на крысах. Это исследование показало, что DRG имеют значительную прогностическую ценность в MIRI, открывая новые перспективы для изучения биомаркеров и потенциальных терапевтических мишеней MIRI.
Введение
Острый инфаркт миокарда (ОИМ) является тяжелым сердечно-сосудистым заболеванием и остается ведущей глобальной причиной смертности. Чрескожное коронарное вмешательство значительно снизило показатели смертности у пациентов с ОИМ1. Однако реперфузионная терапия, направленная на восстановление кровоснабжения миокарда, сопровождается рядом неблагоприятных патологических и физиологических реакций. Эти процессы могут привести к увеличению размера инфаркта, гибели клеток миокарда, устойчивым желудочковым аритмиям и внезапной смерти2. Ишемия-реперфузионное повреждение миокарда (MIRI) — это сложное сердечно-сосудистое заболевание, на которое влияют такие факторы, как цитокины, хемокины, факторы роста, окислительный стресс и перегрузка кальцием3. Смягчение последствий MIRI остается серьезной проблемой.
В последнее время дисульфидептоз стал новой формой клеточной смерти, характеризующейся быстрым коллапсом цитоскелетной актиновой сети из-за чрезмерного накопления дисульфидов, включая цистеин, в клетках в результате истощения NADPH+. Чрезмерное накопление дисульфида нарушает дисульфидные связи между белками цитоскелета, что приводит к миграции актина и гибели клеток 4,5. В отличие от ранее описанных форм клеточной гибели, таких как апоптоз, некроз, пироптоз и ферроптоз, дисульфидептоз инициируется чрезмерной агрегацией внутриклеточных дисульфидов и не антагонизируется специфическими ингибиторами других путей клеточной гибели. Как отличительная клеточная гибель, данные свидетельствуют о том, что вызванная дефицитом глюкозы SLC7A11 сверхэкспрессия в клетках может вызвать дисульфидптоз4. После MIRI недостаточная секреция инсулина может вызвать гипогликемию и последующий дисульфидптоз, что может привести к дальнейшему повреждению клеток миокарда и может быть одним из новых механизмов MIRI5.
В данном исследовании основной целью было использование всеобъемлющих баз данных экспрессии генов, таких как Gene Expression Omnibus (GEO), для анализа дифференциальной экспрессии генов между нормальными образцами и образцами MIRI. Мы провели перекрестный референтный анализ между дифференциально экспрессируемыми генами и генами, связанными с дисульфидептозом, с целью идентификации генов, связанных с дисульфидептозом (DRG), которые демонстрируют дифференциальную экспрессию в MIRI. Для идентификации ключевых генов были использованы алгоритмы машинного обучения, и мы проверили паттерны экспрессии выбранных дифференциальных генов, представляющих интерес, с использованием животной модели. Такой подход позволяет по-новому взглянуть на достижение более глубокого понимания потенциальных механизмов, лежащих в основе возникновения и развития MIRI. Основное внимание в этом исследовании уделялось изучению нового механизма клеточной смерти в MIRI, раскрытию связанных с ним дифференциальных генов и проведению предварительных экспериментов для подтверждения этих результатов. Конечная цель состояла в том, чтобы определить новые терапевтические мишени для смягчения MIRI на основе этого нового механизма клеточной смерти.
протокол
Для этого исследования девять самцов крыс Sprague-Dawley (SD) в возрасте 6-8 недель и весом 180-220 г были отобраны из Хубэйского исследовательского центра экспериментальных животных [SCXK (Hubei) 20200018]. Крысы содержались в специальных помещениях для животных, свободных от патогенов, для акклиматизации в течение 1 недели, с циклом 12 ч/12 ч в светлом и темном свете, свободном питье и еде. Настоящее исследование было проведено с одобрения Комитета по этике животных Третьей аффилированной больницы Медицинского университета Цзуньи (номер одобрения: (2016)-1-56). Все процедуры проводились в соответствии с рекомендациями, изложенными в Руководстве по уходу и использованию лабораторных животных, опубликованном Национальными институтами здравоохранения США. Были приняты строгие меры для минимизации количества используемых животных и облегчения их страданий.
1. Дифференциальный анализ экспрессии генов, связанных с MIRI и дисульфидептозом
ПРИМЕЧАНИЕ: Данные секвенирования РНК из MIRI под названием GSE214122 были отобраны для скрининга генов, связанных с дисульфидептозом, согласно литературному отчету6.
- Откройте базу данных GEO, введите GSE214122 в поле Поиск и нажмите Enter. Загрузите сгенерированные файлы матрицы серий в формате TXT в разделе Скачать.
ПРИМЕЧАНИЕ: Перед проведением анализа данных, как правило, необходимо провести предварительную обработку загруженных данных. Это включает в себя проверку отсутствующих значений, удаление образцов и генов низкого качества, а также выполнение нормализации или стандартизации данных. Извлеченный набор данных GSE214122 содержал образцы из фиктивных групп и групп MIRI. - Выполните дифференциальный анализ экспрессии генов образцов с помощью пакета DESeq27. Рассмотрим гены с |log2FC|>1 (изменение в разы больше 2) и FDR<0,05 как статистически значимые, что приводит к идентификации дифференциально экспрессируемых генов, связанных с MIRI. Сгенерируйте тепловую карту дифференциальной экспрессии генов на шаге 1.2 с помощью пакета Pheatmap7 компании R.
- Постройте диаграмму Венна с помощью пакета VennDiagram7 компании R (см. Таблицу материалов). Создание графиков Volcano для визуализации генов, связанных с дисульфидептозом, с помощью пакета EnhancedVolcano в R7.
- Постройте сеть PPI, соединяющую дифференциально экспрессируемые гены MIRI с генами дисульфидептоза, используя базу данных STRING7 (см. Таблицу материалов).
2. Построение модели MIRI крысы
- Голодайте на крысах в течение ночи перед проведением анестезии. Обезболите крыс путем внутрибрюшинной инъекции 2% пентобарбитала натрия (40 мг/кг) и закрепите конечности на крысиной доске в положении лежа на спине. Подтвердите глубину анестезии отсутствием реакции на защемление пальца ноги, потерей выпрямляющего рефлекса и рефлексом мигания глаз. Используйте ветеринарную мазь, чтобы предотвратить сухость во время анестезии.
- Продезинфицируйте кожу шеи и груди йодофором и дейодируйте 75% спиртом. Сбрейте шерсть шеи и левой части груди электрической бритвой и сделайте скальпелем срединный надрез шеи длиной примерно 2,5 см (см. Таблицу материалов).
- Отделить трахею щипцами и провести эндотрахеальную интубацию с подключением к аппарату искусственной вентиляции легких мелких животных3 (см. Таблицу материалов).
- Разрежьте 4 см продольно вдоль левой стороны грудины офтальмологическими ножницами и тупо отделите подкожные мышцы щипцами, чтобы обнажить плевру между третьим и четвертым ребрами.
- Сделайте разрез 4-5 см от мечевидного отростка до середины левого второго межреберья, держа скальпель под углом 45°. Аккуратно и медленно отделите большую грудную мышцу и переднюю зубчатую мышцу с помощью офтальмологических щипцов для доступа к межреберному пространству.
- Сделайте поперечный разрез 1,5 см между левым, третьим и четвертым ребрами с помощью офтальмологических ножниц. После рассечения перикарда с помощью офтальмологических щипцов поднимите придаток левого предсердия с помощью щипцов для выявления коронарного устья у корня аорты.
- Лигатуру левой передней нисходящей коронарной артерии между легочным конусом и придатком левого предсердия с помощью шва 6-0 (см. Таблицу материалов).
- Через 30 минут ослабьте шов, чтобы обеспечить реперфузию в течение 120 минут, с последующим закрытием мышечного и кожного слоев с помощью шва 6-0. Применяют пенициллин (см. Таблицу материалов) путем внутрибрюшинного введения 80 000-100 000 ЕД.
- В симуляционной группе выполнять все процедуры так же, как и в модельной группе, но продевать только левую переднюю нисходящую коронарную артерию без лигирования и реперфузии.
- Как только крысы придут в сознание, удалите эндотрахеальные трубки. Верните крыс в помещение для животных для восстановления, где у них будет свободный доступ к пище и воде. Содержать крысу, подвергшуюся хирургическому вмешательству, в одной клетке с независимой системой вентиляции в стерильной лаборатории.
- В течение 30 мин ишемии и 120 мин реперфузии проводят эхокардиографию. Моделирование считалось успешным, если фракция выброса левого желудочка составляла менее 50%1,6.
3. Забор сердечной ткани3
- После 120 минут реперфузии поместите крыс в контейнер для эвтаназии для осуществления эвтаназии путем вдыхания углекислого газа. Соберите сердечные ткани крысы немедленно.
- Удалите шерсть на животе крыс с помощью бритвенного аппарата и простерилизуйте переднюю область грудной клетки йодом и 75% спиртом. Рассеките брюшную полость крысы по средней линии живота с помощью скальпеля.
- Разрежьте кожу от мечевидного отростка вверх до подчелюстного пространства хирургическими ножницами и тупо отклейте кожу и подкожную клетчатку щипцами с обеих сторон, чтобы обнажить грудную клетку и поверхностный слой шейных мышц (см. Таблицу материалов).
- Вскройте грудную клетку и плевру по средней линии хирургическими ножницами, чтобы обнажить сердце, зажмите аорту сосудистым зажимом и перережьте артерию офтальмологическими ножницами. Вынуть сердце и рассечь на 1 мм3 тканевых блока в холодном физрастворе на ледяной бане и зафиксировать 4% параформальдегидом на 48 ч (см. Таблицу материалов).
4. Окрашивание гематоксилин-эозином (H&E)
- Обезвоживание и внедрение: Обезвоживайте блок сердечной ткани путем последовательного замачивания в 75% спирте, 85% спирте, 95% спирте (I), 95% спирте (II), 100% спирте (I) и 100% спирте (II) в течение 1 часа в каждом растворе. Прозрачить с помощью ксилола (I) и ксилола (II), погрузив в каждый раствор на 15 минут. Поместите блок сердечной ткани в жидкий парафин (I), парафин (II) и парафин (III) на 20-30 минут последовательно. Дайте парафиновому блоку остыть естественным путем до застывания.
- Разрежьте залитый парафином блок сердечной ткани на срезы размером 4 мкм с помощью машины для нарезки парафина (см. Таблицу материалов). Разложите пряди мягкой щеткой на водяной бане при температуре 45 °C, а затем подхватите полностью развернутые срезы с помощью горки.
- Депарафинизация: Выпекать ломтики в духовке в течение 30-60 минут при температуре 55 °C, а затем удалить воск с помощью ксилола (I) в течение 5-10 минут и ксилола (II) в течение 5-10 минут. Затем промойте ксилол абсолютным этанолом в течение 1-5 минут, 95% этанолом в течение 1-5 минут и 75% этанолом в течение 1-5 минут, а также промойте водопроводной водой в течение 1-5 минут.
- Окрашивание: Окрашивать раствором гематоксилина в течение 5-20 мин, полоскать водопроводной водой в течение 5-10 с, окрашивать раствором эозина в течение 15-30 с, стирать с 75%-85% этанолом в течение 30 с.
- Обезвоживание, прозрачность и герметизация: Обезвоживайте 95% этанола (I) в течение 0,5-2 мин и 95% этанола (II) в течение 2-5 мин, затем абсолютный этанол (I) в течение 2-5 мин и абсолютный этанол (II) в течение 2-5 мин. Прозрачите с помощью ксилола (I) в течение 1 минуты и ксилола (II) в течение 1 минуты, а затем запечатайте ломтик, добавив две капли нейтральной смолы на ломтик, и поместите покровное стекло. Слегка нажмите на покровное стекло, чтобы заполнить ломтик нейтральной смолой (см. Таблицу материалов).
- Наблюдайте за каждым срезом под оптическим микроскопом при 200-кратном увеличении двойным слепым способом двумя независимыми техниками.
- Выберите три случайных поля зрения для оценки застойных явлений миокарда, кровоизлияний, фиброза, некроза и дегенерации. Используйте следующие критерии оценки: 0 указывает на отсутствие поражения; 0-1 указывало на то, что поражения составляли менее 1/4 обозначенной площади; 1-2 выявленных поражения варьировались примерно от 1/4−1/2 обозначенной площади; 2-3 выявленных поражения варьировались примерно от 1/2−3/4 обозначенной области; и 3-4 указанных поражения превышали 3/4 обозначенной площади.
5. Проба TUNEL
- Разбавить протеиназу К фосфатным буферным раствором (PBS) до 40 мкг/мл и добавить 100 мкл протеиназы К к срезам 4 мкм, приготовленным на стадии 4.3, чтобы покрыть всю площадь образца, и инкубировать в течение 10 мин при комнатной температуре.
ПРИМЕЧАНИЕ: Протеиназа К входит в набор для обнаружения апоптоза TUNEL (см. Таблицу материалов). - Промойте секцию 2 раза PBS в течение 5 минут каждая, удалите лишнюю жидкость путем отсасывания фильтровальной бумагой и держите секцию влажной во влажной коробке.
ПРИМЕЧАНИЕ: Протеиназа К должна быть промыта начисто, чтобы не препятствовать последующим реакциям мечения. - Равномерно добавьте 50 мкл реакционного раствора TUNEL, содержащего 2 мкл фермента TdT и 48 мкл реакционного буфера TUNEL, и поместите секцию во влажный бокс для инкубации при 37 °C в темноте в течение 2 ч.
ПРИМЕЧАНИЕ: Фермент TdT и реакционный буфер TUNEL входят в комплект для обнаружения апоптоза TUNEL. - Сбросить реакционный раствор TUNEL и промыть 2 раза PBS в течение 5 минут каждый. Промойте секцию 3 раза в течение 5 минут с PBS, содержащей 0,1% Triton X-100 и 5 мг/мл BSA.
- Равномерно добавьте 50 μL раствора для окрашивания DAPI и инкубируйте в течение 10 минут при комнатной температуре в темноте. Выбросьте раствор для окрашивания DAPI и замочите срез в PBS 3x 5 мин каждый раз.
- Получение красных сигналов TUNEL и синего DAPI на длинах волн возбуждения и излучения 593/614 нм и 364/454 нм соответственно. Получение изображений под флуоресцентным микроскопом при 200-кратном увеличении (см. Таблицу материалов).
6. Иммуногистохимическое окрашивание
- Добавьте 200 мкл усиленного буфера, блокирующего эндогенную пероксидазу, в срез на шаге 4.3 и инкубируйте в течение 10 мин при комнатной температуре в темноте. Промойте секцию 2 раза дистиллированной водой по 5 минут каждая.
- Добавьте 1 мл улучшенного раствора для извлечения цитратного антигена и 49 мл дважды дистиллированной воды в инкубационный бокс для антител и аккуратно перемешайте. Погрузите срез в раствор для извлечения антигена и нагрейте при температуре 95 °C в течение 20 мин перед охлаждением до комнатной температуры (см. Таблицу материалов).
- Промойте секцию 2 раза PBS по 5 минут каждая. Поместите секцию в инкубационный бокс для антител для инкубации со 100 мкл первичных антител против F-актина (1:100), GLUT1 (1:200), Myh9 (1:200), SLC7A11 (1:200) и SLC3A2 (1:200) в течение ночи при 4 °C.
- Промойте секцию 2 раза PBS по 5 минут каждая. Добавьте в срез 100 мкл вторичного антитела и инкубируйте в течение 20 мин при комнатной температуре.
- Промойте секцию 2 раза PBS по 5 минут каждая. Окрасить 100 μЛ рабочего раствора DAB на 5 мин при комнатной температуре и остановить реакцию цвета путем промывки очищенной водой.
Примечание: Рабочий раствор DAB был получен путем смешивания хромогенного раствора DAB А и хромогенного раствора DAB B в соотношении 1:1, который входит в набор для разработки красителя пероксидазы хрена DAB (см. Таблицу материалов). - Срез окрасить 100 мкл раствора для окрашивания гематоксилином на 3 мин и промыть проточной водой в течение 3 мин (см. Таблицу материалов).
ПРИМЕЧАНИЕ: В набор для окрашивания гематоксилином и эозином входит раствор для окрашивания гематоксилином. - Погрузите секцию в 75% этанол, 95% этанол и 100% этанол на 2 минуты в каждую.
- Запечатайте срез нейтральной смолой, накройте крышкой и рассмотрите срез под оптическим микроскопом при 200-кратном увеличении (см. Таблицу материалов). Ткани, имеющие коричневый цвет, являются положительными реакциями. Рассчитайте положительную экспрессию как отношение окрашенной области к общей площади поля зрения. Выполняйте количественный анализ с помощью программного обеспечения Image J.
7. Обнаружение вестерн-блоттинга
Примечание: Буфер для лизиса и ингибитор протеазы были включены в набор для количественного определения белка BCA (см. Таблицу материалов).
- Взвесить 0,1 г свежих образцов миокарда на стадии 3.5 и смешать с 1 мл буфера для лизиса и 10 мкл ингибитора протеазы, после чего измельчить в стеклянной емкости для измельчения и центрифугировать при 10,304 х г в течение 10 мин при 4 °С.
- Соберите надосадочную жидкость и проведите количественное определение белка методом ВСА в соответствии с инструкциями производителя8. Кипятить надосадочную жидкость при температуре 95 °C в течение 5 минут.
- Разделить белки с разной молекулярной массой с помощью 10% разделительного геля путем загрузки образца объемом 10 мкл для электрофореза белка при напряжении 80/120 В.
- Перенесите белки геля на мембрану из ПВДФ9. Затем блокируют мембрану 5% сухим обезжиренным молоком в течение 1 ч и инкубируют в течение ночи при 4 °C первичными антителами Myh9, SLC7A11, SLC3A2 и β-тубулином в разведении 1:1000 (см. Таблицу материалов).
- После промывки PBS 3x в течение 5 мин каждая мембрана инкубируется со вторичным антителом (1:5000; см. Таблицу материалов) при комнатной температуре в течение 2 ч, а затем промывается PBS 3x в течение 5 мин каждая перед визуализацией с помощью инструмента для визуализации белка (см. Таблицу материалов).
- Рассчитайте отношение оттенков серого к β-тубулину с помощью программного обеспечения Image J 8,9.
8. Статистический анализ
- Выражайте данные как среднее значение ± стандартное отклонение. Анализируйте данные с помощью одностороннего дисперсионного анализа с последующим апостериорным тестом на наименее значимую разницу. Проведите статистический анализ с помощью коммерческого инструмента статистического анализа (см. Таблицу материалов) и сочтите p < 0,05 статистически значимым.
Результаты
Скрининг ДРГ в MIRI
Набор данных GSE214122 от Gene Expression Omnibus включал три фиктивных образца и три данные MIRI. С помощью пакета DESeq2 в R было идентифицировано 1233 дифференциально экспрессируемых гена (DEG) между MIRI и фиктивными образцами. На основе |log2FC|>2 и FDR<0.05 417 значительно отличающихся генов были отобраны с помощью пакета pheatmap R (рис. 1A). Затем 15 генов пересечения между этими 1233 ДЭГ и 106 ДРГ были представлены на рисунке 1В. 15 дифференциально выраженных DRG были дополнительно аннотированы с помощью графика вулкана, а 12 DRG были обозначены на карте вулкана, как показано на рисунке 1C. Затем с использованием STRING была сконструирована сеть PPI для 15 DRG, при этом три гена в сети не были соединены и, следовательно, удалены. Окончательная сеть ИПП состояла из 12 генов, как показано на рисунке 1D.
MIRI способствует повреждению клеток миокарда крысы
Результаты окрашивания методом HE показали, что в контрольной (без хирургических процедур) и фиктивной (с теми же хирургическими процедурами, что и в модельной группе, но без процедур ишемии-реперфузии) клетках миокарда наблюдалась регулярная морфология, хорошо организованные волокна миокарда и отсутствовали явные признаки отека или инфильтрации воспалительных клеток. Напротив, в модельной группе наблюдалось дезорганизованное расположение клеток миокарда, отек, уменьшение количества клеток, фрагментация волокон миокарда и заметная инфильтрация пенистых клеток и большое количество воспалительных клеток (рис. 2A).
Результаты окрашивания TUNEL показали, что по сравнению с контрольной и фиктивной группами, в модельной группе наблюдалось значительное увеличение количества красных флуоресцентных меченых апоптотических клеток в тканях миокарда крыс (рис. 2B). Частота апоптоза была заметно повышена (рис. 2C, p < 0,01) в модельной группе, при этом статистически значимых различий между контрольной и фиктивной группами не наблюдалось.
Экспрессия F-актина и GLUT1 в миокардиальной ткани MIRI крыс
По сравнению с контрольной и фиктивной группами, в модельной группе наблюдалось значительное увеличение экспрессии GLUT1 (рис. 3A, B, p < 0,01) и значительное снижение экспрессии F-актина (рис. 3C, D, p < 0,01). Существенных различий между контрольной и фиктивной группами по экспрессии белков GLUT1 и F-актина не наблюдалось.
Экспрессия Myh9, SLC7A11 и SLC3A2 в миокардиальной ткани крысы MIRI
Иммуногистохимический анализ был впервые использован для оценки уровней экспрессии DRG в модели MIRI крыс. Результаты показали, что по сравнению с контрольной и фиктивной группами, в модельной группе значительно повысились уровни экспрессии Myh9 (рис. 4A, B, p < 0,01) и SLC3A2 (рис. 4E, F, p < 0,01). Напротив, экспрессия SLC7A11 была значительно снижена (рис. 4C, D, стр. < 0,01). Соответственно, результаты вестерн-блоттинга показали, что по сравнению с контрольной и фиктивной группами, в модельной группе значительно повысились уровни экспрессии Myh9 (рис. 5A, B, p < 0,01) и SLC3A2 (рис. 5A, D, p < 0,01), в то время как экспрессия SLC7A11 (рис. 5A, C, p < 0,01) была значительно снижена.

Рисунок 1: Скрининг генов, связанных с дисульфидептозом, в MIRI. (A) Тепловая карта 1233 генов для анализа дифференциальной экспрессии на MIRI и фиктивных образцах. (Б) Диаграмма Венна ДЭГ и ДРГ. Среди 1233 DEG и 99 DRG было 15 общих генов, как показано на коробке. (C) Вулканические графики ДЭГ в наборе данных GSE214122. Красные и зеленые точки на графике, соответственно, указывают на повышенную и пониженную регуляцию генов. (D) Сеть PPI 12 узловых DRG была построена с использованием базы данных STRING. ДЭГ, дифференциально экспрессируемые гены; DRG, гены, связанные с дисульфидептозом. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 2: MIRI способствует повреждению клеток миокарда. (A) Репрезентативные изображения повреждений миокарда, оцененные с помощью окрашивания H&E (масштабная линейка = 50 мкм). (B) Апоптоз кардиомиоцитов, обнаруженный с помощью анализа TUNEL. В модельной группе наблюдалось значительное увеличение количества меченных красными флуоресцентными флуоресцентными метками апоптотических клеток в тканях миокарда крыс (масштабная линейка = 50 мкм). (C) Статистические результаты оценки скорости апоптоза путем анализа интенсивности сигнала красной флуоресценции с помощью программного обеспечения Image J. **p < 0,01, модельная группа против фиктивной группы, n=3. Данные выражаются в виде среднего значения ± стандартного отклонения. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
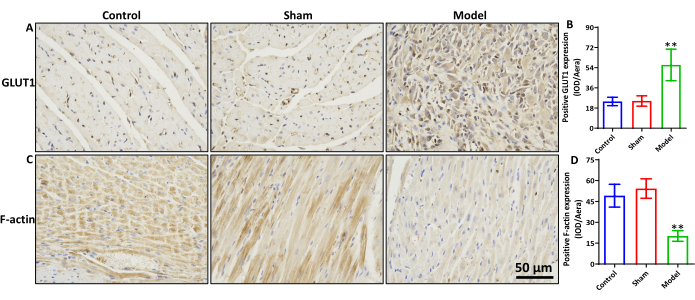
Рисунок 3: Экспрессия F-актина и GLUT1 в ткани миокарда крысы MIRI. (А) окрашивание ИГХ GLUT1 и (В) статистические результаты экспрессии его белка. (C) окрашивание F-актина ИГХ и (D) статистические результаты экспрессии его белка. масштабная линейка = 50 мкм. **p < 0,01, модельная группа против фиктивной группы, n=6. Данные выражаются в виде среднего значения ± стандартного отклонения. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 4: Анализ окрашивания ИГХ экспрессии связанных с дисульфидептозом белков Myh9, SLC7A11 и SLC3A2 в ткани миокарда крысы MIRI. (А) окрашивание ИГХ Myh9 и (В) статистические результаты экспрессии его белка. (C) окрашивание SLC7A11 ИГХ и (D) статистические результаты экспрессии его белка. (E) окрашивание SLC3A2 ИГХ и (F) статистические результаты экспрессии его белка. масштабная линейка = 50 мкм. **p < 0,01, модельная группа против фиктивной группы, n=3. Данные выражаются в виде среднего значения ± стандартного отклонения. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 5: Вестерн-блоттинг экспрессии связанных с дисульфидептозом белков Myh9, SLC7A11 и SLC3A2 в ткани миокарда MIRI крыс . (A) Репрезентативные белковые полосы. Статистические результаты экспрессии белка (B) Myh9, (C) SLC7A11 и (D) SLC3A2. **p < 0,01, модельная группа против фиктивной группы, n=3. Значения оттенков серого белков были проанализированы с помощью программного обеспечения Image J. Данные выражаются в виде среднего значения ± стандартного отклонения. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Обсуждение
Дисульфидептоз тесно связан с актиновым цитоскелетом, важнейшей клеточной структурой, необходимой для поддержания формы и жизнеспособности клеток. Актиновый цитоскелет, состоящий из актиновых филаментов, придает общую клеточную форму и структуру. F-актин служит маркером для клеточного цитоскелета, а в условиях глюкозного голодания дисульфидные связи значительно увеличиваются, что приводит к подавлению F-актина. Это явление в первую очередь влияет на процессы и пути, связанные с актином, цитоскелетом и клеточной адгезией10,11.
В контексте метаболизма глюкозы переносчики глюкозы (GLUTs) играют жизненно важную роль в поддержании динамического баланса глюкозы. GLUT1, один из первых обнаруженных членов семейства GLUT, представляет собой белок, связанный с поглощением глюкозы, с широким распространением в тканях. Он в первую очередь экспрессируется в эритроцитах12 и эндотелиальных клетках гематоэнцефалического барьера13, где он участвует в трансмембранном транспорте глюкозы. GLUT1 может быть тесно связан с развитием заболеваний, связанных с аномальным метаболизмом глюкозы. В моделях глюкозного голодания экспрессия GLUT1 повышается, способствуя гибели опухолевых клеток. В модели MIRI повышение экспрессии GLUT1 ухудшает MIRI, но улучшения наблюдаются при подавлении GLUT1, что делает его ключевой мишенью приглюкозном голодании. Иммуногистохимия выявила достоверное внутриклеточное увеличение белка-транспортера глюкозы GLUT1 в модели MIRI по сравнению с контрольной и фиктивной группами. В то же время F-актин был значительно снижен внутриклеточно по сравнению с контрольной и фиктивной группами. Это говорит о том, что коллапс цитоскелета актина в условиях глюкозного голодания может способствовать ухудшению MIRI, что делает коллапс цитоскелета актина основным механизмом дисульфидептоза. Таким образом, мы предполагаем, что повышение регуляции GLUT1 в модели MIRI индуцирует дисульфидептоз, что приводит к усугублению ишемии-реперфузионного повреждения.
Ген Myh9 кодирует тяжелую цепь немышечного миозина IIA, широко экспрессируемого цитоплазматического миозина, участвующего в различных процессах, требующих генерации внутриклеточных механических сил и актинового цитоскелетного репозиционирования15. Пациенты с врожденной тромбоцитопенией, обусловленной мутациями гена Myh9, склонны к тромбообразованию и острому инфаркту миокарда16. Таким образом, Myh9 может быть прогностическим фактором для AMI или MIRI. SLC7A11 и SLC3A2 — это белки, которые помогают клеткам получать цистеин и глутатион, необходимые для поддержания здоровья и баланса клеток. SLC7A11 может смягчать перекисное окисление липидов и окислительный стресс, играя защитную роль в MIRI17. В нашем исследовании изучались потенциальные биологические функции и терапевтическое значение генов, связанных с дисульфидептозом, с помощью базы данных GEO. Мы обнаружили ограниченное перекрытие между генами, связанными с MIRI и дисульфидептозом, в общей сложности 12 перекрывающихся генов. С помощью анализа P-значения и Log2Fold Change мы определили четыре гена, которые были наиболее тесно связаны в модели MIRI. Результаты показали значительное повышение экспрессии Myh9 и значительное подавление экспрессии SLC7A11 в группе MIRI. Тем не менее, статистически значимой разницы в экспрессии ACTB не наблюдалось. Результаты эксперимента подтвердили, что Myh9 и SLC7A11 участвуют в MIRI, и их механизмы могут быть тесно связаны с дисульфидептозом, опосредованным истощением NADPH. Эти результаты дают важные подсказки для выявления новых прогностических факторов и персонализированных стратегий лечения MIRI (Рисунок 5).
Таким образом, идентификация и характеристика механизмов клеточной смерти не только способствуют нашему фундаментальному пониманию клеточного гомеостаза, но и подчеркивают значительную роль, которую играет дисульфидептоз в MIRI. Недостатком этого метода является отсутствие критических экспериментов по валидации дисульфидептоза. В настоящее время можно обнаружить и идентифицировать дисульфидептоз с помощью флуоресцентного зонда DCP-Bio1, который связывается с дисульфидными связями, мечая внутриклеточные и внеклеточные дисульфиды и облегчая наблюдение за дисульфидами в клетках или тканях18. Такие новые зонды могут быть использованы для изучения пространственно-временной динамики между дисульфидептозом и MIRI.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Это исследование было поддержано Бюро науки и технологий провинции Гуйчжоу (Qiankehe [2022]-583) и Управлением традиционной китайской медицины провинции Гуйчжоу (QZYY-2016-019).
Материалы
| Name | Company | Catalog Number | Comments |
| 75% alcohol | Hunan Tongruijian Pharmaceutical Co. Ltd., Hunan, China | 85026 | |
| 6-0 nylon suture | Shanghai Pudong Jinhuan Medical Supplies Co. Ltd., Shanghai, China | CS002 | |
| BCA protein quantification kit | Beyotime Biotechnology, Shanghai, China | P0011 | |
| Bull serum albumin | Beyotime Biotechnology, Shanghai, China | ST2254 | |
| Centrifuge | Hunan Kaida Scientific Instrument Co. Ltd., Hunan, China | KH19A | |
| DAB horseradish peroxidase color development kit | Beyotime Biotechnology, Shanghai, China | P0203 | |
| DAPI staining solution | Beyotime Biotechnology, Shanghai, China | C1006 | |
| DESeq2 package | Version 4.1 | ||
| Electric razor | Kelmerpp | 235376 | |
| Enhanced endogenous peroxidase blocking buffer | Beyotime Biotechnology, Shanghai, China | P0100B | |
| Filter paper | Nanjing Keruicai Equipment Co., Ltd., Nanjing, China | 1.00049E+11 | |
| Fluorescence microscope | Nikon | ECLIPSE Ci | |
| GEO database | https://www.ncbi.nlm.nih.gov/geo/ | ||
| Glass grinder | Shanghai Leigu Instrument Co. Ltd., Shanghai, China | B-013002 | |
| GraphPad Prism | GraphPad Software | V8.0 | |
| Hematoxylin and eosin staining kit | Beyotime Biotechnology, Shanghai, China | C0105M | |
| Image J software | National Institutes of Health, Bethesda, USA | v1.8.0 | |
| Improved citrate antigen retrieval solution (50X) | Beyotime Biotechnology, Shanghai, China | P0083 | |
| Iodophor | Folca, Shenzhen, China | 1.00077E+11 | |
| Optical microscope | Nikon | ECLIPSE Ci | |
| Phosphate buffer solution | Beyotime Biotechnology, Shanghai, China | C0221A | |
| Primary antibodies against GLUT1 | Proteintech Group, Inc, Wuhan, China | 21829-1-AP | |
| Primary antibodies against MYH9 | Proteintech Group, Inc, Wuhan, China | 11128-1-AP | |
| Primary antibodies against SLC3A2 | Wuhan Lingsi Biotechnology Co., Ltd., Wuhan, China | LJS-D-7468 | |
| Primary antibodies against SLC7A11 | Proteintech Group, Inc, Wuhan, China | 26864-1-AP | |
| Protein visualization instrument | Thermo Fisher Scientific Inc. | iBright CL750 | |
| Rat board | Zhengzhou Haopai Biotechnology Co. Ltd., Zhengzhou, China | JPB-E | |
| Scalpel | Shanghai Lianhui Medical Supplies Co., Ltd., Shanghai, China | 1.00471E+13 | |
| Secondary antibody | Wuhan Boster Biological Technology, Ltd., Wuhan, China | BA1054 | |
| STRING database | https://cn.string-db.org/ | Version 12.0 | |
| Triton X-100 | Beyotime Biotechnology, Shanghai, China | ST1722 | |
| TUNEL apoptosis detection kit | Proteintech Group, Inc., Wuhan, China | PF00009 |
Ссылки
- Lu, Z., et al. Tripartite motif 38 attenuates cardiac fibrosis after myocardial infarction by suppressing TAK1 activation via TAB2/3 degradation. iScience. 25 (8), 104780(2022).
- Tu, Q., et al. EGCG decreases myocardial infarction in both I/R and MIRI rats through reducing intracellular Ca2+ and increasing TnT levels in cardiomyocytes. Adv Clin Exp Med. 30 (6), 607-616 (2021).
- Li, Q., et al. Histone deacetylase HDAC4 participates in the pathological process of myocardial ischemia-reperfusion injury via MEKK1/JNK pathway by binding to miR-206. Cell Death Dis. 7 (1), 240(2021).
- Liu, X., et al. Actin cytoskeleton vulnerability to disulfide stress mediates disulfidptosis. Nat Cell Biol. 25 (3), 404-414 (2023).
- Yang, L., et al. Analysis of risk genes associated with disulfidptosis-related myocardial ischemia-reperfusion injury. J Chongqing Med Univ. 49 (4), 401-408 (2024).
- Xiao, G., et al. CXCR1 and its downstream NF-κB inflammation signaling pathway as a key target of Guanxinning injection for myocardial ischemia/reperfusion injury. Front Immunol. 13, 1007341(2022).
- Zhu, E. Y., et al. Screening of immune-related secretory proteins linking chronic kidney disease with calcific aortic valve disease based on comprehensive bioinformatics analysis and machine learning. J Transl Med. 21, 359(2023).
- Shi, D. C., et al. Potential of Dendrobium officinale oligosaccharides to alleviate chronic colitis by modulating inflammation and gut microbiota. FoodMedHomo. 2, 9420077(2025).
- Ning, E. J., et al. Artemisia argyi polysaccharide alleviates intestinal inflammation and intestinal flora dysbiosis in lipopolysaccharide-treated mice. FoodMedHomo. 1 (1), 9420008(2024).
- Zhou, H., Wang, J., Zhu, P., Hu, S., Ren, J. Ripk3 regulates cardiac microvascular reperfusion injury: The role of IP3R-dependent calcium overload, XO-mediated oxidative stress and F-action/filopodia based cellular migration. Cell Signal. 45, 12-22 (2018).
- Antonipillai, J., Rigby, S., Bassler, N., Peter, K., Bernard, O. Pharmacological inhibition of LIM kinase pathway impairs platelets functionality and facilitates thrombolysis. Exp Cell Res. 382 (2), 111458(2019).
- Kaumeyer, B. A., et al. GLUT1 immunohistochemistry is a highly sensitive and relatively specific marker for erythroid lineage in benign and malignant hematopoietic tissues. Am J Clin Pathol. 158 (2), 228-234 (2022).
- Patching, S. G. Glucose transporters at the blood-brain barrier: Function, regulation and gateways for drug delivery. Mol Neurobiol. 54 (2), 1046-1077 (2017).
- Zhou, H., et al. 3-iodothyronamine inhibits apoptosis induced by myocardial ischemia reperfusion via the Akt/FoxO1 signaling pathway. Ann Trans Med. 10 (4), 168(2022).
- Pecci, A., et al. MYH9: Structure, functions and role of non-muscle myosin IIA in human disease. Gene. 664, 152-167 (2018).
- Girolami, A., et al. Occurrence of thrombosis in congenital thrombocytopenic disorders: A critical annotation of the literature. Blood Coagulat Fibrino. 24 (1), 18-22 (2013).
- Li, P., et al. SLC7A11-associated ferroptosis in acute injury diseases: Mechanisms and strategies. Eur Rev Med Pharmaco Sci. 27 (10), 4386-4398 (2023).
- Wu, X., et al. Dihydrotanshinone I preconditions myocardium against ischemic injury via PKM2 glutathionylation sensitive to ROS. Acta Pharma Sinica B. 13 (1), 113-127 (2023).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены