Method Article
Genetik Olmayan Optik Stimülasyon Yoluyla Ca2+ Yayılımını İncelemek için Kardiyak Mikrofizyolojik Bir Sistem
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Kardiyak hücreleri ve dokuyu kontrol etmek için ışığın kullanılması, temassız stimülasyonu mümkün kılar, böylece hücrelerin doğal durumunu ve işlevini korur, bu da onu hem temel araştırma hem de terapötik uygulamalar için değerli bir yaklaşım haline getirir.
Özet
İn vitro kardiyak mikrofizyolojik modeller, bilimsel araştırma, ilaç geliştirme ve tıbbi uygulamalar için oldukça güvenilirdir. Bilimsel topluluk tarafından yaygın olarak kabul edilmesine rağmen, bu sistemler non-invaziv stimülasyon tekniklerinin olmaması nedeniyle uzun ömürlülük açısından hala sınırlıdır. Fototransdüserler, stimülasyon süreçlerinde invazivliği en aza indirirken yüksek zamansal ve uzamsal çözünürlüğe sahip kablosuz bir yaklaşım sunarak verimli bir stimülasyon yöntemi sağlar. Bu yazıda, in vitro kardiyak mikrofizyolojik bir modelin aktivitesini uyarmak ve tespit etmek için tamamen optik bir yöntem sunuyoruz. Spesifik olarak, bir 3D biyoreaktör süspansiyon kültüründe üretilen insan kaynaklı pluripotent kök hücre türevli kardiyomiyositleri (hiPSC-CM'ler) tohumlayarak mühendislik ürünü laminer anizotropik dokular ürettik. Stimülasyon için Ziapin2 adlı bir amfifilik azobenzen türevi olan bir fototransdüser ve sistemin tepkisini izlemek için bir Ca2 + boyası (X-Rhod 1) kullandık. Sonuçlar, Ziapin2'nin doku bütünlüğünden, canlılığından veya davranışından ödün vermeden kullanılan sistemdeki Ca2 + yanıtlarını fotomodüle edebildiğini göstermektedir. Ayrıca, ışığa dayalı stimülasyon yaklaşımının, mevcut altın standart olan elektriksel stimülasyona kıyasla benzer bir çözünürlük sunduğunu gösterdik. Genel olarak, bu protokol kardiyak araştırmalarda Ziapin2 ve materyal bazlı fotostimülasyonun uygulanması için umut verici perspektifler açmaktadır.
Giriş
Canlı hücreleri ve dokuları uyarmak için ışığın kullanımı, biyomedikal araştırmalarda önemli bir oyun değiştirici olarak ortaya çıkıyor ve hassas zamansal ve uzamsal çözünürlük 1,2,3,4,5,6 ile dokunmadan stimülasyon yetenekleri sunuyor. Hücreleri ışığa duyarlı hale getirmek için kullanılan önde gelen tekniklerden biri, ışığa duyarlı iyon kanallarını veya pompalarıifade etmek için hücrelerin genetik olarak değiştirilmesini içeren optogenetiktir 7,8. Bu yaklaşım, canlı doku içindeki hücrelerin düzenlenmesinde etkileyici bir etkinlik göstermiştir; Bununla birlikte, viral gen transferine olan bağımlılığı, araştırma ve klinik uygulamalarda yaygın olarak benimsenmesini engellemiştir.
Bu sınırlamanın üstesinden gelmek için, organik ve inorganik malzemeler, genetik olmayan, malzeme bazlı ışık aracılı stimülasyon teknikleri geliştirmek için ışığa duyarlı dönüştürücüler olarak kullanılmıştır 9,10. Organik nanoyapılı fototransdüserler 11,12,13,14,15 son zamanlarda nöronlar, kardiyomiyositler ve iskelet kası hücreleri dahil olmak üzere çeşitli uygulamalarda hücresel yanıtları tetiklemede dikkate değer bir başarı göstermiştir.
Burada, tasarlanmış laminer kardiyak dokularda Ca 2+ yayılımını araştırmak için bir azobenzen türevi olanZiapin2 16,17,18'i öneriyoruz. Molekülün amfifilik yapısı, hücre plazma zarının hassas bir şekilde hedeflenmesine izin verirken, azobenzen çekirdeği, ışık kaynaklı izomerizasyonu mümkün kılarak konformasyonel değişimine yol açar 16,17,18. Kardiyak hücrelerde, bu trans-cis izomerizasyonu, plazma zarı kalınlığını değiştirerek, bir aksiyon potansiyeli oluşturan bir dizi etkiye neden olur ve bu da uyarma-kasılma sürecinitetikler 19,20,21.
Ek olarak, kardiyak dokunun22 anizotropik büyümesi için tasarlanmış bir platformun üretim sürecini açıklıyoruz ve özellikle doku23,24 içinde Ca2+ dinamiklerini elde etmeye odaklanarak, aktivitesini optik olarak tetiklemek ve izlemek için kullanılan deney düzeneğini detaylandırıyoruz. Son olarak, elde edilen sinyalleri, referans standart olarak kabul edilen elektriksel stimülasyon yoluyla elde edilen sinyallerle karşılaştırırız. Genel olarak, bu protokol, özellikle mühendislik dokuları bağlamında, kardiyak hücresel davranış anlayışımızı ilerletmede yeni bir ışığa duyarlı dönüştürücünün uygulanmasını vurgulamaktadır.
Protokol
Kullanılan insan pluripotent kök hücre (hiPSC) kültürü, CAGrtTA::TetO-Cas9'un AAVS1 lokusuna sokulmasıyla oluşturulan, doksisiklin (Dox) ile indüklenebilir bir CRISPR/Cas9 sistemini barındıran vahşi tip bir insan erkek iPSC hattıdır (Addgene: #73500). Çalışma, Boston Çocuk Hastanesi Kurumsal İnceleme Kurulu tarafından onaylanan protokollere uygun olarak yürütülmüştür. Çalışmaya katılmadan önce hastalardan bilgilendirilmiş onam alındı. HiPSC'den türetilmiş kardiyomiyositlerin (hiPSC-CM'ler) oluşumu daha önce tarif edildiği gibi indüklenmiştir25,26. Protokol aşağıdaki bölümde kısaca özetlenecektir:
1. İnsan kaynaklı pluripotent kök hücre türevi kardiyomiyositlerin üretilmesi ve hazırlanması
- T75 şişelerinde kültürlenen hiPSC'leri PBS ile bir kez yıkayın. Şelatlama maddesi Versene ile 10-15 dakika inkübe ederek hücreleri ayırın ve 10 μM ROCK inhibitörü Y-27632 ile desteklenmiş 100 mL E8 ortamında 50 milyon IPSC / kap yoğunluğunda% 1 iyonik olmayan yüzey aktif madde çözeltisi ile ön işleme tabi tutulmuş biyoreaktör kaplarına tohumlayın.
- Aşağıdaki biyoreaktör parametrelerini ayarlayın: çalkalama 60 rpm, sıcaklık 37 °C, pH 7 ve 3 standart L/s'de kaplama gazlama (O2 ve CO2).
- Kültürde 1 gün sonra, embriyoid cisim (EB) çapının 100-300 μm'ye ulaştığını onaylayın ve hücreleri 24 saat boyunca 7 μM CHIR99021 içeren bazik RPMI ortamı (B27 eksi İnsülin ile desteklenmiş RPMI 1640 ortamı) ile tedavi edin, ardından 24 saat daha RPMI'ye medya değişikliği yapın. Kardiyak soy çizgisine doğru farklılaşma sürecini başlatmak için 5 μM IWR-1-endo içeren temel RPMI ortamını 48 saat daha ekleyin. 48 saat sonra, ortamı tekrar temel RPMI'ye değiştirin.
- Farklılaşmanın 7. gününde, 1: 1.000 (h / h) insan insülini ile desteklenmiş temel bir RPMI ortamındaki kültür hücreleri. Oksijen tüketimi %30'un üzerine çıkarsa, medyayı her 2 günde bir veya %50 orta değişiklikle her gün yenileyin.
- 15. günde, HBSS, Kollajenaz II (200 birim / mL), HEPES (10 mM), ROCK inhibitörü Y-27632 (10 μM) ve N-benzil-p-toluensülfonamid (BTS, 30 μM) içeren bir Kollajenaz II çözeltisi kullanarak biyoreaktör hücrelerini 3 saat boyunca enzimatik olarak ayırın. Bunu yapmak için, önce farklılaşmış hiPSC-CM EB'leri 2x'i önceden ısıtılmış HBSS ile yıkayın ve bunları Kollajenaz II çözeltisinde (200 μl hacim EB / 12 ml Kollajenaz II çözeltisi) 37 °C'de% 5 CO2'de tek hücreler tam EB ayrışmasından görünene kadar inkübe edin.
- Tek hücreli süspansiyona eşit hacimde bir bloke edici tampon (B27 ve DNaz II içermeyen RPMI-1640, RPMI-1640 mL başına 6 μL DNaz II ile) ekleyerek ayrışma reaksiyonunu durdurun. Farklılaşmış hiPSC-CM'leri sayın, santrifüjleyin (200 × g, 5 dakika) ve hücreleri -80 °C'de izopropanol içinde 24 saat dondurarak ve tohumlama yapılana kadar sıvı nitrojen tanklarına taşıyarak sonraki uygulamalara hazırlanın.
2. Tasarlanmış laminer doku imalatı
- Biri beyaz diğeri mavi olmak üzere iki kat laboratuvar bandını 1 mm kalınlığında şeffaf, çizilmeye ve UV ışınlarına dayanıklı akrilik bir levhaya yapıştırın. Bir CO2 lazer kazıma makinesi kullanarak, akrilik levhayı vektör grafik yazılımında (örneğin, CorelDraw) tasarlandığı gibi bant üzerinde daireler halinde (12 MW'a uyacak şekilde 20 mm çapta) ve çip desenini (3 x 7,5 mm kare, çip başına üç) kesin; akrilik kesme parametreleri: 100 güç, 20 hız ve 1.000 PPI; bant kesme parametreleri: 8 güç, 6 hız ve 1.000 PPI. Cımbız kullanarak en içteki çizginin içindeki iki bant katmanını çıkarın, kalın çizgileri ve koyu lekeleri kesmek için cipsleri 30 dakika ila 1 saat saf ağartıcıda bekletin, keskin bir çizgi bırakın ve cipsleri gece boyunca veya en az 3 saat boyunca akan deiyonize (DI) su ile bir beherde durulayın.
NOT: 2 saatten daha uzun süre ağartmayın, çünkü bu, yan duvarlardaki yapıştırıcıları aşındırarak jelatinin düzgün yapışmasını engeller. - Cipsleri 10 dakika boyunca sonikasyon yapın ve polidimetilsiloksan (PDMS, Sylgard 184) damgalarını hat oluğu özelliklerine (25 μm sırt genişliği, 4 μm oluk genişliği ve 5 μm oluk derinliği) 30 dakika boyunca temiz% 70 etanolde sonikleştirin. Talaşları ve pulları bir kaputun altındaki temiz bir alana aktarın ve ~1-2 saat hava akımı altında kurumaya bırakın.
- Domuz derisinden 1 g jelatini (jel mukavemeti ~ 175 g Bloom, Tip A) 50 mL'lik bir tüpe tartın. 5 mL fosfat tamponlu salin (PBS) ekleyin ve jelatinin hemen çözünmesini sağlamak için iyice karıştırın. Çözünme işlemini tamamlamak için tüpü 30 dakika boyunca 65 ° C'lik bir su banyosuna yerleştirin. Benzer şekilde, 1 g mikrobiyal transglutaminaz (MTG) 50 mL'lik ayrı bir tüpe tartın. 12.5 mL PBS ekleyin, iyice karıştırın ve MTG'nin tamamen çözünmesini sağlamak için tüpü 37 ° C'lik bir su banyosuna 30 dakika boyunca yerleştirin.
- Jelatin tüpünü 15 dakika boyunca sonikleştirin, ardından kullanmadan önce 65 °C su banyosuna geri koyun. MTG tüpünü, kapağı hafifçe gevşetilmiş olarak bir kurutucuya yerleştirin ve vakumu yavaşça açın. Vakum altında MTG çözeltisinden kabarcıkların çıkarıldığını gözlemleyin. Gazdan arındırma işleminden sonra MTG tüpünü 37 °C su banyosuna geri koyun.
NOT: İşlemi izleyin ve kuvvetli kaynamayı önlemek için vakumu ayarlayın. - Bir ızgara sayfasını temiz parafilm ile kaplayın, çipleri ızgaraya yerleştirin ve damgayı yakın, kullanıma hazır tutun. 5 mL jelatin çözeltisine 5 mL MTG ekleyin, kabarcıkları önlemek için dikkatlice pipetleyin; daha sonra, talaş alanını kaplayacak kadar (her biri yaklaşık 0,5 mL) kullanarak jelatini hızlı bir şekilde çipin üzerine pipetleyin. Ardından, çizgi desenli PDMS22 (çizgi genişliği 25 μm, yükseklik 5 μm, aralık 4 μm) damgasını üstüne yerleştirin ve jelatinin dokunun uzunlamasına eksenine paralel desenli olduğundan emin olmak için 200 g ağırlık uygulayın. Tüm talaşlar kalıplandıktan sonra, çevresel rahatsızlığı önlemek için üzerlerini bir cam kavanozla örtün ve gece boyunca çapraz bağlanmalarına izin verin.
NOT: Karışık çözelti jelatin-MTG'yi 5 dakika içinde kullanın; aksi takdirde, jelatinin daha yüksek bir çapraz bağlı durumu nedeniyle hedef model değişecektir. - Çipi ve PDMS damga sandviçini PBS ile doldurulmuş yeni bir P150 kabına aktarın ve PDMS damgasının çipten ayrılmasını kolaylaştırmak için jelatini 30 dakika ila 1 saat boyunca nemlendirin. Çipin etrafındaki fazla kalıplanmamış jelatini çıkarın ve temiz çipi PBS ile doldurulmuş yeni bir P150 kabına aktarın. PDMS damgalarını %70 etanolde saklayın.
- Cipsleri kaputun altında 10 dakika etanolde bekleterek sterilize edin.
NOT: Etanolde 10 dakikayı aşmayın, çünkü daha uzun süre maruz kalma jelatini deforme edebilir. - Cipsleri PBS'ye aktarın, 10 dakika bekletin ve 3 kez durulayın. 20 μg / mL fibronektini 1:100 seyreltilmiş bazal membran matrisi ile kültür ortamında (kuyu başına yaklaşık 0.5 mL) karıştırarak kaplama çözeltileri hazırlayın. Cipsleri inkübatörde 2 saat boyunca 37 °C ve %5 CO2'de veya gece boyunca 4 °C'de kaplayın.
- Hücreleri (cm2 başına 8 × 105 hiPSC-CM) Y-27632 (10 μM) ile RPMI ortamında çözün ve tohumlayın, ardından 24 saat sonra Y-27632 olmadan RPMI ile değiştirin.
- Hücre tohumlamasından üç gün sonra, cımbız kullanarak beyaz bandı çıkarın.
3. Fototransdüserin sentezi ve uygulaması
NOT: Ziapin2, daha önce yayınlanmış bir prosedüre16,18 göre sentezlendi ve doğrudan kültür ortamında hiPSC-CM'lere uygulandı.
- Hücre kültürüne 25 μM Ziapin2 ekleyin ve 37 ° C ve% 5 CO2'de 7 dakika inkübe edin.
- Fazla molekülleri nazikçe yıkayın ve taze kültür ortamı ile durulayın.
4. Canlılık testi
NOT: Alamar Blue, hücrelere nüfuz edebilen ve hücre canlılığını izlemek için bir redoks göstergesi görevi görebilen resazurin bazlı bir testtir. Resazurin, fizyolojik tamponlarda çözünür ve doğrudan kültürdeki hücrelere eklenen koyu mavi bir çözelti ile sonuçlanır. Aktif metabolizmaya sahip canlı hücreler, resazurini pembe ve floresan olan resofurine indirger.
- Daha önce kültür ortamında 20 μg/mL fibronektin ve 1:100 seyreltilmiş bazal membran matrisi ile kaplanmış 96 oyuklu bir plakadaki plaka hücreleri. Çalkalayarak karıştırın ve ardından aseptik olarak her bir kuyucuğa kuyu hacminin %10'una eşit miktarda Alamar Mavisi ekleyin.
- Kültürleri Alamar Blue ile 4 saat inkübe edin.
- Hücreleri daha önce açıklandığı gibi fototransdüser ve araç (DMSO) ile tedavi edin. Ziapin2 içselleştirmesinin ve ışığa maruz kalmanın hiPSC-CM canlılığı üzerindeki etkisini değerlendirmek için bir optik fiber (camgöbeği, 470 nm) aracılığıyla ışık stimülasyonu (1 dakika boyunca 1 Hz darbeli ışık) uygulayın.
- 560 nm uyarma ve 590 nm emisyonda bir plaka okuyucu ile floresan okuyun.
5. Tasarlanmış laminer kardiyak doku anizotropisinin değerlendirilmesi
NOT: Bu protokol, immün boyama, konfokal mikroskopi ve çekirdek analizi27 kullanılarak tasarlanmış laminer kardiyak dokunun anizotropisini değerlendirmek için sistematik bir yaklaşımı özetlemektedir.
- PBS'de %0.05 (h/h) Triton X-100 içeren %4 (h/h) paraformaldehit ile sabitlemeden önce alt tabakayı 10 dakika boyunca PBS ile birkaç kez yıkayın.
- Numuneleri PBS'de% 5 (a / h) sığır serum albümini (BSA) ile 30 dakika inkübe ederek spesifik olmayan bağlanmayı bloke edin.
- Numuneleri Hoechst (1:500) ile oda sıcaklığında 1 saat inkübe edin.
- Solmayı önleyici bir madde ile mikroskop slaytlarına monte etmeden önce PBS ile yıkayın. Slaytların gece boyunca kurumasını bekleyin ve görüntü oluşana kadar 4 °C'de saklayın.
- 20x büyütmede dönen disk konfokal mikroskop kullanarak görüntü örnekleri. Bir FiJi eklentisi olan OrientationJ Measure28'i kullanarak hücrelerin yönünü belirleyin.
6. Optik haritalama kayıtları
NOT: Optik haritalama, jelatin kalıplı doku çipleri üzerine ekilen hiPSC-CM'ler üzerinde kültürde 5 gün sonra gerçekleştirildi.
- Bu protokolü takip etmek için, optik haritalama aparatının, yüksek hızlı bir kamera ve uyarma ışık kaynağı, 200 mW Cıva lambası ile donatılmış modifiye edilmiş bir tandem lens mikroskobundan oluştuğundan emin olun. Preparatın uyarma ışığına maruz kaldığından emin olmak ve numuneden gelen yayılan floresansı toplamak için belirtilen Ca2+ görüntüleme kamerasının önüne dikroik bir ayna yerleştirin.
- Numuneyi, kültür ortamına 37 ° C'de 30 dakika boyunca eklenen 2 μM X-Rhod 1 ile inkübe edin.
NOT: Boyanın foto-ağartılmasını önlemek için numuneyi yalnızca görüntü alımı sırasında ışığa maruz bırakın. - Fototörü daha önce bölüm 3'te açıklandığı gibi inkübe edin.
- Taze kültür ortamı ile yıkayın ve cipsleri B27 eksi İnsülin ile desteklenmiş fenol kırmızısı içermeyen RPMI 1640 ortamına aktarın.
- Doku çiplerini sıcaklık kontrollü bir kaba yerleştirin ve fizyolojik sıcaklıkta (37 °C) kayıtlara başlayın ve 2,5 kare/sn kare hızında görüntüler elde edin.
- Optik pacing için, Ziapin2 stimülasyonuna izin veren bir LED ışık kaynağı (465/25 nm) kullanarak dokunun bir ucuna optik nokta stimülasyonunu uygulayın. Dokudan 0.5 mm uzağa yerleştirilmiş geçici olarak düzenlenmiş bir optik fiber aracılığıyla dokuları 1 veya 1 Hz frekansında hızlandırın. Elektrik pacing için, dikdörtgen dokunun en distal ucunun merkezine yerleştirilmiş bir bipolar platin elektrot kullanarak bir nokta stimülasyonu uygulayın. Bu yerleşim, Ca2+ dalga yayılımının, dikdörtgenin daha kısa kenarına karşılık gelen doku genişliğinin orta noktasından kaynaklanmasını sağlar. Stimülasyon, 0.5 Hz frekansında, 10 V genlik ve 100 ms darbe süresi ile uygulanmalıdır.
- Kayıtlardan sonra, sinyal-gürültü oranını iyileştirmek için 3 x 3 piksel boyutunda bir uzamsal filtre uygulayın.
- Hem x hem de y yönleri boyunca değişim oranını hesaplayarak her darbe için her pikselde Ca2+ dalga iletim hızını belirleyin. Bunu yapmak için, bu yönlerdeki Ca2+ sinyal yoğunluğunun uzamsal gradyanını ölçün ve bunu sinyalin yayılmasının zaman gecikmesiyle ilişkilendirin. Bu yönlü değişim oranlarını birleştirerek, dalganın her iki boyutta da hücresel alan boyunca ne kadar hızlı hareket ettiğini ölçün.
7. Veri dışa aktarma ve işleme
- Referans verilen yazılımla verileri ayıklayın ve analiz edin.
- Sinyal-gürültü oranını iyileştirmek için 3 x 3 piksellik bir uzamsal filtre uygulayın.
- Ca2+ geçici olaylar (CaT) izlerini, manuel olarak seçilen belirli bir ilgi alanının (ROI) ortalaması olarak çıkarın.
- CaT parametrelerini 50 x 50 piksellik (≈ 25mm2) merkezi bir ilgi alanında (ROI) ölçün.
- Her CaT için, CaT genliğini, yükselme süresini (ttepe noktası), maksimum bozunma eğimi süresini (Maksimum Bozunma Eğimi) ve %90 geçici bozunmaya kadar geçen süreyi (Bozunma Süresi90) analiz edin.
8. İstatistiksel analiz
- Parametrik veya parametrik olmayan yöntemlerin uygulanması gerekip gerekmediğini belirlemek için normallik testi gibi uygun bir istatistiksel test kullanarak dağılımın normalliğini değerlendirin.
- Sürekli veya kategorik veriler için sırasıyla Öğrenci t-testi veya Mann-Whitney U-testini kullanarak iki koşul arasındaki istatistiksel anlamlılığı değerlendirin. İkiden fazla grubu karşılaştırırken, veri varsayımlarına bağlı olarak tek yönlü ANOVA veya Kruskal-Wallis testini kullanın, ardından önemli ikili farklılıkları belirlemek için uygun post-hoc testleri kullanın.
Sonuçlar
Lazer modelleme, jelatin kalıplama ve hücre tohumlama tekniklerinin bir kombinasyonu kullanılarak tasarlanmış laminer kalp dokusunun üretimi için çok aşamalı bir süreç geliştirildi ve uygulandı. Başlangıçta McCain ve ark.22 ve Lee ve ark.24 tarafından kurulan bu teknik, tasarlanmış laminer mikrodokuları oluşturmak için protokollerini takip ederek yeniden uygulandı. İşlem, yapısal rehberlik için hassas lazer tabanlı modellemeyi, iskele malzemesi olarak jelatini ve biyomimetik bir doku ortamı oluşturmak için kontrollü hücre tohumlamayı entegre eder. (Şekil 1).
Kağıt alt tabakaların biriktirilmesi, biri beyaz diğeri mavi olmak üzere iki kat laboratuvar etiketleme bandının 1 mm kalınlığında bir akrilik alt tabakaya yapıştırılmasını içeriyordu, bu da sonraki adımlar için sağlam bir temel sağlıyor ve imalat işlemi sırasında hassas görselleştirme ve manipülasyon sağlıyordu (Şekil 1A). Akrilik tabana zarar vermeden hassas ablasyon sağlayan optimize edilmiş parametrelerle, alt tabakalar üzerinde istenen talaş geometrisini elde etmek için lazer modelleme kullanıldı (Şekil 1B). Bant katmanlarının seçici olarak çıkarılması, daha sonraki işlemler için alt tabakanın belirli bölgelerini açığa çıkardı. Domuz derisinden hazırlanan ve mikrobiyal transglutaminaz ile çapraz bağlanmış bir jelatin çözeltisi, daha sonra hücre yapışması için uygun biyouyumlu bir tabaka oluşturmak için desenli akrilik yüzey üzerine bırakıldı (Şekil 1C). Bu jelatin tabakası, dokunun uzunlamasına ekseni ile hizalamayı sağlayan çizgi oluğu desenlerine sahip bir PDMS damgası kullanılarak kalıplandı ve kararlı, desenli bir substrat oluşturmak için gece boyunca çapraz bağlandı (Şekil 1D ve Ek Şekil S1).
İnsan kaynaklı pluripotent kök hücre türevli kardiyomiyositler (hiPSC-CM'ler), yaklaşık 8 × 105 hücre/cm2 yoğunlukta önceden kaplanmış substrat üzerine ekildi (Şekil 1E). Kültür koşulları, hücre büyümesini desteklemek için günlük medya tazelemesi ile optimize edildi. 3 gün sonra, desenli jelatin yüzeyini ortaya çıkarmak için beyaz bant tabakası çıkarıldı (Şekil 1F), hücrelerin belirli substrat bölgelerine hassas bir şekilde hapsedilmesini sağlayarak, istenen geometrik konfigürasyonlara sahip biyomühendislik laminer dokunun gelişimini kolaylaştırdı. Biyomühendislik dokusundaki hiPSC-CM'lerin canlılığı ve hizalanması daha sonra değerlendirildi.
Ziapin2 içselleştirmesinin ardından ışığa maruz kalmanın hücre canlılığı üzerindeki etkisi AlamarBlue Testi kullanılarak değerlendirildi. Şekil 2A'da bildirilen sonuçlar, Ziapin2'nin 25 μM konsantrasyonda içselleştirildiğinde ve ardından 470 nm ışık stimülasyonu ile takip edildiğinde, hücre canlılığını olumsuz etkilemediğini ve bu fototransdüser yaklaşımının canlı hücrelerle uyumluluğunu doğruladığını göstermiştir.
Biyomühendislik ürünü laminer doku içindeki anizotropi, mikro kalıplanmış jelatin substratın desenli olukları boyunca önemli hücresel hizalama gösteren floresan görüntüleme ile amaçlandığı gibi elde edildi (Şekil 2B). Floresan görüntülerinden açıkça görülen hücre oryantasyonu, FiJi eklentisi OrientationJ28 kullanılarak kantitatif olarak değerlendirildi. Oryantasyon, Hoechst floresan görüntüleri işlenerek değerlendirildi ve θortalama = 13.39 ± 2.67°'ye eşit bir ortalama açı elde edildi. Açı, dokuda yüksek derecede anizotropi gösteren, desen yönüne normalleştirilmiş oryantasyonu gösterir. Ölçülen açısal dağılım ve standart sapmanın düşük ölçülen değeri, doku yapısında güçlü bir yön tercihi olduğunu göstermektedir (Şekil 2C). Bu, koordineli kasılma ve elektrik iletimi gibi uygun fonksiyonel performans için gerekli olan doğal mimariyi taklit etmek için kritik olan anizotropik kalp dokusunun oluşumunu gösterdi.
Kültürde 5 gün kaldıktan sonra, jelatin kalıplı doku çipleri üzerine ekilen Ziapin2 yüklü hiPSC-CM'ler üzerinde optik haritalama yapıldı (Şekil 3). Optik haritalama, yüksek hızlı bir kamera ve hassas ışık stimülasyonu ile kolaylaştırılan, tasarlanmış kalp dokusu içindeki Ca2+ dinamiklerinin net ve ayrıntılı bir şekilde görüntülenmesini sağladı. Ziapin2 stimülasyonu, bir LED ışık kaynağı kullanılarak etkili bir şekilde sağlandı ve doku örnekleri, hem 0.5 Hz (Şekil 4A) hem de 1 Hz (Şekil 4B) frekanslarında pacing'e iyi yanıt verdi.
Bu frekanslarda fotostimülasyonla indüklenen Ca2+ dalgaları doku boyunca yayıldı ve uzunlamasına iletim hızları hesaplandı, her iki stimülasyon frekansında doku boyunca elektrik sinyallerinin düzgün yayılımını gösterdi ve sonuç 4.5 ± 0.5 cm/s'ye eşit oldu (Şekil 4A,B).
Son olarak, metodolojimizi elektrik stimülasyonunun altın standart referansı ile karşılaştırdık. Şekil 5'te gösterildiği gibi Ca2+ geçici akımlarının (CaT'ler) ayrıntılı bir analizi, CaT genliği (Şekil 5A), yükselme süresi (Şekil 5B), maksimum bozunma eğimi (Şekil 5C) ve bozunma süresi (Şekil 5D) dahil olmak üzere temel parametrelerin iki stimülasyon ipucu arasında benzer olduğunu ortaya koymuştur. Genel olarak, optik haritalama yaklaşımı, biyomühendislik ürünü laminer kalp dokusunun fizyolojik özellikleri hakkında yüksek çözünürlüklü veriler sağladı ve Ziapin2'nin ışık stimülasyonu yoluyla davranışını modüle etmedeki etkinliğini gösterdi.

Şekil 1: Laminer kardiyak doku hazırlığının çizimi. (A) Akrilik bir alt tabaka üzerinde iki kağıt bandın biriktirilmesi. (B) Her iki kağıt katmanının lazer ablasyon ile desenlenmesi. (C) Jelatinin desenli substrat üzerinde birikmesi. (D) Jelatin tabakasının çizgi desenli bir PDMS damgası ile kalıplanması ve sinterlenmesi. (E) Hazırlanan substrat üzerinde hücre tohumlaması. (F) Gerekli geometriyi elde eden ilk kağıt katmanının çıkarılması. Kısaltma: PDMS = polidimetilsiloksan. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 2: Biyomühendislik ürünü laminer kardiyak dokuda hücre canlılığı ve hizalaması. (A) Ziapin2 içselleştirmesinin ve ışığa maruz kalmanın Alamar Blue Testi ile ölçülen hiPSC-CM'lerin canlılığı üzerindeki etkisi. Ctrl'nin karanlıkta hücre canlılığı %100 olarak ayarlandı. Veriler, her koşul için ortalama (SEM) n = 16 olan ortalama ± standart hata olarak temsil edilir. (B) Mikro kalıplanmış jelatin üzerinde anizotropik biyomühendislik ürünü laminer doku. Anizotropik hiPSC dokusunun floresan görüntüleri; ölçek çubuğu = 100 μm. Hücreler Hoechst (mavi) ile boyanır. (C) Jelatin substratlar üzerine ekilen hücrelerin ortalama oryantasyonu (desen yönüne göre normalleştirilmiş) (4 farklı numuneden gelen N = 45 ROI, dağılımın ortalama açısı, θortalama = 13.39° ± 2.67°). Kısaltmalar: hiPSC-CM = insan kaynaklı pluripotent kök hücre türevli kardiyomiyosit; ROI = ilgi alanı. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
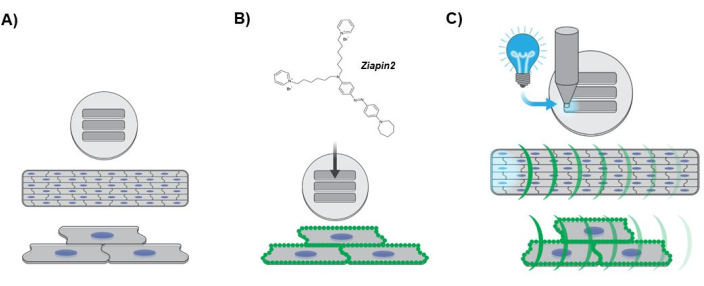
Şekil 3: Deney protokolünü gösteren diyagram. (A) Anizotropik kalp dokusu oluşumu. hiPSC-CM çekirdekleri mavi renkle gösterilmiştir. (B) Tasarlanmış laminer dokuya fototransdüser içselleştirmesi. Sarkolemma boyunca yeşil noktalar Ziapin2 membran bölünmesini gösterir. (C) Fotostimülasyon protokolü ve Ca2+ dinamik optik haritalama. Camgöbeği ışık, bir LED ışık kaynağı kullanılarak dokunun bir ucuna uygulanan optik nokta stimülasyonunu gösterir. Yeşil eğrilikler, tasarlanmış laminer doku boyunca Ca2+ dalgasının yayılmasını temsil eder. Kısaltmalar: hiPSC-CMs = insan kaynaklı pluripotent kök hücre kaynaklı kardiyomiyositler; LED = ışık yayan diyot. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
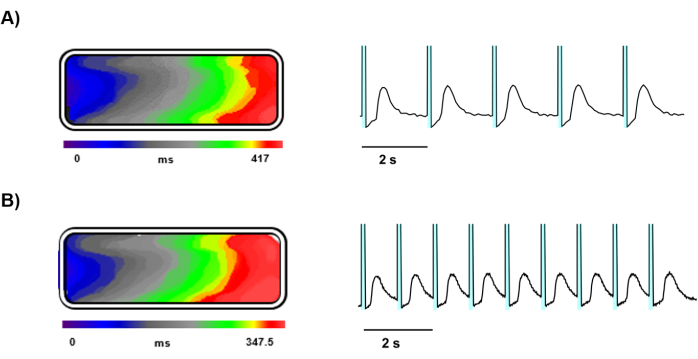
Şekil 4: Işıkla tetiklenen Ca2+ dalgalarının temsili kayıtları. (A) 0.5 Hz ve (B) 1 Hz'de ışıkla uyarılmış bir dokunun Ca2+ dalga cephesi yayılımını, izokron haritasını ve Ca2+ sinyal izlerini temsil eden zaman seyri. Temsili izlerde, her Ca'dan önceki camgöbeği gölgeli alan 2+ geçici foto-uyarımı temsil eder. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
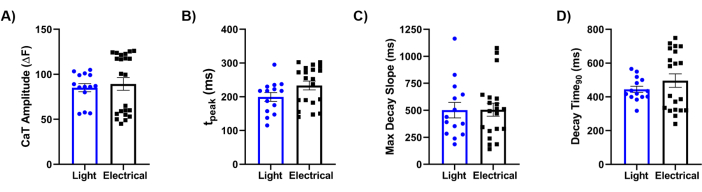
Şekil 5: Elektriksel ve optik stimülasyon arasındaki karşılaştırma. 0,5 Hz'de hiPSC-CM'lerle tohumlanmış çipler üzerine kaydedilen ışık kaynaklı ve elektriksel olarak uyarılmış Ca2+ geçici (CaT) parametrelerinin miktarının belirlenmesi. Analiz edilen CaT özellikleri şunlardı: (A) CaT genliği; (B) yükselme süresi (ttepe noktası); (C) maksimum bozunma eğimi süresi (Maksimum Bozunma Eğimi); ve (D) %90 geçici bozunmaya kadar geçen süre (Bozunma Süresi90). Her koşul için 37 ° C'de eşleştirilmiş ölçümler yapıldı. Işık stimülasyonu N = 5 çip, n = 14 doku; elektriksel stimülasyon N = 8 cips, n = 22 doku. Veriler, ortalamanın standart hatası ± ortalama olarak temsil edilir. Kısaltmalar: CaT = Ca2+ geçici; hiPSC-CM'ler = insan kaynaklı pluripotent kök hücre kaynaklı kardiyomiyositler. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Ek Şekil S1: PDMS ve jelatin substratlar üzerinde mikro modelleme değerlendirmesi. (A) Bir PDMS damgası üzerinde gerçekleştirilen bir desenin optik görüntüsü; ölçek çubuğu =100 μm. (B) Mikro kalıplanmış jelatin substratın optik görüntüsü; ölçek çubuğu =100 μm. (C) Bir PDMS damgasının (siyah çizgi) ve mikro kalıplanmış jelatin filmin (kırmızı çizgi) desen profili. Bu dosyayı indirmek için lütfen buraya tıklayın.
Tartışmalar
Bu yaklaşım, kardiyak araştırmaları ilerletmek için sağlam bir platform sağlar ve kardiyak dokunun karmaşık dinamikleri hakkında içgörüler sağlayarak, potansiyel olarak yeni terapötik stratejilere yol açabilecek uzun vadeli in vitro kardiyak mekanik çalışmalar için yeni olanaklar sunar. Bu metodolojinin başarısını sağlamak için, insan kalbinin in vivo koşullarını yakından taklit eden bir mikrofizyolojik ortamın yeniden üretilmesi çok önemlidir. Bu nedenle, uygun elektrik iletimi ve kasılma fonksiyonu için hayati önem taşıyan kardiyak mimarinin doğal anizotropisini çoğaltmak için dokunun tasarlanmasına ve hizalanmasına dikkat edilmelidir. Kritik faktörler arasında, çip deseninin hassas lazer kesimi, ağartma işleminin zamanlaması ve jelatin çözeltisi viskozitesinin kontrolü yer alır ve bunların tümü tek tip doku kalıpları oluşturmak için gereklidir. Ek olarak, çiplerin fibronektin ve GelTrex (azaltılmış büyüme faktörü bazal membran matrisi) ile doğru bir şekilde kaplanması, başarılı hücre bağlanması ve ardından doku oluşumu için gereklidir.
Ayrıca, fotoaktüatörün (yani Ziapin216,18) inkübasyon süresi ve konsantrasyonu, yeterli içselleştirmeyi sağlamak için dikkatli bir şekilde kontrol edilmelidir. Spesifik olmayan etkileri önlemek için fazla moleküllerin iyice yıkanması şarttır. Molekülün hücreler üzerinde herhangi bir zararlı etkisi olup olmadığını değerlendirmek için her zaman canlılık deneylerinin yapılması önerilir. Fotoaktüatörün içselleştirilmesi yetersizse, inkübasyon süresini uzatmayı veya daha yüksek bir konsantrasyon kullanmayı düşünün.
İşlevsel deneyler için, optik fiberin hassas konumlandırılması ve stimülasyon frekansının kalibrasyonu dahil olmak üzere optik haritalama aparatının uygun kurulumu, yüksek kaliteli verilerin yakalanması için çok önemlidir. Kayıtlar yüksek gürültü seviyeleri gösteriyorsa, uzamsal filtre boyutunu iyileştirin veya optik kurulumda herhangi bir yanlış hizalama olup olmadığını kontrol edin.
Yaklaşım metodolojisi birkaç önemli avantaj sunar; hizalanmış hiPSC-CM'lerin geliştirilmesi ve uygulanması, doğal kardiyak doku özelliklerinin kopyalanmasında kayda değer bir gelişmeyi temsil eder. Hücre hizalaması ile araştırmacılar, uygun elektriksel ve mekanik işlevi sürdürmek için gerekli olan doğal kalp dokusunun anizotropik yapısını yakından taklit edebilirler. Bu, kardiyomiyositlerin in vivo koşullara çok benzeyen bir şekilde etkileşime girmesini ve böylece doğal kalbi daha iyi temsil eden fizyolojik davranışlar sergilemesini sağlar.
Elektrolite kablolama ve elektrot bulunmasını gerektiren elektriksel stimülasyonun aksine, ışık bazlı modülasyon, belirli bölgelerin elektriksel özelliklerini kontrol etmek için invaziv olmayan ve hassas bir yöntem sunar. Işığı yoğunluk, dalga boyu ve zamanlama açısından ayarlama yeteneği, bitişik alanları bozmadan hedefli müdahaleleri kolaylaştırır. Ayrıca, ışığa duyarlı kanalları veya proteinleri eksprese etmek için hücrelerin genetik modifikasyonunu gerektiren optogenetiğin aksine, viral gen transferi gerektirmez. Bu hususlar, genetik modifikasyonun mümkün olmadığı veya istenmediği uygulamalar için çok önemlidir. Ayrıca, materyallerin fotostimülasyon yeteneği, hücreyi veya prosedür özgüllüğünü çözer ve bu stimülasyon yaklaşımını farklı hücre tiplerine kolayca aktarılabilir hale getirir.
Kardiyak doku üzerinde dinamik ve gerçek zamanlı kontrol, bu metodolojinin bir başka avantajıdır. Işık kullanımı, elektriksel özelliklerin gerçek zamanlı modülasyonunu mümkün kılar ve farklı uyaranların kardiyak fonksiyonu nasıl etkilediğini araştırmak için güçlü bir araç sağlar. Ziapin2 ile entegrasyon, ışığın doğrudan elektrik sinyallerine dönüştürülmesine olanak tanıyarak hiPSC-CM'lerde aksiyon potansiyelleri ve ritim üzerinde hassas kontrol sağlar.
Bu yaklaşım aynı zamanda, özellikle kardiyak aritmiler ve diğer elektriksel bozukluklar için doğru hastalık modelleri oluşturmak için zemin hazırlayarak, araştırmacıların kontrollü bir ortamda çeşitli uyaranlara veya ilaçlara hücresel tepkileri incelemelerine olanak tanıyan araştırma uygulamalarını ilerletmek için umut vaat etmektedir. Ayrıca, ilaç taraması ve toksisite testi için sağlam bir platform sunarak, geleneksel hayvan modellerine kıyasla insanla daha ilgili bir bağlam sağlar.
Bu bağlamda, bu teknoloji hayvan modellerine olan bağımlılığı azalttığı ve 3R'lerin (Değiştirme, Azaltma ve İyileştirme) ilkeleriyle uyumlu olduğu için etik hususlar da ele alınmaktadır. İnsan kardiyak tepkileri için daha etik ve potansiyel olarak öngörücü bir model sağlayarak, daha insancıl araştırma uygulamalarına geçişi destekler.
Yöntemin ölçeklenebilirliği ve özelleştirilmesi, faydasını daha da artırır. Araştırmacılar, hücre tipi, hizalama ve fototransdüser yerleşimi gibi faktörleri ayarlayarak doku yapılarını belirli araştırma ihtiyaçlarına göre uyarlayabilirler. Ek olarak, metodoloji daha büyük deneyler veya yüksek verimli çalışmalar için potansiyel olarak ölçeklendirilebilir ve bu da onu hem temel araştırma hem de klinik öncesi uygulamalar için çok yönlü bir araç haline getirir.
Son olarak, kişiselleştirilmiş tıp potansiyeli önemlidir. Araştırmacılar, bireysel hastalardan hiPSC-CM'ler türeterek, hastaya özgü kalp dokusu modelleri oluşturabilir ve ilaçlara veya müdahalelere kişiselleştirilmiş yanıtların incelenmesini sağlayabilir. Bu, kardiyolojide kişiye özel tedavi yaklaşımlarının önünü açmakta ve terapötik gelişim için yeni yollar sunmaktadır.
Açıklamalar
CB, GL ve FL, "FOTOKROMİK BİLEŞİKLER" Patent No'nun mucitleridir. EP 3802491 (02/07/2020).
Teşekkürler
Yazarlar, Şekil 1 ve Şekil 3'teki çizimler için Michael Rosnach'a ve hiPSC tedariki için Prof. William T. Pu'ya minnetle teşekkür eder. Bu çalışma, NCATS Doku Cipsleri Konsorsiyumu (UH3 TR003279) tarafından KKP'ye, İtalya Üniversiteler ve Araştırma Bakanlığı tarafından PRIN 2022 projesi (ID 2022-NAZ-0595) aracılığıyla FL'ye, PRIN 2020 projesi (ID 2020XBFEMS) aracılığıyla CB ve GL'ye ve Fondo Italiano per la Scienza projesi (ID FIS00001244) tarafından GL'ye desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| alamarBlue Cell Viability Reagent | Thermo Fisher Scientific | DAL1025 | Cell Viability Assay |
| B-27 Supplement, minus insulin | Thermo Fisher Scientific | A1895601 | For cell culture |
| Bovine Serum Albumin | Sigma-Aldrich | A9056-50G | For cell staining |
| BrainVision Analyzer software | Brain Products | https://www.brainproducts.com/downloads/analyzer/ | Data export and handling |
| BTS | Sigma | 203895-5MG | |
| CHIR99021 | Stem Cell Technologies | 72054 | |
| Clear Scratch- and UV-Resistant Acrylic Sheet, 12" x 12" x 0.01 inch | McMaster Carr | 4076N11 | Tissue chip fabrication |
| Collagenase Type II | Worthington | CLS-2 / LS004176 | |
| DNase II | VWR | 89346-540 | |
| Essential 8 Medium | Thermo Fisher Scientific | A1517001 | For cell culture |
| Fibronectin | VWR | 47743-654 | Coating |
| Gelatin from porcine skin gel strength 175 Type A | Sigma-Aldrich | G2625-100G | Tissue chip fabrication |
| Geltrex LDEV-Free, hESC-Qualified, Reduced Growth Factor Basement Membrane Matrix | Thermo Fisher Scientific | A1413302 | Coating |
| HBSS | Thermo Fisher | 14175-095 | |
| HEPES (1 M) | Thermo Fisher Scientific | 15630080 | |
| Hoechst 33342 | Life technologies | H1399 | For cell staining |
| Insulin solution human | Sigma Aldrich | I9278-5ML | |
| IWR-1-endo | Stem Cell Technologies | 72564 | |
| Paraformadehyde 16% Aqueous Solution (PFA) | VWR | 100503-917 | For cell staining |
| PBS, sterile, 500 mL | Thermo Fisher Scientific | 10010049 | Tissue chip fabrication |
| phosphate buffered saline | Thermo Fisher Scientific | 10010049 | |
| Pluronic F-127 (20% Solution in DMSO) | Thermo Fisher Scientific | P3000MP | Non-ionic surfactant |
| ROCK inhibitor Y-27632 | Stem Cell Technologies | 72304 | |
| RPMI 1640 Medium, GlutaMAX Supplement | Thermo Fisher Scientific | 61870127 | For cell culture |
| RPMI 1640 Medium, no phenol red | Thermo Fisher Scientific | 11835030 | Optical mapping |
| Versene Solution | Thermo Fisher Scientific | 15040066 | chelating agent |
| VWR General-Purpose Laboratory Labeling Tape | VWR | 89098-058 | Tissue chip fabrication |
| X-Rhod-1 AM | Thermo Fisher Scientific | X14210 | Optical mapping |
Referanslar
- Di Maria, F., Lodola, F., Zucchetti, E., Benfenati, F., Lanzani, G. The evolution of artificial light actuators in living systems: from planar to nanostructured interfaces. Chem Soc Rev. 47 (13), 4757-4780 (2018).
- Manfredi, G., et al. The physics of plasma membrane photostimulation. APL Mater. 9 (3), 030901 (2021).
- Bareket-Keren, L., Hanein, Y. Novel interfaces for light directed neuronal stimulation: advances and challenges. Int J Nanomed. 9 Suppl 1 (Suppl 1), 65-83 (2014).
- Ford, S. M., Watanabe, M., Jenkins, M. W. A review of optical pacing with infrared light. J. Neural Eng. 15 (1), 011001 (2018).
- Antognazza, M. R., et al. Shedding light on living cells. Adv Mater. 27 (46), 7662-7669 (2015).
- Zhang, J., Wang, J., Tian, H. Taking orders from light: progress in photochromic bio-materials. Mater Horiz. 1 (2), 169-184 (2014).
- Deisseroth, K. Optogenetics. Nat Methods. 8 (1), 26-29 (2011).
- Ambrosi, C. M., Entcheva, E. Optogenetics' promise: pacing and cardioversion by light. Future Cardiol. 10 (1), 1-4 (2014).
- Hopkins, J., et al. Photoactive organic substrates for cell stimulation: Progress and perspectives. Adv Mater Technol. 4 (5), 1800744 (2019).
- Vurro, V., Venturino, I., Lanzani, G. A perspective on the use of light as a driving element for bio-hybrid actuation. Appl Phys Lett. 120 (8), 080502 (2022).
- Bruno, G., et al. All-optical and label-free stimulation of action potentials in neurons and cardiomyocytes by plasmonic porous metamaterials. Adv Sci. 8 (21), 2100627 (2021).
- Ronchi, C., et al. Nongenetic optical modulation of pluripotent stem cells derived cardiomyocytes function in the red spectral range. Adv Sci. 11 (3), 2304303 (2023).
- Li, P., et al. Monolithic silicon for high spatiotemporal translational photostimulation. Nature. 626 (8001), 990-998 (2024).
- Jiang, Y., et al. Nongenetic optical neuromodulation with silicon-based materials. Nat Protoc. 14 (5), 1339-1376 (2019).
- Rotenberg, M. Y., et al. Living myofibroblast-silicon composites for probing electrical coupling in cardiac systems. Proc Natl Acad Sci USA. 116 (45), 22531-22539 (2019).
- DiFrancesco, M. L., et al. Neuronal firing modulation by a membrane-targeted photoswitch. Nat Nanotechnol. 15 (4), 296-306 (2020).
- Paternò, G. M., et al. Membrane environment enables ultrafast isomerization of amphiphilic azobenzene. Adv Sci. 7 (8), 1903241 (2020).
- Vurro, V., et al. Molecular design of amphiphilic plasma membrane-targeted azobenzenes for nongenetic optical stimulation. Front Mater. 7, 631567 (2021).
- Vurro, V., et al. Optical modulation of excitation-contraction coupling in human-induced pluripotent stem cell-derived cardiomyocytes. iScience. 26 (3), 106121 (2023).
- Vurro, V., et al. Light-triggered cardiac microphysiological model. APL Bioeng. 7 (2), 026108 (2023).
- Florindi, C., et al. Role of stretch-activated channels in light-generated action potentials mediated by an intramembrane molecular photoswitch. J. Transl. Med. 22 (1), 1068 (2024).
- McCain, M. L., Agarwal, A., Nesmith, H. W., Nesmith, A. P., Parker, K. K. Micromolded gelatin hydrogels for extended culture of engineered cardiac tissues. Biomaterials. 35 (21), 5462-5471 (2014).
- Park, S. -. J., et al. Insights into the pathogenesis of catecholaminergic polymorphic ventricular tachycardia from engineered human heart tissue. Circulation. 140 (5), 390-404 (2019).
- Lee, K. Y., et al. An autonomously swimming biohybrid fish designed with human cardiac biophysics. Science. 375 (6581), 639-647 (2022).
- Lian, X., et al. Directed cardiomyocyte differentiation from human pluripotent stem cells by modulating Wnt/β-catenin signaling under fully defined conditions. Nat Protoc. 8 (1), 162-175 (2013).
- Prondzynski, M., et al. Efficient and reproducible generation of human iPSC-derived cardiomyocytes and cardiac organoids in stirred suspension systems. Nat Commun. 15 (1), 5929 (2024).
- Pasqualini, F. S., Sheehy, S. P., Agarwal, A., Aratyn-Schaus, Y., Parker, K. K. Structural phenotyping of stem cell-derived cardiomyocytes. Stem Cell Rep. 4 (3), 340-347 (2015).
- Fonck, E., et al. Effect of aging on elastin functionality in human cerebral arteries. Stroke. 40 (7), 2552-2556 (2009).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır