Method Article
Ein kardiales mikrophysiologisches System zur Untersuchung der Ca2+ -Ausbreitung durch nicht-genetische optische Stimulation
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Die Steuerung von Herzzellen und -gewebe mit Licht ermöglicht eine berührungslose Stimulation, wodurch der natürliche Zustand und die Funktion der Zellen erhalten bleiben, was sie zu einem wertvollen Ansatz sowohl für die Grundlagenforschung als auch für therapeutische Anwendungen macht.
Zusammenfassung
In-vitro-kardiale mikrophysiologische Modelle sind äußerst zuverlässig für die wissenschaftliche Forschung, Arzneimittelentwicklung und medizinische Anwendungen. Obwohl diese Systeme von der wissenschaftlichen Gemeinschaft weitgehend akzeptiert werden, sind sie aufgrund des Fehlens nicht-invasiver Stimulationstechniken immer noch in ihrer Langlebigkeit begrenzt. Phototransducer bieten eine effiziente Stimulationsmethode, die einen drahtlosen Ansatz mit hoher zeitlicher und räumlicher Auflösung bietet und gleichzeitig die Invasivität in Stimulationsprozessen minimiert. In diesem Manuskript stellen wir eine vollständig optische Methode zur Stimulierung und Detektion der Aktivität eines in vitro kardialen mikrophysiologischen Modells vor. Konkret haben wir technisch hergestellte laminare anisotrope Gewebe hergestellt, indem wir humaninduzierte pluripotente Stammzell-abgeleitete Kardiomyozyten (hiPSC-CMs) ausgesät haben, die in einer 3D-Bioreaktor-Suspensionskultur erzeugt wurden. Wir verwendeten einen Photowandler, ein amphiphiles Azobenzol-Derivat namens Ziapin2, zur Stimulation und einen Ca2+ -Farbstoff (X-Rhod 1) zur Überwachung der Reaktion des Systems. Die Ergebnisse zeigen, dass Ziapin2 dieCa2+ -Reaktionen im verwendeten System photomodulieren kann, ohne die Integrität, Lebensfähigkeit oder das Verhalten des Gewebes zu beeinträchtigen. Darüber hinaus konnten wir zeigen, dass der lichtbasierte Stimulationsansatz eine ähnliche Auflösung im Vergleich zur elektrischen Stimulation, dem aktuellen Goldstandard, bietet. Insgesamt eröffnet dieses Protokoll vielversprechende Perspektiven für die Anwendung von Ziapin2 und der materialbasierten Photostimulation in der Herzforschung.
Einleitung
Die Verwendung von Licht zur Stimulation lebender Zellen und Gewebe entwickelt sich zu einem bedeutenden Wendepunkt in der biomedizinischen Forschung und bietet berührungslose Stimulationsmöglichkeiten mit präziser zeitlicher und räumlicher Auflösung 1,2,3,4,5,6. Eine der führenden Techniken, um Zellen lichtempfindlich zu machen, ist die Optogenetik, bei der Zellen genetisch so verändert werden, dass sie lichtempfindliche Ionenkanäle oder Pumpen exprimieren 7,8. Dieser Ansatz hat eine beeindruckende Wirksamkeit bei der Regulierung von Zellen im lebenden Gewebe gezeigt. Die Abhängigkeit vom viralen Gentransfer hat jedoch seine breite Einführung in Forschung und klinischen Anwendungen behindert.
Um diese Einschränkung zu überwinden, wurden organische und anorganische Materialien als lichtempfindliche Wandler verwendet, um nicht-genetische, materialbasierte lichtvermittelte Stimulationstechniken zu entwickeln 9,10. Organische nanostrukturierte Photowandler 11,12,13,14,15 haben kürzlich bemerkenswerte Erfolge bei der Auslösung zellulärer Reaktionen in verschiedenen Anwendungen gezeigt, einschließlich Neuronen, Kardiomyozyten und Skelettmuskelzellen.
Hier schlagen wir Ziapin2 16,17,18, ein Azobenzolderivat, zur Untersuchung der Ca2+-Ausbreitung in manipulierten laminaren Herzgeweben vor. Die amphiphile Struktur des Moleküls ermöglicht ein präzises Targeting der Plasmamembran der Zelle, während der Azobenzolkern eine lichtinduzierte Isomerisierung ermöglicht, die zu einer Konformationsänderung führt 16,17,18. In Herzzellen verändert diese trans-to-cis-Isomerisierung die Dicke der Plasmamembran und induziert eine Kaskade von Effekten, die ein Aktionspotential erzeugt, das wiederum den Erregungs-Kontraktionsprozess auslöst 19,20,21.
Darüber hinaus beschreiben wir den Herstellungsprozess einer technischen Plattform für das anisotrope Wachstum von Herzgewebe22 und beschreiben detailliert den experimentellen Aufbau, der zur optischen Auslösung und Überwachung seiner Aktivität verwendet wird, mit besonderem Fokus auf die Erfassung der Ca2+-Dynamik innerhalb des Gewebes23,24. Schließlich vergleichen wir die erfassten Signale mit denen, die durch elektrische Stimulation erhalten werden, die als Referenzstandard gilt. Insgesamt unterstreicht dieses Protokoll die Anwendung eines neuartigen lichtempfindlichen Schallkopfs zur Verbesserung unseres Verständnisses des zellulären Verhaltens des Herzens, insbesondere im Zusammenhang mit manipulierten Geweben.
Protokoll
Bei der verwendeten humanen pluripotenten Stammzellkultur (hiPSC) handelt es sich um eine humane humane männliche iPSC-Linie, die ein Doxycyclin (Dox)-induzierbares CRISPR/Cas9-System enthält, das durch die Einführung von CAGrtTA::TetO-Cas9 in den AAVS1-Locus (Addgen: #73500) erzeugt wurde. Die Studie wurde in Übereinstimmung mit den vom Boston Children's Hospital Institutional Review Board genehmigten Protokollen durchgeführt. Die Einverständniserklärung der Patienten wurde vor ihrer Teilnahme an der Studie eingeholt. Die Erzeugung von hiPSC-abgeleiteten Kardiomyozyten (hiPSC-CMs) wurde, wie zuvor beschrieben, induziert25,26. Das Protokoll soll im folgenden Abschnitt kurz zusammengefasst werden:
1. Erzeugung und Aufbereitung von humanen induzierten pluripotenten Stammzell-abgeleiteten Kardiomyozyten
- HiPSCs, die in T75-Kolben kultiviert werden, werden einmal mit PBS gewaschen. Die Zellen werden abgelöst, indem sie 10-15 Minuten lang mit dem Chelatbildner Versen inkubiert und in Bioreaktorgefäße eingesät werden, die mit einer 1%igen Lösung eines nichtionischen Tensids bei einer Dichte von 50 Millionen IPSCs/Gefäß in 100 ml E8-Medium, ergänzt mit 10 μM ROCK-Inhibitor Y-27632, vorbehandelt sind.
- Stellen Sie die folgenden Bioreaktorparameter ein: Rühren 60 U/min, Temperatur 37 °C, pH 7 und Überlagerungsbegasung (O2 und CO2) bei 3 Standard-L/h.
- Bestätigen Sie nach 1 Tag in Kultur, dass der Durchmesser des Embryoidkörpers (EB) 100-300 μm erreicht hat, und behandeln Sie die Zellen mit basischem RPMI-Medium (RPMI 1640-Medium, ergänzt mit B27 minus Insulin), das 7 μM CHIR99021 für 24 h enthält, gefolgt von einem Medienwechsel auf RPMI für weitere 24 Stunden. Geben Sie für weitere 48 h basisches RPMI-Medium mit 5 μM IWR-1-endo hinzu, um den Differenzierungsprozess in Richtung der kardialen Linie zu starten. Wechseln Sie nach 48 Stunden das Medium wieder auf die Basis-RPMI.
- Am 7. Tag der Differenzierung wurden die Kulturzellen in einem basischen RPMI-Medium mit 1:1.000 (v/v) Humaninsulin ergänzt. Aktualisieren Sie das Medium alle 2 Tage oder täglich mit einem Medienwechsel von 50 %, wenn der Sauerstoffverbrauch mehr als 30 % erreicht.
- An Tag 15 dissoziieren Sie die Bioreaktorzellen 3 h lang enzymatisch mit einer Kollagenase II-Lösung, die HBSS, Kollagenase II (200 Einheiten/ml), HEPES (10 mM), ROCK-Inhibitor Y-27632 (10 μM) und N-Benzyl-p-toluolsulfonamid (BTS, 30 μM) enthält. Dazu werden die differenzierten hiPSC-CM EBs zunächst 2x mit vorgewärmtem HBSS gewaschen und in Kollagenase II Lösung (200 μl Volumen EB / 12 ml Collagenase II Lösung) bei 37 °C in 5% CO2 inkubiert, bis einzelne Zellen aus der vollständigen EB-Dissoziation erscheinen.
- Stoppen Sie die Dissoziationsreaktion, indem Sie der Einzelzellsuspension ein gleiches Volumen Blockierungspuffer (RPMI-1640 ohne B27 und DNase II, mit 6 μl DNase II pro ml RPMI-1640) zusetzen. Zählen Sie die differenzierten hiPS-CMs, zentrifugieren Sie sie (200 × g, 5 min) und bereiten Sie sie für nachgelagerte Anwendungen vor, indem Sie die Zellen 24 Stunden lang bei -80 °C in Isopropanol einfrieren und in Flüssigstickstofftanks umfüllen, bis die Aussaat durchgeführt wird.
2. Technische Herstellung von laminarem Gewebe
- Kleben Sie zwei Schichten Laborklebeband, eine weiße und eine blaue, auf eine 1 mm starke, klare, kratz- und UV-beständige Acrylplatte. Schneiden Sie mit einem CO2 -Lasergravierer die Acrylplatte in Kreise (20 mm Durchmesser für die 12 MW) und das Chipmuster (3 x 7,5 mm Quadrate, drei pro Chip) auf das Band, wie es in einer Vektorgrafiksoftware (z. B. CorelDraw) entworfen wurde. Acryl-Schneidparameter: 100 Leistung, 20 Geschwindigkeit und 1.000 PPI; Parameter für das Schneiden des Bandes: 8 Leistung, 6 Geschwindigkeiten und 1.000 PPI. Entfernen Sie die beiden Schichten Klebeband in der innersten Linie mit einer Pinzette, weichen Sie die Chips 30 Minuten bis 1 Stunde lang in reinem Bleichmittel ein, um dicke Linien und dunkle Flecken vom Schneiden zu entfernen, und hinterlassen Sie eine scharfe Linie, und spülen Sie die Chips in einem Becherglas über Nacht oder mindestens 3 Stunden lang mit fließendem deionisiertem (DI) Wasser ab.
HINWEIS: Nicht länger als 2 Stunden bleichen, da dies die Klebstoffe auf den Seitenwänden ätzt und verhindert, dass Gelatine richtig haftet. - Beschallen Sie die Chips 10 Minuten lang und die Polydimethylsiloxan-Stempel (PDMS, Sylgard 184) mit Linienrillenmerkmalen (25 μm Rillenbreite, 4 μm Rillenbreite und 5 μm Rillentiefe) für 30 Minuten in sauberem 70%igem Ethanol. Bringen Sie die Chips und Stempel in einen sauberen Bereich unter einer Haube und lassen Sie sie ~1-2 h unter Luftstrom trocknen.
- Wiegen Sie 1 g Gelatine aus Schweinehaut (Gelstärke ~175 g Bloom, Typ A) in ein 50-ml-Röhrchen. Fügen Sie 5 ml phosphatgepufferte Kochsalzlösung (PBS) hinzu und mischen Sie gründlich, um eine sofortige Auflösung der Gelatine zu gewährleisten. Legen Sie das Röhrchen 30 Minuten lang in ein 65 °C heißes Wasserbad, um den Auflösungsprozess abzuschließen. Wiegen Sie auf ähnliche Weise 1 g mikrobielle Transglutaminase (MTG) in ein separates 50-ml-Röhrchen. Fügen Sie 12,5 ml PBS hinzu, mischen Sie gründlich und legen Sie das Röhrchen 30 Minuten lang in ein 37 °C heißes Wasserbad, um eine vollständige Auflösung des MTG zu gewährleisten.
- Beschallen Sie das Gelatineröhrchen 15 Minuten lang und stellen Sie es dann vor Gebrauch wieder in das 65 °C warme Wasserbad. Legen Sie das MTG-Röhrchen mit leicht gelockerter Kappe in einen Exsikkator und schalten Sie das Vakuum langsam ein. Beobachten Sie, wie die Blasen unter Vakuum aus der MTG-Lösung entfernt werden. Nach der Entgasung stellen Sie das MTG-Rohr wieder in das 37 °C warme Wasserbad.
HINWEIS: Überwachen Sie den Prozess und stellen Sie das Vakuum ein, um starkes Kochen zu vermeiden. - Decken Sie ein Gitterblatt mit sauberem Parafilm ab, legen Sie die Chips auf das Gitter und halten Sie den Stempel griffbereit. Fügen Sie 5 ml MTG zu den 5 ml Gelatinelösung hinzu und pipetieren Sie vorsichtig, um Blasen zu vermeiden. Pipettieren Sie dann die Gelatine schnell auf den Chip und verwenden Sie so viel, dass die Chipfläche bedeckt ist (jeweils ca. 0,5 ml). Platzieren Sie dann den linienförmigen Stempel PDMS22 (Linienbreite 25 μm, Höhe 5 μm, Abstand 4 μm) darauf und tragen Sie ein Gewicht von 200 g auf, um sicherzustellen, dass die Gelatine parallel zur Längsachse des Gewebes strukturiert ist. Sobald alle Chips geformt sind, decken Sie sie mit einem Glas ab, um Umweltstörungen zu vermeiden, und lassen Sie sie über Nacht vernetzen.
HINWEIS: Verwenden Sie die gemischte Lösung gelatine-MTG innerhalb von 5 min; Andernfalls wird das Zielmuster aufgrund eines höher vernetzten Zustands der Gelatine verändert. - Übertragen Sie den Chip und das PDMS-Stempelsandwich in eine neue, mit PBS gefüllte P150-Schale und hydratisieren Sie die Gelatine 30 Minuten bis 1 Stunde lang, um die Trennung des PDMS-Stempels vom Chip zu erleichtern. Entfernen Sie überschüssige, ungeformte Gelatine um den Chip herum und geben Sie den sauberen Chip in eine neue P150-Schale, die mit PBS gefüllt ist. Lagern Sie die PDMS-Stempel in 70% Ethanol.
- Sterilisieren Sie die Chips, indem Sie sie 10 Minuten lang unter der Haube in Ethanol einweichen.
HINWEIS: Nicht länger als 10 min in Ethanol einwirken, da sich die Gelatine bei längerer Einwirkung verformen kann. - Übertragen Sie die Chips auf PBS, lassen Sie sie 10 Minuten einweichen und spülen Sie sie 3x aus. Bereiten Sie Beschichtungslösungen vor, indem Sie 20 μg/mL Fibronektin mit 1:100 verdünnter Basalmembranmatrix in Kulturmedien mischen (ca. 0,5 mL pro Well). Die Chips 2 h im Inkubator bei 37 °C und 5 % CO2 oder über Nacht bei 4 °C beschichten.
- Auftauen und Keimzellen (8 × 105 hiPSC-CMs pro cm2) in RPMI-Medium mit Y-27632 (10 μM) und nach 24 Stunden durch RPMI ohne Y-27632 ersetzen.
- Entfernen Sie drei Tage nach der Zellaussaat das weiße Klebeband mit einer Pinzette.
3. Synthese und Anwendung des Phototransducers
HINWEIS: Ziapin2 wurde gemäß einem zuvor veröffentlichten Verfahrensynthetisiert 16,18 und hiPSC-CMs direkt im Kulturmedium verabreicht.
- 25 μM Ziapin2 in die Zellkultur geben und bei 37 °C und 5 % CO2 7 min inkubieren.
- Überschüssige Moleküle vorsichtig auswaschen und mit frischem Kulturmedium abspülen.
4. Viabilitätsprüfung
HINWEIS: Alamar Blue ist ein Resazurin-basierter Assay, der Zellen durchdringen und als Redoxindikator zur Überwachung der Zellviabilität fungieren kann. Resazurin löst sich in physiologischen Puffern auf, was zu einer tiefblauen Lösung führt, die den Zellen in Kultur direkt zugesetzt wird. Lebensfähige Zellen mit aktivem Stoffwechsel reduzieren Resazurin zu Resofurin, das rosa und fluoreszierend ist.
- Plattenzellen in einer 96-Well-Platte, die zuvor mit 20 μg/mL Fibronektin und 1:100 verdünnter Basalmembranmatrix in Kulturmedien beschichtet war. Mischen Sie durch Schütteln und fügen Sie dann aseptisch Alamar Blue in einer Menge von 10 % des Well-Volumens in jede Vertiefung hinzu.
- Inkubieren Sie Kulturen mit Alamar Blue für 4 Stunden.
- Behandeln Sie die Zellen mit dem Phototransducer and Vehicle (DMSO) wie zuvor beschrieben. Wenden Sie eine Lichtstimulation (1 Hz gepulstes Licht für 1 min) über eine optische Faser (Cyan, 470 nm) an, um den Effekt der Ziapin2-Internalisierung und der Lichtexposition auf die Lebensfähigkeit von hiPSC-CM zu bewerten.
- Lesen Sie die Fluoreszenz mit einem Platten-Reader bei Anregung 560 nm und Emission 590 nm.
5. Bewertung der künstlichen Anisotropie laminarer Herzgewebe
HINWEIS: Dieses Protokoll beschreibt einen systematischen Ansatz zur Beurteilung der Anisotropie von künstlich hergestelltem laminarem Herzgewebe unter Verwendung von Immunfärbung, konfokaler Mikroskopie und Zellkernanalyse27.
- Waschen Sie das Substrat mehrmals mit PBS, bevor Sie es mit 4 % (v/v) Paraformaldehyd mit 0,05 % (v/v) Triton X-100 in PBS für 10 min fixieren.
- Blockieren Sie die unspezifische Bindung, indem Sie Proben 30 Minuten lang mit 5 % (w/v) Rinderserumalbumin (BSA) in PBS inkubieren.
- Inkubieren Sie die Proben mit Hoechst (1:500) bei Raumtemperatur für 1 h.
- Vor der Montage auf Objektträgern mit einem Anti-Fade-Mittel mit PBS waschen. Lassen Sie die Objektträger über Nacht trocknen und lagern Sie sie bis zur Bildgebung bei 4 °C.
- Nehmen Sie Proben mit einem konfokalen Spinning-Disk-Mikroskop bei 20-facher Vergrößerung auf. Bestimmen Sie die Ausrichtung der Zellen mit OrientationJ Measure28, einem FiJi-Plugin.
6. Optische Mapping-Aufnahmen
HINWEIS: Das optische Mapping wurde nach 5 Tagen in Kultur an hiPSC-CMs durchgeführt, die auf gelatinegeformte Gewebechips gesät wurden.
- Um dieses Protokoll zu befolgen, stellen Sie sicher, dass die optische Kartierungsvorrichtung aus einem modifizierten Tandemlinsenmikroskop besteht, das mit einer Hochgeschwindigkeitskamera und der Anregungslichtquelle, einer 200-mW-Quecksilberlampe, ausgestattet ist. Stellen Sie einen dichroitischen Spiegel vor die dafür vorgesehene Ca2+ -Bildkamera, um sicherzustellen, dass das Präparat Anregungslicht ausgesetzt ist, und um die von der Probe emittierte Fluoreszenz zu sammeln.
- Die Probe wird mit 2 μM X-Rhod 1, die dem Kulturmedium zugesetzt wurde, 30 Minuten lang bei 37 °C inkubiert.
HINWEIS: Setzen Sie die Probe nur während der Bildaufnahme Licht aus, um ein Photobleichen des Farbstoffs zu vermeiden. - Inkubieren Sie den Phototrasducer wie zuvor in Abschnitt 3 beschrieben.
- Mit frischem Kulturmedium waschen und die Chips auf phenolrotfreies Medium RPMI 1640 übertragen, das mit B27 minus Insulin versetzt ist.
- Legen Sie die Gewebechips in eine temperaturgesteuerte Schüssel und starten Sie die Aufnahme bei physiologischer Temperatur (37 °C), wobei die Bilder mit einer Bildrate von 2,5 Bildern/s aufgenommen werden.
- Für die optische Stimulation wenden Sie die optische Punktstimulation an einem Ende des Gewebes mit einer LED-Lichtquelle (465/25 nm) an, die eine Ziapin2-Stimulation ermöglicht. Beschleunigen Sie das Gewebe mit einer Frequenz von 0,5 oder 1 Hz über eine zeitlich regulierte optische Faser, die 1 mm vom Gewebe entfernt positioniert ist. Für die elektrische Stimulation wenden Sie eine Punktstimulation mit einer bipolaren Platinelektrode an, die in der Mitte des distalsten Endes des rechteckigen Gewebes positioniert ist. Diese Platzierung stellt sicher, dass die Ausbreitung der Ca2+ -Welle von der Mitte der Gewebebreite ausgeht, die der kürzeren Seite des Rechtecks entspricht. Die Stimulation sollte bei einer Frequenz von 0,5 Hz, mit einer Amplitude von 10 V und einer Impulsdauer von 100 ms erfolgen.
- Wenden Sie nach den Aufnahmen einen räumlichen Filter mit einer Größe von 3 x 3 Pixeln an, um das Signal-Rausch-Verhältnis zu verbessern.
- Bestimmen Sie die Ca2+ -Wellenleitungsgeschwindigkeit an jedem Pixel für jeden Impuls und berechnen Sie die Änderungsrate sowohl in x- als auch in y-Richtung. Messen Sie dazu den räumlichen Gradienten der Intensität des Ca2+ -Signals in diese Richtungen und setzen Sie ihn in Beziehung zur Zeitverzögerung der Ausbreitung des Signals. Durch die Kombination dieser Richtungsänderungsraten können Sie quantifizieren, wie schnell sich die Welle in beiden Dimensionen über das zelluläre Feld ausbreitet.
7. Datenexport und -verarbeitung
- Extrahieren und analysieren Sie die Daten mit der referenzierten Software.
- Wenden Sie einen räumlichen Filter von 3 x 3 Pixeln an, um das Signal-Rausch-Verhältnis zu verbessern.
- Extrahieren Sie die Ca2+ -Transientenkurven (CaT) als Mittelwert eines bestimmten manuell ausgewählten Region of Interest (ROI).
- Messen Sie die CaT-Parameter in einem zentralen Bereich of Interest (ROI) von 50 x 50 Pixeln (≈ 25 mm2).
- Analysieren Sie für jeden CaT die CaT-Amplitude, die Anstiegszeit (tPeak), die Zeit der maximalen Abklingneigung (Max Decay Slope) und die Zeit bis zum transienten Abklingen von 90 % (Abklingzeit90).
8. Statistische Auswertung
- Beurteilen Sie die Normalverteilung mit einem geeigneten statistischen Test, z. B. einem Normalitätstest, um zu bestimmen, ob parametrische oder nicht-parametrische Methoden angewendet werden sollten.
- Bewerten Sie die statistische Signifikanz zwischen zwei Bedingungen mit dem Student's t-Test oder dem Mann-Whitney U-Test für kontinuierliche bzw. kategoriale Daten. Wenn Sie mehr als zwei Gruppen vergleichen, verwenden Sie je nach Datenannahmen eine unidirektionale ANOVA oder den Kruskal-Wallis-Test, gefolgt von geeigneten Post-hoc-Tests, um signifikante paarweise Unterschiede zu identifizieren.
Ergebnisse
Es wurde ein mehrstufiges Verfahren für die Herstellung von künstlich hergestelltem laminarem Herzgewebe unter Verwendung einer Kombination aus Laserstrukturierung, Gelatineformung und Zellaussaattechniken entwickelt und implementiert. Ursprünglich von McCain et al.22 und Lee et al.24 etabliert, wurde diese Technik nach deren Protokollen zur Konstruktion des manipulierten laminaren Mikrogewebes erneut implementiert. Das Verfahren integriert eine präzise laserbasierte Strukturierung für die strukturelle Führung, Gelatine als Gerüstmaterial und eine kontrollierte Zellaussaat, um eine biomimetische Gewebeumgebung zu schaffen. (Abbildung 1).
Bei der Abscheidung von Papiersubstraten wurden zwei Schichten Laborbeschriftungsband, eine weiße und eine blaue, auf ein 1 mm dickes Acrylsubstrat geklebt, um eine robuste Basis für nachfolgende Schritte zu schaffen und eine präzise Visualisierung und Manipulation während des Herstellungsprozesses zu ermöglichen (Abbildung 1A). Um die gewünschte Chipgeometrie auf den Substraten zu erreichen, wurde eine Laserstrukturierung eingesetzt, wobei optimierte Parameter einen präzisen Abtrag gewährleisteten, ohne die Acrylbasis zu beschädigen (Abbildung 1B). Durch das selektive Entfernen von Tape-Schichten wurden bestimmte Bereiche des Substrats für die Weiterverarbeitung freigelegt. Eine Gelatinelösung, die aus Schweinehaut hergestellt und mit mikrobieller Transglutaminase vernetzt wurde, wurde dann auf die gemusterte Acryloberfläche aufgebracht, um eine biokompatible Schicht zu erzeugen, die für die Zelladhäsion geeignet ist (Abbildung 1C). Diese Gelatineschicht wurde mit einem PDMS-Stempel mit Linienrillenmustern geformt, die eine Ausrichtung mit der Längsachse des Gewebes gewährleisten, und über Nacht vernetzt, um ein stabiles, strukturiertes Substrat zu erzeugen (Abbildung 1D und ergänzende Abbildung S1).
Humaninduzierte pluripotente Stammzell-abgeleitete Kardiomyozyten (hiPSC-CMs) wurden mit einer Dichte von etwa 8 × 105 Zellen/cm2 auf das vorbeschichtete Substrat ausgesät (Abbildung 1E). Die Kultivierungsbedingungen wurden durch tägliche Medienauffrischung optimiert, um das Zellwachstum zu unterstützen. Nach 3 Tagen wurde die weiße Klebebandschicht entfernt, um die gemusterte Gelatineoberfläche freizulegen (Abbildung 1F), was eine präzise Eingrenzung der Zellen in bestimmte Substratregionen gewährleistete und die Entwicklung von biotechnologisch hergestelltem laminarem Gewebe mit den gewünschten geometrischen Konfigurationen erleichterte. Anschließend wurden die Lebensfähigkeit und Ausrichtung der hiPS-CMs im biotechnologisch hergestellten Gewebe evaluiert.
Der Einfluss der Ziapin2-Internalisierung, gefolgt von der Lichtexposition, auf die Zellviabilität wurde mit dem AlamarBlue Assay bewertet. Die in Abbildung 2A berichteten Ergebnisse zeigten, dass Ziapin2, wenn es in einer Konzentration von 25 μM internalisiert und von einer 470-nm-Lichtstimulation gefolgt wurde, die Lebensfähigkeit der Zellen nicht negativ beeinflusste, was die Kompatibilität dieses Phototransducer-Ansatzes mit lebenden Zellen bestätigt.
Die Anisotropie innerhalb des biotechnologisch hergestellten laminaren Gewebes wurde wie beabsichtigt erreicht, wobei die Fluoreszenzbildgebung eine signifikante zelluläre Ausrichtung entlang der gemusterten Rillen des mikrogeformten Gelatinesubstrats zeigte (Abbildung 2B). Die Zellorientierung, die sich aus den Fluoreszenzbildern ergibt, wurde mit Hilfe des FiJi-Plugins OrientationJ28 quantitativ bewertet. Die Orientierung wurde durch die Verarbeitung der Hoechst-Fluoreszenzbilder bewertet, was zu einem mittleren Winkel von θMittelwert = 13,39 ± 2,67° führte. Der Winkel gibt die Orientierung an, die auf die Musterrichtung normiert ist, was einen hohen Grad an Anisotropie im Gewebe zeigt. Die gemessene Winkelverteilung, sowie der niedrige Messwert der Standardabweichung, deutet auf eine starke Richtungspräferenz in der Gewebestruktur hin (Abbildung 2C). Dies zeigte die Bildung von anisotropem Herzgewebe, das für die Nachahmung der natürlichen Architektur entscheidend ist, die für eine ordnungsgemäße funktionelle Leistung erforderlich ist, wie z. B. koordinierte Kontraktion und elektrische Leitung.
Nach 5 Tagen in Kultur wurde ein optisches Mapping an Ziapin2-beladenen hiPSC-CMs durchgeführt, die auf gelatinegeformten Gewebechips ausgesät wurden (Abbildung 3). Das optische Mapping lieferte eine klare und detaillierte Abbildung der Ca2+ -Dynamik innerhalb des manipulierten Herzgewebes, unterstützt durch eine Hochgeschwindigkeitskamera und eine präzise Lichtstimulation. Die Ziapin2-Stimulation wurde effektiv mit einer LED-Lichtquelle erreicht, und die Gewebeproben reagierten gut auf die Stimulation bei Frequenzen von 0,5 Hz (Abbildung 4A) und 1 Hz (Abbildung 4B).
Die Photostimulation bei diesen Frequenzen induzierte die Ausbreitung von Ca2+-Wellen über das Gewebe und die longitudinalen Leitungsgeschwindigkeiten wurden berechnet, was eine gleichmäßige Ausbreitung elektrischer Signale im gesamten Gewebe bei beiden Stimulationsfrequenzen zeigte, was zu einer Geschwindigkeit von 4,5 ± 0,5 cm/s führte (Abbildung 4A,B).
Schließlich haben wir unsere Methodik mit der Goldstandard-Referenz der elektrischen Stimulation verglichen. Eine detaillierte Analyse der Ca2+ -Transienten (CaTs), wie in Abbildung 5 dargestellt, zeigte, dass Schlüsselparameter, einschließlich der CaT-Amplitude (Abbildung 5A), der Anstiegszeit (Abbildung 5B), der maximalen Abklingsteigung (Abbildung 5C) und der Abklingzeit (Abbildung 5D), zwischen den beiden Stimulationshinweisen ähnlich waren. Insgesamt lieferte der optische Kartierungsansatz hochauflösende Daten über die physiologischen Eigenschaften des biotechnologisch hergestellten laminaren Herzgewebes, was die Wirksamkeit von Ziapin2 bei der Modulation seines Verhaltens durch Lichtstimulation zeigt.

Abbildung 1: Skizze der laminaren Herzgewebsaufbereitung. (A) Abscheidung von zwei Papierbändern auf einem Acrylsubstrat. (B) Strukturierung beider Papierschichten durch Laserablation. (C) Abscheidung der Gelatine auf dem gemusterten Substrat. (D) Formen und Sintern der Gelatineschicht mit einem linienförmigen PDMS-Stempel. (E) Zellaussaat auf dem vorbereiteten Substrat. (F) Entfernen der ersten Papierschicht, um die gewünschte Geometrie zu erreichen. Abkürzung: PDMS = Polydimethylsiloxan. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Zellviabilität und -ausrichtung im biotechnologisch hergestellten laminaren Herzgewebe. (A) Einfluss der Ziapin2-Internalisierung und der Lichtexposition auf die Lebensfähigkeit von hiPSC-CMs, gemessen mit dem Alamar Blue Assay. Die Zellentauglichkeit von Strg im Dunkeln wurde auf 100 % festgelegt. Die Daten werden als Mittelwert ± Standardfehler des Mittelwerts (SEM) n = 16 pro Bedingung dargestellt. (B) Anisotropes biotechnologisch hergestelltes laminares Gewebe auf mikrogeformter Gelatine. Fluoreszenzbilder von anisotropem hiPSC-Gewebe; Maßstabsleiste = 100 μm. Die Zellen werden mit Hoechst (blau) gefärbt. (C) Durchschnittliche Orientierung (normiert auf Musterrichtung) der auf Gelatinesubstrate ausgesäten Zellen (N = 45 ROI aus 4 verschiedenen Proben, durchschnittlicher Verteilungswinkel, θMittelwert = 13,39° ± 2,67°). Abkürzungen: hiPSC-CM = human-induced pluripotent stem cell derived cardiomycyte; ROI = Region von Interesse. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
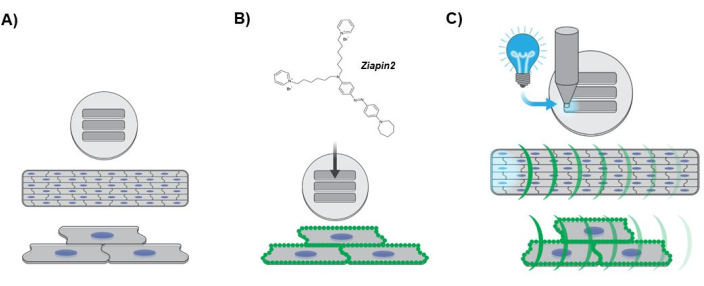
Abbildung 3: Diagramm, das das Versuchsprotokoll darstellt. (A) Bildung von anisotropem Herzgewebe. Die Zellkerne der hiPSC-CM sind blau dargestellt. (B) Internalisierung des Phototransducers in das manipulierte laminare Gewebe. Die grünen Punkte entlang des Sarkolemma deuten auf die Partitionierung der Ziapin2-Membran hin. (C) Photostimulationsprotokoll und optische Kartierung der Ca2+ -Dynamik. Das cyanfarbene Licht zeigt die optische Punktstimulation an, die an einem Ende des Gewebes mit einer LED-Lichtquelle angewendet wird. Die grünen Krümmungen stellen die Ausbreitung der Ca2+ -Welle entlang des manipulierten laminaren Gewebes dar. Abkürzungen: hiPSC-CMs = human-induced pluripotent stem cell derived cardiomycytes; LED = Leuchtdiode. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
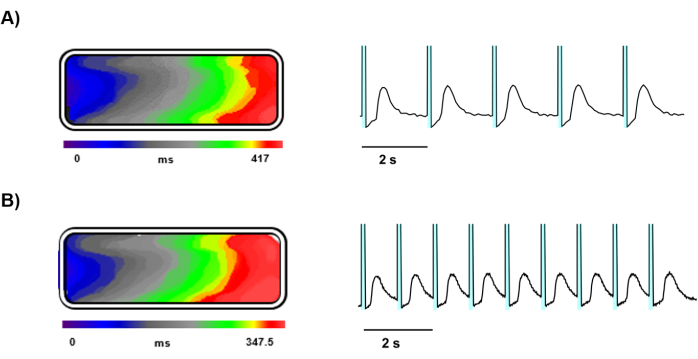
Abbildung 4: Repräsentative Aufnahmen von lichtgetriggerten Ca2+ -Wellen. Zeitverlauf, der die Ca2+ -Wellenfrontausbreitung, die Isochronenkarte und die Ca2+ -Signalspuren eines lichtstimulierten Gewebes bei (A) 0,5 Hz und (B) 1 Hz darstellt. In den repräsentativen Kurven stellt der cyanfarbene schattierte Bereich vor jedem Ca2+ -Transienten die Photoanregung dar. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
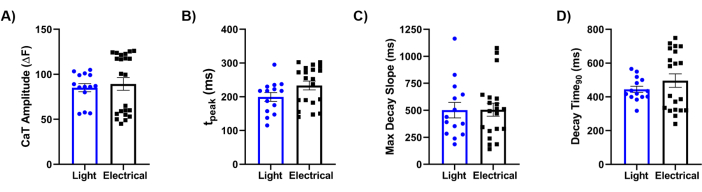
Abbildung 5: Vergleich zwischen elektrischer und optischer Stimulation. Quantifizierung von lichtinduzierten und elektrisch evozierten Ca2+ transienten (CaT) Parametern, die auf Chips aufgezeichnet wurden, die mit hiPSC-CMs bei 0,5 Hz bestückt waren. Die analysierten CaT-Merkmale waren: (A) CaT-Amplitude; (B) Anstiegszeit (tSpitze); (C) Zeit der maximalen Abklingsteigung (Max Decay Slope); und (D) Zeit bis zu 90 % transientem Abklingen (Abklingzeit90). Für jede Bedingung wurden paarweise Messungen bei 37 °C durchgeführt. Lichtstimulation N = 5 Chips, n = 14 Gewebe; elektrische Stimulation N = 8 Chips, n = 22 Gewebe. Die Daten werden als Mittelwert ± Standardfehler des Mittelwerts dargestellt. Abkürzungen: CaT = Ca2+ transient; hiPSC-CMs = human-induzierte pluripotente Stammzell-abgeleitete Kardiomyozyten. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Ergänzende Abbildung S1: Bewertung der Mikrostrukturierung auf PDMS und Gelatinesubstraten. (A) Optisches Bild eines Musters, das auf einem PDMS-Stempel realisiert wurde; Maßstabsbalken = 100 μm. (B) Optisches Bild eines mikrogeformten Gelatinesubstrats; Maßstabsleiste = 100 μm. (C) Musterprofil eines PDMS-Stempels (schwarze Linie) und einer mikrogeformten Gelatinefolie (rote Linie). Bitte klicken Sie hier, um diese Datei herunterzuladen.
Diskussion
Dieser Ansatz bietet eine robuste Plattform für die Weiterentwicklung der kardiologischen Forschung und bietet Einblicke in die komplexe Dynamik des Herzgewebes und eröffnet neue Möglichkeiten für kardiomechanistische Langzeitstudien in vitro , die möglicherweise zu neuen therapeutischen Strategien führen könnten. Um den Erfolg dieser Methode zu gewährleisten, ist es entscheidend, eine mikrophysiologische Umgebung zu reproduzieren, die die In-vivo-Bedingungen des menschlichen Herzens genau nachahmt. Daher muss sorgfältig darauf geachtet werden, das Gewebe so zu gestalten und auszurichten, dass es die natürliche Anisotropie der Herzarchitektur repliziert, die für eine ordnungsgemäße elektrische Leitung und kontraktile Funktion unerlässlich ist. Zu den kritischen Faktoren gehören das präzise Laserschneiden des Chipmusters, der Zeitpunkt der Bleichbehandlung und die Kontrolle der Viskosität der Gelatinelösung, die alle für die Erstellung gleichmäßiger Gewebeformen erforderlich sind. Darüber hinaus ist die genaue Beschichtung der Chips mit Fibronektin und GelTrex (der Basalmembranmatrix mit reduziertem Wachstumsfaktor) für eine erfolgreiche Zelladhäsion und die anschließende Gewebebildung unerlässlich.
Darüber hinaus müssen die Inkubationszeit und die Konzentration des Photoaktuators (d. h. Ziapin216,18) sorgfältig kontrolliert werden, um eine angemessene Internalisierung zu gewährleisten. Eine gründliche Reinigung von überschüssigen Molekülen ist unerlässlich, um unspezifische Effekte zu vermeiden. Es wird immer empfohlen, Viabilitätstests durchzuführen, um zu beurteilen, ob das Molekül schädliche Auswirkungen auf die Zellen hat. Wenn die Internalisierung des Photoaktors unzureichend ist, sollten Sie eine Verlängerung der Inkubationszeit oder die Verwendung einer höheren Konzentration in Betracht ziehen.
Für die Funktionsexperimente ist der richtige Aufbau der optischen Kartierungsapparatur, einschließlich der präzisen Positionierung der optischen Faser und der Kalibrierung der Stimulationsfrequenz, entscheidend für die Erfassung qualitativ hochwertiger Daten. Wenn die Aufnahmen ein hohes Rauschen aufweisen, verfeinern Sie die Größe des räumlichen Filters oder prüfen Sie, ob die optische Konfiguration falsch ausgerichtet ist.
Die Methodik des Ansatzes bietet mehrere wesentliche Vorteile; Die Entwicklung und Anwendung von ausgerichteten hiPS-CMs stellt eine bemerkenswerte Verbesserung bei der Replikation nativer kardialer Gewebeeigenschaften dar. Durch die Zellausrichtung können die Forscher die anisotrope Struktur des nativen Herzgewebes genau nachahmen, die für die Aufrechterhaltung einer ordnungsgemäßen elektrischen und mechanischen Funktion unerlässlich ist. Dies stellt sicher, dass die Kardiomyozyten in einer Weise interagieren, die den In-vivo-Bedingungen sehr ähnlich ist, wodurch physiologische Verhaltensweisen gezeigt werden, die repräsentativer für das native Herz sind.
Im Gegensatz zur elektrischen Stimulation, die eine Verdrahtung und das Vorhandensein einer Elektrode im Elektrolyten erfordert, bietet die lichtbasierte Modulation eine nicht-invasive und präzise Methode, um die elektrischen Eigenschaften bestimmter Regionen zu kontrollieren. Die Möglichkeit, das Licht in Bezug auf Intensität, Wellenlänge und Timing anzupassen, ermöglicht gezielte Eingriffe, ohne benachbarte Bereiche zu stören. Darüber hinaus ist im Gegensatz zur Optogenetik, die die genetische Veränderung von Zellen zur Expression lichtempfindlicher Kanäle oder Proteine erfordert, kein viraler Gentransfer erforderlich. Diese Aspekte sind entscheidend für Anwendungen, bei denen eine genetische Veränderung nicht möglich oder erwünscht ist. Darüber hinaus entwirrt die photostimulierende Fähigkeit von Materialien die Zell- oder Verfahrensspezifität, wodurch dieser Stimulationsansatz leicht auf verschiedene Zelltypen übertragbar ist.
Die dynamische und Echtzeit-Kontrolle des Herzgewebes ist ein weiterer Vorteil dieser Methodik. Der Einsatz von Licht ermöglicht die Echtzeit-Modulation der elektrischen Eigenschaften und bietet ein leistungsfähiges Werkzeug, um zu untersuchen, wie sich verschiedene Reize auf die Herzfunktion auswirken. Die Integration mit Ziapin2 ermöglicht die direkte Umwandlung von Licht in elektrische Signale und ermöglicht so eine präzise Steuerung von Aktionspotentialen und Rhythmus in hiPSC-CMs.
Dieser Ansatz ist auch vielversprechend für die Weiterentwicklung von Forschungsanwendungen und legt den Grundstein für die Erstellung präziser Krankheitsmodelle, insbesondere für Herzrhythmusstörungen und andere elektrische Störungen, die es Forschern ermöglichen, zelluläre Reaktionen auf verschiedene Reize oder Medikamente in einer kontrollierten Umgebung zu untersuchen. Darüber hinaus bietet es eine robuste Plattform für das Wirkstoffscreening und Toxizitätstests und bietet im Vergleich zu herkömmlichen Tiermodellen einen für den Menschen relevanteren Kontext.
In diesem Zusammenhang werden auch ethische Überlegungen berücksichtigt, da diese Technologie die Abhängigkeit von Tiermodellen reduziert und sich an den Prinzipien der 3R (Replacement, Reduction, and Refinement) orientiert. Durch die Bereitstellung eines ethischeren und potenziell prädiktiveren Modells für menschliche Herzreaktionen unterstützt es eine Verlagerung hin zu humaneren Forschungspraktiken.
Die Skalierbarkeit und Anpassung der Methode verbessert ihren Nutzen weiter. Forscher können Gewebekonstrukte an spezifische Forschungsanforderungen anpassen und Faktoren wie Zelltyp, Ausrichtung und Platzierung des Phototransducers anpassen. Darüber hinaus könnte die Methodik potenziell für größere Experimente oder Hochdurchsatzstudien skaliert werden, was sie zu einem vielseitigen Werkzeug sowohl für die Grundlagenforschung als auch für präklinische Anwendungen macht.
Schließlich ist das Potenzial der personalisierten Medizin erheblich. Durch die Ableitung von hiPS-CMs von einzelnen Patienten können Forscher patientenspezifische Herzgewebemodelle erstellen, die die Untersuchung personalisierter Reaktionen auf Medikamente oder Interventionen ermöglichen. Dies ebnet den Weg für maßgeschneiderte Behandlungsansätze in der Kardiologie und eröffnet neue Wege für die therapeutische Entwicklung.
Offenlegungen
CB, GL und FL sind Erfinder des Patents Nr. EP 3802491 (02.07.2020).
Danksagungen
Die Autoren danken Michael Rosnach für die Abbildungen in Abbildung 1 und Abbildung 3 sowie Prof. William T. Pu für die hiPSC-Versorgung. Diese Arbeit wurde unterstützt durch das NCATS Tissue Chips Consortium (UH3 TR003279) an KKP, das italienische Ministerium für Universitäten und Forschung durch das Projekt PRIN 2022 (ID 2022-NAZ-0595) an FL, das Projekt PRIN 2020 (ID 2020XBFEMS) an CB und GL und das Projekt Fondo Italiano per la Scienza (ID FIS00001244) an GL.
Materialien
| Name | Company | Catalog Number | Comments |
| alamarBlue Cell Viability Reagent | Thermo Fisher Scientific | DAL1025 | Cell Viability Assay |
| B-27 Supplement, minus insulin | Thermo Fisher Scientific | A1895601 | For cell culture |
| Bovine Serum Albumin | Sigma-Aldrich | A9056-50G | For cell staining |
| BrainVision Analyzer software | Brain Products | https://www.brainproducts.com/downloads/analyzer/ | Data export and handling |
| BTS | Sigma | 203895-5MG | |
| CHIR99021 | Stem Cell Technologies | 72054 | |
| Clear Scratch- and UV-Resistant Acrylic Sheet, 12" x 12" x 0.01 inch | McMaster Carr | 4076N11 | Tissue chip fabrication |
| Collagenase Type II | Worthington | CLS-2 / LS004176 | |
| DNase II | VWR | 89346-540 | |
| Essential 8 Medium | Thermo Fisher Scientific | A1517001 | For cell culture |
| Fibronectin | VWR | 47743-654 | Coating |
| Gelatin from porcine skin gel strength 175 Type A | Sigma-Aldrich | G2625-100G | Tissue chip fabrication |
| Geltrex LDEV-Free, hESC-Qualified, Reduced Growth Factor Basement Membrane Matrix | Thermo Fisher Scientific | A1413302 | Coating |
| HBSS | Thermo Fisher | 14175-095 | |
| HEPES (1 M) | Thermo Fisher Scientific | 15630080 | |
| Hoechst 33342 | Life technologies | H1399 | For cell staining |
| Insulin solution human | Sigma Aldrich | I9278-5ML | |
| IWR-1-endo | Stem Cell Technologies | 72564 | |
| Paraformadehyde 16% Aqueous Solution (PFA) | VWR | 100503-917 | For cell staining |
| PBS, sterile, 500 mL | Thermo Fisher Scientific | 10010049 | Tissue chip fabrication |
| phosphate buffered saline | Thermo Fisher Scientific | 10010049 | |
| Pluronic F-127 (20% Solution in DMSO) | Thermo Fisher Scientific | P3000MP | Non-ionic surfactant |
| ROCK inhibitor Y-27632 | Stem Cell Technologies | 72304 | |
| RPMI 1640 Medium, GlutaMAX Supplement | Thermo Fisher Scientific | 61870127 | For cell culture |
| RPMI 1640 Medium, no phenol red | Thermo Fisher Scientific | 11835030 | Optical mapping |
| Versene Solution | Thermo Fisher Scientific | 15040066 | chelating agent |
| VWR General-Purpose Laboratory Labeling Tape | VWR | 89098-058 | Tissue chip fabrication |
| X-Rhod-1 AM | Thermo Fisher Scientific | X14210 | Optical mapping |
Referenzen
- Di Maria, F., Lodola, F., Zucchetti, E., Benfenati, F., Lanzani, G. The evolution of artificial light actuators in living systems: from planar to nanostructured interfaces. Chem Soc Rev. 47 (13), 4757-4780 (2018).
- Manfredi, G., et al. The physics of plasma membrane photostimulation. APL Mater. 9 (3), 030901 (2021).
- Bareket-Keren, L., Hanein, Y. Novel interfaces for light directed neuronal stimulation: advances and challenges. Int J Nanomed. 9 Suppl 1 (Suppl 1), 65-83 (2014).
- Ford, S. M., Watanabe, M., Jenkins, M. W. A review of optical pacing with infrared light. J. Neural Eng. 15 (1), 011001 (2018).
- Antognazza, M. R., et al. Shedding light on living cells. Adv Mater. 27 (46), 7662-7669 (2015).
- Zhang, J., Wang, J., Tian, H. Taking orders from light: progress in photochromic bio-materials. Mater Horiz. 1 (2), 169-184 (2014).
- Deisseroth, K. Optogenetics. Nat Methods. 8 (1), 26-29 (2011).
- Ambrosi, C. M., Entcheva, E. Optogenetics' promise: pacing and cardioversion by light. Future Cardiol. 10 (1), 1-4 (2014).
- Hopkins, J., et al. Photoactive organic substrates for cell stimulation: Progress and perspectives. Adv Mater Technol. 4 (5), 1800744 (2019).
- Vurro, V., Venturino, I., Lanzani, G. A perspective on the use of light as a driving element for bio-hybrid actuation. Appl Phys Lett. 120 (8), 080502 (2022).
- Bruno, G., et al. All-optical and label-free stimulation of action potentials in neurons and cardiomyocytes by plasmonic porous metamaterials. Adv Sci. 8 (21), 2100627 (2021).
- Ronchi, C., et al. Nongenetic optical modulation of pluripotent stem cells derived cardiomyocytes function in the red spectral range. Adv Sci. 11 (3), 2304303 (2023).
- Li, P., et al. Monolithic silicon for high spatiotemporal translational photostimulation. Nature. 626 (8001), 990-998 (2024).
- Jiang, Y., et al. Nongenetic optical neuromodulation with silicon-based materials. Nat Protoc. 14 (5), 1339-1376 (2019).
- Rotenberg, M. Y., et al. Living myofibroblast-silicon composites for probing electrical coupling in cardiac systems. Proc Natl Acad Sci USA. 116 (45), 22531-22539 (2019).
- DiFrancesco, M. L., et al. Neuronal firing modulation by a membrane-targeted photoswitch. Nat Nanotechnol. 15 (4), 296-306 (2020).
- Paternò, G. M., et al. Membrane environment enables ultrafast isomerization of amphiphilic azobenzene. Adv Sci. 7 (8), 1903241 (2020).
- Vurro, V., et al. Molecular design of amphiphilic plasma membrane-targeted azobenzenes for nongenetic optical stimulation. Front Mater. 7, 631567 (2021).
- Vurro, V., et al. Optical modulation of excitation-contraction coupling in human-induced pluripotent stem cell-derived cardiomyocytes. iScience. 26 (3), 106121 (2023).
- Vurro, V., et al. Light-triggered cardiac microphysiological model. APL Bioeng. 7 (2), 026108 (2023).
- Florindi, C., et al. Role of stretch-activated channels in light-generated action potentials mediated by an intramembrane molecular photoswitch. J. Transl. Med. 22 (1), 1068 (2024).
- McCain, M. L., Agarwal, A., Nesmith, H. W., Nesmith, A. P., Parker, K. K. Micromolded gelatin hydrogels for extended culture of engineered cardiac tissues. Biomaterials. 35 (21), 5462-5471 (2014).
- Park, S. -. J., et al. Insights into the pathogenesis of catecholaminergic polymorphic ventricular tachycardia from engineered human heart tissue. Circulation. 140 (5), 390-404 (2019).
- Lee, K. Y., et al. An autonomously swimming biohybrid fish designed with human cardiac biophysics. Science. 375 (6581), 639-647 (2022).
- Lian, X., et al. Directed cardiomyocyte differentiation from human pluripotent stem cells by modulating Wnt/β-catenin signaling under fully defined conditions. Nat Protoc. 8 (1), 162-175 (2013).
- Prondzynski, M., et al. Efficient and reproducible generation of human iPSC-derived cardiomyocytes and cardiac organoids in stirred suspension systems. Nat Commun. 15 (1), 5929 (2024).
- Pasqualini, F. S., Sheehy, S. P., Agarwal, A., Aratyn-Schaus, Y., Parker, K. K. Structural phenotyping of stem cell-derived cardiomyocytes. Stem Cell Rep. 4 (3), 340-347 (2015).
- Fonck, E., et al. Effect of aging on elastin functionality in human cerebral arteries. Stroke. 40 (7), 2552-2556 (2009).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten