Method Article
Um sistema microfisiológico cardíaco para estudar a propagação de Ca2+ via estimulação óptica não genética
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
O uso da luz para controlar células e tecidos cardíacos permite a estimulação sem contato, preservando assim o estado natural e a função das células, tornando-se uma abordagem valiosa tanto para pesquisa básica quanto para aplicações terapêuticas.
Resumo
Os modelos microfisiológicos cardíacos in vitro são altamente confiáveis para pesquisa científica, desenvolvimento de medicamentos e aplicações médicas. Embora amplamente aceitos pela comunidade científica, esses sistemas ainda são limitados em longevidade devido à ausência de técnicas de estimulação não invasivas. Os fototransdutores fornecem um método de estimulação eficiente, oferecendo uma abordagem sem fio com alta resolução temporal e espacial, minimizando a invasividade nos processos de estimulação. Neste manuscrito, apresentamos um método totalmente óptico para estimular e detectar a atividade de um modelo microfisiológico cardíaco in vitro. Especificamente, fabricamos tecidos anisotrópicos laminares projetados semeando cardiomiócitos derivados de células-tronco pluripotentes induzidos por humanos (hiPSC-CMs) gerados em uma cultura de suspensão de biorreator 3D. Empregamos um fototransdutor, um derivado anfifílico de azobenzeno, denominado Ziapin2, para estimulação e um corante Ca2+ (X-Rhod 1) para monitorar a resposta do sistema. Os resultados demonstram que o Ziapin2 pode fotomodular as respostas de Ca2+ no sistema empregado sem comprometer a integridade, viabilidade ou comportamento do tecido. Além disso, mostramos que a abordagem de estimulação baseada em luz oferece uma resolução semelhante em comparação com a estimulação elétrica, o padrão-ouro atual. No geral, este protocolo abre perspectivas promissoras para a aplicação de Ziapin2 e fotoestimulação baseada em materiais na pesquisa cardíaca.
Introdução
O uso da luz para estimular células e tecidos vivos está emergindo como um divisor de águas significativo na pesquisa biomédica, oferecendo recursos de estimulação sem toque com resolução temporal e espacial precisa 1,2,3,4,5,6. Uma das principais técnicas usadas para tornar as células sensíveis à luz é a optogenética, que envolve a modificação genética de células para expressar canais iônicos sensíveis à luzou bombas 7,8. Essa abordagem demonstrou uma eficácia impressionante na regulação de células dentro do tecido vivo; no entanto, sua dependência da transferência de genes virais impediu sua ampla adoção em pesquisas e aplicações clínicas.
Para superar essa limitação, materiais orgânicos e inorgânicos têm sido usados como transdutores sensíveis à luz para desenvolver técnicas de estimulação mediada por luz não genéticas baseadas em materiais 9,10. Fototransdutores nanoestruturados orgânicos 11,12,13,14,15 demonstraram recentemente um sucesso notável no desencadeamento de respostas celulares em diversas aplicações, incluindo neurônios, cardiomiócitos e células musculares esqueléticas.
Aqui, propomos Ziapin216,17,18, um derivado do azobenzeno, para investigar a propagação de Ca2+ em tecidos cardíacos laminares projetados. A estrutura anfifílica da molécula permite o direcionamento preciso da membrana plasmática celular, enquanto o núcleo de azobenzeno permite a isomerização induzida pela luz, levando à sua mudança conformacional16 , 17 , 18 . Nas células cardíacas, essa isomerização trans-to-cis altera a espessura da membrana plasmática, induzindo uma cascata de efeitos que gera um potencial de ação, que por sua vez desencadeia o processo de excitação-contração 19,20,21.
Além disso, descrevemos o processo de fabricação de uma plataforma projetada para o crescimento anisotrópico do tecido cardíaco22 e detalhamos a configuração experimental usada para desencadear e monitorar opticamente sua atividade, com foco particular na aquisição da dinâmica de Ca2+ dentro do tecido23,24. Por fim, comparamos os sinais adquiridos com os obtidos por meio de estimulação elétrica, que é considerada o padrão de referência. No geral, este protocolo destaca a aplicação de um novo transdutor responsivo à luz no avanço de nossa compreensão do comportamento celular cardíaco, especialmente no contexto de tecidos projetados.
Protocolo
A cultura de células-tronco pluripotentes humanas (hiPSC) usada é uma linha de iPSC masculina humana de tipo selvagem que abriga um sistema CRISPR/Cas9 induzível por doxiciclina (Dox), criado pela introdução de CAGrtTA::TetO-Cas9 no locus AAVS1 (Addgene: #73500). O estudo foi conduzido de acordo com os protocolos aprovados pelo Conselho de Revisão Institucional do Hospital Infantil de Boston. O consentimento informado foi obtido dos pacientes antes de sua participação no estudo. A geração de cardiomiócitos derivados de hiPSC (hiPSC-CMs) foi induzida conforme descrito anteriormente 25,26. O protocolo será brevemente resumido na seção a seguir:
1. Geração e preparação de cardiomiócitos derivados de células-tronco pluripotentes induzidas por humanos
- Lave os hiPSCs cultivados em frascos T75 uma vez com PBS. Separe as células incubando com o agente quelante Versene por 10-15 min e semeie em vasos de biorreator pré-tratados com solução a 1% de surfactante não iônico a uma densidade de 50 milhões de IPSCs / vaso em 100 mL de meio E8 suplementado com 10 μM de inibidor de ROCK Y-27632.
- Defina os seguintes parâmetros do biorreator: agitação 60 rpm, temperatura 37 °C, pH 7 e gaseificação de sobreposição (O2 e CO2) a 3 L/h padrão.
- Após 1 dia em cultura, confirme se o diâmetro do corpo embrióide (EB) atingiu 100-300 μm e trate as células com meio RPMI básico (meio RPMI 1640 suplementado com B27 menos insulina), contendo 7 μM CHIR99021 por 24 h, seguido de mudança de meio para RPMI por mais 24 h. Adicione o meio RPMI básico contendo 5 μM de IWR-1-endo por mais 48 h para iniciar o processo de diferenciação em direção à linhagem cardíaca. Após 48 h, altere o meio de volta para RPMI básico.
- No dia 7 de diferenciação, cultive células em um meio RPMI básico suplementado com insulina humana 1:1.000 (v/v). Atualize a mídia a cada 2 dias ou todos os dias com uma mudança de 50% no meio se o consumo de oxigênio atingir mais de 30%.
- No dia 15, dissocie enzimaticamente as células do biorreator por 3 h usando uma solução de colagenase II contendo HBSS, colagenase II (200 unidades / mL), HEPES (10 mM), inibidor de ROCK Y-27632 (10 μM) e N-benzil-p-toluenossulfonamida (BTS, 30 μM). Para fazer isso, primeiro lave os EBs hiPSC-CM diferenciados 2x com HBSS pré-aquecido e incube-os em solução de colagenase II (volume de 200 μl de EBs / 12 ml de solução de colagenase II) a 37 ° C em 5% de CO2 até que células únicas apareçam da dissociação completa de EB.
- Pare a reação de dissociação adicionando um volume igual de tampão de bloqueio (RPMI-1640 sem B27 e DNase II, com 6 μL de DNase II por mL de RPMI-1640) à suspensão de célula única. Conte os hiPSC-CMs diferenciados, centrifugue (200 × g, 5 min) e prepare-se para aplicações a jusante, congelando as células a -80 ° C em isopropanol por 24 h e movendo-as para tanques de nitrogênio líquido até que a semeadura seja realizada.
2. Fabricação laminar projetada do tecido
- Cole duas camadas de fita de laboratório, uma branca e outra azul, em uma folha de acrílico transparente de 1 mm de espessura, resistente a arranhões e UV. Usando um gravador a laser CO2 , corte a folha de acrílico em círculos (20 mm de diâmetro para caber nos 12 MW) e o padrão de chip (quadrados de 3 x 7,5 mm, três por chip) na fita conforme projetado em software de gráficos vetoriais (por exemplo, CorelDraw); parâmetros de corte de acrílico: 100 potências, 20 velocidades e 1.000 PPI; parâmetros de corte de fita: 8 potências, 6 velocidades e 1.000 PPI. Remova as duas camadas de fita dentro da linha mais interna usando uma pinça, mergulhe os cavacos em alvejante puro por 30 min a 1 h para remover linhas grossas e manchas escuras do corte, deixando uma linha afiada, e enxágue os cavacos em um copo com água deionizada corrente (DI) durante a noite ou por pelo menos 3 h.
NOTA: Não use alvejante por mais de 2 h, pois isso gravará os adesivos nas paredes laterais, impedindo que a gelatina adira adequadamente. - Sonicate os cavacos por 10 min e os selos de polidimetilsiloxano (PDMS, Sylgard 184) com características de ranhura de linha (largura de sulco de 25 μm, largura de sulco de 4 μm e profundidade de sulco de 5 μm) por 30 min em etanol limpo a 70%. Transfira as fichas e carimbos para uma área limpa sob um capuz e deixe-os secar sob o fluxo de ar por ~ 1-2 h.
- Pese 1 g de gelatina de pele suína (força do gel ~ 175 g Bloom, Tipo A) em um tubo de 50 mL. Adicione 5 mL de solução salina tamponada com fosfato (PBS) e misture bem para garantir a dissolução imediata da gelatina. Coloque o tubo em banho-maria a 65 °C por 30 minutos para completar o processo de dissolução. Da mesma forma, pesar 1 g de transglutaminase microbiana (MTG) em um tubo separado de 50 mL. Adicione 12,5 ml de PBS, misture bem e coloque o tubo num banho-maria a 37 °C durante 30 minutos para garantir a dissolução total do MTG.
- Sonicar o tubo de gelatina durante 15 min e, em seguida, voltar a colocá-lo em banho-maria a 65 °C antes de utilizar. Coloque o tubo MTG em um dessecador com a tampa ligeiramente solta e ligue o aspirador lentamente. Observe as bolhas sendo removidas da solução MTG sob vácuo. Após a desgaseificação, retorne o tubo MTG ao banho-maria a 37 °C.
NOTA: Monitore o processo e ajuste o vácuo para evitar fervura vigorosa. - Cubra uma folha de grade com parafilme limpo, coloque as fichas na grade e mantenha o carimbo por perto, pronto para uso. Adicione 5 mL de MTG aos 5 mL de solução de gelatina, pipetando cuidadosamente para evitar bolhas; em seguida, pipete rapidamente a gelatina no chip, usando o suficiente para cobrir a área do chip (aproximadamente 0,5 mL cada). Em seguida, coloque o carimbo PDMS22 com padrão de linha (largura da linha 25 μm, altura 5 μm, espaçamento 4 μm) no topo e aplique um peso de 200 g para garantir que a gelatina seja padronizada paralelamente ao eixo longitudinal do tecido. Depois que todos os chips estiverem moldados, cubra-os com uma jarra de vidro para evitar distúrbios ambientais e deixe-os reticular durante a noite.
NOTA: Use a solução misturada de gelatina-MTG dentro de 5 min; caso contrário, o padrão alvo será alterado devido a um estado reticulado mais alto da gelatina. - Transfira o chip e o sanduíche de carimbo PDMS para um novo prato P150 cheio de PBS e hidrate a gelatina por 30 min a 1 h para facilitar a separação do carimbo PDMS do chip. Remova qualquer excesso de gelatina não moldada ao redor do chip e transfira o chip limpo para um novo prato P150 cheio de PBS. Armazene os selos PDMS em etanol 70%.
- Esterilize os chips mergulhando-os em etanol por 10 min sob o capô.
NOTA: Não exceda 10 min em etanol, pois uma exposição mais longa pode deformar a gelatina. - Transfira as batatas fritas para PBS, deixe de molho por 10 min e enxágue 3x. Prepare as soluções de revestimento misturando 20 μg / mL de fibronectina com matriz de membrana basal diluída 1:100 em meio de cultura (aproximadamente 0,5 mL por poço). Cubra os cavacos por 2 h na incubadora a 37 °C e 5% de CO2 ou a 4 °C durante a noite.
- Descongele e semeie células (8 ×10 5 hiPSC-CMs por cm2) em meio RPMI com Y-27632 (10 μM) e, em seguida, substitua-o por RPMI sem Y-27632 após 24 horas.
- Três dias após a semeadura celular, remova a fita branca usando uma pinça.
3. Síntese e aplicação do fototransdutor
NOTA: Ziapin2 foi sintetizado de acordo com um procedimento publicado anteriormente 16,18 e foi administrado a hiPSC-CMs diretamente no meio de cultura.
- Adicione 25 μM de Ziapin2 à cultura celular e incube a 37 °C e 5% de CO2 por 7 min.
- Lave suavemente o excesso de moléculas e enxágue com meio de cultura fresco.
4. Ensaio de viabilidade
NOTA: Alamar Blue é um ensaio à base de resazurina que pode permear as células e atuar como um indicador redox para monitorar a viabilidade celular. A resazurina se dissolve em tampões fisiológicos, resultando em uma solução azul profunda que é adicionada diretamente às células em cultura. Células viáveis com metabolismo ativo reduzem a resazurina a resofurina, que é rosa e fluorescente.
- Células da placa em uma placa de 96 poços previamente revestidas com 20 μg/mL de fibronectina e matriz de membrana basal diluída 1:100 em meio de cultura. Misture agitando e, em seguida, adicione Alamar Blue assepticamente a cada poço em uma quantidade igual a 10% do volume do poço.
- Incube culturas com Alamar Blue por 4 h.
- Trate as células com o fototransdutor e veículo (DMSO) conforme descrito anteriormente. Aplique estimulação de luz (luz pulsada de 1 Hz por 1 min) através de uma fibra óptica (ciano, 470 nm) para avaliar o efeito da internalização de Ziapin2 e exposição à luz na viabilidade de hiPSC-CM.
- Leia a fluorescência com um leitor de placas com excitação de 560 nm e emissão de 590 nm.
5. Avaliação da anisotropia do tecido cardíaco laminar projetada
NOTA: Este protocolo descreve uma abordagem sistemática para avaliar a anisotropia do tecido cardíaco laminar projetado usando imunocoloração, microscopia confocal e análise de núcleos27.
- Lave o substrato com PBS várias vezes antes da fixação com paraformaldeído a 4% (v/v) contendo 0,05% (v/v) de Triton X-100 em PBS por 10 min.
- Bloqueie a ligação não específica incubando amostras com albumina de soro bovino (BSA) a 5% (p / v) em PBS por 30 min.
- Incubar amostras com Hoechst (1:500) à temperatura ambiente durante 1 h.
- Lave com PBS antes de montar em lâminas de microscópio com um agente anti-desbotamento. Deixar secar as lâminas durante a noite e conservá-las a 4 °C até à obtenção de imagens.
- Amostras de imagens usando um microscópio confocal de disco giratório com ampliação de 20x. Determine a orientação das células usando o OrientationJ Measure28, um plug-in FiJi.
6. Gravações de mapeamento óptico
NOTA: O mapeamento óptico foi realizado após 5 dias em cultura em hiPSC-CMs semeados em chips de tecido moldados em gelatina.
- Para seguir este protocolo, certifique-se de que o aparelho de mapeamento óptico consiste em um microscópio de lente tandem modificado equipado com uma câmera de alta velocidade e a fonte de luz de excitação, uma lâmpada de mercúrio de 200 mW. Colocar um espelho dicróico à frente da câmara de imagem de Ca2+ designada para garantir que a preparação é exposta à luz de excitação e para recolher a fluorescência emitida proveniente da amostra.
- Incubar a amostra com 2 μM de X-Rhod 1 adicionados ao meio de cultura durante 30 min a 37 °C.
NOTA: Exponha a amostra à luz apenas durante a aquisição da imagem para evitar o fotobranqueamento do corante. - Incubar o fototradutor conforme descrito anteriormente na secção 3.
- Lave com meio de cultura fresco e transfira os chips para o meio RPMI 1640 sem vermelho de fenol suplementado com B27 menos insulina.
- Coloque as fichas de tecido em um prato com temperatura controlada e inicie as gravações em temperatura fisiológica (37 ° C), adquirindo imagens a uma taxa de quadros de 2,5 quadros / s.
- Para estimulação óptica, aplique a estimulação do ponto óptico em uma extremidade do tecido usando uma fonte de luz LED (465/25 nm) permitindo a estimulação do Ziapin2. Estimule os tecidos na frequência de 0.5 ou 1 Hz por meio de uma fibra óptica regulada temporalmente posicionada a 1 mm de distância do tecido. Para estimulação elétrica, aplique uma estimulação pontual usando um eletrodo de platina bipolar posicionado no centro da extremidade mais distal do tecido retangular. Esse posicionamento garante que a propagação da onda Ca2+ se origine do ponto médio da largura do tecido, que corresponde ao lado mais curto do retângulo. A estimulação deve ser aplicada na frequência de 0,5 Hz, com amplitude de 10 V e duração do pulso de 100 ms.
- Após as gravações, aplique um filtro espacial com um tamanho de pixel de 3 x 3 para melhorar a relação sinal-ruído.
- Determine a velocidade de condução da onda Ca2+ em cada pixel para cada pulso, calculando a taxa de mudança ao longo das direções x e y. Para fazer isso, meça o gradiente espacial da intensidade do sinal de Ca2+ nessas direções e relacione-o com o atraso de tempo de propagação do sinal. Ao combinar essas taxas de mudança direcional, quantifique a rapidez com que a onda viaja pelo campo celular em ambas as dimensões.
7. Exportação e tratamento de dados
- Extraia e analise os dados com o software referenciado.
- Aplique um filtro espacial de 3 x 3 pixels para melhorar a relação sinal-ruído.
- Extraia os traços de transientes de Ca2+ (CaT) como a média de uma região de interesse (ROI) específica selecionada manualmente.
- Meça os parâmetros CaT em uma região central de interesse (ROI) de 50 x 50 pixels (≈ 25 mm2).
- Para cada CaT, analise a amplitude do CaT, o tempo de subida(pico t), o tempo de inclinação máxima de decaimento (Max Decay Slope) e o tempo para 90% de decaimento transitório (Decay Time90).
8. Análise estatística
- Avaliar a normalidade da distribuição utilizando um teste estatístico adequado, como um teste de normalidade, para determinar se devem ser aplicados métodos paramétricos ou não paramétricos.
- Avalie a significância estatística entre duas condições usando o teste t de Student ou o teste U de Mann-Whitney para dados contínuos ou categóricos, respectivamente. Ao comparar mais de dois grupos, use ANOVA de uma via ou o teste de Kruskal-Wallis, dependendo das suposições dos dados, seguido por testes post-hoc apropriados para identificar diferenças significativas entre pares.
Resultados
Um processo de várias etapas foi desenvolvido e implementado para a fabricação de tecido cardíaco laminar projetado usando uma combinação de padronização a laser, moldagem de gelatina e técnicas de semeadura celular. Originalmente estabelecida por McCain et al.22 e Lee et al.24, essa técnica foi reimplementada, seguindo seus protocolos para construir os microtecidos laminares projetados. O processo integra padrões precisos baseados em laser para orientação estrutural, gelatina como material de andaime e semeadura celular controlada para criar um ambiente de tecido biomimético. (Figura 1).
A deposição de substratos de papel envolveu a adesão de duas camadas de fita adesiva de laboratório, uma branca e outra azul, a um substrato acrílico de 1 mm de espessura, fornecendo uma base robusta para as etapas subsequentes e permitindo visualização e manipulação precisas durante o processo de fabricação (Figura 1A). A padronização a laser foi empregada para obter a geometria desejada do chip nos substratos, com parâmetros otimizados garantindo uma ablação precisa sem danificar a base de acrílico (Figura 1B). A remoção seletiva de camadas de fita expôs regiões específicas do substrato para processamento posterior. Uma solução de gelatina, preparada a partir de pele suína e reticulada com transglutaminase microbiana, foi então depositada na superfície acrílica padronizada para criar uma camada biocompatível adequada para a adesão celular (Figura 1C). Essa camada de gelatina foi moldada usando um carimbo PDMS com padrões de ranhuras de linha, garantindo o alinhamento com o eixo longitudinal do tecido, e reticulada durante a noite para produzir um substrato estável e padronizado (Figura 1D e Figura Suplementar S1).
Cardiomiócitos derivados de células-tronco pluripotentes induzidos por humanos (hiPSC-CMs) foram semeados no substrato pré-revestido a uma densidade de aproximadamente 8 × 105 células/cm2 (Figura 1E). As condições de cultivo foram otimizadas com atualização diária do meio para apoiar o crescimento celular. Após 3 dias, a camada de fita branca foi removida para expor a superfície padronizada da gelatina (Figura 1F), garantindo o confinamento preciso das células a regiões específicas do substrato, facilitando o desenvolvimento de tecido laminar de bioengenharia com configurações geométricas desejadas. A viabilidade e o alinhamento dos hiPSC-CMs no tecido de bioengenharia foram posteriormente avaliados.
O impacto da internalização da Ziapin2 seguida de exposição à luz na viabilidade celular foi avaliado usando o ensaio AlamarBlue. Os resultados relatados na Figura 2A indicaram que a ziapina2, quando internalizada na concentração de 25 μM e seguida de estimulação luminosa de 470 nm, não afetou adversamente a viabilidade celular, confirmando a compatibilidade dessa abordagem de fototransdutor com células vivas.
A anisotropia dentro do tecido laminar de bioengenharia foi alcançada conforme pretendido, com imagens de fluorescência mostrando alinhamento celular significativo ao longo dos sulcos padronizados do substrato de gelatina micromoldado (Figura 2B). A orientação celular, evidente a partir das imagens de fluorescência, foi avaliada quantitativamente empregando o plugin FiJi OrientationJ28. A orientação foi avaliada pelo processamento das imagens de fluorescência de Hoechst, resultando em um ângulo médio igual a θmédia = 13,39 ± 2,67°. O ângulo indica a orientação normalizada para a direção do padrão, mostrando um alto grau de anisotropia no tecido. A distribuição angular medida, bem como o baixo valor medido do desvio padrão, sugere uma forte preferência direcional na estrutura do tecido (Figura 2C). Isso demonstrou a formação de tecido cardíaco anisotrópico, que é fundamental para mimetizar a arquitetura natural necessária para o desempenho funcional adequado, como contração coordenada e condução elétrica.
Após 5 dias em cultura, o mapeamento óptico foi realizado em hiPSC-CMs carregados com Ziapin2 semeados em chips de tecido moldados em gelatina (Figura 3). O mapeamento óptico forneceu imagens claras e detalhadas da dinâmica do Ca2+ dentro do tecido cardíaco projetado, facilitado por uma câmera de alta velocidade e estimulação de luz precisa. A estimulação com Ziapin2 foi efetivamente alcançada usando uma fonte de luz LED, e as amostras de tecido responderam bem à estimulação nas frequências de 0,5 Hz (Figura 4A) e 1 Hz (Figura 4B).
A fotoestimulação nessas frequências induziu a propagação de ondas Ca2+ através do tecido e as velocidades de condução longitudinal foram calculadas, mostrando propagação uniforme de sinais elétricos por todo o tecido em ambas as frequências de estimulação e resultando igual a 4,5 ± 0,5 cm/s (Figura 4A,B).
Por fim, comparamos nossa metodologia com a referência padrão-ouro de estimulação elétrica. Uma análise detalhada dos transientes de Ca2+ (CaTs), conforme ilustrado na Figura 5, revelou que os principais parâmetros, incluindo amplitude de CaT (Figura 5A), tempo de subida (Figura 5B), inclinação máxima de decaimento (Figura 5C) e tempo de decaimento (Figura 5D), foram semelhantes entre as duas pistas de estimulação. No geral, a abordagem de mapeamento óptico forneceu dados de alta resolução sobre as propriedades fisiológicas do tecido cardíaco laminar de bioengenharia, demonstrando a eficácia do Ziapin2 na modulação de seu comportamento por meio de estimulação luminosa.

Figura 1: Esboço do preparo do tecido cardíaco laminar. (A) Deposição de duas fitas de papel em um substrato acrílico. (B) Padronização de ambas as camadas de papel por ablação a laser. (C) Deposição da gelatina no substrato padronizado. (D) Moldagem e sinterização da camada de gelatina por um carimbo PDMS com padrão de linha. (E) Semeadura celular no substrato preparado. (F) Remoção da primeira camada de papel que atinge a geometria necessária. Abreviatura: PDMS = polidimetilsiloxano. Clique aqui para ver uma versão maior desta figura.

Figura 2: Viabilidade e alinhamento celular no tecido cardíaco laminar de bioengenharia. (A) Efeito da internalização de Ziapin2 e exposição à luz na viabilidade de hiPSC-CMs medida com o ensaio Alamar Blue. A viabilidade celular de Ctrl no escuro foi definida como 100%. Os dados são representados como média ± erro padrão da média (EPM) n = 16 para cada condição. (B) Tecido laminar anisotrópico de bioengenharia em gelatina micromoldada. Imagens de fluorescência do tecido hiPSC anisotrópico; barra de escala = 100 μm. As células são coradas com Hoechst (azul). (C) Orientação média (normalizada para a direção do padrão) das células semeadas em substratos de gelatina (N = 45 ROI provenientes de 4 amostras diferentes, ângulo médio da distribuição, θmédia = 13,39° ± 2,67°). Abreviaturas: hiPSC-CM = cardiomiócito derivado de células-tronco pluripotentes induzido por humanos; ROI = região de interesse. Clique aqui para ver uma versão maior desta figura.
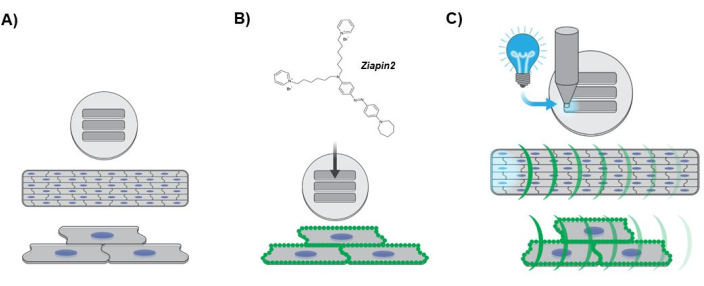
Figura 3: Diagrama representando o protocolo experimental. (A) Formação de tecido cardíaco anisotrópico. Os núcleos hiPSC-CMs são representados em azul. (B) Internalização do fototransdutor no tecido laminar projetado. Os pontos verdes ao longo do sarcolema indicam partição da membrana Ziapin2. (C) Protocolo de fotoestimulação e mapeamento óptico dinâmico de Ca2+ . A luz ciano indica a estimulação do ponto óptico aplicada em uma extremidade do tecido usando uma fonte de luz LED. As curvaturas verdes representam a propagação da onda Ca2+ ao longo do tecido laminar projetado. Abreviaturas: hiPSC-CMs = cardiomiócitos derivados de células-tronco pluripotentes induzidas por humanos; LED = diodo emissor de luz. Clique aqui para ver uma versão maior desta figura.
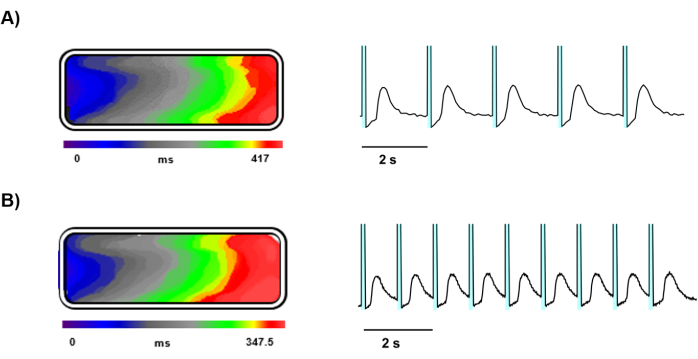
Figura 4: Gravações representativas de ondas de Ca2+ desencadeadas por luz. Curso de tempo representando a propagação da frente de onda de Ca2+ , mapa isócrono e traços de sinal de Ca2+ de um tecido estimulado por luz em (A) 0,5 Hz e (B) 1 Hz. Nos traços representativos, a área sombreada ciano antes de cada transiente de Ca2+ representa a fotoexcitação. Clique aqui para ver uma versão maior desta figura.
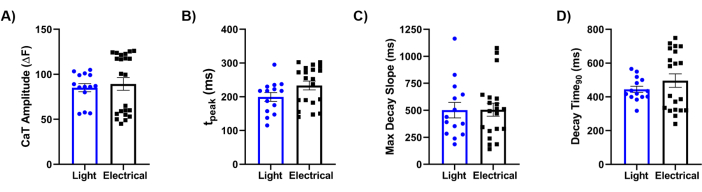
Figura 5: Comparação entre estimulação elétrica e óptica. Quantificação de parâmetros transitórios (CaT) de Ca2+ induzidos por luz e evocados eletricamente registrados em chips semeados com hiPSC-CMs a 0,5 Hz. As características do CaT analisadas foram (A) amplitude do CaT; (B) tempo de subida (tpico); (C) tempo de declive máximo (Max Decay Slope); e (D) tempo para 90% de decaimento transitório (Decay Time90). Medições pareadas foram realizadas a 37 °C para cada condição. Estimulação de luz N = 5 chips, n = 14 tecidos; estimulação elétrica N = 8 chips, n = 22 tecidos. Os dados são representados como média ± erro padrão da média. Abreviaturas: CaT = Ca2+ transiente; hiPSC-CMs = cardiomiócitos derivados de células-tronco pluripotentes induzidas por humanos. Clique aqui para ver uma versão maior desta figura.
Figura Suplementar S1: Avaliação de micropadronização em PDMS e substratos de gelatina. (A) Imagem óptica de um padrão realizado em um carimbo PDMS; barra de escala = 100 μm. (B) Imagem óptica de um substrato de gelatina micromoldada; barra de escala = 100 μm. (C) Perfil padrão de um carimbo PDMS (linha preta) e filme de gelatina micromoldado (linha vermelha). Clique aqui para baixar este arquivo.
Discussão
Essa abordagem fornece uma plataforma robusta para o avanço da pesquisa cardíaca, fornecendo insights sobre a complexa dinâmica do tecido cardíaco, abrindo novas possibilidades para estudos mecanísticos cardíacos in vitro de longo prazo que podem levar a novas estratégias terapêuticas. Para garantir o sucesso dessa metodologia, é crucial reproduzir um ambiente microfisiológico que mimetize de perto as condições in vivo do coração humano. Portanto, deve-se prestar muita atenção ao projeto e alinhamento do tecido para replicar a anisotropia natural da arquitetura cardíaca, que é vital para a condução elétrica adequada e a função contrátil. Os fatores críticos incluem o corte a laser preciso do padrão de cavacos, o momento do tratamento com alvejante e o controle da viscosidade da solução de gelatina, todos necessários para criar moldes de tecido uniformes. Além disso, revestir com precisão os chips com fibronectina e GelTrex (a matriz da membrana basal do fator de crescimento reduzido) é essencial para a fixação bem-sucedida das células e subsequente formação de tecidos.
Além disso, o tempo de incubação e a concentração do fotoatuador (ou seja, Ziapin216,18) devem ser cuidadosamente controlados para garantir a internalização adequada. A lavagem completa do excesso de moléculas é essencial para evitar efeitos inespecíficos. É sempre recomendável realizar ensaios de viabilidade para avaliar se a molécula tem algum efeito prejudicial nas células. Se a internalização do fotoatuador for inadequada, considere estender o tempo de incubação ou usar uma concentração mais alta.
Para os experimentos funcionais, a configuração adequada do aparelho de mapeamento óptico, incluindo o posicionamento preciso da fibra óptica e a calibração da frequência de estimulação, é crucial para capturar dados de alta qualidade. Se as gravações mostrarem altos níveis de ruído, refine o tamanho do filtro espacial ou verifique se há algum desalinhamento na configuração óptica.
A metodologia de abordagem apresenta várias vantagens significativas; o desenvolvimento e a aplicação de hiPSC-CMs alinhados representam uma melhoria notável na replicação das características do tecido cardíaco nativo. Pelo alinhamento celular, os pesquisadores podem imitar de perto a estrutura anisotrópica do tecido cardíaco nativo, o que é essencial para manter a função elétrica e mecânica adequada. Isso garante que os cardiomiócitos interajam de uma maneira que se assemelha às condições in vivo , exibindo assim comportamentos fisiológicos mais representativos do coração nativo.
Ao contrário da estimulação elétrica, que requer fiação e a presença de eletrodo no eletrólito, a modulação baseada em luz oferece um método não invasivo e preciso para controlar as propriedades elétricas de regiões específicas. A capacidade de ajustar a luz em termos de intensidade, comprimento de onda e tempo facilita intervenções direcionadas sem interromper as áreas adjacentes. Além disso, ao contrário da optogenética, que requer a modificação genética das células para expressar canais ou proteínas sensíveis à luz, não requer transferência de genes virais. Esses aspectos são cruciais para aplicações em que a modificação genética não é viável ou desejada. Além disso, a capacidade fotoestimulante dos materiais desembaraça a especificidade da célula ou do procedimento, tornando essa abordagem de estimulação facilmente transferível para diferentes tipos de células.
O controle dinâmico e em tempo real do tecido cardíaco é outra vantagem dessa metodologia. O uso da luz permite a modulação em tempo real das propriedades elétricas, fornecendo uma ferramenta poderosa para investigar como diferentes estímulos afetam a função cardíaca. A integração com o Ziapin2 permite a conversão direta de luz em sinais elétricos, permitindo um controle preciso sobre os potenciais de ação e o ritmo em hiPSC-CMs.
Essa abordagem também é promissora para o avanço das aplicações de pesquisa, lançando as bases para a criação de modelos precisos de doenças, particularmente para arritmias cardíacas e outros distúrbios elétricos, permitindo que os pesquisadores estudem as respostas celulares a vários estímulos ou drogas em um ambiente controlado. Além disso, oferece uma plataforma robusta para triagem de drogas e testes de toxicidade, fornecendo um contexto mais relevante para o ser humano em comparação com os modelos animais tradicionais.
Nesse sentido, também são abordadas considerações éticas, pois essa tecnologia reduz a dependência de modelos animais, alinhando-se aos princípios dos 3Rs (Substituição, Redução e Refinamento). Ao fornecer um modelo mais ético e potencialmente preditivo para as respostas cardíacas humanas, ele apóia uma mudança para práticas de pesquisa mais humanas.
A escalabilidade e a personalização do método aumentam ainda mais sua utilidade. Os pesquisadores podem adaptar as construções de tecido às necessidades específicas de pesquisa, ajustando fatores como tipo de célula, alinhamento e posicionamento do fototransdutor. Além disso, a metodologia pode ser potencialmente dimensionada para experimentos maiores ou estudos de alto rendimento, tornando-a uma ferramenta versátil para pesquisa básica e aplicações pré-clínicas.
Finalmente, o potencial para a medicina personalizada é significativo. Ao derivar hiPSC-CMs de pacientes individuais, os pesquisadores podem criar modelos de tecido cardíaco específicos do paciente, permitindo o estudo de respostas personalizadas a medicamentos ou intervenções. Isso abre caminho para abordagens de tratamento personalizadas em cardiologia, oferecendo novos caminhos para o desenvolvimento terapêutico.
Divulgações
CB, GL e FL são inventores da patente "COMPOSTOS FOTOCRÔMICOS" nº. 3802491 do Parlamento Europeu (02/07/2020).
Agradecimentos
Os autores agradecem a Michael Rosnach pelas ilustrações na Figura 1 e Figura 3, e ao Prof. William T. Pu pelo fornecimento de hiPSC. Este trabalho foi apoiado pelo NCATS Tissue Chips Consortium (UH3 TR003279) para KKP, o Ministério Italiano de Universidades e Pesquisa por meio do projeto PRIN 2022 (ID 2022-NAZ-0595) para FL, o projeto PRIN 2020 (ID 2020XBFEMS) para CB e GL, e o projeto Fondo Italiano per la Scienza (ID FIS00001244) para GL.
Materiais
| Name | Company | Catalog Number | Comments |
| alamarBlue Cell Viability Reagent | Thermo Fisher Scientific | DAL1025 | Cell Viability Assay |
| B-27 Supplement, minus insulin | Thermo Fisher Scientific | A1895601 | For cell culture |
| Bovine Serum Albumin | Sigma-Aldrich | A9056-50G | For cell staining |
| BrainVision Analyzer software | Brain Products | https://www.brainproducts.com/downloads/analyzer/ | Data export and handling |
| BTS | Sigma | 203895-5MG | |
| CHIR99021 | Stem Cell Technologies | 72054 | |
| Clear Scratch- and UV-Resistant Acrylic Sheet, 12" x 12" x 0.01 inch | McMaster Carr | 4076N11 | Tissue chip fabrication |
| Collagenase Type II | Worthington | CLS-2 / LS004176 | |
| DNase II | VWR | 89346-540 | |
| Essential 8 Medium | Thermo Fisher Scientific | A1517001 | For cell culture |
| Fibronectin | VWR | 47743-654 | Coating |
| Gelatin from porcine skin gel strength 175 Type A | Sigma-Aldrich | G2625-100G | Tissue chip fabrication |
| Geltrex LDEV-Free, hESC-Qualified, Reduced Growth Factor Basement Membrane Matrix | Thermo Fisher Scientific | A1413302 | Coating |
| HBSS | Thermo Fisher | 14175-095 | |
| HEPES (1 M) | Thermo Fisher Scientific | 15630080 | |
| Hoechst 33342 | Life technologies | H1399 | For cell staining |
| Insulin solution human | Sigma Aldrich | I9278-5ML | |
| IWR-1-endo | Stem Cell Technologies | 72564 | |
| Paraformadehyde 16% Aqueous Solution (PFA) | VWR | 100503-917 | For cell staining |
| PBS, sterile, 500 mL | Thermo Fisher Scientific | 10010049 | Tissue chip fabrication |
| phosphate buffered saline | Thermo Fisher Scientific | 10010049 | |
| Pluronic F-127 (20% Solution in DMSO) | Thermo Fisher Scientific | P3000MP | Non-ionic surfactant |
| ROCK inhibitor Y-27632 | Stem Cell Technologies | 72304 | |
| RPMI 1640 Medium, GlutaMAX Supplement | Thermo Fisher Scientific | 61870127 | For cell culture |
| RPMI 1640 Medium, no phenol red | Thermo Fisher Scientific | 11835030 | Optical mapping |
| Versene Solution | Thermo Fisher Scientific | 15040066 | chelating agent |
| VWR General-Purpose Laboratory Labeling Tape | VWR | 89098-058 | Tissue chip fabrication |
| X-Rhod-1 AM | Thermo Fisher Scientific | X14210 | Optical mapping |
Referências
- Di Maria, F., Lodola, F., Zucchetti, E., Benfenati, F., Lanzani, G. The evolution of artificial light actuators in living systems: from planar to nanostructured interfaces. Chem Soc Rev. 47 (13), 4757-4780 (2018).
- Manfredi, G., et al. The physics of plasma membrane photostimulation. APL Mater. 9 (3), 030901(2021).
- Bareket-Keren, L., Hanein, Y. Novel interfaces for light directed neuronal stimulation: advances and challenges. Int J Nanomed. 9 Suppl 1 (Suppl 1), 65-83 (2014).
- Ford, S. M., Watanabe, M., Jenkins, M. W. A review of optical pacing with infrared light. J. Neural Eng. 15 (1), 011001(2018).
- Antognazza, M. R., et al. Shedding light on living cells. Adv Mater. 27 (46), 7662-7669 (2015).
- Zhang, J., Wang, J., Tian, H. Taking orders from light: progress in photochromic bio-materials. Mater Horiz. 1 (2), 169-184 (2014).
- Deisseroth, K. Optogenetics. Nat Methods. 8 (1), 26-29 (2011).
- Ambrosi, C. M., Entcheva, E. Optogenetics' promise: pacing and cardioversion by light. Future Cardiol. 10 (1), 1-4 (2014).
- Hopkins, J., et al. Photoactive organic substrates for cell stimulation: Progress and perspectives. Adv Mater Technol. 4 (5), 1800744(2019).
- Vurro, V., Venturino, I., Lanzani, G. A perspective on the use of light as a driving element for bio-hybrid actuation. Appl Phys Lett. 120 (8), 080502(2022).
- Bruno, G., et al. All-optical and label-free stimulation of action potentials in neurons and cardiomyocytes by plasmonic porous metamaterials. Adv Sci. 8 (21), 2100627(2021).
- Ronchi, C., et al. Nongenetic optical modulation of pluripotent stem cells derived cardiomyocytes function in the red spectral range. Adv Sci. 11 (3), 2304303(2023).
- Li, P., et al. Monolithic silicon for high spatiotemporal translational photostimulation. Nature. 626 (8001), 990-998 (2024).
- Jiang, Y., et al. Nongenetic optical neuromodulation with silicon-based materials. Nat Protoc. 14 (5), 1339-1376 (2019).
- Rotenberg, M. Y., et al. Living myofibroblast-silicon composites for probing electrical coupling in cardiac systems. Proc Natl Acad Sci USA. 116 (45), 22531-22539 (2019).
- DiFrancesco, M. L., et al. Neuronal firing modulation by a membrane-targeted photoswitch. Nat Nanotechnol. 15 (4), 296-306 (2020).
- Paternò, G. M., et al. Membrane environment enables ultrafast isomerization of amphiphilic azobenzene. Adv Sci. 7 (8), 1903241(2020).
- Vurro, V., et al. Molecular design of amphiphilic plasma membrane-targeted azobenzenes for nongenetic optical stimulation. Front Mater. 7, 631567(2021).
- Vurro, V., et al. Optical modulation of excitation-contraction coupling in human-induced pluripotent stem cell-derived cardiomyocytes. iScience. 26 (3), 106121(2023).
- Vurro, V., et al. Light-triggered cardiac microphysiological model. APL Bioeng. 7 (2), 026108(2023).
- Florindi, C., et al. Role of stretch-activated channels in light-generated action potentials mediated by an intramembrane molecular photoswitch. J. Transl. Med. 22 (1), 1068(2024).
- McCain, M. L., Agarwal, A., Nesmith, H. W., Nesmith, A. P., Parker, K. K. Micromolded gelatin hydrogels for extended culture of engineered cardiac tissues. Biomaterials. 35 (21), 5462-5471 (2014).
- Park, S. -J., et al. Insights into the pathogenesis of catecholaminergic polymorphic ventricular tachycardia from engineered human heart tissue. Circulation. 140 (5), 390-404 (2019).
- Lee, K. Y., et al. An autonomously swimming biohybrid fish designed with human cardiac biophysics. Science. 375 (6581), 639-647 (2022).
- Lian, X., et al. Directed cardiomyocyte differentiation from human pluripotent stem cells by modulating Wnt/β-catenin signaling under fully defined conditions. Nat Protoc. 8 (1), 162-175 (2013).
- Prondzynski, M., et al. Efficient and reproducible generation of human iPSC-derived cardiomyocytes and cardiac organoids in stirred suspension systems. Nat Commun. 15 (1), 5929(2024).
- Pasqualini, F. S., Sheehy, S. P., Agarwal, A., Aratyn-Schaus, Y., Parker, K. K. Structural phenotyping of stem cell-derived cardiomyocytes. Stem Cell Rep. 4 (3), 340-347 (2015).
- Fonck, E., et al. Effect of aging on elastin functionality in human cerebral arteries. Stroke. 40 (7), 2552-2556 (2009).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados