Method Article
Système microphysiologique cardiaque pour l’étude de la propagation du Ca2+ par stimulation optique non génétique
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
L’utilisation de la lumière pour contrôler les cellules et les tissus cardiaques permet une stimulation sans contact, préservant ainsi l’état et la fonction naturels des cellules, ce qui en fait une approche précieuse pour la recherche fondamentale et les applications thérapeutiques.
Résumé
Les modèles microphysiologiques cardiaques in vitro sont très fiables pour la recherche scientifique, le développement de médicaments et les applications médicales. Bien que largement acceptés par la communauté scientifique, ces systèmes sont encore limités en longévité en raison de l’absence de techniques de stimulation non invasives. Les phototransducteurs fournissent une méthode de stimulation efficace, offrant une approche sans fil avec une résolution temporelle et spatiale élevée tout en minimisant l’invasivité dans les processus de stimulation. Dans ce manuscrit, nous présentons une méthode entièrement optique pour stimuler et détecter l’activité d’un modèle microphysiologique cardiaque in vitro. Plus précisément, nous avons fabriqué des tissus anisotropes laminaires modifiés en ensemenceant des cardiomyocytes dérivés de cellules souches pluripotentes induites par l’homme (hiPSC-CM) générés dans une culture en suspension de bioréacteur 3D. Nous avons utilisé un phototransducteur, un dérivé amphiphile d’azobenzène, nommé Ziapin2, pour la stimulation et un colorant Ca2+ (X-Rhod 1) pour surveiller la réponse du système. Les résultats démontrent que Ziapin2 peut photomoduler les réponses Ca2+ dans le système utilisé sans compromettre l’intégrité, la viabilité ou le comportement des tissus. De plus, nous avons montré que l’approche de stimulation basée sur la lumière offre une résolution similaire à celle de la stimulation électrique, la référence actuelle. Dans l’ensemble, ce protocole ouvre des perspectives prometteuses pour l’application de Ziapin2 et de la photostimulation à base de matériaux dans la recherche cardiaque.
Introduction
L’utilisation de la lumière pour stimuler les cellules et les tissus vivants est en train de changer la donne dans la recherche biomédicale, offrant des capacités de stimulation sans contact avec une résolution temporelle et spatiale précise 1,2,3,4,5,6. L’optogénétique, qui consiste à modifier génétiquement les cellules pour exprimer des canaux ioniques sensibles à la lumièreou des pompes 7,8. Cette approche a démontré une efficacité impressionnante dans la régulation des cellules des tissus vivants ; Cependant, sa dépendance au transfert de gènes viraux a entravé son adoption généralisée dans la recherche et les applications cliniques.
Pour surmonter cette limitation, des matériaux organiques et inorganiques ont été utilisés comme transducteurs sensibles à la lumière pour développer des techniques de stimulation non génétiques, basées sur des matériaux, médiées par la lumière 9,10. Les phototransducteurs organiques nanostructurés 11,12,13,14,15 ont récemment démontré un succès remarquable dans le déclenchement de réponses cellulaires dans diverses applications, notamment les neurones, les cardiomyocytes et les cellules musculaires squelettiques.
Ici, nous proposons Ziapin216,17,18, un dérivé d’azobenzène, pour étudier la propagation du Ca2+ dans les tissus cardiaques laminaires modifiés. La structure amphiphile de la molécule permet un ciblage précis de la membrane plasmique cellulaire, tandis que le noyau d’azobenzène permet l’isomérisation induite par la lumière, conduisant à son changement de conformation 16,17,18. Dans les cellules cardiaques, cette isomérisation trans-to-cis modifie l’épaisseur de la membrane plasmique, induisant une cascade d’effets qui génère un potentiel d’action, qui à son tour déclenche le processus d’excitation-contraction 19,20,21.
De plus, nous décrivons le processus de fabrication d’une plate-forme conçue pour la croissance anisotrope du tissu cardiaque22 et détaillons le dispositif expérimental utilisé pour le déclenchement optique et la surveillance de son activité, en mettant l’accent sur l’acquisition de la dynamique Ca2+ dans le tissu23,24. Enfin, nous comparons les signaux acquis avec ceux obtenus par stimulation électrique, qui est considérée comme l’étalon de référence. Dans l’ensemble, ce protocole met en évidence l’application d’un nouveau transducteur sensible à la lumière pour faire progresser notre compréhension du comportement cellulaire cardiaque, en particulier dans le contexte des tissus modifiés.
Protocole
La culture de cellules souches pluripotentes humaines (hiPSC) utilisée est une lignée iPSC humaine mâle de type sauvage qui héberge un système CRISPR/Cas9 inductible par la doxycycline (Dox), créé en introduisant CAGrtTA ::TetO-Cas9 dans le locus AAVS1 (Addgene : #73500). L’étude a été menée conformément aux protocoles approuvés par le Boston Children’s Hospital Institutional Review Board. Le consentement éclairé a été obtenu des patients avant leur participation à l’étude. La génération de cardiomyocytes dérivés de hiPSC (hiPSC-CM) a été induite comme décrit précédemment25,26. Le protocole sera brièvement résumé dans la section suivante :
1. Génération et préparation de cardiomyocytes dérivés de cellules souches pluripotentes induites humaines
- Laver une fois les hiPSC cultivés dans des flacons T75 avec du PBS. Détacher les cellules en les incubant avec l’agent chélateur Versene pendant 10 à 15 minutes et les ensemencer dans des récipients de bioréacteur prétraités avec une solution à 1 % de surfactant non ionique à une densité de 50 millions d’IPSC/récipient dans 100 mL de milieu E8 complété par un inhibiteur de ROCK Y-27632 de 10 μM.
- Réglez les paramètres suivants du bioréacteur : agitation 60 tr/min, température 37 °C, pH 7 et gazage de recouvrement (O2 et CO2) à 3 L/h standard.
- Après 1 jour de culture, confirmer que le diamètre du corps embryoïde (EB) a atteint 100-300 μm et traiter les cellules avec un milieu RPMI basique (milieu RPMI 1640 complété par B27 moins insuline), contenant 7 μM CHIR99021 pendant 24 h, suivi d’un changement de milieu en RPMI pendant 24 h supplémentaires. Ajouter un milieu RPMI de base contenant 5 μM IWR-1-endo pendant 48 heures supplémentaires pour commencer le processus de différenciation vers la lignée cardiaque. Après 48 h, changez le support pour revenir au RPMI de base.
- Au 7e jour de la différenciation, des cellules de culture dans un milieu RPMI de base ont été complétées par de l’insuline humaine 1:1 000 (v/v). Rafraîchir le média tous les 2 jours ou tous les jours avec un changement de milieu de 50 % si la consommation d’oxygène atteint plus de 30 %.
- Le 15e jour, dissocier enzymatiquement les cellules du bioréacteur pendant 3 h à l’aide d’une solution de collagénase II contenant HBSS, Collagenase II (200 unités/mL), HEPES (10 mM), l’inhibiteur de ROCK Y-27632 (10 μM) et le N-benzyl-p-toluènesulfonamide (BTS, 30 μM). Pour ce faire, lavez d’abord les hiPSC-CM EBs différenciés 2x avec HBSS préchauffés et incubez-les dans une solution de Collagenase II (volume de 200 μl d’EBs / 12 ml de solution de Collagenase II) à 37 °C dans 5 % de CO2 jusqu’à ce que des cellules uniques apparaissent à partir d’une dissociation complète de l’EB.
- Arrêtez la réaction de dissociation en ajoutant un volume égal de tampon bloquant (RPMI-1640 sans B27 et DNase II, avec 6 μL de DNase II par mL de RPMI-1640) à la suspension unicellulaire. Compter les hiPSC-CM différenciés, centrifuger (200 × g, 5 min) et se préparer pour les applications en aval en congelant les cellules à -80 °C dans de l’isopropanol pendant 24 h et en les déplaçant dans des réservoirs d’azote liquide jusqu’à ce que l’ensemencement soit effectué.
2. Fabrication de tissus laminaires artificiels
- Collez deux couches de ruban adhésif de laboratoire, l’une blanche et l’autre bleue, sur une feuille acrylique transparente de 1 mm d’épaisseur, résistante aux rayures et aux UV. À l’aide d’un graveur laser CO2 , découpez la feuille acrylique en cercles (20 mm de diamètre pour s’adapter aux 12 MW) et le motif des puces (3 carrés de 7,5 mm, trois par puce) sur la bande telle qu’elle est conçue dans un logiciel de graphisme vectoriel (par exemple, CorelDraw) ; paramètres de découpe acrylique : 100 puissance, 20 vitesse et 1 000 PPI ; Paramètres de découpe de bande : 8 puissance, 6 vitesses et 1 000 PPI. Retirez les deux couches de ruban à l’intérieur de la ligne la plus intérieure à l’aide d’une pince à épiler, trempez les copeaux dans de l’eau de Javel pure pendant 30 min à 1 h pour enlever les lignes épaisses et les taches sombres de la coupe, en laissant une ligne nette, et rincez les copeaux dans un bécher avec de l’eau déminéralisée courante (DI) pendant la nuit ou pendant au moins 3 h.
REMARQUE : Ne pas javelliser pendant plus de 2 h, car cela graverait les adhésifs sur les parois latérales, empêchant la gélatine d’adhérer correctement. - Sonicez les puces pendant 10 min et les tampons de polydiméthylsiloxane (PDMS, Sylgard 184) avec des caractéristiques de rainure de ligne (largeur de crête de 25 μm, largeur de rainure de 4 μm et profondeur de rainure de 5 μm) pendant 30 min dans de l’éthanol propre à 70 %. Transférez les copeaux et les tampons dans un endroit propre sous une hotte et laissez-les sécher sous flux d’air pendant ~1-2 h.
- Peser 1 g de gélatine de peau de porc (force du gel ~175 g Bloom, type A) dans un tube de 50 ml. Ajouter 5 ml de solution saline tamponnée au phosphate (PBS) et bien mélanger pour assurer la dissolution immédiate de la gélatine. Placez le tube dans un bain-marie à 65 °C pendant 30 minutes pour terminer le processus de dissolution. De même, pesez 1 g de transglutaminase microbienne (MTG) dans un tube séparé de 50 ml. Ajoutez 12,5 ml de PBS, mélangez bien et placez le tube dans un bain-marie à 37 °C pendant 30 minutes pour assurer la dissolution complète du MTG.
- Sonicez le tube de gélatine pendant 15 min, puis remettez-le dans le bain-marie à 65 °C avant utilisation. Placez le tube MTG dans un dessiccateur avec le capuchon légèrement desserré et allumez lentement le vide. Observez les bulles être retirées de la solution MTG sous vide. Après le dégazage, remettez le tube MTG dans le bain-marie à 37 °C.
REMARQUE : Surveillez le processus et ajustez le vide pour éviter une ébullition vigoureuse. - Couvrez une feuille de grille avec un parafilm propre, placez les copeaux sur la grille et gardez le tampon à proximité, prêt à l’emploi. Ajouter 5 mL de MTG aux 5 mL de solution de gélatine, en pipetant soigneusement pour éviter les bulles ; ensuite, pipetez rapidement la gélatine sur la puce, en utilisant suffisamment pour couvrir la surface de la puce (environ 0,5 mL chacune). Ensuite, placez le tampon PDMS22 (largeur de ligne 25 μm, hauteur 5 μm, espacement 4 μm) sur le dessus et appliquez un poids de 200 g pour vous assurer que la gélatine est parallèle à l’axe longitudinal du tissu. Une fois que toutes les puces sont moulées, couvrez-les d’un bocal en verre pour éviter les perturbations environnementales et laissez-les se réticuler pendant la nuit.
REMARQUE : Utiliser la solution mixte gélatine-MTG dans les 5 min ; Sinon, le motif cible sera altéré en raison d’un état réticulé plus élevé de la gélatine. - Transférez la puce et le tampon PDMS sandwich dans une nouvelle boîte P150 remplie de PBS et hydratez la gélatine pendant 30 min à 1 h pour faciliter la séparation du tampon PDMS de la puce. Retirez tout excès de gélatine non moulée autour de la puce et transférez la puce propre dans une nouvelle boîte P150 remplie de PBS. Conservez les tampons PDMS dans de l’éthanol à 70 %.
- Stérilisez les copeaux en les trempant dans de l’éthanol pendant 10 min sous le capot.
REMARQUE : Ne dépassez pas 10 min dans l’éthanol, car une exposition plus longue peut déformer la gélatine. - Transférez les chips dans du PBS, laissez tremper pendant 10 minutes et rincez 3 fois. Préparez les solutions d’enrobage en mélangeant 20 μg/mL de fibronectine avec une matrice de membrane basale diluée à 1:100 dans un milieu de culture (environ 0,5 mL par puits). Enduisez les copeaux pendant 2 h dans l’incubateur à 37 °C et 5 % de CO2 ou à 4 °C pendant la nuit.
- Décongeler et semer des cellules (8 × 105 hiPSC-CMs par cm2) dans un milieu RPMI avec Y-27632 (10 μM), puis le remplacer par RPMI sans Y-27632 après 24 heures.
- Trois jours après l’ensemencement cellulaire, retirez le ruban blanc à l’aide d’une pince à épiler.
3. Synthèse et application du phototransducteur
REMARQUE : Ziapin2 a été synthétisé selon une procédure publiée antérieurement 16,18 et a été administré aux hiPSC-CM directement dans le milieu de culture.
- Ajouter 25 μM de Ziapin2 à la culture cellulaire et incuber à 37 °C et 5 % de CO2 pendant 7 min.
- Lavez délicatement les molécules en excès et rincez avec un milieu de culture frais.
4. Essai de viabilité
REMARQUE : Alamar Blue est un test à base de résazurine qui peut pénétrer dans les cellules et agir comme un indicateur redox pour surveiller la viabilité cellulaire. La résazurine se dissout dans des tampons physiologiques, ce qui donne une solution d’un bleu profond qui est ajoutée directement aux cellules en culture. Les cellules viables avec un métabolisme actif réduisent la résazurine en résoforine, qui est rose et fluorescente.
- Cellules sur plaque dans une plaque de 96 puits préalablement recouverte de fibronectine de 20 μg/mL et de matrice de membrane basale diluée de 1:100 dans un milieu de culture. Mélangez en secouant puis ajoutez aseptiquement Alamar Blue dans chaque puits en une quantité égale à 10 % du volume du puits.
- Incuber des cultures avec Alamar Blue pendant 4 h.
- Traitez les cellules avec le phototransducteur et le véhicule (DMSO) comme décrit précédemment. Appliquer une stimulation lumineuse (lumière pulsée 1 Hz pendant 1 min) à travers une fibre optique (cyan, 470 nm) pour évaluer l’effet de l’internalisation de Ziapin2 et de l’exposition à la lumière sur la viabilité de hiPSC-CM.
- Lire la fluorescence avec un lecteur de plaques à l’excitation 560 nm et à l’émission 590 nm.
5. Évaluation de l’anisotropie du tissu cardiaque laminaire modifié
REMARQUE : Ce protocole décrit une approche systématique pour évaluer l’anisotropie du tissu cardiaque laminaire modifié à l’aide de l’immunomarquage, de la microscopie confocale et de l’analyse des noyaux27.
- Laver le substrat avec du PBS plusieurs fois avant de le fixer avec du paraformaldéhyde à 4 % (v/v) contenant 0,05 % (v/v) de Triton X-100 dans du PBS pendant 10 min.
- Bloquer la liaison non spécifique en incubant des échantillons avec 5 % (p/v) d’albumine sérique bovine (BSA) dans du PBS pendant 30 min.
- Incuber des échantillons avec Hoechst (1:500) à température ambiante pendant 1 h.
- Laver avec du PBS avant de monter sur des lames de microscope avec un agent anti-décoloration. Laissez les lames sécher pendant la nuit et conservez-les à 4 °C jusqu’à l’imagerie.
- Imagez des échantillons à l’aide d’un microscope confocal à disque rotatif à un grossissement de 20x. Déterminez l’orientation des cellules à l’aide d’OrientationJ Measure28, un plugin FiJi.
6. Enregistrements de cartographie optique
REMARQUE : La cartographie optique a été réalisée après 5 jours de culture sur des hiPSC-CM ensemencés sur des puces de tissu moulées à la gélatine.
- Pour suivre ce protocole, assurez-vous que l’appareil de cartographie optique se compose d’un microscope à lentille tandem modifié équipé d’une caméra à haute vitesse et de la source lumineuse d’excitation, une lampe au mercure de 200 mW. Placez un miroir dichroïque devant la caméra d’imagerie Ca2+ désignée pour vous assurer que la préparation est exposée à la lumière d’excitation et pour recueillir la fluorescence émise provenant de l’échantillon.
- Incuber l’échantillon avec 2 μM X-Rhod 1 ajoutés au milieu de culture pendant 30 min à 37 °C.
REMARQUE : N’exposez l’échantillon à la lumière que pendant l’acquisition de l’image pour éviter le photoblanchiment du colorant. - Incuber le phototransducteur comme décrit précédemment dans la section 3.
- Laver avec un milieu de culture frais et transférer les copeaux dans un milieu RPMI 1640 sans rouge de phénol complété par B27 moins insuline.
- Placez les puces de tissu dans une boîte à température contrôlée et démarrez les enregistrements à température physiologique (37 °C), en acquérant des images à une fréquence d’images de 2,5 images/s.
- Pour la stimulation optique, appliquez la stimulation ponctuelle optique à une extrémité du tissu à l’aide d’une source lumineuse LED (465/25 nm) permettant la stimulation Ziapin2. Stimulez les tissus à une fréquence de 0,5 ou 1 Hz via une fibre optique régulée dans le temps positionnée à 1 mm du tissu. Pour la stimulation électrique, appliquez une stimulation ponctuelle à l’aide d’une électrode de platine bipolaire positionnée au centre de l’extrémité la plus distale du tissu rectangulaire. Ce placement garantit que la propagation des ondes Ca2+ provient du milieu de la largeur du tissu, qui correspond au côté le plus court du rectangle. La stimulation doit être appliquée à une fréquence de 0,5 Hz, avec une amplitude de 10 V et une durée d’impulsion de 100 ms.
- Après les enregistrements, appliquez un filtre spatial d’une taille de 3 x 3 pixels pour améliorer le rapport signal/bruit.
- Déterminez la vitesse de conduction de l’onde Ca2+ à chaque pixel pour chaque impulsion, en calculant le taux de variation le long des directions x et y. Pour ce faire, mesurez le gradient spatial de l’intensité du signal Ca2+ dans ces directions et reliez-le au retard de propagation du signal. En combinant ces taux de changement de direction, quantifiez la vitesse à laquelle l’onde se propage dans le champ cellulaire dans les deux dimensions.
7. Exportation et traitement des données
- Extrayez et analysez les données avec le logiciel référencé.
- Appliquez un filtre spatial de 3 x 3 pixels pour améliorer le rapport signal/bruit.
- Extrayez les traces de transitoires Ca2+ (CaT) en tant que moyenne d’une région d’intérêt (ROI) spécifique sélectionnée manuellement.
- Mesurez les paramètres CaT dans une région d’intérêt centrale (ROI) de 50 x 50 pixels (≈ 25 mm2).
- Pour chaque CaT, analysez l’amplitude du CaT, le temps de montée (pic t), le temps de la pente de décroissance maximale (pente de décroissance maximale) et le temps jusqu’à 90 % de décroissance transitoire (temps de décroissance90).
8. Analyse statistique
- Évaluez la normalité de la distribution à l’aide d’un test statistique approprié, tel qu’un test de normalité, pour déterminer si des méthodes paramétriques ou non paramétriques doivent être appliquées.
- Évaluez la signification statistique entre deux conditions à l’aide du test t de Student ou du test U de Mann-Whitney pour les données continues ou catégorielles, respectivement. Lorsque vous comparez plus de deux groupes, utilisez l’ANOVA à un facteur ou le test de Kruskal-Wallis en fonction des hypothèses de données, suivi de tests post-hoc appropriés pour identifier les différences significatives par paires.
Résultats
Un procédé en plusieurs étapes a été développé et mis en œuvre pour la fabrication de tissu cardiaque laminaire modifié à l’aide d’une combinaison de techniques de modelage laser, de moulage à la gélatine et d’ensemencement cellulaire. Établie à l’origine par McCain et al.22 et Lee et al.24, cette technique a été réimplémentée, suivant leurs protocoles de construction des microtissus laminaires modifiés. Le processus intègre un motif précis basé sur le laser pour le guidage structurel, de la gélatine comme matériau d’échafaudage et un ensemencement cellulaire contrôlé pour créer un environnement tissulaire biomimétique. (Figure 1).
Le dépôt des substrats en papier a impliqué l’adhérence de deux couches de ruban d’étiquetage de laboratoire, l’une blanche et l’autre bleue, sur un substrat acrylique de 1 mm d’épaisseur, fournissant une base solide pour les étapes ultérieures et permettant une visualisation et une manipulation précises pendant le processus de fabrication (Figure 1A). La modélisation laser a été utilisée pour obtenir la géométrie de puce souhaitée sur les substrats, avec des paramètres optimisés assurant une ablation précise sans endommager la base acrylique (Figure 1B). L’élimination sélective des couches de ruban a exposé des régions spécifiques du substrat pour un traitement ultérieur. Une solution de gélatine, préparée à partir de peau de porc et réticulée avec de la transglutaminase microbienne, a ensuite été déposée sur la surface acrylique à motifs pour créer une couche biocompatible adaptée à l’adhésion cellulaire (figure 1C). Cette couche de gélatine a été moulée à l’aide d’un tampon PDMS comportant des motifs de rainures de ligne, assurant l’alignement avec l’axe longitudinal du tissu, et réticulée pendant la nuit pour produire un substrat stable à motifs (figure 1D et figure supplémentaire S1).
Des cardiomyocytes dérivés de cellules souches pluripotentes induites par l’homme (hiPSC-CM) ont été ensemencés sur le substrat pré-enrobé à une densité d’environ 8 × 105 cellules/cm2 (Figure 1E). Les conditions de culture ont été optimisées avec un rafraîchissement quotidien des milieux pour favoriser la croissance cellulaire. Après 3 jours, la couche de ruban blanc a été retirée pour exposer la surface de gélatine à motifs (Figure 1F), assurant un confinement précis des cellules dans des régions de substrat spécifiques, facilitant le développement de tissu laminaire bio-modifié avec les configurations géométriques souhaitées. La viabilité et l’alignement des hiPSC-CM dans le tissu issu de la bio-ingénierie ont ensuite été évalués.
L’impact de l’internalisation de Ziapin2 suivie d’une exposition à la lumière sur la viabilité cellulaire a été évalué à l’aide du test AlamarBlue. Les résultats rapportés dans la figure 2A ont indiqué que Ziapin2, lorsqu’il est internalisé à une concentration de 25 μM et suivi d’une stimulation lumineuse de 470 nm, n’a pas affecté négativement la viabilité cellulaire, confirmant la compatibilité de cette approche de phototransducteur avec les cellules vivantes.
L’anisotropie dans le tissu laminaire bio-modifié a été réalisée comme prévu, l’imagerie par fluorescence montrant un alignement cellulaire significatif le long des sillons à motifs du substrat de gélatine micromoulé (Figure 2B). L’orientation de la cellule, évidente sur les images de fluorescence, a été évaluée quantitativement à l’aide du plug-in FiJi OrientationJ28. L’orientation a été évaluée en traitant les images de fluorescence de Hoechst, ce qui a donné un angle moyen égal à θmoyenne = 13,39 ± 2,67°. L’angle indique l’orientation normalisée à la direction du motif, montrant un degré élevé d’anisotropie dans le tissu. La distribution angulaire mesurée, ainsi que la faible valeur mesurée de l’écart-type, suggèrent une forte préférence directionnelle dans la structure du tissu (Figure 2C). Cela a démontré la formation de tissu cardiaque anisotrope, qui est essentiel pour imiter l’architecture naturelle nécessaire à une bonne performance fonctionnelle, telle que la contraction coordonnée et la conduction électrique.
Après 5 jours de culture, la cartographie optique a été réalisée sur des hiPSC-CM chargés de Ziapin2 ensemencés sur des puces de tissu moulées à la gélatine (Figure 3). La cartographie optique a fourni une imagerie claire et détaillée de la dynamique de Ca2+ dans le tissu cardiaque modifié, facilitée par une caméra à haute vitesse et une stimulation lumineuse précise. La stimulation Ziapin2 a été réalisée efficacement à l’aide d’une source lumineuse LED, et les échantillons de tissus ont bien réagi à la stimulation à des fréquences de 0,5 Hz (Figure 4A) et de 1 Hz (Figure 4B).
La photostimulation à ces fréquences a induit la propagation des ondes Ca2+ à travers le tissu et les vitesses de conduction longitudinales ont été calculées, montrant une propagation uniforme des signaux électriques dans tout le tissu aux deux fréquences de stimulation et résultant égale à 4,5 ± 0,5 cm/s (Figure 4A,B).
Enfin, nous avons comparé notre méthodologie avec la référence de référence de la stimulation électrique. Une analyse détaillée des transitoires Ca2+ (CaT), comme illustré à la figure 5, a révélé que les paramètres clés, y compris l’amplitude du CaT (figure 5A), le temps de montée (figure 5B), la pente de décroissance maximale (figure 5C) et le temps de décroissance (figure 5D), étaient similaires entre les deux signaux de stimulation. Dans l’ensemble, l’approche de cartographie optique a fourni des données à haute résolution sur les propriétés physiologiques du tissu cardiaque laminaire bio-modifié, démontrant l’efficacité de Ziapin2 dans la modulation de son comportement par stimulation lumineuse.

Figure 1 : Croquis de la préparation du tissu cardiaque laminaire. (A) Dépôt de deux bandes de papier sur un substrat acrylique. (B) Modelage des deux couches de papier par ablation laser. (C) Dépôt de la gélatine sur le substrat à motifs. (D) Moulage et frittage de la couche de gélatine à l’aide d’un tampon PDMS à motif linéaire. (E) Ensemencement cellulaire sur le substrat préparé. (F) Enlèvement de la première couche de papier en obtenant la géométrie requise. Abréviation : PDMS = polydiméthylsiloxane. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Viabilité et alignement cellulaires dans le tissu cardiaque laminaire bio-modifié. (A) Effet de l’internalisation de Ziapin2 et de l’exposition à la lumière sur la viabilité des hiPSC-CMs mesurée avec le test Alamar Blue. La viabilité de la cellule Ctrl dans l’obscurité a été fixée à 100 %. Les données sont représentées sous forme de moyenne ± d’erreur type de la moyenne (SEM) n = 16 pour chaque condition. (B) Tissu laminaire anisotrope bio-modifié sur gélatine micromoulée. Images de fluorescence de tissus hiPSC anisotropes ; barre d’échelle = 100 μm. Les cellules sont colorées au Hoechst (bleu). (C) Orientation moyenne (normalisée à la direction du motif) des cellules ensemencées sur des substrats de gélatine (N = 45 ROI provenant de 4 échantillons différents, angle moyen de distribution, θmoyenne = 13,39° ± 2,67°). Abréviations : hiPSC-CM = cardiomyocyte dérivé de cellules souches pluripotentes induites par l’homme ; ROI = région d’intérêt. Veuillez cliquer ici pour voir une version agrandie de cette figure.
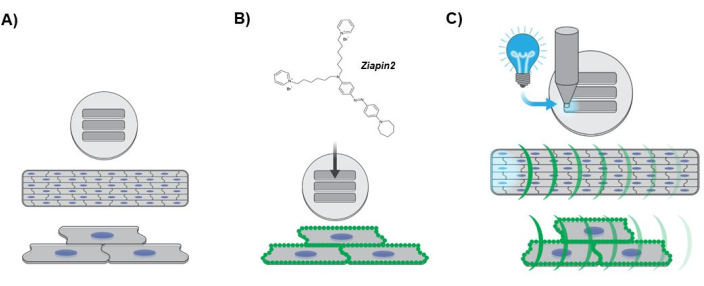
Figure 3 : Schéma illustrant le protocole expérimental. (A) Formation de tissu cardiaque anisotrope. Les noyaux des hiPSC-CMs sont représentés en bleu. (B) Internalisation du phototransducteur dans le tissu laminaire modifié. Les points verts le long du sarcolemme indiquent la séparation de la membrane Ziapin2. (C) Protocole de photostimulation et cartographie optique dynamique Ca2+. La lumière cyan indique la stimulation ponctuelle optique appliquée à une extrémité du tissu à l’aide d’une source lumineuse LED. Les courbures vertes représentent la propagation de l’onde Ca2+ le long du tissu laminaire modifié. Abréviations : hiPSC-CMs = cardiomyocytes dérivés de cellules souches pluripotentes induites par l’homme ; LED = diode électroluminescente. Veuillez cliquer ici pour voir une version agrandie de cette figure.
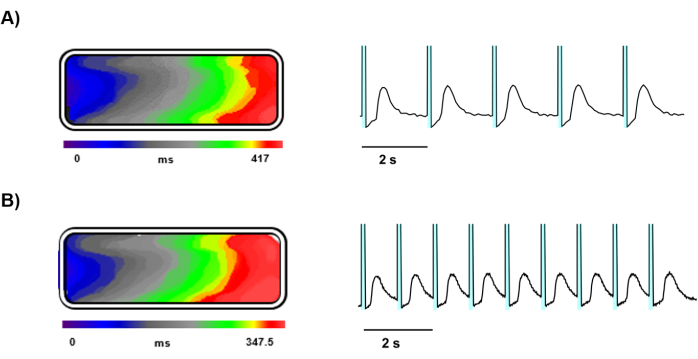
Figure 4 : Enregistrements représentatifs d’ondes Ca2+ déclenchées par la lumière. Parcours temporel représentant la propagation du front d’onde Ca2+, la carte isochrone et les traces de signal Ca2+ d’un tissu stimulé par la lumière à (A) 0,5 Hz et (B) 1 Hz. Dans les traces représentatives, la zone ombrée cyan avant chaque transitoire Ca2+ représente la photoexcitation. Veuillez cliquer ici pour voir une version agrandie de cette figure.
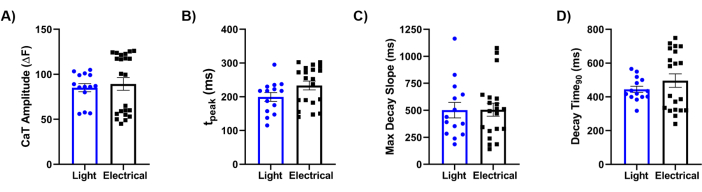
Figure 5 : Comparaison entre la stimulation électrique et optique. Quantification des paramètres transitoires Ca2+ induits par la lumière et évoqués électriquement (CaT) enregistrés sur des puces ensemencées avec des hiPSC-CM à 0,5 Hz. Les caractéristiques du CaT analysées étaient (A) l’amplitude du CaT ; (B) temps de montée (tcrête) ; (C) le temps de la pente de décroissance maximale (Pente de décroissance maximale) ; et (D) le temps jusqu’à 90 % de décroissance transitoire (temps de décroissance90). Des mesures appariées ont été effectuées à 37 °C pour chaque condition. Stimulation lumineuse N = 5 puces, n = 14 tissus ; stimulation électrique N = 8 puces, n = 22 tissus. Les données sont représentées sous forme de moyenne ±'erreur type de la moyenne. Abréviations : CaT = Ca2+ transitoire ; hiPSC-CMs = cardiomyocytes dérivés de cellules souches pluripotentes induites par l’homme. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Figure supplémentaire S1 : Évaluation du micropatterning sur des substrats PDMS et gélatine. (A) Image optique d’un motif réalisé sur un timbre PDMS ; barre d’échelle = 100 μm. (B) Image optique d’un substrat de gélatine micromoulé ; barre d’échelle = 100 μm. (C) Profil de motif d’un tampon PDMS (ligne noire) et d’un film de gélatine micromoulé (ligne rouge). Veuillez cliquer ici pour télécharger ce fichier.
Discussion
Cette approche fournit une plate-forme solide pour faire progresser la recherche cardiaque, en fournissant des informations sur la dynamique complexe du tissu cardiaque, ouvrant de nouvelles possibilités pour des études mécanistes cardiaques in vitro à long terme qui pourraient potentiellement conduire à de nouvelles stratégies thérapeutiques. Pour assurer le succès de cette méthodologie, il est crucial de reproduire un environnement microphysiologique qui imite étroitement les conditions in vivo du cœur humain. Par conséquent, une attention particulière doit être accordée à la conception et à l’alignement du tissu pour reproduire l’anisotropie naturelle de l’architecture cardiaque, qui est vitale pour une bonne conduction électrique et une fonction contractile. Les facteurs critiques comprennent la découpe laser précise du motif de la puce, le moment du traitement à l’eau de Javel et le contrôle de la viscosité de la solution de gélatine, qui sont tous nécessaires à la création de moules de tissus uniformes. De plus, il est essentiel d’enrober avec précision les puces de fibronectine et de GelTrex (la matrice membranaire basale à facteur de croissance réduit) pour une fixation cellulaire réussie et la formation ultérieure des tissus.
De plus, le temps d’incubation et la concentration du photoactionneur (c’est-à-dire Ziapin216,18) doivent être soigneusement contrôlés pour assurer une internalisation adéquate. Un lavage minutieux des molécules en excès est essentiel pour prévenir les effets non spécifiques. Il est toujours recommandé d’effectuer des tests de viabilité pour évaluer si la molécule a des effets néfastes sur les cellules. Si l’internalisation du photoactionneur est inadéquate, envisagez de prolonger le temps d’incubation ou d’utiliser une concentration plus élevée.
Pour les expériences fonctionnelles, la bonne configuration de l’appareil de cartographie optique, y compris le positionnement précis de la fibre optique et l’étalonnage de la fréquence de stimulation, est cruciale pour capturer des données de haute qualité. Si les enregistrements montrent des niveaux de bruit élevés, affinez la taille du filtre spatial ou vérifiez qu’il n’y a pas de désalignement dans la configuration optique.
La méthodologie de l’approche présente plusieurs avantages non négligeables ; le développement et l’application de hiPSC-CM alignés représentent une amélioration notable dans la réplication des caractéristiques natives du tissu cardiaque. En alignant les cellules, les chercheurs peuvent imiter étroitement la structure anisotrope du tissu cardiaque natif, qui est essentielle au maintien d’un bon fonctionnement électrique et mécanique. Cela garantit que les cardiomyocytes interagissent d’une manière qui ressemble beaucoup aux conditions in vivo , présentant ainsi des comportements physiologiques plus représentatifs du cœur natif.
Contrairement à la stimulation électrique, qui nécessite un câblage et la présence d’une électrode dans l’électrolyte, la modulation basée sur la lumière offre une méthode non invasive et précise pour contrôler les propriétés électriques de régions spécifiques. La possibilité d’ajuster la lumière en termes d’intensité, de longueur d’onde et de synchronisation facilite les interventions ciblées sans perturber les zones adjacentes. De plus, contrairement à l’optogénétique, qui nécessite la modification génétique des cellules pour exprimer des canaux ou des protéines sensibles à la lumière, ne nécessite pas de transfert de gènes viraux. Ces aspects sont cruciaux pour les applications où la modification génétique n’est pas réalisable ou souhaitée. De plus, la capacité photostimulante des matériaux démêle la spécificité de la cellule ou de la procédure, ce qui rend cette approche de stimulation facilement transférable à différents types de cellules.
Le contrôle dynamique et en temps réel du tissu cardiaque est un autre avantage de cette méthodologie. L’utilisation de la lumière permet de moduler en temps réel les propriétés électriques, ce qui constitue un outil puissant pour étudier comment différents stimuli affectent la fonction cardiaque. L’intégration avec Ziapin2 permet la conversion directe de la lumière en signaux électriques, ce qui permet un contrôle précis des potentiels d’action et du rythme dans les hiPSC-CM.
Cette approche est également prometteuse pour faire progresser les applications de la recherche, jetant les bases de la création de modèles de maladies précis, en particulier pour les arythmies cardiaques et d’autres troubles électriques, permettant aux chercheurs d’étudier les réponses cellulaires à divers stimuli ou médicaments dans un cadre contrôlé. De plus, il offre une plate-forme solide pour le dépistage de drogues et les tests de toxicité, fournissant un contexte plus pertinent pour l’homme par rapport aux modèles animaux traditionnels.
À cet égard, les considérations éthiques sont également prises en compte, car cette technologie réduit la dépendance aux modèles animaux, s’alignant sur les principes des 3R (Remplacement, Réduction et Raffinement). En fournissant un modèle plus éthique et potentiellement prédictif des réponses cardiaques humaines, il soutient une évolution vers des pratiques de recherche plus humaines.
L’évolutivité et la personnalisation de la méthode améliorent encore son utilité. Les chercheurs peuvent adapter les constructions tissulaires à des besoins de recherche spécifiques, en ajustant des facteurs tels que le type de cellule, l’alignement et l’emplacement du phototransducteur. De plus, la méthodologie pourrait être potentiellement mise à l’échelle pour des expériences de plus grande envergure ou des études à haut débit, ce qui en ferait un outil polyvalent pour la recherche fondamentale et les applications précliniques.
Enfin, le potentiel de la médecine personnalisée est important. En dérivant des hiPSC-CM à partir de patients individuels, les chercheurs peuvent créer des modèles de tissu cardiaque spécifiques au patient, ce qui permet d’étudier des réponses personnalisées à des médicaments ou à des interventions. Cela ouvre la voie à des approches thérapeutiques sur mesure en cardiologie, offrant de nouvelles voies de développement thérapeutique.
Déclarations de divulgation
CB, GL et FL sont les inventeurs du brevet n° « COMPOSÉS PHOTOCHROMIQUES » EP 3802491 (02/07/2020).
Remerciements
Les auteurs remercient vivement Michael Rosnach pour les illustrations des figures 1 et 3, ainsi que le professeur William T. Pu pour la fourniture de hiPSC. Ce travail a été soutenu par le NCATS Tissue Chips Consortium (UH3 TR003279) à KKP, le ministère italien des Universités et de la Recherche à travers le projet PRIN 2022 (ID 2022-NAZ-0595) à FL, le projet PRIN 2020 (ID 2020XBFEMS) à CB et GL, et le projet Fondo Italiano per la Scienza (ID FIS00001244) à GL.
matériels
| Name | Company | Catalog Number | Comments |
| alamarBlue Cell Viability Reagent | Thermo Fisher Scientific | DAL1025 | Cell Viability Assay |
| B-27 Supplement, minus insulin | Thermo Fisher Scientific | A1895601 | For cell culture |
| Bovine Serum Albumin | Sigma-Aldrich | A9056-50G | For cell staining |
| BrainVision Analyzer software | Brain Products | https://www.brainproducts.com/downloads/analyzer/ | Data export and handling |
| BTS | Sigma | 203895-5MG | |
| CHIR99021 | Stem Cell Technologies | 72054 | |
| Clear Scratch- and UV-Resistant Acrylic Sheet, 12" x 12" x 0.01 inch | McMaster Carr | 4076N11 | Tissue chip fabrication |
| Collagenase Type II | Worthington | CLS-2 / LS004176 | |
| DNase II | VWR | 89346-540 | |
| Essential 8 Medium | Thermo Fisher Scientific | A1517001 | For cell culture |
| Fibronectin | VWR | 47743-654 | Coating |
| Gelatin from porcine skin gel strength 175 Type A | Sigma-Aldrich | G2625-100G | Tissue chip fabrication |
| Geltrex LDEV-Free, hESC-Qualified, Reduced Growth Factor Basement Membrane Matrix | Thermo Fisher Scientific | A1413302 | Coating |
| HBSS | Thermo Fisher | 14175-095 | |
| HEPES (1 M) | Thermo Fisher Scientific | 15630080 | |
| Hoechst 33342 | Life technologies | H1399 | For cell staining |
| Insulin solution human | Sigma Aldrich | I9278-5ML | |
| IWR-1-endo | Stem Cell Technologies | 72564 | |
| Paraformadehyde 16% Aqueous Solution (PFA) | VWR | 100503-917 | For cell staining |
| PBS, sterile, 500 mL | Thermo Fisher Scientific | 10010049 | Tissue chip fabrication |
| phosphate buffered saline | Thermo Fisher Scientific | 10010049 | |
| Pluronic F-127 (20% Solution in DMSO) | Thermo Fisher Scientific | P3000MP | Non-ionic surfactant |
| ROCK inhibitor Y-27632 | Stem Cell Technologies | 72304 | |
| RPMI 1640 Medium, GlutaMAX Supplement | Thermo Fisher Scientific | 61870127 | For cell culture |
| RPMI 1640 Medium, no phenol red | Thermo Fisher Scientific | 11835030 | Optical mapping |
| Versene Solution | Thermo Fisher Scientific | 15040066 | chelating agent |
| VWR General-Purpose Laboratory Labeling Tape | VWR | 89098-058 | Tissue chip fabrication |
| X-Rhod-1 AM | Thermo Fisher Scientific | X14210 | Optical mapping |
Références
- Di Maria, F., Lodola, F., Zucchetti, E., Benfenati, F., Lanzani, G. The evolution of artificial light actuators in living systems: from planar to nanostructured interfaces. Chem Soc Rev. 47 (13), 4757-4780 (2018).
- Manfredi, G., et al. The physics of plasma membrane photostimulation. APL Mater. 9 (3), 030901 (2021).
- Bareket-Keren, L., Hanein, Y. Novel interfaces for light directed neuronal stimulation: advances and challenges. Int J Nanomed. 9 Suppl 1 (Suppl 1), 65-83 (2014).
- Ford, S. M., Watanabe, M., Jenkins, M. W. A review of optical pacing with infrared light. J. Neural Eng. 15 (1), 011001 (2018).
- Antognazza, M. R., et al. Shedding light on living cells. Adv Mater. 27 (46), 7662-7669 (2015).
- Zhang, J., Wang, J., Tian, H. Taking orders from light: progress in photochromic bio-materials. Mater Horiz. 1 (2), 169-184 (2014).
- Deisseroth, K. Optogenetics. Nat Methods. 8 (1), 26-29 (2011).
- Ambrosi, C. M., Entcheva, E. Optogenetics' promise: pacing and cardioversion by light. Future Cardiol. 10 (1), 1-4 (2014).
- Hopkins, J., et al. Photoactive organic substrates for cell stimulation: Progress and perspectives. Adv Mater Technol. 4 (5), 1800744 (2019).
- Vurro, V., Venturino, I., Lanzani, G. A perspective on the use of light as a driving element for bio-hybrid actuation. Appl Phys Lett. 120 (8), 080502 (2022).
- Bruno, G., et al. All-optical and label-free stimulation of action potentials in neurons and cardiomyocytes by plasmonic porous metamaterials. Adv Sci. 8 (21), 2100627 (2021).
- Ronchi, C., et al. Nongenetic optical modulation of pluripotent stem cells derived cardiomyocytes function in the red spectral range. Adv Sci. 11 (3), 2304303 (2023).
- Li, P., et al. Monolithic silicon for high spatiotemporal translational photostimulation. Nature. 626 (8001), 990-998 (2024).
- Jiang, Y., et al. Nongenetic optical neuromodulation with silicon-based materials. Nat Protoc. 14 (5), 1339-1376 (2019).
- Rotenberg, M. Y., et al. Living myofibroblast-silicon composites for probing electrical coupling in cardiac systems. Proc Natl Acad Sci USA. 116 (45), 22531-22539 (2019).
- DiFrancesco, M. L., et al. Neuronal firing modulation by a membrane-targeted photoswitch. Nat Nanotechnol. 15 (4), 296-306 (2020).
- Paternò, G. M., et al. Membrane environment enables ultrafast isomerization of amphiphilic azobenzene. Adv Sci. 7 (8), 1903241 (2020).
- Vurro, V., et al. Molecular design of amphiphilic plasma membrane-targeted azobenzenes for nongenetic optical stimulation. Front Mater. 7, 631567 (2021).
- Vurro, V., et al. Optical modulation of excitation-contraction coupling in human-induced pluripotent stem cell-derived cardiomyocytes. iScience. 26 (3), 106121 (2023).
- Vurro, V., et al. Light-triggered cardiac microphysiological model. APL Bioeng. 7 (2), 026108 (2023).
- Florindi, C., et al. Role of stretch-activated channels in light-generated action potentials mediated by an intramembrane molecular photoswitch. J. Transl. Med. 22 (1), 1068 (2024).
- McCain, M. L., Agarwal, A., Nesmith, H. W., Nesmith, A. P., Parker, K. K. Micromolded gelatin hydrogels for extended culture of engineered cardiac tissues. Biomaterials. 35 (21), 5462-5471 (2014).
- Park, S. -. J., et al. Insights into the pathogenesis of catecholaminergic polymorphic ventricular tachycardia from engineered human heart tissue. Circulation. 140 (5), 390-404 (2019).
- Lee, K. Y., et al. An autonomously swimming biohybrid fish designed with human cardiac biophysics. Science. 375 (6581), 639-647 (2022).
- Lian, X., et al. Directed cardiomyocyte differentiation from human pluripotent stem cells by modulating Wnt/β-catenin signaling under fully defined conditions. Nat Protoc. 8 (1), 162-175 (2013).
- Prondzynski, M., et al. Efficient and reproducible generation of human iPSC-derived cardiomyocytes and cardiac organoids in stirred suspension systems. Nat Commun. 15 (1), 5929 (2024).
- Pasqualini, F. S., Sheehy, S. P., Agarwal, A., Aratyn-Schaus, Y., Parker, K. K. Structural phenotyping of stem cell-derived cardiomyocytes. Stem Cell Rep. 4 (3), 340-347 (2015).
- Fonck, E., et al. Effect of aging on elastin functionality in human cerebral arteries. Stroke. 40 (7), 2552-2556 (2009).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon
Nous utilisons des cookies afin d'améliorer votre expérience sur notre site web.
En continuant à utiliser notre site ou en cliquant sur le bouton ''continuer'', vous acceptez l'utilisation de cookies.
