Method Article
一种通过非遗传光刺激研究 Ca2+ 传播的心脏微生理系统
* 这些作者具有相同的贡献
摘要
利用光来控制心脏细胞和组织可实现非接触式刺激,从而保持细胞的自然状态和功能,使其成为基础研究和治疗应用的宝贵方法。
摘要
体外 心脏微生理模型对于科学研究、药物开发和医疗应用具有高度可靠性。尽管被科学界广泛接受,但由于缺乏非侵入性刺激技术,这些系统的寿命仍然有限。光换能器提供了一种有效的刺激方法,提供具有高时间和空间分辨率的无线方法,同时最大限度地减少了刺激过程中的侵入性。在这份手稿中,我们提出了一种全光学方法,用于刺激和检测 体外 心脏微生理模型的活性。具体来说,我们通过接种 3D 生物反应器悬浮培养物中产生的人诱导多能干细胞衍生的心肌细胞 (hiPSC-CMs) 来制造工程化层状各向异性组织。我们使用光换能器,一种名为 Ziapin2 的两亲性偶氮苯衍生物进行刺激,并使用 Ca2+ 染料 (X-Rhod 1) 来监测系统的响应。结果表明,Ziapin2 可以在所采用的系统中光调节 Ca2+ 反应,而不会影响组织完整性、活力或行为。此外,我们表明,与当前的黄金标准电刺激相比,基于光的刺激方法提供了相似的分辨率。总体而言,该协议为 Ziapin2 和基于材料的光刺激在心脏研究中的应用开辟了有希望的前景。
引言
利用光刺激活细胞和组织正在成为生物医学研究中的重要游戏规则改变者,它提供具有精确时间和空间分辨率的非接触式刺激能力 1,2,3,4,5,6。光遗传学是使细胞对光敏感的主要技术之一,它涉及对细胞进行基因修饰以表达光敏离子通道或泵 7,8。这种方法在调节活组织内的细胞方面显示出令人印象深刻的有效性;然而,它对病毒基因转移的依赖阻碍了其在研究和临床应用中的广泛采用。
为了克服这一限制,有机和无机材料已被用作光敏传感器,以开发非遗传的、基于材料的光介导刺激技术 9,10。有机纳米结构光传感器 11,12,13,14,15 最近在触发各种应用(包括神经元、心肌细胞和骨骼肌细胞)的细胞反应方面取得了显著的成功。
在此,我们提出了 Ziapin216,17,18,一种偶氮苯衍生物,用于研究 Ca2+ 在工程层状心脏组织中的繁殖。分子的两亲性结构允许精确靶向细胞质膜,而偶氮苯核心能够光诱导异构化,导致其构象变化 16,17,18。在心肌细胞中,这种反式到顺式异构化改变了质膜厚度,诱导了一连串效应,从而产生动作电位,进而触发兴奋-收缩过程 19,20,21。
此外,我们描述了用于心脏组织各向异性生长的工程平台的制造过程22 并详细介绍了用于光学触发和监测其活动的实验设置,特别关注获得组织内的 Ca2+ 动力学23,24。最后,我们将获取的信号与通过电刺激获得的信号进行比较,电刺激被认为是参考标准。总体而言,该协议强调了新型光响应换能器在促进我们对心脏细胞行为的理解方面的应用,尤其是在工程组织的背景下。
研究方案
使用的人多能干细胞 (hiPSC) 培养物是一种野生型人雄性 iPSC 细胞系,含有多西环素 (Dox) 诱导的 CRISPR/Cas9 系统,该系统通过将 CAGrtTA::TetO-Cas9 引入 AAVS1 基因座而产生 (Addgene: #73500)。该研究是根据波士顿儿童医院机构审查委员会批准的方案进行的。在患者参与研究之前获得患者的知情同意。如前所述诱导 hiPSC 来源的心肌细胞 (hiPSC-CM) 的产生25,26。该协议将在以下部分中简要总结:
1. 人诱导多能干细胞来源的心肌细胞的产生和制备
- 用 PBS 洗涤在 T75 培养瓶中培养的 hiPSC 一次。通过与螯合剂 Versene 孵育 10-15 分钟分离细胞,并将种子接种到用 1% 非离子表面活性剂溶液以 5000 万个 IPSC/容器的密度预处理的生物反应器容器中,溶于 100 mL 补充有 10 μM ROCK 抑制剂 Y-27632 的 E8 培养基中。
- 设置以下生物反应器参数:搅拌 60 rpm,温度 37 °C,pH 7,覆盖加气(O2 和 CO2),速度为 3 标准 L/h。
- 培养 1 天后,确认胚状体 (EB) 直径已达到 100-300 μM,并用含有 7 μM CHIR99021的碱性 RPMI 培养基(补充有 B27 减去胰岛素的 RPMI 1640 培养基)处理细胞 24 小时,然后更换培养基至 RPMI 再 24 小时。加入含有 5 μ M IWR-1-endo 的碱性 RPMI 培养基再添加 48 小时,以开始向心脏谱系分化过程。48 小时后,将培养基改回碱性 RPMI。
- 在分化第 7 天,在补充有 1:1,000 (v/v) 人胰岛素的碱性 RPMI 培养基中培养细胞。每 2 天刷新一次培养基,如果耗氧量超过 50%,则每天更换 30% 培养基。
- 在第 15 天,使用含有 HBSS、胶原酶 II(200 单位/mL)、HEPES(10 mM)、ROCK 抑制剂 Y-27632(10 μM)和 N-苄基对甲苯磺酰胺(BTS,30 μM)的胶原酶 II 溶液将生物反应器细胞酶解离 3 小时。为此,首先用预热的HBSS洗涤分化的hiPSC-CM EBs 2x,并在37°C的5%CO2 中将它们在胶原酶II溶液(200μl体积的EBs / 12ml胶原酶II溶液)中孵育,直到单细胞从完全EB解离中出现。
- 向单细胞悬液中加入等体积的封闭缓冲液(不含 B27 和 DNase II 的 RPMI-1640,每 mL RPMI-1640 含 6 μL DNase II)来终止解离反应。计数分化的 hiPSC-CMs,离心(200 × g,5 分钟),并通过将细胞在 -80 °C 下在异丙醇中冷冻 24 小时并将它们移至液氮罐直至进行接种来准备下游应用。
2. 工程层状组织制造
- 将两层实验室胶带(一层白色和一层蓝色)粘附到 1 毫米厚的透明、耐刮擦和抗紫外线亚克力板上。使用 CO2 激光雕刻机,按照矢量图形软件(例如 CorelDraw)中的设计,在胶带上将亚克力板切割成圆圈(直径 20 毫米以适合 12 MW)和芯片图案(3 x 7.5 毫米正方形,每个芯片三个);亚克力切割参数:100 功率、20 速度和 1,000 PPI;胶带切割参数:8 功率、6 速度和 1,000 PPI。用镊子撕下最内层线内的两层胶带,将木片浸泡在纯漂白剂中 30 分钟至 1 小时,以去除切割中的粗线和黑点,留下尖锐的线条,然后在烧杯中用流动的去离子 (DI) 水冲洗木片过夜或至少 3 小时。
注:漂白时间不要超过 2 小时,因为这会蚀刻侧壁上的粘合剂,阻止明胶正确粘附。 - 在干净的 70% 乙醇中对芯片超声处理 10 分钟,并将具有线槽特征(25 μm 脊宽、4 μm 槽宽和 5 μm 槽深)的聚二甲基硅氧烷(PDMS,Sylgard 184)邮票超声处理 30 分钟。将芯片和邮票转移到引擎盖下的干净区域,让它们在气流下干燥 ~1-2 小时。
- 称取 1 g 猪皮明胶(凝胶强度 ~175 g Bloom,A 型)放入 50 mL 管中。加入 5 mL 磷酸盐缓冲盐水 (PBS) 并充分混合,以确保明胶立即溶解。将试管置于 65 °C 水浴中 30 分钟以完成溶出过程。同样,称取 1 g 微生物谷氨酰胺转移酶 (MTG) 放入单独的 50 mL 试管中。加入 12.5 mL PBS,充分混合,并将试管置于 37 °C 水浴中 30 分钟,以确保 MTG 完全溶解。
- 对明胶管进行超声处理 15 分钟,然后在使用前将其放回 65 °C 水浴中。将 MTG 管放入干燥器中,稍微松开盖子,然后慢慢打开真空。观察在真空下从 MTG 溶液中去除的气泡。脱气后,将 MTG 管放回 37 °C 水浴中。
注意:监控过程并调整真空以避免剧烈沸腾。 - 用干净的封口膜盖住网格板,将芯片放在网格上,并将邮票放在附近,以备使用。将 5 mL MTG 添加到 5 mL 明胶溶液中,小心移液以避免气泡;然后,将明胶快速移液到芯片上,使用足以覆盖芯片区域(每个约 0.5 mL)的明胶。然后,将线型 PDMS22 (线宽 25 μm,高 5 μm,间距 4 μm)印章放在顶部,并施加 200 g 的砝码,以确保明胶的图案平行于组织的纵轴。所有芯片成型后,用玻璃罐盖住它们以避免环境干扰,并让它们在夜间交联。
注意:在 5 分钟内使用混合溶液明胶-MTG;否则,由于明胶的交联状态较高,目标模式将发生改变。 - 将芯片和 PDMS 邮票三明治转移到装满 PBS 的新 P150 培养皿中,并将明胶水合 30 分钟至 1 小时,以促进 PDMS 邮票与芯片分离。去除芯片周围多余的未成型明胶,并将干净的芯片转移到装满 PBS 的新 P150 培养皿中。将 PDMS 邮票储存在 70% 乙醇中。
- 通过在引擎盖下将芯片浸泡在乙醇中 10 分钟来对芯片进行消毒。
注意:不要在乙醇中超过 10 分钟,因为长时间暴露可能会使明胶变形。 - 将芯片转移到 PBS 中,浸泡 10 分钟,然后冲洗 3 次。通过在培养培养基(每孔约 0.5 mL)中将 20 μg/mL 纤连蛋白与 1:100 稀释的基底膜基质混合来制备包被溶液。将芯片在 37 °C 和 5% CO2 的培养箱中或在 4 °C 下包被 2 小时过夜。
- 在含有 Y-27632 (10 μM) 的 RPMI 培养基中解冻并接种细胞(每厘米 2 8 × 10个 5 个 hiPSC-CM),然后在 24 小时后用不含 Y-27632 的 RPMI 替换。
- 细胞接种后 3 天,用镊子去除白色胶带。
3. 光换能器的合成与应用
注:Ziapin2 根据先前发表的程序16,18 合成,并直接在培养基中施用到 hiPSC-CM。
- 向细胞培养物中加入 25 μM Ziapin2,并在 37 °C 和 5% CO2 下孵育 7 分钟。
- 轻轻洗去多余的分子,然后用新鲜的培养基冲洗。
4. 活力检测
注:Alamar Blue 是一种基于刃天青的测定法,可以渗透细胞并作为氧化还原指示剂来监测细胞活力。刃天青溶于生理缓冲液中,产生深蓝色溶液,可直接添加到培养物中的细胞中。具有活跃代谢的活细胞将刃天青还原为试冬氨酸,试卤素呈粉红色和荧光。
- 将细胞铺在 96 孔板中,之前在培养基中涂有 20 μg/mL 纤连蛋白和 1:100 稀释的基底膜基质。通过振荡混合,然后在无菌中加入 Alamar Blue,其量等于孔体积的 10%。
- 用 Alamar Blue 孵育培养物 4 小时。
- 如前所述,用光换能器和载体 (DMSO) 处理细胞。通过光纤(青色,470 nm)施加光刺激(1 Hz 脉冲光 1 分钟),以评估 Ziapin2 内化和光暴露对 hiPSC-CM 活力的影响。
- 使用酶标仪在 560 nm 激发波长和 590 nm 发射波长处读取荧光。
5. 工程层状心脏组织各向异性的评估
注:该协议概述了一种使用免疫染色、共聚焦显微镜和细胞核分析评估工程层状心脏组织各向异性的系统方法27。
- 用 PBS 洗涤底物数次,然后用含有 0.05% (v/v) Triton X-100 的 4% (v/v) 多聚甲醛在 PBS 中固定 10 分钟。
- 通过将样品与 5% (w/v) 牛血清白蛋白 (BSA) 的 PBS 溶液孵育 30 分钟来阻断非特异性结合。
- 将样品与 Hoechst (1:500) 在室温下孵育 1 小时。
- 用 PBS 洗涤,然后用抗褪色剂安装到显微镜载玻片上。让载玻片干燥过夜并储存在 4 °C 直至成像。
- 使用转盘式共聚焦显微镜以 20 倍放大倍率对样品进行成像。使用 FiJi 插件 OrientationJ Measure28 确定单元格的方向。
6. 光学映射记录
注:在接种在明胶模塑组织芯片上的 hiPSC-CMs 上培养 5 天后进行光学映射。
- 为了遵循此协议,请确保光学映射设备由配备高速相机的改良串联镜头显微镜和激发光源(200 mW 汞灯)组成。在指定的 Ca2+ 成像相机前面放置一面二向色镜,以确保制剂暴露在激发光下并收集来自样品的发射荧光。
- 将样品与添加到培养基中的 2 μM X-Rhod 1 在 37 °C 下孵育 30 分钟。
注意:仅在图像采集期间将样品暴露在光线下,以避免染料发生光漂白。 - 如前面第 3 节所述孵育光膜诱导器。
- 用新鲜的培养基洗涤,并将芯片转移到补充有 B27 不含胰岛素的不含酚红的 RPMI 1640 培养基中。
- 将组织芯片放入温控皿中,在生理温度 (37 °C) 下开始记录,以 2.5 帧/秒的帧速率采集图像。
- 对于光学起搏,使用 LED 光源 (465/25 nm) 在组织的一端施加光学点刺激,以允许 Ziapin2 刺激。通过距离组织 0.5 mm 的时间调节光纤以 1 或 1 Hz 的频率对组织起搏。对于电起搏,使用位于矩形组织最远端中心的双极铂电极进行点刺激。这种放置可确保 Ca2+ 波传播源自组织宽度的中点,该中点对应于矩形的较短边。刺激应以 0.5 Hz 的频率施加,振幅为 10 V,脉冲持续时间为 100 ms。
- 录制后,应用像素大小为 3 x 3 的空间滤镜以提高信噪比。
- 确定每个脉冲在每个像素处的 Ca2+ 波传导速度,计算沿 x 和 y 方向的变化率。为此,请测量 Ca2+ 信号强度在这些方向上的空间梯度,并将其与信号传播的时间延迟相关联。通过组合这些方向变化率,量化波在两个维度上穿过蜂窝场的速度。
7. 数据导出和处理
- 使用引用的软件提取和分析数据。
- 应用 3 x 3 像素的空间滤镜以提高信噪比。
- 提取 Ca2+ 瞬变 (CaT) 迹线作为特定手动选择感兴趣区域 (ROI) 的平均值。
- 在 50 x 50 像素 (≈ 25 mm2) 的中心感兴趣区域 (ROI) 中测量 CaT 参数。
- 对于每个 CaT,分析 CaT 振幅、上升时间(t峰值)、最大衰减斜率时间(Max Decay Slope)和达到 90% 瞬态衰减的时间(Decay Time90)。
8. 统计分析
- 使用适当的统计检验(如正态性检验)评估分布的正态性,以确定应采用参数方法还是非参数方法。
- 分别对连续数据或分类数据使用学生 t 检验或 Mann-Whitney U 检验评估两个条件之间的统计显著性。在比较两个以上的组时,根据数据假设使用单因子方差分析或 Kruskal-Wallis 检验,然后进行适当的事后检验来识别显著的成对差异。
结果
开发并实施了一种多步骤工艺,用于结合使用激光图案化、明胶成型和细胞接种技术来制造工程层状心脏组织。该技术最初由 McCain 等人 22 和 Lee 等人 24 建立,按照他们的方案构建工程层状微组织,该技术被重新实施。该工艺集成了用于结构引导的基于激光的精确图案化、作为支架材料的明胶和受控的细胞接种,以创造一个仿生组织环境。(图 1)。
纸质基材的沉积涉及将两层实验室标记胶带(一层白色和一层蓝色)粘附到 1 毫米厚的丙烯酸基材上,为后续步骤提供坚固的基础,并在制造过程中实现精确的可视化和作(图 1A)。采用激光图案化在基板上实现所需的芯片几何形状,优化参数可确保在不损坏丙烯酸基材的情况下进行精确烧蚀(图 1B)。选择性去除胶带层暴露了基材的特定区域以进行进一步加工。然后将由猪皮制备并与微生物谷氨酰胺转移酶交联的明胶溶液沉积到图案化的丙烯酸表面上,以形成适合细胞粘附的生物相容性层(图 1C)。该明胶层是使用具有线槽图案的 PDMS 印章模制的,确保与组织的纵轴对齐,并在夜间交联以产生稳定的图案化基材(图 1D 和补充图 S1)。
将人诱导的多能干细胞来源的心肌细胞 (hiPSC-CM) 以大约 8 × 105 个细胞/cm2 的密度接种到预包被的底物上(图 1E)。通过每日培养基更新优化培养条件以支持细胞生长。3 天后,去除白色带层以露出图案化的明胶表面(图 1F),确保将细胞精确限制在特定的底物区域,促进具有所需几何配置的生物工程层组织的发育。随后评估了生物工程组织中 hiPSC-CMs 的活力和对齐。
使用 AlamarBlue 检测评估 Ziapin2 内化后光照对细胞活力的影响。 图 2A 中报告的结果表明,当以 25 μM 的浓度内化并随后进行 470 nm 光刺激时,Ziapin2 不会对细胞活力产生不利影响,证实了这种光传感器方法与活细胞的兼容性。
生物工程层组织内的各向异性按预期实现,荧光成像显示沿着微成型明胶基材的图案凹槽有明显的细胞排列(图 2B)。使用 FiJi 插件 OrientationJ28 定量评估从荧光图像中明显的细胞方向。通过处理 Hoechst 荧光图像来评估方向,得到平均角度等于 θ平均值 = 13.39 ± 2.67°。该角度表示归一化为图案方向的方向,显示组织中高度各向异性。测得的角度分布以及标准差的低测量值表明组织结构具有很强的方向偏好(图 2C)。这证明了各向异性心脏组织的形成,这对于模拟适当功能表现(如协调收缩和导电)所需的自然结构至关重要。
培养 5 天后,对接种在明胶模塑组织芯片上的载有 Ziapin2 的 hiPSC-CMs 进行光学映射(图 3)。光学标测提供了工程心脏组织内 Ca2+ 动力学的清晰详细成像,并辅以高速相机和精确的光刺激。使用 LED 光源有效实现了 Ziapin2 刺激,组织样本对 0.5 Hz(图 4A)和 1 Hz(图 4B)频率的起搏反应良好。
这些频率的光刺激诱导 Ca2+ 波在组织中传播,并计算了纵向传导速度,显示电信号在两个刺激频率下在整个组织中均匀传播,结果等于 4.5 ± 0.5 cm/s(图 4A、B)。
最后,我们将我们的方法与电刺激的金标准参考进行了比较。如图 5 所示,对 Ca2+ 瞬变 (CaTs) 的详细分析表明,关键参数,包括 CaT 振幅(图 5A)、上升时间(图 5B)、最大衰减斜率(图 5C)和衰减时间(图 5D),在两个刺激线索之间是相似的。总体而言,光学标测方法提供了有关生物工程层状心脏组织生理特性的高分辨率数据,证明了 Ziapin2 通过光刺激调节其行为的有效性。

图 1:层状心脏组织制备草图。(A) 在丙烯酸基材上沉积两条纸带。(B) 通过激光烧蚀对两个纸层进行图案化。(C) 明胶在图案化基材上的沉积。(D) 通过线型 PDMS 印章对明胶层进行成型和烧结。(E) 在制备的底物上接种细胞。(F) 去除第一个图纸层,达到所需的几何形状。缩写:PDMS = 聚二甲基硅氧烷。 请单击此处查看此图的较大版本。

图 2:生物工程层状心脏组织中的细胞活力和排列。 (A) Ziapin2 内化和光照对 Alamar Blue 测定法测量的 hiPSC-CMs 活力的影响。Ctrl 在黑暗中的细胞活力设置为 100%。数据表示为每个条件的平均值 (SEM) n = 16 的平均值±标准误差。(B) 微成型明胶上的各向异性生物工程层组织。各向异性 hiPSC 组织的荧光图像;比例尺 = 100 μm。用 Hoechst(蓝色)对细胞进行染色。(C) 接种在明胶底物上的细胞的平均取向(归一化为模式方向)(来自 4 个不同样品的 N = 45 ROI,平均分布角度,θ平均值 = 13.39° ± 2.67°)。缩写:hiPSC-CM = 人诱导的多能干细胞来源的心肌细胞;ROI = 感兴趣区域。 请单击此处查看此图的较大版本。
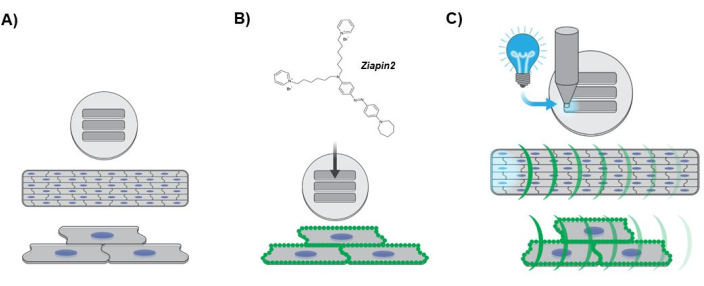
图 3:描述实验方案的图表。 (A) 各向异性心脏组织形成。hiPSC-CMs 细胞核以蓝色表示。(B) 光换能器内化到工程层组织中。沿肌膜的绿点表示 Ziapin2 膜分配。(C) 光刺激协议和 Ca2+ 动态光学映射。青色光表示使用 LED 光源施加在组织一端的光点刺激。绿色曲率代表 Ca2+ 波沿工程层组织的传播。缩写:hiPSC-CMs = 人诱导的多能干细胞来源的心肌细胞;LED = 发光二极管。 请单击此处查看此图的较大版本。
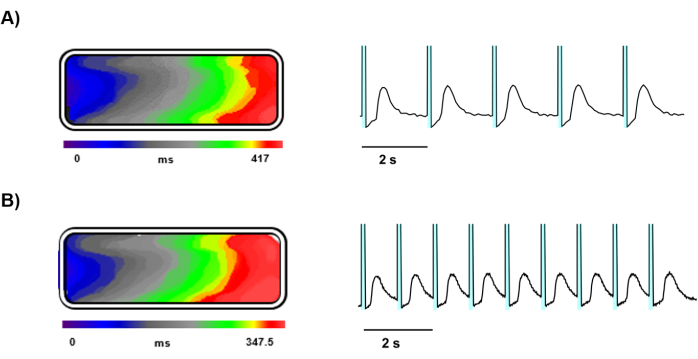
图 4:光触发 Ca2+ 波的代表性记录。表示 (A) 0.5 Hz 和 (B) 1 Hz 下光刺激组织的 Ca2+ 波前传播、等时线图和 Ca2+ 信号轨迹。在代表中,每个 Ca2+ 瞬变之前的青色阴影区域代表光激发。请单击此处查看此图的较大版本。
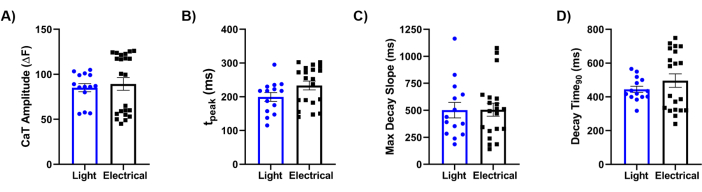
图 5:电刺激和光刺激的比较。 定量定量在以 0.5 Hz 接种 hiPSC-CMs 的芯片上记录的光诱导和电诱发 Ca2+ 瞬态 (CaT) 参数。分析的 CaT 特征是 (A) CaT 振幅;(B) 上升时间 (t峰);(C) 最大衰减斜率 (Max Decay Slope) 的时间;(D) 达到 90% 瞬态衰减的时间 (Decay Time90)。在 37 °C 下对每种条件进行配对测量。光刺激 N = 5 个芯片,n = 14 个组织;电刺激 N = 8 个芯片,n = 22 个组织。数据表示为平均值±平均值的标准误差。缩写:CaT = Ca2+ 瞬时;hiPSC-CMs = 人诱导的多能干细胞来源的心肌细胞。 请单击此处查看此图的较大版本。
补充图 S1:PDMS 和明胶基材的微图案化评估。 (A) 在 PDMS 邮票上实现的图案的光学图像;比例尺 =100 μm。(B) 微成型明胶基材的光学图像;比例尺 =100 μm。(C) PDMS 邮票(黑线)和微成型明胶薄膜(红线)的图案轮廓。 请点击此处下载此文件。
讨论
这种方法为推进心脏研究提供了一个强大的平台,提供了对心脏组织复杂动力学的见解,为长期 体外 心脏机制研究开辟了新的可能性,这可能导致新的治疗策略。为了确保这种方法的成功,重现与人体心脏 体内条件非常相似 的微生理环境至关重要。因此,必须仔细注意设计和对齐组织以复制心脏结构的自然各向异性,这对于适当的电传导和收缩功能至关重要。关键因素包括芯片模型的精确激光切割、漂白处理的时间以及明胶溶液粘度的控制,所有这些都是创建均匀生活用纸模具所必需的。此外,用纤连蛋白和 GelTrex(还原生长因子基底膜基质)准确包被芯片对于成功贴壁和随后的组织形成至关重要。
此外,必须仔细控制光致动器(即 Ziapin216,18)的孵育时间和浓度,以确保充分内化。彻底清洗多余的分子对于防止非特异性影响至关重要。始终建议进行活力测定,以评估分子是否对细胞有任何不利影响。如果光致动器的内化不充分,请考虑延长孵育时间或使用更高的浓度。
对于功能实验,正确设置光学映射设备,包括光纤的精确定位和刺激频率的校准,对于捕获高质量数据至关重要。如果记录显示高噪声水平,请优化空间滤波器大小或检查光学设置中是否有任何错位。
该方法具有几个显著的优势;对齐的 hiPSC-CMs 的开发和应用代表了复制天然心脏组织特征的显着改进。通过细胞排列,研究人员可以密切模拟天然心脏组织的各向异性结构,这对于维持适当的电气和机械功能至关重要。这确保了心肌细胞以与 体内 条件非常相似的方式相互作用,从而表现出更能代表天然心脏的生理行为。
与需要布线和电极进入电解质的电刺激不同,基于光的调制提供了一种非侵入性的精确方法来控制特定区域的电特性。根据强度、波长和时间调整光的能力有助于在不干扰相邻区域的情况下进行有针对性的干预。此外,与光遗传学相反,光遗传学需要对细胞进行基因改造以表达光敏通道或蛋白质,不需要病毒基因转移。这些方面对于基因改造不可行或不希望的应用至关重要。此外,材料的光刺激能力解开了细胞或程序的特异性,使这种刺激方法很容易转移到不同的细胞类型。
对心脏组织的动态和实时控制是这种方法的另一个优势。光的使用可以实时调节电特性,为研究不同刺激如何影响心脏功能提供了强大的工具。与 Ziapin2 的集成允许将光直接转换为电信号,从而能够精确控制 hiPSC-CM 中的动作电位和节律。
这种方法还有望推进研究应用,为创建准确的疾病模型奠定基础,特别是对于心律失常和其他电气疾病,使研究人员能够在受控环境中研究细胞对各种刺激或药物的反应。此外,它为药物筛选和毒性测试提供了一个强大的平台,与传统动物模型相比,它提供了更符合人类的背景。
在这方面,还解决了道德考虑,因为这项技术减少了对动物模型的依赖,符合 3R(替换、减少和细化)的原则。通过为人类心脏反应提供更合乎道德和潜在预测性的模型,它支持向更人性化的研究实践转变。
该方法的可扩展性和定制性进一步增强了其实用性。研究人员可以根据特定的研究需求定制组织结构,调整细胞类型、对齐和光换能器位置等因素。此外,该方法有可能扩展到更大规模的实验或高通量研究,使其成为基础研究和临床前应用的多功能工具。
最后,个性化医疗的潜力是巨大的。通过从个体患者那里获得 hiPSC-CM,研究人员可以创建患者特异性心脏组织模型,从而能够研究对药物或干预措施的个性化反应。这为心脏病学的定制治疗方法铺平了道路,为治疗开发提供了新的途径。
披露声明
CB、GL 和 FL 是“PHOTOCHROMIC COMPOUNDS”专利号的发明者。EP 3802491 (2020 年 2 月 7 日)。
致谢
作者非常感谢 Michael Rosnach 提供 图 1 和 图 3 中的插图,并感谢 William T. Pu 教授提供 hiPSC。这项工作得到了 NCATS 组织芯片联盟 (UH3 TR003279) 到 KKP 的支持,意大利大学和研究部通过 PRIN 2022 项目 (ID 2022-NAZ-0595) 到 FL,PRIN 2020 项目 (ID 2020XBFEMS) 到 CB 和 GL,以及 Fondo Italiano per la Scienza 项目 (ID FIS00001244) 到 GL。
材料
| Name | Company | Catalog Number | Comments |
| alamarBlue Cell Viability Reagent | Thermo Fisher Scientific | DAL1025 | Cell Viability Assay |
| B-27 Supplement, minus insulin | Thermo Fisher Scientific | A1895601 | For cell culture |
| Bovine Serum Albumin | Sigma-Aldrich | A9056-50G | For cell staining |
| BrainVision Analyzer software | Brain Products | https://www.brainproducts.com/downloads/analyzer/ | Data export and handling |
| BTS | Sigma | 203895-5MG | |
| CHIR99021 | Stem Cell Technologies | 72054 | |
| Clear Scratch- and UV-Resistant Acrylic Sheet, 12" x 12" x 0.01 inch | McMaster Carr | 4076N11 | Tissue chip fabrication |
| Collagenase Type II | Worthington | CLS-2 / LS004176 | |
| DNase II | VWR | 89346-540 | |
| Essential 8 Medium | Thermo Fisher Scientific | A1517001 | For cell culture |
| Fibronectin | VWR | 47743-654 | Coating |
| Gelatin from porcine skin gel strength 175 Type A | Sigma-Aldrich | G2625-100G | Tissue chip fabrication |
| Geltrex LDEV-Free, hESC-Qualified, Reduced Growth Factor Basement Membrane Matrix | Thermo Fisher Scientific | A1413302 | Coating |
| HBSS | Thermo Fisher | 14175-095 | |
| HEPES (1 M) | Thermo Fisher Scientific | 15630080 | |
| Hoechst 33342 | Life technologies | H1399 | For cell staining |
| Insulin solution human | Sigma Aldrich | I9278-5ML | |
| IWR-1-endo | Stem Cell Technologies | 72564 | |
| Paraformadehyde 16% Aqueous Solution (PFA) | VWR | 100503-917 | For cell staining |
| PBS, sterile, 500 mL | Thermo Fisher Scientific | 10010049 | Tissue chip fabrication |
| phosphate buffered saline | Thermo Fisher Scientific | 10010049 | |
| Pluronic F-127 (20% Solution in DMSO) | Thermo Fisher Scientific | P3000MP | Non-ionic surfactant |
| ROCK inhibitor Y-27632 | Stem Cell Technologies | 72304 | |
| RPMI 1640 Medium, GlutaMAX Supplement | Thermo Fisher Scientific | 61870127 | For cell culture |
| RPMI 1640 Medium, no phenol red | Thermo Fisher Scientific | 11835030 | Optical mapping |
| Versene Solution | Thermo Fisher Scientific | 15040066 | chelating agent |
| VWR General-Purpose Laboratory Labeling Tape | VWR | 89098-058 | Tissue chip fabrication |
| X-Rhod-1 AM | Thermo Fisher Scientific | X14210 | Optical mapping |
参考文献
- Di Maria, F., Lodola, F., Zucchetti, E., Benfenati, F., Lanzani, G. The evolution of artificial light actuators in living systems: from planar to nanostructured interfaces. Chem Soc Rev. 47 (13), 4757-4780 (2018).
- Manfredi, G., et al. The physics of plasma membrane photostimulation. APL Mater. 9 (3), 030901 (2021).
- Bareket-Keren, L., Hanein, Y. Novel interfaces for light directed neuronal stimulation: advances and challenges. Int J Nanomed. 9 Suppl 1 (Suppl 1), 65-83 (2014).
- Ford, S. M., Watanabe, M., Jenkins, M. W. A review of optical pacing with infrared light. J. Neural Eng. 15 (1), 011001 (2018).
- Antognazza, M. R., et al. Shedding light on living cells. Adv Mater. 27 (46), 7662-7669 (2015).
- Zhang, J., Wang, J., Tian, H. Taking orders from light: progress in photochromic bio-materials. Mater Horiz. 1 (2), 169-184 (2014).
- Deisseroth, K. Optogenetics. Nat Methods. 8 (1), 26-29 (2011).
- Ambrosi, C. M., Entcheva, E. Optogenetics' promise: pacing and cardioversion by light. Future Cardiol. 10 (1), 1-4 (2014).
- Hopkins, J., et al. Photoactive organic substrates for cell stimulation: Progress and perspectives. Adv Mater Technol. 4 (5), 1800744 (2019).
- Vurro, V., Venturino, I., Lanzani, G. A perspective on the use of light as a driving element for bio-hybrid actuation. Appl Phys Lett. 120 (8), 080502 (2022).
- Bruno, G., et al. All-optical and label-free stimulation of action potentials in neurons and cardiomyocytes by plasmonic porous metamaterials. Adv Sci. 8 (21), 2100627 (2021).
- Ronchi, C., et al. Nongenetic optical modulation of pluripotent stem cells derived cardiomyocytes function in the red spectral range. Adv Sci. 11 (3), 2304303 (2023).
- Li, P., et al. Monolithic silicon for high spatiotemporal translational photostimulation. Nature. 626 (8001), 990-998 (2024).
- Jiang, Y., et al. Nongenetic optical neuromodulation with silicon-based materials. Nat Protoc. 14 (5), 1339-1376 (2019).
- Rotenberg, M. Y., et al. Living myofibroblast-silicon composites for probing electrical coupling in cardiac systems. Proc Natl Acad Sci USA. 116 (45), 22531-22539 (2019).
- DiFrancesco, M. L., et al. Neuronal firing modulation by a membrane-targeted photoswitch. Nat Nanotechnol. 15 (4), 296-306 (2020).
- Paternò, G. M., et al. Membrane environment enables ultrafast isomerization of amphiphilic azobenzene. Adv Sci. 7 (8), 1903241 (2020).
- Vurro, V., et al. Molecular design of amphiphilic plasma membrane-targeted azobenzenes for nongenetic optical stimulation. Front Mater. 7, 631567 (2021).
- Vurro, V., et al. Optical modulation of excitation-contraction coupling in human-induced pluripotent stem cell-derived cardiomyocytes. iScience. 26 (3), 106121 (2023).
- Vurro, V., et al. Light-triggered cardiac microphysiological model. APL Bioeng. 7 (2), 026108 (2023).
- Florindi, C., et al. Role of stretch-activated channels in light-generated action potentials mediated by an intramembrane molecular photoswitch. J. Transl. Med. 22 (1), 1068 (2024).
- McCain, M. L., Agarwal, A., Nesmith, H. W., Nesmith, A. P., Parker, K. K. Micromolded gelatin hydrogels for extended culture of engineered cardiac tissues. Biomaterials. 35 (21), 5462-5471 (2014).
- Park, S. -. J., et al. Insights into the pathogenesis of catecholaminergic polymorphic ventricular tachycardia from engineered human heart tissue. Circulation. 140 (5), 390-404 (2019).
- Lee, K. Y., et al. An autonomously swimming biohybrid fish designed with human cardiac biophysics. Science. 375 (6581), 639-647 (2022).
- Lian, X., et al. Directed cardiomyocyte differentiation from human pluripotent stem cells by modulating Wnt/β-catenin signaling under fully defined conditions. Nat Protoc. 8 (1), 162-175 (2013).
- Prondzynski, M., et al. Efficient and reproducible generation of human iPSC-derived cardiomyocytes and cardiac organoids in stirred suspension systems. Nat Commun. 15 (1), 5929 (2024).
- Pasqualini, F. S., Sheehy, S. P., Agarwal, A., Aratyn-Schaus, Y., Parker, K. K. Structural phenotyping of stem cell-derived cardiomyocytes. Stem Cell Rep. 4 (3), 340-347 (2015).
- Fonck, E., et al. Effect of aging on elastin functionality in human cerebral arteries. Stroke. 40 (7), 2552-2556 (2009).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。