Method Article
Echinococcus granulosus'tan Küçük Hücre Dışı Veziküllerin İzolasyonu ve Dendritik Hücre Alımı
Bu Makalede
Özet
Burada, Echinococcus granulosus'tan in vitro kültür koşullarını, izolasyonu ve hücre dışı veziküllerin (EV'ler) artan oluşumunu açıklıyoruz. Küçük EV'ler, dinamik ışık saçılımı ve transmisyon elektron mikroskobu ile karakterize edildi. Kemik iliği kaynaklı dendritik hücrelerin tutulumu ve fenotipik modülasyonları, konfokal mikroskopi ve akış sitometrisi kullanılarak incelendi.
Özet
Hücre dışı veziküllerin sestodlar tarafından salgılanması, sadece parazitler arasında değil, aynı zamanda konakçı dokularla da hücresel iletişimi sağlamak için çok önemlidir. Özellikle, küçük hücre dışı veziküller (sEV'ler), konak immünomodülasyonu ve parazit sağkalımında kritik olan doğal antijenleri aktaran nano taşıyıcılar olarak işlev görür. Bu makale, Echinococcus granulosus'un larva evresindeki kültürlerinden sEV'leri izole etmek için adım adım bir protokol sunmakta ve bunların bir haftalık in vitro kültürden sonra olgunlaşmaları sırasında adezyon ve antijen sunum kapasitesi kazanan murin kemik iliğinden elde edilen dendritik hücreler tarafından alımını analiz etmektedir. Bu makale, dinamik ışık saçılımı ve transmisyon elektron mikroskobunun paralel analizlerinin yanı sıra ultrasantrifüjleme kullanarak sEV'lerin oluşturulması, saflaştırılması ve miktarının belirlenmesi için kapsamlı bilgiler sağlar. Ek olarak, fare kemik iliği hücrelerini izole etmek ve yetiştirmek ve bunların Flt3L kullanarak dendritik hücrelere farklılaşmasını sağlamak için ayrıntılı bir deneysel protokol özetlenmiştir. Bu dendritik hücreler, naif T hücrelerine antijenler sunabilir ve böylece in vivo olarak immün yanıt tipini modüle edebilir. Bu nedenle, daha önce parazitik sEV'lere maruz kalan dendritik hücrelerin edinilmiş olgunlaşma fenotipini kontrol etmek için konfokal mikroskopi ve akış sitometri analizi dahil olmak üzere alternatif protokoller önerilmektedir. Son olarak, tarif edilen protokolün, paraziti in vitro kültür yapmak, hücre dışı vezikülleri izole etmek, kemik iliği kaynaklı dendritik hücre kültürleri oluşturmak ve bu hücrelerle alım testleri yapmak için bir bütün olarak veya tek tek parçalar halinde uygulanabileceğini belirtmek gerekir.
Giriş
Echinococcus granulosus , kistik ekinokokkoz1 olarak bilinen uzun süreli bir enfeksiyondan sorumlu zoonotik bir parazitik helminttir. Çiftlik hayvanları ve insanlar gibi ara konakçılarda, parazit enfeksiyonu öncelikle karaciğer ve akciğerleri etkiler, burada larva aşaması sıvı dolu kistler veya protoscoleces (bir larvanın kendisi) içeren metacestodlar olarak gelişir. Tüm sestodlar gibi, bu parazit hem sindirim hem de boşaltım sistemlerinden yoksundur ve bu nedenle, metabolitlerin alımını ve atılımını ve ayrıca hücre dışı veziküllerin salınımını düzenlemek için aktif endositik ve ekzositik hücresel süreçler geliştirmiştir2,3. Hücre dışı veziküller (EV'ler), görünüşte tüm hücre tipleri tarafından salgılanan lipid çift tabakalı parçacıklardır. Özellikle, biyogenez kökenlerine bakılmaksızın 200 nm'den küçük EV'ler olarak tanımlanan küçük hücre dışı veziküller (sEV'ler)4, hücreler arası immün mediyatörler olarak işlev görebilir. Bu işlev, hayatta kalmalarını sağlamak için konakçı immünomodülasyonuna dayanan parazitlerde özellikle önemlidir3. İmmün manipülasyon, sEV'lerin, naif T hücrelerini in vivo olarak aktive edebilen ve bu parazitik solucanlar tarafından kronik enfeksiyona yol açacak adaptif bir bağışıklık tepkisi başlatabilen tek hücreler olan konakçı dendritik hücreler tarafından alınması yoluyla elde edilir. Doğuştan gelen bağışıklık sisteminin profesyonel antijen sunan hücreleri olan dendritik hücreler, antijenik peptitleri Majör Histouyumluluk Kompleksi Sınıf I ve Sınıf II'ye (MHC I ve MHC II) işler ve yükler ve bunları özel naif T hücresi hazırlama (sırasıyla CD8 + ve CD4 + T hücreleri) için zarlarında sergilerler5. Dendritik hücreleri, yardımcı uyarıcı belirteçler CD80 / CD86 ve CD40 ve MHC-II'nin ekspresyonunun indüklenmesiyle olgunlaşmalarını indükler ve yabancı antijenleri tanıdıktan sonra periferik dokulardan ikincil lenfoid organlara göç ederler ve bunları özel naif T hücresi hazırlama için yüklerler6. Bu nedenle, bu protokolün genel amacı, helmint parazit-konak iletişimini gerçekçi bir şekilde incelemek, parazitik bileşenlerin sEV'ler şeklinde paketlenmesini ve verilmesini analiz etmek, bu da konakçı bağışıklık hücrelerine ulaştıktan sonra enfeksiyonun gelişimini ve kronik paraziter hastalığın ilerlemesini etkilemektedir.
helmint-konak arayüzünün analizinin sEV'lerin incelenmesi yoluyla ele alınmasının çeşitli avantajları vardır. Birincisi, yassı solucanların dış kaplaması olan tegument, parazit ile konakçısı arasında önemli bir geçiş noktası oluşturan ve sEV'lerin bu yapıdan kolayca üretilmesine veya nüfuz etmesine izin veren çift zarlı bir yapıdır7. İkincisi, sEV'ler, parazit yaşam döngüsünün tüm aşamalarından protein antijenleri ile yüksek oranda yüklüdür ve bu, konakçı bağışıklık sisteminin solucan enfeksiyonu sırasında antijenleri örneklediği doğal yolu temsil eder 8,9. Biyolojik üretimleri, saflaştırma kolaylığı (doku bozulması veya protein fraksiyonasyonu gerektirmeden) ve konakçı hücrelerle doğrudan etkileşimleri nedeniyle, helmint sEV'ler, parazit-konak etkileşiminin in vivo koşullarını simüle etmek için in vitro deneylerin geliştirilmesini sağlar. Son olarak, sEV'ler, konakçı hücreler tarafından fagositoza dönüştürülebilen veya içselleştirilebilen parazitik yapılara sahip olma olasılığını temsil eder ve özellikle kistli solucan vakalarında tüm parazitlerle bunu yapmanın imkansızlığının üstesinden gelir.
Bahsedilen avantajlar ve helmintiyazların yaygın ve tipik olarak parazitlerin bir hayatta kalma stratejisi olarak konakçı bağışıklık sistemini manipüle ettiği kronik hastalıklar olduğu gerçeği göz önüne alındığında, parazit kaynaklı EV'lerin izolasyonu ve dendritik hücrelerle etkileşim içinde çalışmaları, bu immünomodülasyonu araştırmak için değerli bir çerçeve sağlar10. Bu anlamda, EV'lerin nematodlar ve Schistosoma mansoni, Fasciola hepatica, Brugia malayi ve E. granulosus gibi platyhelmintler dahil olmak üzere helmintlerden içselleştirilmesinin, dendritik hücrelerin olgunlaşmasını ve aktivasyonunu indüklediğiaçıklanmıştır 9,11,12,13,14,15.
Helmint türevli EV'lerin izolasyonu, potansiyel olarak alerjik veya otoimmün hastalıklar için koruyucu aşıların veya immünoterapötik ajanların geliştirilmesine yol açan immünolojik etkileşimlerin incelenmesini sağlamakla kalmaz, aynı zamanda diğer biyolojik etkileşimlerin ve işlevlerin araştırılmasını da kolaylaştırır 8,16,17. Bu bağlamda, paraziter enfeksiyonların doğal seyrinde rol oynayan EV'ler, parazit gelişimini ve spesifik konak hücrelerle etkileşimlerini araştırmak için kullanılabilir. Ayrıca, paraziter hastalıkların teşhisi, terapötik yanıtların izlenmesi ve paraziter enfeksiyonların kontrol ve yönetimine katkıda bulunmak için erken veya ayırıcı biyobelirteçler olarak potansiyel uygulamalara sahip olabilirler17,18.
Ek olarak, daha önce gösterildiği gibi, E. granulosus'un larva aşaması, parazit canlılığında rol oynamanın yanı sıra, ekzositoz oranını da kontrol eden sitozolik kalsiyum konsantrasyonundaki değişikliklere karşı hassastır19,20. Bu bağlamda ve hücre içi kalsiyum yükselmesinin EV salınımını arttırdığını bilerek, loperamid olarak hücre içi kalsiyum arttırıcı kullanmak, EV sayısını artırmak için çok önemli bir strateji olabilir. Bu yaklaşım, kargo ve fonksiyonel analiz için yeterli miktarda EV üretmek için büyük popülasyonlar gerektiren hücresel sistemler için özellikle ilgi çekicidir 11,21,22. Mevcut protokol (Şekil 1), E. granulosus larva evresinin saf kültürlerini elde etme yöntemlerini ve sEV üretimini artıran koşulları detaylandırmaktadır. Ayrıca, bu veziküllerin izolasyonu ve karakterizasyonu için iş akışının yanı sıra, konakçı bağışıklık sistemi modülasyonunun ilk çalışmasında önemli bir adım olan murin dendritik hücreler tarafından alımlarını da açıklar.
Protokol
Hayvanları içeren tüm prosedürler, Mar del Plata'daki Tam ve Doğa Bilimleri Fakültesi Hayvan Deney Komitesi tarafından değerlendirildi ve onaylandı (izin numaraları: RD544-2020; RD624-625-2021; RD80-2022). Bu protokolde, NIH tarafından yayınlanan "Laboratuvar Hayvanlarının Bakımı ve Kullanımı Kılavuzu" ve Ulusal Sağlık Hizmeti ve Gıda Kalitesi (SENASA) kılavuzlarına göre farelere ötenazi uygulandı.
1. Echinococcus larva aşaması yetiştiriciliği
NOT: Tüm prosedürler aseptik koşullar altında gerçekleştirilmiştir.
- E. granulosus protoscoleces obtention
- Kist turgorunu azaltmak için enfekte sığırların akciğerinden veya karaciğerinden 21 G iğne ve 10 mL şırınga hidatik sıvısının bir kısmını aspire edin (Şekil 2A).
NOT: Enfekte akciğerler ve karaciğerler, mezbahada rutin kesim için sunulan sığırlardan gelir. 4 °C'de tutulmalı ve kesimden sonraki 24 saat içinde işlenmelidir. - Kisti makasla açın ve forseps kullanarak laminer ve germinal tabakaları kistten çıkarın. Bunları, kalan hidatik sıvısıyla birlikte steril bir Petri kabına yerleştirin (Şekil 2B,C).
NOT: Bu noktada, protoscoleces ve kuluçka kapsüllerinin kalitesini değerlendirmek için Petri kabının ters mikroskop altında gözlemlenmesi önerilir. Biyolojik materyali, protoscoleces'in% 50'sinden fazlasının çöktüğü, sözleşmeli somaları, daha koyu renkleri ve kanca kaybı ile düzensiz rostellum ile tanımlanan kistlerden toplamaktan kaçının. - Protoscoleces'i çıkarmak için katmanları antibiyotiklerle (100 μg/mL penisilin, 100 μg/mL streptomisin, 100 μg/mL gentamisin 100 μg/mL) takviye edilmiş steril fosfat tamponlu salin (PBS) ile yıkayın.
NOT: Tüm yıkamalar antibiyotik takviyeli PBS ile yapılacaktır. - Protoscolex süspansiyonunu bir Pasteur pipeti kullanarak steril bir cam Khan tüpüne aktarın.
- Ölü parazitleri gidermek için protoscoleces'i bir Pasteur pipeti kullanarak 4 ° C'de takviye edilmiş PBS ile yıkayın. Protoscolex salınımını kolaylaştıran kuluçka kapsüllerini kırmak için süspansiyonu kuvvetlice yeniden askıya alın. Protoscoleces'in tüpün dibinde 1-2 dakika oturmasına izin verin; Daha sonra ölü protoscoleces içeren süpernatanı atın.
NOT: Yoğunluk farkından dolayı, canlı protoscoleces ölü parazitlerden daha hızlı yerleşir. - Tüm ölü ve yüzen protoscoleces çıkarılana kadar yıkama işlemini tekrarlayın.
NOT: Ölü parazitler, hepsi aynı oranda yerleştiğinde uzaklaştırılır. - Metilen dışlama testini kullanarak protoscoleces'in canlılığını belirleyin.
- Yıkanmış protoscoleces'i bir pipetle tekrar askıya alın ve bir slayt üzerine bir damla koyun. 0.1 mg / mL metilen mavisi bir damla ekleyin ve bir lamel ile örtün. 2-3 dakika bekleyin ve mikroskop altında gözlemleyin.
- Canlı (lekelenmemiş) ve ölü (mavi lekeli) protoscoleces'in toplam sayısını sayın ve canlı protoscoleces'in yüzdesini hesaplayın (Şekil 2D ve ek).
NOT: Kültürler oluşturulmadan önce protoscoleces'in canlılığı %98 civarında olmalıdır. Boyama süresi 10 dakikayı geçmemelidir, çünkü daha uzun süreler canlı parazitlerin lekelenmesine neden olabilir.
- Kist turgorunu azaltmak için enfekte sığırların akciğerinden veya karaciğerinden 21 G iğne ve 10 mL şırınga hidatik sıvısının bir kısmını aspire edin (Şekil 2A).
- E. granulosus metacestodes obtention
- Dişi CF1 farelerini (vücut ağırlığı 25 ± 5 g) 0.5 mL takviyeli PBS içinde süspanse edilmiş 1500 protoscoleces (10 μL protocolex peletine eşdeğer) ile intraperitoneal olarak enfekte ederek deneysel bir ikincil hidatik hastalığı üretin (Şekil 2E).
NOT: Antibiyotiklerle takviye edilmiş PBS'deki protoscoleces'in enfeksiyondan önce 24 saat boyunca 4 ° C'de veya kültürde 3-5 gün boyunca tutulması önerilir. - Metacestodlar enfeksiyondan sonraki 4-6 ay içinde gelişir (Şekil 2F). Bu süre zarfında, hayvanları kontrollü laboratuvar koşullarında (sıcaklık 20 ± 1 °C, 12 saat aydınlık/karanlık döngüsü ve ad libitum sağlanan su ve yiyecek) barındırın. Kistler geliştikten sonra, fareleri ketamin-ksilazin (50 mg / kg / fare - 5 mg / kg / fare) kullanarak uyuşturun ve servikal çıkık ile ötenazi yapın.
- Farenin ventral yüzeyini% 70 alkolle temizleyin ve makas ve forseps kullanarak geliştirilen metacestodları çıkarmak için periton boşluğunu cerrahi olarak açın.
- Metacestod kütlelerini steril bir Petri kabına aktarın.
NOT: Metacestod kitleleri, bağ dokusu ile çevrili çok sayıda iç kistten oluşur. - Gerekirse forseps kullanarak metacestodları kaplayan bağ dokusunu dikkatlice çıkararak kistleri metacestod kitlelerinden ayırın.
NOT: Bu adım, parazitlerin konak dokusundan arınmış olmasını sağlar. - Elde edilen metasestodları 4 ° C'de takviye edilmiş PBS ile yıkayın (Şekil 2G).
- Dişi CF1 farelerini (vücut ağırlığı 25 ± 5 g) 0.5 mL takviyeli PBS içinde süspanse edilmiş 1500 protoscoleces (10 μL protocolex peletine eşdeğer) ile intraperitoneal olarak enfekte ederek deneysel bir ikincil hidatik hastalığı üretin (Şekil 2E).
- E. granulosus protoscoleces ve metacestodes yetiştiriciliği
- Kültür ortamını aşağıdaki gibi hazırlayın: 100 μg/mL penisilin, 100 μg/mL streptomisin, 100 μg/mL gentamisin, 4 mg/mL glikoz, 50 mM Hepes tampon pH 7.5 ve orta 199 ekleyin İstenilen nihai hacme ulaşmak için ve ters çevirerek hafifçe karıştırın.
- Hazırlanan kültür ortamının 5 mL'sini her bir Leighton tüpüne aktarın (Şekil 2H–I).
- Parazitleri kültür ortamına ekleyin ve ortamı değiştirmeden 5 gün boyunca 37 ° C'de inkübe edin. Biyolojik materyalin düz yüzey boyunca eşit dağılımını sağlamak için Leighton tüplerini 15°'lik bir açıyla inkübe edin. Bu, kauçuk tıpa ile teması önlerken kültür ortamına parazit maruziyetini en üst düzeye çıkarır.
NOT: 9.000-10.000 protoskoleces veya 50 metacestod ekleyin (çapları 5 mm ile 15 mm arasında değişen, tüp başına 10 kist olarak dağıtılır). - İsteğe bağlı olarak, sitozolik kalsiyum seviyesini arttırmak ve E. granulosus'un larva aşaması ile EV salınımını arttırmak için parazit kültür ortamına 16-24 saat boyunca dimetil sülfoksit içinde çözülmüş 20 μM loperamid (öldürücü bir alt konsantrasyon) ekleyin.
NOT: Hücre içi kalsiyum konsantrasyonlarındaki bir artışın EV üretimini arttırdığı göz önüne alındığında, parazitin kalsiyum homeostazını etkileyen bileşiklerle tedavi edilmesi EV salınımını artıracaktır.
2. Hücre dışı veziküllerin saflaştırılması
- Parazit kültür ortamını her Leighton tüpünden toplayın ve 15 mL'lik konik bir tüpe aktarın.
NOT: Kültür ortamı, veziküllerin konsantrasyonu veya boyut dağılımı üzerinde minimum etki ile ilk santrifüjlemeden önce 24 saat saklanabilir. Protoscoleces, PBS tamponu ile üç kez yıkanabilir, hasat edilebilir ve -20 ° C'de 1.5 mL'lik tüplerde saklanabilir. - 4 ° C'de 10 dakika boyunca 300 x g'da santrifüjleyin ve süpernatanı bir pipet kullanarak yeni bir 15 mL konik tüpe aktarın.
NOT: Bu adım ölü protoscoleces'i kaldırır. Her santrifüj adımından sonra, kontaminasyonu önlemek için peletin üzerinde en az 0,5 cm süpernatan kaldığından emin olun. - Süpernatanı 2.000 x g'da 4 ° C'de 10 dakika boyunca santrifüjleyin ve bir pipet kullanarak yeni 1.5 mL tüplere aktarın.
NOT: Bu adım, daha büyük hücre kalıntılarını temizler. - Daha küçük hücre kalıntılarını temizlemek için 10.000 x g'da 4 °C'de 30 dakika santrifüjleyin.
- Süpernatanı bir pipet kullanarak ultrasantrifüj rotoru için uygun bir tüpe aktarın. Ultrasantrifüj rotoruna yerleştirmeden önce her tüpün bir tarafını bir işaretleyici ile işaretleyin. Ardından, tüpü işaretli tarafı yukarı bakacak şekilde rotora yerleştirin.
NOT: İşaret, ultrasantrifüjlemeden sonra peletin yerini belirlemek için bir referans noktası görevi görür. Tüplerin dörtte üçü dolu ve hassas bir şekilde dengelenmiş olmalıdır; bu nedenle, gerekirse PBS ekleyin. Süpernatan hacmi tek bir tüpün kapasitesini aşarsa, numuneleri birden fazla tüpe bölün ve yeniden süspansiyon sırasında birleştirin. - 4 ° C'de 1 saat boyunca 100.000 x g'da santrifüjleyin ve süpernatanı hızlı bir şekilde dökün. Tüpün 1 dakika baş aşağı dinlenmesine izin verin. Pelet bu aşamada görünmeyebilir.
NOT: Kullanılan rotor için k faktörü 103'tür. - Kirletici proteinleri çıkarmak için peleti en az 3 mL PBS ile yıkayın. Tüpün üst tarafından aşağıya doğru tüm tüp yüzlerinde, ancak esas olarak peletin olması beklenen işaretli tarafta birden çok kez yukarı ve aşağı pipetleyerek peleti yeniden süspanse edin.
NOT: Mümkünse, aynı süpernatanttan türetilen yeniden askıya alınmış peleti tek bir tüpte toplayın. - 4 ° C'de 1 saat boyunca 100.000 x g'da santrifüjleyin ve süpernatanı hızlı bir şekilde dökün. Tüpün 1 dakika baş aşağı dinlenmesine izin verin.
NOT: Kullanılan rotor için k faktörü 103'tür. - Adım 2.7'de açıklanan işlemi takiben peleti 30 μL PBS'de yeniden süspanse edin.
NOT: Bu noktada, salgılanan sEV'lerin miktarını tahmin etmek için yeniden askıya alınan peletteki toplam protein konsantrasyonunun ölçülmesi önerilir. Protein konsantrasyonu, bir mikrohacim spektrofotometresi kullanılarak 280 nm'de absorbans ölçülerek belirlenebilir. - Numuneyi 1,5 mL'lik bir tüpe aktarın. Hücre dışı vezikülleri -80 °C'de dondurun.
NOT: Aşağı akış uygulamaları için vezikül bütünlüğünü korumak için, yeniden askıya alınan peleti mümkün olduğunca çabuk dondurun ve tekrarlanan donma-çözülme döngülerinden kaçının.
3. İzole edilen veziküllerin karakterizasyonu
- Dinamik ışık saçılımı (DLS) kullanılarak EV boyutunun belirlenmesi
NOT: Dinamik Işık saçılımı, türlerinden bağımsız olarak karmaşık sıvılardaki nanopartiküllerin boyutunu (hidrodinamik yarıçap, Rh'ye dayalı olarak) ve şeklini değerlendirmek için güvenilir ve hassas bir yöntemdir. DLS ve zeta potansiyeli ölçümleri, 633 nm'de He-Ne monokromatik lazer ışını kullanılarak gerçekleştirildi. Numune alma gününde analiz mümkün değilse, numuneler depolanmadan önce önceden filtrelenmiş bir tamponda dondurulabilir.- Numunelerin buzunu çözün ve ölçümler alınana kadar buz üzerinde tutun.
NOT: Numunelerin dondurulması, sEV'lerin partikül dağılımını ve bütünlüğünü etkileyebilir. Bu nedenle, donma ve çözülme döngülerinden kaçının, çünkü bunlar azaltılmış tepe yükseklikleri ile LS sinyalinde bir azalmaya yol açabilir. - DLS için kullanılan sulu numuneleri 0,2 μm gözenek boyutlu bir filtreden süzün.
NOT: LS deneylerinde, ölçümlere müdahale edebilecek büyük parçacıkları ve tozu uzaklaştırmak için tüm çözeltileri, tamponları ve sulu numuneleri filtrelemek önemlidir. - Numuneleri önceden filtrelenmiş PBS'de 1:10 ila 1:50 oranında seyreltin.
- Daha uzun numune işleme süresi nedeniyle LS yoğunluğu azalabileceğinden, sedimantasyonu önlemek için her ölçümden önce numuneleri nazikçe ters çevirerek karıştırın.
- Numunenin 1 mL'sini temiz bir küvete ekleyin ve buzlanmamış tarafı cihazın solundaki lazer yoluna yerleştirin. Kapağı kapatın ve numuneyi ölçmeden önce dengeleme için 2-3 dakika bekleyin.
- Zeta potansiyeli ölçümünü gerçekleştirmeden önce boyutu hidrodinamik yarıçap (Rh) cinsinden ölçün. 25 °±C ila 1 °C'de tek bir saçılma açısında (θ = 90° ila 150°) ölçümleri kaydedin.
- Okumaları kontrol etmek ve veri toplamaya başlamak için Kontrol Paneli'ne tıklayın.
NOT: Ortalama Rh değerlerine ve sEV'ler için değerlendirilen boyut dağılımlarına bağlı olarak, 30 nm ile 200 nm arasında bir tepe gözlenmelidir (Şekil 3). Rh'de 15 nm'nin altındaki zirveler, süspansiyondaki nükleik asitlere ve proteinlere atfedilir. Tipik olarak, boyut dağılımları ortalama hidrodinamik yarıçaptan hesaplanır. Bununla birlikte, Z-ortalaması (numunedeki ortalama partikül boyutu), polidispersite indeksi (bir numunenin boyut heterojenliğini belirleyen PDI) ve saçılan ışık yoğunluğunun açısal bağımlılığı da rapor edilebilir.
- Numunelerin buzunu çözün ve ölçümler alınana kadar buz üzerinde tutun.
- Transmisyon elektron mikroskobu (TEM) ile yapı ve parçacık boyutunun belirlenmesi
NOT: Sabitleme, dehidrasyon, reçine gömme ve tam montajlı sEV preparatları için kontrast oluşturmayı içeren standart bir protokol kullanarak sEV'lerin boyutunu, yapısını ve saflığını değerlendirmek için negatif leke iletim elektron mikroskobu gerçekleştirin.- Konsantre sEV numunelerini adım 2.10'dan itibaren çözdürün ve buz üzerinde tutun.
- sEV'leri 1,5 mL'lik tüplere sabitleyin. 0,1 M sodyum kakodilat tamponunda (pH 7) ~5 μL sEV numune peletinde (gerekli sEV konsantrasyonu 1 x 10 8–1x 109 mL≈-1) 5-10 μL %2,5 glutaraldehiti dikkatlice uygulayın ve 4 °C'de 2 saat inkübe edin.
NOT: sEV'ler, daha fazla işlemden önce 0,1 M sodyum kakodilat tamponunda 4 °C'de 1 haftaya kadar saklanabilir. Bu nedenle, TEM analizi için harici teknik hizmetler gerekiyorsa, sabit sEV numunelerini 1,5 mL'lik tüplerde soğutulmuş olarak gönderin. - 300 gözenekli Formvar-karbon kaplı EM bakır ızgaralar üzerine 5 μL yeniden asılı pelet biriktirin. Her numune için iki veya üç ızgara hazırlayın.
- Numunenin kuru bir ortamda 20 dakika adsorbe olmasına izin verin ve fazla numuneyi filtre kağıdı kullanarak ızgaradan çıkarın.
- 100 μL damla PBS'yi bir film tabakasına yerleştirin. Temiz forseps kullanarak, ızgaraları (adsorbe edilmiş numune tarafı aşağı bakacak şekilde) yıkama için PBS damlalarına aktarın.
- Adsorbe edilen numunenin karşı tarafını kurutun ve ızgaraların numune tarafının aşağıdaki adımlardan herhangi biri sırasında kurumamasını sağlayın.
NOT: Sonraki tüm adımlar için, reaktif damlalarını düz bir film üzerine yerleştirin ve ızgaraları forseps kullanarak damlalara aktarın. - Izgaraları 5 dakika boyunca 50 μL'lik %1 glutaraldehit damlasına aktarın.
- Izgaraları 100 μL damlatılmış su ile yıkayın ve 3 dakika bekletin. Toplam on yıkama için dokuz kez tekrarlayın.
- Numune ızgaralarını 1 dakika boyunca %1 w/v uranil-asetat çözeltisi, pH 7'lik 50 μL'lik bir damla ile karşılaştırın.
- Izgaraları kontrastlayın ve 100 μL %4 uranil asetat ve 900 μL %2 metil selüloz karışımına gömün.
- Izgaraları döngü üzerinde kalırken 5-10 dakika havayla kurutun ve 80-100 kV'da 0,2 nm çözünürlük ve 100.000x büyütme ile elektron mikroskobu ile gözlemleyin.
- Uzun süreli saklama için ızgaraları kuru saklama kutularında saklayın.
4. Kemik iliği kaynaklı dendritik hücre üretimi
NOT: Bu prosedür, aktif proliferasyon ve farklılaşma kapasitelerine sahip sağlam hematopoietik sistemler ile karakterize edilen genç fareler kullanılarak yapılmalıdır. Buna karşılık, yaşlı fareler hematopoietik fonksiyonda düşüşler, azalmış kök hücre rezervleri, değişmiş niş etkileşimleri ve uzun süreli bağışıklık ve patojenlere veya immünoyaşlanma gibi yaşa bağlı değişikliklere yanıt için çok önemli olan daha gelişmiş bir hafıza rezervuarı sergiler.
- 5-8 haftalık bir dişi CF-1 faresini kurumsal etik yönergelere göre ötenazi yapın ve hayvanların çektiği acıyı en aza indirin.
- Fareyi bir doku kültürü başlığına yerleştirmeden önce etanol ile püskürtün.
NOT: Aşağıdaki adımlar steril koşullar altında gerçekleştirilmelidir. - Fareyi sırtüstü pozisyonda bir diseksiyon tahtasına yerleştirin. Forseps ve diseksiyon makası kullanarak, üretranın üzerinde dikey bir "T" kesisi yapın ve peritonu kırmamaya veya herhangi bir organı, özellikle de bağırsakları delmemeye dikkat ederek yatay olarak alt ekstremitelerin tepesine uzatın.
- Forseps kullanarak bacak kemiklerini ve dokularını ortaya çıkarmak için cildi her iki arka bacak boyunca ayırın. Ellerle, ayak bileğinden karın bölgesine doğru iterek her bacağın derisini çıkarın, cildi karşı tarafa çekin. Daha sonra her iki bacak da deriden arınmış olacaktır.
NOT: Fare gövdesini patojen kalıntı torbasına atın. - Makas ve forseps kullanarak, kırılmayı önlemek için femur ve tibiayı dikkatlice çıkarın. Her kemiğin ucunu forseps ile sabitleyin ve kemiklerin etrafındaki kas fasyalarını çıkarmak için tendonları kesin. Kas dokusunu kağıt peçetelerle temizleyin.
- Her kemik çıkarılırken, kalıntıları gidermek için% 5 FBS, 100 U / ml penisilin, 100 U / mL streptomisin ve 10 μg / mL gentamisin ile desteklenmiş RPMI ortamı ile hazırlanmış 2 mL tam ortam içeren steril 50 mL'lik bir tüpe yerleştirin. Ardından, kültür ortamını aspire edin ve atın ve kemikleri 5 dakika boyunca% 70 etanol ile iki kez yıkayın.
- Kemikleri steril bir Petri kabına aktarın.
- Kemik iliği hücrelerine erişmek için keskin diseksiyon makası kullanarak iki kemik epifizini kesin.
- Dört kemiğin her birinden kemik iliği hücrelerini, tam ortam içeren 20 mL'lik bir şırıngaya bağlı 25 G'lik bir iğne kullanarak steril bir Petri kabına dikkatlice yıkayın. Kemik iliği çıkarıldıkça kemikler daha şeffaf hale gelecektir.
NOT: Kemik iliği hücrelerini iki femur ve tibiadan çıkarmak için tam ortamın 20 mL'lik bir hacmi yeterli olmalıdır. - Kemik, bağ dokusu ve hücre topaklarını çıkarmak için pipetleme yoluyla ortamı ayrıştırılmış ilik ile nazikçe homojenize edin. Daha sonra, numuneyi steril 50 mL'lik bir konik tüpe aktarın ve hücreleri bağ dokusu ve kemik kalıntılarını gidermek için steril 70 μm polipropilen hücre süzgecinden geçirin.
- Hücreleri 450 ° C'de 7 dakika boyunca 4 x g'da santrifüjleyin. Süpernatanı dikkatlice çıkarın ve atın, peletin tüp duvarına yapıştığından emin olun.
- Hücreleri oda sıcaklığında (RT) 1 dakika inkübe edin, ardından 500 μL kırmızı kan hücresi (RBC) lizis tamponunda yeniden süspanse edin. 3 mL tam ortam ekleyerek lizis tamponunu nötralize edin.
- Hücreleri 450 ° C'de 7 dakika boyunca 4 x g'da santrifüjleyin. Süpernatanı atın ve peleti 5 mL tam ortamda yeniden süspanse edin.
- Hücre süspansiyonunu, parçalanmış eritrositlerden hücre agregalarını çıkarmak için steril 70 μm polipropilen hücre süzgecinden steril 50 mL'lik bir konik tüpe geçirin.
- Bir hemositometre kullanarak hücreleri sayın.
- Kültür ortamına 300 ng / mL rekombinant murin Fms ile ilişkili tirozin kinaz 3 ligandı (Flt3L) ekleyin.
- Hücreleri çok kuyulu bir plakada 1 x 106 hücre / mL konsantrasyonda plakalayın.
- Hücreleri 7 gün boyunca 37 ° C'de% 5 CO2 ile nemlendirilmiş bir atmosferde inkübe edin.
NOT: Kendiliğinden olgunlaşmayı önlemek için hücreleri farklılaşırken ve büyürken sallamaktan kaçının. - 3. günde, her kuyucuktan 1 mL besiyerini çıkarın (hücrelerin bozulmasını önleyerek) ve 150 ng / mL rekombinant murin Flt3L ile takviye edilmiş 1 mL önceden ısıtılmış taze tam besiyeri ile değiştirin.
5. Kemik iliği kaynaklı dendritik hücreler ile E. granulosus'tan hücre dışı veziküller arasındaki etkileşim
- Hücre dışı vezikül zarı boyaması
- Adım 2.10'da saklanan sEV'lerin buzunu çözün ve buz üzerinde tutun.
- 10 μL saflaştırılmış sEV'leri 10 μL etiketleme aracında (Seyreltici C) yeniden süspanse edin.
- 2 μM'lik bir nihai konsantrasyon elde etmek için 20 μL 2x PKH26 boya çözeltisi ekleyin. Bir pipet kullanarak nazikçe karıştırın ve karanlıkta 37 ° C'de 35 dakika inkübe edin.
NOT: 2x PKH26 boya çözeltisi (4 μM), boyamadan hemen önce 125 μL Seyreltici C'ye 0,5 μL PKH26 etanolik boya çözeltisi eklenerek hazırlanmalıdır. - Homojen lekelenmeyi sağlamak için inkübasyon sırasında her 3-5 dakikada bir nazikçe karıştırın.
- 40 μL BSA% 1 ekleyin ve boyama işlemini durdurmak için RT'de 10 dakika inkübe edin.
- sEV'leri 1 mL PBS ile yıkayın ve fazla boyayı çıkarmak için 4 °C'de 1 saat boyunca 100.000 x g'da santrifüjleyin.
NOT: Rotor için k faktörü 103'tür. - Adım 2.7'de açıklanan protokolü izleyerek peleti 90 μL PBS'de yeniden süspanse edin.
- Murin kemik iliği kaynaklı dendritik hücrelerin E. granulosus'un hücre dışı vezikülleri ile uyarılması
- Kemik iliği kaynaklı dendritik hücreleri (BMDC'ler) kültür plakasından iyi bir şekilde toplayın ve bunları 1.5 mL'lik tüplere aktarın.
NOT: Spontan hücre olgunlaşmasını önlemek için dikkatli bir şekilde kullanın. - Hücreleri peletlemek için ortamı 450 x g'da 5 dakika santrifüjleyin.
NOT: Sonraki akış sitometrisi analiz adımlarında hücreleri yeniden plakalamak için süpernatanları santrifüjlemeden ayırın. - Akış sitometrisi analizi için adım 2.10'dan itibaren 30 μL boyanmamış sEV'lerde veya adım 5.1.7'den 90 μL PBS içeren lekeli sEV'lerde BMDC'leri yeniden askıya alın. konfokal mikroskopi için. % 5 CO 2 ile nemlendirilmiş bir atmosferde 37 ° C'de 30 dakika inkübeedin. Numuneyi her 10 dakikada bir yavaşça karıştırın.
NOT: BMDC'ler ve sEV'ler arasında etkili temas sağlamak için, inkübasyonun ilk 30 dakikası 1.5 mL tüpler kullanılarak minimum hacimde gerçekleştirilmelidir. - Konfokal mikroskopi için, hücreleri 24 oyuklu bir plakaya yerleştirilmiş Alcian mavisi ile muamele edilmiş bir cam lamel (12 mm çapında) üzerine aktarın. % 5 CO2 içeren nemlendirilmiş bir odada 37 ° C'de 30 dakika daha inkübe edin.
NOT: Alcian-blue işlemi, BMDC'lerin negatif yüklü plazma zarlarının yapışmasını kolaylaştırarak lamel üzerine pozitif bir yük verir.- Lamelleri hazırlamak için filtrelenmiş %1 Alcian mavisi 8 GX boyaya batırın ve mikrodalgada 1-2 dakika kaynatmadan ısıtın. Her 2 ila 3 dakikada bir döndürerek sıcak çözeltide 10 dakika inkübe edin.
- Ardından, fazla Alcian mavisini çıkarmak için lamelleri deiyonize damıtılmış su ile yıkayın ve kağıt havlu üzerinde kurulayın. Son olarak, lamelleri otoklavlayın ve kullanıma kadar steril koşullarda saklayın.
- Akış sitometrisi analizi için, BMDC'ler-sEV'leri hasat edildikleri aynı kuyuya geri aktarın (bkz. adım 5.2.1), adım 5.2.2'deki ayrılmış süpernatanları ekleyin ve %5 CO2 içeren nemlendirilmiş bir atmosferde 37 ° C'de 18 saat inkübe edin.
NOT: Toplandıktan sonra kalan hücrelerin kurumasını önlemek için kuyuda yaklaşık 500 μL ortam bırakın. - BMDC olgunlaşmasını değerlendirmek için pozitif ve negatif kontroller kullanın. Hücreleri pozitif kontrol olarak 18 saat boyunca 100 ng / mL lipopolisakkarit (LPS) ile uyarın. Endositozun negatif kontrolü için, BMDC'leri sEV'lerle 4 ° C'de inkübe edin. Ayrıca, uyarılmamış bir dendritik hücre kontrolü içerir.
- Kemik iliği kaynaklı dendritik hücreleri (BMDC'ler) kültür plakasından iyi bir şekilde toplayın ve bunları 1.5 mL'lik tüplere aktarın.
- Kemik iliği kaynaklı dendritik hücreler tarafından yakalanan ve içselleştirilen E. granulosus'tan hücre dışı veziküllerin konfokal mikroskobu.
- Adım 5.2.4'te açıklanan inkübasyon süresi tamamlandıktan sonra, PBS'yi lamel üzerinden aspire edin ve atın.
- Lamel üzerine 100 μL %4 paraformaldehit (PFA) ekleyerek BMDC'leri sabitleyin ve RT'de 10 dakika inkübe edin.
NOT: Hacmin, lamel üzerindeki yüzey gerilimini koruduğundan emin olun. - PFA'yı aspire edin ve atın, ardından lameli PBS-BSA %2 ile üç kez yıkayın.
- 1/100 oranında seyreltilmiş anti-MHC sınıf II-FITC antikoru içeren 100 μL PBS ekleyin ve karanlıkta RT'de 1 saat inkübe edin.
- Antikor solüsyonunu aspire edin ve atın ve lameli PBS-BSA% 2 ile üç kez yıkayın.
- 100 μL 50 ng/mL DAPI ekleyin ve çekirdekleri lekelemek için ıslak bir odada oda sıcaklığında 30 dakika inkübe edin.
- Boya solüsyonunu aspire edin ve atın ve lameli PBS-BSA %2 ile üç kez yıkayın.
- Kavisli-ince uçlu forseps kullanarak lameli çıkarın ve fazla sıvıyı gidermek için bir kağıt havlu üzerinde kurulayın.
- Lameli aşağı bakacak şekilde polivinil alkol ve gliserolden oluşan bir montaj ortamı kullanarak bir cam kızağa monte edin. 37 °C'de 2 saat veya karanlıkta 4 °C'de gece boyunca kurumaya bırakın.
- Lameli ile cam sürgü arasındaki hava kabarcıklarını, lamel üzerine forseps ile hafifçe bastırarak çıkarın.
- FITC için 485/538 nm, DAPI için 358/461 nm ve PKH26 için 551/567 nm uyarma/emisyon dalga boyuna sahip 60x yağa daldırma objektifi kullanarak monte edilmiş numuneleri konfokal mikroskop altında gözlemleyin.
- Hücre dışı vezikül ile uyarılan kemik iliği kaynaklı dendritik hücrelerin akım sitometrisi ile fenotipik değerlendirilmesi
- Adım 5.2.5'te açıklanan kuluçka süresinden sonra, ortamı bir pipetle birkaç kez yukarı ve aşağı yıkayarak BMDC'leri hasat edin.
- Orta içeren BMDC'leri toplayın ve 1,5 mL'lik tüplere yerleştirin.
- Hücreleri peletlemek için 450 ° C'de 5 dakika boyunca 4 x g'da santrifüjleyin.
NOT: İsteğe bağlı olarak, sitokin sekresyonunu analiz etmek için, süpernatanları bir pipetle çıkarın, yeni 1.5 mL'lik tüplere aktarın ve daha ileri enzime bağlı immünosorbent testi (ELISA) testleri için -20 °C'de saklayın. - CD11c, CD40, CD80, CD86, MHC sınıf I ve MHC sınıf II'ye yönlendirilmiş floresein izotiyosiyanat (FITC), allofikosiyanin (APC) veya fikoeritrin konjuge mAbs içeren 100 μL PBS'de BMDC'leri yeniden süspanse edin ve karanlıkta 4 ° C'de 15 dakika inkübe edin.
- BMDC'leri PBS ile yıkayın ve 4 ° C'de 5 dakika boyunca 4 × g'da santrifüjleyin.
- BMDC'leri sabitlemek için 500 μL% 1 PFA'da yeniden askıya alın ve bir akış sitometresinde alınana kadar 4 ° C'de saklayın.
Sonuçlar
E. granulosus larva evresinin saf kültürlerinin korunması, sEV'lerin izolasyonu ve karakterizasyonu ve bunların murin dendritik hücreler tarafından alımının ana adımlarını özetleyen bir akış şeması Şekil 1'de gösterilmektedir. E. granulosus protoscoleces ve metacestodes'ten yüksek sEV üretimi elde etmek için, incelenen parazitin sağkalımını ve metabolik homeostazını en üst düzeye çıkarmak için daha önce laboratuvarda geliştirilen bir in vitro kültür yöntemi kullanılmıştır (Şekil 2).

Şekil 1: E. granulosus sEV'leri ve BMDC'leri elde etmek için deneysel prosedürlere genel bakış. Parazit materyalinin elde edilmesi ve yetiştirilmesinden (ADIM 1), izole edilmesinden (ADIM 2) ve parazit EV'lerin karakterize edilmesinden (ADIM 3) BMDC'lerin üretilmesine (ADIM 4) ve bunların E. granulosus sEV'leri ile etkileşimine (ADIM 5) kadar bu protokolde izlenen adımları açıklayan şematik temsiller. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
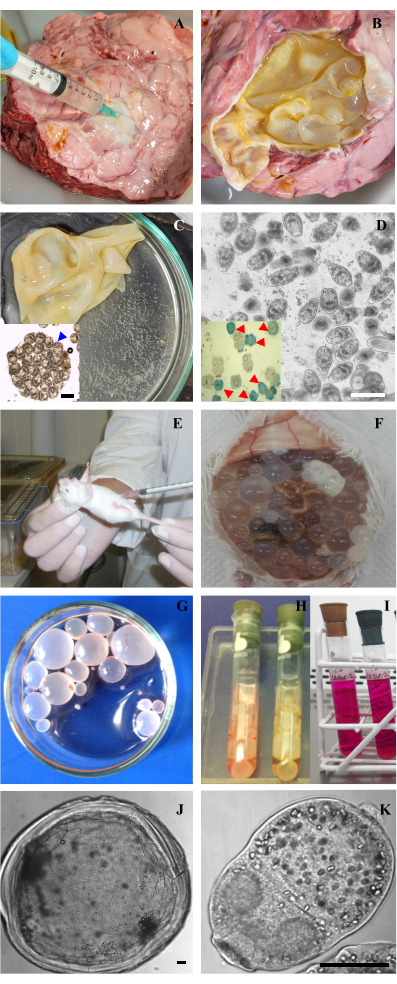
Şekil 2: Echinococcus granulosus'un protoscoleces ve metacestodes örneklerinin alınması ve in vitro kültürü. (A) Hidatik sıvısını çıkarmak için sığırların pulmoner hidatik kistinin delinmesi. (B) Zarı açıkta kalacak şekilde açılmış kist hidatik. (C) Kist hidatik zarı ve kuluçka kapsülleri ve "kist hidatik kum" olarak adlandırılan serbest protoscoleces ile hiyalin sıvısı. İç: Korunmuş morfolojiye sahip içinde protoscoleces bulunan kuluçka kapsülü. (D) Ölü protoskolekslerin çıkarılmasından sonra hayati protoskolekslerin optik mikroskobu. Çubuk 200 μm. Ek: Canlı protoscoleces (yarı saydam) ve ölü protoscoleces (mavi lekeli, kırmızı ok uçları ile gösterilir) gösteren protoscoleces'in metilen mavisi boyaması. (E) Protoscoleces'in bir CF-1 faresinin periton boşluğuna aşılanması. (F) Protoscoleces ile aşılamadan 7 ay sonra karın boşluğu içindeki metacestodlar. (G) Bir fareden izole edilen ve PBS ile bir Petri kabına yıkanan kistler. (H,İ) M199 besiyeri ile Leighton tüplerinde metacestod ve protoscoleces'in in vitro bakımı. (J,K) Bir metacestodun optik mikroskobu ve bir E. granulosus'un protoskoleksi. Çubuklar 50 μm'yi gösterir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
E. granulosus larva evresinden saflaştırılan EV'lerin karakterizasyonu Şekil 3'te gösterilmiştir. Mevcut protokolü takiben izole edilen EV'ler, DLS tarafından belirlenen (Şekil 3A) ve MET tarafından onaylanan (Şekil 3B) esas olarak 50 ila 200 nm arasında değişen çaplara sahip sEV'lerdi. TEM analizi ayrıca sEV'lerin eksozom benzeri veziküllerin tipik fincan şeklindeki morfolojisini sergilediğini ortaya koymuştur (Şekil 3B). Ek olarak, TEM, kontrollere kıyasla loperamid ile muamele edilen numunelerde artan sEV oranıyla gösterildiği gibi, öldürücü olmayan loperamid konsantrasyonlarının bir EV salım arttırıcı olarak işlev görebileceğini doğruladı. Benzer şekilde, loperamid ile tedavi edilen parazitlerden elde edilen daha yüksek sEV bolluğu, protein konsantrasyonu ölçümleri ile daha da desteklenmiştir (kontrollerde 6 ± 1 μg/μL'ye kıyasla 11 ± 1.5 μg/μL, Şekil 3C).

Şekil 3: E. granulosus larva evresinden saflaştırılan hücre dışı veziküllerin karakterizasyonu. (A) Kontrol (Co) ve loperamid (Lp) ile tedavi edilen protoskolekslerden (PTS) izole edilmiş EV'lerin boyut dağılımını gösteren Dinamik Işık Saçılımı (DLS) grafiği. (B) Kontrol (a) veya loperamid ile muamele edilmiş PTS'den (d) arındırılmış negatif lekeli EV'lerin transmisyon elektron mikroskobu (TEM) fotoğrafları. Ölçek çubukları 50 nm'yi gösterir. Arrowheds, tipik fincan şeklindeki yapıya sahip bol miktarda eksozom benzeri vezikülleri gösterir. (b-c) ve (e-f), sırasıyla (a) ve (d)'den kutulu alanların amplifikasyonlarına karşılık gelir. (C) Yedi bağımsız tahlilden elde edilen ultrasantrifüj peletinin protein konsantrasyonu. Veriler ortalama ± SD olarak sunulmuştur. Yıldız, anlamlı farklılıkları göstermektedir (Kruskal-Wallis ile Dunn'ın son testi, p < 0.05). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Şekil 4 , ilk kültür kuruluşundan tam farklılaşmaya kadar kemik iliği hücrelerinin miktarı ve morfolojisindeki varyasyonların gözlemleri yoluyla BMDC üretiminin ilerlemesini göstermektedir. 0. günde, hematopoietik hücreler, hematopoietik progenitörleri çoğalmak ve dendritik hücre morfolojisine farklılaşmak için aktive eden bir sitokin ve büyüme faktörü olan 300 ng / mL Flt3L ile desteklenmiş 1×10 6 hücre / mL yoğunlukta tam bir ortamda büyütüldü. 1-2. günlerde, hücreler, miktarları artmış olmasına rağmen, önemli morfolojik değişiklikler olmaksızın hala küçük ve yuvarlaktı. 3-5. günler arasında, aktif hücre iskeleti yeniden şekillenmesi meydana geldi ve bu da sitoplazmik uzantılarda (dendritler) bir artışla birlikte heterojen, uzun şekillerle sonuçlandı. Bu noktada, kültürler belirgin sitoplazmik uzantılara sahip yapışık hücreler, dendritik hücre farklılaşması sırasında morfolojik değişikliklere uğrayan yapışık olmayan hücreler ve sitokin indüksiyonuna yanıt vermeyen küresel yapışık olmayan hücreler içeriyordu (Şekil 4). 6-7. günlerden sonra, kültürlerin %80-90'ı esas olarak kararlı durum ve tamamen farklılaşmış BMDC'lerden oluşuyordu. Bu hücreler, antijen yakalama ve sunumu için optimize edilmiş kapsamlı sitoplazmik süreçlere sahip bir yıldız şekli sergiledi. 7. günde, BMDC'ler fenotiplerini analiz etmek ve fonksiyonel tahliller yapmak için hasat edildi.
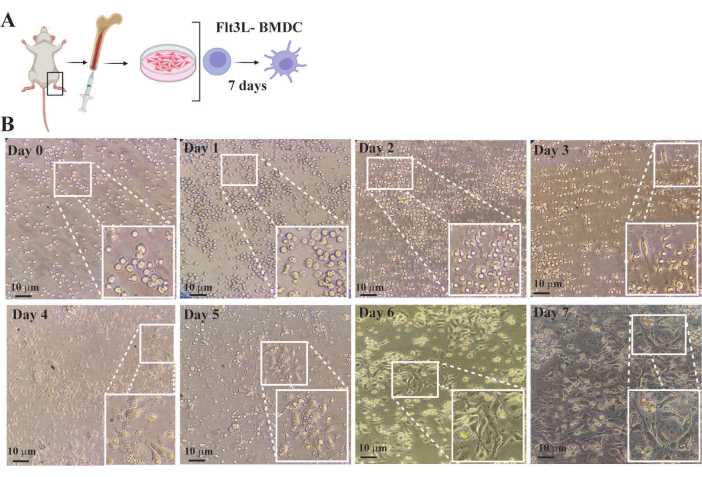
Şekil 4: Konvansiyonel ters optik mikroskop kullanılarak FTL3L kemik iliği kaynaklı dendritik hücre farklılaşmasının izlenmesi. (A) Hematopoietik öncüllerin şematik gösterimi, fare kemik iliğinden saflaştırma ve flt3L ile desteklenmiş tam ortamda hücre kültürü B- Farklı zaman noktalarında elde edilen kemik iliği hücre kültürünün görüntüleri. Ekler, her görüntüdeki kutulu alanın büyütülmüş bölgeleridir. (B) Gün 0: Kemik iliğinden yakın zamanda saflaştırılmış hematopoietik hücrelerin görüntüsü. Popülasyonun heterojen olmasına rağmen, çoğunluğunun yuvarlak morfolojiye ve küçük boyutlu hücreler olduğu görülmektedir. 1-5. Günler: FLT3 sinyal yolu aktivasyonunun neden olduğu aktif proliferasyona bağlı olarak hücre sayısındaki artışı ve morfolojideki değişiklikleri gösteren kültür görüntüleri. Hücre morfolojisi, sitoplazmik uzantılarda (dendritler) ilerleyici bir artışla yuvarlaktan uzuna geçiş yapar. Bu değişiklikler, hücreler kültür plakasının kuyucuklarına yapıştığında en belirgindir. 6-7. Günler: belirgin bir çekirdeğe ve çok sayıda ince dallanma çıkıntısına sahip düzensiz şekil ile karakterize edilen kararlı durumda tamamen farklılaşmış BMDC'leri gösteren görüntüler, sitoplazma, antijen sunumu ve bağışıklık tepkisinde yer alan veziküller ile oldukça granülerdir. Çubuk 10 μm'yi temsil eder. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Dendritik hücreler, indüklenmiş immün yanıtın aktivasyonu ve oryantasyonunda temel aracılar olduğundan, sEV'lerin konak-parazit etkileşimlerindeki potansiyel rollerini ortaya çıkarmak için bu hücrelerin fonksiyonel analizlerinin yapılması çok önemlidir. Burada sunulan protokol, BMDC'lerin 37 ° C'de 1 saatlik inkübasyondan sonra parazit-sEV'leri yakaladığını doğrulamaktadır. İlginç bir şekilde, sEV'lerin, önceden oluşturulmuş MHCII moleküllerinin birlikte lokalize oldukları gözlemlendikçe depolandığı endozomal-lizozomal bölmelerde yer aldığı görülmektedir (Şekil 5).
Ayrıca, etiketleme özgüllüğünü doğrulamak için EV'ler olmadan boya ile uyarılmış BMDC'ler negatif kontroller olarak dahil edildi. Lekeli sEV'lere maruz kalan pozitif etiketli hücrelerin %40'ından fazlasına kıyasla, yalnızca spesifik olmayan hücre dışı floresan ve dağınık boya sinyaline sahip hücrelerin %3-4'ü gözlenmiştir.

Şekil 5: Etiketli sEV'lerin verimli alımını ve MHC sınıf II'nin endozomlara alınmasını gösteren BMDC'lerin immünofloresan konfokal mikroskobu. (A) BMDC'lerde PKH26 etiketli sEV'lerin stimülasyonunu gösteren madde 5.3'te açıklanan protokolün şematik gösterimi. (B) sEV'ler (kırmızı, PKH26) ve (mavi DAPI) olmadan PKH26 ile uyarılan BMDCS'nin negatif kontrolünü gösteren Konfokal Görüntü. sEV'ler olmadan hücre içindeki boyadan hiçbir floresan sinyali gözlenmedi. (C) Lekeli sEV'lerle uyarılan BMDC'leri gösteren ayrı konfokal görüntü kanalları: diferansiyel girişim kontrast mikroskobu (DIC), DAPI (mavi, çekirdek), PKH26 (kırmızı, sEV'ler) ve FITC (yeşil, MHC sınıf II). Ölçek çubukları 10 μm'yi temsil eder. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Parazitlerin kültürlenmesi, parazit kaynaklı sEV'lerin izole edilmesi, dendritik hücrelerin kemik iliğinden ayırt edilmesi ve bu hücreler tarafından sEV alımının analiz edilmesi için protokol iş akışı Şekil 1'de özetlenmiştir. Amaç, metodolojinin uygulanmasını garanti altına almak için önemli hususları vurgulayarak, bir bütün olarak veya ayrı ayrı gerçekleştirilebilecek her bir protokol bölümünü ayrıntılı olarak tanımlamaktı. Tam parazitik organizmalardan elde edilen EV popülasyonunun analizi, parazit-konak ilişkisinin incelenmesi üzerinde somut bir etkiye sahiptir ve tam da bu bağlamda, bu deneysel protokol ana hatlarıyla belirtilmiştir.
Paraziter hastalıklara ilişkin yeni anlayışlar, bu parazitlerin bazılarının in vitro kültürlenmesinin zorluğu nedeniyle engellenmiştir. Parazit helmintler yapay koşullar altında yaşam döngülerini tamamlayamadıkları için, bir kültürde ancak tam organizmalar olarak hayatta kalabilirler. Bu nedenle, solucan-konak arayüzünü incelemek için bu protokol tarafından önerilen çözüm, sEV'leri zenginleştirmek ve izole etmek için her bir parazitik formun (yetişkin solucan ve farklı larva formları) yetiştiriciliğini bağımsız olarak gerçekleştirmek ve daha sonra bunları hedef organların hücreleri veya konakçı bağışıklık sisteminin hücreleri ile karşı karşıya getirerek, içselleştirilmelerine veya fagosite edilmelerine izin vermektir. sırasıyla. Ek olarak, EV'leri izole etmek için bir helmint kültürü oluşturmanın kritik bir adımı, in vitro kültüre başlamak için canlı parazitleri sıkı bir şekilde seçmek ve parazit ölümünü ve serbest kalıntı zarların oluşumunu sınırlamak için bunları mümkün olduğunca kısa süre inkübasyonlarda tutmaktır23. E. granulosus'ta yapmak için, kist hidatiklerden elde edilen protoscoleces, küçük çaplı cam tüplerde soğuk PBS ile yoğun yıkamaya tabi tutulur. Bir pipet ile kuvvetli dispersiyon sırasında, canlı protoscoleces hızlı bir şekilde çökelir. Böylece, tüpün sıvı kolonunda daha uzun süre asılı kalan cansız protoscoleces'ten ayrılarak, karışımdan yakalanmalarına ve elimine edilmelerine izin verilir. Bu amaç doğrultusunda, her yıkama adımında, bir pipet ile kuvvetlice karıştırma, kuluçka kapsüllerinin kırılmasını ve sıkışan protoscoleces'in iç kısımlarından salınmasını sağlayarak onları çevre zarından kurtarır. Parazit kültürleri, sEV'lerin yapışmasını önlemek için Leighton tipi cam tüplerde ve parazit kültürünün dağınık bir şekilde kurulmasını sağlamak için düz bir kısım ile kurulur. Farelerin periton boşluğundan elde edilen metacestodlar söz konusu olduğunda, bunları kaplayan advential tabakayı ayırmak ve ilişkili hücreleri ve bağırsak mikrobiyotasını uzaklaştırmak için antibiyotiklerle desteklenmiş PBS ile birkaç yıkama yapmak önemlidir, bu da White ve ark.23 tarafından da tanımlandığı gibi helmintin kendisinden türetilen sEV'lerin saflığını etkileyebilir. Tüpler, bu parazitlerin in vivo olarak sürdürdüğü fermentatif metabolizmayı taklit etmek için gereken oksijen eksikliği olan bir atmosferin oluşturulmasına katkıda bulunan steril kauçuk tıpalarla tıkanır. Son olarak, M199 besiyeri, uzun vadede sestod larva aşaması için bir bakım ortamı olarak çok uygundur24,25. Ortam, tuzlar, glikoz ve esansiyel amino asitler gibi minimum bileşenlere sahiptir ve ayrıca esansiyel olmayan amino asitler, kolesterol, pirimidinler, suda ve yağda çözünen vitaminler ve tiamin, riboflavin ve biotin dahil olmak üzere nükleik asit öncüleri içerir. Tüm bu besinler, temel organik fonksiyonların korunmasını ve bu parazitlerin yaşayabilirliğini teşvik eder. M199 özellikle transforme edilmemiş hücreler, embriyolar, birincil eksplantlar ve organ kültürleri için kullanılır ve hücre kütlesi yetiştiriciliği için idealdir26. Spesifik olarak, bir idame kültürü ortamı olarak kullanıldığında, M199, vezikülerize protoskolekslerin elde edilmesini ve bunların mikrokistlere farklılaşmasını teşvik ettiği için fetal sığır serumu takviyesi olmadan uygulanmalıdır27,28.
Parazit kültürleri için kullanılan tüm koşulların, sEV'lerin geri kazanımını ve hücre alımını içeren sonuçların tekrarlanabilirliğini sağlamak için belgelenmesi gerekir. Özellikle, EV üretimini etkileyen bir husus, kalsiyuma bağımlı ekzositozu artırdıkları için kalsiyum homeostazını etkileyen bileşiklerin kültüre eklenmesidir29,30. Burada, parazit kültürlerine E. granulosus 19,31'de hücre içi bir kalsiyum indüktörü olan loperamidin eklenmesinin sEV salınımını arttırması önerilmektedir. Bu yöntem, sestodlardaki vezikül sayısını arttırır (Şekil 3) ve düşük EV salınımı olan hücresel sistemlerde üretimi iyileştirmek için iyi bir strateji olabilir. Bununla birlikte, bu strateji, diğer fiziksel veya kimyasal kültür modifikasyonları gibi, EV özelliklerini ve işlevlerini değiştirebileceğinden, proteomik gibi yüksek verimli analizler yapılırken dikkatli olunmalıdır.
Sestod kültürleri, dış tegument yüzeylerinin ekzositoz ve endositozun temel süreçlerine uyarlanmış sinsityal bir sitoplazmik tabaka olduğu göz önüne alındığında, yüksek büyüklükte EV konsantrasyonlarının elde edilmesine izin verir32. EV hazırlığının ölçeği deneysel gerekliliklere tabi olacaktır. Toplam 9.000 protoscoleces, DLS, TEM ve LC-MS-MS analizlerini paralel olarak gerçekleştirmek için yeterli olan 1–2.5 ' 108 sEV/mL konsantrasyonda ortalama 30 μL sEV verir. Protokolün bir sınırlaması, veziküllerin ortama salınmasını engelleyen laminer tabakalarının varlığından dolayı mecestodlardan yüksek miktarda vezikül elde etmektir. Bu nedenle, büyük miktarlarda parazit gereklidir (adım 1.3.3)11. Alternatif bir yaklaşım, diğer çalışmalardabildirildiği gibi, hidatik sıvıdan sEV'leri de analiz etmektir 11,33,34,35,36.
EV araştırmalarında gözlemlenen daha geniş eğilime paralel olarak, bugüne kadar helmint EV'ler üzerine yapılan çalışmaların çoğu, EV izolasyonu ve ayrılması için birincil yöntem olarak boşaltım/salgı ürünlerinin ultrasantrifüjlenmesini kullanmıştır37. Bu protokolde, EV'ler15 ile birlikte kirleticilerin dahil edilmesini gerektirebilmesine rağmen, EV geri kazanımı için altın standart yöntem olarak kabul edilen sEV'leri izole etmek için ultrasantrifüjleme kullanılmıştır. Bu yöntemin bir sınırlaması, çözünür kirleticilerin uzaklaştırılmasıdır. sEV'ler çözünür kirleticilerden daha büyük olduğundan, saflaştırmayı iyileştirmenin bir alternatifi, boyut dışlama kromatografisi (SEC) kullanmak gibi ek adımları dahil etmektir38,39. Bununla birlikte, helmint parazit-konak iletişimini incelemek gibi fonksiyonel analizler için EV'lerin izolasyonu gerektiğinde, hepsi antijenik yük taşıdığından, EV popülasyonunun kesin olarak tanımlanması o kadar kritik değildir. Bu nedenle, daha fazla deney için gerekli saflığa bağlı olarak, izolasyon işlemi burada gerçekleştirildiği gibi ultrasantrifüjlemede tamamlanabilir veya büyük kirleticileri ortadan kaldırmak için filtrasyon, sakaroz veya iyodiksanol yoğunluk gradyan santrifüjlemesi veya boyut dışlama kromatografisi gibi diğer yöntemlerle birleştirilebilir, bu da sadece kirleticileri temizlemeye değil, aynı zamanda farklı EV popülasyonlarını da ayırmaya izin verir37, 38,40. Ne olursa olsun, burada kullanılan yöntem basittir ve parazitlerden sEV'leri hasat etmek ve zenginleştirmek için birincil tercihi temsil eder39. Yalnızca yeniden kullanılabilir tüplerin kullanılabileceği bir ultrasantrifüj ile donatılmış bir laboratuvar gerektirdiğinden, nispeten düşük bir maliyetle yüksek bir sEV verimi sağlar.
İzole edilmiş EV'lerin özellik açıklaması, EV'lerin konsantrasyonunu, boyutunu, kalitesini ve alt tipini belirlemek için esastır. Ek olarak, protein bileşiminin analizi, numunede hangi EV alt popülasyonlarının zenginleştirildiğini belirlemek ve olası kirleticilerin varlığını tahmin etmek için işbirliği yapar. EV karakterizasyonu, sıklıkla özel ekipman ve tesisler gerektiren farklı yöntemlerle gerçekleştirilebilir41. Burada, parazit sEV'lerin boyutu, monodispers süspansiyonlarda güvenilir veriler sağlayan ancak geniş dağıtılmış EV'lere sahip süspansiyonlarda daha az kesin olan DLS kullanılarak analiz edildi42. Bu nedenle, bir alternatif, vezikül boyutunu ve miktarını doğru bir şekilde belirleyen Nanopartikül İzleme Analizi (NTA), NTA'dan daha geniş bir dinamik aralık sunan Ayarlanabilir Dirençli Darbe Algılama (TRPS) veya geleneksel akış sitometrisinden daha yüksek hassasiyete sahip Nano akış Sitometresi (NanFCM) gibi diğer yöntemlerin kullanılması olabilir 43,44,45. Ayrıca, deneysel rutinin bir parçası olarak ve uzman tavsiyeleri ile TEM tekniği, esasen yüksek EV hasatlarında elde edilen EV'lerin saflığını, verimini ve boyutunu bütünsel olarak belirlemeye izin verir46. Ek olarak, ultrasantrifüjlemeden sonra, geri kazanılan materyalin bileşimini doğrulamak için EV peletini görselleştirmek mümkün olmadığında, TEM analizi ile inceleme özellikle önerilir.
Bu konular, helmint türevli EV'lerin izolasyonu ve kapsamlı karakterizasyonu için sağlam tekniklerin kullanılmasının önemini vurgulamaktadır, bu da kaderlerini izlemek için belirli belirteçlerin tanımlanmasını kolaylaştırabilir ve dolayısıyla işlevsel rollerinin değerlendirilmesini sağlayabilir.
E. granulosus'tan saflaştırılan hücre dışı veziküller, birkaç karakterize edilmiş ve bilinmeyen antijenik proteine sahip doğal antijen taşıma taşıyıcılarını temsil eder9. Bu sEV'ler tek başına, konakçının farklı dokularına ve ikincil lenfoid organlarına dağılmış antijen sunan hücreleri uyarabilir. Dendritik hücreler, naif T hücrelerine antijen gösterebilen, in vivo immün yanıt tipini belirleyen benzersiz profesyonel antijen sunan hücrelerdir 47,48.
Bu el yazması, daha önce yayınlanmış bir araştırmadan uyarlanan fare kemik iliği kültürlerinden dendritik hücreler üretmek için bir yöntemi detaylandırmak için bir protokolü açıklamaktadır49. Burada, kemik iliği izolasyonunun başarılı bir in vitro kültür50 elde etmek için önemli bir adım olduğu, Flt3L güdümlü murin BMDC'lerinin in vitro kültürüne dayalı olarak immün çalışmalar için iyi kurulmuş bir yöntem önerilmiştir. Kemik iliği hücrelerinin çeşitli izolasyon protokollerinin heterojen hücre popülasyonları ürettiği göz önüne alındığında, BMDC kültürleri, planlanan deneyler için hücre fenotipini belirlemek için Flt3L farklılaşmasının ilk zamanı sırasında akış sitometrisi ile analiz edilmelidir 51,52,53. Flt3L etkisi altında BMDC'nin fenotipik karakterizasyonu, çoğunluğun, eksojen antijenleri yükleyen in vivo bulunan dendritik hücrelere daha çok benzeyen geleneksel dendritik hücreler (CD11b +, CD11c +, CD172a +) olduğunu gösterir. BMDC'nin küçük bir yüzdesi plazmasitoid dendritik hücrelere (CD11c+, B220+, SinglecH+) ve CD8+ benzeri dendritik hücrelere (CD11c+, CD24+ ve CD172a-) karşılık gelirken11,53.
Bazı yaygın rahatsız edici adımlar, hazırlama sırasında kemik kırılması, verimsiz kemik iliği ekstraksiyonu, hücre küme oluşumu, suboptimal kültür koşulları (örneğin, orta bileşim, sıcaklık) veya yetersiz sitokin stimülasyonundan kaynaklanabilecek kültürde BMDC'lerin düşük verimidir. Bu sorunları ele almak için, bazı alternatifler epifizlerin arkasını kesmek, femur ve tibiaların her iki tarafından kemik iliği hücrelerinin tamamen yıkanmasını sağlamak, hücre süzgecinden geçmeden önce kemik iliğini tamamen askıya almak, önerilen konsantrasyonda taze hazırlanmış sitokinleri kullanmak ve kültür ortamının sterilitesini ve pH stabilitesini korumaktır.
Antijen teması ile olgunlaşmalarını indüklemeden önce dendritik hücre başlangıç 'dinlenme' durumunu sağlamak zorunludur. Dendritik hücreler sadece çok çeşitli dış antijenleri (PAMP'ler, patojenle ilişkili moleküler model) ve iç antijenleri (DAMP'ler, tehlikeyle ilişkili moleküler model) tanımakla kalmaz, aynı zamanda hücre kültüründeki minimal değişiklikler (pH, hafif ajitasyon, hücre yoğunluğu) olgunlaşmalarını indükleyebilir. Bu nedenlerden dolayı, santrifüj veya inkübatörde kullanım sırasında hücre kültürü hareketleri ve titreşimleri en aza indirilmelidir. Ayrıca, pipetleme ortamda kabarcıklar oluşturmadan pürüzsüz olmalıdır. Ek olarak, birincil kültürlerin 8 günden fazla sürdürülmesi, dendritik hücreleri aktive edebilir ve hücre ölümünü teşvik edebilir. Ayrıca, 2.5 x 106'dan daha yüksek bir hücre yoğunluğu, daha fazla MHCII ekspresyonu54 üretir ve antijen temasından önce olgunlaşmayı artırır. Ayrıca, kullanılan tüm reaktifler, gram negatif bakterilerle önceki kontaminasyonun bir sonucu olarak endotoksinlerden veya LPS'den tamamen arındırılmalıdır, çünkü LPS, dendritik hücrelerin uyarılmasına veya tükenmesine neden olur23,55. Kemik iliği kültürlerinin manipülasyonu sırasında steriliteyi korumak için, ortamda antibiyotik kullanımının yanı sıra, etanol ve kemik iliği hücreleri arasındaki teması koruyarak yüzeyde, eldivenli ellerde ve dolap nesnelerinde sürekli olarak %70 etanol spreyi kullanılmalıdır. Aletleri kemiklere veya hücrelere maruz bırakmadan önce, etanolün buharlaştığından emin olun ve kemik iliği hücreleri için zehirli olduğu için havayla kurutun.
Dendritik hücreler, sEV'leri tanıdıktan ve fagosisite ettikten sonra olgunlaşmalarını ve sitokin üretimlerini teşvik eder. E. granulosus sEV'ler, Th1 profili9'u tercih ederek IL-12 ekspresyonunu indükler. Dendritik hücre fenotipik olgunlaşması yetersizse, eklenen sEV'lerle elde edilen uyaranın süresi veya konsantrasyonu optimize edilmelidir. Konfokal mikroskopi, dendritik hücre endozomları üzerinde MHC molekülleri ile kargo içselleştirmesini ve kolokalizasyonunu görselleştirmek için kullanılan güçlü bir araçtır. Ayrıca, sEV'lerin alımından en az 8 saat sonra, akış sitometrisi, olgun dendritik hücrelerde hücre içi sitokinleri ve CD40, CD80, CD86 ve MHCII gibi yüzey moleküllerini ölçmek için de kullanılabilir11,13.
Çok çeşitli teknikler kullanan kapsamlı araştırmalar, parazit EV boyutunun, kökeninin ve kargosunun konakçı tepkilerine nasıl müdahale edebileceği ve bunları nasıl değiştirebileceği konusunda daha derin bir anlayış sağlayacaktır.
Açıklamalar
Yazarlar herhangi bir çıkar çatışması olmadığını beyan ederler.
Teşekkürler
Yazarlar Lic'i kabul eder. Cecilia Gutiérrez Ayesta (Servicio de Microscopía Electrónica, CONICET, Bahía Blanca, Arjantin) ve Lic. Leonardo Sechi ve Lic. Eliana Maza (INIFTA, Universidad Nacional de La Plata, Arjantin) sırasıyla transmisyon elektron mikroskobu ve dinamik ışık saçılımı konularında teknik yardım için. Dra'ya da teşekkür ediyoruz. Graciela Salerno, Dra. Corina Berón ve Dr. Gonzalo Caló, Arjantin'deki INBIOTEC-CONICET-FIBA'da ultrasantrifüjün kullanımı için. Yazarlar Lic'i minnetle kabul eder. Kelly (SENASA, Mar del Plata, Arjantin) ve Lic. H. Núnez García (CONICET, Universidad Nacional de Mar del Plata, Arjantin) farelerin refah değerlendirmesindeki işbirlikleri için ve Med. Vet. J. Reyno, Med. Vet. S. Gonzalez ve Med. Vet. L. Netti'ye parazit materyali elde edilmesine katkılarından dolayı. Deney, reaktifler ve ekipman maliyetleri de dahil olmak üzere bu çalışma, ANPCyT tarafından finanse edilen PICT 2020 No. 1651 tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1.5 mL tubes | Henso | N14059 | |
| 24-well plate | JetBiofil | CAP011024 | Polystyrene, flat bottom, Sterile |
| 6-well plate | Henso Medical Co. Ltd. | N14221 | Flat-shape bottom, PS material, Sterile |
| 70 mm polypropylene cell strainer | Biologix Group Limited | 15-1070 | Sterile |
| Alcian blue 8 GX dye | Santa Cruz | sc-214517B | |
| Automatic CO2 incubator | Nuarire | UN-5100E/G DH | |
| Bovine Serum Albumin | Wiener lab | 1443151 | |
| CD11c Monoclonal antibody-PECy5 100 µg | eBioscience | 15-0114-82 | clone (N418) |
| CD40 Monoclonal antibody-FITC 100 µg | eBioscience | 11-0402-82 | clone (HM40-3) |
| CD80 Monoclonal antibody-APC 100 µg | eBioscience | 17-0801-82 | clone (16-10A-1) |
| CD86 Monoclonal antibody-FITC 100 µg | eBioscience | 11-0862-82 | clone (GL-1) |
| Centrifuge | Thermo Scientific | IEC CL31R Multispeed | |
| Confocal Microscope | Nikon | Nikon Confocal Microscope C1 | |
| Conical tubes 15 mL dia.17 x 120 mm | Citotest | 4610-1865 | |
| DAPI | Sigma | 107K4034 | |
| D-Glucose | Merk | 1.78343 | |
| Dimethyl Sulfoxide | Anedra | 6646 | |
| Fetal Bovine Serum 500 mL | Sigma-Aldrich | 12352207 | |
| Flow Cytometry System | BD Biosciences | BD FACSCanto™ II | |
| Folded Capillary Zeta Cell | Malvern Panalytical | DTS1070 | |
| Gentamicin sulfate salt | Sigma | G1264 | |
| Glutaraldehyde solution | Fluka | 49630 | |
| Hepes | Gibco | 11344041 | |
| Hypodermic needle 21 G x 1"25/8 | Weigao | Sterile | |
| Hypodermic needle 25 G x 5/8" | Weigao | Sterile | |
| Inverted microscope | Leica | DMIL LED Fluo | |
| Ketamine | Holliday | ||
| Lipopolysaccharide 5 mg | Invitrogen | tlrl-rslps | LPS from the Gram-negative bacteria E. coli K12 . TLR2/4 Agonists |
| Loperamide hydrochloride | Sigma-Aldrich | 5.08162 | |
| Medium 199 | Gibco | 11150059 | |
| Methylene Blue | Anedra | 6337 | |
| MHC class I (H2kb) Monoclonal antibody-PE 100 µg | eBioscience | 12-5958-82 | clone (AF6-88.5.5.3) |
| MHC class II (IA/IE) Monoclonal antibody-FITC 100 µg | eBioscience | 11-5321-82 | clone (M5/114.15.2) |
| Microscope | Olympus | CX31 | |
| Mouse recombinant murine Flt3L. | PrepoTech | 250-31L-10UG | |
| Nanodrop | Thermo Scientific | ND-One | |
| Paraformaldehyde | Agar Scientific | R1018 | |
| Penicillin G sodium salt | Sigma | P3032-10MU | |
| PKH26 | Sigma-Aldrich | MINI26 | |
| Potassium Phosphate Monobasic | Timper | For Phosphate Buffered Saline (PBS) | |
| RBC lysis buffer 100 mL | Roche | 11814389001 | |
| RPMI medium 1640 1x 500 mL | Sigma-Aldrich (Gibco) | 11875093 | |
| Sodium Cacodylate | Sigma-Aldrich | C0250 | |
| Sodium Chloride | Anedra | 7647-14-5 | For Phosphate Buffered Saline (PBS) |
| Sodium Phosphate Dibasic (Anhydrous) p. a. | Biopack | 1639.07 | For Phosphate Buffered Saline (PBS) |
| Streptomycin sulfate salt | Sigma | S9137 | |
| Syringe 10 mL | Bremen | Sterile | |
| Thickwall polycarbonate tubes | Beckman Coulter | 13 x 55 mm , nominal capacity 4 mL | |
| Transmission Electron Microscope | Jeol | JEOL JSM 100CX II | |
| Ultracentrifuge | Beckman | Optima LE-80k | 90 Ti rotor |
| Xylazine | Richmond | ||
| Zetasizer Nano | Malvern | Nano ZSizer-ZEN3600 | To perform Dynamic Light scattering and zeta potential measurements |
Referanslar
- Wen, H., et al. Echinococcosis: advances in the 21st century. Clin Microbiol Rev. 32 (2), e00075-e00118 (2019).
- Geary, T. G., Thompson, D. P. Development of antiparasitic drugs in the 21st century. Vet Parasitol. 115 (2), 167-184 (2003).
- Drurey, C., Maizels, R. M. Helminth extracellular vesicles: Interactions with the host immune system. Mol Immunol. 137, 124-133 (2021).
- Welsh, J. A., et al. Minimal information for studies of extracellular vesicles (MISEV2023): From basic to advanced approaches. J. Extracell Vesicles. 13 (2), e12404 (2024).
- Cresswell, P. Antigen processing and presentation. Immunol Rev. 207, 5-7 (2005).
- Buzas, E. I. The roles of extracellular vesicles in the immune system. Nat Rev Immunol. 23 (4), 236-250 (2023).
- Bennett, A. P. S., de la Torre-Escudero, E., Oliver, N. A. M., Huson, K. M., Robinson, M. W. The cellular and molecular origins of extracellular vesicles released by the helminth pathogen Fasciola hepatica. Int J Parasitol. 50 (9), 671-683 (2020).
- Drurey, C., Coakley, G., Maizels, R. M. Extracellular vesicles: new targets for vaccines against helminth parasites. Int J Parasitol. 50 (9), 623-633 (2020).
- Nicolao, M. C., et al. Characterization of protein cargo of Echinococcus granulosus extracellular vesicles in drug response and its influence on immune response. Parasit Vectors. 16 (1), 255 (2023).
- Sánchez-López, C. M., Trelis, M., Bernal, D., Marcilla, A. Overview of the interaction of helminth extracellular vesicles with the host and their potential functions and biological applications. Mol Immunol. 134, 228-235 (2021).
- Nicolao, M. C., Rodriguez, R. C., Cumino, A. C. Extracellular vesicles from Echinococcus granulosus larval stage: Isolation, characterization and uptake by dendritic cells. PLoS Negl Trop Dis. 13 (1), e0007032 (2019).
- Kuipers, M. E., et al. DC-SIGN mediated internalisation of glycosylated extracellular vesicles from Schistosoma mansoni increases activation of monocyte-derived dendritic cells. J Extracell Vesicles. 9 (1), 1753420 (2020).
- Murphy, A., et al. Fasciola hepatica extracellular vesicles isolated from excretory-secretory products using a gravity flow method modulate dendritic cell phenotype and activity. PLoS Negl Trop Dis. 14 (9), e0008626 (2020).
- Ricciardi, A., et al. Extracellular vesicles released from the filarial parasite Brugia malayi downregulate the host mTOR pathway. PLoS Negl Trop Dis. 15 (1), e0008884 (2021).
- Zhang, Q., Jeppesen, D. K., Higginbotham, J. N., Franklin, J. L., Coffey, R. J. Comprehensive isolation of extracellular vesicles and nanoparticles. Nat Protoc. 18 (5), 1462-1487 (2023).
- Brezgin, S., et al. Basic guide for approaching drug delivery with extracellular vesicles. Int J Mol Sci. 25 (19), 10401 (2024).
- Pinheiro, A. A., et al. Potential of extracellular vesicles in the pathogenesis, diagnosis, and therapy for parasitic diseases. J Extracell Vesicles. 13 (8), e12496 (2024).
- Barnadas-Carceller, B., Del Portillo, H. A., Fernandez-Becerra, C. Extracellular vesicles as biomarkers in parasitic disease diagnosis. Curr Top Membr. 94, 187-223 (2024).
- Nicolao, M. C., Denegri, G. M., Carcamo, J. G., Cumino, A. C. P-glycoprotein expression and pharmacological modulation in larval stages of Echinococcus granulosus. Parasitol Int. 63 (1), 1-8 (2014).
- Nicolao, M. C., Cumino, A. C. Biochemical and molecular characterization of the calcineurin in Echinococcus granulosus larval stages. Acta Trop. 146, 141-151 (2015).
- Savina, A., Furlan, M., Vidal, M., Colombo, M. I. Exosome release is regulated by a calcium-dependent mechanism in K562 cells. J Biol Chem. 278 (22), 20083-20090 (2003).
- Ambattu, L. A., et al. High frequency acoustic cell stimulation promotes exosome generation regulated by a calcium-dependent mechanism. Commun Biol. 3 (1), 553 (2020).
- White, R., et al. Special considerations for studies of extracellular vesicles from parasitic helminths: A community-led roadmap to increase rigour and reproducibility. J Extracell Vesicles. 12 (1), e12298 (2023).
- Casado, N., Rodriguez-Caabeiro, F., Hernandez, S. In vitro survival of Echinococcus granulosus protoscolices in several media, at +4 degrees C and +37 degrees C. Z Parasitenkd. 72 (2), 273-278 (1986).
- Casado, N., Rodriguez-Caabeiro, F., Jiménez, A., Criado, A., de Armas, C. In vitro effects of levamisole and ivermectin against Echinococcus granulosus protoscoleces. Int J Parasitol. 19 (8), 945-947 (1989).
- Al-Lamki, R. S., Bradley, J. R., Pober, J. S. Human organ culture: updating the approach to bridge the gap from in vitro to in vivo in inflammation, cancer, and stem cell biology. Front Med. 4, 148 (2017).
- Rodriguez-Caabeiro, F., Casado, N. Evidence of in vitro germinal layer development in Echinococcus granulosus cysts. Parasitol Res. 74 (6), 558-562 (1988).
- Loos, J. A., Cumino, A. C. In vitro anti-echinococcal and metabolic effects of metformin involve activation of AMP-activated protein kinase in larval stages of Echinococcus granulosus. PLoS One. 10 (5), e0126009 (2015).
- Erwin, N., Serafim, M. F., He, M. Enhancing the cellular production of extracellular vesicles for developing therapeutic applications. Phar. Res. 40 (4), 833-853 (2023).
- Sako, Y., et al. Identification of a novel small molecule that enhances the release of extracellular vesicles with immunostimulatory potency via induction of calcium influx. ACS Chem Biol. 18 (4), 982-993 (2023).
- He, L. P., Mears, D., Atwater, I., Rojas, E., Cleemann, L. Loperamide mobilizes intracellular Ca2+ stores in insulin-secreting HIT-T15 cells. Br J Pharmacol. 139 (2), 351-361 (2003).
- Dalton, J. P., Skelly, P., Halton, D. W. Role of the tegument and gut in nutrient uptake by parasitic platyhelminths. Can J Zool. 82 (2), 211-232 (2004).
- Dos Santos, G. B., et al. Excretory/secretory products in the Echinococcus granulosus metacestode: is the intermediate host complacent with infection caused by the larval form of the parasite. Int J Parasitol. 46 (13-14), 843-856 (2016).
- Siles-Lucas, M., et al. Isolation and characterization of exosomes derived from fertile sheep hydatid cysts. Vet Parasitol. 236, 22-22 (2017).
- Yang, J., et al. Identification of different extracellular vesicles in the hydatid fluid of Echinococcus granulosus and immunomodulatory effects of 110 K EVs on sheep PBMCs. Front Immunol. 12, 602717 (2021).
- Khosravi, M., et al. Characterisation of extracellular vesicles isolated from hydatid cyst fluid and evaluation of immunomodulatory effects on human monocytes. J Cell Mol Med. 27 (17), 2614-2625 (2023).
- Sotillo, J., et al. The protein and microRNA cargo of extracellular vesicles from parasitic helminths–current status and research priorities. Int J Parasitol. 50 (9), 635-645 (2020).
- Kuipers, M. E., et al. Optimized protocol for the isolation of extracellular vesicles from the parasitic worm Schistosoma mansoni with improved purity, concentration, and yield. J Immunol Res. 2022 (1), 5473763 (2022).
- Fernandez-Becerra, C., et al. Guidelines for the purification and characterization of extracellular vesicles of parasites. J Extracell Biol. 2 (10), e117 (2023).
- Chaiyadet, S., et al. Silencing of Opisthorchis viverrini tetraspanin gene expression results in reduced secretion of extracellular vesicles. Front Cell Infect Microbiol. 12, 827521 (2022).
- Théry, C., et al. Minimal information for studies of extracellular vesicles 2018 (MISEV2018): A position statement of the International Society for Extracellular Vesicles and update of the MISEV2014 guidelines. J Extracell Vesicles. 7 (1), 1535750 (2018).
- Szatanek, R., et al. The methods of choice for extracellular vesicles (EVs) characterization. Int J Mol Sci. 18 (6), 1153 (2017).
- Blundell, E. L. C. J., Mayne, L. J., Billinge, E. R., Platt, M. Emergence of tunable resistive pulse sensing as a biosensor. Anal Methods. 7 (17), 7055-7066 (2015).
- Vucetic, A., Filho, A., Dong, G., Olivier, M. Isolation of extracellular vesicles from Leishmania spp. Methods Mol Biol. , 555-574 (2020).
- Caputo, F., et al. Measuring particle size distribution and mass concentration of nanoplastics and microplastics: Addressing some analytical challenges in the submicron size range. J Colloid Interface Sci. 588, 401-417 (2021).
- Crescitelli, R., Lässer, C., Lötvall, J. Isolation and characterization of extracellular vesicle subpopulations from tissues. Nat Protoc. 16 (3), 1548-1580 (2021).
- Trombetta, E. S., Mellman, I. The cell biological basis of antigen presentation in vitro and in vivo. Ann Rev Immunol. 23 (1), 975-1028 (2005).
- Hammer, G. E., Ma, A. Molecular control of state dendritic cell maturation and immuno homeostasis. Ann Rev Immunol. 31 (1), 743-791 (2013).
- Weigel, B. J., et al. Comparative analysis of murine marrow–derived dendritic cells generated by Flt3L or GM-CSF/IL-4 and matured with immune stimulatory agents on the in vivo induction of antileukemia responses. Blood. 100 (12), 4169-4176 (2002).
- March, N., et al. Differences in dendritic cells stimulated in vivo by tumors engineered to secrete granulocyte macrophage colony-stimulating factor or Flt3-ligand. Cancer Res. 60, 3239-3246 (2000).
- Heath, W. R., et al. Cross-presentation, dendritic cell subsets, and the generation of immunity to cellular antigens. Immunol Rev. 199 (1), 9-26 (2004).
- Naik, S., et al. Cutting edge: generation of splenic CD8+ and CD8− dendritic cell equivalents in Fms-like tyrosine kinase 3 ligand bone marrow cultures. J Immunol. 174 (11), 6592-6597 (2005).
- Sauter, M., et al. Protocol to isolate and analyze mouse bone marrow derived dendritic cells (BMDC). STAR Protoc. 3 (3), 101664 (2022).
- Helft, J., et al. GM-CSF mouse bone marrow cultures comprise a heterogeneous population of CD11c(+) MHCII(+) macrophages and dendritic cells. Immunity. 42 (6), 1197-1211 (2015).
- Borup, A., et al. Comparison of separation methods for immunomodulatory extracellular vesicles from helminths. J Extracell Biol. 1 (5), e41 (2022).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır