Method Article
عزل وامتصاص الخلايا الشجيرية للحويصلات الصغيرة خارج الخلية من المشوكات الحبيبية
In This Article
Summary
هنا ، نصف ظروف الثقافة في المختبر ، والعزل ، وزيادة توليد الحويصلات خارج الخلية (EVs) من المشوكات الحبيبية. تميزت المركبات الكهربائية الصغيرة بتشتت الضوء الديناميكي والفحص المجهري الإلكتروني للإرسال. تمت دراسة امتصاص الخلايا المتغصنة المشتقة من نخاع العظام وتعديلها الظاهري باستخدام الفحص المجهري متحد البؤر وقياس التدفق الخلوي.
Abstract
يعد إفراز الحويصلات خارج الخلية بواسطة الخيط أمرا بالغ الأهمية لتمكين الاتصال الخلوي ليس فقط بين الطفيليات ولكن أيضا مع الأنسجة المضيفة. على وجه الخصوص ، تعمل الحويصلات الصغيرة خارج الخلية (sEVs) كناقلات نانوية تنقل المستضدات الطبيعية ، والتي تعتبر ضرورية في التعديل المناعي للمضيف وبقاء الطفيليات. تقدم هذه المقالة بروتوكولا خطوة بخطوة لعزل sevs من مزارع مرحلة اليرقات من المشوكات الحبيبية وتحلل امتصاصها بواسطة الخلايا المتغصنة التي تم الحصول عليها من نخاع عظم الفئران ، والتي تكتسب قدرة الالتصاق وعرض المستضد أثناء نضجها بعد أسبوع واحد من الزراعة في المختبر . توفر هذه المقالة معلومات شاملة لتوليد وتنقية وقياس sEVs باستخدام الطرد المركزي الفائق جنبا إلى جنب مع التحليلات المتوازية لتشتت الضوء الديناميكي والفحص المجهري الإلكتروني للإرسال. بالإضافة إلى ذلك ، تم تحديد بروتوكول تجريبي مفصل لعزل وزراعة خلايا نخاع عظم الفأر ودفع تمايزها إلى خلايا متغصنة باستخدام Flt3L. يمكن لهذه الخلايا المتغصنة أن تقدم مستضدات للخلايا التائية الساذجة ، وبالتالي تعديل نوع الاستجابة المناعية في الجسم الحي. وبالتالي ، يتم اقتراح بروتوكولات بديلة ، بما في ذلك الفحص المجهري متحد البؤر وتحليل قياس التدفق الخلوي ، للتحقق من النمط الظاهري الناضج المكتسب للخلايا المتغصنة التي تعرضت سابقا للمركبات الكهربائية الطفيلية. أخيرا ، تجدر الإشارة إلى أنه يمكن تطبيق البروتوكول الموصوف ككل أو في أجزاء فردية لإجراء الطفيليات في الثقافة المختبرية ، وعزل الحويصلات خارج الخلية ، وتوليد مزارع الخلايا المتغصنة المشتقة من نخاع العظام ، وإجراء فحوصات الامتصاص مع هذه الخلايا.
Introduction
المشوكات الحبيبية هي الديدان الطفيلية الحيوانية المنشأ المسؤولة عن عدوى طويلة الأمد تعرف باسم داء المشوكاتالكيسي 1. في المضيفين الوسيطين ، مثل الماشية والبشر ، تؤثر عدوى الطفيليات بشكل أساسي على الكبد والرئتين ، حيث تتطور مرحلة اليرقات على شكل أكياس مملوءة بالسوائل أو قليل يحتوي على البروتوسكوليسيات (اليرقة نفسها). مثل جميع الديستوكيد الخيطية ، يفتقر هذا الطفيل إلى كل من الجهاز الهضمي والإخراجي ، وبالتالي فقد طور عمليات خلوية داخلية وخارجية نشطة لتنظيم امتصاص وإفراز المستقلبات بالإضافة إلى إطلاق الحويصلات خارج الخلية2،3. الحويصلات خارج الخلية (EVs) عبارة عن جزيئات محاطة بطبقة ثنائية الدهون تفرزها جميع أنواع الخلايا على ما يبدو. على وجه الخصوص ، يمكن أن تعمل الحويصلات الصغيرة خارج الخلية (sEVs) ، والتي تعرف بأنها EVs أصغر من 200 نانومتر بغض النظر عن أصلها الحيوي4 ، كوسطاء مناعي بين الخلايا. هذه الوظيفة مهمة بشكل خاص في الطفيليات ، التي تعتمد على التعديل المناعي للمضيف لضمان بقائهاعلى قيد الحياة 3. يتم تحقيق التلاعب المناعي من خلال امتصاص الخلايا التائية المضيفة للخلايا التائية الساذجة في الجسم الحي وبدء استجابة مناعية تكيفية تؤدي إلى عدوى مزمنة بهذه الديدان الطفيلية. تقوم الخلايا المتغصنة ، والخلايا المهنية العارضة للمستضد في الجهاز المناعي الفطري ، بمعالجة وتحميل الببتيدات المستضدية على مركب التوافق النسيجي الرئيسي من الفئة الأولى والفئة الثانية (معقد التوافق النسيجي الكبير الأول ومعقد التوافق النسيجي الكبير الثاني) وعرضها على أغشيتها لتحضير الخلايا التائية الساذجة الحصرية (خلايا CD8 + و CD4 + T ، على التوالي)5. بعد الخلايا المتغصنة تحفز نضوجها عن طريق تحريض التعبير عن علامات التحفيز المشترك CD80 / CD86 و CD40 و MHC-II وتهاجر من الأنسجة المحيطية إلى الأعضاء اللمفاوية الثانوية عند التعرف على المستضدات الغريبة ، وتحميلها لتحضير الخلايا التائية الساذجةالحصرية 6. وبالتالي ، فإن الهدف العام لهذا البروتوكول هو دراسة التواصل بين الطفيلي والمضيف بطريقة واقعية ، وتحليل تغليف وتسليم المكونات الطفيلية في شكل sevs ، والتي ، عند وصولها إلى الخلايا المناعية المضيفة ، تؤثر على تطور العدوى وتطور المرض الطفيلي المزمن.
إن معالجة تحليل واجهة الديدان الطفيلية المضيفة من خلال دراسة المركبات الكهربائية الكهربائية لها العديد من المزايا. أولا ، الغطاء الخارجي للديدان المفلطحة ، عبارة عن هيكل غشائي مزدوج يشكل نقطة عبور رئيسية بين الطفيلي ومضيفه ، مما يسمح بتوليد المركبات الكهربائية الصغيرة بسهولة أو تغلغلها من هذا الهيكل7. ثانيا ، يتم تحميل sevs بشكل كبير بمستضدات البروتين من جميع مراحل دورة حياة الطفيليات ، مما يمثل الطريقة الطبيعية التي يقوم من خلالها الجهاز المناعي المضيف بأخذ عينات من المستضدات أثناء الإصابة بالديدان8،9. نظرا لإنتاجها البيولوجي ، وسهولة التنقية (دون الحاجة إلى تعطيل الأنسجة أو تجزئة البروتين) ، والتفاعل المباشر مع الخلايا المضيفة ، تمكن الديدان الطفيلية من تطوير تجارب في المختبر لمحاكاة الظروف في الجسم الحي للتفاعل بين الطفيليات والمضيف. أخيرا ، تمثل sevs إمكانية وجود هياكل طفيلية يمكن أن تكون بلعمة أو استيعابها بواسطة الخلايا المضيفة ، والتغلب على استحالة القيام بذلك مع الطفيليات الكاملة ، خاصة في حالات الديدان المكيسة.
بالنظر إلى المزايا المذكورة وحقيقة أن الديدان الطفيلية منتشرة وعادة ما تكون أمراضا مزمنة يفترض فيها أن تتلاعب الطفيليات بالجهاز المناعي المضيف كاستراتيجية للبقاء على قيد الحياة ، فإن عزل المركبات الكهربائية المشتقة من الطفيليات ودراستها في التفاعل مع الخلايا المتغصنة يوفر إطارا قيما لاستكشاف هذا التعديل المناعي10. بهذا المعنى ، تم وصف أن استيعاب المركبات الكهربائية من الديدان الطفيلية ، بما في ذلك الديدان الخيطية والديدان الصديدية مثل البلهارسيا مانسوني ، والفاسيولا الكبد ، و Brugia malayi ، و E. granulosus ، يحفز نضوج الخلايا المتغصنة ونشطها9،11،12،13،14،15.
لا يتيح عزل المركبات الكهربائية المشتقة من الديدان الطفيلية دراسة التفاعلات المناعية فحسب ، مما قد يؤدي إلى تطوير لقاحات وقائية أو عوامل علاج مناعي لأمراض الحساسية أو المناعة الذاتية ، ولكنه يسهل أيضا استكشاف التفاعلات والوظائف البيولوجية الأخرى8 ، 16 ، 17. في هذا السياق ، يمكن استخدام المركبات الكهربائية ، التي تلعب دورا في التاريخ الطبيعي للعدوى الطفيلية ، للتحقيق في تطور الطفيليات والتفاعلات مع الخلايا المضيفة المحددة. علاوة على ذلك ، يمكن أن يكون لها تطبيقات محتملة كمؤشرات حيوية مبكرة أو تفاضلية لتشخيص الأمراض الطفيلية ، ومراقبة الاستجابات العلاجية ، والمساهمة في السيطرة على العدوى الطفيلية وإدارتها17،18.
بالإضافة إلى ذلك ، كما هو موضح سابقا ، فإن مرحلة اليرقات من بكتريا حبيبية عرضة للتغيرات في تركيز الكالسيوم العصاري الخلوي ، والذي ، إلى جانب لعبه دورا في بقاء الطفيليات ، يتحكم أيضا في معدل إفرازالخلايا 19،20. في هذا السياق ، ومعرفة أن ارتفاع الكالسيوم داخل الخلايا يعزز إطلاق EV ، فإن استخدام محسن الكالسيوم داخل الخلايا مثل لوبيراميد يمكن أن يكون استراتيجية حاسمة لزيادة عدد المركبات الكهربائية. هذا النهج مثير للاهتمام بشكل خاص للأنظمة الخلوية التي تتطلب عددا كبيرا من السكان لتوليد كمية كافية من المركبات الكهربائية للشحن والتحليل الوظيفي11،21،22. يوضح البروتوكول الحالي (الشكل 1) بالتفصيل طرق الحصول على الثقافات النقية لمرحلة اليرقات E. granulosus والظروف التي تعزز إنتاج sev. كما يصف سير العمل لعزل وتوصيف هذه الحويصلات ، بالإضافة إلى امتصاصها بواسطة الخلايا المتغصنة في الفئران ، وهي خطوة أساسية في الدراسة الأولية لتعديل الجهاز المناعي للمضيف.
Protocol
تم تقييم جميع الإجراءات المتعلقة بالحيوانات والموافقة عليها من قبل اللجنة التجريبية الحيوانية التابعة لكلية العلوم الدقيقة والطبيعية ، مار ديل بلاتا (أرقام التصاريح: RD544-2020; RD624-625-2021 ؛ RD80-2022). في هذا البروتوكول ، تم القتل الرحيم للفئران ، وفقا ل "دليل رعاية واستخدام المختبر" الذي نشرته المعاهد الوطنية للصحة وإرشادات الخدمة الصحية الوطنية وجودة الغذاء (SENASA).
1. زراعة مرحلة اليرقات Echinococcus
ملاحظة: تم تنفيذ جميع الإجراءات في ظل ظروف معقمة.
- E. الحبيبات protoscoleces الوفاء
- قم بالشفط بإبرة 21 جم وجزء من حقنة 10 مل من السائل العداري من الرئة أو الكبد للماشية المصابة لتقليل تورم الكيس (الشكل 2 أ).
ملاحظة: تأتي الرئتان والكبد المصابتان من الماشية المقدمة للذبح الروتيني في المسلخ. يجب الاحتفاظ بها في درجة حرارة 4 درجات مئوية ومعالجتها في غضون 24 ساعة من الذبح. - افتح الكيس بالمقص وقم بإزالة الطبقات الصفيحية والجرثومية من الكيس باستخدام الملقط. ضعها في طبق بتري معقم ، جنبا إلى جنب مع أي سائل هيداتيد متبقي (الشكل 2 ب ، ج).
ملاحظة: في هذه المرحلة ، يوصى بمراقبة طبق بتري تحت المجهر المقلوب لتقييم جودة البروتوسكوليسيات وكبسولات الحضنة. تجنب تجميع المواد البيولوجية من الخراجات التي انهارت فيها أكثر من 50٪ من القوالب الأولية ، والتي يتم تحديدها من خلال السوما المتقلص ، واللون الداكن ، والوردية غير المنظمة مع فقدان الخطافات. - اغسل الطبقات بمحلول ملحي معقم بالفوسفات (PBS) مكمل بالمضادات الحيوية (100 ميكروغرام / مل بنسلين ، 100 ميكروغرام / مل ستربتومايسين ، 100 ميكروغرام / مل جنتاميسين 100 ميكروغرام / مل) لإزالة البروتوسكوليسيس.
ملاحظة: سيتم إجراء جميع عمليات الغسيل باستخدام PBS المكملة بالمضادات الحيوية. - انقل معلق البروتوسكولكس إلى أنبوب خان زجاجي معقم باستخدام ماصة باستور.
- اغسل البروتوسكوليت باستخدام PBS المكمل عند 4 درجات مئوية باستخدام ماصة باستور لإزالة الطفيليات الميتة. أعد تعليق التعليق بقوة لكسر كبسولات الحضنة مما يسهل إطلاق البروتوسكولكس. اسمح للكتل الأولية بالاستقرار لمدة 1-2 دقيقة في قاع الأنبوب ؛ ثم تخلص من المادة الطافية التي تحتوي على أوليات ميتة.
ملاحظة: بسبب الاختلاف في الكثافة ، تستقر الكتل الأولية الحية بشكل أسرع من الطفيليات الميتة. - كرر عملية الغسيل حتى تتم إزالة جميع الكتل الأولية الميتة والعائمة.
ملاحظة: تتم إزالة الطفيليات الميتة عندما تستقر جميعها بنفس المعدل. - تحديد جدوى البروتوسكوليسيات باستخدام اختبار استبعاد الميثيلين.
- أعد تعليق الكتل الأولية المغسولة بماصة وضع قطرة على شريحة. أضف قطرة 0.1 مجم / مل من الميثيلين الأزرق وقم بتغطيتها بغطاء. انتظر لمدة 2-3 دقائق وراقب تحت المجهر.
- احسب العدد الإجمالي للبروتوسكوليس الأحياء (غير الملوثة) والميتة (الملطخة باللون الأزرق) ، واحسب النسبة المئوية للكتل الأولية القابلة للحياة (الشكل 2D والداخلية).
ملاحظة: يجب أن تكون صلاحية الكتل الأولية حوالي 98٪ قبل إنشاء الثقافات. يجب ألا يتجاوز وقت التلوين 10 دقائق ، حيث قد تؤدي الفترات الأطول إلى تلطيخ الطفيليات الحية.
- قم بالشفط بإبرة 21 جم وجزء من حقنة 10 مل من السائل العداري من الرئة أو الكبد للماشية المصابة لتقليل تورم الكيس (الشكل 2 أ).
- E. الحبيبات metacestodes الابتذار
- إنتاج مرض العدارية الثانوي التجريبي عن طريق إصابة إناث الفئران CF1 داخل الصفاق (وزن الجسم 25 ± 5 جم) مع 1500 بروتوسكوليسيس (ما يعادل 10 ميكرولتر من بيليه protocolex) معلقة في 0.5 مل من PBS المكملة (الشكل 2 ه).
ملاحظة: يوصى بالحفاظ على البروتوسكوليات في PBS المكملة بالمضادات الحيوية عند 4 درجات مئوية لمدة 24 ساعة أو في المزرعة لمدة 3-5 أيام قبل الإصابة. - تتطور القشايل في غضون 4-6 أشهر بعد الإصابة (الشكل 2F). خلال هذه الفترة ، قم بإيواء في ظروف معملية خاضعة للرقابة (درجة الحرارة 20 ± 1 درجة مئوية ، 12 ساعة دورة الضوء / الظلام ، والماء والغذاء المتاح للحراسة). بمجرد تطور الخراجات ، قم بتخدير الفئران باستخدام الكيتامين - زيلازين (50 مجم / كجم / فأر - 5 مجم / كجم / فأر) وقم بالقتل الرحيم عن طريق خلع عنق الرحم.
- نظف السطح البطني للفأر بنسبة 70٪ كحول وافتح التجويف البريتوني جراحيا لإزالة النقائل المطورة باستخدام المقص والملقط.
- انقل كتل metacestodes إلى طبق بتري معقم.
ملاحظة: تتكون كتل metacetode من أكياس داخلية متعددة محاطة بنسيج ضام. - حرر الخراجات من كتل النقيق عن طريق إزالة النسيج الضام الذي يغطي المشابك بعناية باستخدام ملقط إذا لزم الأمر.
ملاحظة: تضمن هذه الخطوة خلو الطفيليات من الأنسجة المضيفة. - اغسل النقائل التي تم الحصول عليها ب PBS المكملة عند 4 درجات مئوية (الشكل 2G).
- إنتاج مرض العدارية الثانوي التجريبي عن طريق إصابة إناث الفئران CF1 داخل الصفاق (وزن الجسم 25 ± 5 جم) مع 1500 بروتوسكوليسيس (ما يعادل 10 ميكرولتر من بيليه protocolex) معلقة في 0.5 مل من PBS المكملة (الشكل 2 ه).
- E. الحبيبات البروتوسكوليسيس وزراعة metacestodes
- قم بإعداد وسط الاستزراع على النحو التالي: أضف 100 ميكروغرام / مل من البنسلين ، و 100 ميكروغرام / مل من الستربتومايسين ، و 100 ميكروغرام / مل من الجنتاميسين ، و 4 مجم / مل من الجلوكوز ، و 50 ملي مولار من الرقم الهيدروجيني 7.5 ، ومتوسط 199 للوصول إلى الحجم النهائي المطلوب واخلطه برفق عن طريق الانعكاس.
- انقل 5 مل من وسط الاستزراع المحضر إلى كل أنبوب لايتون (الشكل 2H-I).
- أضف الطفيليات إلى وسط الاستزراع واحتضانها عند 37 درجة مئوية لمدة 5 أيام دون تغيير الوسط. احتضان أنابيب لايتون بزاوية 15 درجة لضمان التوزيع المتساوي للمادة البيولوجية عبر السطح المسطح. هذا يزيد من تعرض الطفيليات لوسط الثقافة مع منع ملامسة السدادة المطاطية.
ملاحظة: أضف 9,000-10,000 بروتوسكوليس أو 50 قميلا (بأقطار تتراوح بين 5 مم و 15 مم موزعة على شكل 10 أكياس لكل أنبوب). - اختياريا ، أضف 20 ميكرومتر لوبيراميد (تركيز شبه مميت) مذاب في ثنائي ميثيل سلفوكسيد لمدة 16-24 ساعة في وسط زراعة الطفيليات لزيادة مستوى الكالسيوم العصاري الخلوي وتعزيز إطلاق EV في مرحلة اليرقات من بكتريا حبيبية.
ملاحظة: بالنظر إلى أن الزيادة في تركيزات الكالسيوم داخل الخلايا تعزز إنتاج EV ، فإن معالجة الطفيلي بالمركبات التي تؤثر على توازن الكالسيوم سيزيد من إطلاق EV.
2. تنقية الحويصلات خارج الخلية
- اجمع وسط زراعة الطفيليات من كل أنبوب لايتون وانقله إلى أنبوب مخروطي سعة 15 مل.
ملاحظة: يمكن تخزين وسط الاستزراع لمدة 24 ساعة قبل الطرد المركزي الأول مع الحد الأدنى من التأثير على تركيز أو توزيع حجم الحويصلات. يمكن غسل البروتوسكوليسات ثلاث مرات باستخدام المخزن المؤقت PBS ، وحصادها ، وتخزينها عند -20 درجة مئوية في أنابيب سعة 1.5 مل. - جهاز طرد مركزي عند 300 × جم لمدة 10 دقائق عند 4 درجات مئوية ونقل المادة الطافية إلى أنبوب مخروطي جديد سعة 15 مل باستخدام ماصة.
ملاحظة: هذه الخطوة تزيل الأوليات الميتة. بعد كل خطوة من خطوات الطرد المركزي ، تأكد من بقاء ما لا يقل عن 0.5 سم من المادة الطافية فوق الحبيبات لتجنب التلوث. - قم بجهاز الطرد المركزي للطافي عند 2,000 × جم لمدة 10 دقائق عند 4 درجات مئوية ونقله إلى أنابيب جديدة سعة 1.5 مل باستخدام ماصة.
ملاحظة: تزيل هذه الخطوة حطام الخلايا الأكبر. - جهاز طرد مركزي عند 10,000 × جم لمدة 30 دقيقة عند 4 درجات مئوية لإزالة حطام الخلايا الأصغر.
- انقل المادة الطافية إلى أنبوب مناسب لدوار الطرد المركزي الفائق باستخدام ماصة. ضع علامة على جانب واحد من كل أنبوب بعلامة قبل وضعه في دوار الطرد المركزي الفائق. ثم ضع الأنبوب في الدوار بحيث يكون الجانب المحدد متجها لأعلى.
ملاحظة: تعمل العلامة كنقطة مرجعية لتحديد موقع الحبيبات بعد الطرد المركزي الفائق. يجب أن تكون الأنابيب ممتلئة ومتوازنة بدقة ثلاثة أرباع ؛ لذلك ، إذا لزم الأمر ، أضف PBS. إذا تجاوز حجم المادة الطافية سعة أنبوب واحد ، فقم بتقسيم العينات إلى أنابيب متعددة ودمجها أثناء إعادة التعليق. - جهاز طرد مركزي عند 100,000 × جم لمدة ساعة واحدة عند 4 درجات مئوية وصب المادة الطافية في إجراء سريع. اترك الأنبوب يرتاح رأسا على عقب لمدة 1 دقيقة. قد لا تكون الحبيبات مرئية في هذه المرحلة.
ملاحظة: عامل k للدوار المستخدم هو 103. - اغسل الحبيبات بما لا يقل عن 3 مل من PBS لإزالة البروتينات الملوثة. أعد تعليق الحبيبات عن طريق سحب العينة لأعلى ولأسفل عدة مرات من الجانب العلوي من الأنبوب إلى الأسفل على جميع وجوه الأنبوب ولكن بشكل أساسي على الجانب المحدد حيث من المتوقع أن تكون الحبيبات.
ملاحظة: إذا كان ذلك ممكنا ، قم بتجميع الحبيبات المعلقة المشتقة من نفس المادة الطافية في أنبوب واحد. - جهاز طرد مركزي عند 100,000 × جم لمدة ساعة واحدة عند 4 درجات مئوية وصب المادة الطافية في إجراء سريع. اترك الأنبوب يرتاح رأسا على عقب لمدة 1 دقيقة.
ملاحظة: عامل k للدوار المستخدم هو 103. - أعد تعليق الحبيبات في 30 ميكرولتر من PBS باتباع العملية الموضحة في الخطوة 2.7.
ملاحظة: في هذه المرحلة ، يوصى بقياس إجمالي تركيز البروتين في الحبيبات المعلقة لتقدير كمية المركبات الكهربائية المفرزة. يمكن تحديد تركيز البروتين عن طريق قياس الامتصاص عند 280 نانومتر باستخدام مقياس الطيف الضوئي الصغير. - انقل العينة إلى أنبوب سعة 1.5 مل. قم بتجميد الحويصلات خارج الخلية عند -80 درجة مئوية.
ملاحظة: للحفاظ على سلامة الحويصلة للتطبيقات النهائية ، قم بتجميد الحبيبات المعلقة في أسرع وقت ممكن وتجنب دورات التجميد والذوبان المتكررة.
3. توصيف الحويصلات المعزولة
- تحديد حجم EV باستخدام تشتت الضوء الديناميكي (DLS)
ملاحظة: تشتت الضوء الديناميكي هو طريقة موثوقة وحساسة لتقييم الحجم (بناء على نصف القطر الهيدروديناميكي ، Rh) وشكل الجسيمات النانوية في السوائل المعقدة ، بغض النظر عن نوعها. تم إجراء قياسات جهد DLS و zeta باستخدام شعاع ليزر أحادي اللون He-Ne عند 633 نانومتر. إذا لم يكن التحليل ممكنا في يوم أخذ العينات ، فقد يتم تجميد العينات في مخزن مؤقت مصفيا مسبقا قبل التخزين.- قم بإذابة العينات واحتفظ بها على الجليد حتى يتم أخذ القياسات.
ملاحظة: قد يؤثر تجميد العينات على توزيع الجسيمات وسلامة المركبات الكهربائية الكهربائية. لذلك ، تجنب دورات التجميد والذوبان ، لأنها يمكن أن تؤدي إلى انخفاض في إشارة LS مع انخفاض ارتفاعات الذروة. - قم بتصفية العينات المائية المستخدمة في DLS من خلال مرشح بحجم المسام 0.2 ميكرومتر.
ملاحظة: في تجارب LS ، من الضروري تصفية جميع المحاليل والمخازن المؤقتة والعينات المائية لإزالة الجسيمات الكبيرة والغبار ، والتي يمكن أن تتداخل مع القياسات. - قم بتخفيف العينات من 1:10 إلى 1:50 في PBS المصفى مسبقا.
- امزج العينات عن طريق الانعكاس اللطيف قبل كل قياس لمنع الترسيب ، حيث يمكن أن تنخفض شدة LS بسبب وقت معالجة العينة الأطول.
- أضف 1 مل من العينة إلى كوفيت نظيف ، مع وضع الجانب غير المتجمد في مسار الليزر على اليسار في الجهاز. أغلق الغطاء واتركه لمدة 2-3 دقائق للتوازن قبل قياس العينة.
- قم بقياس الحجم من حيث نصف القطر الهيدروديناميكي (Rh) قبل إجراء قياس جهد زيتا. تسجيل القياسات بزاوية تشتت واحدة (θ = 90 درجة إلى 150 درجة) عند 25 درجة مئوية ± 1 درجة مئوية.
- انقر فوق لوحة التحكم للتحقق من القراءات والبدء في الحصول على البيانات.
ملاحظة: بناء على متوسط قيم Rh وتوزيعات الحجم المقدرة للمركبات الكهربائية ، يجب ملاحظة ذروة بين 30 نانومتر و 200 نانومتر (الشكل 3). تعزى القمم التي تقل عن 15 نانومتر في Rh إلى الأحماض النووية والبروتينات المعلقة. عادة ، يتم حساب توزيعات الحجم من متوسط نصف القطر الهيدروديناميكي. ومع ذلك ، يمكن أيضا الإبلاغ عن متوسط Z (متوسط حجم الجسيمات في العينة) ، ومؤشر التشتت المتعدد (PDI ، الذي يحدد عدم تجانس حجم العينة) ، والتبعية الزاوية لشدة الضوء المتناثرة.
- قم بإذابة العينات واحتفظ بها على الجليد حتى يتم أخذ القياسات.
- تحديد الهيكل وحجم الجسيمات عن طريق المجهر الإلكتروني الناقل (TEM)
ملاحظة: قم بإجراء فحص مجهري إلكتروني لإرسال البقع السلبية لتقييم حجم وهيكل ونقاء sevs ، باستخدام بروتوكول قياسي يتضمن التثبيت والجفاف وتضمين الراتنج والتباين لمستحضرات sEV المثبتة بالكامل.- قم بإذابة عينات sEV المركزة من الخطوة 2.10 واحتفظ بها على الجليد.
- قم بإصلاح sEVs في أنابيب سعة 1.5 مل. ضع بعناية 5-10 ميكرولتر من 2.5٪ جلوتارالديهايد في محلول كاكوديلات الصوديوم 0.1 M (الرقم الهيدروجيني 7) إلى ~ 5 ميكرولتر من حبيبات عينة sEV (تركيز sEV المطلوب ≈ 1 × 108-1 ×10 9 مل -1) واحتضانه لمدة ساعتين عند 4 درجات مئوية.
ملاحظة: يمكن تخزين sEVs لمدة تصل إلى أسبوع واحد عند 4 درجات مئوية في محلول كاكوديلات الصوديوم 0.1 M قبل مزيد من المعالجة. لذلك ، إذا كانت هناك حاجة إلى خدمات فنية خارجية لتحليل TEM ، فأرسل عينات sEV الثابتة المبردة في أنابيب سعة 1.5 مل. - قم بإيداع 5 ميكرولتر من الكريات المعلقة على شبكات نحاسية EM مطلية بالكربون فورمفار 300 شبكة. قم بإعداد شبكتين أو ثلاث شبكات لكل عينة.
- اسمح للعينة بالامتصاص لمدة 20 دقيقة في بيئة جافة وإزالة العينة الزائدة من الشبكة باستخدام ورق الترشيح.
- ضع 100 ميكرولتر قطرات من PBS على ورقة من الفيلم. باستخدام ملقط نظيف ، انقل الشبكات (مع جانب العينة الممتزة لأسفل) إلى قطرات PBS للغسيل.
- جفف الجانب الآخر من العينة الممتصة ، مع التأكد من عدم جفاف جانب العينة من الشبكات خلال أي من الخطوات التالية.
ملاحظة: بالنسبة لجميع الخطوات اللاحقة ، ضع قطرات من الكواشف على فيلم مسطح وانقل الشبكات إلى القطرات باستخدام الملقط. - انقل الشبكات إلى قطرة 50 ميكرولتر من 1٪ جلوتارالديهايد لمدة 5 دقائق.
- اغسل الشبكات بقطرة 100 ميكرولتر من الماء المقطر واتركها تقف لمدة 3 دقائق. كرر تسع مرات ليصبح المجموع عشر غسلات.
- قارن شبكات العينة بانخفاض 50 ميكرولتر بنسبة 1٪ وزن / حجم محلول أسيتات اليورانيل ، درجة الحموضة 7 ، لمدة دقيقة واحدة.
- قارن وقم بتضمين الشبكات في خليط من 100 ميكرولتر من أسيتات اليورانيل 4٪ و 900 ميكرولتر من 2٪ ميثيل السليلوز.
- جفف الشبكات بالهواء لمدة 5-10 دقائق أثناء بقائها في الحلقة ، وراقبها بمجهر إلكتروني عند 80-100 كيلو فولت بدقة 0.2 نانومتر وتكبير 100,000 ضعف.
- قم بتخزين الشبكات في صناديق تخزين جافة للتخزين طويل الأجل.
4. توليد الخلايا الشجيرية المشتقة من نخاع العظام
ملاحظة: يجب تنفيذ هذا الإجراء باستخدام الفئران الصغيرة ، والتي تتميز بأنظمة مكونة للدم قوية ذات قدرات التكاثر والتمايز النشطة. في المقابل ، تظهر الفئران الأكبر سنا انخفاضا في وظيفة المكونة للدم ، وانخفاض احتياطيات الخلايا الجذعية ، وتغير التفاعلات المتخصصة ، وخزان ذاكرة أكثر تطورا وهو أمر بالغ الأهمية للمناعة طويلة المدى والاستجابة لمسببات الأمراض أو التغيرات المرتبطة بالعمر مثل الشيخوخة المناعية.
- قتل أنثى فأر CF-1 تبلغ من العمر 5-8 أسابيع وفقا للإرشادات الأخلاقية المؤسسية ، مما يقلل من معاناة.
- رش الفأر بالإيثانول قبل وضعه في غطاء مزرعة الأنسجة.
ملاحظة: يجب تنفيذ الخطوات التالية في ظل ظروف معقمة. - ضع الماوس على لوح تشريح في وضع الاستلقاء. باستخدام الملقط ومقص التشريح ، قم بعمل شق عمودي "T" فوق مجرى البول ومديده أفقيا إلى أعلى الأطراف السفلية ، مع الحرص على عدم كسر الصفاق أو ثقب أي أعضاء ، وخاصة الأمعاء.
- افصل الجلد على طول كلا الطرفين الخلفيين لكشف عظام الساق والأنسجة باستخدام الملقط. باستخدام اليدين ، قم بإزالة جلد كل ساق تدفع من الكاحل باتجاه البطن ، واسحب الجلد إلى الجانب الآخر. ستكون كلتا الساقين بعد ذلك خالية من الجلد.
ملاحظة: تخلص من جسم الماوس في كيس بقايا مسببات الأمراض. - باستخدام المقص والملقط ، قم بإزالة عظم الفخذ والساق بعناية ، وتجنب الكسر. اربط طرف كل عظم بالملقط وقطع الأوتار لإزالة اللفافات العضلية حول العظام. تنظيف كامل الأنسجة العضلية بالمناديل الورقية.
- عند إزالة كل عظمة ، ضعها في أنبوب معقم سعة 50 مل يحتوي على 2 مل من الوسط الكامل المحضر بوسط RPMI مكمل بنسبة 5٪ FBS و 100 وحدة / مل بنسلين و 100 وحدة / مل من الستربتومايسين و 10 ميكروغرام / مل جنتاميسين لإزالة الحطام. بعد ذلك ، قم بالشفط والتخلص من وسط المزرعة وغسل العظام مرتين باستخدام 70٪ إيثانول لمدة 5 دقائق.
- انقل العظام إلى طبق بتري معقم.
- اقطع المشاشية العظمية باستخدام مقص تشريح حاد للوصول إلى خلايا نخاع العظام.
- اغسل خلايا نخاع العظم بعناية من كل عظمة من العظام الأربعة في طبق بتري معقم باستخدام إبرة 25 جم متصلة بحقنة سعة 20 مل تحتوي على وسط كامل. ستصبح العظام أكثر شفافية عند استخراج نخاع العظم.
ملاحظة: يجب أن يكون حجم 20 مل من الوسط الكامل كافيا لإزالة خلايا نخاع العظم من عظمي الفخذ والظنبوب. - قم بتجانس الوسط برفق مع النخاع المملوطة عن طريق سحب العينة لإزالة الأنسجة الضامة العظمية وكتل الخلايا. بعد ذلك ، انقل العينة إلى أنبوب مخروطي معقم سعة 50 مل ، وقم بتمرير الخلايا عبر مصفاة خلايا بولي بروبلين معقمة 70 ميكرومتر لإزالة النسيج الضام وبقايا العظام.
- الطرد المركزي للخلايا عند 450 × جم لمدة 7 دقائق عند 4 درجات مئوية. قم بإزالة المادة الطافية والتخلص منها بعناية ، مع التأكد من بقاء الحبيبات ملتصقة بجدار الأنبوب.
- احتضان الخلايا لمدة دقيقة واحدة في درجة حرارة الغرفة (RT) ، ثم أعد تعليقها في 500 ميكرولتر من محلول تحلل خلايا الدم الحمراء (RBC). قم بتحييد المخزن المؤقت للتحلل بإضافة 3 مل من الوسط الكامل.
- الطرد المركزي للخلايا عند 450 × جم لمدة 7 دقائق عند 4 درجات مئوية. تخلص من المادة الطافية وأعد تعليق الحبيبات في 5 مل من الوسط الكامل.
- مرر معلق الخلية من خلال مصفاة خلية بولي بروبلين معقمة 70 ميكرومتر إلى أنبوب مخروطي معقم سعة 50 مل لإزالة مجاميع الخلايا من كريات الدم الحمراء المحللة.
- عد الخلايا باستخدام مقياس كثافة الدم.
- أضف 300 نانوغرام / مل من التيروزين كيناز 3 ليجند المرتبط بالفئران المؤتلف FMS (Flt3L) إلى وسط الاستزراع.
- ضع الخلايا بتركيز 1 × 106 خلايا / مل في صفيحة متعددة الآبار.
- احتضان الخلايا لمدة 7 أيام عند 37 درجة مئوية في جو مرطب مع 5٪ ثاني أكسيد الكربون2.
ملاحظة: تجنب هز الخلايا أثناء تمايزها ونموها لمنع النضج التلقائي. - في اليوم 3 ، قم بإزالة 1 مل من الوسط من كل بئر (تجنب اضطراب الخلايا) واستبدله ب 1 مل من الوسط الكامل الطازج المسخن مسبقا مع 150 نانوغرام / مل من الفئران المؤتلف Flt3L.
5. التفاعل بين الخلايا المتغصنة المشتقة من نخاع العظام والحويصلات خارج الخلية من بكتريا حبيبية
- تلطيخ غشاء الحويصلة خارج الخلية
- قم بإذابة المركبات الكهربائية المخزنة في الخطوة 2.10 واحتفظ بها على الجليد.
- أعد تعليق 10 ميكرولتر من مركبات المركبات الكهربائية المنقاة في 10 ميكرولتر من مركبة وضع العلامات (المخفف C).
- أضف 20 ميكرولتر من محلول صبغة 2x PKH26 لتحقيق تركيز نهائي يبلغ 2 ميكرومتر. امزج برفق باستخدام ماصة واحتضنه لمدة 35 دقيقة عند 37 درجة مئوية في الظلام.
ملاحظة: يجب تحضير محلول الصبغة 2x PKH26 (4 ميكرومتر) مباشرة قبل التلوين عن طريق إضافة 0.5 ميكرولتر من محلول الصبغة الإيثانولي PKH26 إلى 125 ميكرولتر من المخفف C. - تخلط برفق كل 3-5 دقائق أثناء الحضانة لضمان تلطيخ متجانس.
- أضف 40 ميكرولتر من BSA 1٪ واحتضن لمدة 10 دقائق في RT لإيقاف عملية التلوين.
- اغسل مركبات الدفع الكهربائي ب 1 مل من PBS وأجهزة الطرد المركزي عند 100,000 × جم لمدة ساعة واحدة عند 4 درجات مئوية لإزالة الصبغة الزائدة.
ملاحظة: عامل k للدوار هو 103. - أعد تعليق الحبيبات في 90 ميكرولتر من PBS باتباع البروتوكول الموضح في الخطوة 2.7.
- تحفيز الخلايا المتغصنة المشتقة من نخاع عظم الفئران مع حويصلات خارج الخلية من بكتريا حبيبية
- حصاد الخلايا المتغصنة المشتقة من نخاع العظام (BMDCs) من لوحة الاستزراع جيدا ونقلها إلى أنابيب سعة 1.5 مل.
ملاحظة: تعامل بعناية لتجنب نضوج الخلايا التلقائي. - جهاز الطرد المركزي الوسط عند 450 × جم لمدة 5 دقائق لحبيبات الخلايا.
ملاحظة: احتفظ بالمواد الطافية من الطرد المركزي لإعادة طلاء الخلايا في خطوات تحليل قياس التدفق الخلوي اللاحقة. - قم بتعليق BMDCs في 30 ميكرولتر من sevs غير الملوثة من الخطوة 2.10 لتحليل قياس التدفق الخلوي أو في 90 ميكرولتر من مركبات sev الملونة المحتوية على PBS من الخطوة 5.1.7. للفحص المجهري متحد البؤر. احتضن لمدة 30 دقيقة عند 37 درجة مئوية في جو مرطب مع 5٪ ثاني أكسيد الكربون2. امزج العينة برفق كل 10 دقائق.
ملاحظة: لضمان الاتصال الفعال بين BMDCs و sevs ، يجب إجراء أول 30 دقيقة من الحضانة بحجم صغير باستخدام أنابيب 1.5 مل. - للفحص المجهري متحد البؤر ، انقل الخلايا إلى غطاء زجاجي معالج باللون الأزرق من Alcian (قطر 12 مم) موضوعة في صفيحة 24 بئرا. احتضان لمدة 30 دقيقة إضافية عند 37 درجة مئوية في غرفة مرطبة مع 5٪ ثاني أكسيد الكربون2.
ملاحظة: يضفي العلاج الأزرق Alcian-شحنة موجبة على الغطاء ، مما يسهل التصاق أغشية البلازما سالبة الشحنة ل BMDCs.- لتحضير أغطية ، اغمرها في صبغة ألكيان زرقاء 8 GX مصفاة بنسبة 1٪ وقم بتسخينها في الميكروويف لمدة 1-2 دقيقة دون غليان. احتضنها في المحلول الساخن لمدة 10 دقائق ، مع لفها كل 2 إلى 3 دقائق.
- بعد ذلك ، اغسل الأغطية بالماء المقطر منزوع الأيونات لإزالة اللون الأزرق الألسي الزائد ، وجففها على مناشف ورقية. أخيرا ، قم بتعقيم أغطية الغطاء وتخزينها في ظروف معقمة حتى الاستخدام.
- لتحليل قياس التدفق الخلوي ، انقل BMDCs-sEVs مرة أخرى إلى نفس البئر الذي تم حصادها منه (انظر الخطوة 5.2.1) ، أضف المواد الطافية المحجوزة من الخطوة 5.2.2 واحتضن لمدة 18 ساعة عند 37 درجة مئوية في جو مرطب مع 5٪ ثاني أكسيدالكربون 2.
ملاحظة: اترك ما يقرب من 500 ميكرولتر من الوسط في البئر لمنع جفاف الخلايا المتبقية بعد التجميع. - استخدم الضوابط الإيجابية والسلبية لتقييم نضج BMDC. تحفيز الخلايا مع 100 نانوغرام / مل من عديدات السكاريد الدهون (LPS) لمدة 18 ساعة كتحكم إيجابي. للتحكم السلبي في الالتقام الخلوي ، احتضن BMDCs مع sEVs عند 4 درجات مئوية. أيضا ، قم بتضمين التحكم في الخلايا الشجيرية غير المحفزة.
- حصاد الخلايا المتغصنة المشتقة من نخاع العظام (BMDCs) من لوحة الاستزراع جيدا ونقلها إلى أنابيب سعة 1.5 مل.
- الفحص المجهري متحد البؤر للحويصلات خارج الخلية من E. granulosus تم التقاطها واستيعابها بواسطة الخلايا المتغصنة المشتقة من نخاع العظام.
- بمجرد اكتمال فترة الحضانة الموضحة في الخطوة 5.2.4 ، قم بشفط وتجاهل PBS من قسيمة الغطاء.
- قم بإصلاح BMDCs عن طريق إضافة 100 ميكرولتر من 4٪ بارافورمالدهيد (PFA) فوق الغطاء واحتضانه لمدة 10 دقائق في RT.
ملاحظة: تأكد من أن الحجم يحافظ على التوتر السطحي على الغطاء. - قم بالشفط والتخلص من PFA ، ثم اغسل الغطاء ثلاث مرات باستخدام PBS-BSA 2٪.
- أضف 100 ميكرولتر من PBS الذي يحتوي على جسم مضاد مضاد مضاد ل معقد التوافق النسيجي الكبير من الفئة II-FITC المخفف 1/100 واحتضانه لمدة 1 ساعة في RT في الظلام.
- قم بشفط محلول الأجسام المضادة والتخلص منه ، واغسل الغطاء ثلاث مرات باستخدام PBS-BSA 2٪.
- أضف 100 ميكرولتر من 50 نانوغرام / مل DAPI واحتضنه لمدة 30 دقيقة في درجة حرارة الغرفة في غرفة مبللة لمواجهة النوى.
- قم بشفط محلول الصبغة والتخلص منه وغسل الغطاء ثلاث مرات باستخدام PBS-BSA 2٪.
- قم بإزالة الغطاء باستخدام ملقط منحني ودقيق وجففه على منشفة ورقية للتخلص من السوائل الزائدة.
- قم بتركيب الغطاء متجها لأسفل على شريحة زجاجية باستخدام وسيط تثبيت مكون من كحول البولي فينيل والجلسرين. اتركه يجف لمدة ساعتين عند 37 درجة مئوية أو طوال الليل عند 4 درجات مئوية في الظلام.
- قم بإزالة أي فقاعات هواء بين زلة الغطاء والشريحة الزجاجية عن طريق الضغط برفق على الغطاء باستخدام الملقط.
- راقب العينات المركبة تحت مجهر متحد البؤر باستخدام هدف غمر الزيت 60x مع طول موجي للإثارة / الانبعاث يبلغ 485/538 نانومتر ل FITC ، و 358/461 نانومتر ل DAPI ، و 551/567 نانومتر ل PKH26.
- تقييم النمط الظاهري للخلايا التغصنية المشتقة من نخاع العظام المحفزة خارج الخلية عن طريق قياس التدفق الخلوي
- بعد فترة الحضانة الموضحة في الخطوة 5.2.5 ، قم بحصاد BMDCs عن طريق شطف الوسط لأعلى ولأسفل عدة مرات باستخدام ماصة.
- اجمع BMDCs المحتوية على الوسط وضعها في أنابيب سعة 1.5 مل.
- جهاز طرد مركزي عند 450 × جم لمدة 5 دقائق عند 4 درجات مئوية لحبيبات الخلايا.
ملاحظة: اختياريا، لتحليل إفراز السيتوكين، قم بإزالة المواد الطافية باستخدام ماصة، ونقلها إلى أنابيب جديدة سعة 1.5 مل، وتخزينها عند -20 درجة مئوية لمزيد من اختبارات المقايسة الممتزة المناعية المرتبطة بالإنزيم (ELISA). - أعد تعليق BMDCs في 100 ميكرولتر من PBS المحتوي على فلوريسين إيزوثيوسيانات (FITC) أو ألوفيكوسيانات (APC) أو mAbs المترافقة بفيكوريثرین موجهة إلى CD11c و CD40 و CD80 و CD86 و MHC من الفئة الأولى و معقد التوافق النسيجي الكبير من الفئة الثانية واحتضانها لمدة 15 دقيقة عند 4 درجات مئوية في الظلام.
- اغسل BMDCs باستخدام PBS وأجهزة الطرد المركزي عند 450 × جم لمدة 5 دقائق عند 4 درجات مئوية.
- قم بتعليق BMDCs في 500 ميكرولتر من 1٪ PFA لإصلاحها وتخزينها عند 4 درجات مئوية حتى الحصول عليها في مقياس التدفق الخلوي.
النتائج
يظهر في الشكل 1 مخطط انسيابي يلخص الخطوات الرئيسية للحفاظ على الثقافات النقية لمرحلة اليرقات بكتريا حبيبية ، وعزل وتوصيف sEVs ، وامتصاصها بواسطة الخلايا المتغصنة للفئران. لتحقيق إنتاج مرتفع من sev من E. granulosus protoscoleces و metacestodes ، تم استخدام طريقة زراعة في المختبر تم تطويرها مسبقا في المختبر لتعظيم البقاء على قيد الحياة والتوازن الأيضي للطفيلي المدروس (الشكل 2).

الشكل 1: نظرة عامة على الإجراءات التجريبية للحصول على E. granulosus sEVs و BMDCs. تمثيلات تخطيطية تصف الخطوات المتبعة في هذا البروتوكول من الحصول على المادة الطفيلية وزراعتها (الخطوة 1) ، والعزل (الخطوة 2) ، وتوصيف الطفيليات EVs (الخطوة 3) إلى توليد BMDCs (الخطوة 4) وتفاعلها مع E. granulosus sEVs (الخطوة 5). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
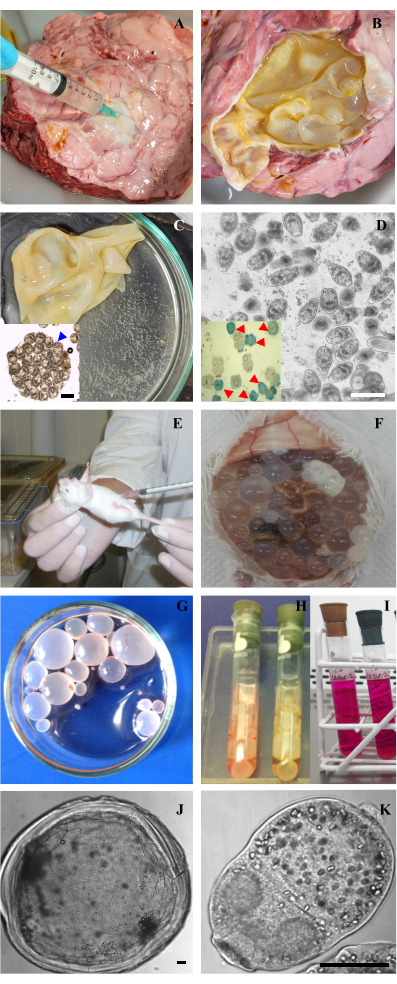
الشكل 2: الحصول على عينات وزراعة المخبرات من الجرجيرات الأولية والقائل من المشوكات الحبيبية. (أ) ثقب الكيس العداري الرئوي للماشية لاستخراج السائل العداري. (ب) فتح الكيس العداري مع غشاء مكشوف. (ج) الغشاء العداري وسائله الزجاجي مع كبسولات الحضنة والأوليات الحرة المسماة "الرمل العداري". داخلي: كبسولة حضنة مع بروتوسكول بالداخل مع مورفولوجيا محفوظة. (د) الفحص المجهري البصري للجرجيرات الأولية الحيوية بعد إزالة الأوليات الميتة. شريط 200 ميكرومتر. داخلي: تلطيخ الميثيلين الأزرق للبروتوسكول تظهر البروتوسكوليسيات الحية (شفافة) والبروتوسكوليسيات الميتة (ملطخة باللون الأزرق ، يشار إليها برؤوس سهام حمراء). (ه) تلقيح الجرمون الأولي في التجويف البريتوني لفأر CF-1. (و) تطورت القمامة داخل تجويف البطن بعد 7 أشهر من التلقيح بالمنظار الأولية. (ز) الخراجات المعزولة من الفأر وغسلها باستخدام PBS في طبق بتري. (ح ، أنا) الصيانة في المختبر للقائل والجربون الأولي في أنابيب لايتون مع وسط M199. (ي، ك) الفحص المجهري البصري للقميص وبروتوسكولكس من بكتريا حبيبية. تشير القضبان إلى 50 ميكرومتر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
توصيف المركبات الكهربائية المنقاة من E. حبيبية المرحلة اليرقية موضح في الشكل 3. كانت المركبات الكهربائية المعزولة باتباع البروتوكول الحالي عبارة عن مركبات كهربائية متنقلة بأقطار تتراوح من 50 إلى 200 نانومتر على النحو الذي حددته DLS (الشكل 3 أ) وأكده MET (الشكل 3 ب). كشف تحليل TEM أيضا أن sEVs أظهرت مورفولوجيا نموذجية على شكل كوب للحويصلات الشبيهة بالإكسوسوم (الشكل 3 ب). بالإضافة إلى ذلك ، أكد TEM أن تركيزات اللوبيراميد شبه المميتة يمكن أن تعمل كمحسن لإطلاق المركبات الكهربائية ، كما يتضح من زيادة نسبة sevs في العينات المعالجة باللوبيراميد مقارنة بالضوابط. وبالمثل ، فإن الوفرة العالية من sevs التي تم الحصول عليها من الطفيليات المعالجة باللوبيراميد كانت مدعومة بشكل أكبر من خلال قياسات تركيز البروتين (11 ± 1.5 ميكروغرام / ميكرولتر مقارنة ب 6 ± 1 ميكروغرام / ميكرولتر في الضوابط ، الشكل 3 ج).

الشكل 3: توصيف الحويصلات خارج الخلية المنقاة من E. حبيبية المرحلة اليرقاتية. (أ) مخطط تشتت الضوء الديناميكي (DLS) الذي يصور توزيع حجم المركبات الكهربائية المعزولة من البروتوسكوليسيات المعالجة باللوبيراميد (Lp) (PTS). (ب) صور الفحص المجهري الإلكتروني للإرسال (TEM) للمركبات الكهربائية الملطخة بشكل سلبي المنقاة من التحكم (أ) أو PTS المعالجة باللوبيراميد (د). تشير أشرطة المقياس إلى 50 نانومتر. تشير Arrowheds إلى حويصلات وفيرة تشبه الإكسوسوم مع هيكل نموذجي على شكل كوب. (B-C) و (E-F) يتوافق مع تضخيم المناطق المعلوقة من (أ) و (د) ، على التوالي. (ج) تركيز البروتين لحبيبات الطرد المركزي الفائق من سبعة فحوصات مستقلة. يتم تقديم البيانات كمتوسط ± SD. تشير العلامة النجمية إلى اختلافات كبيرة (Kruskal-Wallis مع اختبار دن اللاحق ، ص < 0.05). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
يوضح الشكل 4 تطور توليد BMDC من خلال ملاحظات الاختلافات في كمية وتشكل خلايا نخاع العظم من إنشاء الثقافة الأولية إلى التمايز الكامل. في اليوم 0 ، نمت الخلايا المكونة للدم في وسط كامل بكثافة 1× 106 خلايا / مل مكملة ب 300 نانوغرام / مل Flt3L ، وهو عامل سيتوكين ونمو ينشط أسلاف المكونة للدم للتكاثر والتمايز إلى مورفولوجيا الخلايا المتغصنة. في الأيام 1-2 ، كانت الخلايا لا تزال صغيرة ومستديرة الشكل دون تغييرات مورفولوجية كبيرة ، على الرغم من زيادة كميتها. بين الأيام 3-5 ، حدثت إعادة تشكيل الهيكل الخلوي النشط ، مما أدى إلى أشكال ممدودة غير متجانسة مع زيادة في الامتدادات السيتوبلازمية (التشعبات). في هذه المرحلة ، احتوت الثقافات على خلايا ملتصقة ذات امتدادات سيتوبلازمية واضحة ، وخلايا غير ملتصقة تخضع لتغيرات مورفولوجية أثناء تمايز الخلايا المتغصنة ، وخلايا كروية غير ملتصقة ظلت غير مستجيبة لتحريض السيتوكين (الشكل 4). بعد الأيام 6-7 ، تألفت 80٪ -90٪ من الثقافات بشكل أساسي من BMDCs ذات الحالة المستقرة والمتمايزة تماما. أظهرت هذه الخلايا شكلا نجميا مع عمليات سيتوبلازمية واسعة النطاق محسنة لالتقاط المستضد وعرضه. في اليوم السابع ، تم حصاد BMDCs لتحليل نمطها الظاهري وإجراء المقايسات الوظيفية.
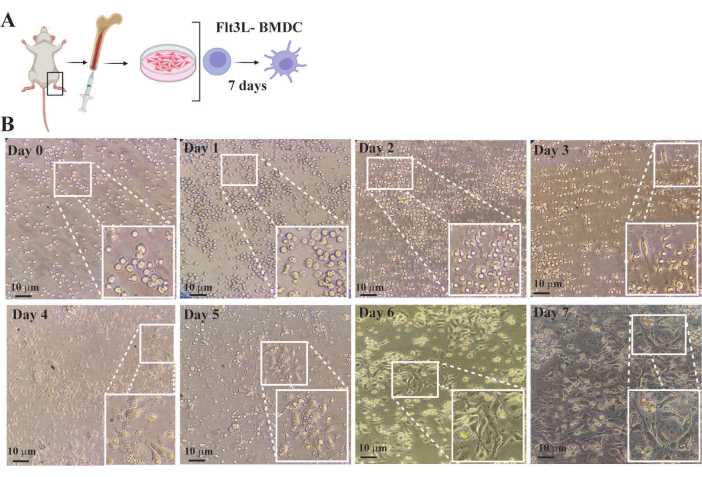
الشكل 4: مراقبة تمايز الخلايا المتغصنة المشتقة من نخاع العظام FTL3L باستخدام مجهر بصري مقلوب تقليدي. (أ) التمثيل التخطيطي لتنقية السلائف المكونة للدم من نخاع عظم الفأر وزراعة الخلايا في وسط كامل مكمل ب flt3L ب- صور لزراعة خلايا نخاع العظم التي تم الحصول عليها في نقاط زمنية مختلفة. الإدخالات هي مناطق مكبرة في المنطقة المعبأة من كل صورة. (ب) اليوم 0: صورة لخلايا المكونة للدم التي تم تنقيتها مؤخرا من نخاع العظام. لوحظ أنه على الرغم من أن السكان غير متجانسين ، إلا أن الغالبية عبارة عن خلايا ذات مورفولوجيا مستديرة وصغر الحجم. الأيام 1-5: صور الثقافة التي توضح الزيادة في عدد الخلايا والتغيرات في التشكل بسبب التكاثر النشط الناجم عن تنشيط مسار إشارات FLT3. ينتقل مورفولوجيا الخلية من مستدير إلى ممدود مع زيادة تدريجية في الامتدادات السيتوبلازمية (التشعبات). تكون هذه التغييرات أكثر وضوحا عندما تلتصق الخلايا بآبار لوحة الثقافة. الأيام 6-7: صور تظهر BMDCs متمايزة تماما في حالة مستقرة تتميز بشكل غير منتظم مع نواة بارزة والعديد من الإسقاطات المتفرعة الدقيقة ، السيتوبلازم حبيبي للغاية مع حويصلات تشارك في عرض المستضد والاستجابة المناعية. يمثل الشريط 10 ميكرومتر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
نظرا لأن الخلايا المتغصنة هي وسطاء أساسيين في تنشيط وتوجيه الاستجابة المناعية المستحثة ، فمن الأهمية بمكان إجراء تحليلات وظيفية لهذه الخلايا للكشف عن الأدوار المحتملة للمركبات الكهربائية المتغصنة في تفاعلات الطفيليات المضيفة. يؤكد البروتوكول المقدم هنا أن BMDCs تلتقط الطفيليات الكهربائي بعد حضانة لمدة ساعة واحدة عند 37 درجة مئوية. ومن المثير للاهتمام ، أن sEVs يبدو أنها موجودة في مقصورات ليزوزومية داخلية حيث يتم تخزين جزيئات MHCII المشكلة مسبقا حيث لوحظ أنها تتموضع (الشكل 5).
علاوة على ذلك ، تم تضمين BMDCs المحفزة بالصبغة بدون EVs كضوابط سلبية للتحقق من خصوصية وضع العلامات. لوحظ فقط التألق خارج الخلية غير المحدد و 3٪ -4٪ من الخلايا ذات إشارة الصبغة المنتشرة مقارنة بأكثر من 40٪ من الخلايا ذات العلامات الإيجابية المعرضة لمركبات الصبغة الملطخة.

الشكل 5: الفحص المجهري متحد البؤر المناعي الفلوري ل BMDCs الذي يظهر امتصاصا فعالا ل sevs المصنفة وتوظيف معقد التوافق النسيجي الكبير من الفئة الثانية في الجسيمات الداخلية. (أ) التمثيل التخطيطي للبروتوكول الموصوف في البند 5.3 الذي يوضح تحفيز sevs المسمى PKH26 في BMDCs. (ب) صورة متحد البؤر تظهر تحكما سلبيا في تحفيز PKH26 BMDCS دون وجود sEVs (أحمر ، PKH26) و (أزرق DAPI). لم يتم ملاحظة أي إشارات فلورية من الصبغة داخل الخلية بدون sevs. (ج) قنوات منفصلة للصور متحدة البؤر تظهر BMDCs المحفزة باستخدام مركبات القياس المتوافق مع المركبات الكهربائية الملونة: الفحص المجهري لتباين التداخل التفاضلي (DIC) ، DAPI (أزرق ، نوى) ، PKH26 (أحمر ، sEVs) و FITC (أخضر ، معقد التوافق النسيجي الكبير من الفئة الثانية). تمثل أشرطة المقياس 10 ميكرومتر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
تم توضيح سير عمل البروتوكول لزراعة الطفيليات ، وعزل sEVs المشتقة من الطفيليات ، وتمييز الخلايا المتغصنة عن نخاع العظام ، وتحليل امتصاص sEV بواسطة هذه الخلايا . وكان الهدف من ذلك هو الوصف المفصل لكل قسم من أقسام البروتوكول التي يمكن تنفيذها ككل أو على حدة، مع تسليط الضوء على الاعتبارات الرئيسية لضمان تنفيذ المنهجية. إن تحليل مجموعة المركبات الكهربائية التي تم الحصول عليها من الكائنات الطفيلية الكاملة له تأثير ملموس على دراسة العلاقة المتبادلة بين الطفيلي والمضيف ، وفي هذا السياق على وجه التحديد ، تم تحديد هذا البروتوكول التجريبي.
تم إعاقة الأفكار الجديدة حول الأمراض الطفيلية بسبب صعوبة زراعة بعض هذه الطفيليات في المختبر . نظرا لأن الديدان الطفيلية تفشل في إكمال دورات حياتها في ظل ظروف اصطناعية ، فلا يمكنها البقاء على قيد الحياة إلا في الثقافة ككائنات حية كاملة. لذلك ، فإن الحل الذي يقترحه هذا البروتوكول لدراسة واجهة الدودة والمضيف هو إجراء زراعة كل شكل طفيلي بشكل مستقل (دودة بالغة وأشكال يرقات مختلفة) لإثراء وعزل sevs ، ثم مواجهتها بخلايا الأعضاء المستهدفة أو خلايا الجهاز المناعي المضيف ، مما يسمح لها باستيعاب أو البلعمة ، على التوالي. بالإضافة إلى ذلك ، تتمثل إحدى الخطوات الحاسمة لإنشاء ثقافة الديدان الطفيلية لعزل المركبات الكهربائية في اختيار الطفيليات الحية بدقة لبدء الثقافة في المختبر وإبقائها في الحضانات في أقصر وقت ممكن للحد من موت الطفيليات وتوليد الأغشية المتبقيةالحرة 23. لجعله في E. granulosus ، تخضع البروتوسكوليسيات المستردة من الخراجات العدارية لغسيل مكثف باستخدام PBS البارد في أنابيب زجاجية صغيرة القطر. أثناء التشتت القوي باستخدام الماصة ، تتراكم الكتل الأولية الحية بسرعة. وبالتالي ، يتم فصلها عن البروتوسكوليسيات غير القابلة للحياة التي تظل معلقة لفترة أطول في العمود السائل للأنبوب ، مما يسمح بالتقاطها والتخلص منها من الخليط. تماشيا مع هذا الغرض ، خلال كل خطوة غسيل ، يضمن الخلط بقوة مع الماصة أيضا كسر كبسولات الحضنة وإطلاق البروتوسكوليك المحاصرين من داخلها ، وتحريرها من الغشاء المحيط. يتم إنشاء مزارع الطفيليات في أنابيب زجاجية من نوع لايتون لتجنب التصاق sEVs وبجزء مسطح لتمكين إنشاء مشتت لثقافة الطفيليات. في حالة النقائل التي تم الحصول عليها من التجويف البريتوني للفئران ، من الضروري فصل الطبقة العرضية التي تغطيها وإجراء عدة غسلات باستخدام PBS المكمل بالمضادات الحيوية لإزالة الخلايا المرتبطة والجراثيم المعوية ، والتي قد تؤثر على نقاء sevs المشتقة من الديدان الطفيلية نفسها كما هو موضح أيضا بواسطة White et al.23. يتم توصيل الأنابيب بسدادات مطاطية معقمة ، والتي تساهم في توليد جو يعاني من نقص الأكسجين المطلوب لمحاكاة التمثيل الغذائي المخمر الذي تحافظ عليه هذه الطفيليات في الجسم الحي. أخيرا ، يعتبر وسط M199 مناسبا جدا كوسيط صيانة لمرحلة يرقات السيستودا على المدى الطويل24،25. يحتوي الوسيط على الحد الأدنى من المكونات مثل الأملاح والجلوكوز والأحماض الأمينية الأساسية ، بالإضافة إلى أنه يحتوي على أحماض أمينية غير أساسية ، والكوليسترول ، والبيريميدين ، والفيتامينات القابلة للذوبان في الماء والدهون ، وسلائف الحمض النووي بما في ذلك الثيامين والريبوفلافين والبيوتين. كل هذه العناصر الغذائية تعزز الحفاظ على الوظائف العضوية الأساسية وصلاحية هذه الطفيليات. يستخدم M199 بشكل خاص للخلايا غير المحولة والأجنة والنباتات الأولية ومزارع الأعضاء ، كونه مثاليا لزراعة كتلةالخلايا 26. على وجه التحديد ، عند استخدامه كوسيط لثقافة الصيانة ، يجب تطبيق M199 بدون مكملات مصل الأبقار الجنينية لأنه يعزز انتفاع الجرجيرات الحويصلية وإزالة التمايز إلى الكيسات الدقيقة27،28.
يجب توثيق جميع الظروف المستخدمة في مزارع الطفيليات لضمان استنساخ النتائج التي تنطوي على التعافي وامتصاص الخلايا من sevs. على وجه الخصوص ، أحد الجوانب التي تؤثر على إنتاج EV هو إضافة المركبات التي تؤثر على توازن الكالسيوم إلى الثقافة لأنها تزيد من إفراز الخلايا المعتمد على الكالسيوم29،30. هنا ، إضافة لوبيراميد ، وهو محث كالسيوم داخل الخلايا في E. granulosus19،31 ، إلى مزارع الطفيليات لتعزيز إطلاق sev. تعمل هذه الطريقة على تحسين عدد الحويصلات في الديدان الخيطية (الشكل 3) ويمكن أن تكون استراتيجية جيدة لتحسين الإنتاج في الأنظمة الخلوية ذات الإطلاق المنخفض للمركبات الكهربائية. ومع ذلك ، نظرا لأن هذه الإستراتيجية ، مثل تعديلات الثقافة الفيزيائية أو الكيميائية الأخرى ، يمكن أن تغير خصائص ووظائف EV ، يجب مراعاة الاهتمام الدقيق عند إجراء تحليلات عالية الإنتاجية مثل البروتينات.
تسمح مزارع السيستود بتحقيق تركيزات EV من الأوامر ذات الحجم الكبير ، بالنظر إلى أن سطحها الخارجي عبارة عن طبقة سيتوبلازمية مخلوية تتكيف مع العمليات الرئيسية لإفراز الخلايا والالتقام الخلوي32. سيخضع حجم إعداد المركبات الكهربائية للمتطلبات التجريبية. ينتج ما مجموعه 9,000 بروتوسكوليسيس في المتوسط 30 ميكرولتر من sEVs بتركيز 1-2.5 ' 108 sEV / مل ، وهو ما يكفي لإجراء تحليل DLS و TEM و LC-MS-MS بالتوازي. يتمثل أحد قيود البروتوكول في الحصول على كمية عالية من الحويصلات من القشائيل بسبب وجود طبقتها الصفيحية ، مما يعيق إطلاق الحويصلات في الوسط. لذلك ، هناك حاجة إلى كميات كبيرة من الطفيليات (الخطوة 1.3.3)11. يتمثل النهج البديل أيضا في تحليل sevs من السائل العداري ، كما ورد في دراسات أخرى11،33،34،35،36.
تماشيا مع الاتجاه الأوسع الذي لوحظ في أبحاث المركبات الكهربائية ، استخدمت غالبية الدراسات التي أجريت على الديدان الطفيلية الكهربائية حتى الآن الطرد المركزي الفائق للمنتجات الإخراجية / الإفرازية كطريقة أساسية لعزل المركبات الكهربائية وفصلها37. في هذا البروتوكول ، تم استخدام الطرد المركزي الفائق لعزل المركبات الكهربائية ، والتي تعتبر الطريقة القياسية الذهبية لاستعادة المركبات الكهربائية ، على الرغم من أنها يمكن أن تنطوي على إدراج الملوثات بالاشتراك مع المركباتالكهربائية 15. أحد قيود هذه الطريقة هو إزالة الملوثات القابلة للذوبان. نظرا لأن sevs أكبر من الملوثات القابلة للذوبان ، فإن البديل لتحسين التنقية هو دمج خطوات إضافية ، مثل استخدام كروماتوغرافيا استبعاد الحجم (SEC) 38،39. ومع ذلك ، عندما يكون عزل المركبات الكهربائية مطلوبا للتحليلات الوظيفية ، مثل دراسة التواصل بين الطفيليات الطفيلية ومضيف الديدان الطفيلية ، فإن التحديد الدقيق لمجموعة المركبات الكهربائية ليس بنفس الأهمية ، حيث يحملون جميعا شحنات مستضدية. وبالتالي ، اعتمادا على النقاء المطلوب لمزيد من التجارب ، يمكن أن تنتهي عملية العزل عند الطرد المركزي الفائق ، كما يتم إجراؤه هنا ، أو يمكن دمجها مع طرق أخرى مثل الترشيح للتخلص من الملوثات الكبيرة أو الطرد المركزي المتدرج بكثافة السكروز أو اليوديكسانول أو كروماتوغرافيا استبعاد الحجم ، والتي لا تسمح فقط بتنظيف الملوثات ولكن أيضا بفصل مجموعات مختلفة من المركباتالكهربائية 37 ، 38،40. بغض النظر ، فإن الطريقة المستخدمة هنا بسيطة وتمثل الخيار الأساسي لحصاد وإثراء المركبات الكهربائية من الطفيليات39. إنه يوفر إنتاجية عالية من المركبات الكهربائية بتكلفة منخفضة نسبيا لأنه لا يتطلب سوى مختبر مجهز بجهاز طرد مركزي فائق يمكن فيه استخدام الأنابيب القابلة لإعادة الاستخدام.
يعد وصف ميزة المركبات الكهربائية المعزولة أمرا أساسيا لتحديد تركيز المركبات الكهربائية وحجمها وجودتها ونوعها الفرعي. بالإضافة إلى ذلك ، يتعاون تحليل تركيبة البروتين لتحديد المجموعات السكانية الفرعية للمركبات الكهربائية التي يتم إثرائها في العينة ، بالإضافة إلى تقدير وجود الملوثات المحتملة. يمكن إجراء توصيف EV بطرق مختلفة تتطلب في كثير من الأحيان معدات ومرافقمتخصصة 41. هنا ، تم تحليل حجم المركبات الكهربائية الطفيلية باستخدام DLS ، والتي توفر بيانات موثوقة في أنظمة التعليق أحادية التشتت ولكنها أقل دقة في أنظمة التعليق مع المركبات الكهربائية الموزعةعلى نطاق واسع 42. لذلك ، يمكن أن يكون البديل هو استخدام طرق أخرى مثل تحليل تتبع الجسيمات النانوية (NTA) ، الذي يحدد بدقة حجم الحويصلة وكميتها ، أو استشعار النبض المقاوم للضبط (TRPS) ، والذي يوفر نطاقا ديناميكيا أوسع من NTA ، أو مقياس التدفق الخلوي النانوي (NanFCM) الذي يمتلك حساسية أعلى من قياس التدفق الخلويالتقليدي 43،44،45. أيضا ، كجزء من الروتين التجريبي وتوصيات الخبراء ، تسمح تقنية TEM بتحديد نقاء ومحصول وحجم المركبات الكهربائية التي تم الحصول عليها بشكل متكامل ، بشكل أساسي في حصاد المركبات الكهربائية المرتفع46. بالإضافة إلى ذلك ، يوصى بالفحص بواسطة تحليل TEM بشكل خاص عندما لا يكون من الممكن تصور حبيبات EV للتحقق من تكوين المادة المستردة بعد الطرد المركزي الفائق.
تسلط هذه القضايا الضوء على أهمية استخدام تقنيات قوية لعزل المركبات الكهربائية المشتقة من الديدان الطفيلية وتوصيفها الشامل ، والتي يمكن أن تسهل تحديد علامات محددة لتتبع مصيرها ، وبالتالي تمكين تقييم أدوارها الوظيفية.
الحويصلات خارج الخلية المنقاة من E. حبيبية تمثل ناقلات نقل مستضد طبيعية مع العديد من البروتينات المستضدية المميزة وغير المعروفة9. يمكن لهذه sevs وحدها تحفيز الخلايا العارضة للمستضد الموزعة في جميع أنحاء الأنسجة المختلفة والأعضاء اللمفاوية الثانوية للمضيف. الخلايا المتغصنة هي خلايا احترافية فريدة من نوعها تقدم مستضد يمكنها عرض مستضدات للخلايا التائية الساذجة ، وتحديد نوع الاستجابة المناعية في الجسم الحي47،48.
تصف هذه المخطوطة بروتوكولا لتفصيل طريقة لتوليد الخلايا المتغصنة من مزارع نخاع عظم الفأر المقتبسة من بحث نشرسابقا 49. هنا ، يتم اقتراح طريقة راسخة للدراسات المناعية بناء على الثقافة المختبرية لفئران BMDCs التي يحركها Flt3L ، حيث يعد عزل نخاع العظم خطوة أساسية لتحقيق ثقافة ناجحة في المختبر 50. بالنظر إلى أن العديد من بروتوكولات العزل لخلايا نخاع العظم تنتج مجموعات خلايا غير متجانسة ، يجب تحليل مزارع BMDC عن طريق قياس التدفق الخلوي خلال المرة الأولى من تمايز Flt3L لإنشاء النمط الظاهري للخلية للتجارب المخطط لها51،52،53. يشير التوصيف الظاهري ل BMDC تحت تأثير Flt3L إلى أن الغالبية هي خلايا متغصنة تقليدية (CD11b + ، CD11c + ، CD172a +) ، والتي تشبه إلى حد كبير الخلايا المتغصنة الموجودة في الجسم الحي والتي تحمل مستضدات خارجية. في حين أن نسبة صغيرة من BMDC تتوافق مع الخلايا المتغصنة البلازمية (CD11c + B220 + SinglecH +) والخلايا المتغصنة الشبيهة ب CD8 + (CD11c + CD24 + و CD172a-) 11،53.
بعض الخطوات المقلقة الشائعة هي انخفاض إنتاجية BMDCs في الثقافة ، والتي قد تنتج عن كسر العظام أثناء التحضير ، أو استخراج نخاع العظم غير الفعال ، أو تكوين كتلة الخلايا ، أو ظروف الثقافة دون المستوى الأمثل (على سبيل المثال ، التركيب المتوسط ، درجة الحرارة) ، أو عدم كفاية تحفيز السيتوكين. لمعالجة هذه المشكلات ، تتمثل بعض البدائل في قطع المشاشية ، وضمان التنظيف الكامل لخلايا نخاع العظم من جانبي عظم الفخذ والظنبوب ، وتعليق نخاع العظم بشكل مرهق قبل المرور عبر مصفاة الخلية ، واستخدام السيتوكينات المحضرة حديثا بالتركيز الموصى به والحفاظ على العقم ، واستقرار الأس الهيدروجيني لوسط الثقافة.
من الضروري التأكد من حالة "راحة" خط الأساس للخلية المتغصنة قبل إحداث نضجها مع ملامسة المستضد. لا تتعرف الخلايا المتغصنة فقط على مجموعة واسعة من المستضدات الخارجية (PAMPs ، النمط الجزيئي المرتبط بممرضات الأمراض) والمستضدات الداخلية (DAMPs ، النمط الجزيئي المرتبط بالخطر) ولكن أيضا التغييرات الطفيفة في زراعة الخلايا (درجة الحموضة ، التحريض الخفيف ، كثافة الخلية) يمكن أن تحفز نضجها. لهذه الأسباب ، يجب تقليل حركات واهتزازات زراعة الخلايا أثناء المناولة في جهاز الطرد المركزي أو الحاضنة. علاوة على ذلك ، يجب أن تكون سحب العينات سلسة دون توليد فقاعات في الوسط. بالإضافة إلى ذلك ، فإن الحفاظ على الثقافات الأولية لأكثر من 8 أيام قد ينشط الخلايا المتغصنة ويعزز موت الخلايا. إلى جانب ذلك ، فإن كثافة الخلايا الأعلى من 2.5 × 106 تنتج تعبيرا أكبر ل MHCII54 وتزيد من النضج قبل ملامسة المستضد. أيضا ، يجب أن تكون جميع الكواشف المستخدمة خالية تماما من السموم الداخلية أو LPS ، نتيجة للتلوث السابق بالبكتيريا سالبة الجرام ، لأن LPS يحفز تحفيز أو استنفاد الخلايا المتغصنة23،55. للحفاظ على العقم أثناء التلاعب بمزارع نخاع العظام ، إلى جانب دمج استخدام المضادات الحيوية في الوسائط ، يجب استخدامه باستمرار 70٪ من رذاذ الإيثانول على السطح والأيدي التي ترتدي القفازات وأشياء الخزانة ، مما يحافظ على التلامس بين خلايا الإيثانول ونخاع العظام. قبل تعريض الأدوات للعظام أو الخلايا ، تأكد من تبخر الإيثانول وجففها في الهواء لأنه سام لخلايا نخاع العظام.
تعزز الخلايا المتغصنة نضوجها وإنتاج السيتوكين بعد التعرف على sEVs وتحريكها. E. حبيبات sEVs تحفز التعبير عن IL-12 ، لصالح ملف تعريف Th19. إذا كان نضوج النمط الظاهري للخلايا المتغصنة ناقصا ، فيجب تحسين وقت أو تركيز الحافز الذي تم تحقيقه باستخدام sEVs المضافة. الفحص المجهري متحد البؤر هو أداة قوية تستخدم لتصور استيعاب البضائع وتحديد الموقع مع جزيئات معقد التوافق النسيجي الكبير على الجسيمات الداخلية للخلايا المتغصنة. علاوة على ذلك ، بعد 8 ساعات على الأقل من امتصاص sEVs ، يمكن أيضا استخدام قياس التدفق الخلوي لقياس السيتوكينات داخل الخلايا والجزيئات السطحية مثل CD40 و CD80 و CD86 و MHCII في الخلايا المتغصنةالناضجة 11،13.
ستوفر الأبحاث المكثفة التي تستخدم مجموعة واسعة من التقنيات فهما أعمق لكيفية تداخل حجم الطفيليات EV ومنشأها وحمولتها مع استجابات المضيف وتعديلها.
Disclosures
ويعلن أصحاب البلاغ أنه ليس لديهم تضارب في المصالح.
Acknowledgements
يقر المؤلفون ب Lic. سيسيليا غوتيريز أيستا (Servicio de Microscopía Electrónica, CONICET, Bahía Blanca, Argentina) و Lic. ليوناردو سيتشي وليك. إليانا مازا (INIFTA ، جامعة لا بلاتا الوطنية ، الأرجنتين) للمساعدة الفنية في الفحص المجهري الإلكتروني للإرسال وتشتت الضوء الديناميكي ، على التوالي. نشكر أيضا درا. جراسييلا ساليرنو ، درا. كورينا بيرون والدكتور غونزالو كالو لاستخدام جهاز الطرد المركزي الفائق في INBIOTEC-CONICET-FIBA ، الأرجنتين. ويعترف المؤلفان بامتنان ليك. كيلي (SENASA، مار ديل بلاتا، الأرجنتين) وليك. H. Núnez García (CONICET ، Universidad Nacional de Mar del Plata ، الأرجنتين) لتعاونهم في تقييم رفاهية الفئران ، و Med. Vet. J. Reyno ، Med. Vet. S. Gonzalez ، و Med. Vet L. Netti لمساهمتهم في الحصول على المواد الطفيلية. تم دعم هذا العمل ، بما في ذلك تكاليف التجارب والكواشف والمعدات ، من قبل PICT 2020 رقم 1651 الممول من ANPCyT.
Materials
| Name | Company | Catalog Number | Comments |
| 1.5 mL tubes | Henso | N14059 | |
| 24-well plate | JetBiofil | CAP011024 | Polystyrene, flat bottom, Sterile |
| 6-well plate | Henso Medical Co. Ltd. | N14221 | Flat-shape bottom, PS material, Sterile |
| 70 mm polypropylene cell strainer | Biologix Group Limited | 15-1070 | Sterile |
| Alcian blue 8 GX dye | Santa Cruz | sc-214517B | |
| Automatic CO2 incubator | Nuarire | UN-5100E/G DH | |
| Bovine Serum Albumin | Wiener lab | 1443151 | |
| CD11c Monoclonal antibody-PECy5 100 µg | eBioscience | 15-0114-82 | clone (N418) |
| CD40 Monoclonal antibody-FITC 100 µg | eBioscience | 11-0402-82 | clone (HM40-3) |
| CD80 Monoclonal antibody-APC 100 µg | eBioscience | 17-0801-82 | clone (16-10A-1) |
| CD86 Monoclonal antibody-FITC 100 µg | eBioscience | 11-0862-82 | clone (GL-1) |
| Centrifuge | Thermo Scientific | IEC CL31R Multispeed | |
| Confocal Microscope | Nikon | Nikon Confocal Microscope C1 | |
| Conical tubes 15 mL dia.17 x 120 mm | Citotest | 4610-1865 | |
| DAPI | Sigma | 107K4034 | |
| D-Glucose | Merk | 1.78343 | |
| Dimethyl Sulfoxide | Anedra | 6646 | |
| Fetal Bovine Serum 500 mL | Sigma-Aldrich | 12352207 | |
| Flow Cytometry System | BD Biosciences | BD FACSCanto™ II | |
| Folded Capillary Zeta Cell | Malvern Panalytical | DTS1070 | |
| Gentamicin sulfate salt | Sigma | G1264 | |
| Glutaraldehyde solution | Fluka | 49630 | |
| Hepes | Gibco | 11344041 | |
| Hypodermic needle 21 G x 1"25/8 | Weigao | Sterile | |
| Hypodermic needle 25 G x 5/8" | Weigao | Sterile | |
| Inverted microscope | Leica | DMIL LED Fluo | |
| Ketamine | Holliday | ||
| Lipopolysaccharide 5 mg | Invitrogen | tlrl-rslps | LPS from the Gram-negative bacteria E. coli K12 . TLR2/4 Agonists |
| Loperamide hydrochloride | Sigma-Aldrich | 5.08162 | |
| Medium 199 | Gibco | 11150059 | |
| Methylene Blue | Anedra | 6337 | |
| MHC class I (H2kb) Monoclonal antibody-PE 100 µg | eBioscience | 12-5958-82 | clone (AF6-88.5.5.3) |
| MHC class II (IA/IE) Monoclonal antibody-FITC 100 µg | eBioscience | 11-5321-82 | clone (M5/114.15.2) |
| Microscope | Olympus | CX31 | |
| Mouse recombinant murine Flt3L. | PrepoTech | 250-31L-10UG | |
| Nanodrop | Thermo Scientific | ND-One | |
| Paraformaldehyde | Agar Scientific | R1018 | |
| Penicillin G sodium salt | Sigma | P3032-10MU | |
| PKH26 | Sigma-Aldrich | MINI26 | |
| Potassium Phosphate Monobasic | Timper | For Phosphate Buffered Saline (PBS) | |
| RBC lysis buffer 100 mL | Roche | 11814389001 | |
| RPMI medium 1640 1x 500 mL | Sigma-Aldrich (Gibco) | 11875093 | |
| Sodium Cacodylate | Sigma-Aldrich | C0250 | |
| Sodium Chloride | Anedra | 7647-14-5 | For Phosphate Buffered Saline (PBS) |
| Sodium Phosphate Dibasic (Anhydrous) p. a. | Biopack | 1639.07 | For Phosphate Buffered Saline (PBS) |
| Streptomycin sulfate salt | Sigma | S9137 | |
| Syringe 10 mL | Bremen | Sterile | |
| Thickwall polycarbonate tubes | Beckman Coulter | 13 x 55 mm , nominal capacity 4 mL | |
| Transmission Electron Microscope | Jeol | JEOL JSM 100CX II | |
| Ultracentrifuge | Beckman | Optima LE-80k | 90 Ti rotor |
| Xylazine | Richmond | ||
| Zetasizer Nano | Malvern | Nano ZSizer-ZEN3600 | To perform Dynamic Light scattering and zeta potential measurements |
References
- Wen, H., et al. Echinococcosis: advances in the 21st century. Clin Microbiol Rev. 32 (2), e00075-e00118 (2019).
- Geary, T. G., Thompson, D. P. Development of antiparasitic drugs in the 21st century. Vet Parasitol. 115 (2), 167-184 (2003).
- Drurey, C., Maizels, R. M. Helminth extracellular vesicles: Interactions with the host immune system. Mol Immunol. 137, 124-133 (2021).
- Welsh, J. A., et al. Minimal information for studies of extracellular vesicles (MISEV2023): From basic to advanced approaches. J. Extracell Vesicles. 13 (2), e12404 (2024).
- Cresswell, P. Antigen processing and presentation. Immunol Rev. 207, 5-7 (2005).
- Buzas, E. I. The roles of extracellular vesicles in the immune system. Nat Rev Immunol. 23 (4), 236-250 (2023).
- Bennett, A. P. S., de la Torre-Escudero, E., Oliver, N. A. M., Huson, K. M., Robinson, M. W. The cellular and molecular origins of extracellular vesicles released by the helminth pathogen Fasciola hepatica. Int J Parasitol. 50 (9), 671-683 (2020).
- Drurey, C., Coakley, G., Maizels, R. M. Extracellular vesicles: new targets for vaccines against helminth parasites. Int J Parasitol. 50 (9), 623-633 (2020).
- Nicolao, M. C., et al. Characterization of protein cargo of Echinococcus granulosus extracellular vesicles in drug response and its influence on immune response. Parasit Vectors. 16 (1), 255 (2023).
- Sánchez-López, C. M., Trelis, M., Bernal, D., Marcilla, A. Overview of the interaction of helminth extracellular vesicles with the host and their potential functions and biological applications. Mol Immunol. 134, 228-235 (2021).
- Nicolao, M. C., Rodriguez, R. C., Cumino, A. C. Extracellular vesicles from Echinococcus granulosus larval stage: Isolation, characterization and uptake by dendritic cells. PLoS Negl Trop Dis. 13 (1), e0007032 (2019).
- Kuipers, M. E., et al. DC-SIGN mediated internalisation of glycosylated extracellular vesicles from Schistosoma mansoni increases activation of monocyte-derived dendritic cells. J Extracell Vesicles. 9 (1), 1753420 (2020).
- Murphy, A., et al. Fasciola hepatica extracellular vesicles isolated from excretory-secretory products using a gravity flow method modulate dendritic cell phenotype and activity. PLoS Negl Trop Dis. 14 (9), e0008626 (2020).
- Ricciardi, A., et al. Extracellular vesicles released from the filarial parasite Brugia malayi downregulate the host mTOR pathway. PLoS Negl Trop Dis. 15 (1), e0008884 (2021).
- Zhang, Q., Jeppesen, D. K., Higginbotham, J. N., Franklin, J. L., Coffey, R. J. Comprehensive isolation of extracellular vesicles and nanoparticles. Nat Protoc. 18 (5), 1462-1487 (2023).
- Brezgin, S., et al. Basic guide for approaching drug delivery with extracellular vesicles. Int J Mol Sci. 25 (19), 10401 (2024).
- Pinheiro, A. A., et al. Potential of extracellular vesicles in the pathogenesis, diagnosis, and therapy for parasitic diseases. J Extracell Vesicles. 13 (8), e12496 (2024).
- Barnadas-Carceller, B., Del Portillo, H. A., Fernandez-Becerra, C. Extracellular vesicles as biomarkers in parasitic disease diagnosis. Curr Top Membr. 94, 187-223 (2024).
- Nicolao, M. C., Denegri, G. M., Carcamo, J. G., Cumino, A. C. P-glycoprotein expression and pharmacological modulation in larval stages of Echinococcus granulosus. Parasitol Int. 63 (1), 1-8 (2014).
- Nicolao, M. C., Cumino, A. C. Biochemical and molecular characterization of the calcineurin in Echinococcus granulosus larval stages. Acta Trop. 146, 141-151 (2015).
- Savina, A., Furlan, M., Vidal, M., Colombo, M. I. Exosome release is regulated by a calcium-dependent mechanism in K562 cells. J Biol Chem. 278 (22), 20083-20090 (2003).
- Ambattu, L. A., et al. High frequency acoustic cell stimulation promotes exosome generation regulated by a calcium-dependent mechanism. Commun Biol. 3 (1), 553 (2020).
- White, R., et al. Special considerations for studies of extracellular vesicles from parasitic helminths: A community-led roadmap to increase rigour and reproducibility. J Extracell Vesicles. 12 (1), e12298 (2023).
- Casado, N., Rodriguez-Caabeiro, F., Hernandez, S. In vitro survival of Echinococcus granulosus protoscolices in several media, at +4 degrees C and +37 degrees C. Z Parasitenkd. 72 (2), 273-278 (1986).
- Casado, N., Rodriguez-Caabeiro, F., Jiménez, A., Criado, A., de Armas, C. In vitro effects of levamisole and ivermectin against Echinococcus granulosus protoscoleces. Int J Parasitol. 19 (8), 945-947 (1989).
- Al-Lamki, R. S., Bradley, J. R., Pober, J. S. Human organ culture: updating the approach to bridge the gap from in vitro to in vivo in inflammation, cancer, and stem cell biology. Front Med. 4, 148 (2017).
- Rodriguez-Caabeiro, F., Casado, N. Evidence of in vitro germinal layer development in Echinococcus granulosus cysts. Parasitol Res. 74 (6), 558-562 (1988).
- Loos, J. A., Cumino, A. C. In vitro anti-echinococcal and metabolic effects of metformin involve activation of AMP-activated protein kinase in larval stages of Echinococcus granulosus. PLoS One. 10 (5), e0126009 (2015).
- Erwin, N., Serafim, M. F., He, M. Enhancing the cellular production of extracellular vesicles for developing therapeutic applications. Phar. Res. 40 (4), 833-853 (2023).
- Sako, Y., et al. Identification of a novel small molecule that enhances the release of extracellular vesicles with immunostimulatory potency via induction of calcium influx. ACS Chem Biol. 18 (4), 982-993 (2023).
- He, L. P., Mears, D., Atwater, I., Rojas, E., Cleemann, L. Loperamide mobilizes intracellular Ca2+ stores in insulin-secreting HIT-T15 cells. Br J Pharmacol. 139 (2), 351-361 (2003).
- Dalton, J. P., Skelly, P., Halton, D. W. Role of the tegument and gut in nutrient uptake by parasitic platyhelminths. Can J Zool. 82 (2), 211-232 (2004).
- Dos Santos, G. B., et al. Excretory/secretory products in the Echinococcus granulosus metacestode: is the intermediate host complacent with infection caused by the larval form of the parasite. Int J Parasitol. 46 (13-14), 843-856 (2016).
- Siles-Lucas, M., et al. Isolation and characterization of exosomes derived from fertile sheep hydatid cysts. Vet Parasitol. 236, 22-22 (2017).
- Yang, J., et al. Identification of different extracellular vesicles in the hydatid fluid of Echinococcus granulosus and immunomodulatory effects of 110 K EVs on sheep PBMCs. Front Immunol. 12, 602717 (2021).
- Khosravi, M., et al. Characterisation of extracellular vesicles isolated from hydatid cyst fluid and evaluation of immunomodulatory effects on human monocytes. J Cell Mol Med. 27 (17), 2614-2625 (2023).
- Sotillo, J., et al. The protein and microRNA cargo of extracellular vesicles from parasitic helminths–current status and research priorities. Int J Parasitol. 50 (9), 635-645 (2020).
- Kuipers, M. E., et al. Optimized protocol for the isolation of extracellular vesicles from the parasitic worm Schistosoma mansoni with improved purity, concentration, and yield. J Immunol Res. 2022 (1), 5473763 (2022).
- Fernandez-Becerra, C., et al. Guidelines for the purification and characterization of extracellular vesicles of parasites. J Extracell Biol. 2 (10), e117 (2023).
- Chaiyadet, S., et al. Silencing of Opisthorchis viverrini tetraspanin gene expression results in reduced secretion of extracellular vesicles. Front Cell Infect Microbiol. 12, 827521 (2022).
- Théry, C., et al. Minimal information for studies of extracellular vesicles 2018 (MISEV2018): A position statement of the International Society for Extracellular Vesicles and update of the MISEV2014 guidelines. J Extracell Vesicles. 7 (1), 1535750 (2018).
- Szatanek, R., et al. The methods of choice for extracellular vesicles (EVs) characterization. Int J Mol Sci. 18 (6), 1153 (2017).
- Blundell, E. L. C. J., Mayne, L. J., Billinge, E. R., Platt, M. Emergence of tunable resistive pulse sensing as a biosensor. Anal Methods. 7 (17), 7055-7066 (2015).
- Vucetic, A., Filho, A., Dong, G., Olivier, M. Isolation of extracellular vesicles from Leishmania spp. Methods Mol Biol. , 555-574 (2020).
- Caputo, F., et al. Measuring particle size distribution and mass concentration of nanoplastics and microplastics: Addressing some analytical challenges in the submicron size range. J Colloid Interface Sci. 588, 401-417 (2021).
- Crescitelli, R., Lässer, C., Lötvall, J. Isolation and characterization of extracellular vesicle subpopulations from tissues. Nat Protoc. 16 (3), 1548-1580 (2021).
- Trombetta, E. S., Mellman, I. The cell biological basis of antigen presentation in vitro and in vivo. Ann Rev Immunol. 23 (1), 975-1028 (2005).
- Hammer, G. E., Ma, A. Molecular control of state dendritic cell maturation and immuno homeostasis. Ann Rev Immunol. 31 (1), 743-791 (2013).
- Weigel, B. J., et al. Comparative analysis of murine marrow–derived dendritic cells generated by Flt3L or GM-CSF/IL-4 and matured with immune stimulatory agents on the in vivo induction of antileukemia responses. Blood. 100 (12), 4169-4176 (2002).
- March, N., et al. Differences in dendritic cells stimulated in vivo by tumors engineered to secrete granulocyte macrophage colony-stimulating factor or Flt3-ligand. Cancer Res. 60, 3239-3246 (2000).
- Heath, W. R., et al. Cross-presentation, dendritic cell subsets, and the generation of immunity to cellular antigens. Immunol Rev. 199 (1), 9-26 (2004).
- Naik, S., et al. Cutting edge: generation of splenic CD8+ and CD8− dendritic cell equivalents in Fms-like tyrosine kinase 3 ligand bone marrow cultures. J Immunol. 174 (11), 6592-6597 (2005).
- Sauter, M., et al. Protocol to isolate and analyze mouse bone marrow derived dendritic cells (BMDC). STAR Protoc. 3 (3), 101664 (2022).
- Helft, J., et al. GM-CSF mouse bone marrow cultures comprise a heterogeneous population of CD11c(+) MHCII(+) macrophages and dendritic cells. Immunity. 42 (6), 1197-1211 (2015).
- Borup, A., et al. Comparison of separation methods for immunomodulatory extracellular vesicles from helminths. J Extracell Biol. 1 (5), e41 (2022).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved