Method Article
Isolamento e captazione delle cellule dendritiche di piccole vescicole extracellulari da Echinococcus granulosus
In questo articolo
Riepilogo
Qui, descriviamo le condizioni di coltura in vitro , l'isolamento e l'aumento della generazione di vescicole extracellulari (EV) da Echinococcus granulosus. Le piccole vescicole extracellulari sono state caratterizzate dalla diffusione dinamica della luce e dalla microscopia elettronica a trasmissione. L'assorbimento da parte delle cellule dendritiche derivate dal midollo osseo e la loro modulazione fenotipica sono stati studiati mediante microscopia confocale e citometria a flusso.
Abstract
La secrezione di vescicole extracellulari da parte dei cestodi è fondamentale per consentire la comunicazione cellulare non solo tra i parassiti ma anche con i tessuti ospiti. In particolare, le piccole vescicole extracellulari (sEV) agiscono come nano-vettori trasferendo antigeni naturali, che sono fondamentali per l'immunomodulazione dell'ospite e la sopravvivenza del parassita. Questo articolo presenta un protocollo passo-passo per isolare le sEV da colture allo stadio larvale di Echinococcus granulosus e analizza il loro assorbimento da parte delle cellule dendritiche ottenute dal midollo osseo murino, che acquisiscono adesione e capacità di presentazione dell'antigene durante la loro maturazione dopo una settimana di coltura in vitro . Questo articolo fornisce informazioni complete per la generazione, la purificazione e la quantificazione delle sEV utilizzando l'ultracentrifugazione insieme ad analisi parallele di diffusione dinamica della luce e microscopia elettronica a trasmissione. Inoltre, viene delineato un protocollo sperimentale dettagliato per isolare e coltivare cellule di midollo osseo di topo e guidare la loro differenziazione in cellule dendritiche utilizzando Flt3L. Queste cellule dendritiche possono presentare antigeni alle cellule T naive, modulando così il tipo di risposta immunitaria in vivo. Pertanto, vengono proposti protocolli alternativi, tra cui la microscopia confocale e l'analisi della citometria a flusso, per verificare il fenotipo maturazionale acquisito di cellule dendritiche precedentemente esposte a sEV parassite. Infine, vale la pena notare che il protocollo descritto può essere applicato nel suo insieme o in singole parti per eseguire colture di parassiti in vitro , isolare vescicole extracellulari, generare colture di cellule dendritiche derivate dal midollo osseo ed eseguire saggi di captazione con queste cellule.
Introduzione
L'Echinococcus granulosus è un elminto parassita zoonotico responsabile di un'infezione a lungo termine nota come echinococcosi cistica1. Negli ospiti intermedi, come il bestiame e l'uomo, l'infezione parassitaria colpisce principalmente il fegato e i polmoni, dove lo stadio larvale si sviluppa sotto forma di cisti piene di liquido o metacestodi contenenti protoscoleci (una larva stessa). Come tutti i cestodi, questo parassita è privo sia del sistema digestivo che di quello escretore e ha, quindi, sviluppato processi cellulari endocitici ed esocitici attivi per regolare l'assorbimento e l'escrezione dei metaboliti, nonché il rilascio di vescicole extracellulari2,3. Le vescicole extracellulari (EV) sono particelle racchiuse in un doppio strato lipidico secrete apparentemente da tutti i tipi di cellule. In particolare, le piccole vescicole extracellulari (sEV), definite come vescicole extracellulari più piccole di 200 nm indipendentemente dalla loro origine di biogenesi4, possono agire come mediatori immunitari intercellulari. Questa funzione è particolarmente significativa nei parassiti, che si basano sull'immunomodulazione dell'ospite per garantire la loro sopravvivenza3. La manipolazione immunitaria si ottiene attraverso l'assorbimento di sEV da parte delle cellule dendritiche dell'ospite, le uniche cellule in grado di attivare le cellule T naive in vivo e di avviare una risposta immunitaria adattativa che porterà all'infezione cronica da parte di questi vermi parassiti. Le cellule dendritiche, cellule professionali presentanti l'antigene del sistema immunitario innato, elaborano e caricano peptidi antigenici sul complesso maggiore di istocompatibilità di classe I e II (MHC I e MHC II) e li esibiscono sulle loro membrane per l'esclusivo priming delle cellule T naive (cellule T CD8+ e CD4+ , rispettivamente)5. Le cellule dendritiche successive inducono la loro maturazione per induzione dell'espressione dei marcatori co-stimolatori CD80/CD86 e CD40 e MHC-II e migrano dai tessuti periferici agli organi linfoidi secondari dopo aver riconosciuto antigeni estranei, caricandoli per l'esclusivo priming delle cellule T naive6. Pertanto, l'obiettivo generale di questo protocollo è quello di studiare la comunicazione tra elminto parassita e ospite in modo realistico, analizzando l'imballaggio e la consegna di componenti parassitari sotto forma di sEV, che, una volta raggiunte le cellule immunitarie dell'ospite, influenzano lo sviluppo dell'infezione e la progressione della malattia parassitaria cronica.
Affrontare l'analisi dell'interfaccia elminto-ospite attraverso lo studio delle sEV presenta diversi vantaggi. In primo luogo, il tegumento, il rivestimento esterno dei vermi piatti, è una struttura a doppia membrana che costituisce un importante punto di incrocio tra il parassita e il suo ospite, consentendo alle sEV di essere prontamente generate o permeate da questa struttura7. In secondo luogo, le sEV sono altamente caricate con antigeni proteici provenienti da tutte le fasi del ciclo di vita del parassita, rappresentando il modo naturale attraverso il quale il sistema immunitario dell'ospite campiona gli antigeni durante l'infezione da vermi 8,9. Grazie alla loro produzione biologica, alla facilità di purificazione (senza richiedere la distruzione dei tessuti o il frazionamento delle proteine) e all'interazione diretta con le cellule ospiti, le sEV di elminti consentono lo sviluppo di esperimenti in vitro per simulare le condizioni in vivo di interazione parassita-ospite. Infine, le sEV rappresentano la possibilità di avere strutture parassite che possono essere fagocitate o internalizzate dalle cellule ospiti, superando l'impossibilità di farlo con parassiti interi, in particolare nei casi di vermi incistati.
Considerando i vantaggi menzionati e il fatto che le elmintiasi sono malattie prevalenti e tipicamente croniche in cui i parassiti presumibilmente manipolano il sistema immunitario dell'ospite come strategia di sopravvivenza, l'isolamento delle vescicole extracellulari derivate da parassiti e il loro studio in interazione con cellule dendritiche fornisce un quadro prezioso per esplorare questa immunomodulazione10. In questo senso, è stato descritto che l'internalizzazione delle vescicole extracellulari da elminti, inclusi nematodi e platelminti come Schistosoma mansoni, Fasciola hepatica, Brugia malayi ed E. granulosus, induce la maturazione e l'attivazione delle cellule dendritiche 9,11,12,13,14,15.
L'isolamento di vescicole extracellulari derivate da elminti non solo consente lo studio delle interazioni immunologiche, portando potenzialmente allo sviluppo di vaccini protettivi o agenti immunoterapici per malattie allergiche o autoimmuni, ma facilita anche l'esplorazione di altre interazioni e funzioni biologiche 8,16,17. In questo contesto, le vescicole extracellulari, che svolgono un ruolo nella storia naturale delle infezioni parassitarie, potrebbero essere utilizzate per studiare lo sviluppo del parassita e le interazioni con specifiche cellule ospiti. Inoltre, potrebbero avere potenziali applicazioni come biomarcatori precoci o differenziali per la diagnosi di malattie parassitarie, il monitoraggio delle risposte terapeutiche e il contributo al controllo e alla gestione delle infezioni parassitarie17,18.
Inoltre, come precedentemente dimostrato, lo stadio larvale di E. granulosus è suscettibile a variazioni della concentrazione citosolica di calcio, che, oltre a svolgere un ruolo nella vitalità del parassita, controlla anche il tasso di esocitosi19,20. In questo contesto, e sapendo che l'aumento intracellulare del calcio migliora il rilascio di vescicole extracellulari, l'utilizzo di un potenziatore intracellulare del calcio come la loperamide potrebbe essere una strategia cruciale per aumentare il numero di vescicole extracellulari. Questo approccio è particolarmente interessante per i sistemi cellulari che richiedono grandi popolazioni per generare una quantità adeguata di EV per il carico e l'analisi funzionale 11,21,22. L'attuale protocollo (Figura 1) descrive in dettaglio i metodi per ottenere colture pure dello stadio larvale di E. granulosus e le condizioni che migliorano la produzione di sEV. Descrive inoltre il flusso di lavoro per l'isolamento e la caratterizzazione di queste vescicole, nonché il loro assorbimento da parte delle cellule dendritiche murine, un passo essenziale nello studio iniziale della modulazione del sistema immunitario dell'ospite.
Protocollo
Tutte le procedure che coinvolgono gli animali sono state valutate e approvate dal Comitato Sperimentale Animale della Facoltà di Scienze Esatte e Naturali, Mar del Plata (numeri di permesso: RD544-2020; RD624-625-2021; RD80-2022). In questo protocollo, i topi sono stati soppressi, secondo la "Guida per la cura e l'uso degli animali da laboratorio" pubblicata dal NIH e le linee guida del Servizio sanitario nazionale e della qualità alimentare (SENASA).
1. Coltivazione allo stadio larvale di Echinococcus
NOTA: Tutte le procedure sono state eseguite in condizioni asettiche.
- E. granulosus protoscoleces obtention
- Aspirare con un ago da 21 G e una siringa da 10 mL una parte di liquido idatideo dal polmone o dal fegato di bovini infetti per ridurre il turgore delle cisti (Figura 2A).
NOTA: I polmoni e i fegati infetti provengono da bovini presentati per la macellazione di routine al macello. Devono essere mantenuti a 4 °C e lavorati entro 24 ore dalla macellazione. - Aprire la cisti con le forbici e rimuovere gli strati laminare e germinale dalla cisti usando una pinza. Metterli su una capsula di Petri sterile, insieme all'eventuale liquido idatideo rimanente (Figura 2B, C).
NOTA: A questo punto, si consiglia di osservare la capsula di Petri al microscopio invertito per valutare la qualità delle protoscoleci e delle capsule di covata. Evitare di raggruppare il materiale biologico delle cisti con più del 50% dei protoscoleci collassati, che sono identificati dal loro soma contratto, dal colore più scuro e dal rostellum disorganizzato con perdita di uncini. - Lavare gli strati con soluzione salina tamponata con fosfato sterile (PBS) integrata con antibiotici (100 μg/mL di penicillina, 100 μg/mL di streptomicina, 100 μg/mL di gentamicina 100 μg/mL) per rimuovere le protoscole.
NOTA: Tutti i lavaggi saranno eseguiti con PBS integrato con antibiotici. - Trasferire la sospensione di protoscolex in una provetta di vetro Khan sterile utilizzando una pipetta Pasteur.
- Lavare le protoscoleci con PBS integrato a 4 °C utilizzando una pipetta Pasteur per rimuovere i parassiti morti. Risospendere energicamente la sospensione per rompere le capsule di covata facilitando il rilascio di protoscolex. Lasciare depositare i protoscoli per 1-2 minuti sul fondo del tubo; quindi scartare il surnatante contenente i protoscoleci morti.
NOTA: A causa di una differenza di densità, i protoschieli viventi si depositano più velocemente dei parassiti morti. - Ripetere il processo di lavaggio fino a rimuovere tutte le protoscole morte e galleggianti.
NOTA: I parassiti morti vengono rimossi quando tutti si insediano alla stessa velocità. - Determinare la vitalità dei protoscoleci utilizzando il test di esclusione del metilene.
- Risospendere i protoscoleci lavati con una pipetta e posizionare una goccia su un vetrino. Aggiungere una goccia di 0,1 mg/mL di blu di metilene e coprire con un vetrino coprioggetti. Attendere 2-3 minuti e osservare al microscopio.
- Contare il numero totale di protoscoleci vivi (non colorati) e morti (colorati in blu) e calcolare la percentuale di protoscoleci vitali (Figura 2D e riquadro).
NOTA: La vitalità dei protoscoleci dovrebbe essere di circa il 98% prima di stabilire le colture. Il tempo di colorazione non deve superare i 10 minuti, poiché durate più lunghe possono provocare la colorazione di parassiti vivi.
- Aspirare con un ago da 21 G e una siringa da 10 mL una parte di liquido idatideo dal polmone o dal fegato di bovini infetti per ridurre il turgore delle cisti (Figura 2A).
- E. granulosus metacestodes obtention
- Produrre una malattia idatidea secondaria sperimentale infettando intraperitonealmente topi femmina di CF1 (peso corporeo 25 ± 5 g) con 1500 protoschioli (equivalenti a 10 μL del pellet protocolex) sospesi in 0,5 mL di PBS integrato (Figura 2E).
NOTA: Si raccomanda di mantenere le protoscole in PBS integrate con antibiotici a 4 °C per 24 ore o in coltura per 3-5 giorni prima dell'infezione. - I metacestodi si sviluppano entro 4-6 mesi dall'infezione (Figura 2F). Durante questo periodo, alloggiare gli animali in condizioni di laboratorio controllate (temperatura 20 ± 1 °C, ciclo luce/buio di 12 ore e fornitura di acqua e cibo ad libitum). Una volta che le cisti si sono sviluppate, anestetizzare i topi usando ketamina-xilazina (50 mg/kg/topo-5 mg/kg/topo) e sopprimerli mediante lussazione cervicale.
- Pulire la superficie ventrale del topo con alcool al 70% e aprire chirurgicamente la cavità peritoneale per rimuovere i metacestodi sviluppati utilizzando forbici e pinze.
- Trasferire le masse di metacestodi in una capsula di Petri sterile.
NOTA: Le masse metacestodiche sono costituite da più cisti interne circondate da tessuto connettivo. - Rilasciare le cisti dalle masse metacestodiche rimuovendo con cura il tessuto connettivo che copre i metacestodi usando una pinza, se necessario.
NOTA: Questo passaggio garantisce che i parassiti siano privi di tessuto ospite. - Lavare i metacestodi ottenuti con PBS integrato a 4 °C (Figura 2G).
- Produrre una malattia idatidea secondaria sperimentale infettando intraperitonealmente topi femmina di CF1 (peso corporeo 25 ± 5 g) con 1500 protoschioli (equivalenti a 10 μL del pellet protocolex) sospesi in 0,5 mL di PBS integrato (Figura 2E).
- Coltivazione di protoscoleces e metacestodi di E. granulosus
- Preparare il terreno di coltura come segue: aggiungere 100 μg/mL di penicillina, 100 μg/mL di streptomicina, 100 μg/mL di gentamicina, 4 mg/mL di glucosio, 50 mM di tampone Hepes pH 7,5 e terreno 199 per raggiungere il volume finale desiderato e mescolare delicatamente per inversione.
- Trasferire 5 mL del terreno di coltura preparato in ciascuna provetta di Leighton (Figura 2H–I).
- Aggiungere i parassiti al terreno di coltura e incubare a 37 °C per 5 giorni senza cambiare il terreno. Incubare le provette di Leighton con un angolo di 15° per garantire una distribuzione uniforme del materiale biologico sulla superficie piana. Ciò massimizza l'esposizione dei parassiti al terreno di coltura evitando il contatto con il tappo di gomma.
NOTA: Aggiungere 9.000-10.000 protoscoleci o 50 metacestodi (con diametri compresi tra 5 mm e 15 mm distribuiti come 10 cisti per tubo). - Facoltativamente, aggiungere 20 μM di loperamide (una concentrazione sub-letale) disciolta in dimetilsolfossido per 16-24 ore nel terreno di coltura del parassita per aumentare il livello citosolico di calcio e migliorare il rilascio di EV allo stadio larvale di E. granulosus.
NOTA: Dato che un aumento delle concentrazioni intracellulari di calcio aumenta la produzione di EV, il trattamento del parassita con composti che influenzano l'omeostasi del calcio aumenterà il rilascio di EV.
2. Purificazione delle vescicole extracellulari
- Raccogliere il terreno di coltura dei parassiti da ciascuna provetta di Leighton e trasferirlo in una provetta conica da 15 mL.
NOTA: Il terreno di coltura può essere conservato per 24 ore prima della prima centrifugazione con un impatto minimo sulla concentrazione o sulla distribuzione dimensionale delle vescicole. I protoscoleci possono essere lavati tre volte con tampone PBS, raccolti e conservati a -20 °C in provette da 1,5 mL. - Centrifugare a 300 x g per 10 minuti a 4 °C e trasferire il surnatante in una nuova provetta conica da 15 mL utilizzando una pipetta.
NOTA: Questo passaggio rimuove i protoschiocchi morti. Dopo ogni fase di centrifugazione, assicurarsi che rimangano almeno 0,5 cm di surnatante sopra il pellet per evitare contaminazioni. - Centrifugare il surnatante a 2.000 x g per 10 minuti a 4 °C e trasferirlo in nuove provette da 1,5 mL utilizzando una pipetta.
NOTA: Questo passaggio rimuove i detriti cellulari più grandi. - Centrifugare a 10.000 x g per 30 minuti a 4 °C per rimuovere i detriti cellulari più piccoli.
- Trasferire il surnatante in una provetta adatta al rotore dell'ultracentrifuga utilizzando una pipetta. Contrassegnare un lato di ogni provetta con un pennarello prima di inserirla nel rotore dell'ultracentrifuga. Quindi, posizionare il tubo nel rotore con il lato contrassegnato rivolto verso l'alto.
NOTA: Il marchio funge da punto di riferimento per la localizzazione del pellet dopo l'ultracentrifugazione. I tubi devono essere pieni per tre quarti e bilanciati con precisione; quindi, se necessario, aggiungere PBS. Se il volume del surnatante supera la capacità di una singola provetta, dividere i campioni in più provette e combinarli durante la risospensione. - Centrifugare a 100.000 x g per 1 ora a 4 °C e versare il surnatante con un'azione rapida. Lasciare riposare il tubo capovolto per 1 minuto. Il pellet potrebbe non essere visibile in questa fase.
NOTA: Il fattore k per il rotore utilizzato è 103. - Lavare il pellet con almeno 3 mL di PBS per rimuovere le proteine contaminanti. Risospendere il pellet pipettandolo più volte dal lato superiore verso il basso della provetta su tutte le facce della provetta, ma principalmente sul lato contrassegnato in cui si prevede che si trovi il pellet.
NOTA: Se applicabile, riunire il pellet risospeso derivato dallo stesso surnatante in un unico tubo. - Centrifugare a 100.000 x g per 1 ora a 4 °C e versare il surnatante con un'azione rapida. Lasciare riposare il tubo capovolto per 1 minuto.
NOTA: Il fattore k per il rotore utilizzato è 103. - Risospendere il pellet in 30 μl di PBS seguendo il processo descritto al punto 2.7.
NOTA: A questo punto, si consiglia di misurare la concentrazione proteica totale nel pellet risospeso per stimare la quantità di sEVs secrete. La concentrazione proteica può essere determinata misurando l'assorbanza a 280 nm utilizzando uno spettrofotometro a microvolume. - Trasferire il campione in una provetta da 1,5 mL. Congelare le vescicole extracellulari a -80 °C.
NOTA: Per preservare l'integrità delle vescicole per le applicazioni a valle, congelare il pellet risospeso il più rapidamente possibile ed evitare ripetuti cicli di congelamento-scongelamento.
3. Caratterizzazione delle vescicole isolate
- Determinazione delle dimensioni delle vescicole extracellulari mediante diffusione dinamica della luce (DLS)
NOTA: La diffusione dinamica della luce è un metodo affidabile e sensibile per valutare le dimensioni (in base al raggio idrodinamico, Rh) e la forma delle nanoparticelle in fluidi complessi, indipendentemente dal loro tipo. Le misure del potenziale DLS e zeta sono state eseguite utilizzando un raggio laser monocromatico He-Ne a 633 nm. Se l'analisi non è possibile il giorno del campionamento, i campioni possono essere congelati in un tampone prefiltrato prima della conservazione.- Scongelare i campioni e mantenerli sul ghiaccio fino a quando non vengono effettuate le misurazioni.
NOTA: Il congelamento dei campioni potrebbe influire sulla distribuzione delle particelle e sull'integrità delle sEV. Pertanto, evitare i cicli di congelamento e scongelamento, in quanto possono portare a una diminuzione del segnale LS con altezze di picco ridotte. - Filtrare i campioni acquosi utilizzati per la DLS attraverso un filtro con pori di 0,2 μm.
NOTA: Negli esperimenti LS, è essenziale filtrare tutte le soluzioni, i tamponi e i campioni acquosi per rimuovere le particelle di grandi dimensioni e la polvere, che possono interferire con le misurazioni. - Diluire i campioni da 1:10 a 1:50 in PBS prefiltrato.
- Mescolare i campioni mediante una leggera inversione prima di ogni misurazione per evitare la sedimentazione, poiché l'intensità LS può diminuire a causa del tempo di elaborazione del campione più lungo.
- Aggiungere 1 mL di campione in una cuvetta pulita, posizionando il lato non smerigliato nel percorso del laser a sinistra nello strumento. Chiudere il coperchio e attendere 2-3 minuti per l'equilibrio prima di misurare il campione.
- Misurare le dimensioni in termini di raggio idrodinamico (Rh) prima di eseguire la misurazione del potenziale zeta. Registra le misure con un singolo angolo di diffusione (θ = da 90° a 150°) a 25 °C ± 1 °C.
- Fare clic su Pannello di controllo per controllare le letture e avviare l'acquisizione dei dati.
NOTA: Sulla base dei valori medi di Rh e delle distribuzioni dimensionali valutate per le sEV, si dovrebbe osservare un picco compreso tra 30 nm e 200 nm (Figura 3). Picchi inferiori a 15 nm di Rh sono attribuiti agli acidi nucleici e alle proteine in sospensione. Tipicamente, le distribuzioni dimensionali sono calcolate dal raggio idrodinamico medio. Tuttavia, possono essere riportati anche la media Z (dimensione media delle particelle nel campione), l'indice di polidispersione (PDI, che determina l'eterogeneità delle dimensioni di un campione) e la dipendenza angolare dell'intensità della luce diffusa.
- Scongelare i campioni e mantenerli sul ghiaccio fino a quando non vengono effettuate le misurazioni.
- Determinazione della struttura e della dimensione delle particelle mediante microscopia elettronica a trasmissione (TEM)
NOTA: eseguire la microscopia elettronica a trasmissione con colorazione negativa per valutare le dimensioni, la struttura e la purezza delle sEV, utilizzando un protocollo standard che include fissazione, disidratazione, inclusione di resina e contrasto per le preparazioni di sEV a montaggio intero.- Scongelare i campioni di sEV concentrati dal passaggio 2.10 e mantenerli sul ghiaccio.
- Fissare i sEV in provette da 1,5 mL. Applicare con cautela 5-10 μL di glutaraldeide al 2,5% in tampone cacodilato di sodio 0,1 M (pH 7) a ~5 μL del pellet del campione sEV (concentrazione di sEV richiesta ≈ 1 x 108-1 x 109 mL-1) e incubare per 2 ore a 4 °C.
NOTA: le sEV possono essere conservate fino a 1 settimana a 4 °C in tampone di cacodilato di sodio 0,1 M prima di un'ulteriore lavorazione. Pertanto, se sono necessari servizi tecnici esterni per l'analisi TEM, inviare i campioni di sEV fissi refrigerati in provette da 1,5 mL. - Depositare 5 μL di pellet risospeso sulle griglie di rame EM rivestite in carbonio Formvar da 300 mesh. Preparare due o tre griglie per ogni campione.
- Lasciare che il campione si adsorba per 20 minuti in un ambiente asciutto e rimuovere il campione in eccesso dalla griglia utilizzando carta da filtro.
- Posizionare 100 μl di gocce di PBS su un foglio di pellicola. Utilizzando una pinza pulita, trasferire le griglie (con il lato adsorbito del campione rivolto verso il basso) nelle gocce PBS per il lavaggio.
- Asciugare il lato opposto del campione adsorbito, assicurandosi che il lato del campione delle griglie non si asciughi durante nessuno dei passaggi successivi.
NOTA: Per tutti i passaggi successivi, posizionare le gocce di reagenti su una pellicola piatta e trasferire le griglie sulle gocce utilizzando una pinza. - Trasferire le griglie in una goccia di 50 μL di glutaraldeide all'1% per 5 minuti.
- Lavare le griglie con una goccia da 100 μL di acqua distillata e lasciarle riposare per 3 min. Ripetere nove volte per un totale di dieci lavaggi.
- Confrontare le griglie del campione con una goccia di 50 μl di soluzione all'1% p/v di uranil-acetato, pH 7, per 1 minuto.
- Confrontare e incorporare le griglie in una miscela di 100 μl di acetato di uranile al 4% e 900 μl di metilcellulosa al 2%.
- Asciugare le griglie all'aria per 5-10 minuti mentre rimangono sul loop e osservarle con un microscopio elettronico a 80-100 kV con una risoluzione di 0,2 nm e un ingrandimento di 100.000x.
- Conservare le griglie in scatole di stoccaggio asciutte per la conservazione a lungo termine.
4. Generazione di cellule dendritiche derivate dal midollo osseo
NOTA: Questa procedura deve essere eseguita utilizzando topi giovani, che sono caratterizzati da robusti sistemi ematopoietici con capacità di proliferazione e differenziazione attive. Al contrario, i topi più anziani mostrano un declino della funzione ematopoietica, riserve ridotte di cellule staminali, interazioni di nicchia alterate e un serbatoio di memoria più sviluppato che è fondamentale per l'immunità a lungo termine e la risposta ai patogeni o ai cambiamenti legati all'età come l'immunosenescenza.
- Eutanasia di una femmina di topo CF-1 di 5-8 settimane secondo le linee guida etiche istituzionali, riducendo al minimo la sofferenza degli animali.
- Spruzzare il topo con etanolo prima di inserirlo in una cappa per coltura tissutale.
NOTA: I seguenti passaggi devono essere eseguiti in condizioni sterili. - Posizionare il mouse su una tavola da dissezione in posizione supina. Usando una pinza e le forbici da dissezione, praticare un'incisione verticale a "T" sopra l'uretra ed estenderla orizzontalmente fino alla sommità degli arti inferiori, facendo attenzione a non rompere il peritoneo o perforare alcun organo, in particolare l'intestino.
- Separare la pelle lungo entrambi gli arti posteriori per esporre le ossa e i tessuti delle gambe usando una pinza. Con le mani, rimuovere la pelle di ogni gamba spingendo dalla caviglia verso l'addome, tirando la pelle dal lato opposto. Entrambe le gambe saranno quindi prive di pelle.
NOTA: Gettare il corpo del topo nel sacchetto dei residui di agenti patogeni. - Utilizzando forbici e pinze, rimuovere con cura il femore e la tibia, evitando rotture. Fissare la punta di ogni osso con una pinza e tagliare i tendini per rimuovere le fasce muscolari attorno alle ossa. Completare la pulizia del tessuto muscolare con tovaglioli di carta.
- Man mano che ogni osso viene rimosso, metterlo in una provetta sterile da 50 ml contenente 2 ml di terreno completo preparato con terreno RPMI integrato con FBS al 5%, 100 U/ml di penicillina, 100 U/mL di streptomicina e 10 μg/mL di gentamicina per rimuovere i detriti. Successivamente, aspirare e scartare il terreno di coltura e lavare le ossa due volte con etanolo al 70% per 5 minuti.
- Trasferire le ossa in una capsula di Petri sterile.
- Tagliare le due epifisi ossee usando forbici da dissezione affilate per accedere alle cellule del midollo osseo.
- Sciacquare accuratamente le cellule del midollo osseo da ciascuna delle quattro ossa in una capsula di Petri sterile utilizzando un ago da 25 G collegato a una siringa da 20 ml contenente terreno completo. Le ossa diventeranno più trasparenti man mano che il midollo osseo viene estratto.
NOTA: Un volume di 20 mL del terreno completo dovrebbe essere sufficiente per eluire le cellule del midollo osseo dai due femori e dalla tibia. - Omogeneizzare delicatamente il terreno con il midollo eluito mediante pipettaggio per rimuovere il tessuto connettivo osseo e i grumi di cellule. Successivamente, trasferire il campione in una provetta conica sterile da 50 mL, facendo passare le cellule attraverso un filtro sterile in polipropilene da 70 μm per rimuovere il tessuto connettivo e i detriti ossei.
- Centrifugare le celle a 450 x g per 7 minuti a 4 °C. Rimuovere ed eliminare con cura il surnatante, assicurandosi che il pellet rimanga aderente alla parete del tubo.
- Incubare le cellule per 1 minuto a temperatura ambiente (RT), quindi risospenderle in 500 μL di tampone di lisi dei globuli rossi (RBC). Neutralizzare il tampone di lisi aggiungendo 3 mL di terreno completo.
- Centrifugare le celle a 450 x g per 7 minuti a 4 °C. Scartare il surnatante e risospendere il pellet in 5 mL di terreno completo.
- Passare la sospensione cellulare attraverso un filtro cellulare sterile in polipropilene da 70 μm in una provetta conica sterile da 50 ml per rimuovere gli aggregati cellulari dagli eritrociti lizzati.
- Contare le cellule utilizzando un emocitometro.
- Aggiungere 300 ng/mL di ligando ricombinante della tirosin-chinasi 3 (Flt3L) correlata alla Fms murina al terreno di coltura.
- Piastra le cellule a una concentrazione di 1 x 106 cellule/mL in una piastra multipozzetto.
- Incubare le cellule per 7 giorni a 37 °C in atmosfera umidificata con CO2 al 5%.
NOTA: Evitare di scuotere le cellule mentre si differenziano e crescono per evitare la maturazione spontanea. - Il giorno 3, rimuovere 1 mL di terreno da ciascun pozzetto (evitando di disturbare le cellule) e sostituirlo con 1 mL di terreno completo fresco preriscaldato integrato con 150 ng/mL di Flt3L murino ricombinante.
5. Interazione tra cellule dendritiche derivate dal midollo osseo e vescicole extracellulari da E. granulosus
- Colorazione della membrana delle vescicole extracellulari
- Scongelare i sEV conservati al punto 2.10 e mantenerli in ghiaccio.
- Risospendere 10 μl di sEV purificati in 10 μl di veicolo di marcatura (diluente C).
- Aggiungere 20 μl di soluzione colorante 2x PKH26 per ottenere una concentrazione finale di 2 μM. Mescolare delicatamente con una pipetta e incubare al buio per 35 minuti a 37°C.
NOTA: La soluzione colorante 2x PKH26 (4 μM) deve essere preparata immediatamente prima della colorazione aggiungendo 0,5 μl di soluzione colorante etanolica PKH26 a 125 μl di diluente C. - Mescolare delicatamente ogni 3-5 minuti durante l'incubazione per garantire una colorazione omogenea.
- Aggiungere 40 μl di BSA 1% e incubare per 10 minuti a RT per arrestare il processo di colorazione.
- Lavare i sEV con 1 mL di PBS e centrifugare a 100.000 x g per 1 ora a 4 °C per rimuovere il colorante in eccesso.
NOTA: Il fattore k per il rotore è 103. - Risospendere il pellet in 90 μl di PBS seguendo il protocollo descritto al punto 2.7.
- Stimolazione di cellule dendritiche murine derivate dal midollo osseo con vescicole extracellulari di E. granulosus
- Prelevare le cellule dendritiche derivate dal midollo osseo (BMDC) dal pozzetto della piastra di coltura e trasferirle in provette da 1,5 mL.
NOTA: Maneggiare con cura per evitare la maturazione spontanea delle cellule. - Centrifugare il terreno a 450 x g per 5 minuti per pellettare le cellule.
NOTA: Riservare i surnatanti della centrifugazione per riplaccare le cellule nelle successive fasi dell'analisi della citometria a flusso. - Risospendere i BMDC in 30 μL di sEV non colorate dal passaggio 2.10 per l'analisi di citometria a flusso o in 90 μL di sEV colorate contenenti PBS dal passaggio 5.1.7. per microscopia confocale. Incubare per 30 minuti a 37 °C in atmosfera umidificata con CO2 al 5%. Mescolare delicatamente il campione ogni 10 minuti.
NOTA: Per garantire un contatto efficace tra BMDC e sEV, i primi 30 minuti di incubazione devono essere eseguiti in un volume minimo utilizzando provette da 1,5 mL. - Per la microscopia confocale, trasferire le cellule su un vetrino coprioggetti trattato con blu Alcian (diametro 12 mm) posto in una piastra a 24 pozzetti. Incubare per altri 30 minuti a 37 °C in una camera umidificata con CO2 al 5 %.
NOTA: Il trattamento con blu di Alciano conferisce una carica positiva al vetrino, facilitando l'aderenza delle membrane plasmatiche caricate negativamente dei BMDC.- Per preparare i vetrini, immergerli in un colorante filtrato all'1% di Alcian blue 8 GX e scaldarli in microonde per 1-2 minuti senza farli bollire. Incubarli nella soluzione calda per 10 minuti, agitandoli ogni 2 o 3 minuti.
- Quindi, lavare i vetrini coprioggetti con acqua distillata deionizzata per rimuovere il blu di Alcian in eccesso e asciugarli su carta assorbente. Infine, sterilizzare in autoclave i vetrini coprioggetti e conservarli in condizioni sterili fino al momento dell'uso.
- Per l'analisi della citometria a flusso, trasferire nuovamente le BMDC-sEV nello stesso pozzetto da cui sono state prelevate (vedere la fase 5.2.1), aggiungere i surnatanti riservati dalla fase 5.2.2 e incubare per 18 ore a 37 °C in un'atmosfera umidificata con il 5% di CO2.
NOTA: Lasciare circa 500 μl di terreno nel pozzetto per evitare l'essiccazione delle cellule rimanenti dopo la raccolta. - Utilizzare controlli positivi e negativi per valutare la maturazione del BMDC. Stimolare le cellule con 100 ng/mL di lipopolisaccaride (LPS) per 18 ore come controllo positivo. Per un controllo negativo dell'endocitosi, incubare le BMDC con sEV a 4 °C. Inoltre, includere un controllo delle cellule dendritiche non stimolato.
- Prelevare le cellule dendritiche derivate dal midollo osseo (BMDC) dal pozzetto della piastra di coltura e trasferirle in provette da 1,5 mL.
- Microscopia confocale di vescicole extracellulari da E. granulosus catturate e internalizzate da cellule dendritiche derivate dal midollo osseo.
- Una volta completato il periodo di incubazione descritto al punto 5.2.4, aspirare ed eliminare il PBS dal vetrino coprioggetti.
- Fissare i BMDC aggiungendo 100 μl di paraformaldeide (PFA) al 4% sul vetrino coprioggetti e incubare per 10 minuti a RT.
NOTA: Assicurarsi che il volume mantenga la tensione superficiale del vetrino coprioggetti. - Aspirare e gettare il PFA, quindi lavare il vetrino coprioggetti tre volte con PBS-BSA 2%.
- Aggiungere 100 μl di PBS contenente anticorpo anti-MHC di classe II-FITC diluito 1/100 e incubare per 1 ora a RT al buio.
- Aspirare e scartare la soluzione anticorpale e lavare il vetrino coprioggetti tre volte con PBS-BSA 2%.
- Aggiungere 100 μL di DAPI da 50 ng/mL e incubare per 30 minuti a temperatura ambiente in una camera umida per controcolorare i nuclei.
- Aspirare e gettare la soluzione colorante e lavare il vetrino coprioggetti tre volte con PBS-BSA 2 %.
- Rimuovere il vetrino coprioggetti utilizzando una pinza a punta curva e asciugarlo su un tovagliolo di carta per eliminare il liquido in eccesso.
- Montare il vetrino coprioggetti rivolto verso il basso su un vetrino utilizzando un mezzo di montaggio composto da alcol polivinilico e glicerolo. Lasciare asciugare per 2 ore a 37 °C o per una notte a 4 °C al buio.
- Rimuovere eventuali bolle d'aria tra il vetrino coprioggetti e il vetrino premendo delicatamente sul vetrino con una pinza.
- Osservare i campioni montati al microscopio confocale utilizzando un obiettivo a immersione in olio 60x con una lunghezza d'onda di eccitazione/emissione di 485/538 nm per FITC, 358/461 nm per DAPI e 551/567 nm per PKH26.
- Valutazione fenotipica di cellule dendritiche derivate dal midollo osseo stimolate da vescicole extracellulari mediante citometria a flusso
- Dopo il periodo di incubazione descritto al punto 5.2.5, prelevare i BMDC lavando più volte il terreno su e giù con una pipetta.
- Raccogliere i BMDC contenenti terreno e metterli in provette da 1,5 mL.
- Centrifugare a 450 x g per 5 minuti a 4 °C per pellettare le cellule.
NOTA: Facoltativamente, per analizzare la secrezione di citochine, rimuovere i surnatanti con una pipetta, trasferirli in nuove provette da 1,5 ml e conservarli a -20 °C per ulteriori test ELISA (Enzyme-Linked Immunosorbent Assay). - Risospendere i BMDC in 100 μL di PBS contenente isotiocianato di fluoresceina (FITC), alloficocianina (APC) o mAb coniugati con ficoeritrina diretti a CD11c, CD40, CD80, CD86, MHC classe I e MHC classe II e incubare per 15 minuti a 4 °C al buio.
- Lavare i BMDC con PBS e centrifugare a 450 × g per 5 min a 4 °C.
- Risospendere i BMDC in 500 μL di PFA all'1% per fissarli e conservarli a 4 °C fino all'acquisizione in un citometro a flusso.
Risultati
Nella Figura 1 è mostrato un diagramma di flusso che riassume le fasi principali per il mantenimento di colture pure dello stadio larvale di E. granulosus, l'isolamento e la caratterizzazione delle sEV e il loro assorbimento da parte delle cellule dendritiche murine. Per ottenere un'elevata produzione di sEV da protoscoleces e metacestodi di E. granulosus, è stato impiegato un metodo di coltura in vitro precedentemente sviluppato in laboratorio per massimizzare la sopravvivenza e l'omeostasi metabolica del parassita studiato (Figura 2).

Figura 1: Panoramica delle procedure sperimentali per l'ottenimento di sEVs e BMDC di E. granulosus . Rappresentazioni schematiche che descrivono le fasi seguite in questo protocollo, dall'ottenimento e dalla coltivazione del materiale parassita (FASE 1), all'isolamento (FASE 2) e alla caratterizzazione delle vescicole extracellulari del parassita (FASE 3) fino alla generazione di BMDC (FASE 4) e alla loro interazione con le sEV di E. granulosus (FASE 5). Clicca qui per visualizzare una versione più grande di questa figura.
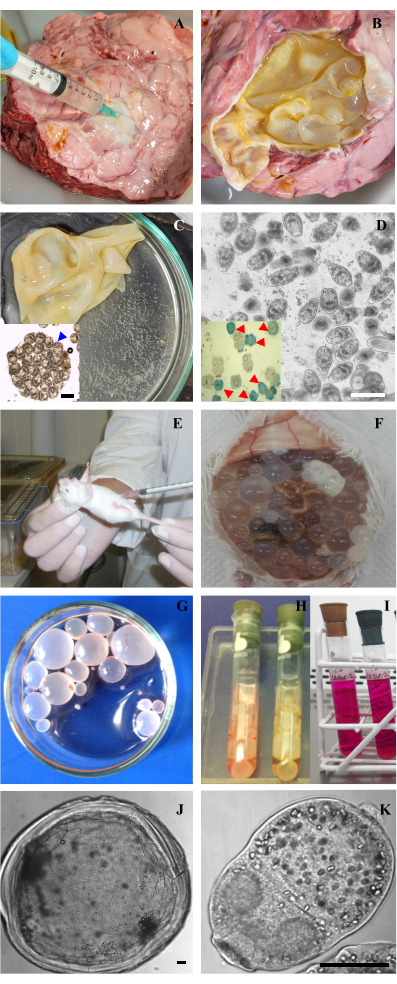
Figura 2: Acquisizione di campioni e coltura in vitro di protoscoleci e metacestodi di Echinococcus granulosus. (A) Puntura di cisti idatidea polmonare di bovini per estrarre il liquido idatideo. (B) Cisti idatidea aperta con la membrana esposta. (C) Membrana idatide e suo fluido ialino con capsule di covata e protoschieli liberi denominati "sabbia idatidea". Inserto: Capsula di covata con protoscoleci all'interno con morfologia conservata. (D) Microscopia ottica di protoscole vitali dopo la rimozione di protoscole morte. Barra 200 μm. Riquadro: colorazione blu di metilene di protoscoleci che mostrano protoscoleci vivi (traslucidi) e protoscoleci morti (colorati in blu, indicati con punte di freccia rosse). (E) Inoculazione di protoscoleci nella cavità peritoneale di un topo CF-1. (F) Metacestodi all'interno della cavità addominale sviluppati dopo 7 mesi di inoculazione con protoscoleci. (G) Cisti isolate da un topo e lavate con PBS in una capsula di Petri. (H,I) Mantenimento in vitro di metacestodi e protoscoleci in tubi di Leighton con terreno M199. (J,K) Microscopia ottica di un metacestode e di un protoscolex di E. granulosus. Le barre indicano 50 μm. Clicca qui per visualizzare una versione più grande di questa figura.
La caratterizzazione delle vescicole extracellulari purificate dallo stadio larvale di E. granulosus è mostrata nella Figura 3. Le EV isolate seguendo l'attuale protocollo erano principalmente sEV con diametri compresi tra 50 e 200 nm come determinato da DLS (Figura 3A) e confermato da MET (Figura 3B). L'analisi TEM ha anche rivelato che le sEV mostravano la tipica morfologia a forma di coppa delle vescicole simili a esosomi (Figura 3B). Inoltre, la TEM ha confermato che concentrazioni subletali di loperamide possono agire come potenziatore del rilascio di EV, come dimostrato da un aumento del rapporto di sEV nei campioni trattati con loperamide rispetto ai controlli. Allo stesso modo, la maggiore abbondanza di sEV ottenuta da parassiti trattati con loperamide è stata ulteriormente supportata dalle misurazioni della concentrazione proteica (11 ± 1,5 μg/μL rispetto a 6 ± 1 μg/μL nei controlli, Figura 3C).

Figura 3: Caratterizzazione di vescicole extracellulari purificate dallo stadio larvale di E. granulosus . (A) Grafico a diffusione dinamica della luce (DLS) che descrive la distribuzione dimensionale delle vescicole extracellulari isolate da protoscoceti di controllo (Co) e trattati con loperamide (Lp). (B) Fotografie al microscopio elettronico a trasmissione (TEM) di vescicole extracellulari colorate negativamente purificate dal controllo (a) o PTS (d) trattate con loperamide. Le barre della scala indicano 50 nm. Gli arrowheds indicano abbondanti vescicole simili a esosomi con la tipica struttura a forma di coppa. (b-c) e (e-f) corrispondono alle amplificazioni delle aree scatolate rispettivamente da (a) e (d). (C) Concentrazione proteica del pellet di ultracentrifugazione da sette saggi indipendenti. I dati sono presentati come media ± SD. L'asterisco indica differenze significative (Kruskal-Wallis con il post-test di Dunn, p < 0,05). Clicca qui per visualizzare una versione più grande di questa figura.
La Figura 4 illustra la progressione della generazione di BMDC attraverso l'osservazione delle variazioni nella quantità e nella morfologia delle cellule del midollo osseo dall'insediamento iniziale della coltura alla completa differenziazione. Il giorno 0, le cellule ematopoietiche sono state coltivate in un terreno completo a una densità di 1× 106 cellule/mL integrate con 300 ng/mL di Flt3L, una citochina e fattore di crescita che attiva i progenitori ematopoietici per proliferare e differenziarsi nella morfologia delle cellule dendritiche. Nei giorni 1-2, le cellule erano ancora piccole e di forma arrotondata senza cambiamenti morfologici significativi, sebbene la loro quantità fosse aumentata. Tra i giorni 3-5, si è verificato un rimodellamento citoscheletrico attivo, con conseguente forma eterogenea e allungata con un aumento delle estensioni citoplasmatiche (dendriti). A questo punto, le colture contenevano cellule aderenti con estensioni citoplasmatiche pronunciate, cellule non aderenti che subivano cambiamenti morfologici durante la differenziazione delle cellule dendritiche e cellule sferiche non aderenti che rimanevano insensibili all'induzione delle citochine (Figura 4). Dopo i giorni 6-7, l'80%-90% delle colture consisteva principalmente in BMDC allo stato stazionario e completamente differenziati. Queste cellule mostravano una forma stellata con estesi processi citoplasmatici ottimizzati per la cattura e la presentazione dell'antigene. Il giorno 7, i BMDC sono stati raccolti per analizzare il loro fenotipo ed eseguire saggi funzionali.
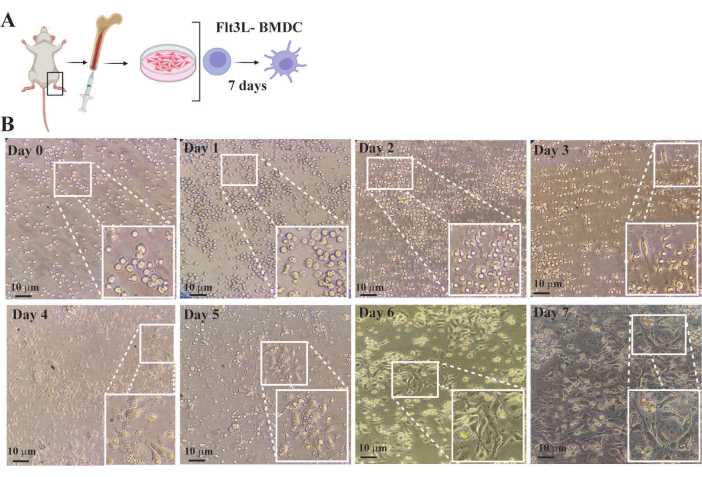
Figura 4: Monitoraggio della differenziazione delle cellule dendritiche derivate dal midollo osseo FTL3L utilizzando un microscopio ottico invertito convenzionale. (A) Rappresentazione schematica della purificazione dei precursori ematopoietici da midollo osseo di topo e coltura cellulare in terreno completo integrato con flt3L B- Immagini di colture cellulari di midollo osseo ottenute in diversi punti temporali. I riquadri sono regioni ingrandite dell'area riquadri di ogni immagine. (B) Giorno 0: Immagine di cellule ematopoietiche recentemente purificate dal midollo osseo. Si osserva che, sebbene la popolazione sia eterogenea, la maggior parte sono cellule con morfologia arrotondata e dimensioni ridotte. Giorni 1-5: immagini di coltura che mostrano l'aumento del numero di cellule e i cambiamenti nella morfologia dovuti alla proliferazione attiva indotta dall'attivazione della via di segnalazione FLT3. La morfologia cellulare passa da arrotondata ad allungata con un progressivo aumento delle estensioni citoplasmatiche (dendriti). Questi cambiamenti sono più evidenti quando le cellule aderiscono ai pozzetti della piastra di coltura. Giorni 6-7: immagini che mostrano BMDC completamente differenziate allo stato stazionario caratterizzate da forma irregolare con un nucleo prominente e numerose proiezioni ramificate fini, il citoplasma è altamente granulare con vescicole coinvolte nella presentazione dell'antigene e nella risposta immunitaria. La barra rappresenta 10 μm. Fare clic qui per visualizzare una versione più grande di questa figura.
Poiché le cellule dendritiche sono mediatori essenziali nell'attivazione e nell'orientamento della risposta immunitaria indotta, è fondamentale eseguire analisi funzionali di queste cellule per rivelare i potenziali ruoli delle sEV nelle interazioni ospite-parassita. Il protocollo qui presentato conferma che le BMDC catturano le sEV del parassita dopo un'incubazione di 1 ora a 37 °C. È interessante notare che le sEV sembrano essere localizzate nei compartimenti endosomiali-lisosomiali dove sono conservate le molecole MHCII preformate mentre si osserva che colocalizzano (Figura 5).
Inoltre, i BMDC stimolati con colorante senza EV sono stati inclusi come controlli negativi per convalidare la specificità dell'etichettatura. Sono stati osservati solo fluorescenza extracellulare aspecifica e il 3%-4% delle cellule con segnale di colorante diffuso rispetto a oltre il 40% delle cellule marcate positivamente esposte a sEV colorate.

Figura 5: Microscopia confocale in immunofluorescenza di BMDC che mostra un efficiente captamento delle sEV marcate e il reclutamento di MHC di classe II negli endosomi. (A) Rappresentazione schematica del protocollo descritto al punto 5.3 che mostra la stimolazione delle sEV marcate con PKH26 nelle BMDC. (B) Immagine confocale che mostra un controllo negativo delle BMDC stimolate con PKH26 senza la presenza di sEV (rosso, PKH26) e (DAPI blu). Non sono stati osservati segnali fluorescenti dal colorante all'interno della cellula senza le sEV. (C) Canali separati di immagini confocali che mostrano BMDC stimolati con sEV colorate: microscopia a contrasto interferenziale differenziale (DIC), DAPI (blu, nuclei), PKH26 (rosso, sEVs) e FITC (verde, MHC classe II). Le barre della scala rappresentano 10 μm. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
Il flusso di lavoro del protocollo per la coltura dei parassiti, l'isolamento delle sEV derivate dai parassiti, la differenziazione delle cellule dendritiche dal midollo osseo e l'analisi dell'assorbimento delle sEV da parte di queste cellule è descritto nella Figura 1. L'obiettivo è stato quello di descrivere dettagliatamente ogni sezione del protocollo che può essere svolta nel suo insieme o separatamente, evidenziando le principali considerazioni per garantire l'attuazione della metodologia. L'analisi della popolazione di EV ottenute da organismi parassiti completi ha un impatto concreto sullo studio dell'interrelazione parassita-ospite, e proprio in questo contesto è stato delineato questo protocollo sperimentale.
Le nuove conoscenze sulle malattie parassitarie sono state ostacolate dalla difficoltà di coltivare in vitro alcuni di questi parassiti. Poiché gli elminti parassiti non riescono a completare i loro cicli vitali in condizioni artificiali, possono sopravvivere in una cultura solo come organismi completi. Pertanto, la soluzione proposta da questo protocollo per studiare l'interfaccia verme-ospite è quella di effettuare autonomamente la coltivazione di ciascuna forma parassita (verme adulto e diverse forme larvali) per arricchire e isolare le sEV, per poi confrontarle con le cellule degli organi bersaglio o delle cellule del sistema immunitario ospite, permettendone l'internalizzazione o la fagocitazione, rispettivamente. Inoltre, un passaggio fondamentale per stabilire una coltura di elminti per isolare le vescicole extracellulari è quello di selezionare rigorosamente i parassiti vivi per avviare la coltura in vitro e tenerli in incubazione il più breve possibile per limitare la morte dei parassiti e la generazione di membrane residue libere23. Per realizzarlo in E. granulosus, le protoscoleci recuperate da cisti idatidee vengono sottoposte a lavaggi intensivi con PBS freddo in tubi di vetro di piccolo diametro. Durante la vigorosa dispersione con una pipetta, i protoschili vivi sedimentano rapidamente. In questo modo, vengono separati dai protoscoceti non vitali che rimangono sospesi più a lungo nella colonna liquida del tubo, permettendo loro di essere catturati ed eliminati dalla miscela. In linea con questo scopo, durante ogni fase di lavaggio, la miscelazione energica con una pipetta garantisce anche la rottura delle capsule di covata e il rilascio delle protoscoleci intrappolate dal loro interno, liberandole dalla membrana di cerchio. Le colture di parassiti sono stabilite in tubi di vetro di tipo Leighton per evitare l'adesione delle sEV e con una porzione piatta per consentire un insediamento disperso della coltura di parassiti. Nel caso di metacestodi ottenuti dalla cavità peritoneale dei topi, è fondamentale separare lo strato avventiziale che li ricopre ed eseguire diversi lavaggi con PBS additivato con antibiotici per rimuovere le cellule associate e il microbiota intestinale, che possono influenzare la purezza delle sEVs derivate dall'elminto stesso come descritto anche da White et al.23. I tubi sono tappati con tappi di gomma sterili, che contribuiscono a generare un'atmosfera carente di ossigeno necessaria per emulare il metabolismo fermentativo che questi parassiti mantengono in vivo. Infine, il terreno M199 è molto appropriato come mezzo di mantenimento per lo stadio larvale cestodico a lungo termine24,25. Il terreno ha i componenti minimi come sali, glucosio e aminoacidi essenziali e, inoltre, contiene aminoacidi non essenziali, colesterolo, pirimidine, vitamine idrosolubili e liposolubili e precursori degli acidi nucleici tra cui tiamina, riboflavina e biotina. Tutti questi nutrienti favoriscono il mantenimento delle funzioni organiche di base e la vitalità di questi parassiti. L'M199 è particolarmente utilizzato per cellule non trasformate, embrioni, espianti primari e colture di organi, essendo ottimale per la coltivazione di massa cellulare26. In particolare, quando utilizzato come terreno di coltura di mantenimento, M199 deve essere applicato senza integrazione di siero fetale bovino poiché favorisce l'ottenimento di protoscoleci vescicolarizzate e la loro dedifferenziazione a microcisti27,28.
Tutte le condizioni utilizzate per le colture di parassiti devono essere documentate per garantire la riproducibilità dei risultati che coinvolgono il recupero e l'assorbimento cellulare delle sEV. In particolare, un aspetto che influenza la produzione di EV è l'aggiunta alla coltura di composti che influenzano l'omeostasi del calcio poiché aumentano l'esocitosi calcio-dipendente29,30. Qui, l'aggiunta di loperamide, un induttore intracellulare del calcio in E. granulosus19,31, alle colture di parassiti è proposta per migliorare il rilascio di sEV. Questo metodo aumenta il numero di vescicole nei cestodi (Figura 3) e potrebbe essere una buona strategia per migliorare la produzione nei sistemi cellulari con basso rilascio di EV. Tuttavia, poiché questa strategia, come altre modifiche fisiche o chimiche della coltura, potrebbe alterare le proprietà e le funzionalità delle vescicole extracellulari, è necessario prestare particolare attenzione quando si eseguono analisi ad alto rendimento come la proteomica.
Le colture di cestodi consentono di raggiungere concentrazioni di EV di ordini di grandezza elevati, dato che la loro superficie tegumentale esterna è uno strato citoplasmatico sinciziale adattato ai processi chiave di esocitosi ed endocitosi32. La scala della preparazione dell'EV sarà soggetta ai requisiti sperimentali. Un totale di 9.000 protoscoleci produce in media 30 μL di sEV con una concentrazione di 1-2,5 ' 108 sEV/mL, sufficienti per eseguire analisi DLS, TEM e LC-MS-MS in parallelo. Una limitazione del protocollo è l'ottenimento di un'elevata quantità di vescicole dai metacestodi a causa della presenza del loro strato laminare, che ostacola il rilascio di vescicole nel mezzo. Pertanto, sono necessarie grandi quantità di parassiti (passaggio 1.3.3)11. Un approccio alternativo consiste nell'analizzare anche le sEV del liquido idatideo, come riportato in altri studi 11,33,34,35,36.
In linea con la tendenza più ampia osservata nella ricerca sulle vescicole extracellulari, la maggior parte degli studi sulle vescicole extracellulari elmintiche fino ad oggi ha impiegato l'ultracentrifugazione di prodotti escretori/secretori come metodo principale per l'isolamento e la separazione delle vescicole extracellulari37. In questo protocollo, l'ultracentrifugazione è stata utilizzata per isolare le sEV, che è considerato il metodo gold standard per il recupero delle vescicole extracellulari, anche se può comportare l'inclusione di contaminanti insieme alle vescicole extracellulari15. Una limitazione di questo metodo è la rimozione dei contaminanti solubili. Poiché le sEV sono più grandi dei contaminanti solubili, un'alternativa per migliorare la purificazione consiste nell'incorporare passaggi aggiuntivi, come l'utilizzo della cromatografia ad esclusione dimensionale (SEC)38,39. Tuttavia, quando l'isolamento delle vescicole extracellulari è necessario per analisi funzionali, come lo studio della comunicazione tra elminti parassita e ospite, l'identificazione rigorosa della popolazione di vescicole extracellulari non è così critica, poiché tutte trasportano carico antigenico. Pertanto, a seconda della purezza necessaria per ulteriori sperimentazioni, il processo di isolamento può terminare con l'ultracentrifugazione, come qui eseguito, oppure può essere combinato con altri metodi come la filtrazione per eliminare i contaminanti di grandi dimensioni, la centrifugazione in gradiente di densità di saccarosio o iodixanolo o la cromatografia ad esclusione dimensionale, che consentono non solo di pulire i contaminanti ma anche di separare diverse popolazioni di EV37, 38,40. Indipendentemente da ciò, il metodo impiegato qui è semplice e rappresenta la scelta principale per la raccolta e l'arricchimento delle sEV dai parassiti39. Fornisce un'elevata resa di sEV a un costo relativamente basso, poiché richiede solo un laboratorio dotato di un'ultracentrifuga in cui è possibile utilizzare provette riutilizzabili.
La descrizione delle caratteristiche delle vescicole extracellulari isolate è fondamentale per determinare la concentrazione, le dimensioni, la qualità e il sottotipo delle vescicole extracellulari. Inoltre, l'analisi della composizione proteica contribuisce a determinare quali sottopopolazioni di EV sono arricchite nel campione, oltre a stimare la presenza di possibili contaminanti. La caratterizzazione delle vescicole extracellulari può essere eseguita con diversi metodi che spesso richiedono attrezzature e strutture specializzate41. Qui, la dimensione delle sEV parasite è stata analizzata utilizzando DLS, che fornisce dati affidabili nelle sospensioni monodisperse ma è meno preciso nelle sospensioni con EV42 ad ampia distribuzione. Pertanto, un'alternativa potrebbe essere l'utilizzo di altri metodi come l'analisi di tracciamento delle nanoparticelle (NTA), che determina con precisione le dimensioni e la quantità delle vescicole, il rilevamento di impulsi resistivi sintonizzabili (TRPS), che offre una gamma dinamica più ampia rispetto all'NTA, o il citometro a flusso nanometrico (NanFCM) che possiede una sensibilità maggiore rispetto alla citometria a flusso convenzionale 43,44,45. Inoltre, come parte della routine sperimentale e in base alle raccomandazioni degli esperti, la tecnica TEM consente di determinare integralmente la purezza, la resa e le dimensioni delle EV ottenute, essenzialmente in raccolti ad alta EV46. Inoltre, l'esame mediante analisi TEM è particolarmente consigliato quando, dopo l'ultracentrifugazione, non è possibile visualizzare il pellet EV per verificare la composizione del materiale recuperato.
Questi problemi evidenziano l'importanza di utilizzare tecniche robuste per l'isolamento e la caratterizzazione completa delle vescicole extracellulari derivate da elminti, che potrebbero facilitare l'identificazione di marcatori specifici per tracciare il loro destino e, a loro volta, consentire la valutazione dei loro ruoli funzionali.
Le vescicole extracellulari purificate da E. granulosus rappresentano vettori naturali del trasporto dell'antigene con diverse proteine antigeniche caratterizzate e sconosciute9. Queste sEV da sole possono stimolare le cellule presentanti l'antigene distribuite in diversi tessuti e organi linfoidi secondari dell'ospite. Le cellule dendritiche sono cellule professionali uniche che presentano l'antigene in grado di mostrare antigeni alle cellule T naive, determinando il tipo di risposta immunitaria in vivo47,48.
Questo manoscritto descrive un protocollo per dettagliare un metodo per generare cellule dendritiche da colture di midollo osseo di topo adattato da una ricerca precedentemente pubblicata49. Qui, viene proposto un metodo consolidato per gli studi immunitari basato sulla coltura in vitro di BMDC murini guidati da Flt3L, in cui l'isolamento del midollo osseo è un passaggio essenziale per ottenere una coltura in vitro di successo50. Dato che diversi protocolli di isolamento di cellule del midollo osseo producono popolazioni cellulari eterogenee, le colture di BMDC devono essere analizzate mediante citometria a flusso durante la prima fase di differenziazione di Flt3L per stabilire il fenotipo cellulare per gli esperimenti pianificati 51,52,53. La caratterizzazione fenotipica della BMDC sotto l'effetto Flt3L indica che la maggior parte sono cellule dendritiche convenzionali (CD11b+, CD11c+, CD172a+), che assomigliano più da vicino alle cellule dendritiche trovate in vivo che caricano antigeni esogeni. Mentre una piccola percentuale di BMDC corrisponde a cellule dendritiche plasmacitoidi (CD11c+, B220+, SinglecH+) e a cellule dendritiche CD8+-like (CD11c+, CD24+ e CD172a-)11,53.
Alcuni passaggi problematici comuni sono la bassa resa di BMDC in coltura, che può derivare dalla rottura dell'osso durante la preparazione, dall'estrazione inefficiente del midollo osseo, dalla formazione di grumi cellulari, dalle condizioni di coltura non ottimali (ad esempio, composizione media, temperatura) o dall'insufficiente stimolazione delle citochine. Per affrontare questi problemi, alcune alternative sono tagliare dietro le epifisi, garantire il lavaggio completo delle cellule del midollo osseo da entrambi i lati del femoro e della tibia, sospendere completamente il midollo osseo prima di passare attraverso il filtro cellulare, utilizzare citochine appena preparate alla concentrazione raccomandata e mantenere la sterilità e la stabilità del pH del terreno di coltura.
È imperativo garantire lo stato di "riposo" delle cellule dendritiche di base prima di indurne la maturazione con il contatto con l'antigene. Le cellule dendritiche non solo riconoscono un'ampia gamma di antigeni esterni (PAMP, pathogen-associated molecular pattern) e antigeni interni (DAMPs, danger-associated molecular pattern), ma anche cambiamenti minimi nella coltura cellulare (pH, lieve agitazione, densità cellulare) possono indurre la loro maturazione. Per questi motivi, i movimenti e le vibrazioni della coltura cellulare devono essere ridotti al minimo durante la manipolazione nella centrifuga o nell'incubatore. Inoltre, il pipettaggio deve essere regolare senza generare bolle nel terreno. Inoltre, il mantenimento delle colture primarie per più di 8 giorni può attivare le cellule dendritiche e promuovere la morte cellulare. Inoltre, una densità cellulare più elevata di 2,5 x 106 produce una maggiore espressione di MHCII54 e aumenta la maturazione prima del contatto con l'antigene. Inoltre, tutti i reagenti utilizzati devono essere completamente privi di endotossine o LPS, conseguenza di una precedente contaminazione con batteri gram-negativi, perché l'LPS induce la stimolazione o l'esaurimento delle cellule dendritiche23,55. Per mantenere la sterilità durante la manipolazione delle colture di midollo osseo, oltre a incorporare l'uso di antibiotici nei terreni, deve essere continuamente utilizzato spray di etanolo al 70% sulla superficie, sulle mani guantate e sugli oggetti dell'armadio, preservando il contatto tra etanolo e cellule del midollo osseo. Prima di esporre gli strumenti a ossa o cellule, assicurarsi che l'etanolo sia evaporato e asciugarli all'aria perché è velenoso per le cellule del midollo osseo.
Le cellule dendritiche promuovono la loro maturazione e la produzione di citochine dopo aver riconosciuto e fagocitato le sEV. Le sEV di E. granulosus inducono l'espressione di IL-12, favorendo il profilo Th19. Se la maturazione fenotipica delle cellule dendritiche è carente, il tempo o la concentrazione dello stimolo raggiunto con le sEV aggiunte devono essere ottimizzati. La microscopia confocale è un potente strumento impiegato per visualizzare l'internalizzazione del carico e la colocalizzazione con molecole MHC sugli endosomi delle cellule dendritiche. Inoltre, dopo almeno 8 ore dall'assorbimento delle sEV, la citometria a flusso può essere utilizzata anche per misurare citochine intracellulari e molecole di superficie come CD40, CD80, CD86 e MHCII in cellule dendritiche mature11,13.
Un'ampia ricerca che impiega un'ampia gamma di tecniche fornirà una comprensione più profonda di come le dimensioni, l'origine e il carico delle vescicole extracellulari del parassita possano interferire e modificare le risposte dell'ospite.
Divulgazioni
Gli autori dichiarano di non avere conflitti di interesse.
Riconoscimenti
Gli autori riconoscono Lic. Cecilia Gutiérrez Ayesta (Servicio de Microscopía Electrónica, CONICET, Bahía Blanca, Argentina) e Lic. Leonardo Sechi e Lic. Eliana Maza (INIFTA, Universidad Nacional de La Plata, Argentina) per l'assistenza tecnica rispettivamente con la microscopia elettronica a trasmissione e la diffusione dinamica della luce. Ringraziamo anche Dra. Graciela Salerno, Dra. Corina Berón e il Dr. Gonzalo Caló per l'utilizzo dell'ultracentrifuga presso l'INBIOTEC-CONICET-FIBA, Argentina. Gli autori riconoscono con gratitudine Lic. Kelly (SENASA, Mar del Plata, Argentina) e Lic. H. Núnez García (CONICET, Universidad Nacional de Mar del Plata, Argentina) per la loro collaborazione nella valutazione del benessere dei topi, e Med. Vet. J. Reyno, Med. Vet. S. Gonzalez e Med. Vet L. Netti per il loro contributo all'ottenimento di materiale parassitario. Questo lavoro, compresi i costi di sperimentazione, reagenti e attrezzature, è stato sostenuto dal PICT 2020 n. 1651 finanziato dall'ANPCyT.
Materiali
| Name | Company | Catalog Number | Comments |
| 1.5 mL tubes | Henso | N14059 | |
| 24-well plate | JetBiofil | CAP011024 | Polystyrene, flat bottom, Sterile |
| 6-well plate | Henso Medical Co. Ltd. | N14221 | Flat-shape bottom, PS material, Sterile |
| 70 mm polypropylene cell strainer | Biologix Group Limited | 15-1070 | Sterile |
| Alcian blue 8 GX dye | Santa Cruz | sc-214517B | |
| Automatic CO2 incubator | Nuarire | UN-5100E/G DH | |
| Bovine Serum Albumin | Wiener lab | 1443151 | |
| CD11c Monoclonal antibody-PECy5 100 µg | eBioscience | 15-0114-82 | clone (N418) |
| CD40 Monoclonal antibody-FITC 100 µg | eBioscience | 11-0402-82 | clone (HM40-3) |
| CD80 Monoclonal antibody-APC 100 µg | eBioscience | 17-0801-82 | clone (16-10A-1) |
| CD86 Monoclonal antibody-FITC 100 µg | eBioscience | 11-0862-82 | clone (GL-1) |
| Centrifuge | Thermo Scientific | IEC CL31R Multispeed | |
| Confocal Microscope | Nikon | Nikon Confocal Microscope C1 | |
| Conical tubes 15 mL dia.17 x 120 mm | Citotest | 4610-1865 | |
| DAPI | Sigma | 107K4034 | |
| D-Glucose | Merk | 1.78343 | |
| Dimethyl Sulfoxide | Anedra | 6646 | |
| Fetal Bovine Serum 500 mL | Sigma-Aldrich | 12352207 | |
| Flow Cytometry System | BD Biosciences | BD FACSCanto™ II | |
| Folded Capillary Zeta Cell | Malvern Panalytical | DTS1070 | |
| Gentamicin sulfate salt | Sigma | G1264 | |
| Glutaraldehyde solution | Fluka | 49630 | |
| Hepes | Gibco | 11344041 | |
| Hypodermic needle 21 G x 1"25/8 | Weigao | Sterile | |
| Hypodermic needle 25 G x 5/8" | Weigao | Sterile | |
| Inverted microscope | Leica | DMIL LED Fluo | |
| Ketamine | Holliday | ||
| Lipopolysaccharide 5 mg | Invitrogen | tlrl-rslps | LPS from the Gram-negative bacteria E. coli K12 . TLR2/4 Agonists |
| Loperamide hydrochloride | Sigma-Aldrich | 5.08162 | |
| Medium 199 | Gibco | 11150059 | |
| Methylene Blue | Anedra | 6337 | |
| MHC class I (H2kb) Monoclonal antibody-PE 100 µg | eBioscience | 12-5958-82 | clone (AF6-88.5.5.3) |
| MHC class II (IA/IE) Monoclonal antibody-FITC 100 µg | eBioscience | 11-5321-82 | clone (M5/114.15.2) |
| Microscope | Olympus | CX31 | |
| Mouse recombinant murine Flt3L. | PrepoTech | 250-31L-10UG | |
| Nanodrop | Thermo Scientific | ND-One | |
| Paraformaldehyde | Agar Scientific | R1018 | |
| Penicillin G sodium salt | Sigma | P3032-10MU | |
| PKH26 | Sigma-Aldrich | MINI26 | |
| Potassium Phosphate Monobasic | Timper | For Phosphate Buffered Saline (PBS) | |
| RBC lysis buffer 100 mL | Roche | 11814389001 | |
| RPMI medium 1640 1x 500 mL | Sigma-Aldrich (Gibco) | 11875093 | |
| Sodium Cacodylate | Sigma-Aldrich | C0250 | |
| Sodium Chloride | Anedra | 7647-14-5 | For Phosphate Buffered Saline (PBS) |
| Sodium Phosphate Dibasic (Anhydrous) p. a. | Biopack | 1639.07 | For Phosphate Buffered Saline (PBS) |
| Streptomycin sulfate salt | Sigma | S9137 | |
| Syringe 10 mL | Bremen | Sterile | |
| Thickwall polycarbonate tubes | Beckman Coulter | 13 x 55 mm , nominal capacity 4 mL | |
| Transmission Electron Microscope | Jeol | JEOL JSM 100CX II | |
| Ultracentrifuge | Beckman | Optima LE-80k | 90 Ti rotor |
| Xylazine | Richmond | ||
| Zetasizer Nano | Malvern | Nano ZSizer-ZEN3600 | To perform Dynamic Light scattering and zeta potential measurements |
Riferimenti
- Wen, H., et al. Echinococcosis: advances in the 21st century. Clin Microbiol Rev. 32 (2), e00075-e00118 (2019).
- Geary, T. G., Thompson, D. P. Development of antiparasitic drugs in the 21st century. Vet Parasitol. 115 (2), 167-184 (2003).
- Drurey, C., Maizels, R. M. Helminth extracellular vesicles: Interactions with the host immune system. Mol Immunol. 137, 124-133 (2021).
- Welsh, J. A., et al. Minimal information for studies of extracellular vesicles (MISEV2023): From basic to advanced approaches. J. Extracell Vesicles. 13 (2), e12404 (2024).
- Cresswell, P. Antigen processing and presentation. Immunol Rev. 207, 5-7 (2005).
- Buzas, E. I. The roles of extracellular vesicles in the immune system. Nat Rev Immunol. 23 (4), 236-250 (2023).
- Bennett, A. P. S., de la Torre-Escudero, E., Oliver, N. A. M., Huson, K. M., Robinson, M. W. The cellular and molecular origins of extracellular vesicles released by the helminth pathogen Fasciola hepatica. Int J Parasitol. 50 (9), 671-683 (2020).
- Drurey, C., Coakley, G., Maizels, R. M. Extracellular vesicles: new targets for vaccines against helminth parasites. Int J Parasitol. 50 (9), 623-633 (2020).
- Nicolao, M. C., et al. Characterization of protein cargo of Echinococcus granulosus extracellular vesicles in drug response and its influence on immune response. Parasit Vectors. 16 (1), 255 (2023).
- Sánchez-López, C. M., Trelis, M., Bernal, D., Marcilla, A. Overview of the interaction of helminth extracellular vesicles with the host and their potential functions and biological applications. Mol Immunol. 134, 228-235 (2021).
- Nicolao, M. C., Rodriguez, R. C., Cumino, A. C. Extracellular vesicles from Echinococcus granulosus larval stage: Isolation, characterization and uptake by dendritic cells. PLoS Negl Trop Dis. 13 (1), e0007032 (2019).
- Kuipers, M. E., et al. DC-SIGN mediated internalisation of glycosylated extracellular vesicles from Schistosoma mansoni increases activation of monocyte-derived dendritic cells. J Extracell Vesicles. 9 (1), 1753420 (2020).
- Murphy, A., et al. Fasciola hepatica extracellular vesicles isolated from excretory-secretory products using a gravity flow method modulate dendritic cell phenotype and activity. PLoS Negl Trop Dis. 14 (9), e0008626 (2020).
- Ricciardi, A., et al. Extracellular vesicles released from the filarial parasite Brugia malayi downregulate the host mTOR pathway. PLoS Negl Trop Dis. 15 (1), e0008884 (2021).
- Zhang, Q., Jeppesen, D. K., Higginbotham, J. N., Franklin, J. L., Coffey, R. J. Comprehensive isolation of extracellular vesicles and nanoparticles. Nat Protoc. 18 (5), 1462-1487 (2023).
- Brezgin, S., et al. Basic guide for approaching drug delivery with extracellular vesicles. Int J Mol Sci. 25 (19), 10401 (2024).
- Pinheiro, A. A., et al. Potential of extracellular vesicles in the pathogenesis, diagnosis, and therapy for parasitic diseases. J Extracell Vesicles. 13 (8), e12496 (2024).
- Barnadas-Carceller, B., Del Portillo, H. A., Fernandez-Becerra, C. Extracellular vesicles as biomarkers in parasitic disease diagnosis. Curr Top Membr. 94, 187-223 (2024).
- Nicolao, M. C., Denegri, G. M., Carcamo, J. G., Cumino, A. C. P-glycoprotein expression and pharmacological modulation in larval stages of Echinococcus granulosus. Parasitol Int. 63 (1), 1-8 (2014).
- Nicolao, M. C., Cumino, A. C. Biochemical and molecular characterization of the calcineurin in Echinococcus granulosus larval stages. Acta Trop. 146, 141-151 (2015).
- Savina, A., Furlan, M., Vidal, M., Colombo, M. I. Exosome release is regulated by a calcium-dependent mechanism in K562 cells. J Biol Chem. 278 (22), 20083-20090 (2003).
- Ambattu, L. A., et al. High frequency acoustic cell stimulation promotes exosome generation regulated by a calcium-dependent mechanism. Commun Biol. 3 (1), 553 (2020).
- White, R., et al. Special considerations for studies of extracellular vesicles from parasitic helminths: A community-led roadmap to increase rigour and reproducibility. J Extracell Vesicles. 12 (1), e12298 (2023).
- Casado, N., Rodriguez-Caabeiro, F., Hernandez, S. In vitro survival of Echinococcus granulosus protoscolices in several media, at +4 degrees C and +37 degrees C. Z Parasitenkd. 72 (2), 273-278 (1986).
- Casado, N., Rodriguez-Caabeiro, F., Jiménez, A., Criado, A., de Armas, C. In vitro effects of levamisole and ivermectin against Echinococcus granulosus protoscoleces. Int J Parasitol. 19 (8), 945-947 (1989).
- Al-Lamki, R. S., Bradley, J. R., Pober, J. S. Human organ culture: updating the approach to bridge the gap from in vitro to in vivo in inflammation, cancer, and stem cell biology. Front Med. 4, 148 (2017).
- Rodriguez-Caabeiro, F., Casado, N. Evidence of in vitro germinal layer development in Echinococcus granulosus cysts. Parasitol Res. 74 (6), 558-562 (1988).
- Loos, J. A., Cumino, A. C. In vitro anti-echinococcal and metabolic effects of metformin involve activation of AMP-activated protein kinase in larval stages of Echinococcus granulosus. PLoS One. 10 (5), e0126009 (2015).
- Erwin, N., Serafim, M. F., He, M. Enhancing the cellular production of extracellular vesicles for developing therapeutic applications. Phar. Res. 40 (4), 833-853 (2023).
- Sako, Y., et al. Identification of a novel small molecule that enhances the release of extracellular vesicles with immunostimulatory potency via induction of calcium influx. ACS Chem Biol. 18 (4), 982-993 (2023).
- He, L. P., Mears, D., Atwater, I., Rojas, E., Cleemann, L. Loperamide mobilizes intracellular Ca2+ stores in insulin-secreting HIT-T15 cells. Br J Pharmacol. 139 (2), 351-361 (2003).
- Dalton, J. P., Skelly, P., Halton, D. W. Role of the tegument and gut in nutrient uptake by parasitic platyhelminths. Can J Zool. 82 (2), 211-232 (2004).
- Dos Santos, G. B., et al. Excretory/secretory products in the Echinococcus granulosus metacestode: is the intermediate host complacent with infection caused by the larval form of the parasite. Int J Parasitol. 46 (13-14), 843-856 (2016).
- Siles-Lucas, M., et al. Isolation and characterization of exosomes derived from fertile sheep hydatid cysts. Vet Parasitol. 236, 22-22 (2017).
- Yang, J., et al. Identification of different extracellular vesicles in the hydatid fluid of Echinococcus granulosus and immunomodulatory effects of 110 K EVs on sheep PBMCs. Front Immunol. 12, 602717 (2021).
- Khosravi, M., et al. Characterisation of extracellular vesicles isolated from hydatid cyst fluid and evaluation of immunomodulatory effects on human monocytes. J Cell Mol Med. 27 (17), 2614-2625 (2023).
- Sotillo, J., et al. The protein and microRNA cargo of extracellular vesicles from parasitic helminths–current status and research priorities. Int J Parasitol. 50 (9), 635-645 (2020).
- Kuipers, M. E., et al. Optimized protocol for the isolation of extracellular vesicles from the parasitic worm Schistosoma mansoni with improved purity, concentration, and yield. J Immunol Res. 2022 (1), 5473763 (2022).
- Fernandez-Becerra, C., et al. Guidelines for the purification and characterization of extracellular vesicles of parasites. J Extracell Biol. 2 (10), e117 (2023).
- Chaiyadet, S., et al. Silencing of Opisthorchis viverrini tetraspanin gene expression results in reduced secretion of extracellular vesicles. Front Cell Infect Microbiol. 12, 827521 (2022).
- Théry, C., et al. Minimal information for studies of extracellular vesicles 2018 (MISEV2018): A position statement of the International Society for Extracellular Vesicles and update of the MISEV2014 guidelines. J Extracell Vesicles. 7 (1), 1535750 (2018).
- Szatanek, R., et al. The methods of choice for extracellular vesicles (EVs) characterization. Int J Mol Sci. 18 (6), 1153 (2017).
- Blundell, E. L. C. J., Mayne, L. J., Billinge, E. R., Platt, M. Emergence of tunable resistive pulse sensing as a biosensor. Anal Methods. 7 (17), 7055-7066 (2015).
- Vucetic, A., Filho, A., Dong, G., Olivier, M. Isolation of extracellular vesicles from Leishmania spp. Methods Mol Biol. , 555-574 (2020).
- Caputo, F., et al. Measuring particle size distribution and mass concentration of nanoplastics and microplastics: Addressing some analytical challenges in the submicron size range. J Colloid Interface Sci. 588, 401-417 (2021).
- Crescitelli, R., Lässer, C., Lötvall, J. Isolation and characterization of extracellular vesicle subpopulations from tissues. Nat Protoc. 16 (3), 1548-1580 (2021).
- Trombetta, E. S., Mellman, I. The cell biological basis of antigen presentation in vitro and in vivo. Ann Rev Immunol. 23 (1), 975-1028 (2005).
- Hammer, G. E., Ma, A. Molecular control of state dendritic cell maturation and immuno homeostasis. Ann Rev Immunol. 31 (1), 743-791 (2013).
- Weigel, B. J., et al. Comparative analysis of murine marrow–derived dendritic cells generated by Flt3L or GM-CSF/IL-4 and matured with immune stimulatory agents on the in vivo induction of antileukemia responses. Blood. 100 (12), 4169-4176 (2002).
- March, N., et al. Differences in dendritic cells stimulated in vivo by tumors engineered to secrete granulocyte macrophage colony-stimulating factor or Flt3-ligand. Cancer Res. 60, 3239-3246 (2000).
- Heath, W. R., et al. Cross-presentation, dendritic cell subsets, and the generation of immunity to cellular antigens. Immunol Rev. 199 (1), 9-26 (2004).
- Naik, S., et al. Cutting edge: generation of splenic CD8+ and CD8− dendritic cell equivalents in Fms-like tyrosine kinase 3 ligand bone marrow cultures. J Immunol. 174 (11), 6592-6597 (2005).
- Sauter, M., et al. Protocol to isolate and analyze mouse bone marrow derived dendritic cells (BMDC). STAR Protoc. 3 (3), 101664 (2022).
- Helft, J., et al. GM-CSF mouse bone marrow cultures comprise a heterogeneous population of CD11c(+) MHCII(+) macrophages and dendritic cells. Immunity. 42 (6), 1197-1211 (2015).
- Borup, A., et al. Comparison of separation methods for immunomodulatory extracellular vesicles from helminths. J Extracell Biol. 1 (5), e41 (2022).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon