Method Article
Isolamento e captação de células dendríticas de pequenas vesículas extracelulares de Echinococcus granulosus
Neste Artigo
Resumo
Aqui, descrevemos as condições de cultivo in vitro , isolamento e aumento da geração de vesículas extracelulares (EVs) de Echinococcus granulosus. Os pequenos EVs foram caracterizados por espalhamento dinâmico de luz e microscopia eletrônica de transmissão. A captação por células dendríticas derivadas da medula óssea e sua modulação fenotípica foram estudadas por meio de microscopia confocal e citometria de fluxo.
Resumo
A secreção de vesículas extracelulares por cestóides é crucial para permitir a comunicação celular não apenas entre parasitas, mas também com tecidos hospedeiros. Em particular, pequenas vesículas extracelulares (sEVs) atuam como nanocarreadores transferindo antígenos naturais, que são críticos na imunomodulação do hospedeiro e na sobrevivência do parasita. Este artigo apresenta um protocolo passo a passo para isolar sEVs de culturas em estágio larval de Echinococcus granulosus e analisa sua captação por células dendríticas obtidas da medula óssea murina, que adquirem capacidade de adesão e apresentação de antígenos durante sua maturação após uma semana de cultivo in vitro . Este artigo fornece informações abrangentes para gerar, purificar e quantificar sEVs usando ultracentrifugação, juntamente com análises paralelas de espalhamento dinâmico de luz e microscopia eletrônica de transmissão. Além disso, um protocolo experimental detalhado é delineado para isolar e cultivar células da medula óssea de camundongos e conduzir sua diferenciação em células dendríticas usando Flt3L. Essas células dendríticas podem apresentar antígenos para células T virgens, modulando assim o tipo de resposta imune in vivo. Assim, protocolos alternativos, incluindo microscopia confocal e análise por citometria de fluxo, são propostos para verificar o fenótipo maturacional adquirido de células dendríticas previamente expostas a sEVs parasitas. Por fim, vale ressaltar que o protocolo descrito pode ser aplicado como um todo ou em partes individuais para realizar cultura parasitária in vitro , isolar vesículas extracelulares, gerar culturas de células dendríticas derivadas da medula óssea e realizar ensaios de captação com essas células.
Introdução
Echinococcus granulosus é um helmintos parasita zoonótico responsável por uma infecção de longa duração conhecida como equinococose cística1. Em hospedeiros intermediários, como gado e humanos, a infecção por parasitas afeta principalmente o fígado e os pulmões, onde o estágio larval se desenvolve como cistos cheios de líquido ou metacestóides contendo protoscoleces (a própria larva). Como todos os cestóides, este parasita carece de sistemas digestivo e excretor e, portanto, desenvolveu processos celulares endocíticos e exocíticos ativos para regular a captação e excreção de metabólitos, bem como a liberação de vesículas extracelulares2,3. As vesículas extracelulares (EVs) são partículas lipídicas fechadas por aparentemente todos os tipos de células. Em particular, pequenas vesículas extracelulares (sEVs), definidas como EVs menores que 200 nm, independentemente de sua origem biogênica4, podem atuar como mediadores imunes intercelulares. Essa função é especialmente significativa em parasitas, que dependem da imunomodulação do hospedeiro para garantir sua sobrevivência3. A manipulação imunológica é alcançada através da captação de sEVs pelas células dendríticas do hospedeiro, as únicas células capazes de ativar células T virgens in vivo e iniciar uma resposta imune adaptativa que levará à infecção crônica por esses vermes parasitas. As células dendríticas, células apresentadoras de antígenos profissionais do sistema imune inato, processam e carregam peptídeos antigênicos no Complexo Principal de Histocompatibilidade Classe I e Classe II (MHC I e MHC II) e os exibem em suas membranas para priming exclusivo de células T virgens (células T CD8+ e CD4+ , respectivamente)5. As células dendríticas seguintes induzem sua maturação por indução da expressão dos marcadores co-estimulatórios CD80/CD86 e CD40 e MHC-II e migram dos tecidos periféricos para os órgãos linfóides secundários ao reconhecer antígenos estranhos, carregando-os para priming exclusivo de células T virgens6. Assim, o objetivo geral deste protocolo é estudar a comunicação helmintos parasito-hospedeiro de forma realista, analisando o empacotamento e a entrega de componentes parasitários na forma de sEVs, que, ao atingirem as células imunes do hospedeiro, influenciam o desenvolvimento da infecção e a progressão da doença parasitária crônica.
Abordar a análise da interface helminto-hospedeiro por meio do estudo de sEVs tem várias vantagens. Primeiro, o tegumento, a cobertura externa dos platelmintos, é uma estrutura de membrana dupla que constitui um importante ponto de cruzamento entre o parasita e seu hospedeiro, permitindo que os sEVs sejam prontamente gerados ou permeados a partir dessa estrutura7. Em segundo lugar, os sEVs são altamente carregados com antígenos proteicos de todos os estágios do ciclo de vida do parasita, representando a maneira natural pela qual o sistema imunológico do hospedeiro coleta amostras de antígenos durante a infecção por vermes 8,9. Devido à sua produção biológica, facilidade de purificação (sem a necessidade de ruptura tecidual ou fracionamento de proteínas) e interação direta com as células hospedeiras, os sEVs de helmintos permitem o desenvolvimento de experimentos in vitro para simular as condições in vivo de interação parasita-hospedeiro. Finalmente, os sEVs representam a possibilidade de ter estruturas parasitárias que podem ser fagocitadas ou internalizadas pelas células hospedeiras, superando a impossibilidade de fazê-lo com parasitas inteiros, particularmente nos casos de vermes encistados.
Considerando as vantagens mencionadas e o fato de que as helmintíases são prevalentes e tipicamente doenças crônicas nas quais os parasitas presumivelmente manipulam o sistema imunológico do hospedeiro como estratégia de sobrevivência, o isolamento de EVs derivados do parasita e seu estudo em interação com células dendríticas fornece uma estrutura valiosa para explorar essa imunomodulação10. Nesse sentido, foi descrito que a internalização de EVs de helmintos, incluindo nematóides e platelmintos, como Schistosoma mansoni, Fasciola hepatica, Brugia malayi e E. granulosus, induz a maturação e ativação de células dendríticas 9,11,12,13,14,15.
O isolamento de EVs derivados de helmintos não apenas permite o estudo de interações imunológicas, potencialmente levando ao desenvolvimento de vacinas protetoras ou agentes imunoterapêuticos para doenças alérgicas ou autoimunes, mas também facilita a exploração de outras interações e funções biológicas 8,16,17. Nesse contexto, os EVs, que desempenham um papel na história natural das infecções parasitárias, podem ser utilizados para investigar o desenvolvimento do parasita e as interações com células hospedeiras específicas. Além disso, podem ter aplicações potenciais como biomarcadores precoces ou diferenciais para o diagnóstico de doenças parasitárias, monitorando respostas terapêuticas e contribuindo para o controle e manejo de infecções parasitárias17,18.
Além disso, como demonstrado anteriormente, o estágio larval de E. granulosus é suscetível a alterações na concentração citosólica de cálcio, que, além de desempenhar um papel na viabilidade do parasita, também controla a taxa de exocitose19,20. Nesse contexto, e sabendo que a elevação do cálcio intracelular aumenta a liberação de EV, usar um intensificador de cálcio intracelular como a loperamida pode ser uma estratégia crucial para aumentar o número de EVs. Essa abordagem é particularmente interessante para sistemas celulares que requerem grandes populações para gerar uma quantidade adequada de EVs para carga e análise funcional 11,21,22. O protocolo atual (Figura 1) detalha os métodos para obtenção de culturas puras do estágio larval de E. granulosus e as condições que aumentam a produção de sEV. Também descreve o fluxo de trabalho para o isolamento e caracterização dessas vesículas, bem como sua captação pelas células dendríticas murinas, uma etapa essencial no estudo inicial da modulação do sistema imune do hospedeiro.
Protocolo
Todos os procedimentos envolvendo animais foram avaliados e aprovados pelo Comitê Experimental Animal da Faculdade de Ciências Exatas e Naturais de Mar del Plata (números de permissão: RD544-2020; RD624-625-2021; RD80-2022). Nesse protocolo, os camundongos foram eutanasiados, de acordo com o "Guia para o Cuidado e Uso de Animais de Laboratório" publicado pelo NIH e as diretrizes do Serviço Nacional de Saúde e Qualidade Alimentar (SENASA).
1. Cultivo em estágio larval de Echinococcus
NOTA: Todos os procedimentos foram realizados em condições assépticas.
- Obtenção de E. granulosus protoscoleces
- Aspire com uma agulha de 21 G e uma seringa de 10 mL parte do fluido hidático do pulmão ou fígado de bovinos infectados para reduzir o turgor do cisto (Figura 2A).
NOTA: Os pulmões e fígados infectados vêm de bovinos apresentados para abate de rotina no matadouro. Devem ser mantidos a 4 °C e transformados nas 24 horas seguintes ao abate. - Abra o cisto com uma tesoura e remova as camadas laminar e germinativa do cisto usando uma pinça. Coloque-os em uma placa de Petri estéril, junto com qualquer fluido hidático restante ( Figura 2B, C ).
NOTA: Neste ponto, recomenda-se observar a placa de Petri sob um microscópio invertido para avaliar a qualidade dos protoscólices e cápsulas de cria. Evite agrupar o material biológico de cistos com mais de 50% dos protoscólices colapsados, que são identificados por seu soma contraído, cor mais escura e rostelo desorganizado com perda de ganchos. - Lave as camadas com solução salina tamponada com fosfato estéril (PBS) suplementada com antibióticos (100 μg / mL de penicilina, 100 μg / mL de estreptomicina, 100 μg / mL de gentamicina 100 μg / mL) para remover os protoscoleces.
NOTA: Todas as lavagens serão realizadas com PBS suplementado com antibióticos. - Transferir a suspensão de protoscólex para um tubo de vidro Khan estéril utilizando uma pipeta Pasteur.
- Lavar os protoscólices com PBS suplementado a 4 °C com uma pipeta Pasteur para remover os parasitas mortos. Ressuspenda vigorosamente a suspensão para quebrar as cápsulas de cria, facilitando a liberação do protoescólex. Deixe os protoscólices assentarem por 1–2 min no fundo do tubo; Em seguida, descarte o sobrenadante contendo os protoscoleces mortos.
NOTA: Devido a uma diferença de densidade, os protoscólices vivos se instalam mais rapidamente do que os parasitas mortos. - Repita o processo de lavagem até que todos os protoscoleces mortos e flutuantes tenham sido removidos.
NOTA: Os parasitas mortos são removidos quando todos se acomodam na mesma taxa. - Determinar a viabilidade dos protoscólices utilizando o teste de exclusão do metileno.
- Ressuspenda os protoscoleces lavados com uma pipeta e coloque uma gota em uma lâmina. Adicione uma gota de 0,1 mg/mL de azul de metileno e cubra com uma lamínula. Aguarde 2–3 minutos e observe ao microscópio.
- Conte o número total de protoscólices vivos (não corados) e mortos (manchados de azul) e calcule a porcentagem de protoscólices viáveis (Figura 2D e inserção).
NOTA: A viabilidade dos protoscoleces deve ser em torno de 98% antes de estabelecer as culturas. O tempo de coloração não deve exceder 10 min, pois durações mais longas podem resultar na coloração de parasitas vivos.
- Aspire com uma agulha de 21 G e uma seringa de 10 mL parte do fluido hidático do pulmão ou fígado de bovinos infectados para reduzir o turgor do cisto (Figura 2A).
- Obtenção de metacestóides de E. granulosus
- Produza uma doença hidática secundária experimental infectando intraperitonealmente camundongos CF1 fêmeas (peso corporal de 25 ± 5 g) com 1500 protoscólices (equivalente a 10 μL do pellet protocolex) suspensos em 0,5 mL de PBS suplementado ( Figura 2E ).
NOTA: Recomenda-se manter os protoscoleces em PBS suplementados com antibióticos a 4 ° C por 24 h ou em cultura por 3 a 5 dias antes da infecção. - Os metacestóides se desenvolvem dentro de 4-6 meses após a infecção ( Figura 2F ). Durante este período, alojar os animais em condições controladas de laboratório (temperatura de 20 ± 1 °C, ciclo claro/escuro de 12 h e água e alimentos fornecidos ad libitum). Uma vez que os cistos tenham se desenvolvido, anestesiar os camundongos usando cetamina-xilazina (50 mg / kg / camundongo-5 mg / kg / camundongo) e sacrificá-los por luxação cervical.
- Limpe a superfície ventral do camundongo com álcool 70% e abra cirurgicamente a cavidade peritoneal para remover os metacestóides desenvolvidos usando tesoura e fórceps.
- Transferir as massas de metacestóides para uma placa de Petri estéril.
NOTA: As massas metacestóides consistem em múltiplos cistos internos circundados por tecido conjuntivo. - Libere os cistos das massas metacestóides removendo cuidadosamente o tecido conjuntivo que cobre os metacestóides usando uma pinça, se necessário.
NOTA: Esta etapa garante que os parasitas estejam livres do tecido hospedeiro. - Lave os metacestóides obtidos com PBS suplementado a 4 ° C ( Figura 2G ).
- Produza uma doença hidática secundária experimental infectando intraperitonealmente camundongos CF1 fêmeas (peso corporal de 25 ± 5 g) com 1500 protoscólices (equivalente a 10 μL do pellet protocolex) suspensos em 0,5 mL de PBS suplementado ( Figura 2E ).
- Cultivo de protoscoleces e metacestóides de E. granulosus
- Prepare o meio de cultura da seguinte forma: Adicione 100 μg / mL de penicilina, 100 μg / mL de estreptomicina, 100 μg / mL de gentamicina, 4 mg / mL de glicose, 50 mM de tampão Hepes pH 7,5 e meio 199 para atingir o volume final desejado e misture suavemente por inversão.
- Transfira 5 mL do meio de cultura preparado para cada tubo de Leighton (Figura 2H-I).
- Adicionar os parasitas ao meio de cultura e incubar a 37 °C durante 5 dias sem mudar o meio. Incube os tubos Leighton em um ângulo de 15° para garantir uma distribuição uniforme do material biológico na superfície plana. Isso maximiza a exposição do parasita ao meio de cultura, evitando o contato com a rolha de borracha.
NOTA: Adicione 9.000–10.000 protoscólices ou 50 metacestóides (com diâmetros variando entre 5 mm e 15 mm distribuídos como 10 cistos por tubo). - Opcionalmente, adicione 20 μM de loperamida (uma concentração subletal) dissolvida em dimetilsulfóxido por 16–24 h no meio de cultura do parasita para aumentar o nível citosólico de cálcio e aumentar a liberação de EV pelo estágio larval de E. granulosus.
NOTA: Dado que um aumento nas concentrações intracelulares de cálcio aumenta a produção de EV, o tratamento do parasita com compostos que afetam a homeostase do cálcio aumentará a liberação de EV.
2. Purificação de vesículas extracelulares
- Coletar o meio de cultura do parasita de cada tubo de Leighton e transferi-lo para um tubo cônico de 15 mL.
NOTA: O meio de cultura pode ser armazenado por 24 h antes da primeira centrifugação com impacto mínimo na concentração ou distribuição de tamanho das vesículas. Os protoscoleces podem ser lavados três vezes com tampão PBS, colhidos e armazenados a -20 °C em tubos de 1,5 mL. - Centrifugar a 300 x g durante 10 min a 4 °C e transferir o sobrenadante para um novo tubo cónico de 15 ml com uma pipeta.
NOTA: Esta etapa remove protoscoleces mortos. Após cada etapa de centrifugação, certifique-se de que pelo menos 0,5 cm de sobrenadante permaneça acima do pellet para evitar contaminação. - Centrifugue o sobrenadante a 2.000 x g por 10 min a 4 ° C e transfira-o para novos tubos de 1,5 mL usando uma pipeta.
NOTA: Esta etapa remove detritos de células maiores. - Centrifugue a 10.000 x g por 30 min a 4 °C para remover detritos de células menores.
- Transferir o sobrenadante para um tubo adequado ao rotor da ultracentrífuga utilizando uma pipeta. Marque um lado de cada tubo com um marcador antes de colocá-lo no rotor da ultracentrífuga. Em seguida, coloque o tubo no rotor com o lado marcado voltado para cima.
NOTA: A marca serve como ponto de referência para localizar o pellet após a ultracentrifugação. Os tubos devem estar três quartos cheios e precisamente equilibrados; portanto, se necessário, adicione PBS. Se o volume do sobrenadante exceder a capacidade de um único tubo, divida as amostras em vários tubos e combine-os durante a ressuspensão. - Centrifugue a 100.000 x g por 1 h a 4 °C e despeje o sobrenadante em uma ação rápida. Deixe o tubo descansar de cabeça para baixo por 1 min. O pellet pode não ser visível nesta fase.
NOTA: O fator k para o rotor usado é 103. - Lave o pellet com pelo menos 3 mL de PBS para remover as proteínas contaminantes. Ressuspenda o pellet pipetando para cima e para baixo várias vezes do lado superior do tubo para o fundo em todas as faces do tubo, mas principalmente no lado marcado onde se espera que o pellet esteja.
NOTA: Se aplicável, agrupe o pellet ressuspenso derivado do mesmo sobrenadante em um único tubo. - Centrifugue a 100.000 x g por 1 h a 4 °C e despeje o sobrenadante em uma ação rápida. Deixe o tubo descansar de cabeça para baixo por 1 min.
NOTA: O fator k para o rotor usado é 103. - Ressuspenda o pellet em 30 μL de PBS seguindo o processo descrito na etapa 2.7.
NOTA: Neste ponto, recomenda-se medir a concentração total de proteína no pellet ressuspenso para estimar a quantidade de sEVs secretados. A concentração de proteínas pode ser determinada medindo a absorbância a 280 nm usando um espectrofotômetro de microvolume. - Transfira a amostra para um tubo de 1,5 mL. Congelar as vesículas extracelulares a -80 °C.
NOTA: Para preservar a integridade da vesícula para aplicações a jusante, congele o pellet ressuspenso o mais rápido possível e evite ciclos repetidos de congelamento e descongelamento.
3. Caracterização das vesículas isoladas
- Determinação do tamanho EV usando espalhamento dinâmico de luz (DLS)
NOTA: O espalhamento dinâmico de luz é um método confiável e sensível para avaliar o tamanho (com base no raio hidrodinâmico, Rh) e a forma de nanopartículas em fluidos complexos, independentemente de seu tipo. As medições de DLS e potencial zeta foram realizadas usando um feixe de laser monocromático He-Ne a 633 nm. Se a análise não for possível no dia da amostragem, as amostras podem ser congeladas num tampão pré-filtrado antes do armazenamento.- Descongele as amostras e mantenha-as no gelo até que as medições sejam feitas.
NOTA: O congelamento das amostras pode afetar a distribuição de partículas e a integridade dos sEVs. Portanto, evite ciclos de congelamento e descongelamento, pois eles podem levar a uma diminuição no sinal LS com alturas de pico reduzidas. - Filtre as amostras aquosas usadas para DLS através de um filtro de tamanho de poro de 0,2 μm.
NOTA: Nos experimentos LS, é essencial filtrar todas as soluções, tampões e amostras aquosas para remover partículas grandes e poeira, que podem interferir nas medições. - Diluir as amostras 1:10 a 1:50 em PBS pré-filtrado.
- Misture as amostras por inversão suave antes de cada medição para evitar sedimentação, pois a intensidade do LS pode diminuir devido ao maior tempo de processamento da amostra.
- Adicione 1 mL da amostra em uma cubeta limpa, posicionando o lado não fosco no caminho do laser à esquerda no instrumento. Feche a tampa e aguarde 2–3 min para o equilíbrio antes de medir a amostra.
- Meça o tamanho em termos do raio hidrodinâmico (Rh) antes de realizar a medição do potencial zeta. Registar as medições num único ângulo de dispersão (θ = 90° a 150°) a 25 °C ± 1 °C.
- Clique em Painel de Controle para verificar as leituras e iniciar a aquisição de dados.
NOTA: Com base nos valores médios de Rh e nas distribuições de tamanho avaliadas para sEVs, um pico entre 30 nm e 200 nm deve ser observado (Figura 3). Picos abaixo de 15 nm em Rh são atribuídos a ácidos nucléicos e proteínas em suspensão. Normalmente, as distribuições de tamanho são calculadas a partir do raio hidrodinâmico médio. No entanto, a média Z (tamanho médio de partícula na amostra), o índice de polidispersidade (PDI, que determina a heterogeneidade de tamanho de uma amostra) e a dependência angular da intensidade da luz espalhada também podem ser relatados.
- Descongele as amostras e mantenha-as no gelo até que as medições sejam feitas.
- Determinação da estrutura e tamanho de partícula por microscopia eletrônica de transmissão (MET)
NOTA: Realize microscopia eletrônica de transmissão de coloração negativa para avaliar o tamanho, a estrutura e a pureza dos sEVs, usando um protocolo padrão que inclui fixação, desidratação, incorporação de resina e contraste para preparações de sEV de montagem inteira.- Descongele as amostras concentradas de sEV da etapa 2.10 e mantenha-as no gelo.
- Fixe sEVs em tubos de 1,5 mL. Aplique cuidadosamente 5–10 μL de glutaraldeído a 2,5% em tampão cacodilato de sódio 0,1 M (pH 7) a ~5 μL do pellet de amostra sEV (concentração necessária de sEV ≈ 1 x 108–1 x 109 mL-1) e incube por 2 h a 4 °C.
NOTA: os sEVs podem ser armazenados por até 1 semana a 4 ° C em tampão de cacodilato de sódio 0,1 M antes do processamento posterior. Portanto, se forem necessários serviços técnicos externos para a análise de MET, envie as amostras fixas de sEV refrigeradas em tubos de 1,5 mL. - Deposite 5 μL dos pellets ressuspensos nas grades de cobre EM revestidas com carbono Formvar de 300 malhas. Prepare duas ou três grades para cada amostra.
- Deixar a amostra adsorver durante 20 min num ambiente seco e remover o excesso de amostra da grelha com papel de filtro.
- Coloque gotas de 100 μL de PBS em uma folha de filme. Usando uma pinça limpa, transfira as grades (com o lado da amostra adsorvido para baixo) para as gotas de PBS para lavagem.
- Seque o lado oposto da amostra adsorvida, certificando-se de que o lado da amostra das grades não seque durante nenhuma das etapas a seguir.
NOTA: Para todas as etapas subsequentes, coloque gotas de reagentes em um filme plano e transfira as grades para as gotas usando uma pinça. - Transfira as grades para uma gota de 50 μL de glutaraldeído a 1% por 5 min.
- Lave as grelhas com uma gota de 100 μL de água destilada e deixe repousar durante 3 min. Repita nove vezes para um total de dez lavagens.
- Compare as grades de amostra com uma gota de 50 μL de solução de acetato de uranila a 1% p / v, pH 7, por 1 min.
- Contraste e incorpore as grades em uma mistura de 100 μL de acetato de uranila a 4% e 900 μL de metilcelulose a 2%.
- Seque as grades ao ar por 5 a 10 minutos enquanto elas permanecem no loop e observe-as com um microscópio eletrônico de 80 a 100 kV com resolução de 0,2 nm e ampliação de 100.000x.
- Armazene as grades em caixas de armazenamento seco para armazenamento de longo prazo.
4. Geração de células dendríticas derivadas da medula óssea
NOTA: Este procedimento deve ser realizado em camundongos jovens, que são caracterizados por sistemas hematopoiéticos robustos com capacidades ativas de proliferação e diferenciação. Em contraste, camundongos mais velhos exibem declínios na função hematopoiética, reservas reduzidas de células-tronco, interações de nicho alteradas e um reservatório de memória mais desenvolvido, que é crucial para imunidade de longo prazo e resposta a patógenos ou alterações relacionadas à idade, como imunossenescência.
- Eutanasiar um camundongo CF-1 fêmea de 5 a 8 semanas de idade de acordo com as diretrizes éticas institucionais, minimizando o sofrimento animal.
- Pulverize o camundongo com etanol antes de colocá-lo em uma capa de cultura de tecidos.
NOTA: As etapas a seguir devem ser executadas em condições estéreis. - Coloque o mouse em uma placa de dissecação na posição supina. Usando uma pinça e uma tesoura de dissecação, faça uma incisão vertical em "T" acima da uretra e estenda-a horizontalmente até o topo das extremidades inferiores, tomando cuidado para não romper o peritônio ou perfurar nenhum órgão, especialmente o intestino.
- Separe a pele ao longo de ambos os membros posteriores para expor os ossos e tecidos das pernas usando uma pinça. Com as mãos, retire a pele de cada perna empurrando do tornozelo em direção ao abdômen, puxando a pele para o lado oposto. Ambas as pernas ficarão livres de pele.
NOTA: Descarte o corpo do camundongo no saco de resíduos de patógenos. - Usando tesoura e fórceps, remova cuidadosamente o fêmur e a tíbia, evitando a quebra. Prenda a ponta de cada osso com uma pinça e corte os tendões para remover as fáscias musculares ao redor dos ossos. Limpeza completa do tecido muscular com guardanapos de papel.
- À medida que cada osso é removido, coloque-o em um tubo estéril de 50 mL contendo 2 mL de meio completo preparado com meio RPMI suplementado com 5% de FBS, 100 U / ml de penicilina, 100 U / mL de estreptomicina e 10 μg / mL de gentamicina para remover os detritos. Em seguida, aspirar e descartar o meio de cultura e lavar os ossos duas vezes com etanol a 70% por 5 min.
- Transfira os ossos para uma placa de Petri estéril.
- Corte as duas epífises ósseas usando uma tesoura de dissecação afiada para acessar as células da medula óssea.
- Lave cuidadosamente as células da medula óssea de cada um dos quatro ossos em uma placa de Petri estéril usando uma agulha de 25 G conectada a uma seringa de 20 mL contendo meio completo. Os ossos ficarão mais transparentes à medida que a medula óssea for extraída.
NOTA: Um volume de 20 mL do meio completo deve ser suficiente para eluir as células da medula óssea dos dois fêmures e tíbias. - Homogeneizar suavemente o meio com a medula eluída pipetando para remover o tecido conjuntivo ósseo e os nódulos celulares. Em seguida, transfira a amostra para um tubo cônico estéril de 50 mL, passando as células por um filtro estéril de células de polipropileno de 70 μm para remover o tecido conjuntivo e os restos ósseos.
- Centrifugue as células a 450 x g durante 7 min a 4 °C. Remova e descarte cuidadosamente o sobrenadante, garantindo que o pellet permaneça aderido à parede do tubo.
- Incube as células por 1 min em temperatura ambiente (RT) e, em seguida, ressuspenda-as em 500 μL de tampão de lise de glóbulos vermelhos (RBC). Neutralize o tampão de lise adicionando 3 mL de meio completo.
- Centrifugue as células a 450 x g durante 7 min a 4 °C. Rejeitar o sobrenadante e ressuspender o sedimento em 5 ml de meio completo.
- Passe a suspensão celular através de um filtro estéril de células de polipropileno de 70 μm para um tubo cônico estéril de 50 mL para remover os agregados celulares dos eritrócitos lisados.
- Conte as células usando um hemocitômetro.
- Adicione 300 ng/mL de ligante tirosina quinase 3 (Flt3L) referente murino recombinante relacionado a Fms ao meio de cultura.
- Coloque as células em uma concentração de 1 x 106 células/mL em uma placa multipoços.
- Incubar as células durante 7 dias a 37 °C numa atmosfera humidificada com 5% de CO2.
NOTA: Evite agitar as células enquanto elas se diferenciam e crescem para evitar a maturação espontânea. - No dia 3, remova 1 mL de meio de cada poço (evitando perturbação das células) e substitua-o por 1 mL de meio completo fresco pré-aquecido suplementado com 150 ng/mL de Flt3L murino recombinante.
5. Interação entre células dendríticas derivadas da medula óssea e vesículas extracelulares de E. granulosus
- Coloração da membrana da vesícula extracelular
- Descongele os sEVs armazenados na etapa 2.10 e mantenha-os no gelo.
- Ressuspenda 10 μL de sEVs purificados em 10 μL de veículo de rotulagem (Diluente C).
- Adicione 20 μL de solução de corante 2x PKH26 para atingir uma concentração final de 2 μM. Misture delicadamente usando uma pipeta e incube por 35 min a 37 ° C no escuro.
NOTA: A solução de corante 2x PKH26 (4 μM) deve ser preparada imediatamente antes da coloração, adicionando 0,5 μL de solução de corante etanólico PKH26 a 125 μL de diluente C. - Misture delicadamente a cada 3–5 minutos durante a incubação para garantir uma coloração homogênea.
- Adicione 40 μL de BSA 1% e incube por 10 min em RT para interromper o processo de coloração.
- Lave os sEVs com 1 mL de PBS e centrifugue a 100.000 x g por 1 h a 4 ° C para remover o excesso de corante.
NOTA: O fator k para o rotor é 103. - Ressuspenda o pellet em 90 μL de PBS seguindo o protocolo descrito na etapa 2.7.
- Estimulação de células dendríticas derivadas da medula óssea murina com vesículas extracelulares de E. granulosus
- Colha células dendríticas derivadas da medula óssea (BMDCs) do poço da placa de cultura e transfira-as para tubos de 1,5 mL.
NOTA: Manuseie com cuidado para evitar a maturação celular espontânea. - Centrifugue o meio a 450 x g por 5 min para pellet as células.
NOTA: Reserve os sobrenadantes da centrifugação para recolocar as células em placas nas etapas subsequentes da análise de citometria de fluxo. - Ressuspenda os BMDCs em 30 μL de sEVs não corados da etapa 2.10 para análise de citometria de fluxo ou em 90 μL de sEVs corados contendo PBS da etapa 5.1.7. para microscopia confocal. Incubar durante 30 min a 37 °C numa atmosfera humidificada com 5% de CO2. Misture delicadamente a amostra a cada 10 min.
NOTA: Para garantir o contato efetivo entre BMDCs e sEVs, os primeiros 30 minutos de incubação devem ser realizados em um volume mínimo usando tubos de 1,5 mL. - Para microscopia confocal, transfira as células para uma lamínula de vidro tratada com azul Alcian (12 mm de diâmetro) colocada em uma placa de 24 poços. Incubar durante mais 30 minutos a 37 °C numa câmara humidificada com 5 % de CO2.
NOTA: O tratamento com azul de Alciano confere uma carga positiva à lamínula, facilitando a aderência das membranas plasmáticas carregadas negativamente dos BMDCs.- Para preparar as lamínulas, mergulhe-as em um corante Alcian blue 8 GX a 1% filtrado e aqueça-as no micro-ondas por 1–2 min sem ferver. Incube-os na solução quente por 10 min, girando a cada 2 a 3 min.
- Em seguida, lave as lamínulas com água destilada deionizada para remover o excesso de azul Alcian e seque-as em papel toalha. Por fim, autoclave as lamínulas e guarde-as em condições estéreis até o uso.
- Para a análise por citometria de fluxo, transferir os BMDCs-sEVs de volta para o mesmo poço de onde foram colhidos (ver etapa 5.2.1), adicionar os sobrenadantes reservados da etapa 5.2.2 e incubar por 18 h a 37 ° C em uma atmosfera umidificada com 5% de CO2.
NOTA: Deixe aproximadamente 500 μL de meio no poço para evitar a dessecação das células restantes após a coleta. - Use controles positivos e negativos para avaliar a maturação do BMDC. Estimule as células com 100 ng/mL de lipopolissacarídeo (LPS) por 18 h como controle positivo. Para um controlo negativo da endocitose, incubar BMDCs com sEVs a 4 °C. Além disso, inclua um controle de células dendríticas não estimulado.
- Colha células dendríticas derivadas da medula óssea (BMDCs) do poço da placa de cultura e transfira-as para tubos de 1,5 mL.
- Microscopia confocal de vesículas extracelulares de E. granulosus capturadas e internalizadas por células dendríticas derivadas da medula óssea.
- Uma vez terminado o período de incubação descrito no passo 5.2.4, aspirar e rejeitar o PBS da lamínula.
- Fixe os BMDCs adicionando 100 μL de paraformaldeído (PFA) a 4% sobre a lamínula e incube por 10 min em RT.
NOTA: Certifique-se de que o volume mantenha a tensão superficial na lamínula. - Aspire e descarte o PFA e, em seguida, lave a lamínula três vezes com PBS-BSA 2%.
- Adicione 100 μL de PBS contendo anticorpo anti-MHC classe II-FITC diluído 1/100 e incube por 1 h em RT no escuro.
- Aspirar e rejeitar a solução de anticorpos e lavar a lamínula três vezes com PBS-BSA 2%.
- Adicione 100 μL de DAPI de 50 ng/mL e incube por 30 min em temperatura ambiente em uma câmara úmida para contracorar os núcleos.
- Aspirar e rejeitar a solução de corante e lavar a lamínula três vezes com PBS-BSA 2 %.
- Remova a lamínula usando uma pinça de ponta fina curva e seque-a em uma toalha de papel para eliminar o excesso de líquido.
- Monte a lamínula voltada para baixo em uma lâmina de vidro usando um meio de montagem composto de álcool polivinílico e glicerol. Deixe secar por 2 h a 37 °C ou durante a noite a 4 °C no escuro.
- Remova quaisquer bolhas de ar entre a lamínula e a lâmina de vidro pressionando suavemente a lamínula com uma pinça.
- Observe as amostras montadas sob um microscópio confocal usando uma objetiva de imersão em óleo de 60x com um comprimento de onda de excitação/emissão de 485/538 nm para FITC, 358/461 nm para DAPI e 551/567 nm para PKH26.
- Avaliação fenotípica de células dendríticas derivadas da medula óssea estimuladas por vesículas extracelulares por citometria de fluxo
- Após o período de incubação descrito na etapa 5.2.5, colher os BMDC lavando o meio várias vezes para cima e para baixo com uma pipeta.
- Colete os BMDCs contendo meio e coloque-os em tubos de 1,5 mL.
- Centrifugue a 450 x g durante 5 min a 4 °C para peletar as células.
NOTA: Opcionalmente, para analisar a secreção de citocinas, remova os sobrenadantes com uma pipeta, transfira-os para novos tubos de 1,5 mL e armazene-os a -20 ° C para outros testes de ensaio imunoenzimático (ELISA). - Ressuspenda os BMDCs em 100 μL de PBS contendo isotiocianato de fluoresceína (FITC), aloficocianina (APC) ou mAbs conjugados com ficoeritrina direcionados a CD11c, CD40, CD80, CD86, MHC classe I e MHC classe II e incube por 15 min a 4 ° C no escuro.
- Lavar os BMDCs com PBS e centrifugar a 450 × g durante 5 min a 4 °C.
- Ressuspender os BMDCs em 500 μL de PFA a 1% para fixá-los e armazená-los a 4 °C até a aquisição em um citômetro de fluxo.
Resultados
Um fluxograma resumindo as principais etapas para a manutenção de culturas puras do estágio larval de E. granulosus , o isolamento e caracterização de sEVs e sua captação por células dendríticas murinas são mostrados na Figura 1. Para alcançar alta produção de sEV a partir de protoscoleces e metacestóides de E. granulosus , um método de cultura in vitro previamente desenvolvido em laboratório foi empregado para maximizar a sobrevivência e a homeostase metabólica do parasita estudado (Figura 2).

Figura 1: Visão geral dos procedimentos experimentais para obtenção de sEVs e BMDCs de E. granulosus . Representações esquemáticas descrevendo as etapas seguidas neste protocolo desde a obtenção e cultivo do material parasitário (PASSO 1), isolamento (PASSO 2) e caracterização de EVs do parasita (PASSO 3) até a geração de BMDCs (PASSO 4) e sua interação com E. granulosus sEVs (PASSO 5). Clique aqui para ver uma versão maior desta figura.
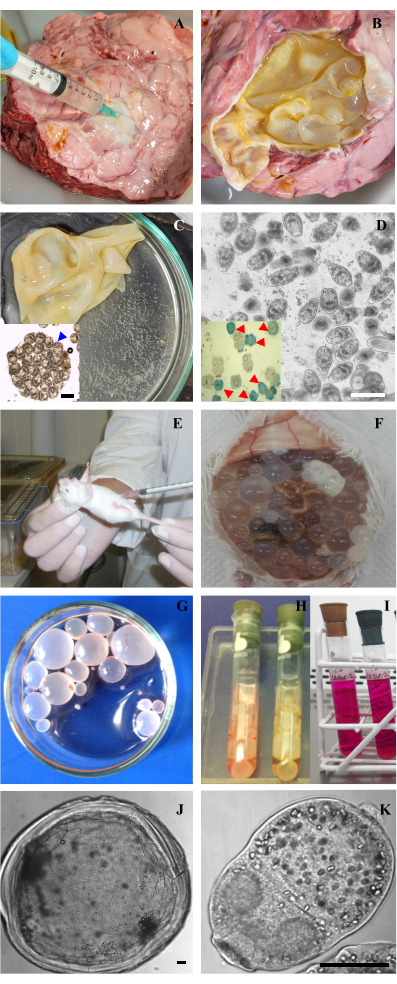
Figura 2: Aquisição de amostras e cultivo in vitro de protoscoleces e metacestóides de Echinococcus granulosus. (A) Punção de cisto hidático pulmonar de bovinos para extração do líquido hidático. (B) Cisto hidático aberto com sua membrana exposta. (C) Membrana hidática e seu fluido hialino com cápsulas de cria e protoscólices livres denominados "areia hidática". Inserção: Cápsula de cria com protoscólices no interior com morfologia preservada. (D) Microscopia óptica de protoscólices vitais após a remoção de protoscólices mortos. Barra 200 μm. Inserção: Coloração com azul de metileno de protoscólices mostrando protoscólices vivos (translúcidos) e protoscólices mortos (corados de azul, indicados com pontas de setas vermelhas). (E) Inoculação de protoscólices na cavidade peritoneal de um camundongo CF-1. (F) Metacestóides dentro da cavidade abdominal se desenvolveram após 7 meses de inoculação com protoscólices. (G) Cistos isolados de um camundongo e lavados com PBS em uma placa de Petri. (H, I) Manutenção in vitro de metacestóides e protoscólices em tubos de Leighton com meio M199. (J, K) Microscopia óptica de um metacestódeo e um protoescólex de E. granulosus. As barras indicam 50 μm. Clique aqui para ver uma versão maior desta figura.
A caracterização das EVs purificadas do estágio larval de E. granulosus é mostrada na Figura 3. Os EVs isolados seguindo o protocolo atual eram principalmente sEVs com diâmetros variando de 50 a 200 nm, conforme determinado por DLS (Figura 3A) e confirmado por MET (Figura 3B). A análise TEM também revelou que os sEVs exibiam a morfologia típica em forma de taça de vesículas semelhantes a exossomos (Figura 3B). Além disso, o TEM confirmou que as concentrações subletais de loperamida podem atuar como um intensificador da liberação de EV, conforme mostrado por uma proporção aumentada de sEVs em amostras tratadas com loperamida em comparação com os controles. Da mesma forma, a maior abundância de sEVs obtidos de parasitas tratados com loperamida foi ainda apoiada por medições de concentração de proteína (11 ± 1,5 μg / μL em comparação com 6 ± 1 μg / μL nos controles, Figura 3C).

Figura 3: Caracterização de vesículas extracelulares purificadas do estágio larval de E. granulosus . (A) Gráfico de espalhamento dinâmico de luz (DLS) representando a distribuição de tamanho de EVs isolados de protoscoleces tratados com controle (Co) e loperamida (Lp) (PTS). (B) Fotografias de microscopia eletrônica de transmissão (TEM) de EVs corados negativamente purificados do controle (a) ou PTS tratado com loperamida (d). As barras de escala indicam 50 nm. Arrowheds indicam abundantes vesículas semelhantes a exossomos com a estrutura típica em forma de taça. (b-c) e (e-f) corresponde a amplificações de áreas encaixotadas de (a) e (d), respectivamente. (C) Concentração de proteína do pellet de ultracentrifugação de sete ensaios independentes. Os dados são apresentados como a média ± DP. O asterisco indica diferenças significativas (Kruskal-Wallis com pós-teste de Dunn, p < 0,05). Clique aqui para ver uma versão maior desta figura.
A Figura 4 ilustra a progressão da geração de BMDC por meio de observações de variações na quantidade e morfologia das células da medula óssea desde o estabelecimento inicial da cultura até a diferenciação completa. No dia 0, as células hematopoiéticas foram cultivadas em meio completo a uma densidade de 1× 106 células/mL suplementadas com 300 ng/mL de Flt3L, uma citocina e fator de crescimento que ativa os progenitores hematopoiéticos para proliferar e se diferenciar na morfologia das células dendríticas. Nos dias 1-2, as células ainda eram pequenas e arredondadas sem mudanças morfológicas significativas, embora sua quantidade tivesse aumentado. Entre os dias 3-5, ocorreu remodelação ativa do citoesqueleto, resultando em formas heterogêneas e alongadas com aumento das extensões citoplasmáticas (dendritos). Nesse ponto, as culturas continham células aderentes com extensões citoplasmáticas pronunciadas, células não aderentes sofrendo alterações morfológicas durante a diferenciação de células dendríticas e células esféricas não aderentes que permaneceram sem resposta à indução de citocinas (Figura 4). Após os dias 6-7, 80% a 90% das culturas consistiram principalmente em BMDCs em estado estacionário e totalmente diferenciados. Essas células exibiram uma forma estrelada com extensos processos citoplasmáticos otimizados para captura e apresentação de antígenos. No dia 7, os BMDCs foram colhidos para análise de seu fenótipo e realização de ensaios funcionais.
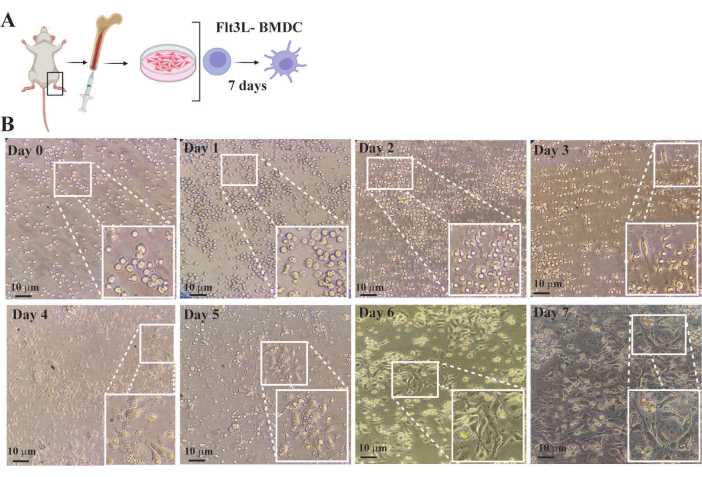
Figura 4: Monitoramento da diferenciação de células dendríticas derivadas da medula óssea FTL3L usando um microscópio óptico invertido convencional. (A) Representação esquemática da purificação de precursores hematopoiéticos da medula óssea de camundongos e cultura de células em meio completo suplementado com flt3L B- Imagens de cultura de células da medula óssea obtidas em diferentes momentos. As inserções são regiões ampliadas da área encaixotada de cada imagem. (B) Dia 0: Imagem de células hematopoiéticas recentemente purificadas da medula óssea. Observa-se que, embora a população seja heterogênea, a maioria são células com morfologia arredondada e tamanho pequeno. Dias 1-5: imagens de cultura mostrando o aumento no número de células e mudanças na morfologia devido à proliferação ativa induzida pela ativação da via de sinalização FLT3. A morfologia celular passa de arredondada para alongada com um aumento progressivo nas extensões citoplasmáticas (dendritos). Essas mudanças são mais perceptíveis quando as células aderem aos poços da placa de cultura. Dias 6-7: imagens mostrando BMDCs totalmente diferenciadas em estado estacionário caracterizadas por forma irregular com um núcleo proeminente e numerosas projeções de ramificação fina, o citoplasma é altamente granular com vesículas envolvidas na apresentação do antígeno e na resposta imune. Bar representa 10 μm. Clique aqui para ver uma versão maior desta figura.
Uma vez que as células dendríticas são mediadores essenciais na ativação e orientação da resposta imune induzida, é crucial realizar análises funcionais dessas células para revelar os papéis potenciais dos sEVs nas interações parasito-hospedeiro. O protocolo aqui apresentado confirma que os BMDCs capturam parasitas-sEVs após 1 hora de incubação a 37 °C. Curiosamente, os sEVs parecem estar localizados em compartimentos endossômico-lisossômicos, onde as moléculas MHCII pré-formadas são armazenadas à medida que são observadas colocalizando (Figura 5).
Além disso, BMDCs estimulados por corante sem EVs foram incluídos como controles negativos para validar a especificidade da marcação. Apenas fluorescência extracelular inespecífica e 3% a 4% das células com sinal de corante difuso foram observadas em comparação com mais de 40% das células marcadas positivamente expostas a sEVs corados.

Figura 5: Microscopia confocal de imunofluorescência de BMDCs mostrando captação eficiente de sEVs marcados e recrutamento de MHC classe II para endossomos. (A) Representação esquemática do protocolo descrito no item 5.3 mostrando a estimulação de sEVs marcados com PKH26 em BMDCs. (B) Imagem confocal mostrando um controle negativo de BMDCs estimulados por PKH26 sem a presença de sEVs (vermelho, PKH26) e (DAPI azul). Nenhum sinal fluorescente do corante dentro da célula foi observado sem os sEVs. (C) Canais separados de imagens confocais mostrando BMDCs estimuladas com sEVs corados: microscopia de contraste de interferência diferencial (DIC), DAPI (azul, núcleos), PKH26 (vermelho, sEVs) e FITC (verde, MHC classe II). As barras de escala representam 10 μm. Clique aqui para ver uma versão maior desta figura.
Discussão
O fluxo de trabalho do protocolo para cultivar parasitas, isolar sEVs derivados de parasitas, diferenciar células dendríticas da medula óssea e analisar a captação de sEV por essas células é descrito na Figura 1. O objetivo foi descrever detalhadamente cada seção do protocolo que pode ser realizada como um todo ou separadamente, destacando as principais considerações para garantir a implementação da metodologia. A análise da população de EVs obtida de organismos parasitas completos tem um impacto concreto no estudo da inter-relação parasito-hospedeiro, e precisamente neste contexto, este protocolo experimental foi delineado.
Os novos insights sobre doenças parasitárias foram prejudicados pela dificuldade de cultura in vitro de alguns desses parasitas. Como os helmintos parasitas não conseguem completar seus ciclos de vida em condições artificiais, eles só podem sobreviver em uma cultura como organismos completos. Portanto, a solução proposta por este protocolo para estudar a interface verme-hospedeiro é realizar de forma independente o cultivo de cada forma parasitária (verme adulto e diferentes formas larvais) para enriquecer e isolar sEVs, e então confrontá-los com as células dos órgãos-alvo ou células do sistema imunológico do hospedeiro, permitindo que sejam internalizados ou fagocitados, respectivamente. Além disso, um passo crítico para estabelecer uma cultura de helmintos para isolar EVs é selecionar estritamente parasitas vivos para iniciar a cultura in vitro e mantê-los em incubações o mais curtas possível para limitar a morte do parasita e a geração de membranas residuais livres23. Para fazê-lo em E. granulosus, protoscoleces recuperados de cistos hidáticos são submetidos a lavagem intensiva com PBS frio em tubos de vidro de pequeno diâmetro. Durante a dispersão vigorosa com uma pipeta, os protoscoleces vivos sedimentam rapidamente. Assim, eles são separados dos protoscoleces não viáveis que permanecem suspensos por mais tempo na coluna líquida do tubo, permitindo que sejam capturados e eliminados da mistura. De acordo com esse propósito, durante cada etapa de lavagem, a mistura vigorosa com uma pipeta também garante a quebra das cápsulas de cria e a liberação de protoscólices presos de seu interior, libertando-os da membrana circundante. As culturas do parasito são estabelecidas em tubos de vidro do tipo Leighton para evitar a adesão dos sEVs e com uma porção plana para permitir um estabelecimento disperso da cultura do parasito. No caso de metacestóides obtidos da cavidade peritoneal de camundongos, é essencial separar a camada adventícia que os reveste e realizar várias lavagens com PBS suplementado com antibióticos para remover células associadas e microbiota intestinal, o que pode influenciar a pureza dos sEVs derivados do próprio helminto, como também descrito por White et al.23. Os tubos são obstruídos com rolhas de borracha estéreis, que contribuem para gerar uma atmosfera deficiente em oxigênio necessária para emular o metabolismo fermentativo que esses parasitas mantêm in vivo. Finalmente, o meio M199 é muito apropriado como meio de manutenção para o estágio larval do cestóide a longo prazo24,25. O meio possui os componentes mínimos como sais, glicose e aminoácidos essenciais e, além disso, contém aminoácidos não essenciais, colesterol, pirimidinas, vitaminas solúveis em água e gordura e precursores de ácidos nucléicos, incluindo tiamina, riboflavina e biotina. Todos esses nutrientes promovem a manutenção das funções orgânicas básicas e a viabilidade desses parasitas. O M199 é particularmente usado para células não transformadas, embriões, explantes primários e culturas de órgãos, sendo ideal para o cultivo de massa celular26. Especificamente, quando usado como meio de cultura de manutenção, o M199 deve ser aplicado sem suplementação de soro fetal bovino, pois promove a obtenção de protoscólices vesicularizados e sua desdiferenciação em microcistos27,28.
Todas as condições usadas para culturas de parasitas precisam ser documentadas para garantir a reprodutibilidade dos resultados que envolvem recuperação e absorção celular de sEVs. Em particular, um aspecto que influencia a produção de EV é a adição de compostos que afetam a homeostase do cálcio à cultura, uma vez que aumentam a exocitose dependente de cálcio29,30. Aqui, a adição de loperamida, um indutor de cálcio intracelular em E. granulosus19,31, às culturas de parasitas é proposta para aumentar a liberação de sEV. Este método aumenta o número de vesículas em cestóides (Figura 3) e pode ser uma boa estratégia para melhorar a produção em sistemas celulares com baixa liberação de EV. No entanto, uma vez que essa estratégia, como outras modificações físicas ou químicas da cultura, pode alterar as propriedades e funcionalidades do EV, deve-se considerar uma atenção cuidadosa ao realizar análises de alto rendimento, como proteômica.
As culturas de cestóides permitem atingir concentrações de EV de ordens de alta magnitude, uma vez que sua superfície tegumentar externa é uma camada citoplasmática sincicial adaptada aos principais processos de exocitose e endocitose32. A escala da preparação do EV estará sujeita aos requisitos experimentais. Um total de 9.000 protoscólices produzem, em média, 30 μL de sEVs com uma concentração de 1–2,5 ' 108 sEV/mL, o suficiente para realizar análises DLS, TEM e LC-MS-MS em paralelo. Uma limitação do protocolo é a obtenção de uma grande quantidade de vesículas a partir de metacestóides devido à presença de sua camada laminar, o que dificulta a liberação de vesículas no meio. Portanto, grandes quantidades de parasitas são necessárias (etapa 1.3.3)11. Uma abordagem alternativa é também analisar os VEs do líquido hidático, conforme relatado em outros estudos 11,33,34,35,36.
Em linha com a tendência mais ampla observada na pesquisa de EV, a maioria dos estudos sobre EVs de helmintos até o momento empregou a ultracentrifugação de produtos excretores / secretores como o principal método para isolamento e separação de EV37. Nesse protocolo, a ultracentrifugação foi utilizada para isolar os sEVs, que é considerado o método padrão-ouro para a recuperação de EVs, embora possa implicar na inclusão de contaminantes em conjunto com os EVs15. Uma limitação deste método é a remoção de contaminantes solúveis. Como os sEVs são maiores que os contaminantes solúveis, uma alternativa para melhorar a purificação é incorporar etapas adicionais, como o uso de cromatografia de exclusão de tamanho (SEC) 38 , 39 . No entanto, quando o isolamento de EVs é necessário para análises funcionais, como estudar a comunicação parasita-hospedeiro helminto, identificar estritamente a população de EVs não é tão crítico, pois todos eles carregam carga antigênica. Assim, dependendo da pureza necessária para uma experimentação posterior, o processo de isolamento pode terminar na ultracentrifugação, como aqui realizado, ou pode ser combinado com outros métodos, como filtração para eliminar grandes contaminantes, centrifugação com gradiente de densidade de sacarose ou iodixanol ou cromatografia de exclusão de tamanho, que permitem não apenas limpar contaminantes, mas também separar diferentes populações de EV37, 38,40. Independentemente disso, o método empregado aqui é simples e representa a principal escolha para colher e enriquecer sEVs de parasitas39. Ele fornece um alto rendimento de sEVs a um custo relativamente baixo, pois requer apenas um laboratório equipado com uma ultracentrífuga na qual tubos reutilizáveis podem ser usados.
A descrição da característica dos EVs isolados é fundamental para determinar a concentração, tamanho, qualidade e subtipo de EVs. Além disso, a análise da composição da proteína coopera para determinar quais subpopulações de EV são enriquecidas na amostra, bem como estima a presença de possíveis contaminantes. A caracterização da VE pode ser realizada por diferentes métodos que frequentemente requerem equipamentos e instalações especializadas41. Aqui, o tamanho dos sEVs do parasita foi analisado usando DLS, que fornece dados confiáveis em suspensões monodispersas, mas é menos preciso em suspensões com EVs de distribuição ampla42. Portanto, uma alternativa poderia ser o uso de outros métodos, como Análise de Rastreamento de Nanopartículas (NTA), que determina com precisão o tamanho e a quantidade de vesículas, Sensor de Pulso Resistivo Sintonizável (TRPS), que oferece uma faixa dinâmica mais ampla do que o NTA, ou o Citômetro de Nanofluxo (NanFCM), que possui maior sensibilidade do que a citometria de fluxo convencional 43,44,45. Além disso, como parte da rotina experimental e por recomendações de especialistas, a técnica TEM permite determinar integralmente a pureza, o rendimento e o tamanho dos EVs obtidos, essencialmente em colheitas de EV altas46. Além disso, o exame por análise MET é particularmente recomendado quando, após a ultracentrifugação, não é possível visualizar o pellet EV para verificar a composição do material recuperado.
Essas questões destacam a importância de utilizar técnicas robustas para o isolamento e caracterização abrangente de EVs derivados de helmintos, o que poderia facilitar a identificação de marcadores específicos para rastrear seu destino e, por sua vez, permitir a avaliação de seus papéis funcionais.
As vesículas extracelulares purificadas de E. granulosus representam transportadores naturais de antígenos com várias proteínas antigênicas caracterizadas e desconhecidas9. Esses sEVs sozinhos podem estimular células apresentadoras de antígenos distribuídas por diferentes tecidos e órgãos linfóides secundários do hospedeiro. As células dendríticas são células apresentadoras de antígenos profissionais únicas que podem exibir antígenos para células T virgens, determinando o tipo de resposta imune in vivo47,48.
Este manuscrito descreve um protocolo para detalhar um método para gerar células dendríticas a partir de culturas de medula óssea de camundongos adaptado de uma pesquisa publicada anteriormente49. Aqui, um método bem estabelecido para estudos imunológicos é proposto com base na cultura in vitro de BMDCs murinos conduzidos por Flt3L, onde o isolamento da medula óssea é uma etapa essencial para alcançar uma cultura in vitro bem-sucedida50. Dado que vários protocolos de isolamento de células da medula óssea produzem populações celulares heterogêneas, as culturas de BMDC devem ser analisadas por citometria de fluxo durante o primeiro tempo de diferenciação de Flt3L para estabelecer o fenótipo celular para experimentos planejados 51,52,53. A caracterização fenotípica do BMDC sob o efeito Flt3L indica que a maioria são células dendríticas convencionais (CD11b+, CD11c+, CD172a+), que se assemelham mais às células dendríticas encontradas in vivo que carregam antígenos exógenos. Enquanto uma pequena porcentagem de BMDC corresponde a células dendríticas plasmocitoides (CD11c+, B220+, SinglecH+) e células dendríticas semelhantes a CD8+ (CD11c+, CD24+ e CD172a-)11,53.
Algumas etapas preocupantes comuns são o baixo rendimento de BMDCs em cultura, que pode resultar de quebra óssea durante o preparo, extração ineficiente da medula óssea, formação de aglomerados celulares, condições de cultura abaixo do ideal (por exemplo, composição do meio, temperatura) ou estimulação insuficiente de citocinas. Para resolver esses problemas, algumas alternativas são cortar atrás das epífises, garantir a lavagem completa das células da medula óssea de ambos os lados dos fêmures e tíbias, suspender exaustivamente a medula óssea antes de passar pelo filtro celular, usar citocinas recém-preparadas na concentração recomendada e manter a esterilidade e a estabilidade do pH do meio de cultura.
É imperativo garantir o estado de 'repouso' da linha de base da célula dendrítica antes de induzir sua maturação com contato com antígeno. As células dendríticas não apenas reconhecem uma ampla gama de antígenos externos (PAMPs, padrão molecular associado a patógenos) e antígenos internos (DAMPs, padrão molecular associado ao perigo), mas também mudanças mínimas na cultura de células (pH, agitação leve, densidade celular) podem induzir sua maturação. Por esses motivos, os movimentos e vibrações da cultura de células devem ser minimizados durante o manuseio na centrífuga ou incubadora. Além disso, a pipetagem deve ser suave, sem gerar bolhas no meio. Além disso, a manutenção de culturas primárias por mais de 8 dias pode ativar as células dendríticas e promover a morte celular. Além disso, uma densidade celular maior que 2,5 x 106 produz maior expressão de MHCII54 e aumenta a maturação antes do contato com o antígeno. Além disso, todos os reagentes utilizados devem estar completamente livres de endotoxinas ou LPS, consequência da contaminação prévia com bactérias gram-negativas, pois o LPS induz estimulação ou exaustão das células dendríticas23,55. Para manter a esterilidade durante a manipulação das culturas de medula óssea, além de incorporar o uso de antibióticos no meio, deve-se utilizar continuamente spray de etanol a 70% na superfície, mãos enluvadas e objetos do gabinete, preservando o contato entre o etanol e as células da medula óssea. Antes de expor os instrumentos aos ossos ou células, certifique-se de que o etanol tenha evaporado e seque-os ao ar, pois é venenoso para as células da medula óssea.
As células dendríticas promovem sua maturação e produção de citocinas após reconhecer e fagocitar sEVs. Os sEVs de E. granulosus induzem a expressão de IL-12, favorecendo o perfil Th19. Se a maturação fenotípica das células dendríticas for deficiente, o tempo ou a concentração do estímulo alcançado com os sEVs adicionados devem ser otimizados. A microscopia confocal é uma ferramenta poderosa empregada para visualizar a internalização e colocalização da carga com moléculas de MHC nos endossomos das células dendríticas. Além disso, após pelo menos 8 h da captação de sEVs, a citometria de fluxo também pode ser usada para medir citocinas intracelulares e moléculas de superfície como CD40, CD80, CD86 e MHCII em células dendríticas maduras 11,13.
Uma extensa pesquisa empregando uma ampla gama de técnicas fornecerá uma compreensão mais profunda de como o tamanho, a origem e a carga do parasita EV podem interferir e modificar as respostas do hospedeiro.
Divulgações
Os autores declaram não ter conflitos de interesse.
Agradecimentos
Os autores reconhecem que Lic. Cecilia Gutiérrez Ayesta (Servicio de Microscopía Electrónica, CONICET, Bahía Blanca, Argentina) e Lic. Leonardo Sechi e Lic. Eliana Maza (INIFTA, Universidad Nacional de La Plata, Argentina) pela assistência técnica com microscopia eletrônica de transmissão e espalhamento dinâmico de luz, respectivamente. Agradecemos também à Dra. Graciela Salerno, Dra. Corina Berón e Dr. Gonzalo Caló pelo uso da ultracentrífuga no INBIOTEC-CONICET-FIBA, Argentina. Os autores agradecem a Lic. Kelly (SENASA, Mar del Plata, Argentina) e Lic. H. Núnez García (CONICET, Universidad Nacional de Mar del Plata, Argentina) por sua colaboração na avaliação do bem-estar de camundongos, e Med. Vet. J. Reyno, Med. Vet. S. Gonzalez e Med. Vet L. Netti por sua contribuição na obtenção de material parasitário. Este trabalho, incluindo os custos de experimentação, reagentes e equipamentos, foi apoiado pelo PICT 2020 nº 1651 financiado pela ANPCyT.
Materiais
| Name | Company | Catalog Number | Comments |
| 1.5 mL tubes | Henso | N14059 | |
| 24-well plate | JetBiofil | CAP011024 | Polystyrene, flat bottom, Sterile |
| 6-well plate | Henso Medical Co. Ltd. | N14221 | Flat-shape bottom, PS material, Sterile |
| 70 mm polypropylene cell strainer | Biologix Group Limited | 15-1070 | Sterile |
| Alcian blue 8 GX dye | Santa Cruz | sc-214517B | |
| Automatic CO2 incubator | Nuarire | UN-5100E/G DH | |
| Bovine Serum Albumin | Wiener lab | 1443151 | |
| CD11c Monoclonal antibody-PECy5 100 µg | eBioscience | 15-0114-82 | clone (N418) |
| CD40 Monoclonal antibody-FITC 100 µg | eBioscience | 11-0402-82 | clone (HM40-3) |
| CD80 Monoclonal antibody-APC 100 µg | eBioscience | 17-0801-82 | clone (16-10A-1) |
| CD86 Monoclonal antibody-FITC 100 µg | eBioscience | 11-0862-82 | clone (GL-1) |
| Centrifuge | Thermo Scientific | IEC CL31R Multispeed | |
| Confocal Microscope | Nikon | Nikon Confocal Microscope C1 | |
| Conical tubes 15 mL dia.17 x 120 mm | Citotest | 4610-1865 | |
| DAPI | Sigma | 107K4034 | |
| D-Glucose | Merk | 1.78343 | |
| Dimethyl Sulfoxide | Anedra | 6646 | |
| Fetal Bovine Serum 500 mL | Sigma-Aldrich | 12352207 | |
| Flow Cytometry System | BD Biosciences | BD FACSCanto™ II | |
| Folded Capillary Zeta Cell | Malvern Panalytical | DTS1070 | |
| Gentamicin sulfate salt | Sigma | G1264 | |
| Glutaraldehyde solution | Fluka | 49630 | |
| Hepes | Gibco | 11344041 | |
| Hypodermic needle 21 G x 1"25/8 | Weigao | Sterile | |
| Hypodermic needle 25 G x 5/8" | Weigao | Sterile | |
| Inverted microscope | Leica | DMIL LED Fluo | |
| Ketamine | Holliday | ||
| Lipopolysaccharide 5 mg | Invitrogen | tlrl-rslps | LPS from the Gram-negative bacteria E. coli K12 . TLR2/4 Agonists |
| Loperamide hydrochloride | Sigma-Aldrich | 5.08162 | |
| Medium 199 | Gibco | 11150059 | |
| Methylene Blue | Anedra | 6337 | |
| MHC class I (H2kb) Monoclonal antibody-PE 100 µg | eBioscience | 12-5958-82 | clone (AF6-88.5.5.3) |
| MHC class II (IA/IE) Monoclonal antibody-FITC 100 µg | eBioscience | 11-5321-82 | clone (M5/114.15.2) |
| Microscope | Olympus | CX31 | |
| Mouse recombinant murine Flt3L. | PrepoTech | 250-31L-10UG | |
| Nanodrop | Thermo Scientific | ND-One | |
| Paraformaldehyde | Agar Scientific | R1018 | |
| Penicillin G sodium salt | Sigma | P3032-10MU | |
| PKH26 | Sigma-Aldrich | MINI26 | |
| Potassium Phosphate Monobasic | Timper | For Phosphate Buffered Saline (PBS) | |
| RBC lysis buffer 100 mL | Roche | 11814389001 | |
| RPMI medium 1640 1x 500 mL | Sigma-Aldrich (Gibco) | 11875093 | |
| Sodium Cacodylate | Sigma-Aldrich | C0250 | |
| Sodium Chloride | Anedra | 7647-14-5 | For Phosphate Buffered Saline (PBS) |
| Sodium Phosphate Dibasic (Anhydrous) p. a. | Biopack | 1639.07 | For Phosphate Buffered Saline (PBS) |
| Streptomycin sulfate salt | Sigma | S9137 | |
| Syringe 10 mL | Bremen | Sterile | |
| Thickwall polycarbonate tubes | Beckman Coulter | 13 x 55 mm , nominal capacity 4 mL | |
| Transmission Electron Microscope | Jeol | JEOL JSM 100CX II | |
| Ultracentrifuge | Beckman | Optima LE-80k | 90 Ti rotor |
| Xylazine | Richmond | ||
| Zetasizer Nano | Malvern | Nano ZSizer-ZEN3600 | To perform Dynamic Light scattering and zeta potential measurements |
Referências
- Wen, H., et al. Echinococcosis: advances in the 21st century. Clin Microbiol Rev. 32 (2), e00075-e00118 (2019).
- Geary, T. G., Thompson, D. P. Development of antiparasitic drugs in the 21st century. Vet Parasitol. 115 (2), 167-184 (2003).
- Drurey, C., Maizels, R. M. Helminth extracellular vesicles: Interactions with the host immune system. Mol Immunol. 137, 124-133 (2021).
- Welsh, J. A., et al. Minimal information for studies of extracellular vesicles (MISEV2023): From basic to advanced approaches. J. Extracell Vesicles. 13 (2), e12404 (2024).
- Cresswell, P. Antigen processing and presentation. Immunol Rev. 207, 5-7 (2005).
- Buzas, E. I. The roles of extracellular vesicles in the immune system. Nat Rev Immunol. 23 (4), 236-250 (2023).
- Bennett, A. P. S., de la Torre-Escudero, E., Oliver, N. A. M., Huson, K. M., Robinson, M. W. The cellular and molecular origins of extracellular vesicles released by the helminth pathogen Fasciola hepatica. Int J Parasitol. 50 (9), 671-683 (2020).
- Drurey, C., Coakley, G., Maizels, R. M. Extracellular vesicles: new targets for vaccines against helminth parasites. Int J Parasitol. 50 (9), 623-633 (2020).
- Nicolao, M. C., et al. Characterization of protein cargo of Echinococcus granulosus extracellular vesicles in drug response and its influence on immune response. Parasit Vectors. 16 (1), 255 (2023).
- Sánchez-López, C. M., Trelis, M., Bernal, D., Marcilla, A. Overview of the interaction of helminth extracellular vesicles with the host and their potential functions and biological applications. Mol Immunol. 134, 228-235 (2021).
- Nicolao, M. C., Rodriguez, R. C., Cumino, A. C. Extracellular vesicles from Echinococcus granulosus larval stage: Isolation, characterization and uptake by dendritic cells. PLoS Negl Trop Dis. 13 (1), e0007032 (2019).
- Kuipers, M. E., et al. DC-SIGN mediated internalisation of glycosylated extracellular vesicles from Schistosoma mansoni increases activation of monocyte-derived dendritic cells. J Extracell Vesicles. 9 (1), 1753420 (2020).
- Murphy, A., et al. Fasciola hepatica extracellular vesicles isolated from excretory-secretory products using a gravity flow method modulate dendritic cell phenotype and activity. PLoS Negl Trop Dis. 14 (9), e0008626 (2020).
- Ricciardi, A., et al. Extracellular vesicles released from the filarial parasite Brugia malayi downregulate the host mTOR pathway. PLoS Negl Trop Dis. 15 (1), e0008884 (2021).
- Zhang, Q., Jeppesen, D. K., Higginbotham, J. N., Franklin, J. L., Coffey, R. J. Comprehensive isolation of extracellular vesicles and nanoparticles. Nat Protoc. 18 (5), 1462-1487 (2023).
- Brezgin, S., et al. Basic guide for approaching drug delivery with extracellular vesicles. Int J Mol Sci. 25 (19), 10401 (2024).
- Pinheiro, A. A., et al. Potential of extracellular vesicles in the pathogenesis, diagnosis, and therapy for parasitic diseases. J Extracell Vesicles. 13 (8), e12496 (2024).
- Barnadas-Carceller, B., Del Portillo, H. A., Fernandez-Becerra, C. Extracellular vesicles as biomarkers in parasitic disease diagnosis. Curr Top Membr. 94, 187-223 (2024).
- Nicolao, M. C., Denegri, G. M., Carcamo, J. G., Cumino, A. C. P-glycoprotein expression and pharmacological modulation in larval stages of Echinococcus granulosus. Parasitol Int. 63 (1), 1-8 (2014).
- Nicolao, M. C., Cumino, A. C. Biochemical and molecular characterization of the calcineurin in Echinococcus granulosus larval stages. Acta Trop. 146, 141-151 (2015).
- Savina, A., Furlan, M., Vidal, M., Colombo, M. I. Exosome release is regulated by a calcium-dependent mechanism in K562 cells. J Biol Chem. 278 (22), 20083-20090 (2003).
- Ambattu, L. A., et al. High frequency acoustic cell stimulation promotes exosome generation regulated by a calcium-dependent mechanism. Commun Biol. 3 (1), 553 (2020).
- White, R., et al. Special considerations for studies of extracellular vesicles from parasitic helminths: A community-led roadmap to increase rigour and reproducibility. J Extracell Vesicles. 12 (1), e12298 (2023).
- Casado, N., Rodriguez-Caabeiro, F., Hernandez, S. In vitro survival of Echinococcus granulosus protoscolices in several media, at +4 degrees C and +37 degrees C. Z Parasitenkd. 72 (2), 273-278 (1986).
- Casado, N., Rodriguez-Caabeiro, F., Jiménez, A., Criado, A., de Armas, C. In vitro effects of levamisole and ivermectin against Echinococcus granulosus protoscoleces. Int J Parasitol. 19 (8), 945-947 (1989).
- Al-Lamki, R. S., Bradley, J. R., Pober, J. S. Human organ culture: updating the approach to bridge the gap from in vitro to in vivo in inflammation, cancer, and stem cell biology. Front Med. 4, 148 (2017).
- Rodriguez-Caabeiro, F., Casado, N. Evidence of in vitro germinal layer development in Echinococcus granulosus cysts. Parasitol Res. 74 (6), 558-562 (1988).
- Loos, J. A., Cumino, A. C. In vitro anti-echinococcal and metabolic effects of metformin involve activation of AMP-activated protein kinase in larval stages of Echinococcus granulosus. PLoS One. 10 (5), e0126009 (2015).
- Erwin, N., Serafim, M. F., He, M. Enhancing the cellular production of extracellular vesicles for developing therapeutic applications. Phar. Res. 40 (4), 833-853 (2023).
- Sako, Y., et al. Identification of a novel small molecule that enhances the release of extracellular vesicles with immunostimulatory potency via induction of calcium influx. ACS Chem Biol. 18 (4), 982-993 (2023).
- He, L. P., Mears, D., Atwater, I., Rojas, E., Cleemann, L. Loperamide mobilizes intracellular Ca2+ stores in insulin-secreting HIT-T15 cells. Br J Pharmacol. 139 (2), 351-361 (2003).
- Dalton, J. P., Skelly, P., Halton, D. W. Role of the tegument and gut in nutrient uptake by parasitic platyhelminths. Can J Zool. 82 (2), 211-232 (2004).
- Dos Santos, G. B., et al. Excretory/secretory products in the Echinococcus granulosus metacestode: is the intermediate host complacent with infection caused by the larval form of the parasite. Int J Parasitol. 46 (13-14), 843-856 (2016).
- Siles-Lucas, M., et al. Isolation and characterization of exosomes derived from fertile sheep hydatid cysts. Vet Parasitol. 236, 22-22 (2017).
- Yang, J., et al. Identification of different extracellular vesicles in the hydatid fluid of Echinococcus granulosus and immunomodulatory effects of 110 K EVs on sheep PBMCs. Front Immunol. 12, 602717 (2021).
- Khosravi, M., et al. Characterisation of extracellular vesicles isolated from hydatid cyst fluid and evaluation of immunomodulatory effects on human monocytes. J Cell Mol Med. 27 (17), 2614-2625 (2023).
- Sotillo, J., et al. The protein and microRNA cargo of extracellular vesicles from parasitic helminths–current status and research priorities. Int J Parasitol. 50 (9), 635-645 (2020).
- Kuipers, M. E., et al. Optimized protocol for the isolation of extracellular vesicles from the parasitic worm Schistosoma mansoni with improved purity, concentration, and yield. J Immunol Res. 2022 (1), 5473763 (2022).
- Fernandez-Becerra, C., et al. Guidelines for the purification and characterization of extracellular vesicles of parasites. J Extracell Biol. 2 (10), e117 (2023).
- Chaiyadet, S., et al. Silencing of Opisthorchis viverrini tetraspanin gene expression results in reduced secretion of extracellular vesicles. Front Cell Infect Microbiol. 12, 827521 (2022).
- Théry, C., et al. Minimal information for studies of extracellular vesicles 2018 (MISEV2018): A position statement of the International Society for Extracellular Vesicles and update of the MISEV2014 guidelines. J Extracell Vesicles. 7 (1), 1535750 (2018).
- Szatanek, R., et al. The methods of choice for extracellular vesicles (EVs) characterization. Int J Mol Sci. 18 (6), 1153 (2017).
- Blundell, E. L. C. J., Mayne, L. J., Billinge, E. R., Platt, M. Emergence of tunable resistive pulse sensing as a biosensor. Anal Methods. 7 (17), 7055-7066 (2015).
- Vucetic, A., Filho, A., Dong, G., Olivier, M. Isolation of extracellular vesicles from Leishmania spp. Methods Mol Biol. , 555-574 (2020).
- Caputo, F., et al. Measuring particle size distribution and mass concentration of nanoplastics and microplastics: Addressing some analytical challenges in the submicron size range. J Colloid Interface Sci. 588, 401-417 (2021).
- Crescitelli, R., Lässer, C., Lötvall, J. Isolation and characterization of extracellular vesicle subpopulations from tissues. Nat Protoc. 16 (3), 1548-1580 (2021).
- Trombetta, E. S., Mellman, I. The cell biological basis of antigen presentation in vitro and in vivo. Ann Rev Immunol. 23 (1), 975-1028 (2005).
- Hammer, G. E., Ma, A. Molecular control of state dendritic cell maturation and immuno homeostasis. Ann Rev Immunol. 31 (1), 743-791 (2013).
- Weigel, B. J., et al. Comparative analysis of murine marrow–derived dendritic cells generated by Flt3L or GM-CSF/IL-4 and matured with immune stimulatory agents on the in vivo induction of antileukemia responses. Blood. 100 (12), 4169-4176 (2002).
- March, N., et al. Differences in dendritic cells stimulated in vivo by tumors engineered to secrete granulocyte macrophage colony-stimulating factor or Flt3-ligand. Cancer Res. 60, 3239-3246 (2000).
- Heath, W. R., et al. Cross-presentation, dendritic cell subsets, and the generation of immunity to cellular antigens. Immunol Rev. 199 (1), 9-26 (2004).
- Naik, S., et al. Cutting edge: generation of splenic CD8+ and CD8− dendritic cell equivalents in Fms-like tyrosine kinase 3 ligand bone marrow cultures. J Immunol. 174 (11), 6592-6597 (2005).
- Sauter, M., et al. Protocol to isolate and analyze mouse bone marrow derived dendritic cells (BMDC). STAR Protoc. 3 (3), 101664 (2022).
- Helft, J., et al. GM-CSF mouse bone marrow cultures comprise a heterogeneous population of CD11c(+) MHCII(+) macrophages and dendritic cells. Immunity. 42 (6), 1197-1211 (2015).
- Borup, A., et al. Comparison of separation methods for immunomodulatory extracellular vesicles from helminths. J Extracell Biol. 1 (5), e41 (2022).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados