Method Article
Aislamiento y absorción de células dendríticas de pequeñas vesículas extracelulares de Echinococcus granulosus
En este artículo
Resumen
Aquí, describimos las condiciones de cultivo in vitro , el aislamiento y el aumento de la generación de vesículas extracelulares (EV) de Echinococcus granulosus. Los pequeños vehículos eléctricos se caracterizaron mediante dispersión dinámica de la luz y microscopía electrónica de transmisión. La captación por las células dendríticas derivadas de la médula ósea y su modulación fenotípica se estudiaron mediante microscopía confocal y citometría de flujo.
Resumen
La secreción de vesículas extracelulares por parte de los cestodos es crucial para permitir la comunicación celular no solo entre parásitos, sino también con los tejidos del huésped. En particular, las pequeñas vesículas extracelulares (sEV) actúan como nanotransportadores que transfieren antígenos naturales, que son fundamentales para la inmunomodulación del huésped y la supervivencia del parásito. En este artículo se presenta un protocolo paso a paso para aislar sEVs de cultivos en estadio larvario de Echinococcus granulosus y se analiza su absorción por células dendríticas obtenidas de médula ósea murina, que adquieren capacidad de adhesión y presentación de antígenos durante su maduración tras una semana de cultivo in vitro . Este artículo proporciona información completa para generar, purificar y cuantificar sEV mediante ultracentrifugación junto con análisis paralelos de dispersión dinámica de luz y microscopía electrónica de transmisión. Además, se describe un protocolo experimental detallado para aislar y cultivar células de médula ósea de ratón y conducir su diferenciación en células dendríticas utilizando Flt3L. Estas células dendríticas pueden presentar antígenos a las células T vírgenes, modulando así el tipo de respuesta inmunitaria in vivo. Por lo tanto, se proponen protocolos alternativos, que incluyen microscopía confocal y análisis de citometría de flujo, para verificar el fenotipo madurativo adquirido de células dendríticas previamente expuestas a sEV parásitos. Por último, cabe destacar que el protocolo descrito puede aplicarse en su totalidad o en partes individuales para realizar cultivos in vitro de parásitos, aislar vesículas extracelulares, generar cultivos de células dendríticas derivadas de la médula ósea y realizar ensayos de absorción con estas células.
Introducción
Echinococcus granulosus es un helminto parásito zoonótico responsable de una infección a largo plazo conocida como equinococosis quística1. En los huéspedes intermediarios, como el ganado y los seres humanos, la infección por parásitos afecta principalmente al hígado y los pulmones, donde la etapa larvaria se desarrolla como quistes llenos de líquido o metacestodos que contienen protoscoleces (una larva en sí). Como todos los cestodos, este parásito carece de sistemas digestivo y excretor y, por lo tanto, ha desarrollado procesos celulares endocíticos y exocíticos activos para regular la absorción y excreción de metabolitos, así como la liberación de vesículas extracelulares2,3. Las vesículas extracelulares (VE) son partículas encerradas en bicapas lipídicas secretadas por aparentemente todos los tipos de células. En particular, las pequeñas vesículas extracelulares (sEV), definidas como VE de menos de 200 nm, independientemente de su origen biogénico4, pueden actuar como mediadores inmunitarios intercelulares. Esta función es especialmente significativa en los parásitos, que dependen de la inmunomodulación del huésped para asegurar su supervivencia3. La manipulación inmunitaria se logra a través de la absorción de sEV por parte de las células dendríticas del huésped, las únicas células capaces de activar las células T ingenuas in vivo e iniciar una respuesta inmunitaria adaptativa que conducirá a una infección crónica por estos gusanos parásitos. Las células dendríticas, células presentadoras de antígenos profesionales del sistema inmunitario innato, procesan y cargan péptidos antigénicos en el complejo mayor de histocompatibilidad de clase I y clase II (MHC I y MHC II) y los exhiben en sus membranas para el cebado exclusivo de células T vírgenes (células T CD8+ y CD4+ , respectivamente)5. Las células dendríticas siguientes inducen su maduración por inducción de la expresión de los marcadores coestimuladores CD80/CD86 y CD40 y MHC-II y migran de los tejidos periféricos a los órganos linfoides secundarios al reconocer antígenos extraños, cargándolos para el cebado exclusivo de células T ingenuas6. Por lo tanto, el objetivo general de este protocolo es estudiar la comunicación parásito-huésped de los helmintos de una manera realista, analizando el empaquetamiento y la entrega de componentes parásitos en forma de sEV, que, al llegar a las células inmunitarias del huésped, influyen en el desarrollo de la infección y la progresión de la enfermedad parasitaria crónica.
Abordar el análisis de la interfaz helminto-huésped a través del estudio de los sEV tiene varias ventajas. En primer lugar, el tegumento, la cubierta exterior de los gusanos planos, es una estructura de doble membrana que constituye un importante punto de cruce entre el parásito y su huésped, lo que permite que los sEV se generen o impregnen fácilmente a partir de esta estructura7. En segundo lugar, los sEV están altamente cargados de antígenos proteicos de todas las etapas del ciclo de vida del parásito, lo que representa la forma natural a través de la cual el sistema inmunológico del huésped muestrea antígenos durante la infección por gusanos 8,9. Debido a su producción biológica, su facilidad de purificación (sin necesidad de disrupción tisular o fraccionamiento de proteínas) y su interacción directa con las células huésped, los helmintos sEV permiten el desarrollo de experimentos in vitro para simular las condiciones in vivo de la interacción parásito-huésped. Por último, los sEVs representan la posibilidad de tener estructuras parásitas que pueden ser fagocitadas o internalizadas por las células huésped, superando la imposibilidad de hacerlo con parásitos enteros, particularmente en casos de gusanos enquistados.
Teniendo en cuenta las ventajas mencionadas y el hecho de que las helmintiasis son enfermedades prevalentes y típicamente crónicas en las que los parásitos presumiblemente manipulan el sistema inmune del huésped como estrategia de supervivencia, el aislamiento de las VE derivadas del parásito y su estudio en interacción con las células dendríticas proporciona un marco valioso para explorar esta inmunomodulación10. En este sentido, se ha descrito que la internalización de VE de helmintos, incluyendo nematodos y plathelmintos como Schistosoma mansoni, Fasciola hepatica, Brugia malayi y E. granulosus, induce la maduración y activación de células dendríticas 9,11,12,13,14,15.
El aislamiento de las VE derivadas de helmintos no solo permite el estudio de las interacciones inmunológicas, lo que podría conducir al desarrollo de vacunas protectoras o agentes inmunoterapéuticos para enfermedades alérgicas o autoinmunes, sino que también facilita la exploración de otras interacciones y funciones biológicas 8,16,17. En este contexto, las VE, que desempeñan un papel en la historia natural de las infecciones parasitarias, podrían utilizarse para investigar el desarrollo de parásitos y las interacciones con células huésped específicas. Además, podrían tener aplicaciones potenciales como biomarcadores tempranos o diferenciales para el diagnóstico de enfermedades parasitarias, el seguimiento de las respuestas terapéuticas y la contribución al control y manejo de las infecciones parasitarias17,18.
Además, como se demostró anteriormente, el estadio larvario de E. granulosus es susceptible a cambios en la concentración de calcio citosólico, lo que, además de desempeñar un papel en la viabilidad del parásito, también controla la tasa de exocitosis19,20. En este contexto, y sabiendo que la elevación del calcio intracelular aumenta la liberación de EV, el uso de un potenciador del calcio intracelular como loperamida podría ser una estrategia crucial para aumentar el número de EV. Este enfoque es particularmente interesante para sistemas celulares que requieren grandes poblaciones para generar una cantidad adecuada de VE para la carga y el análisis funcional 11,21,22. El protocolo actual (Figura 1) detalla los métodos para obtener cultivos puros de la etapa larvaria de E. granulosus y las condiciones que mejoran la producción de sEV. También describe el flujo de trabajo para el aislamiento y la caracterización de estas vesículas, así como su absorción por las células dendríticas murinas, un paso esencial en el estudio inicial de la modulación del sistema inmunitario del huésped.
Protocolo
Todos los procedimientos que involucran animales fueron evaluados y aprobados por el Comité Experimental Animal de la Facultad de Ciencias Exactas y Naturales, Mar del Plata (números de permiso: RD544-2020; RD624-625-2021; RD80-2022). En este protocolo, los ratones fueron sacrificados, de acuerdo con la "Guía para el Cuidado y Uso de Animales de Laboratorio" publicada por los NIH y los lineamientos del Servicio Nacional de Salud y Calidad Alimentaria (SENASA).
1. Cultivo en etapa larvaria de Echinococcus
NOTA: Todos los procedimientos se realizaron en condiciones asépticas.
- Obtención de E. granulosus protoscoleces
- Aspirar con una aguja de 21 g y una jeringa de 10 mL parte del líquido hidatídico del pulmón o el hígado del ganado infectado para reducir la turgencia del quiste (Figura 2A).
NOTA: Los pulmones e hígados infectados provienen de ganado presentado para el sacrificio de rutina en el matadero. Deberán mantenerse a 4 °C y transformarse dentro de las 24 horas siguientes al sacrificio. - Abra el quiste con unas tijeras y retire las capas laminares y germinales del quiste con pinzas. Colóquelos en una placa de Petri estéril, junto con cualquier líquido hidatídico restante (Figura 2B, C).
NOTA: En este punto, se recomienda observar la placa de Petri bajo un microscopio invertido para evaluar la calidad de los protoscoleces y las cápsulas de cría. Evite acumular el material biológico de los quistes con más del 50% de los protoscoleces colapsados, que se identifican por su soma contraído, color más oscuro y rostelo desorganizado con pérdida de ganchos. - Lavar las capas con solución salina estéril tamponada con fosfato (PBS) suplementada con antibióticos (100 μg/mL de penicilina, 100 μg/mL de estreptomicina, 100 μg/mL de gentamicina, 100 μg/mL) para eliminar los protoescotes.
NOTA: Todos los lavados se realizarán con PBS suplementado con antibióticos. - Transfiera la suspensión de protoscólex a un tubo Khan de vidrio estéril con una pipeta Pasteur.
- Lavar los protoscoleces con PBS suplementado a 4 °C con una pipeta Pasteur para eliminar los parásitos muertos. Vuelva a suspender vigorosamente la suspensión para romper las cápsulas de cría, facilitando la liberación de protoscolex. Deje que los protoscoleces se asienten durante 1-2 minutos en el fondo del tubo; A continuación, desecha el sobrenadante que contiene los protoscoleces muertos.
NOTA: Debido a una diferencia en la densidad, los protoscoleces vivos se asientan más rápido que los parásitos muertos. - Repita el proceso de lavado hasta que se hayan eliminado todos los protoscoleces muertos y flotantes.
NOTA: Los parásitos muertos se eliminan cuando todos se asientan a la misma velocidad. - Determinar la viabilidad de protoscoleces mediante la prueba de exclusión de metileno.
- Vuelva a suspender los protoscoleces lavados con una pipeta y coloque una gota en un portaobjetos. Agregue una gota de azul de metileno de 0,1 mg/mL y cubra con un cubreobjetos. Espere de 2 a 3 minutos y observe bajo el microscopio.
- Cuente el número total de protoscoleces vivos (sin teñir) y muertos (teñidos de azul) y calcule el porcentaje de protoscoleces viables (Figura 2D y recuadro).
NOTA: La viabilidad de los protoscoleces debería ser de alrededor del 98% antes de establecer los cultivos. El tiempo de tinción no debe exceder los 10 minutos, ya que las duraciones más largas pueden resultar en la tinción de parásitos vivos.
- Aspirar con una aguja de 21 g y una jeringa de 10 mL parte del líquido hidatídico del pulmón o el hígado del ganado infectado para reducir la turgencia del quiste (Figura 2A).
- Obtención de metacestodos por E. granulosus
- Producir una hidatidosis secundaria experimental infectando intraperitonealmente ratones hembra CF1 (peso corporal de 25 ± 5 g) con 1500 protoescoles (equivalentes a 10 μL del pellet protocolex) suspendidos en 0,5 mL de PBS suplementado (Figura 2E).
NOTA: Se recomienda mantener los protoescoles en PBS suplementados con antibióticos a 4 °C durante 24 h o en cultivo durante 3-5 días antes de la infección. - Los metacestodos se desarrollan dentro de los 4-6 meses posteriores a la infección (Figura 2F). Durante este período, alojar a los animales en condiciones controladas de laboratorio (temperatura de 20 ± 1 °C, ciclo de luz/oscuridad de 12 h, y agua y alimento proporcionados ad libitum). Una vez que los quistes se han desarrollado, anestesiar a los ratones con ketamina-xilacina (50 mg/kg/ratón-5 mg/kg/ratón) y sacrificarlos mediante luxación cervical.
- Limpiar la superficie ventral del ratón con alcohol al 70% y abrir quirúrgicamente la cavidad peritoneal para eliminar los metacestodos desarrollados con tijeras y fórceps.
- Transfiera las masas de metacestodos a una placa de Petri estéril.
NOTA: Las masas de metacestodos consisten en múltiples quistes internos rodeados de tejido conectivo. - Libere los quistes de las masas de metacestodos retirando cuidadosamente el tejido conectivo que cubre los metacestodos con fórceps si es necesario.
NOTA: Este paso asegura que los parásitos estén libres de tejido huésped. - Lavar los metacestodos obtenidos con PBS suplementado a 4 °C (Figura 2G).
- Producir una hidatidosis secundaria experimental infectando intraperitonealmente ratones hembra CF1 (peso corporal de 25 ± 5 g) con 1500 protoescoles (equivalentes a 10 μL del pellet protocolex) suspendidos en 0,5 mL de PBS suplementado (Figura 2E).
- Cultivo de protoscoleces y metacestodos de E. granulosus
- Prepare el medio de cultivo de la siguiente manera: Añadir 100 μg/mL de penicilina, 100 μg/mL de estreptomicina, 100 μg/mL de gentamicina, 4 mg/mL de glucosa, 50 mM de tampón Hepes pH 7,5 y medio 199 para alcanzar el volumen final deseado y mezclar suavemente por inversión.
- Transfiera 5 mL del medio de cultivo preparado a cada tubo de Leighton (Figura 2H-I).
- Añadir los parásitos al medio de cultivo e incubar a 37 °C durante 5 días sin cambiar el medio. Incube los tubos de Leighton en un ángulo de 15° para garantizar una distribución uniforme del material biológico a través de la superficie plana. Esto maximiza la exposición de los parásitos al medio de cultivo y evita el contacto con el tapón de goma.
NOTA: Agregue 9,000 a 10,000 protoscoleces o 50 metacestodos (con diámetros que oscilan entre 5 mm y 15 mm distribuidos como 10 quistes por tubo). - Opcionalmente, agregue 20 μM de loperamida (una concentración subletal) disuelta en dimetilsulfóxido durante 16-24 h en el medio de cultivo del parásito para aumentar el nivel de calcio citosólico y mejorar la liberación de EV en la etapa larvaria de E. granulosus.
NOTA: Dado que un aumento en las concentraciones de calcio intracelular aumenta la producción de EV, el tratamiento del parásito con compuestos que afectan la homeostasis del calcio aumentará la liberación de EV.
2. Purificación de vesículas extracelulares
- Recoja el medio de cultivo de parásitos de cada tubo Leighton y transfiéralo a un tubo cónico de 15 mL.
NOTA: El medio de cultivo puede almacenarse durante 24 horas antes de la primera centrifugación con un impacto mínimo en la concentración o la distribución del tamaño de las vesículas. Los protoscoleces pueden lavarse tres veces con tampón PBS, cosecharse y almacenarse a -20 °C en tubos de 1,5 ml. - Centrifugar a 300 x g durante 10 min a 4 °C y transferir el sobrenadante a un nuevo tubo cónico de 15 mL con una pipeta.
NOTA: Este paso elimina los protoscoleces muertos. Después de cada paso de centrifugación, asegúrese de que queden al menos 0,5 cm de sobrenadante por encima del pellet para evitar la contaminación. - Centrifugar el sobrenadante a 2.000 x g durante 10 min a 4 °C y transferirlo a nuevos tubos de 1,5 mL con una pipeta.
NOTA: Este paso elimina los residuos de celdas más grandes. - Centrifugar a 10.000 x g durante 30 min a 4 °C para eliminar los residuos de celdas más pequeñas.
- Transfiera el sobrenadante a un tubo adecuado para el rotor de ultracentrífuga mediante una pipeta. Marque un lado de cada tubo con un marcador antes de colocarlo en el rotor de la ultracentrífuga. Luego, coloque el tubo en el rotor con el lado marcado hacia arriba.
NOTA: La marca sirve como punto de referencia para localizar el pellet después de la ultracentrifugación. Los tubos deben estar llenos en tres cuartas partes y estar equilibrados con precisión; por lo tanto, si es necesario, agregue PBS. Si el volumen del sobrenadante superparte la capacidad de un solo tubo, divida las muestras en varios tubos y combínelos durante la resuspensión. - Centrifugar a 100.000 x g durante 1 h a 4 °C y verter el sobrenadante con una acción rápida. Deje que el tubo descanse boca abajo durante 1 minuto. Es posible que el pellet no sea visible en esta etapa.
NOTA: El factor k para el rotor utilizado es 103. - Lave el pellet con al menos 3 mL de PBS para eliminar las proteínas contaminantes. Vuelva a suspender el pellet pipeteando hacia arriba y hacia abajo varias veces desde la parte superior del tubo hasta la parte inferior en todas las caras del tubo, pero principalmente en el lado marcado donde se espera que esté el pellet.
NOTA: Si corresponde, agrupe el pellet resuspendido derivado del mismo sobrenadante en un solo tubo. - Centrifugar a 100.000 x g durante 1 h a 4 °C y verter el sobrenadante con una acción rápida. Deje que el tubo descanse boca abajo durante 1 minuto.
NOTA: El factor k para el rotor utilizado es 103. - Vuelva a suspender el pellet en 30 μL de PBS siguiendo el proceso descrito en el paso 2.7.
NOTA: En este punto, se recomienda medir la concentración total de proteína en el pellet resuspendido para estimar la cantidad de los sEV secretados. La concentración de proteínas se puede determinar midiendo la absorbancia a 280 nm utilizando un espectrofotómetro de microvolúmenes. - Transfiera la muestra a un tubo de 1,5 mL. Congelar las vesículas extracelulares a -80 °C.
NOTA: Para preservar la integridad de la vesícula para aplicaciones posteriores, congele el pellet resuspendido lo más rápido posible y evite ciclos repetidos de congelación y descongelación.
3. Caracterización de las vesículas aisladas
- Determinación del tamaño del EV mediante dispersión dinámica de la luz (DLS)
NOTA: La dispersión dinámica de la luz es un método fiable y sensible para evaluar el tamaño (basado en el radio hidrodinámico, Rh) y la forma de las nanopartículas en fluidos complejos, independientemente de su tipo. Las mediciones de potencial DLS y zeta se realizaron utilizando un rayo láser monocromático He-Ne a 633 nm. Si el análisis no es posible el día de la toma de muestras, las muestras podrán congelarse en un tampón prefiltrado antes de su almacenamiento.- Descongele las muestras y manténgalas en hielo hasta que se tomen las mediciones.
NOTA: La congelación de las muestras podría afectar la distribución de partículas y la integridad de los sEV. Por lo tanto, evite los ciclos de congelación y descongelación, ya que pueden provocar una disminución de la señal LS con alturas de pico reducidas. - Filtre las muestras acuosas utilizadas para DLS a través de un filtro de tamaño de poro de 0,2 μm.
NOTA: En los experimentos de LS, es esencial filtrar todas las soluciones, tampones y muestras acuosas para eliminar las partículas grandes y el polvo, que pueden interferir con las mediciones. - Diluya las muestras de 1:10 a 1:50 en PBS prefiltrado.
- Mezcle las muestras por inversión suave antes de cada medición para evitar la sedimentación, ya que la intensidad del LS puede disminuir debido a un tiempo de procesamiento de muestras más prolongado.
- Agregue 1 mL de la muestra en una cubeta limpia, colocando el lado no esmerilado en la trayectoria del láser a la izquierda en el instrumento. Cierre la tapa y espere de 2 a 3 minutos para que se equilibre antes de medir la muestra.
- Mida el tamaño en términos del radio hidrodinámico (Rh) antes de realizar la medición del potencial zeta. Registre las mediciones en un solo ángulo de dispersión (θ = 90° a 150°) a 25 °C ± 1 °C.
- Haga clic en Panel de control para verificar las lecturas e iniciar la adquisición de datos.
NOTA: Sobre la base de los valores medios de Rh y las distribuciones de tamaño evaluadas para los sEV, se debe observar un pico entre 30 nm y 200 nm (Figura 3). Los picos por debajo de 15 nm en Rh se atribuyen a los ácidos nucleicos y proteínas en suspensión. Normalmente, las distribuciones de tamaño se calculan a partir del radio hidrodinámico medio. Sin embargo, también se puede informar el promedio Z (tamaño medio de partícula en la muestra), el índice de polidispersidad (PDI, que determina la heterogeneidad del tamaño de una muestra) y la dependencia angular de la intensidad de la luz dispersa.
- Descongele las muestras y manténgalas en hielo hasta que se tomen las mediciones.
- Determinación de estructura y tamaño de partícula por microscopía electrónica de transmisión (TEM)
NOTA: Realice microscopía electrónica de transmisión de tinción negativa para evaluar el tamaño, la estructura y la pureza de los sEV, utilizando un protocolo estándar que incluye fijación, deshidratación, inclusión de resina y contraste para preparaciones de sEV de montaje completo.- Descongele las muestras concentradas de sEV del paso 2.10 y manténgalas en hielo.
- Fije los sEV en tubos de 1,5 ml. Aplique cuidadosamente 5-10 μL de glutaraldehído al 2,5% en tampón de cacodilato de sodio de 0,1 M (pH 7) a ~5 μL del pellet de muestra de sEV (concentración de sEV requerida ≈ 1 x 108-1 x 109 mL-1) e incube durante 2 h a 4 °C.
NOTA: Los sEV pueden almacenarse hasta 1 semana a 4 °C en tampón de cacodilato de sodio de 0,1 M antes de su posterior procesamiento. Por lo tanto, si se requieren servicios técnicos externos para el análisis TEM, envíe las muestras fijas de sEV refrigeradas en tubos de 1,5 mL. - Deposite 5 μL de los pellets resuspendidos en las rejillas de cobre EM recubiertas de carbono Formvar de malla 300. Prepare dos o tres cuadrículas para cada muestra.
- Deje que la muestra se adsorba durante 20 minutos en un ambiente seco y elimine el exceso de muestra de la rejilla con papel de filtro.
- Coloque gotas de 100 μl de PBS en una hoja de película. Con pinzas limpias, transfiera las rejillas (con la muestra adsorbida hacia abajo) a las gotas de PBS para lavarlas.
- Seque el lado opuesto de la muestra adsorbida, asegurándose de que el lado de la muestra de las rejillas no se seque durante ninguno de los siguientes pasos.
NOTA: Para todos los pasos subsiguientes, coloque gotas de reactivos en una película plana y transfiera las rejillas a las gotas con pinzas. - Transfiera las rejillas a una gota de 50 μL de glutaraldehído al 1% durante 5 min.
- Lavar las rejillas con una gota de 100 μL de agua destilada y dejarlas reposar durante 3 min. Repita nueve veces para un total de diez lavados.
- Contrastar las rejillas de muestra con una gota de 50 μL de solución de acetato de uranilo al 1% p/v, pH 7, durante 1 min.
- Contrasta e incrusta las rejillas en una mezcla de 100 μL de acetato de uranilo al 4% y 900 μL de metilcelulosa al 2%.
- Seque las rejillas al aire durante 5-10 minutos mientras permanecen en el circuito, y obsérvelas con un microscopio electrónico a 80-100 kV con una resolución de 0,2 nm y un aumento de 100.000x.
- Guarde las rejillas en cajas de almacenamiento en seco para el almacenamiento a largo plazo.
4. Generación de células dendríticas derivadas de la médula ósea
NOTA: Este procedimiento debe realizarse con ratones jóvenes, que se caracterizan por sistemas hematopoyéticos robustos con capacidades activas de proliferación y diferenciación. Por el contrario, los ratones más viejos exhiben disminuciones en la función hematopoyética, reservas reducidas de células madre, interacciones de nicho alteradas y un reservorio de memoria más desarrollado que es crucial para la inmunidad a largo plazo y la respuesta a patógenos o cambios relacionados con la edad, como la inmunosenescencia.
- Sacrificar a un ratón hembra CF-1 de 5 a 8 semanas de edad de acuerdo con las pautas éticas institucionales, minimizando el sufrimiento animal.
- Rocíe el ratón con etanol antes de colocarlo en una campana de cultivo de tejidos.
NOTA: Los siguientes pasos deben realizarse en condiciones estériles. - Coloque el ratón sobre una tabla de disección en posición supina. Con pinzas y tijeras de disección, haga una incisión vertical en "T" por encima de la uretra y extiéndala horizontalmente hasta la parte superior de las extremidades inferiores, teniendo cuidado de no romper el peritoneo ni perforar ningún órgano, especialmente el intestino.
- Separe la piel a lo largo de ambas extremidades traseras para exponer los huesos y tejidos de las piernas con pinzas. Con las manos, retira la piel de cada pierna empujando desde el tobillo hacia el abdomen, tirando de la piel hacia el lado opuesto. Ambas piernas quedarán entonces libres de piel.
NOTA: Deseche el cuerpo del ratón en la bolsa de residuos de patógenos. - Con unas tijeras y fórceps, retire con cuidado el fémur y la tibia, evitando roturas. Sujete la punta de cada hueso con pinzas y corte los tendones para eliminar las fascias musculares alrededor de los huesos. Limpieza completa del tejido muscular con servilletas de papel.
- A medida que se extrae cada hueso, colóquelo en un tubo estéril de 50 mL que contenga 2 mL de medio completo preparado con medio RPMI suplementado con FBS al 5%, 100 U/ml de penicilina, 100 U/mL de estreptomicina y 10 μg/mL de gentamicina para eliminar los desechos. A continuación, aspire y deseche el medio de cultivo y lave los huesos dos veces con etanol al 70% durante 5 min.
- Transfiera los huesos a una placa de Petri estéril.
- Corta las dos epífisis óseas con unas tijeras de disección afiladas para acceder a las células de la médula ósea.
- Enjuague cuidadosamente las células de la médula ósea de cada uno de los cuatro huesos en una placa de Petri estéril con una aguja de 25 G conectada a una jeringa de 20 ml que contenga medio completo. Los huesos se volverán más transparentes a medida que se extraiga la médula ósea.
NOTA: Un volumen de 20 mL del medio completo debería ser suficiente para eluir las células de la médula ósea de los dos fémures y tibias. - Homogeneizar suavemente el medio con la médula eluida mediante pipeteo para eliminar el hueso, el tejido conectivo y los bultos celulares. A continuación, transfiera la muestra a un tubo cónico estéril de 50 mL, pasando las células a través de un filtro de células de polipropileno estéril de 70 μm para eliminar el tejido conectivo y los restos óseos.
- Centrifugar las células a 450 x g durante 7 min a 4 °C. Retire y deseche con cuidado el sobrenadante, asegurándose de que el pellet permanezca adherido a la pared del tubo.
- Incubar las células durante 1 minuto a temperatura ambiente (RT), luego volver a suspenderlas en 500 μL de tampón de lisis de glóbulos rojos (RBC). Neutralizar el tampón de lisis añadiendo 3 mL de medio completo.
- Centrifugar las células a 450 x g durante 7 min a 4 °C. Deseche el sobrenadante y vuelva a suspender el pellet en 5 mL de medio completo.
- Pase la suspensión celular a través de un filtro celular estéril de polipropileno de 70 μm a un tubo cónico estéril de 50 mL para eliminar los agregados celulares de los eritrocitos lisados.
- Cuente las células con un hemocitómetro.
- Añadir 300 ng/mL de ligando 3 de tirosina quinasa 3 (Flt3L) murino recombinante al medio de cultivo.
- Coloque las células en una concentración de 1 x 106 células/mL en una placa multipocillo.
- Incubar las células durante 7 días a 37 °C en una atmósfera humidificada con 5% de CO2.
NOTA: Evite agitar las células mientras se diferencian y crecen para evitar la maduración espontánea. - El día 3, retire 1 mL de medio de cada pocillo (evitando la alteración de las células) y reemplácelo con 1 mL de medio completo fresco precalentado suplementado con 150 ng/mL de Flt3L murino recombinante.
5. Interacción entre células dendríticas derivadas de la médula ósea y vesículas extracelulares de E. granulosus
- Tinción de la membrana de la vesícula extracelular
- Descongele los sEV almacenados en el paso 2.10 y manténgalos en hielo.
- Vuelva a suspender 10 μL de sEV purificados en 10 μL de vehículo de etiquetado (diluyente C).
- Añadir 20 μL de 2 veces la solución de colorante PKH26 para lograr una concentración final de 2 μM. Mezclar suavemente con una pipeta e incubar durante 35 minutos a 37° C en la oscuridad.
NOTA: La solución de colorante PKH26 2x (4 μM) debe prepararse inmediatamente antes de la tinción agregando 0,5 μL de solución de colorante etanólico PKH26 a 125 μL de diluyente C. - Mezclar suavemente cada 3-5 minutos durante la incubación para asegurar una tinción homogénea.
- Añadir 40 μL de BSA 1% e incubar durante 10 min en RT para detener el proceso de tinción.
- Lavar los sEV con 1 mL de PBS y centrifugar a 100.000 x g durante 1 h a 4 °C para eliminar el exceso de tinte.
NOTA: El factor k para el rotor es 103. - Vuelva a suspender el pellet en 90 μL de PBS siguiendo el protocolo descrito en el paso 2.7.
- Estimulación de células dendríticas derivadas de la médula ósea murina con vesículas extracelulares de E. granulosus
- Extraiga células dendríticas derivadas de la médula ósea (BMDC) del pozo de la placa de cultivo y transfiérelas a tubos de 1,5 ml.
NOTA: Manipule con cuidado para evitar la maduración espontánea de las células. - Centrifugar el medio a 450 x g durante 5 min para granular las células.
NOTA: Reserve los sobrenadantes de la centrifugación para replatear las células en los siguientes pasos de análisis de citometría de flujo. - Vuelva a suspender los BMDC en 30 μl de sEV no teñidos del paso 2.10 para el análisis de citometría de flujo o en 90 μl de sEV teñidos con PBS del paso 5.1.7. para microscopía confocal. Incubar durante 30 min a 37 °C en una atmósfera humidificada con 5% de CO2. Mezcle suavemente la muestra cada 10 minutos.
NOTA: Para garantizar un contacto efectivo entre los BMDC y los sEV, los primeros 30 minutos de incubación deben realizarse en un volumen mínimo utilizando tubos de 1,5 mL. - Para la microscopía confocal, transfiera las células a un cubreobjetos de vidrio tratado con azul alcián (12 mm de diámetro) colocado en una placa de 24 pocillos. Incubar durante 30 minutos adicionales a 37 °C en una cámara humidificada con 5 % de CO2.
NOTA: El tratamiento con azul alcián imparte una carga positiva al cubreobjetos, lo que facilita la adherencia de las membranas plasmáticas cargadas negativamente de los BMDC.- Para preparar los cubreobjetos, sumérgelos en un tinte azul alcián 8 GX filtrado al 1% y caliéntalos en el microondas durante 1-2 minutos sin hervir. Incubarlos en la solución caliente durante 10 minutos, agitándolos cada 2 a 3 minutos.
- A continuación, lave los cubreobjetos con agua destilada desionizada para eliminar el exceso de azul alcián y séquelos con toallas de papel. Por último, autoclave los cubreobjetos y guárdelos en condiciones estériles hasta su uso.
- Para el análisis por citometría de flujo, se deben transferir los BMDC-sEV al mismo pocillo del que se extrajeron (ver paso 5.2.1), añadir los sobrenadantes reservados del paso 5.2.2 e incubar durante 18 h a 37 °C en una atmósfera humidificada con 5% de CO2.
NOTA: Deje aproximadamente 500 μL de medio en el pocillo para evitar la desecación de las células restantes después de la recolección. - Utilice controles positivos y negativos para evaluar la maduración de BMDC. Estimular las células con 100 ng/mL de lipopolisacárido (LPS) durante 18 h como control positivo. Para un control negativo de la endocitosis, incubar BMDC con sEV a 4 °C. Además, incluye un control de células dendríticas no estimuladas.
- Extraiga células dendríticas derivadas de la médula ósea (BMDC) del pozo de la placa de cultivo y transfiérelas a tubos de 1,5 ml.
- Microscopía confocal de vesículas extracelulares de E. granulosus capturadas e internalizadas por células dendríticas derivadas de la médula ósea.
- Una vez finalizado el período de incubación descrito en el paso 5.2.4, aspire y deseche el PBS del cubreobjetos.
- Fije los BMDC añadiendo 100 μL de paraformaldehído (PFA) al 4% sobre el cubreobjetos e incube durante 10 min en RT.
NOTA: Asegúrese de que el volumen mantenga la tensión superficial en el cubreobjetos. - Aspire y deseche el PFA, luego lave el cubreobjetos tres veces con PBS-BSA 2%.
- Añadir 100 μL de PBS que contenga anticuerpo anti-MHC clase II-FITC diluido 1/100 e incubar durante 1 h a RT en oscuridad.
- Aspire y deseche la solución de anticuerpos, y lave el cubreobjetos tres veces con PBS-BSA 2%.
- Añadir 100 μL de 50 ng/mL de DAPI e incubar durante 30 min a temperatura ambiente en una cámara húmeda para contratinción de núcleos.
- Aspire y deseche la solución de tinte y lave el cubreobjetos tres veces con PBS-BSA al 2 %.
- Retire el cubreobjetos con pinzas de punta fina curvada y séquelo sobre una toalla de papel para eliminar el exceso de líquido.
- Monte el cubreobjetos boca abajo sobre una corredera de vidrio utilizando un medio de montaje compuesto de alcohol polivinílico y glicerol. Dejar secar durante 2 h a 37 °C o toda la noche a 4 °C en oscuridad.
- Elimine las burbujas de aire entre el cubreobjetos y el portaobjetos de vidrio presionando suavemente el cubreobjetos con pinzas.
- Observe las muestras montadas bajo un microscopio confocal utilizando un objetivo de inmersión en aceite de 60x con una longitud de onda de excitación/emisión de 485/538 nm para FITC, 358/461 nm para DAPI y 551/567 nm para PKH26.
- Evaluación fenotípica de células dendríticas derivadas de médula ósea estimuladas por vesículas extracelulares mediante citometría de flujo
- Después del período de incubación descrito en el paso 5.2.5, coseche los BMDC enjuagando el medio hacia arriba y hacia abajo varias veces con una pipeta.
- Recoja los BMDC que contienen medio y colóquelos en tubos de 1,5 ml.
- Centrifugar a 450 x g durante 5 min a 4 °C para peletizar las células.
NOTA: Opcionalmente, para analizar la secreción de citocinas, retire los sobrenadantes con una pipeta, transfiéralos a nuevos tubos de 1,5 ml y guárdelos a -20 °C para realizar más pruebas de ensayo de inmunoabsorción enzimática (ELISA). - Vuelva a suspender los BMDC en 100 μL de PBS que contengan isotiocianato de fluoresceína (FITC), aloficocianina (APC) o mAbs conjugados con ficoeritrina dirigidos a CD11c, CD40, CD80, CD86, MHC clase I y MHC clase II e incube durante 15 min a 4 °C en la oscuridad.
- Lavar los BMDC con PBS y centrifugar a 450 × g durante 5 min a 4 °C.
- Vuelva a suspender los BMDC en 500 μL de PFA al 1% para fijarlos y almacenarlos a 4 °C hasta su adquisición en un citómetro de flujo.
Resultados
En la Figura 1 se muestra un diagrama de flujo que resume los principales pasos para mantener cultivos puros de la etapa larvaria de E. granulosus, el aislamiento y la caracterización de las sEV y su absorción por las células dendríticas murinas. Para lograr una alta producción de sEV a partir de protoscoleces y metacestodos de E. granulosus, se empleó un método de cultivo in vitro previamente desarrollado en el laboratorio para maximizar la supervivencia y la homeostasis metabólica del parásito estudiado (Figura 2).

Figura 1: Resumen de los procedimientos experimentales para la obtención de sEVs y BMDC de E. granulosus . Representaciones esquemáticas que describen los pasos seguidos en este protocolo desde la obtención y cultivo del material del parásito (PASO 1), el aislamiento (PASO 2) y la caracterización de los EV del parásito (PASO 3) hasta la generación de BMDC (PASO 4) y su interacción con los EV de E. granulosus (PASO 5). Haga clic aquí para ver una versión más grande de esta figura.
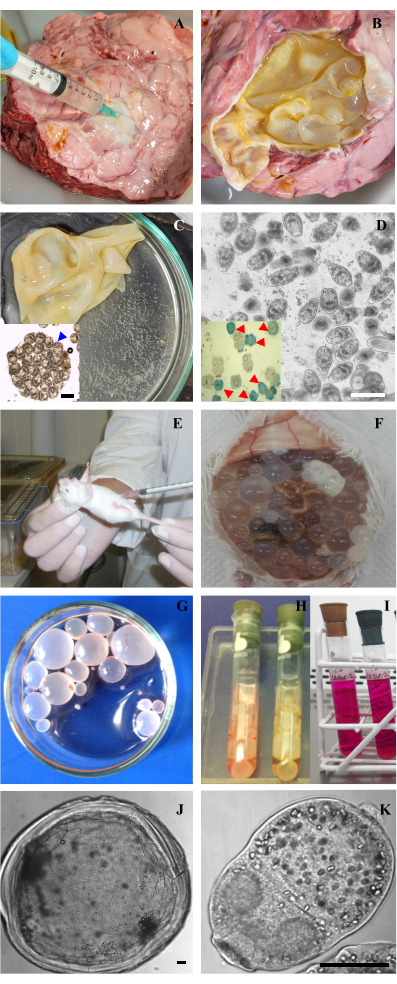
Figura 2: Adquisición de muestras y cultivo in vitro de protoscoleces y metacestodos de Echinococcus granulosus. (A) Punción del quiste hidatídico pulmonar de bovinos para extraer el líquido hidatídico. (B) Quiste hidatídico abierto con su membrana expuesta. (C) Membrana hidatídica y su líquido hialino con cápsulas de cría y protoscoleces libres denominadas "arena hidatídica". Recuadro: Cápsula de cría con protoscoleces en su interior con morfología conservada. (D) Microscopía óptica de protoscoleces vitales después de la extracción de protoscoleces muertos. Barra de 200 μm. Recuadro: Tinción con azul de metileno de protoscoleces que muestra protoscoleces vivos (translúcidos) y protoscoleces muertos (teñidos de azul, indicados con puntas de flecha rojas). (E) Inoculación de protoscoleces en la cavidad peritoneal de un ratón CF-1. (F) Metacestodos dentro de la cavidad abdominal desarrollados después de 7 meses de inoculación con protoscoleces. (G) Quistes aislados de un ratón y lavados con PBS en una placa de Petri. (H,I) Mantenimiento in vitro de metacestodos y protoscoleces en tubos de Leighton con medio M199. (J,K) Microscopía óptica de un metacestodo y un protoscólex de E. granulosus. Las barras indican 50 μm. Haga clic aquí para ver una versión más grande de esta figura.
En la Figura 3 se muestra la caracterización de las VE purificadas a partir de la etapa larvaria de E. granulosus. Los vehículos eléctricos aislados siguiendo el protocolo actual fueron principalmente vehículos eléctricos con diámetros que oscilaron entre 50 y 200 nm, según lo determinado por DLS (Figura 3A) y confirmado por MET (Figura 3B). El análisis TEM también reveló que los sEV exhibían la morfología típica en forma de copa de las vesículas similares a exosomas (Figura 3B). Además, la TEM confirmó que las concentraciones subletales de loperamida pueden actuar como potenciador de la liberación de EV, como lo demuestra una mayor proporción de sEV en las muestras tratadas con loperamida en comparación con los controles. Del mismo modo, la mayor abundancia de sEVs obtenidos de los parásitos tratados con loperamida fue respaldada por las mediciones de la concentración de proteínas (11 ± 1,5 μg/μL en comparación con 6 ± 1 μg/μL en los controles, Figura 3C).

Figura 3: Caracterización de vesículas extracelulares purificadas a partir de la etapa larvaria de E. granulosus . (A) Gráfico de dispersión dinámica de luz (DLS) que representa la distribución de tamaño de los EV aislados de los protoescoles tratados con control (Co) y loperamida (Lp) (PTS). (B) Fotografías de microscopía electrónica de transmisión (TEM) de EV teñidos negativamente purificados a partir de control (a) o PTS tratados con loperamida (d). Las barras de escala indican 50 nm. Las flechas indican abundantes vesículas en forma de exosomas con la típica estructura en forma de copa. (b-c) y (e-f) corresponden a amplificaciones de áreas en caja de (a) y (d), respectivamente. (C) Concentración de proteínas de gránulos de ultracentrifugación de siete ensayos independientes. Los datos se presentan como media ± DE. El asterisco indica diferencias significativas (Kruskal-Wallis con postest de Dunn, p < 0,05). Haga clic aquí para ver una versión más grande de esta figura.
La Figura 4 ilustra la progresión de la generación de BMDC a través de la observación de variaciones en la cantidad y morfología de las células de la médula ósea desde el establecimiento del cultivo inicial hasta la diferenciación completa. En el día 0, las células hematopoyéticas se cultivaron en un medio completo a una densidad de 1× 106 células/mL suplementadas con 300 ng/mL de Flt3L, una citocina y factor de crecimiento que activa a los progenitores hematopoyéticos para que proliferen y se diferencien en la morfología de células dendríticas. En los días 1 y 2, las células seguían siendo pequeñas y de forma redondeada, sin cambios morfológicos significativos, aunque su cantidad había aumentado. Entre los días 3 y 5, se produjo una remodelación activa del citoesqueleto, lo que dio lugar a formas heterogéneas y alargadas con un aumento de las extensiones citoplasmáticas (dendritas). En este punto, los cultivos contenían células adherentes con extensiones citoplasmáticas pronunciadas, células no adherentes que experimentaban cambios morfológicos durante la diferenciación de células dendríticas y células esféricas no adherentes que permanecían sin responder a la inducción de citocinas (Figura 4). Después de los días 6-7, entre el 80% y el 90% de los cultivos consistieron principalmente en BMDC en estado estacionario y completamente diferenciados. Estas células exhibieron una forma estrellada con extensos procesos citoplasmáticos optimizados para la captura y presentación de antígenos. El día 7 se recolectaron los BMDC para analizar su fenotipo y realizar ensayos funcionales.
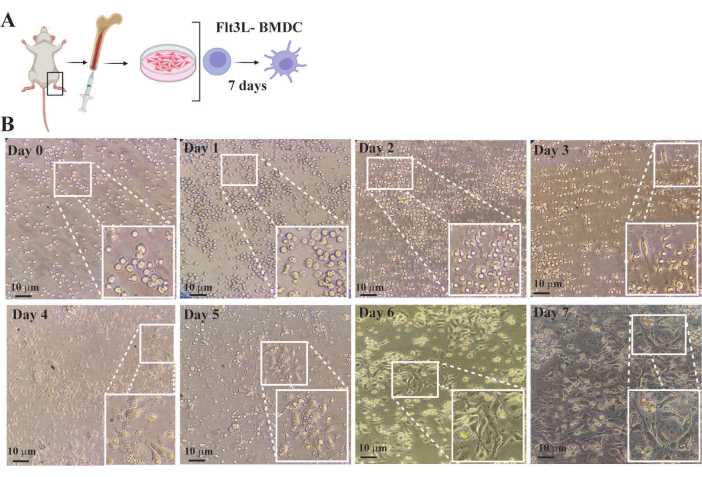
Figura 4: Monitorización de la diferenciación de células dendríticas derivadas de la médula ósea FTL3L mediante un microscopio óptico invertido convencional. (A) Representación esquemática de la purificación de precursores hematopoyéticos a partir de médula ósea de ratón y cultivo celular en medio completo complementado con flt3L B- Imágenes de cultivo de células de médula ósea obtenidas en diferentes puntos temporales. Los recuadros son regiones ampliadas del área en caja de cada imagen. (B) Día 0: Imagen de células hematopoyéticas recién purificadas de médula ósea. Se observa que aunque la población es heterogénea, la mayoría son células con morfología redondeada y tamaño pequeño. Días 1-5: imágenes de cultivo que muestran el aumento en el número de células y cambios en la morfología debido a la proliferación activa inducida por la activación de la vía de señalización FLT3. La morfología celular pasa de redondeada a alargada con un aumento progresivo de las extensiones citoplasmáticas (dendritas). Estos cambios son más notables cuando las células se adhieren a los pocillos de la placa de cultivo. Días 6-7: imágenes que muestran BMDC completamente diferenciadas en estado estacionario caracterizadas por una forma irregular con un núcleo prominente y numerosas proyecciones de ramificación fina, el citoplasma es altamente granular con vesículas involucradas en la presentación de antígenos y la respuesta inmune. La barra representa 10 μm. Haga clic aquí para ver una versión más grande de esta figura.
Dado que las células dendríticas son mediadores esenciales en la activación y orientación de la respuesta inmunitaria inducida, es crucial realizar análisis funcionales de estas células para revelar el papel potencial de las sEV en las interacciones huésped-parásito. El protocolo presentado aquí confirma que los BMDC capturan parásitos-sEV después de 1 hora de incubación a 37 °C. Curiosamente, los sEV parecen estar ubicados en compartimentos endosómico-lisosomales donde se almacenan las moléculas MHCII preformadas a medida que se observa que se colocalizan (Figura 5).
Además, se incluyeron BMDC estimulados con colorante sin EV como controles negativos para validar la especificidad del etiquetado. Solo se observó fluorescencia extracelular inespecífica y 3-4% de las células con señal de colorante difusa, en comparación con más del 40% de las células marcadas positivamente expuestas a sEV teñidas.

Figura 5: Microscopía confocal de inmunofluorescencia de BMDC que muestra la absorción eficiente de sEV marcados y el reclutamiento de MHC clase II a los endosomas. (A) Representación esquemática del protocolo descrito en el ítem 5.3 que muestra la estimulación de sEVs marcados con PKH26 en BMDC. (B) Imagen confocal que muestra un control negativo de BMDCS estimulado por PKH26 sin la presencia de sEV (rojo, PKH26) y (DAPI azul). No se observaron señales fluorescentes del colorante dentro de la célula sin los sEV. (C) Canales separados de imágenes confocales que muestran BMDC estimulados con sEV teñidos: microscopía de contraste de interferencia diferencial (DIC), DAPI (azul, núcleos), PKH26 (rojo, sEVs) y FITC (verde, MHC clase II). Las barras de escala representan 10 μm. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
En la Figura 1 se describe el flujo de trabajo del protocolo para el cultivo de parásitos, el aislamiento de sEV derivados de parásitos, la diferenciación de células dendríticas de la médula ósea y el análisis de la absorción de sEV por parte de estas células. El objetivo fue describir en detalle cada una de las secciones del protocolo que se pueden llevar a cabo en su conjunto o por separado, destacando las principales consideraciones para garantizar la implementación de la metodología. El análisis de la población de VEs obtenidos a partir de organismos parásitos completos tiene un impacto concreto en el estudio de la interrelación parásito-huésped, y precisamente en este contexto se esbozó este protocolo experimental.
Los nuevos conocimientos sobre las enfermedades parasitarias se han visto obstaculizados por la dificultad del cultivo in vitro de algunos de estos parásitos. Como los helmintos parásitos no logran completar sus ciclos de vida en condiciones artificiales, solo pueden sobrevivir en un cultivo como organismos completos. Por lo tanto, la solución que propone este protocolo para estudiar la interfaz gusano-huésped es llevar a cabo de forma independiente el cultivo de cada forma parasitaria (gusano adulto y diferentes formas larvarias) para enriquecer y aislar las sEVs, y luego confrontarlas con las células de los órganos diana o células del sistema inmune del huésped, permitiendo que sean internalizadas o fagocitadas, respectivamente. Además, un paso crítico para establecer un cultivo de helmintos para aislar los VE es seleccionar estrictamente los parásitos vivos para iniciar el cultivo in vitro y mantenerlos en incubaciones lo más corto posible para limitar la muerte del parásito y la generación de membranas residuales libres23. Para su producción en E. granulosus, los protoscoleces recuperados de quistes hidatídicos se someten a un lavado intensivo con PBS frío en tubos de vidrio de pequeño diámetro. Durante la dispersión vigorosa con una pipeta, los protoscoleces vivos se sedimentan rápidamente. Así, se separan de los protoscoleces no viables que permanecen suspendidos durante más tiempo en la columna líquida del tubo, lo que permite su captura y eliminación de la mezcla. De acuerdo con este propósito, durante cada paso de lavado, la mezcla vigorosa con una pipeta también asegura la ruptura de las cápsulas de cría y la liberación de los protoscoleces atrapados en su interior, liberándolos de la membrana circundante. Los cultivos de parásitos se establecen en tubos de vidrio tipo Leighton para evitar la adhesión de los sEVs y con una porción plana para permitir un establecimiento disperso del cultivo de parásitos. En el caso de los metacestodos obtenidos de la cavidad peritoneal de ratones, es fundamental separar la capa adventicial que los recubre y realizar varios lavados con PBS suplementado con antibióticos para eliminar las células asociadas y la microbiota intestinal, lo que puede influir en la pureza de los sEVs derivados del propio helminto, tal y como también describen White et al.23. Los tubos están taponados con tapones de goma estériles, que contribuyen a generar una atmósfera deficiente en oxígeno necesaria para emular el metabolismo fermentativo que estos parásitos mantienen in vivo. Finalmente, el medio M199 es muy apropiado como medio de mantenimiento para la etapa larvaria de cestodos a largo plazo24,25. El medio tiene los componentes mínimos como sales, glucosa y aminoácidos esenciales, y, además, contiene aminoácidos no esenciales, colesterol, pirimidinas, vitaminas hidrosolubles y liposolubles y precursores de ácidos nucleicos como tiamina, riboflavina y biotina. Todos estos nutrientes favorecen el mantenimiento de las funciones orgánicas básicas y la viabilidad de estos parásitos. El M199 se utiliza particularmente para células no transformadas, embriones, explantes primarios y cultivos de órganos, siendo óptimo para el cultivo de masa celular26. Específicamente, cuando se utiliza como medio de cultivo de mantenimiento, M199 debe aplicarse sin suplementación con suplementación de suero fetal bovino, ya que promueve la obtención de protoescoles vesicularizados y su desdiferenciación a microquistes27,28.
Todas las condiciones utilizadas para los cultivos de parásitos deben documentarse para garantizar la reproducibilidad de los resultados que implican la recuperación y la absorción celular de sEV. En particular, un aspecto que influye en la producción de EV es la adición de compuestos que afectan la homeostasis del calcio al cultivo, ya que aumentan la exocitosis dependiente del calcio29,30. En este caso, se propone la adición de loperamida, un inductor de calcio intracelular en E. granulosus19,31, a los cultivos de parásitos para mejorar la liberación de sEV. Este método aumenta el número de vesículas en los cestodos (Figura 3) y podría ser una buena estrategia para mejorar la producción en sistemas celulares con baja liberación de EV. Sin embargo, dado que esta estrategia, al igual que otras modificaciones físicas o químicas del cultivo, podría alterar las propiedades y funcionalidades de los EV, se debe prestar especial atención al realizar análisis de alto rendimiento, como la proteómica.
Los cultivos de cestodos permiten alcanzar concentraciones de EV de órdenes de alta magnitud, dado que su superficie tegumento externa es una capa citoplasmática sincitial adaptada a procesos clave de exocitosis y endocitosis32. La escala de la preparación del EV estará sujeta a los requisitos experimentales. Un total de 9.000 protoscoleces producen en promedio 30 μL de sEVs con una concentración de 1–2.5 ' 108 sEV/mL, suficiente para llevar a cabo análisis de DLS, TEM y LC-MS-MS en paralelo. Una limitación del protocolo es la obtención de una alta cantidad de vesículas a partir de metacestodos debido a la presencia de su capa laminar, lo que dificulta la liberación de vesículas en el medio. Por lo tanto, se requieren grandes cantidades de parásitos (paso 1.3.3)11. Un abordaje alternativo es analizar también los sEVs del líquido hidatídico, como se ha reportado en otros estudios 11,33,34,35,36.
En línea con la tendencia más amplia observada en la investigación de los VE, la mayoría de los estudios sobre los VE helmintos hasta la fecha han empleado la ultracentrifugación de productos excretores/secretores como método principal para el aislamiento y la separación de los VE37. En este protocolo, se utilizó la ultracentrifugación para aislar los vehículos eléctricos, que se considera el método estándar de oro para la recuperación de vehículos eléctricos, aunque puede implicar la inclusión de contaminantes conjuntamente con los vehículos eléctricos15. Una limitación de este método es la eliminación de contaminantes solubles. Dado que los sEV son más grandes que los contaminantes solubles, una alternativa para mejorar la purificación es incorporar pasos adicionales, como el uso de cromatografía de exclusión por tamaño (SEC)38,39. Sin embargo, cuando se requiere el aislamiento de las VE para los análisis funcionales, como el estudio de la comunicación entre el parásito helminto y el huésped, la identificación estricta de la población de VE no es tan crítica, ya que todas ellas transportan carga antigénica. Así, dependiendo de la pureza necesaria para la experimentación posterior, el proceso de aislamiento puede terminar en ultracentrifugación, como se realiza aquí, o puede combinarse con otros métodos como la filtración para eliminar contaminantes grandes, la centrifugación en gradiente de densidad de sacarosa o yodixanol o la cromatografía de exclusión por tamaño, que permiten no solo limpiar los contaminantes sino también separar diferentes poblaciones de VE37, 38,40. En cualquier caso, el método empleado aquí es simple y representa la opción principal para cosechar y enriquecer los sEV de los parásitos39. Proporciona un alto rendimiento de sEVs a un coste relativamente bajo, ya que solo requiere de un laboratorio equipado con una ultracentrífuga en la que se pueden utilizar tubos reutilizables.
La descripción de las características de los vehículos eléctricos aislados es fundamental para determinar la concentración, el tamaño, la calidad y el subtipo de los vehículos eléctricos. Además, el análisis de la composición proteica coopera para determinar qué subpoblaciones de EV están enriquecidas en la muestra, así como para estimar la presencia de posibles contaminantes. La caracterización de los VE puede realizarse mediante diferentes métodos que frecuentemente requieren equipos e instalaciones especializadas41. En este caso, se analizó el tamaño de los SEV parásitos utilizando DLS, que proporciona datos fiables en suspensiones monodispersas, pero es menos preciso en suspensiones con EV de amplia distribución42. Por lo tanto, una alternativa podría ser el uso de otros métodos como el Análisis de Seguimiento de Nanopartículas (NTA), que determina con precisión el tamaño y la cantidad de vesículas, el Sensor de Pulso Resistivo Sintonizable (TRPS), que ofrece un rango dinámico más amplio que el NTA, o el Citómetro de Nanoflujo (NanFCM) que posee una mayor sensibilidad que la citometría de flujo convencional 43,44,45. Asimismo, como parte de la rutina experimental y por recomendación de expertos, la técnica TEM permite determinar integralmente la pureza, rendimiento y tamaño de los VE obtenidos, esencialmente en cosechas de alto EV46. Además, el examen por análisis TEM se recomienda particularmente cuando, después de la ultracentrifugación, no es posible visualizar el pellet EV para verificar la composición del material recuperado.
Estas cuestiones ponen de manifiesto la importancia de utilizar técnicas sólidas para el aislamiento y la caracterización exhaustiva de las VE derivadas de helmintos, lo que podría facilitar la identificación de marcadores específicos para rastrear su destino y, a su vez, permitir la evaluación de sus funciones funcionales.
Las vesículas extracelulares purificadas a partir de E. granulosus representan portadores naturales de transporte de antígenos con varias proteínas antigénicas caracterizadas y desconocidas9. Estos sEV por sí solos pueden estimular las células presentadoras de antígenos distribuidas en diferentes tejidos y órganos linfoides secundarios del huésped. Las células dendríticas son células presentadoras de antígenos profesionales únicas que pueden mostrar antígenos a las células T vírgenes, determinando el tipo de respuesta inmune in vivo47,48.
Este manuscrito describe un protocolo para detallar un método para generar células dendríticas a partir de cultivos de médula ósea de ratón, adaptado de una investigación publicada anteriormente49. En este caso, se propone un método bien establecido para estudios inmunes basado en el cultivo in vitro de BMDC murinas impulsadas por Flt3L, donde el aislamiento de la médula ósea es un paso esencial para lograr un cultivo in vitro exitoso50. Dado que varios protocolos de aislamiento de células de médula ósea producen poblaciones celulares heterogéneas, los cultivos de BMDC deben analizarse por citometría de flujo durante el primer tiempo de diferenciación de Flt3L para establecer el fenotipo celular para los experimentos planificados 51,52,53. La caracterización fenotípica de BMDC bajo el efecto Flt3L indica que la mayoría son células dendríticas convencionales (CD11b+, CD11c+, CD172a+), que se asemejan más a las células dendríticas encontradas in vivo que cargan antígenos exógenos. Mientras que un pequeño porcentaje de BMDC corresponde a células dendríticas plasmocitoides (CD11c+, B220+, SinglecH+) y células dendríticas tipo CD8+ (CD11c+, CD24+ y CD172a-)11,53.
Algunos pasos problemáticos comunes son el bajo rendimiento de BMDC en cultivo, que puede ser el resultado de la rotura ósea durante la preparación, la extracción ineficiente de la médula ósea, la formación de grupos de células, las condiciones de cultivo subóptimas (p. ej., composición del medio, temperatura) o la estimulación insuficiente de citocinas. Para abordar estos problemas, algunas alternativas son cortar detrás de las epífisis, asegurar el lavado completo de las células de la médula ósea desde ambos lados de los fémures y las tibias, suspender exhaustivamente la médula ósea antes de pasar a través del filtro de células, usar citocinas recién preparadas a la concentración recomendada y mantener la esterilidad y la estabilidad del pH del medio de cultivo.
Es imperativo asegurar el estado de "reposo" basal de las células dendríticas antes de inducir su maduración con el contacto con el antígeno. Las células dendríticas no solo reconocen una amplia gama de antígenos externos (PAMPs, patrón molecular asociado a patógenos) y antígenos internos (DAMPs, patrón molecular asociado al peligro), sino que también cambios mínimos en el cultivo celular (pH, agitación leve, densidad celular) pueden inducir su maduración. Por estas razones, los movimientos y vibraciones del cultivo celular deben minimizarse durante la manipulación en la centrífuga o incubadora. Además, el pipeteo debe ser suave sin generar burbujas en el medio. Además, el mantenimiento de cultivos primarios durante más de 8 días puede activar las células dendríticas y promover la muerte celular. Además, una densidad celular superior a 2,5 x 10,6 produce una mayor expresión de MHCII54 y aumenta la maduración antes del contacto con el antígeno. Además, todos los reactivos utilizados deben estar completamente libres de endotoxinas o LPS, consecuencia de la contaminación previa con bacterias gramnegativas, ya que el LPS induce la estimulación o el agotamiento de las células dendríticas23,55. Para mantener la esterilidad durante la manipulación de los cultivos de médula ósea, además de incorporar el uso de antibióticos en los medios, se debe utilizar continuamente etanol en aerosol al 70% en la superficie, las manos enguantadas y los objetos del gabinete, preservando el contacto entre el etanol y las células de la médula ósea. Antes de exponer los instrumentos a los huesos o células, asegúrese de que el etanol se haya evaporado y séquelos al aire porque es venenoso para las células de la médula ósea.
Las células dendríticas promueven su maduración y producción de citoquinas después de reconocer y fagocitar las sEV. Los sEVs de E. granulosus inducen la expresión de IL-12, favoreciendo el perfil Th19. Si la maduración fenotípica de las células dendríticas es deficiente, se debe optimizar el tiempo o la concentración del estímulo logrado con los sEV añadidos. La microscopía confocal es una poderosa herramienta empleada para visualizar la internalización de la carga y la colocalización con moléculas MHC en endosomas de células dendríticas. Además, después de al menos 8 h de la absorción de sEVs, la citometría de flujo también se puede utilizar para medir citocinas intracelulares y moléculas de superficie como CD40, CD80, CD86 y MHCII en células dendríticas maduras11,13.
Una investigación exhaustiva que emplea una amplia gama de técnicas proporcionará una comprensión más profunda de cómo el tamaño, el origen y la carga de los parásitos EV pueden interferir y modificar las respuestas del huésped.
Divulgaciones
Los autores declaran que no tienen conflictos de intereses.
Agradecimientos
Los autores reconocen a la Lic. Cecilia Gutiérrez Ayesta (Servicio de Microscopía Electrónica, CONICET, Bahía Blanca, Argentina) y Lic. Leonardo Sechi y el Lic. Eliana Maza (INIFTA, Universidad Nacional de La Plata, Argentina) por la asistencia técnica en microscopía electrónica de transmisión y dispersión dinámica de luz, respectivamente. También agradecemos a la Dra. Graciela Salerno, Dra. Corina Berón y Dr. Gonzalo Caló por el uso de la ultracentrífuga en el INBIOTEC-CONICET-FIBA, Argentina. Los autores agradecen a la Lic. Kelly (SENASA, Mar del Plata, Argentina) y el Lic. H. Núñez García (CONICET, Universidad Nacional de Mar del Plata, Argentina) por su colaboración en la evaluación del bienestar de ratones, y a Med. Vet. J. Reyno, Med. Vet. S. Gonzalez y Med. Vet L. Netti por su contribución a la obtención de material parasitario. Este trabajo, incluyendo los costos de experimentación, reactivos y equipos, fue apoyado por el PICT 2020 Nº 1651 financiado por la ANPCyT.
Materiales
| Name | Company | Catalog Number | Comments |
| 1.5 mL tubes | Henso | N14059 | |
| 24-well plate | JetBiofil | CAP011024 | Polystyrene, flat bottom, Sterile |
| 6-well plate | Henso Medical Co. Ltd. | N14221 | Flat-shape bottom, PS material, Sterile |
| 70 mm polypropylene cell strainer | Biologix Group Limited | 15-1070 | Sterile |
| Alcian blue 8 GX dye | Santa Cruz | sc-214517B | |
| Automatic CO2 incubator | Nuarire | UN-5100E/G DH | |
| Bovine Serum Albumin | Wiener lab | 1443151 | |
| CD11c Monoclonal antibody-PECy5 100 µg | eBioscience | 15-0114-82 | clone (N418) |
| CD40 Monoclonal antibody-FITC 100 µg | eBioscience | 11-0402-82 | clone (HM40-3) |
| CD80 Monoclonal antibody-APC 100 µg | eBioscience | 17-0801-82 | clone (16-10A-1) |
| CD86 Monoclonal antibody-FITC 100 µg | eBioscience | 11-0862-82 | clone (GL-1) |
| Centrifuge | Thermo Scientific | IEC CL31R Multispeed | |
| Confocal Microscope | Nikon | Nikon Confocal Microscope C1 | |
| Conical tubes 15 mL dia.17 x 120 mm | Citotest | 4610-1865 | |
| DAPI | Sigma | 107K4034 | |
| D-Glucose | Merk | 1.78343 | |
| Dimethyl Sulfoxide | Anedra | 6646 | |
| Fetal Bovine Serum 500 mL | Sigma-Aldrich | 12352207 | |
| Flow Cytometry System | BD Biosciences | BD FACSCanto™ II | |
| Folded Capillary Zeta Cell | Malvern Panalytical | DTS1070 | |
| Gentamicin sulfate salt | Sigma | G1264 | |
| Glutaraldehyde solution | Fluka | 49630 | |
| Hepes | Gibco | 11344041 | |
| Hypodermic needle 21 G x 1"25/8 | Weigao | Sterile | |
| Hypodermic needle 25 G x 5/8" | Weigao | Sterile | |
| Inverted microscope | Leica | DMIL LED Fluo | |
| Ketamine | Holliday | ||
| Lipopolysaccharide 5 mg | Invitrogen | tlrl-rslps | LPS from the Gram-negative bacteria E. coli K12 . TLR2/4 Agonists |
| Loperamide hydrochloride | Sigma-Aldrich | 5.08162 | |
| Medium 199 | Gibco | 11150059 | |
| Methylene Blue | Anedra | 6337 | |
| MHC class I (H2kb) Monoclonal antibody-PE 100 µg | eBioscience | 12-5958-82 | clone (AF6-88.5.5.3) |
| MHC class II (IA/IE) Monoclonal antibody-FITC 100 µg | eBioscience | 11-5321-82 | clone (M5/114.15.2) |
| Microscope | Olympus | CX31 | |
| Mouse recombinant murine Flt3L. | PrepoTech | 250-31L-10UG | |
| Nanodrop | Thermo Scientific | ND-One | |
| Paraformaldehyde | Agar Scientific | R1018 | |
| Penicillin G sodium salt | Sigma | P3032-10MU | |
| PKH26 | Sigma-Aldrich | MINI26 | |
| Potassium Phosphate Monobasic | Timper | For Phosphate Buffered Saline (PBS) | |
| RBC lysis buffer 100 mL | Roche | 11814389001 | |
| RPMI medium 1640 1x 500 mL | Sigma-Aldrich (Gibco) | 11875093 | |
| Sodium Cacodylate | Sigma-Aldrich | C0250 | |
| Sodium Chloride | Anedra | 7647-14-5 | For Phosphate Buffered Saline (PBS) |
| Sodium Phosphate Dibasic (Anhydrous) p. a. | Biopack | 1639.07 | For Phosphate Buffered Saline (PBS) |
| Streptomycin sulfate salt | Sigma | S9137 | |
| Syringe 10 mL | Bremen | Sterile | |
| Thickwall polycarbonate tubes | Beckman Coulter | 13 x 55 mm , nominal capacity 4 mL | |
| Transmission Electron Microscope | Jeol | JEOL JSM 100CX II | |
| Ultracentrifuge | Beckman | Optima LE-80k | 90 Ti rotor |
| Xylazine | Richmond | ||
| Zetasizer Nano | Malvern | Nano ZSizer-ZEN3600 | To perform Dynamic Light scattering and zeta potential measurements |
Referencias
- Wen, H., et al. Echinococcosis: advances in the 21st century. Clin Microbiol Rev. 32 (2), e00075-e00118 (2019).
- Geary, T. G., Thompson, D. P. Development of antiparasitic drugs in the 21st century. Vet Parasitol. 115 (2), 167-184 (2003).
- Drurey, C., Maizels, R. M. Helminth extracellular vesicles: Interactions with the host immune system. Mol Immunol. 137, 124-133 (2021).
- Welsh, J. A., et al. Minimal information for studies of extracellular vesicles (MISEV2023): From basic to advanced approaches. J. Extracell Vesicles. 13 (2), e12404 (2024).
- Cresswell, P. Antigen processing and presentation. Immunol Rev. 207, 5-7 (2005).
- Buzas, E. I. The roles of extracellular vesicles in the immune system. Nat Rev Immunol. 23 (4), 236-250 (2023).
- Bennett, A. P. S., de la Torre-Escudero, E., Oliver, N. A. M., Huson, K. M., Robinson, M. W. The cellular and molecular origins of extracellular vesicles released by the helminth pathogen Fasciola hepatica. Int J Parasitol. 50 (9), 671-683 (2020).
- Drurey, C., Coakley, G., Maizels, R. M. Extracellular vesicles: new targets for vaccines against helminth parasites. Int J Parasitol. 50 (9), 623-633 (2020).
- Nicolao, M. C., et al. Characterization of protein cargo of Echinococcus granulosus extracellular vesicles in drug response and its influence on immune response. Parasit Vectors. 16 (1), 255 (2023).
- Sánchez-López, C. M., Trelis, M., Bernal, D., Marcilla, A. Overview of the interaction of helminth extracellular vesicles with the host and their potential functions and biological applications. Mol Immunol. 134, 228-235 (2021).
- Nicolao, M. C., Rodriguez, R. C., Cumino, A. C. Extracellular vesicles from Echinococcus granulosus larval stage: Isolation, characterization and uptake by dendritic cells. PLoS Negl Trop Dis. 13 (1), e0007032 (2019).
- Kuipers, M. E., et al. DC-SIGN mediated internalisation of glycosylated extracellular vesicles from Schistosoma mansoni increases activation of monocyte-derived dendritic cells. J Extracell Vesicles. 9 (1), 1753420 (2020).
- Murphy, A., et al. Fasciola hepatica extracellular vesicles isolated from excretory-secretory products using a gravity flow method modulate dendritic cell phenotype and activity. PLoS Negl Trop Dis. 14 (9), e0008626 (2020).
- Ricciardi, A., et al. Extracellular vesicles released from the filarial parasite Brugia malayi downregulate the host mTOR pathway. PLoS Negl Trop Dis. 15 (1), e0008884 (2021).
- Zhang, Q., Jeppesen, D. K., Higginbotham, J. N., Franklin, J. L., Coffey, R. J. Comprehensive isolation of extracellular vesicles and nanoparticles. Nat Protoc. 18 (5), 1462-1487 (2023).
- Brezgin, S., et al. Basic guide for approaching drug delivery with extracellular vesicles. Int J Mol Sci. 25 (19), 10401 (2024).
- Pinheiro, A. A., et al. Potential of extracellular vesicles in the pathogenesis, diagnosis, and therapy for parasitic diseases. J Extracell Vesicles. 13 (8), e12496 (2024).
- Barnadas-Carceller, B., Del Portillo, H. A., Fernandez-Becerra, C. Extracellular vesicles as biomarkers in parasitic disease diagnosis. Curr Top Membr. 94, 187-223 (2024).
- Nicolao, M. C., Denegri, G. M., Carcamo, J. G., Cumino, A. C. P-glycoprotein expression and pharmacological modulation in larval stages of Echinococcus granulosus. Parasitol Int. 63 (1), 1-8 (2014).
- Nicolao, M. C., Cumino, A. C. Biochemical and molecular characterization of the calcineurin in Echinococcus granulosus larval stages. Acta Trop. 146, 141-151 (2015).
- Savina, A., Furlan, M., Vidal, M., Colombo, M. I. Exosome release is regulated by a calcium-dependent mechanism in K562 cells. J Biol Chem. 278 (22), 20083-20090 (2003).
- Ambattu, L. A., et al. High frequency acoustic cell stimulation promotes exosome generation regulated by a calcium-dependent mechanism. Commun Biol. 3 (1), 553 (2020).
- White, R., et al. Special considerations for studies of extracellular vesicles from parasitic helminths: A community-led roadmap to increase rigour and reproducibility. J Extracell Vesicles. 12 (1), e12298 (2023).
- Casado, N., Rodriguez-Caabeiro, F., Hernandez, S. In vitro survival of Echinococcus granulosus protoscolices in several media, at +4 degrees C and +37 degrees C. Z Parasitenkd. 72 (2), 273-278 (1986).
- Casado, N., Rodriguez-Caabeiro, F., Jiménez, A., Criado, A., de Armas, C. In vitro effects of levamisole and ivermectin against Echinococcus granulosus protoscoleces. Int J Parasitol. 19 (8), 945-947 (1989).
- Al-Lamki, R. S., Bradley, J. R., Pober, J. S. Human organ culture: updating the approach to bridge the gap from in vitro to in vivo in inflammation, cancer, and stem cell biology. Front Med. 4, 148 (2017).
- Rodriguez-Caabeiro, F., Casado, N. Evidence of in vitro germinal layer development in Echinococcus granulosus cysts. Parasitol Res. 74 (6), 558-562 (1988).
- Loos, J. A., Cumino, A. C. In vitro anti-echinococcal and metabolic effects of metformin involve activation of AMP-activated protein kinase in larval stages of Echinococcus granulosus. PLoS One. 10 (5), e0126009 (2015).
- Erwin, N., Serafim, M. F., He, M. Enhancing the cellular production of extracellular vesicles for developing therapeutic applications. Phar. Res. 40 (4), 833-853 (2023).
- Sako, Y., et al. Identification of a novel small molecule that enhances the release of extracellular vesicles with immunostimulatory potency via induction of calcium influx. ACS Chem Biol. 18 (4), 982-993 (2023).
- He, L. P., Mears, D., Atwater, I., Rojas, E., Cleemann, L. Loperamide mobilizes intracellular Ca2+ stores in insulin-secreting HIT-T15 cells. Br J Pharmacol. 139 (2), 351-361 (2003).
- Dalton, J. P., Skelly, P., Halton, D. W. Role of the tegument and gut in nutrient uptake by parasitic platyhelminths. Can J Zool. 82 (2), 211-232 (2004).
- Dos Santos, G. B., et al. Excretory/secretory products in the Echinococcus granulosus metacestode: is the intermediate host complacent with infection caused by the larval form of the parasite. Int J Parasitol. 46 (13-14), 843-856 (2016).
- Siles-Lucas, M., et al. Isolation and characterization of exosomes derived from fertile sheep hydatid cysts. Vet Parasitol. 236, 22-22 (2017).
- Yang, J., et al. Identification of different extracellular vesicles in the hydatid fluid of Echinococcus granulosus and immunomodulatory effects of 110 K EVs on sheep PBMCs. Front Immunol. 12, 602717 (2021).
- Khosravi, M., et al. Characterisation of extracellular vesicles isolated from hydatid cyst fluid and evaluation of immunomodulatory effects on human monocytes. J Cell Mol Med. 27 (17), 2614-2625 (2023).
- Sotillo, J., et al. The protein and microRNA cargo of extracellular vesicles from parasitic helminths–current status and research priorities. Int J Parasitol. 50 (9), 635-645 (2020).
- Kuipers, M. E., et al. Optimized protocol for the isolation of extracellular vesicles from the parasitic worm Schistosoma mansoni with improved purity, concentration, and yield. J Immunol Res. 2022 (1), 5473763 (2022).
- Fernandez-Becerra, C., et al. Guidelines for the purification and characterization of extracellular vesicles of parasites. J Extracell Biol. 2 (10), e117 (2023).
- Chaiyadet, S., et al. Silencing of Opisthorchis viverrini tetraspanin gene expression results in reduced secretion of extracellular vesicles. Front Cell Infect Microbiol. 12, 827521 (2022).
- Théry, C., et al. Minimal information for studies of extracellular vesicles 2018 (MISEV2018): A position statement of the International Society for Extracellular Vesicles and update of the MISEV2014 guidelines. J Extracell Vesicles. 7 (1), 1535750 (2018).
- Szatanek, R., et al. The methods of choice for extracellular vesicles (EVs) characterization. Int J Mol Sci. 18 (6), 1153 (2017).
- Blundell, E. L. C. J., Mayne, L. J., Billinge, E. R., Platt, M. Emergence of tunable resistive pulse sensing as a biosensor. Anal Methods. 7 (17), 7055-7066 (2015).
- Vucetic, A., Filho, A., Dong, G., Olivier, M. Isolation of extracellular vesicles from Leishmania spp. Methods Mol Biol. , 555-574 (2020).
- Caputo, F., et al. Measuring particle size distribution and mass concentration of nanoplastics and microplastics: Addressing some analytical challenges in the submicron size range. J Colloid Interface Sci. 588, 401-417 (2021).
- Crescitelli, R., Lässer, C., Lötvall, J. Isolation and characterization of extracellular vesicle subpopulations from tissues. Nat Protoc. 16 (3), 1548-1580 (2021).
- Trombetta, E. S., Mellman, I. The cell biological basis of antigen presentation in vitro and in vivo. Ann Rev Immunol. 23 (1), 975-1028 (2005).
- Hammer, G. E., Ma, A. Molecular control of state dendritic cell maturation and immuno homeostasis. Ann Rev Immunol. 31 (1), 743-791 (2013).
- Weigel, B. J., et al. Comparative analysis of murine marrow–derived dendritic cells generated by Flt3L or GM-CSF/IL-4 and matured with immune stimulatory agents on the in vivo induction of antileukemia responses. Blood. 100 (12), 4169-4176 (2002).
- March, N., et al. Differences in dendritic cells stimulated in vivo by tumors engineered to secrete granulocyte macrophage colony-stimulating factor or Flt3-ligand. Cancer Res. 60, 3239-3246 (2000).
- Heath, W. R., et al. Cross-presentation, dendritic cell subsets, and the generation of immunity to cellular antigens. Immunol Rev. 199 (1), 9-26 (2004).
- Naik, S., et al. Cutting edge: generation of splenic CD8+ and CD8− dendritic cell equivalents in Fms-like tyrosine kinase 3 ligand bone marrow cultures. J Immunol. 174 (11), 6592-6597 (2005).
- Sauter, M., et al. Protocol to isolate and analyze mouse bone marrow derived dendritic cells (BMDC). STAR Protoc. 3 (3), 101664 (2022).
- Helft, J., et al. GM-CSF mouse bone marrow cultures comprise a heterogeneous population of CD11c(+) MHCII(+) macrophages and dendritic cells. Immunity. 42 (6), 1197-1211 (2015).
- Borup, A., et al. Comparison of separation methods for immunomodulatory extracellular vesicles from helminths. J Extracell Biol. 1 (5), e41 (2022).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados