Method Article
Click Kimyası ve Genleşme Mikroskobu ile Hücre İçi Sialilasyonun Görselleştirilmesi
Bu Makalede
Özet
Burada, rutin mikroskopi ekipmanı kullanarak hücre içi sialillenmiş N-glikoproteinlerin biyogörüntülemesine izin veren metabolik oligosakkarit mühendisliği, tıklama kimyası ve genleşme mikroskobunu birleştiren basit bir protokol öneriyoruz.
Özet
Metabolik etiketleme teknikleri, biyoortogonal raportörlerin glikanlara dahil edilmesine izin vererek, tıklama ve biyoortogonal kimya yoluyla hücreler içindeki moleküler boyaların hedeflenen biyokonjugasyonunu sağlar. Metabolik oligosakkarit mühendisliği (MOE), moleküler tanımayı içeren çok sayıda biyolojik süreçte glikozilasyonun önemli rolü ve kanserden genetik bozukluklara, viral ve bakteriyel enfeksiyonlara kadar çeşitli patolojiler üzerindeki etkisi nedeniyle büyük ilgi görmüştür.
MOE, hücre yüzeyi glikokonjugatlarının tespiti için daha iyi bilinmesine rağmen, aynı zamanda fizyolojik ve patolojik bağlamlarda hücre içi glikanların incelenmesi için çok önemli bir metodolojidir. Bu tür çalışmalar, yüksek uzamsal çözünürlükten büyük ölçüde yararlanır. Bununla birlikte, süper çözünürlüklü mikroskopi çoğu laboratuvarda hazır değildir ve günlük uygulama için zorluklar doğurur. Genleşme mikroskobu, floresan işaretleyicilerle etiketlenmiş biyolojik örnekleri fiziksel olarak büyüterek mikroskopinin çözünürlüğünü artıran yeni bir alternatiftir. Numuneyi şişirilebilir bir jel içine gömerek ve kimyasal işlem yoluyla izotropik olarak genişlemesine neden olarak, hücre altı yapılar, süper çözünürlük tekniklerine ihtiyaç duymadan gelişmiş hassasiyet ve çözünürlükle görselleştirilebilir.
Bu çalışmada, MOE ve tıklama kimyasının birlikte kullanımı yoluyla hücre içi sialillenmiş glikanları görselleştirmek için genleşme mikroskobunun kapasitesini gösteriyoruz. Spesifik olarak, ko-lokalizasyon çalışmaları için immünofloresan ile ilişkili olabilecek sialilasyonu hedefleyen bir raportör kullanan biyoortogonal etiketleme ve genleşme mikroskobu için bir prosedür öneriyoruz. Bu protokol, sialokonjugat biyosentezi, hücre içi kaçakçılığı ve geri dönüşümün lokalizasyon çalışmalarını mümkün kılar.
Giriş
Floresan mikroskobu, hücreler içindeki belirli molekülleri etiketlemek ve görselleştirmek için yaygın olarak kullanılırken, yaklaşık 200-250 nm'den daha yakın nesneler arasında ayrım yapma yeteneğini kısıtlayan Abbe'nin ışıkkırınım sınırı 1 ile doğal olarak çözünürlükte sınırlıdır. Bu sınırlama, ışığın dalga doğasından ve mikroskobun objektif merceğinin sayısal açıklığından kaynaklanır ve hücre altı yapıları görüntülerken bir zorluk ortaya çıkarır. Bu sınırlamaların üstesinden gelmek, nanometrik ölçekte belirli biyolojik süreçler hakkında daha iyi bilgiler sağlar.
Işığın kırınım sınırını aşmak için STORM (Stokastik Optik Rekonstrüksiyon Mikroskobu) ve STED (Uyarılmış Emisyon Tükenmesi) gibi süper çözünürlüklü mikroskopi teknikleri geliştirilmiştir 2,3. STORM, floroforların stokastik aktivasyonuna dayanır ve herhangi bir zamanda yalnızca seyrek bir alt kümenin görüntülenmesine izin verir. Bu, yüksek çözünürlüklü bir görüntünün yeniden yapılandırılmasına izin veren tek tek floroforların hassas bir şekilde lokalizasyonunu sağlar. Öte yandan STED, uyarma noktasının çevresi etrafındaki floresansı seçici olarak söndürmek için bir tükenme lazeri kullanarak çözünürlüğü iyileştirir ve nokta yayılma işlevini etkili bir şekilde daraltır.
Bu yaklaşımlar, tüm floroforların aynı anda algılandığı geniş alan veya konfokal mikroskopi ile kontrast oluşturur, bu da tüm kırınım modellerini birleştiren ve yakındaki bireysel floroforlar arasındaki ayrımı önleyen ve çözünürlük kaybına yol açan bir görüntü ile sonuçlanır. Bununla birlikte, bu süper çözünürlüklü yöntemler çok özel ışık kaynakları, ekipman, numune hazırlama ve/veya floroforlar gerektirir, bu da bu teknolojileri maliyetli, çoğu laboratuvarda erişilmesi zor ve rutin deneylerde uygulanması zor hale getirir. Bu kısıtlamalar, bilim camiasının, hazır mikroskopi ekipmanı ve rutin boyama protokolleri ile uyumlu olacak daha yüksek çözünürlük elde etmek için alternatif çözümler aramasına yol açmıştır. 2015 yılında, numuneyi fiziksel olarak genişleterek optik mikroskopinin sınırlamalarını aşmak için Boyden ve meslektaşları tarafından Genişleme Mikroskobu (ExM) 4 adı verilen bir yöntem geliştirildi.
ExM, ışığın kırınım sınırını aşmadan biyolojik numunelerin nano ölçekli ayrıntılarını sağlayan üç aşamalı bir yöntemdir (Şekil 1). Bunun yerine, izotropik bir şekilde fiziksel olarak büyütülmüş numuneleri görüntülemek için geleneksel kırınım sınırlı mikroskoplar kullanır. Jelleşme adı verilen ilk adım, biyolojik numunenin, tipik olarak sabit hücrelerin veya dokuların, sodyum akrilat ve akrilamid bazlı şişebilir bir polielektrolit hidrojel içine gömülmesinden oluşur. Biyolojik numune daha sonra proteinler veya zarlar gibi belirli bileşenleri kısmen parçalamak ve hücrelerin düzgün bir şekilde genişleyebilmesini sağlamak için yoğun hücresel yapıları parçalamak için enzimatik işleme tabi tutulur. Parçalama adı verilen bu adım, numunenin yapısal bileşenlerini mekanik özelliklere göre homojenize ederek ve numunenin bozulmasına yol açabilecek diferansiyel genleşmeyi önleyerek bunu başarmaya yardımcı olur. Son olarak, genleşme adı verilen son adımda, hidrojel ile gömülmüş ve sindirilmiş numune, deiyonize suya yerleştirilerek şişmesi sağlanır. Bu teknoloji, numunenin her boyutta yaklaşık 4-5 kat doğrusal bir büyütme faktörü ile genişlemesine neden olur ve standart mikroskopi teknikleri kullanılarak ince hücresel ayrıntıların görselleştirilmesine olanak tanır. Genleşmenin izotropik doğası göz önüne alındığında, jel matrisi içinde büyütülen biyolojik numune, üç boyutlu geometrik ayrıntılarını ve çeşitli yapısal bileşenleri arasındaki uzamsal ilişkileri korur. Bu nedenle, uzamsal bilgi şişme üzerine korunurken, jel bağlantılı floresan etiketler veya biyomoleküller arasındaki mesafe her yöne eşit şekilde artar. Bu, sinyallerin daha iyi ayrılmasını sağlayarak gelişmiş çözünürlük sağlar.

Şekil 1: ExM Protokolüne Genel Bakış. (a) Jelleşme: Biyolojik numune sabitlenir ve şişirilebilir bir polielektrolit hidrojel içine gömülür. (b) Sindirim: Numunenin mekanik özellikleri, enzimler ve deterjanlar kullanılarak, aksi takdirde genleşmeyi kısıtlayacak ve bozulmalara neden olacak proteinleri ve lipit zarlarını parçalayarak homojenize edilir. (c) Genleşme: Hidrojel, deiyonize suya daldırılır ve izotropik olarak genişlemesine neden olur. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
ExM, 2015 yılından bu yana mekansal bilgilerin korunmasında önemli teknolojik gelişmeler gördü. Özellikle, biyomolekülleri doğrudan şişirilebilir hidrojel 5,6'ya kovalent olarak bağlamak için çeşitli moleküler ankrajlar tasarlanmıştır. Bu protokolde, bir akriloil grubunu glikoproteinler de dahil olmak üzere hücrenin proteinlerine biyokonjuge etmek için biyomoleküllerin serbest amin gruplarıyla (tipik olarak, lizin kalıntıları veya proteinlerin N-terminal pozisyonları) reaksiyona giren N-akriloksisüksinimid (NAS) kullandık. Bu akriloil grubu daha sonra jelleşme sırasında çapraz bağlama reaksiyonları yoluyla diğer monomerlerle reaksiyona girer ve bu biyomolekülleri doğrudan polimere bağlar.
ExM, Metabolik Oligosakkarit Mühendisliği (MOE) dahil olmak üzere çok çeşitli etiketleme yöntemleriyle uyumludur. MOE, biyoortogonal bir kimyasal tutamak7 ile donatılmış metabolik öncülerin analoglarını birleştirerek glikanların etiketlenmesini sağlayan güçlü bir araçtır. Kimyasal raportörler olarak bilinen bu analoglar, toksisiteye neden olmadan metabolik yollara entegre olur. MOE yaklaşımında, raportör monosakkaritler metabolik olarak aktive edilmiş nükleotid şekerlerine işlenir ve daha sonra yeni ortaya çıkan glikokonjugatlara aktarılır. Birincil odak noktamız, hücre-hücre etkileşimleri, bağışıklık regülasyonu ve gelişimindeki rolleri nedeniyle sağlık ve hastalık bağlamında çok önemli olan sialilasyon, özellikle hücre içi dinamikler ve sialillenmiş N-glikoproteinlerin kaçakçılığı olmak üzere sialilasyon çalışmasıdır. Anormal sialilasyon, kanser 8,9,10,11, bulaşıcı hastalıklar12 ve genetik bozukluklar 13,14,15 gibi hastalıklarda rol oynar ve bu da onu terapötik geliştirme ve biyobelirteç keşfi için önemli bir hedef haline getirir. Sialilasyonu anlamak, glikobiyoloji ve hastalık mekanizmalarına ilişkin içgörüleri geliştirir.
Sialilasyon, insanlarda en bol bulunan sialik asit olan N-asetilnöraminik asit (Neu5Ac) analogları ile veya Neu5Ac'nin metabolik bir öncüsü olan N-asetilmannozamin (ManNAc) analogları ile MOE kullanılarak incelenebilir ve biyoortogonal bir sap 8,16 taşır. ManNAc, sitozolde Neu5Ac'ye dönüştürülür, daha sonra çekirdekte sitididin-5'-monofosfo-N-nöraminik aside (CMP-Neu5Ac) aktive edilir. Bir nükleotid şekerine aktive edildikten sonra, Golgi aygıtındaki siail transferazlar, Neu5Ac birimlerini büyüyen glikan zincirlerinin terminal pozisyonlarına aktarır (Şekil 2). Doğal olmayan ManNAc türevlerinin metabolik olarak dahil edilmesinin ardından, etiketli sialillenmiş glikanlar, biyoortogonal tıklama kimyası yoluyla raportör tutamağına tamamlayıcı reaktif bir grup taşıyan bir florofora kovalent olarak bağlanabilir. Bu, glikokonjugatların in vivo veya ex vivo olarak doğrudan gözlemlenmesine izin verir.
Çoğu monosakkarit raportör için, pasif difüzyon yoluyla plazma zarını geçmek için perasetillenmiş bir form gereklidir. Bununla birlikte, hem perasetillenmiş hem de korunmasız raportörlerin sialilasyonu etkili bir şekilde araştırdığı gösterilmiştir16. Korunmasız sialilasyon raportörleri, Neu5Ac analogları için pinositoz ve ManNAc için henüz tanımlanmamış bir taşıyıcı olan aktif taşıma mekanizmaları ile hücrelere girebilirler. Korunmasız şekerler, karşılaştırılabilir etkiler elde etmek için daha yüksek bir konsantrasyon (tipik olarak 100-500 μM) gerektirirken, hücrenin içine girdikten sonra doğrudan sialik asit metabolik yoluna girebilirler. Buna karşılık, perasetillenmiş şekerlerin, metabolik olarak aktif hale gelmeden önce hücre içi spesifik olmayan esterazlar tarafından tamamen deasetillenmesi gerekir. Daha düşük konsantrasyonlarda (tipik olarak 10-50 μM) kullanılabilmelerine rağmen, eksik deasetilasyon, enzim aktivitesine müdahale edebilir veya kısmen asetillenmiş sialik asit analoglarının dahil edilmesine yol açabilir ve bu da potansiyel olarak aşağı akış analizini çarpıtabilir. Ek olarak, asetik asit salınımı pH'ı lokal olarak etkileyebilir ve potansiyel olarak hücresel işlevi etkileyebilir. Chen ve meslektaşları ayrıca, per-O-asetillenmiş şekerlerin, enzimatik olmayan bir mekanizma yoluyla proteinlerdeki serbest sistein kalıntıları ile reaksiyona girdiğini, hedef dışı birleşmeye ve spesifik olmayan sinyalin artmasına yol açtığını göstermiştir 17,18. Bu nedenle mevcut protokolde korumasız ManNAc muhabirleri istihdam ediyoruz.

Şekil 2: Sialik asitlerin metabolik oligosakkarit mühendisliği ve etiketlenmesi. UDP-GlcNAc, sitozoldeki GNE/MNK'nin UDP-GlcNAc 2-epimaz alanı tarafından ManNAc'ye dönüştürülür. ManNAc daha sonra ManNAc-6-fosfat oluşturmak için GNE/MNK'nin ManNAc 6-kinaz alanı ile sitozolde fosforile edilir. N-asetilnöraminat sentaz, ManNAc-6-P'nin fosfoenolpiruvat ile yoğunlaşmasını katalize ederek Neu5Ac-9-fosfat üretir ve daha sonra Neu5Ac elde etmek üzere sialik asit fosfataz ile fosforillenir. Neu5Ac ayrıca endositoz ve lizozomal geri dönüşüm8 yoluyla kurtarma yolu tarafından da sağlanabilir. Çekirdeğe taşındıktan sonra, CMP-sialik asit sentetaz tarafından CMP-Neu5Ac'ye dönüştürülür. Golgi aygıtında, CMP-NeuAc, sonunda hücre zarında eksprese edilen veya salgılanan, olgunlaşan glikokonjugatlar üzerindeki glikanların terminal pozisyonlarında bir Neu5Ac kısmı oluşturan sialiltransferazların substratıdır. Biyoortogonal bir tutamak taşıyan ManNAz kimyasal raportörleri, tanımlanamayan bir aktif taşıyıcı aracılığıyla hücreye nüfuz edebilir ve metabolik yola girebilir. Biyosentezden sonra glikanlara dahil edilen etiketli Neu5Az birimleri daha sonra bir floresan probun CuAAC aracılı konjugasyonu yoluyla etiketlenir. Kısaltmalar: NAc = N-asetil; UDP-GlcNAc = Üridin difosfat N-asetilglukozamin; ManNAc = N-asetilmannozamin; GNE = UDP-GlcNAc 2-epimeraz; MNK = ManNAc 6-kinaz; ManNAc-6-P = ManNAc-6-fosfat; NANS = N-asetilnöraminat sentaz; PEP = fosfoenolpiruvat; Neu5Ac = N-asetilnöraminik asit; Neu5Ac-9-P = Neu5Ac-9-fosfat; NANP = sialik asit fosfataz; CMP = sitidin-5"-monofosfat; CMAS = CMP-sialik asit sentetaz; ST'ler = sialiltransferazlar; ManNAz = N-azidoasetilmannozamin; Neu5Az = N-azidoasetilnöraminik asit. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Olası biyoortogonal reaksiyonlar arasında, ilgimizi Bakır katalizli Azide-Alkin Sikloilavesi (CuAAC)16,19 üzerine odakladık. Deneyimlerimize göre, CuAAC, sabit hücrelerde hücre içi glikanları etiketlemek için en iyi seçenektir. Bu reaksiyon iyi kurulmuş, biyoortogonal kimyada kapsamlı bir şekilde incelenmiştir ve karmaşık biyolojik ortamlarda kullanım için standartlaştırılmış, sağlam bir bilgi temeli ve optimize edilmiş protokoller sağlamıştır. Hızlı kinetiği gerçekten de yüksek reaksiyon verimliliği ve özgüllüğü sunar ve sentezlenmesi kolay, kararlı, canlı sistemlerde bulunmayan ve doğal biyomoleküllere karşı inert olan azid ve alkin gruplarını içerir, bu da onu bakır toksisitesinin bir sorun olmadığı sabit hücreli uygulamalar için ideal hale getirir. Suş destekli Alkin-Azid Siklo Ekleme (SPAAC)20,21, bakır toksisitesinden kaçınırken, hidrofobik tuzak nedeniyle hücre içi uygulamalar için daha yüksek arka plan sinyaline ve daha düşük sinyal-gürültü oranına yol açma eğiliminde olan daha yavaş kinetiklere ve daha hacimli problara sahipken, Ters Elektron Talebi Diels-Alder (IEDDA)22,23, hızlı ve bakır içermemesine rağmen, daha karmaşık prob sentezini içerir ve MOE uygulamalarında henüz tam olarak karakterize edilmemiş daha hacimli raportör grupları gerektirir. ExM yalnızca sabit hücreler gerektirdiğinden, CuAAC biyoortogonal etiketleme için sağlam ve verimli bir çözüm sunar.
Bu makale, metabolik etiketleme, biyoortogonal tıklama kimyası ve genleşme mikroskobunu birleştirerek hücrelerde hücre içi sialillenmiş glikoproteinlerin görselleştirilmesi için bir protokol sunmaktadır. Bu yazıda açıklanan deneysel prosedürlerde, kimyasal raportör olarak N-azidoasetilmannozamin (ManNAz) kullanıyoruz ve genişletme prosedüründen önce küçük organik floroforların CuAAC ligasyonu gerçekleştiriliyor. Glikoproteinler, jelleşme, sindirim ve genişlemeden önce NAS ile hidrojele bağlanır. Sialik asitlerin MOE etiketlemesi, burada cis-Golgi aparatında lokalize edilmiş bir fare anti-GM130 birincil antikoru ile örneklendiği gibi, ko-lokalizasyon değerlendirmesi için immünofloresan yaklaşımları ile ilişkilendirilebilir. Bu protokol, fizyolojik durumdaki hücrelere veya kimyasal işleme tabi tutulmuş hücrelere uygulanabilir. Bunu göstermek için, klorokin, hücreler içindeki glikoproteinlerin işlenmesini ve kaçakçılığını etkileyen lizozomal fonksiyonu inhibe etmek için kullanıldı. Nükleer boyama, yalnızca hücreleri lokalize etmek için değil, aynı zamanda ExM işleminin kalitesinin bir göstergesi olarak da bir dönüm noktası olarak kullanılır. Genişleme faktörü gerçekten de çekirdeğin genişleme öncesi (preExM) ve genişleme sonrası (postExM) boyutunun karşılaştırılmasıyla ölçülebilir.
Protokol
1. Hücre tohumlama
NOT: Sonraki adımları steril koşullar altında laminer akış başlığı altında gerçekleştirin. Bu yöntem, mevcut çalışmada kullanılan hücre dizilerinden herhangi birine (HeLa, MCF7, primer fibroblastlar) veya araştırmada yaygın olarak kullanılan çoğu yapışık hücre dizisi modelineuygulanabilir 20,24,25.
- % 5 CO2 atmosferi altında 37 ° C'de bir T75 şişesinde% 10 fetal sığır serumu (FBS) ile desteklenmiş DMEM yüksek glikoz ortamında hücreleri büyütün.
- Hücreler tam birleşmeye ulaştığında, hücre kültürü ortamını çıkarın ve hücreleri 4 mL PBS ile yıkayın.
NOT: Bu adımda ve sonraki tüm yıkama adımlarında kullanılan PBS çözeltileri, kullanımdan önce 0.2 μm'lik bir PTFE membrandan süzülerek steril hale getirilmelidir. - Hücreleri, şişenin dibinden serbest bırakmak için 0.5 g / L tripsin içeren 2 mL 1x tripsin-EDTA çözeltisinde 37 ° C'de 5 dakika inkübe edin.
- % 10 FBS içeren 8 mL DMEM yüksek glikoz ortamı ekleyin ve her bir hücrenin şişenin dibinden ayrıldığından emin olmak için iyice karıştırın.
- Hücreleri 15 mL'lik konik bir tüpe aktarın ve 200 × g'da 5 dakika santrifüjleyin. Bu arada, 12 oyuklu bir plakanın her bir oyuğuna bir lamel (çap 12 mm, kalınlık 130-160 μm) ekleyin.
NOT: Lamel kalınlığı, sonraki görüntüleme adımlarında kullanılan mikroskobun gereksinimlerine uyacak şekilde ayarlanmalıdır. - Santrifüjlemeden sonra süpernatanı çıkarın ve peleti 1 mL hücre kültürü ortamında yeniden süspanse edin.
- En az iki ölçümde hemositometri ile ortalama hücre / mL sayısını belirleyin.
- Hücre süspansiyonunu, hücre kültürü ortamında mL başına 300.000 hücre konsantrasyonuna seyreltin ve her bir oyuğa 1 mL süspansiyon tohumu ekin.
- Sonraki adımlardan önce,% 5 CO2 atmosferi altında% 37 ° C'de% 10 FBS içeren% 10 FBS içeren DMEM yüksek glikoz ortamında 24 saat bekletin.
2. Klorokin tedavisi (isteğe bağlı)
NOT: Adım 2.1-2.8, örnek olarak klorokin kullanılarak, harici bir reaktif (inhibitör, efektör, ilaç) ile tedavi edilen hücrelerde protokolün nasıl kullanılacağını göstermektedir. Harici reaktiflerle tedavi edilmeyen hücreler için bu adımları atlayın.
- Yeterli hacimde 10 mM'lik bir stok çözeltisi hazırlamak için doğru miktarda klorokin difosfat tuzu (CQ) tartın.
NOT: Sonraki adımları steril koşullar altında laminer akış başlığı altında gerçekleştirin. - Katı CQ'yu 10 mM'lik bir nihai konsantrasyon için istenen miktarda deiyonize suda çözündürün.
- Çözeltiyi 0,2 μm'lik bir filtreden süzün.
- 10 mM'lik stok çözeltisinin 1 mL'sini 1.5 mL'lik mikrosantrifüj tüplerinde alın ve -20 °C'de saklayın.
- Adım 1.9'da hazırlanan hücre örneğini 1 mL PBS ile yıkayın.
- 100 μM CQ'luk bir nihai konsantrasyon için% 10 FBS içeren% 10 mL DMEM yüksek glikoz ortamına 100 μL 10 mM CQ ekleyin.
- Hücreleri,% 5 CO2 atmosferi altında 37 ° C'de 100 μM CQ ile desteklenmiş bir ortamın 1 mL'sinde 8 saat inkübe edin.
- Hücreleri 3x 1 mL PBS ile yıkayın.
3. Metabolik oligosakkarit mühendisliği
- % 10 FBS içeren DMEM yüksek glikoz ortamında 5 mM'lik bir ManNAz (veya negatif kontrol koşulu için ManNAc) stok çözeltisi hazırlayın.
NOT: Bu stok çözeltisi, her bir kuyucuğun 1 mL şeker analog çözeltisi ile muamele edilebilmesi için yeterli hacimde olmalıdır. Sonraki adımları steril koşullar altında laminer akış başlığı altında gerçekleştirin. - Çözeltiyi 0.2 μm'lik bir filtreden süzün ve gerekene kadar -20 ° C'de 1 mL alikotlarda saklayın.
- Adım 3.2'de hazırlanan 1 mL'lik bir stok çözeltisi alikotunu% 10 FBS içeren 9 mL DMEM yüksek glikoz ortamı ile seyrelterek 500 μM ManNAz veya ManNAc ile takviye edilmiş bir ortam hazırlayın.
- Adım 1.9'da (işlenmemiş hücreler üzerinde deneyler için) veya adım 2.8'de (CQ ile muamele edilen hücreler üzerinde yapılan deneyler için) hazırlanan hücreleri, 500 μM ManNAz (veya kontrol grubu için 500 μM ManNAc) ile takviye edilmiş 1 mL'lik ortamda% 5 CO2 atmosferi altında 37 ° C'de 24 saat boyunca inkübe edin.
4. Fiksasyon ve geçirgenlik
NOT: Tüm bu adımlar çeker ocak altında gerçekleştirilir.
- Numuneleri 1 mL PBS ile yıkayın.
- 500 μL %5 paraformaldehit ekleyerek hücreleri her bir lamel üzerine sabitleyin. Oda sıcaklığında 15 dakika dinlendirin.
- 3 kez 1 mL PBS ile yıkayın.
- Kapaklı, yeterince büyük opak bir kutu (örneğin bir polistiren kutu) kullanarak özel bir nem odası hazırlayın. Kutunun altına ıslak bir parça kurutma kağıdı yerleştirin ve üzerine bir kat parafilm yerleştirin.
NOT: Nemli oda, kapatıldığında numuneyi dış ışık kaynaklarından tamamen korumalıdır. - Lamelleri, hücreler yukarı bakacak şekilde parafilm üzerine yerleştirin.
NOT: Parafilmi, numunelerin adı veya referansı ile önceden etiketleyin. - Oda sıcaklığında 15 dakika boyunca PBS'de 200 μL% 0.5 (h / h) Triton X-100 kullanarak hücre geçirgenliği gerçekleştirin.
- 3x'i 200 μL PBS ile yıkayın.
5. Floresan etiketleme
- Etiketli sialillenmiş glikanların CuAAC etiketlemesi
NOT: CuAAC reaksiyon tamponu kullanımdan önce taze olarak hazırlanmalı ve reaktanlar belirtilen sırayla eklenmeli, en son sodyum askorbat eklenmelidir. Oksijenli sulu çözeltilerde, Cu(II)'nin askorbat ile indirgenmesiyle oluşan Cu(I) iyonları kademeli olarak Cu(II)'ye yeniden oksitlenecek ve zamanla askorbat konsantrasyonunda bir azalmaya yol açacaktır. Sonucun tekrarlanabilirliğini korumak için, tampon 4 °C'de birkaç günden fazla saklanmamalıdır ve tercihen aynı gün kullanılmalıdır.- Bölüm 3'te mühendisliği yapılan azid ile modifiye edilmiş sialillenmiş glikanları etiketlemek için, 5 μM AlexaFluor 488 alkin (AF488Alk), 150 μM CuSO4, 300 μM 2-(4-((bis((1-(tert-butil)-1H-1,2,3-triazol-4-il)metil)amino)metil)-1H-1,2,3-triazol-1-il)asetik asit (BTTAA), 0.1 MK2HPO4ve deiyonize suda 2.5 mM sodyum askorbat. Her lamel için 200 μL uygulamak için yeterli çözelti hazırlayın.
- Reaksiyonu başlatmak için her lamel üzerine 200 μL CuAAC tamponu ekleyin. Numunenin damla ile homojen bir şekilde kaplandığından emin olun ve ışıktan koruyarak oda sıcaklığında 45 dakika reaksiyona girmesine izin verin.
- Reaksiyonu durdurmak ve fazla prob ve reaktifleri çıkarmak için 3x'i 200 μL PBS ile yıkayın.
- Çekirdek boyama
- Hoechst 33342 ile nükleer etiketleme için, PBS'de 1: 2000'de 10 mg / mL'lik bir stok çözeltisini seyreltin.
NOT: Aynı etki için 4 ', 6-diamidino-2-fenilindol (DAPI) gibi eşdeğer nükleer karşı boyalar kullanılabilir. - Hücreleri bu solüsyondan 200 μL ile örtün ve ışıktan koruyarak oda sıcaklığında 5-10 dakika inkübe edin.
- 3x'i 200 μL PBS ile yıkayın.
- Hoechst 33342 ile nükleer etiketleme için, PBS'de 1: 2000'de 10 mg / mL'lik bir stok çözeltisini seyreltin.
- İmmünofloresan boyama
- 50 mL tampon için 0.1 g jelatin, 1 g BSA, 1 mL FBS ve 49 mL PBS içeren bir Sığır Serum Albümini (BSA) bloke edici tampon hazırlayın.
- Numuneleri 200 μL BSA bloke edici tampon içinde 4 ° C'de 1 saat inkübe edin. Numuneyi ışıktan koruyun.
- Saflaştırılmış bir fare anti-GM130 antikoru kullanılarak Golgi aygıtının immünofloresan boyaması için (epitop tanınan: Sıçan GM130 aa. 869-982 | RRID: AB_398142), hazırlanan BSA bloke edici tamponda birincil antikoru 1:100'de seyreltin.
NOT: Bu adım, ilgili herhangi bir primer antikor kullanılarak diğer organelleri hedef alan immünofloresan boyamaya uyarlanabilir, bu durumda seyreltme faktörü üreticinin kılavuzuna göre uyarlanmalıdır. - Antikor içeren solüsyondan 70 μL'yi lamellere ekleyin ve ışıktan koruyarak 4 °C'de 1 saat inkübe edin.
- 3x'i 200 μL PBS ile yıkayın.
- Floresan ikincil antikoru (Alexa Fluor 546 anti-fare IgG) BSA bloke edici tamponda 1:600'de seyreltin ve her lamel üzerine 100 μL ekleyin.
- Numuneleri ışıktan koruyarak oda sıcaklığında 1 saat inkübe edin.
- 3x'i 200 μL PBS ile yıkayın.
- Lamelleri 6 oyuklu bir plakaya aktarın. Numuneleri 2 mL PBS'de 4 °C'de birkaç gün ışıktan koruyarak saklayın.
NOT: Genişletmeden önce ve sonra karşılaştırma amacıyla referans olarak ve genişletmeden sonra etiketleme modelinin bozulmadığından emin olmak için her zaman yalnızca görselleştirme preExM için bir kopya hazırlanması önerilir.
6. Numunelerin genişleme öncesi görüntülenmesi
NOT: Aşağıdaki adımlar, kullanılan biyogörüntüleme ekipmanına bağlıdır ve makinenin gereksinimlerine göre ayarlanması gerekebilir. Lütfen yerel laboratuvarın veya biyogörüntüleme platformunun kurallarına uyun. Buradaki 6.1-6.13 numaralı adımlar lazer taramalı konfokal mikroskopta gerçekleştirilir.
- Mikroskobu açın ve ışık kaynaklarının (lazerler) ısındığından emin olun. Biyogörüntüleme toplama yazılımını açın.
- Kanalları oluşturmak için floroforlara karşılık gelen lazer uyarma dalga boylarını seçin (örneğin, nükleer boyama için 405 nm, AF488Alk etiketli sialillenmiş glikanlar için 488 nm ve immünofloresan etiketleme için 546 nm). Lazerleri buna göre etkinleştirin.
- 32 mm çapında bir lamel (130-170 μm kalınlık) mikroskoba uyarlanmış bir tutucuya yerleştirin ve sabitleyin.
- Adım 5.3.9'da hazırlanan numuneyi, hücreler aşağı bakacak şekilde 32 mm'lik lamel üzerine yerleştirin. Numunenin kurumasını önlemek için bir damla deiyonize su ekleyin.
- Uygun bir objektif lens seçin, burada 1,4 sayısal diyafram açıklığına veya eşdeğerine sahip 63x yağa daldırma objektifi.
NOT: En yüksek sayısal diyafram açıklığı en iyi çözünürlüğü sağlar. Yağa daldırma objektifi kullanırken, objektif ile lamel arasına bir damla yağ eklemeyi unutmayın. - Tutucuyu objektifin üzerindeki mikroskop tablasına yerleştirin.
- Numunedeki bir ilgi alanını bulmak için parlak alan veya düşük lazer yoğunluklu floresan modunu kullanın.
- Odağı ayarlayın.
- Yazılımdaki hücreleri canlı floresan modunda görselleştirin. Her kanal için lazer yoğunluğunu ayarlayın. Foto ağartmayı önlemek için düşük lazer gücüyle başlayın. Lazer gücünü yavaşça artırın ve floresansı aşırı pozlama olmadan net bir şekilde görselleştirmek için gerektiği gibi aşırı gürültü oluşturmadan sinyali yükseltmek için dedektör kazancını ve ofsetini ayarlayın.
NOT: Parametreler, hem arka plan gürültüsünü en aza indirecek hem de sinyal doygunluğunu önleyecek şekilde ayarlanmalıdır. Negatif kontroller de dahil olmak üzere bir dizi deneyde tüm numunelerde tutarlı ayarların sürdürülmesi çok önemlidir. - İstenen gözleme ulaşmak için iğne deliği boyutu (örn. 1 Havadar Birim), tarama hızı (örn. 8), yakınlaştırma faktörü (örn. 1), parlaklık değerleri aralığı (örn. 16 bit) ve ortalama sayı (örn. 2), mod (örn. çizgi) ve yöntem (örn. ortalama) gibi görüntü parametrelerini gerektiği gibi ayarlayın.
NOT: Bu değerler sisteme ve örneğe bağlıdır ve alınmadan önce optimize edilmelidir. İğne deliği boyutu, sayısal diyafram açıklığına, büyütmeye ve dalga boyuna bağlıdır: azaltmak, sinyal-gürültü oranı pahasına çözünürlüğü iyileştirebilir. Foto ağartmayı önlemek için tarama hızının hızlı değerlere (piksel başına küçük bekleme süresine karşılık gelir) ayarlanması önerilir. - Alımı gerçekleştirin ve verileri ileride başvurmak üzere uygun meta verilerle istenen biçimde kaydedin.
- Alım bittiğinde, bir cımbızla transferi kolaylaştırmak için az miktarda deiyonize su ekleyerek numuneyi 6 oyuklu plakaya geri koyun.
NOT: Adım 6.12, yalnızca bu özel numunenin genişletilmesi gerekiyorsa gerçekleştirilir. Aksi takdirde, örneği atın ve aşağıdaki adımlar için diğer kopyaları kullanın.
7. Genişleme mikroskobu protokolü
NOT: Foto ağartmayı önlemek için numuneler ışıktan mümkün olduğunca korunur. Ankraj ve jelleşme aşamaları çeker ocak altında gerçekleştirilir.
- Ankraj
- Numuneleri, oda sıcaklığında 1 saat boyunca mekanik bir çalkalayıcı üzerinde PBS'de 3.2 mg / mL konsantrasyonda N-akriloilsüksinimid (NAS) ile inkübe edin. Kuyucuk başına 500 μL çözelti eklemek için yeterli miktarda çözelti hazırlayın (stok çözeltisi: DMSO'da 16 mg / mL NAS).
NOT: NAS, bir akriloil grubunu aşılamak için lizin kalıntıları ve proteinlerin N-terminalleri ile reaksiyona girer ve proteinlerin sonraki adımlarda hidrojele bağlanmasını sağlar. - 3 kez 1 mL PBS ile yıkayın.
- Numuneleri, oda sıcaklığında 1 saat boyunca mekanik bir çalkalayıcı üzerinde PBS'de 3.2 mg / mL konsantrasyonda N-akriloilsüksinimid (NAS) ile inkübe edin. Kuyucuk başına 500 μL çözelti eklemek için yeterli miktarda çözelti hazırlayın (stok çözeltisi: DMSO'da 16 mg / mL NAS).
- Jelleşme
- Aşağıdaki gibi oluşan bir monomer çözeltisi hazırlayın: 50 mL 1x PBS (pH 7.4) içinde 5.843 g NaCl, 1.25 g akrilamid, 0.075 g bis-akrilamid ve 4.313 g sodyum akrilat ekleyin. Her lamel üzerine 70 μL uygulamak için yeterli çözelti hazırlayın. Jelleşmeden en az 24 saat önce 1 mL alikotları dondurun.
DİKKAT: Monomerler toksiktir; Uygun koruma ekipmanı ile dikkatli bir şekilde kullanılmalı ve çeker ocak altında tartılmalıdır. - Bir parafilm parçası üzerine, 70 μL'lik bir monomer çözeltisi damlatılır, ardından 1.4 μL% 10 (h / h) N, N, N, N', -tetrametiletilendiamin (TMEDA), ardından 1.4 μL% 10 (a / h) Amonyum persülfat (APS), damlaya karıştırılır.
NOT: Çapraz bağlayıcı reaktifleri bu özel sırayla eklenmelidir, önce TMEDA, ardından APS. - Hızlı bir şekilde, lameli hücreler aşağı bakacak şekilde çözeltinin üzerine dikkatlice yerleştirin.
- Çözeltinin nemli bir odada oda sıcaklığında 1 saat polimerize olmasına izin verin.
- Aşağıdaki gibi oluşan bir monomer çözeltisi hazırlayın: 50 mL 1x PBS (pH 7.4) içinde 5.843 g NaCl, 1.25 g akrilamid, 0.075 g bis-akrilamid ve 4.313 g sodyum akrilat ekleyin. Her lamel üzerine 70 μL uygulamak için yeterli çözelti hazırlayın. Jelleşmeden en az 24 saat önce 1 mL alikotları dondurun.
- Sindirim
- 1x TAE tamponu,% 0.5 (h / h) Triton X-100, 0.8 M guanidin HCl ve 8 U / mL proteinaz K'den oluşan bir sindirim tamponu çözeltisi hazırlayın.
NOT: Sindirim tamponu kullanımdan önce taze olarak hazırlanmalı ve 37 ° C'de 30 dakika önceden inkübe edilmelidir. - Adım 7.2'de oluşan hidrojele 1 mL sindirim tamponu ekleyin. Sindirimin mekanik bir çalkalayıcı üzerinde 37 °C'de 3 saat devam etmesine izin verin.
- Sindirim tamponunu çıkarın ve jeli 3x 2 mL deiyonize su ile nazikçe yıkayın.
NOT: Hidrojel hafifçe genişleyecek ve kendini kapak kızağından ayıracaktır.
- 1x TAE tamponu,% 0.5 (h / h) Triton X-100, 0.8 M guanidin HCl ve 8 U / mL proteinaz K'den oluşan bir sindirim tamponu çözeltisi hazırlayın.
- Genleşme
- Hidrojeli 3 mL deiyonize suda 2 saat genleşmeye bırakın. Suyu her 30 dakikada bir değiştirin.
8. Numunelerin genişleme sonrası görüntülenmesi
- 32 mm çapında bir lamel (130-170 μm kalınlık) yerleştirin ve bir tutucuya sabitleyin.
- Hidrojelden bir parça kesin ve hücreler jelin dibinde olacak şekilde kapak fişine yerleştirin.
NOT: Eksize edilen parçalar, gözlem için yeterli yüzey alanı sağlayacak kadar büyük olmalı, ancak çok büyük olmamalıdır, çünkü bu, jelin kullanımını zorlaştırabilir ve kırılma riskini artırabilir (önerilen boyut: 5 ila 8 mm). Lamelin tüm yüzeyini kaplayacak kadar hidrojel parçası yerleştirin; Bu, parçaların yerinde sabitlenmesine yardımcı olacak ve görüntüleme sırasında herhangi bir kaymayı önleyecektir. Sürüklenme sorunları olması durumunda, lamellerin poli-D-lizin ile önceden kaplanması avantajlı olabilir6. - Tutucuyu objektifin üzerindeki mikroskop tablasına yerleştirin.
- Görüntü alımını, 6. adımda açıklandığı gibi yağa daldırma objektifine sahip bir Lazer Taramalı Konfokal Mikroskopta gerçekleştirin.
9. ImageJ'de Genleşme Faktörü (EF) hesaplaması
- Görüntüleme verilerini ücretsiz ImageJ yazılımında veya eşdeğerinde açın.
- Birden fazla kanal görüntüsü üzerinde çalışıyorsanız, kanalları bölün ve Görüntü Seç | Renk | Kanalları ayırın.
- Çekirdek çapını ölçmek için, Görüntü Seç'e tıklayarak bir eşik belirleyerek çekirdeğe karşılık gelen sinyali vurgulayın | Ayarla | Eşik.... Varsayılan açılır menüden görüntüye en uygun yöntemi seçin (örneğin, Otsu) ve çekirdeğin şekli arka plandan net bir şekilde kesilene kadar eşiği ayarlayın.
NOT: Bir ayar tüm görüntülere veya her örneğe uymayabileceğinden, eşik ayarının her görüntü için ayarlanması gerekir. - Seç'e tıklayarak Feret çapını belirlemek için ölçümü ayarlayın Analiz Et | Ölçümleri ayarlayın.... Menüden Feret çapını seçin ve gerekirse ondalık sayıyı ayarlayın.
- Görüntünün analizine başlamak için Analiz Et | Parçacıkların boyutunu ayarlamak için parçacıkları analiz edin; Çekirdek için 5-sonsuz μm² | Sonuçları görüntüle | Yöneticiye ekle | Kenarları ve Kaplamayı hariç tut. Analizi başlatın.
- Analiz başladığında, birden çok pencere görünecektir. Pencere sonuçlarında, Feret sütunundaki her bir çekirdeğin maksimum Feret çapını arayın. Ham verileri bir elektronik tabloya kopyalayıp yapıştırın ve önceden genişletilmiş ve genişletilmiş örnekler için ortalama çekirdek boyutunu hesaplayın.
NOT: Her bir çekirdeğe karşılık gelen ilgi bölgelerinin (ROI'ler) çekirdeğin tüm çevresini takip ettiğinden emin olun. - Genişleme faktörünü (EF) aşağıdaki gibi hesaplayın:
EF =
NOT: EF faktörü, numunenin ne kadar genişletildiğini belirler.
Sonuçlar
Aşağıda, HeLa hücrelerinde (Şekil 3A) ve MCF7 hücrelerinde (Şekil 3B) sialile glikoproteinleri görselleştirmek için protokolün uygulanması, CQ tedavisi (protokol bölüm 2) ve immünofloresan ko-lokalizasyon boyaması (protokol adımı 5.3) atlanmıştır.

Şekil 3: ExM protokolünden önce (solda) ve sonra (sağda) sialilasyon etiketleme modelinin karşılaştırılması. (A) Hela hücreleri ve (B) MCF7 hücreleri 500 μM ManNAz ile 24 saat inkübe edildi. Etiketleme, Alexa Fluor 488 alkin (yeşil renkle gösterilen) ile CuAAC aracılığıyla gerçekleştirildi. Çekirdekler Hoechst 33342 (mavi ile gösterilmiştir) ile boyandı. Ölçek çubukları = 20 μm. Kısaltmalar: ExM = Genleşme Mikroskobu; ManNAz = N-azidoasetilmannozamin; CuAAC = Bakır katalizli Azide-Alkin Sikloilavesi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tipik olarak, sialilasyon etiketlemesi üç ana floresan havuzundan oluşur: sentezlenmekte olan yeni oluşan glikokonjugatları gösteren bir Golgi havuzu, hücre zarına ihraç edilen veya hücre zarından geri dönüştürülen glikokonjugatları temsil eden bir veziküler havuz (genellikle daha az yoğun) ve ifade edilen glikokonjugatları gösteren bir zar havuzu13. Sadece metabolik olarak üretilen Neu5Az ile etiketlenmiş biyopolimer glikokonjugatların tespit edildiğini, reaksiyona girmemiş fazla raportör veya probların yıkama adımları sırasında elimine edildiğini not etmek önemlidir. ExM sonrası görüntüler konfokal bir mikroskopta elde edildi ve özellikle Golgi aygıtında çok daha ince ayrıntılar ve daha az arka plan ortaya çıkardı. Protokol, sialillenmiş glikokonjugatları eksprese eden her türlü yapışık hücreye uygulanabilir.
Farklı hücre veya doku tipleri, floroforların hacimsel seyreltilmesine bağlı olarak ExM'ye özgü kısmi sinyal kaybından farklı derecelerde etkilenebilir. Bu aynı zamanda, radikal polimerizasyon sırasında floroforların zayıf tutulması veya optimal olmayan ankraj veya sindirim nedeniyle biyomoleküllerin zayıf tutulması ile daha da kötüleşebilir, bu da ciddi bir sinyal kaybına yol açabilir (Şekil 4). Bu nokta, aşağıdaki tartışmanın ana konusudur. Bu nedenle, gerekirse sindirim adımlarının parametrelerinin inceleme altındaki hücre veya doku tipine göre ayarlanması tavsiye edilir. Sindirim, gözlemlenen spesifik yapılara veya biyomoleküllere bağlı olarak çeşitli yollarla optimize edilebilir. İstenen sonuçları elde etmek için standartlaştırılmış bir sindirim protokolü ile başlamanızı ve ardından sindirim süresi, deterjan konsantrasyonu ve/veya enzim konsantrasyonu gibi parametreleri ampirik olarak ayarlamanızı öneririz. Daha verimli sindirimin, bozulmayı önleyerek daha iyi bir izotropik genleşmeye yol açtığına dikkat etmek önemlidir, ancak bu aynı zamanda sinyal kaybı riskini de artırabilir. Bu nedenle, yüksek kaliteli izotropik genleşme elde etmek ile sinyal bütünlüğünü korumak arasında bir denge bulunmalıdır. Sinyal tutma, özel olarak tasarlanmış moleküler ankrajlar kullanılarak daha da geliştirilebilir. Protein gözlemine odaklanan çalışmalar için, yüksek sıcaklıklarda yalnızca Sodyum Dodesil Sülfat (SDS) kullanan protokollerin, protein sinyallerini daha iyi korurken gömülü numuneyi etkili bir şekilde sindirdiği gösterilmiştir26,27.
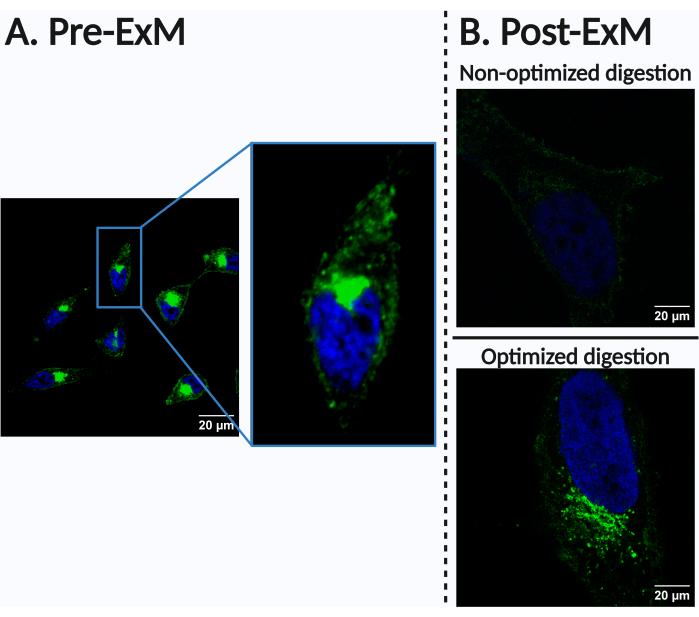
Şekil 4: Optimal olmayan sonuç örneği. Bu şekil, özellikle sindirim aşaması için koşulların her bir hücre, doku ve izlenen biyomolekül tipine göre ayarlanmasının önemini göstermektedir. HeLa hücreleri 24 saat 500 μM ManNAz ile inkübe edildi ve Alexa Fluor 488 alkin (yeşil, sialillenmiş N-glikoproteinler) ve Hoechst 33342 (mavi, çekirdekler) ile etiketlendi. (A) Etiketleme deseni ön genişlemesi. (B) genişletme sonrası etiketleme modeli. (Yukarıya) Bileşim, konsantrasyon ve/veya uzunluk açısından kötü optimize edilmiş sindirim parametreleri, hidrojelde aşılanmış biyomolekül retansiyonunun olmaması nedeniyle ciddi sinyal kaybına yol açarak yeterli hassasiyetle biyogörüntüleme verilerinin toplanmasını engelleyebilir. Bu özel durumda, sindirim arabelleği protokol adımı 7.3'te kullanılana benzerdi. Bununla birlikte, sindirim süresi, sonraki görüntüde kullanılan 180 dakikalık sindirim süresine kıyasla 90 dakika idi. (Altta) Sindirim parametrelerinin optimizasyonundan sonra elde edilen görüntü (bkz. protokol adımı 7.3). Ölçek çubukları = 20 μm. Kısaltma: ManNAz = N-azidoasetilmannosamin. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Deneyin tekrarlanabilirliğini sağlamak için, numuneleri hidrojel içine gömdükten sonra bile çözelti içinde muhafaza etmek ve ışıktan korumak çok önemlidir. Hidrojel, kurumasını önlemek için nemli bir odada tutulmalıdır. Jelleşme (protokol adımı 7.2), sindirim (protokol adımı 7.3) ve genişleme (protokol adımı 7.4) olmak üzere üç ana adımın aynı gün içinde gerçekleştirilmesi şiddetle tavsiye edilir. Genleştirildikten sonra, numune deiyonize suda 4 °C'de tutulursa ve ışıktan korunursa birkaç gün stabil kalır ve bu da biyogörüntüleme verilerinin toplanması için zaman tanır.
Mikroskopi görüntülerinin analizi sırasında, genişleme öncesi (preExM) ve genişleme sonrası (postExM) çekirdek Feret çapının ortalama oranını ölçerek genleşme faktörünün (EF) değerlendirilmesi önerilir. Burada, bu protokolde, çekirdekler Hoechst 33342 ile boyanır, ancak daha geleneksel DAPI de genleşme mikroskobu ile uyumludur. Feret çapı, çekirdeğin sınırında bulunan iki nokta arasındaki maksimum mesafeye karşılık gelir. Tipik olarak, başarılı deneyler, kullanılan dalga boyuna ve objektife bağlı olarak ~60-70 nm'lik maksimum yanal çözünürlüğe karşılık gelen 4 ila 5 arasında bir EF değeri sağlar (Şekil 5). Çekirdeğin ortalama Feret çapı, istatistiksel bir yaklaşım için çeşitli görüntülerde en az 60 ila 100 hücre ölçülerek belirlenir. Daha fazla doğruluk için, 3D rekonstrüksiyonu mümkün kılan z-yığınları, ölçülen mesafenin tüm çekirdekler için gerçek Feret çapına karşılık geldiğinden emin olmak için sistematik olarak elde edilebilir ve işlenebilir. Bununla birlikte, bu yaklaşım, hem mikroskoba ve kullanılan hedeflere bağlı olarak elde etme açısından hem de özellikle veri işleme açısından önemli ölçüde daha fazla zaman alıcı olabilir. Bu, hidrojelin genleşme öncesi ve sonrası boyutunu karşılaştırarak EF'nin makro ölçekli ölçümü ile çapraz kontrol edilebilir, bu da deneyimlerimize göre benzer sonuçlara yol açar.

Şekil 5: Genleşme faktörünün belirlenmesi. Genişlemeden önceki ve sonraki çekirdeklerin ortalama boyutu, ImageJ yazılımında Feret çaplarının (yani, çekirdeğin kenarındaki iki nokta arasındaki en uzun mesafe) ölçülmesiyle belirlenir. ExM sonrası ortalama Feret çapı ile ExM öncesi arasındaki oranın hesaplanması, doğrusal genleşme faktörünü sağlar. İnsan primer fibroblastları 533T genişletme protokolüne tabi tutuldu. Çekirdekler Hoechst 33342 (mavi ile gösterilmiştir) ile boyandı. Ölçek çubukları = 20 μm. Kısaltma: ExM = Genleşme Mikroskobu. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Bu protokol, spesifik hücre tedavileri veya çeşitli fizyolojik ve patolojik durumlar arasında karşılaştırmalar gerektiren biyolojik soruları ele almak için tasarlanmıştır. Bu, burada antimalaryal ilaç klorokin (CQ) ile tedavi edilen insan fibroblastları üzerindeki uygulamasıyla örneklenmiştir. pKa değerleri 8.4 ve 10.8 olan diprotik zayıf bir baz olan CQ, tercihen pH hapsi yoluyla lizozomlarda birikir, bu da lizozomal pH'ın artmasına ve ardından fonksiyon kaybına neden olur.
Bu deneyde, ManNAz, daha sonra CuAAC aracılığıyla Alexa Fluor 488 ile etiketlenen sialile glikanlara dahil edilirken, Golgi aygıtı fare anti-GM130 antikoru ile boyanır. Özellikle, kontrol hücreleri (Şekil 6A) ve CQ ile tedavi edilen hücreler (Şekil 6B) arasında nispi yoğunluklarda belirgin farklılıklar gözlenir. Kontrol hücrelerindeki fizyolojik koşullar altında, birincil sialokonjugat etiketleme havuzu Golgi aygıtı içinde lokalizedir. Buna karşılık, CQ ile muamele edilen hücreler, lizozomlarda sialik asit birikimi sergiler ve bu da geri dönüştürülmüş glikokonjugatların sıkıştığını kanıtlar. Bu, özellikle konjenital glikozilasyon bozukluklarının veya lizozomal depo hastalıklarının incelenmesi bağlamında geçerlidir 13,14,15.

Şekil 6: Klorokinin sialillenmiş glikoproteinlerin postExM lokalizasyonu üzerindeki etkisinin PostExM görselleştirmesi. İnsan primer fibroblastları 533T, (A) CQ ile muamele edilmedi veya (B) 24 saat boyunca 500 μM ManNAz ile inkübasyondan önce 8 saat boyunca 100 μM CQ ile muamele edildi ve Alexa Fluor 488 alkin (yeşil kanal) ile CuAAC etiketlemesi yapıldı. Golgi aygıtının (kırmızı kanal) ko-lokalizasyon boyaması, bir fare anti-GM130 birincil antikoru ve bir anti-fare Alexa Fluor 546 etiketli ikincil antikor ile gerçekleştirildi. Hücreler, tarif edildiği gibi ankraj, jelleşme, sindirim ve genişlemeye tabi tutuldu. Ölçek çubukları = 20 μm. Kısaltmalar: ExM = Genleşme Mikroskobu; CQ = klorokin; ManNAz = N-azidoasetilmannozamin; CuAAC = Bakır katalizli Azide-Alkin Sikloilavesi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Mevcut CuAAC etiketleme protokolü, reaksiyon tamponunda aminoguanidin içermez. Hücre içi glikokonjugatların görselleştirilmesi amaçlandığından, herhangi bir sitotoksisite sorununu önlemek ve katalitik sistemin alımını iyileştirmek için metabolik birleştirme adımından sonra sabitlenen hücreler üzerinde gerçekleştirilir. Aminoguanidin kullanımı tipik olarak, dehidroaskorbat ile proteinlerin arginin, histidin ve lizin kalıntıları arasındaki yan reaksiyonları önlemek için canlı hücrelerin hücre yüzeyi etiketlemesi için önerilir28. Bu modifikasyonlar gerçekten de protein fonksiyonunu etkileyebilir ve potansiyel olarak bozulmalara veya sitotoksisiteye neden olabilir. CuAAC reaksiyon tamponu için bir diğer önemli husus, bakır iyonlarının BTTAA ile kompleksleşmesinin hızlı olması, ancak hemen olmamasıdır. Modifiye edilmiş şekerlerin verimli bir şekilde etiketlenmesini sağlamak için, sonuçların acemi kullanıcılar tarafından tekrarlanabilirliğini sağlamak için etiketleme işlemine başlamadan en az 30 dakika önce çözeltiyi hazırlamanızı öneririz.
Elde etmek için herhangi bir konfokal mikroskop kullanılabilir. Örnek genişledikçe gözlemlenebilir alan da genişler. Bir hücrenin tamamını yakalamak için, görüntüler arasında %10'luk bir örtüşme olan alanın döşeme taramasının yapılması önerilir. Aynı anda hem döşeme taraması hem de z-yığını yapmak mümkün olsa da, bu durumda daha küçük bir döşeme taraması seçmenizi öneririz. Bunun nedeni, sürecin zaman alıcı olması ve önemli miktarda ham veri üreterek yoğun veri işlemeye yol açmasıdır. Her iki yöntemi de ayırmanız, yalnızca ilgi alanları için bir z-yığını oluşturmanız, genişletme öncesi z-yığını ile tutarlı parametrelerle tavsiye edilir. Genleşmiş jellerde solmaya karşı önleyici montaj ortamı kullanılmadığından, foto ağartmayı en aza indirmek için (hızlı tarama hızı, düşük lazer yoğunlukları) edinme parametrelerinin buna göre ayarlanmasını öneririz.
Başarılı genleşme deneyleri tipik olarak 4 ila 5 arasında bir genleşme faktörüne yol açar, bu da 64x ile 125x arasında hacimsel bir artışa karşılık gelir. Aynı sayıda florofor molekülü genleşmeden sonra çok daha büyük bir hacme yayıldığından, ExM'nin önemli bir dezavantajı, sinyal yoğunluğunda kaçınılmaz bir azalmadır. Genleşmeden sonra floresan sinyalini gözlemleyebilmek için, uyarma lazerinin kazancı ve/veya yoğunluğu, florofora bağlı olarak büyük ölçüde artırılabilir. İğne deliği açıklığı da modüle edilebilir. Floresan sinyali üzerindeki bu tamamen fiziksel seyreltme etkisine ek olarak, sinyal kaybının başka olası nedenleri de vardır.
Moleküler ankrajların etiketlenmesini, fiksasyonunu ve biyokonjugasyonunu takiben, jelleşme (protokol adımı 7.2), numuneyi bir polielektrolit hidrojel içinde kapsüllemeyi amaçlar. Bu tür polimerler üç monomerden oluşur: akrilamid, bis-akrilamid ve sodyum akrilat. Sonuncusu, iyonik yapısı nedeniyle jele genleşme özelliğini verir; Aslında, bu polimer, sodyum iyonlarını su molekülleri29 ile değiştirerek sudaki ağırlığının birkaç katını emebilir. Jelin çapraz bağlanması, TMEDA ve APS tarafından katalize edilen radikal bir reaksiyondur. Daha fazla sinyal azalmasının bir nedeninin, bu radikal kaynaklı polimerizasyon sırasında organik floroforların kısmi bozunması olması dikkat çekicidir. Çeşitli boyalar değişen derecelerde etkilenir; örneğin, siyanin boyaları genleşme sırasında neredeyse tamamen yok olur ve %30,31 oranında 0,3-0,4'lük zayıf bir sinyal tutma sergilerken, Alexa Fluor 488 boyaları ExM4 sonrası sinyal yoğunluğunun ~%57'sinin tutulmasına izin verir. Çeşitli organik floroforların ve floresan proteinlerin sinyal tutulmasının bir özeti için, Wen ve ark.31 tarafından yapılan incelemeye bakınız.
Ek olarak, biyomolekül retansiyonu, protokolün belirli adımlarından da etkilenebilir. Örneğin, hidrojele bağlı olmayan protein parçaları üzerinde yer alan glikan zincirleri, sindirim sırasında yıkanabilir ve bu da sinyal yoğunluğunu daha da azaltabilir (Şekil 4). Sindirim, hücre iskeleti gibi zarları ve protein yapılarını bozmak için proteinaz K 4,5,6,31 olan veya olmayan TritonX-100 gibi en az bir deterjan32 kullanır. Sindirim süresi ve sindirim tamponunun bileşimi, belirli floroforları ve biyomolekülleri en iyi şekilde korumak için ayarlanabilir. Bu nedenle, sindirim parametreleri (protokol adımı 7.3), biyomoleküllerin ve probların izotropik genleşmesi ve tutulmasını sağlamak için homojenizasyon arasında en iyi dengeyi elde etmek için bileşim, konsantrasyon ve süre açısından incelenen numune tipine göre optimize edilmelidir. Bazı durumlarda, sindirim tamponu tipi, numunenin proteinlerinin jel genişlemesinden26,27 önce 95 °C'de SDS'de denatüre edildiği Ultrastructure-ExM'de olduğu gibi daha hafif koşullar için tamamen değiştirilebilir.
Mümkün olduğunda, daha düşük sinyal sonrası ExM, belirli problara ihtiyaç duymadan görüntüleme verilerinin elde edilmesi sırasında uyarma kaynağının gücü ve/veya dedektör kamerasının kazancı ayarlanarak basitçe ele alınabilir. ExM sonrası sinyal-gürültü oranının yetersiz kalacağı durumlarda, çeşitli laboratuvarlar tarafından, örneğin floroforların kendilerinin doğrudan polimer matrisine 6,14 tutturulmasına izin veren üç işlevli moleküller kullanılarak ek sinyal tutma ve/veya amplifikasyon stratejileri geliştirilmiştir. Bu zorlukların üstesinden gelmek için alternatif bir çözüm olarak, jel yeterince geçirgen olduğundan, genleşmeden sonra numunenin boyanması yapılabilir. Ancak bu, numunenin genişlemeden önce gözlemlenmesini engeller. Bu yaklaşım yakın zamanda, örneklerin önce izotropik olarak genişletildiği ve daha sonra antikorlarla boyandığı immün boyama33 için bildirilmiştir. Yazarlar, bunun ExM ve süper çözünürlük tekniklerini birleştirirken lokalizasyon doğruluğunu engelleyen bağlantı hatalarını azaltırken, gelişmiş floresan parlaklığına ve epitop erişilebilirliğine yol açabileceğini gösterdi.
Floresan yoğunluğunun azalmasını engellemek için alternatif stratejiler araştırılmıştır. Bir örnek, geleneksel floresan molekülleri yerine polimer bazlı floroforların kullanılmasıdır. Liu ve ark. geleneksel floroforlardan çok daha parlak olan ve daha iyi sinyal-gürültü oranı sağlayan floresan polimer noktaları (Pdots)34 geliştirdi. Pdots, bir çapa ve bir antikor ile işlevselleştirilebilir. Başka bir örnekte, Tıklama Genişletme Mikroskobu (ClickExM)6 , bir çapa taşıyan bir floresan streptavidin kullanarak dolaylı bir biyotin-streptavidin stratejisiyle sinyal tutmayı artırmak için evrensel bir strateji tanıttı. Bu, floresan probların polimer çerçeveye doğrudan aşılanmasına izin verir. Benzer şekilde, Molekül Ankrajlanabilir Jel özellikli Nano Ölçekli Yerinde Floresan mikroskobu (MAGNIFY)35 , floresan sinyal tutulmasını artırmak için büyük ölçüde biyomolekül ankrajına dayanır. Belirli bir molekülü jele bağlayan ClickExM'in aksine, MAGNIFY, çok çeşitli biyomolekülleri hidrojelin çerçevesine çapraz bağlamak için metakrolein kullanır.
ExM'nin mikroskopta veri toplama açısından bir başka olası sınırlaması, genişletilmiş bir numuneyi daha geniş bir fiziksel alanda görüntüleme gerekliliğidir, bu da tüm numuneyi yakalamak için gereken süreyi önemli ölçüde artırır. Genişletme işlemi numuneyi büyüttüğünden, yüksek çözünürlüklü görüntüleme elde etmek, aynı biyolojik bölgeyi kapsayacak şekilde daha fazla görüntü döşemesi yakalamayı gerektirir ve bu da uzun çekim sürelerine neden olur. Bu bağlamda, bir dizi uygulama için ExM, klasik konfokal mikroskopinin yerine geçmez, ancak kapsamlı ve ayrıntılı görüntüleme için tamamlayıcı bir teknik olarak kabul edilir.

Şekil 7: İnsan primer fibroblast 533T hücrelerinin preExM ve postExM 3D görüntülemesinin karşılaştırılması. Hücreler 24 saat boyunca 500 μM ManNAz ile inkübe edildi ve CuAAC (yeşil renk) tarafından Alexa Fluor 488 alkin ile etiketlendi. Golgi aygıtının (kırmızı renk) ko-lokalizasyon boyaması, bir fare anti-GM130 birincil antikoru ve bir anti-fare Alexa Fluor 546 etiketli ikincil antikor ile gerçekleştirildi ve çekirdekler Hoechst 33342 (mavi renk) ile boyandı. (Solda) (A) Z-yığını ve (B,C) hücrelerin 3D yüzey işlemesi preExM görselleştirildi. (Sağda) Hücreler, z-yığını ediniminden önce (D) tarif edildiği gibi ankraj, jelleşme, sindirim ve genişlemeye tabi tutuldu. (E) Sinyallerin 3D yüzey sunumu, karmaşık hücre içi alt yapıları tespit ederken özellikle değerli olan çözünürlük artışını açıkça göstermektedir. 3D rekonstrüksiyon ve yüzey oluşturma, sinyal yoğunluğu kullanılarak oluşturuldu. Ölçek çubukları = 20 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
ExM, kırınım sınırını gerçekten aşmadan nano ölçekli görüntüleme elde etmek için yenilikçi bir teknik olarak ortaya çıkmıştır ve aksi takdirde standart protokollerde göz ardı edilecek biyolojik örneklerden alınan ayrıntıların görselleştirilmesine olanak tanır6. ~250 nm kırınım sınırlı bir ekipman kullanıldığında (genellikle yeşil lazerlerle donatılmış rutin konfokal mikroskoplarda olduğu gibi), 4.5x'lik bir genleşme faktörü tipik olarak 60 nm'ye yakın bir yanal çözünürlüğe yol açar. Bu, 2D görüntülemede ve aynı zamanda z-yığını ediniminden 3D görüntüler üreterek yararlanılabilen Golgi aygıtı veya veziküller gibi hücre altı yapıları incelerken çok önemli bir gelişmedir (Şekil 7). Genleşme mikroskobunun tam gücünden yararlanmak için, elde edilen çözünürlük, ExM'yi bu makalenin kapsamı dışında kalan STED veya STORM gibi süper çözünürlüklü mikroskopi teknikleriyle birleştirerek daha da iyileştirilebilir.
Genleşme Mikroskobu alanı çok hızlı bir büyümeye ve önemli gelişmelere tanık oluyor ve bu da onu heyecan verici ve dinamik bir araştırma alanı haline getiriyor. Boyden ve meslektaşları, 2015 yılında Genleşme Mikroskobu'nu tanıttı ve polimer matrisindeki biyomoleküllerin geometrisini korumak için jel sabitlenebilir etiketler kullanarak konfokal mikroskoplarla yaklaşık 70 nm çözünürlük elde etti. İlk ilginin ardından, ısmarlama oligonükleotid-antikor konjugatlarına duyulan ihtiyaç, bilim camiasını bu yöntem için yeni araçlar ve yaklaşımlar geliştirmeye itti. Floresan etiketli antikorların veya proteinlerin kullanımına izin veren, ticari olarak temin edilebilen ajanlar kullanılarak proteinleri jele doğrudan sabitlemek için çeşitli stratejiler geliştirilmiştir ve son gelişmeler, Genleşme Mikroskobunu daha da basitleştirmiş ve ayrı ankraj adımlarına ihtiyaç duymadan çeşitli biyomoleküllere uygulamasını genişletmiştir.
ExM aracılığıyla daha yüksek çözünürlüklü MOE etiketlemesi elde etmek, maliyetli ve erişilmesi zor olan süper çözünürlüklü mikroskoplara ihtiyaç duymadan sialillenmiş glikanların uzamsal dağılımını rutin olarak incelemek için özellikle yararlıdır. Örneğin, plazma zarı üzerindeki sialoglikanlar bu yöntemle görüntülenmiş, mikrovillus ve diğer hücresel yapılardaki dağılımları ortaya çıkarılmıştır6. Hücre içi glikanları gelişmiş çözünürlükle görselleştirme yeteneği, biyosentezlerini, kaçakçılığını ve geri dönüşümünüincelemek için daha da önemlidir 8,13,14,15 ve metabolik hastalıklar veya kanserler gibi patolojilerdeki rollerini deşifre etmek. ExM ve biyoortogonal kimyayı birleştirmek, hücre regülasyonu ve hastalık mekanizmalarının anahtarı olan hücresel yollar, organel fonksiyonu ve etkileşimlerdeki lokalizasyonlarını ve katılımlarını daha iyi anlamak için eşsiz bir fırsat sunacaktır. Bu, kuşkusuz, gelecekte çeşitli patolojilerde sialik asitlerin oynadığı rol hakkındaki anlayışımızı geliştirecektir.
Açıklamalar
Yazarların rekabet eden finansal çıkarları veya diğer çıkar çatışmaları yoktur.
Teşekkürler
Bu işi başarmak için elverişli teknik ortamı sağladıkları için TisBio tesislerine ve PLBS platformuna teşekkür ederiz. Bu çalışma, CNRS ve Ministère de l'Enseignement Supérieur et de la Recherche'den alınan hibelerle desteklenmiştir. Dr. François Foulquier'e, Dr. Zoé Durin'e, Bayan Dorothée Vicogne'ye ve Bayan Céline Schulz'a tartışmaları teşvik ettikleri ve bize Fibroblast 533T hücre hattını ve birincil antikor GM130'u sağladıkları için teşekkür ederiz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| (+) Sodium L-ascorbate | Sigma Aldrich | 11140 | |
| 12 well cell culture plate | Corning | 3513 | |
| Acrylamide | Sigma Aldrich | A8887 | |
| Acrylic acid N-hydroxysuccinimide ester | Sigma Aldrich | A8060 | |
| Alexa Fluor 488 alkyne | Jena Bioscience | CLK-1277-5 | |
| Alexa Fluor 546 goat anti-mouse IgG | Invitrogen | A11003 | |
| Amonium persulfate | Sigma Aldrich | 9913 | |
| Bis-Acrylamide | Sigma Aldrich | 146072 | |
| BSA | Sigma Aldrich | A7906 | |
| BTTAA | Jena Bioscience | CLK-067-100 | |
| Centrifugation tube 2 mL | EPPENDORF | 30120094 | |
| Chloroquine diphosphate salt | Sigma Aldrich | C6628 | |
| Conical tube 15 mL | Falcon | 352097 | |
| cover slips 12 mm #1 | epredia | CB00120RA120MNZ0 | |
| cover slips 32 mm #1 | epredia | CB00320RA140MNZ0 | |
| CuSO4 | Sigma Aldrich | 209198 | |
| DMEM high glucose medium | Dutscher | L0104-500 | |
| Dulbecco's Phosphate Buffered Saline (PBS) | Dutscher | L0615-500 | |
| Fetal Bovine Serum | biowest | S1810-500 | |
| Fibroblast 533T | - | - | Collected from healthy individual |
| FIJI ImageJ 2.9.0 | - | - | |
| Gelatin | Bio-RAD | 170-6537 | |
| Guanidine HCl | Sigma Aldrich | 50950 | |
| HeLa cells | ATCC | CCL-2 | |
| Hoechst 33342 | Sigma Aldrich | 14533 | |
| Imaris 10.2 | - | - | |
| K2HPO4 | Euromedex | PB0447-B | Anhydrous |
| LSM 780 Confocal Microscopy | Zeiss | - | |
| MCF7 | ATCC | HTB-22 | |
| N-acetylmannosamine (ManNAc) | BIOSYNTH | MA05269 | |
| NaCl | Carlo Erba | 479687 | |
| N-azidoacetylmannosamine (ManNAz) | BIOSYNTH | MA46002 | |
| Objectif "Plan-Apochromat" 63x/1,4 Oil DIC M27 | Zeiss | 420782-9900-799 | |
| Phosphate Buffered Saline (PBS) 10x | Euromedex | ET330 | |
| Proteinase K | Sigma Aldrich | P2308 | from Tritirachium album |
| purified mouse GM130 antibody | BD Bioscience | 610822 | 50 µg |
| Sodium acrylate | Sigma Aldrich | 408220 | |
| T75 Flask | Corning | 430641 | |
| TEMED | Sigma Aldrich | T9281 | |
| tris Acetate EDTA (TAE) 10x | Euromedex | EU0202-B | |
| Triton X-100 | Sigma Aldrich | X-100 | |
| Trypan Blue | Dutscher | 702630 | |
| Trypsine-EDTA 1x | Dutscher | L0930-100 |
Referanslar
- De Souza, N. Light microscopy at the limit. Nat Cell Biol. 11 (Suppl 1), S22(2009).
- Tam, J., Merino, D. Stochastic optical reconstruction microscopy (STORM) in comparison with stimulated emission depletion (STED) and other imaging methods. J Neurochem. 135, 643-658 (2015).
- Jeong, S., Widengren, J., Lee, J. C. Fluorescent probes for STED optical nanoscopy. Nanomaterials. 12 (1), 21(2021).
- Chen, F., Tillberg, P. W., Boyden, E. S. Expansion microscopy. Science. 347 (6221), 543548(2015).
- Kang, S., et al. Expansion microscopy with a thermally adjustable expansion factor using thermoresponsive biospecimen-hydrogel hybrids. ACS Appl Mater Interfaces. 13 (24), 2896228974(2021).
- Sun, D., et al. Click-ExM enables expansion microscopy for all biomolecules. Nat Methods. 18 (1), 107113(2020).
- Dube, D., Bertozzi, C. Metabolic oligosaccharide engineering as a tool for glycobiology. Curr Opin Chem Biol. 7 (5), 616625(2003).
- Scache, J., et al. Switching azide and alkyne tags on bioorthogonal reporters in metabolic labeling of sialylated glycoconjugates: a comparative study. Sci Rep. 12 (1), 22129(2022).
- Holst, S., Wuhrer, M., Rombouts, Y. Glycosylation characteristics of colorectal cancer. Adv Cancer Res. 126, 203256(2015).
- Boyaval, F., et al. N-Glycomic signature of stage II colorectal cancer and its association with the tumor microenvironment. Mol Cell Proteomics. 20, 100057(2021).
- Ferreira, J. A., et al. Protein glycosylation in gastric and colorectal cancers: Toward cancer detection and targeted therapeutics. Cancer Lett. 387, 32-45 (2017).
- Jennings, M. P., Day, C. J., Atack, J. M. How bacteria utilize sialic acid during interactions with the host: snip, snatch, dispatch, match and attach. Microbiology. 168 (3), 001157(2022).
- Gilormini, P. A., et al. A sequential bioorthogonal dual strategy: ManNAl and SiaNAl as distinct tools to unravel sialic acid metabolic pathways. Chem Commun. 52 (11), 2318-2321 (2016).
- Vanbeselaere, J., et al. Alkynyl monosaccharide analogues as a tool for evaluating Golgi glycosylation efficiency: application to Congenital Disorders of Glycosylation (CDG). Chem Commun. 49 (96), 11293-11295 (2013).
- Gilormini, P. A., et al. Chemical glycomics enrichment: imaging the recycling of sialic acid in living cells. J Inherit Metab Dis. 4 (3), 515523(2018).
- Rigolot, V., Biot, C., Lion, C. To view your biomolecule, click inside the cell. Angew Chem. 60 (43), 2308423105(2021).
- Qin, W., et al. Artificial cysteine S-glycosylation induced by per-O-acetylated unnatural monosaccharides during metabolic Glycan Labeling. Angew Chem. 130 (7), 1835-1838 (2018).
- Qin, K., Zhang, H., Zhao, Z., Chen, X. Protein S-glyco-modification through an elimination-addition mechanism. J Am Chem Soc. 142 (20), 9382-9388 (2020).
- Rostovtsev, V. V., Green, L. G., Fokin, V. V., Sharpless, K. B. A. Stepwise Huisgen cycloaddition process: Copper(I)-catalyzed regioselective "ligation" of azides and terminal alkynes. Angew Chem. 41 (14), 25962599(2002).
- Agard, N. J., Prescher, J. A., Bertozzi, C. R. A strain-promoted [3 + 2] azide−alkyne cycloaddition for covalent modification of biomolecules in living systems. J Am Chem Soc. 126 (46), 15046-15047 (2004).
- Mbua, N. E., et al. Strain-promoted alkyne-azide cycloadditions (SPAAC) reveal new features of glycoconjugate biosynthesis. ChemBioChem. 12 (12), 19121921(2011).
- Blackman, M. L., Royzen, M., Fox, J. M. Tetrazine ligation: Fast bioconjugation based on inverse-electron-demand Diels-Alder reactivity. J Am Chem Soc. 130 (41), 1351813519(2008).
- Devaraj, N. K., Weissleder, R., Hilderbrand, S. A. Tetrazine-based cycloadditions: Application to pretargeted live cell imaging. Bioconjug Chem. 19 (12), 22972299(2008).
- Bird, R. E., et al. Bioorthogonal chemistry and its applications. Bioconjug Chem. 32 (12), 2457-2479 (2021).
- Slade, P. G., et al. Identifying the CHO secretome using mucin-type O-linked glycosylation and click-chemistry. J Proteome Res. 11 (12), 61756186(2012).
- Gambarotto, D., Hamel, V., Guichard, P. Ultrastructure expansion microscopy (U-ExM). Methods Cell Biol. 161, 5781(2021).
- Gambarotto, D., et al. Imaging cellular ultrastructures using expansion microscopy (U-ExM). Nat. Methods. 16, 71-74 (2019).
- Presolski, S. I., Hong, V. P., Finn, M. Copper-catalyzed azide-alkyne click chemistry for bioconjugation. Curr Protoc Chem Biol. 3 (4), 153-162 (2011).
- Santiago, F., et al. Synthesis and swelling behaviour of poly(sodium acrylate)/sepiolite superabsorbent composites and nanocomposites. Polym Int. 55 (8), 843848(2006).
- Wen, G., et al. Evaluation of direct grafting strategies via trivalent anchoring for enabling lipid membrane and cytoskeleton staining in expansion microscopy. ACS Nano. 14 (7), 78607867(2020).
- Wen, G., et al. Current progress in expansion microscopy: Chemical strategies and applications. Chem Rev. 123 (6), 32993323(2023).
- Drelich, L., et al. Toward high spatially resolved proteomics using expansion microscopy. Anal Chem. 93 (36), 12195-12203 (2021).
- Zwettler, F. U., et al. Molecular resolution imaging by post-labeling expansion single-molecule localization microscopy (Ex-SMLM). Nat Commun. 11 (1), 3388(2020).
- Liu, J., et al. Expansion microscopy with multifunctional polymer dots. Adv Mater. 33 (25), 2007854(2021).
- Klimas, A., et al. Magnify is a universal molecular anchoring strategy for expansion microscopy. Nat Biotechnol. 41 (6), 858869(2023).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır