Method Article
Визуализация внутриклеточного сиалирования с помощью клик-химии и экспансионной микроскопии
В этой статье
Резюме
Здесь мы предлагаем простой протокол, сочетающий метаболическую инженерию олигосахаридов, клик-химию и экспансионную микроскопию, который позволяет биовизуализировать внутриклеточные сиалированные N-гликопротеины с улучшенным разрешением с использованием обычного оборудования для микроскопии.
Аннотация
Методы метаболического мечения позволяют встраивать биоортогональные репортеры в гликаны, обеспечивая целенаправленную биоконъюгацию молекулярных красителей в клетках с помощью кликовой и биоортогональной химии. Метаболическая инженерия олигосахаридов (MOE) привлекла значительный интерес из-за важной роли гликозилирования в многочисленных биологических процессах, которые включают молекулярное распознавание, и его влияния на патологии, начиная от рака и генетических расстройств, вирусных и бактериальных инфекций.
Несмотря на то, что МОЭ более известен тем, что обнаруживает гликоконъюгаты клеточной поверхности, он также является очень важной методологией для изучения внутриклеточных гликанов в физиологическом и патологическом контекстах. Такие исследования в значительной степени выигрывают от высокого пространственного разрешения. Тем не менее, микроскопия сверхвысокого разрешения недоступна в большинстве лабораторий и создает проблемы для ежедневного внедрения. Экспансионная микроскопия является новейшей альтернативой, которая повышает разрешающую способность микроскопии за счет физического увеличения биологических образцов, помеченных флуоресцентными маркерами. Встраивая образец в набухающий гель и заставляя его изотропно расширяться с помощью химической обработки, субклеточные структуры могут быть визуализированы с повышенной точностью и разрешением без необходимости использования методов сверхвысокого разрешения.
В этой работе мы иллюстрируем возможности экспансионной микроскопии для визуализации внутриклеточных сиалированных гликанов за счет комбинированного использования MOE и клик-химии. В частности, мы предлагаем процедуру биоортогонального мечения и экспансионной микроскопии, в которой используется репортер, нацеленный на сиалирование, которое может быть связано с иммунофлуоресценцией для исследований колокализации. Этот протокол позволяет проводить локализационные исследования биосинтеза сиалоконъюгатов, внутриклеточного транспорта и рециркуляции.
Введение
Флуоресцентная микроскопия, хотя и широко используется для обозначения и визуализации конкретных молекул в клетках, по своей сути ограничена в разрешении дифракционным пределом светаАббе 1, который ограничивает способность различать объекты ближе примерно 200-250 нм. Это ограничение возникает из-за волновой природы света и числовой апертуры объектива микроскопа, что создает проблемы при визуализации субклеточных структур. Преодоление этих ограничений позволяет лучше понять определенные биологические процессы в нанометровом масштабе.
Чтобы превзойти дифракционный предел света, были разработаны методы микроскопии сверхвысокого разрешения, такие как STORM (стохастическая оптическая реконструкционная микроскопия) и STED (вынужденное истощение эмиссии) 2,3. STORM полагается на стохастическую активацию флуорофоров, позволяя визуализировать только разреженное подмножество в любой момент времени. Это позволяет точно локализовать отдельные флуорофоры, что позволяет реконструировать изображение с высоким разрешением. STED, с другой стороны, улучшает разрешение за счет использования истощающего лазера для избирательного гашения флуоресценции по периферии пятна возбуждения, эффективно сужая функцию разброса точки.
Эти подходы контрастируют с широкопольной или конфокальной микроскопией, где все флуорофоры обнаруживаются одновременно, в результате чего получается изображение, объединяющее все дифракционные картины и предотвращающее различие между отдельными флуорофорами, находящимися близко друг к другу, что приводит к потере разрешения. Тем не менее, эти методы со сверхвысоким разрешением требуют очень специфических источников света, оборудования, пробоподготовки и/или флуорофоров, что делает эти технологии дорогостоящими, труднодоступными в большинстве лабораторий и сложными для реализации в рутинных экспериментах. Эти ограничения заставили научное сообщество искать альтернативные решения для достижения более высокого разрешения, которое было бы совместимо с легкодоступным оборудованием для микроскопии и рутинными протоколами окрашивания. В 2015 году Бойден и его коллеги разработали метод, позволяющий обойти ограничения оптической микроскопии путем физического расширения образца под названием «Экспансионная микроскопия» (ExM)4.
ExM — это трехступенчатый метод, который позволяет получить наноразмерные детали биологических образцов без превышения дифракционного предела света (рис. 1). Вместо этого он использует обычные дифракционно-ограниченные микроскопы для получения изображений образцов, которые были физически увеличены изотропным образом. Первый этап, называемый гелеобразованием, заключается во встраивании биологического образца, обычно фиксированных клеток или тканей, в набухающий полиэлектролитный гидрогель на основе акрилата натрия и акриламида. Затем биологический образец подвергается ферментативной обработке для частичного разрушения определенных компонентов, таких как белки или мембраны, и разрушения плотных клеточных структур, чтобы обеспечить равномерное расширение клеток. Этот этап, называемый разложением, помогает достичь этого путем гомогенизации структурных компонентов образца с учетом механических свойств, предотвращая дифференциальное расширение, которое может привести к деформации образца. Наконец, на последнем этапе, называемом расширением, погруженный в гидрогель и сброженный образец помещается в деионизированную воду, вызывая его набухание. Эта технология приводит к тому, что образец расширяется с коэффициентом линейного увеличения примерно в 4-5 раз в каждом измерении, что позволяет визуализировать мелкие клеточные детали с помощью стандартных методов микроскопии. Учитывая изотропный характер расширения, биологический образец, увеличенный внутри гелевой матрицы, сохраняет свои трехмерные геометрические детали и пространственные отношения между различными структурными компонентами. Таким образом, пространственная информация сохраняется при набухании, в то время как расстояние между гелевыми флуоресцентными метками или биомолекулами равномерно увеличивается во всех направлениях. Это позволяет лучше разделять сигналы, что приводит к повышению разрешения.

Рисунок 1: Обзор протокола ExM. (a) Гелеобразование: Биологический образец закрепляется и встраивается в набухающий полиэлектролитный гидрогель. (b) Пищеварение: Механические свойства образца гомогенизируются за счет использования ферментов и детергентов, разрушающих белки и липидные мембраны, которые в противном случае ограничивали бы расширение и создавали бы искажения. (c) Расширение: гидрогель погружается в деионизированную воду, в результате чего он изотропно расширяется. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
С 2015 года в ExM наблюдаются значительные технологические усовершенствования в области сохранения пространственной информации. В частности, были разработаны различные молекулярные якоря для ковалентного присоединения биомолекул непосредственно к набухающему гидрогелю 5,6. В этом протоколе мы использовали N-акрилоксисукцинимид (НАС), который реагирует со свободными аминогруппами биомолекул (как правило, остатками лизина или N-концевыми позициями белков) с целью биоконъюгирования акрилоильной группы с белками клетки, включая гликопротеины. Эта акрилольная группа затем вступает в реакцию с другими мономерами посредством реакций сшивания во время гелеобразования, привязывая эти биомолекулы непосредственно к полимеру.
ExM совместим с широким спектром методов мечения, включая метаболическую инженерию олигосахаридов (MOE). MOE является мощным инструментом, который позволяет мечить гликаны путем включения аналогов метаболических предшественников, оснащенных биоортогональной химической ручкой7. Эти аналоги, известные как химические репортеры, интегрируются в метаболические пути, не вызывая токсичности. В подходе MOE репортерные моносахариды метаболически перерабатываются в активированные нуклеотидные сахара, а затем переносятся в зарождающиеся гликоконъюгаты. Наше основное внимание сосредоточено на изучении сиалирования, в частности, внутриклеточной динамики и транспорта сиалированных N-гликопротеинов, что имеет решающее значение в контексте здоровья и болезней из-за его роли в межклеточных взаимодействиях, иммунной регуляции и развитии. Аномальное сиалирование связано с такими заболеваниями, как рак 8,9,10,11, инфекционные заболевания 12 и генетические расстройства 13,14,15, что делает его ключевой мишенью для терапевтических разработок и открытия биомаркеров. Понимание сиалирования улучшает понимание гликобиологии и механизмов заболеваний.
Сиалирование можно зондировать с помощью МОЭ с аналогами N-ацетилнейраминовой кислоты (Neu5Ac), наиболее распространенной сиаловой кислоты в организме человека, или с аналогами N-ацетилманнозамина (ManNAc), метаболического предшественника Neu5Ac, несущего биоортогональную ручку 8,16. ManNAc превращается в Neu5Ac в цитозоле, а затем активируется в цитидин-5'-монофосфо-N-нейраминовую кислоту (CMP-Neu5Ac) в ядре. После активации в нуклеотидный сахар сиалилтрансферазы в аппарате Гольджи переносят единицы Neu5Ac в конечные положения растущих гликановых цепей (рис. 2). После метаболического включения неестественных производных ManNAc меченые сиалированные гликаны могут быть ковалентно связаны с флуорофором, несущим реакционноспособную группу, комплементарную репортерному маркеру, посредством биоортогональной клик-химии. Это позволяет проводить прямое наблюдение гликоконъюгатов in vivo или ex vivo.
Для большинства репортеров с моносахаридами требуется перацетилированная форма для пересечения плазматической мембраны посредством пассивной диффузии. Тем не менее, было показано, что как перацетилированные, так и незащищенные репортеры эффективно исследуютсиалирование16. Незащищенные репортеры сиалирования способны проникать в клетки с помощью активных транспортных механизмов, а именно пиноцитоза для аналогов Neu5Ac и еще не идентифицированного транспортера для ManNAc. В то время как незащищенные сахара требуют более высокой концентрации (обычно 100-500 мкМ) для достижения сопоставимых эффектов, попав внутрь клетки, они могут напрямую проникнуть в метаболический путь сиаловой кислоты. Напротив, перацетилированные сахара должны быть полностью деацетилированы внутриклеточными неспецифическими эстеразами, прежде чем стать метаболически активными. Несмотря на то, что их можно использовать в более низких концентрациях (обычно 10-50 мкМ), неполное деацетилирование может повлиять на активность фермента или привести к включению частично ацетилированных аналогов сиаловой кислоты, что может привести к искажению последующего анализа. Кроме того, высвобождение уксусной кислоты может влиять на pH локально, потенциально влияя на клеточную функцию. Чен и его коллеги также продемонстрировали, что пер-O-ацетилированные сахара реагируют со свободными остатками цистеина в белках через неферментативный механизм, что приводит к нецелевому включению и увеличению неспецифического сигнала 17,18. Поэтому в настоящем протоколе мы используем незащищенных репортеров ManNAc.

Рисунок 2: Метаболическая инженерия олигосахаридов и мечение сиаловых кислот. UDP-GlcNAc превращается в ManNAc с помощью 2-эпимеразного домена UDP-GlcNAc GNE/MNK в цитозоле. Затем ManNAc фосфорилируется в цитозоле доменом ManNAc 6-киназы GNE/MNK с образованием ManNAc-6-фосфата. N-ацетилнейраминатсинтаза катализирует конденсацию ManNAc-6-P с фосфоенолпируватом с образованием Neu5Ac-9-фосфата, который впоследствии дефосфорилируется фосфатазой сиаловой кислоты с образованием Neu5Ac. Neu5Ac также может поставляться путем спасения через эндоцитоз и лизосомальную рециркуляцию8. После транспортировки в ядро он превращается в CMP-Neu5Ac синтетазой CMP-сиаловой кислоты. В аппарате Гольджи CMP-NeuAc является субстратом сиалилтрансфераз, которые вводят фрагмент Neu5Ac в концевые положения гликанов на созревающих гликоконъюгатах, которые в конечном итоге экспрессируются на клеточной мембране или секретируются. Химические репортеры ManNAz, несущие биоортогональную ручку, могут проникать в клетку через неопознанный активный транспортер и вступать в метаболический путь. Меченые единицы Neu5Az, включенные в гликаны после биосинтеза, затем мечутся с помощью CuAAC-опосредованной конъюгации флуоресцентного зонда. Сокращения: NAc = N-ацетил; UDP-GlcNAc = N-ацетилглюкозамин уридиндифосфат; ManNAc = N-ацетилманнозамин; GNE = UDP-GlcNAc 2-эпимераза; MNK = ManNAc 6-киназа; ManNAc-6-P = ManNAc-6-фосфат; NANS = N-ацетилнейраминатсинтаза; PEP = фосфоенолпируват; Neu5Ac = N-ацетилнейраминовая кислота; Neu5Ac-9-P = Neu5Ac-9-фосфат; NANP = фосфатаза сиаловой кислоты; CMP = цитидин-5'-монофосфат; CMAS = синтетаза CMP-сиаловой кислоты; STs = сиалилтрансферазы; ManNAz = N-азидоацетилманнозамин; Neu5Az = N-азидоацетилнейраминовая кислота. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Среди возможных биоортогональных реакций мы сосредоточили свой интерес на катализируемом медью азид-алкиновом циклоприсоединении (CuAAC)16,19. По нашему опыту, CuAAC является оптимальным вариантом для мечения внутриклеточных гликанов в фиксированных клетках. Эта реакция хорошо известна, тщательно изучена в биоортогональной химии и стандартизирована для использования в сложных биологических средах, обеспечивая прочную основу знаний и оптимизированных протоколов. Его быстрая кинетика действительно обеспечивает высокую эффективность и специфичность реакции, и он включает азидные и алкиновые группы, которые легко синтезировать, стабильны, отсутствуют в живых системах и инертны по отношению к нативным биомолекулам, что делает его идеальным для приложений с фиксированными элементами, где токсичность меди не является проблемой. Стимулируемое штаммом алкин-азидное циклоприсоединение (SPAAC)20,21, хотя и предотвращает токсичность меди, имеет более медленную кинетику и более объемные зонды, что приводит к более высокому фоновому сигналу и снижению отношения сигнал/шум для внутриклеточных приложений из-за гидрофобного захвата, в то время как обратный электронный спрос Дильса-Альдера (IEDDA)22,23, несмотря на то, что он быстрый и не содержит меди, требует более сложного синтеза зондов и требует более объемных репортерных групп, которые еще предстоит полностью охарактеризовать в приложениях MOE. Поскольку для ExM требуются исключительно фиксированные клетки, CuAAC предлагает надежное и эффективное решение для биоортогонального мечения.
В данной работе представлен протокол визуализации внутриклеточных сиалированных гликопротеинов в клетках, сочетающий метаболическое мечение, биоортогональную клик-химию и экспансионную микроскопию. В экспериментальных процедурах, описанных в данной статье, мы используем N-азидоацетилманнозамин (ManNAz) в качестве химического репортера, а перед процедурой расширения проводится лигирование CuAAC малых органических флуорофоров. Гликопротеины прикрепляются к гидрогелю с помощью NAS перед гелеобразованием, перевариванием и расширением. Мечение сиаловых кислот методом MOE может быть связано с иммунофлуоресцентными подходами для оценки колокализации, как это показано на примере мышиного первичного антитела против GM130, локализованного в аппарате цис-Гольджи. Этот протокол может быть применен к клеткам в их физиологическом состоянии, либо к клеткам, которые подверглись химической обработке. Чтобы проиллюстрировать это, хлорохин был использован для ингибирования лизосомальной функции, которая влияет на обработку и транспортировку гликопротеинов в клетках. Ядерное окрашивание используется в качестве ориентира не только для локализации клеток, но и в качестве индикатора качества процесса ExM. Коэффициент расширения действительно можно измерить, сравнив размер ядра до расширения (preExM) и после расширения (postExM).
протокол
1. Посев клеток
ПРИМЕЧАНИЕ: Выполняйте следующие шаги в стерильных условиях под ламинарным колпаком. Этот метод может быть применен к любой из клеточных линий, использованных в настоящей работе (HeLa, MCF7, первичные фибробласты), или к большинству адгезивных моделей клеточных линий, обычно используемых в исследованиях 20,24,25.
- Выращивайте клетки в среде DMEM с высоким содержанием глюкозы с добавлением 10% фетальной бычьей сыворотки (FBS) в колбе T75 при 37 °C при 5% атмосфереCO2 .
- Как только клетки достигнут полного слияния, удалите среду для культивирования клеток и промойте клетки 4 мл PBS.
ПРИМЕЧАНИЕ: Растворы PBS, используемые на этом этапе и на всех последующих этапах промывки, должны быть стерильны путем фильтрации через мембрану из ПТФЭ толщиной 0,2 мкм перед использованием. - Инкубируйте клетки в течение 5 мин при 37 °C в 2 мл 1x раствора трипсина-ЭДТА, содержащего 0,5 г/л трипсина, чтобы освободить их от дна колбы.
- Добавьте 8 мл среды DMEM с высоким содержанием глюкозы, содержащей 10% FBS, и тщательно перемешайте, чтобы убедиться, что каждая отдельная клетка отделена от дна колбы.
- Переложите ячейки в коническую пробирку объемом 15 мл и центрифугируйте в течение 5 минут при конусе 200 × г. Тем временем добавьте по одному покровному стеклу (диаметр 12 мм, толщина 130-160 мкм) в каждую лунку 12-луночного планшета.
ПРИМЕЧАНИЕ: Толщина покровного стекла должна быть отрегулирована в соответствии с требованиями микроскопа, используемого на последующих этапах визуализации. - После центрифугирования надосадочную жидкость удалить надосадочную жидкость и повторно суспендировать гранулу в 1 мл среды для культивирования клеток.
- Определите среднее количество клеток/мл с помощью гемоцитометрии, по крайней мере, по двум измерениям.
- Развести клеточную суспензию до концентрации 300 000 клеток/мл в среде для культивирования клеток и засеять 1 мл суспензии в каждую лунку.
- Дайте клеткам отстояться в течение 24 ч в среде DMEM с высоким содержанием глюкозы, содержащей 10% FBS при 37 °C в атмосфере 5%CO2 , прежде чем приступать к следующим этапам.
2. Лечение хлорохином (по желанию)
ПРИМЕЧАНИЕ: Шаги 2.1-2.8 иллюстрируют, как использовать протокол на клетках, которые обрабатываются внешним реагентом (ингибитором, эффектором, препаратом), используя в качестве примера хлорохин. Пропустите эти шаги для клеток, не обработанных внешними реагентами.
- Взвесьте правильное количество соли хлорохина дифосфата (CQ), чтобы приготовить достаточный объем 10 мМ исходного раствора.
ПРИМЕЧАНИЕ: Выполняйте следующие шаги в стерильных условиях под ламинарным колпаком. - Растворите твердое вещество CQ в желаемом количестве деионизированной воды до конечной концентрации 10 мМ.
- Отфильтруйте раствор через фильтр 0,2 мкм.
- Разогнать 1 мл стокового раствора 10 мМ в микроцентрифужные пробирки объемом 1,5 мл и хранить при температуре -20 °С.
- Промойте образец клетки, приготовленный на шаге 1.9, 1 мл PBS.
- Добавьте 100 мкл 10 мМ CQ в 9,9 мл среды DMEM с высоким содержанием глюкозы, содержащей 10% FBS, для получения конечной концентрации 100 мкМ CQ.
- Инкубировать клетки в течение 8 ч в 1 мл среды с добавлением 100 мкМ CQ при 37 °C при 5% атмосфереCO2 .
- Промойте ячейки 3 раза 1 мл PBS.
3. Метаболическая олигосахаридная инженерия
- Приготовьте 5 мМ стоковый раствор ManNAz (или ManNAc для отрицательного контрольного состояния) в среде DMEM с высоким содержанием глюкозы, содержащей 10% FBS.
ПРИМЕЧАНИЕ: Этот исходный раствор должен иметь достаточный объем, чтобы каждую лунку можно было обработать 1 мл раствора аналога сахара. Следующие действия проводите в стерильных условиях под ламинарным вытяжным шкафом. - Отфильтруйте раствор через фильтр 0,2 мкм и храните в 1 мл аликвот при температуре -20 °C до тех пор, пока не потребуется.
- Готовят среду с добавлением 500 мкМ ManNAz или ManNAc путем разведения 1 мл щелочного раствора, приготовленного на стадии 3.2, с 9 мл среды DMEM с высоким содержанием глюкозы, содержащей 10% FBS.
- Клетки, приготовленные на этапе 1.9 (для экспериментов на необработанных клетках) или на шаге 2.8 (для экспериментов на клетках, обработанных CQ), инкубируют в 1 мл среды с добавлением 500 мкМ ManNAz (или 500 мкМ ManNAc для контрольной группы) в течение 24 ч при 37 °С при 5% атмосфереСО2 .
4. Фиксация и пермеабилизация
ПРИМЕЧАНИЕ: Все эти действия выполняются под вытяжным шкафом.
- Промойте образцы 1 мл PBS.
- Закрепите ячейки на каждом покровном листе, добавив 500 мкл 5% параформальдегида. Дайте ему отдохнуть 15 минут при комнатной температуре.
- Умойтесь 3 раза с 1 мл PBS.
- Подготовьте нестандартную влажную камеру с помощью достаточно большого непрозрачного ящика (например, ящика из полистирола) с крышкой. На дно коробки положите влажный кусок промокательной бумаги, а затем положите поверх него слой парапленки.
ПРИМЕЧАНИЕ: Влажная камера должна полностью защищать образец от внешних источников света в закрытом состоянии. - Поместите покровные листы на парапленку ячейками вверх.
ПРИМЕЧАНИЕ: Заранее пометьте парапленку названием или ссылкой на образцы. - Проведите пермеабилизацию клеток с использованием 200 мкл 0,5% (v/v) Triton X-100 в PBS в течение 15 мин при комнатной температуре.
- Промойте 3 раза 200 μл PBS.
5. Флуоресцентное мечение
- Мечение меченых сиатилированных гликанов с помощью CuAAC
ПРИМЕЧАНИЕ: Реакционный буфер CuAAC должен быть свежеприготовлен перед использованием, а реагенты должны быть добавлены в указанном порядке, при этом аскорбат натрия должен быть добавлен в последнюю очередь. В насыщенных кислородом водных растворах ионы Cu(I), образованные восстановлением Cu(II) с аскорбатом, будут постепенно повторно окисляться до Cu(II), что приведет к снижению концентрации аскорбата с течением времени. Для сохранения воспроизводимости результата буфер не следует хранить более нескольких дней при температуре 4 °C и предпочтительно использовать в тот же день.- Для маркировки модифицированных азидами сиатилированных гликанов, сконструированных в разделе 3, получают реакционный буфер CuAAC, состоящий из 5 μM AlexaFluor 488 алкина (AF488Alk), 150 μM CuSO4, 300 μM 2-(4-((bis((1-(tert-butyl)-1H-1,2,3-триазол-4-ил)метил)амино)метил)-1H-1,2,3-триазол-1-ил)уксусной кислоты (BTTAA), 0,1 M K2HPO4 и 2,5 мМ аскорбата натрия. Приготовьте достаточное количество раствора, чтобы нанести 200 мкл на каждый покровный лист.
- Добавьте 200 μL буфера CuAAC на каждую защитную крышку, чтобы начать реакцию. Убедитесь, что образец равномерно покрыт каплей, и дайте ему вступить в реакцию в течение 45 минут при комнатной температуре, защищенном от света.
- Промойте 3 раза 200 мкл PBS, чтобы остановить реакцию и удалить излишки зонда и реагентов.
- Окрашивание ядер
- Для ядерного мечения с помощью Hoechst 33342 разбавьте стоковый раствор в концентрации 10 мг/мл в соотношении 1:2000 в PBS.
Эквивалентные ядерные контркрасители, такие как 4',6-диамидино-2-фенилиндол (DAPI), могут быть использованы для достижения того же эффекта. - Залейте клетки 200 μл этого раствора и инкубируйте 5-10 мин при комнатной температуре, защищенной от света.
- Промойте 3 раза 200 μл PBS.
- Для ядерного мечения с помощью Hoechst 33342 разбавьте стоковый раствор в концентрации 10 мг/мл в соотношении 1:2000 в PBS.
- Иммунофлуоресцентное окрашивание
- Приготовьте буфер для блокировки бычьего сывороточного альбумина (БСА), содержащий 0,1 г желатина, 1 г БСА, 1 мл FBS и 49 мл PBS на 50 мл буфера.
- Образцы инкубируют в течение 1 ч при 4 °C в 200 мкл блокирующего буфера BSA. Беречь образец от света.
- Для иммунофлуоресцентного окрашивания аппарата Гольджи с использованием очищенного мышиного антитела к GM130 (эпитоп распознан: Rat GM130 aa. 869-982 | RRID: AB_398142), разведите первичное антитело в соотношении 1:100 в подготовленном буфере для блокировки BSA.
ПРИМЕЧАНИЕ: Этот этап может быть адаптирован к иммунофлуоресцентному окрашиванию, нацеленному на другие органеллы, с использованием любого соответствующего первичного антитела, и в этом случае фактор разведения должен быть адаптирован в соответствии с рекомендациями производителя. - Добавьте 70 мкл раствора, содержащего антитело, в покровные стекла и инкубируйте в течение 1 ч при температуре 4 °C, защищенном от света месте.
- Промойте 3 раза 200 μл PBS.
- Разведите флуоресцентное вторичное антитело (Alexa Fluor 546 anti-mouse IgG) в соотношении 1:600 в блокирующем буфере BSA и добавьте 100 мкл на каждую покровную стежку.
- Инкубируйте образцы в течение 1 ч при комнатной температуре, защищенном от света.
- Промойте 3 раза 200 μл PBS.
- Переложите покровные стекла на 6-луночный планшет. Храните образцы в 2 мл PBS при температуре 4 °C в течение нескольких дней в защищенном от света месте.
ПРИМЕЧАНИЕ: рекомендуется всегда готовить репликацию исключительно для визуализации preExM в качестве эталона для целей сравнения до и после расширения, а также для того, чтобы убедиться, что шаблон маркировки не был искажен после расширения.
6. Визуализация образцов перед расширением
ПРИМЕЧАНИЕ: Следующие шаги зависят от используемого оборудования для биовизуализации и, возможно, потребуется адаптировать их к требованиям аппарата. Пожалуйста, соблюдайте правила местной лаборатории или платформы биовизуализации. Шаги 6.1-6.13 здесь выполняются на лазерном сканирующем конфокальном микроскопе.
- Включите микроскоп и убедитесь, что источники света (лазеры) прогреты. Откройте программное обеспечение для получения биоизображений.
- Выберите длины волн лазерного возбуждения, соответствующие флуорофорам для создания каналов (например, 405 нм для ядерного окрашивания, 488 нм для сиатилированных гликанов, меченных AF488Alk, и 546 нм для иммунофлуоресцентного мечения). Активируйте лазеры соответствующим образом.
- Поместите и закрепите покровное стекло диаметром 32 мм (толщина 130-170 мкм) в держателе, приспособленном для микроскопа.
- Поместите образец, подготовленный на шаге 5.3.9, ячейками вниз, на покровное стекло диаметром 32 мм. Добавьте каплю деионизированной воды, чтобы предотвратить высыхание образца.
- Выберите подходящий объектив, в данном случае масляный иммерсионный объектив с 63-кратным увеличением и числовой апертурой 1,4 или эквивалент.
ПРИМЕЧАНИЕ: Самая высокая числовая апертура обеспечивает наилучшее разрешение. При использовании масляного иммерсионного объектива не забудьте добавить каплю масла между объективом и покровным стеклом. - Поместите держатель на предметный столик микроскопа над объективом.
- Используйте режим светлопольной флуоресценции или флуоресценции с низкой интенсивностью лазера, чтобы определить интересующую область в образце.
- Установите фокус.
- Визуализируйте клетки в программном обеспечении в режиме живой флуоресценции . Установите интенсивность лазера для каждого канала. Начните с низкой мощности лазера, чтобы избежать фотообесцвечивания. Медленно увеличивайте мощность лазера и регулируйте усиление и смещение детектора, чтобы усилить сигнал без внесения чрезмерного шума, поскольку это необходимо для четкой визуализации флуоресценции без передержки.
ПРИМЕЧАНИЕ: Параметры должны быть отрегулированы таким образом, чтобы свести к минимуму как фоновый шум, так и избежать насыщения сигнала. Крайне важно поддерживать постоянные настройки для всех образцов в серии экспериментов, включая отрицательный контроль. - Задайте параметры изображения, такие как размер отверстия (например, 1 единица Эйри), скорость сканирования (например, 8), коэффициент масштабирования (например, 1), диапазон значений яркости (например, 16 бит) и усредненное число (например, 2), режим (например, линия) и метод (например, среднее) по мере необходимости, чтобы достичь желаемого наблюдения.
ПРИМЕЧАНИЕ: Эти значения зависят от системы и образца и должны быть оптимизированы перед сбором. Размер отверстия зависит от числовой апертуры, увеличения и длины волны: уменьшение его может улучшить разрешение за счет отношения сигнал/шум. Рекомендуется установить скорость сканирования на быстрые значения (соответствующие малому времени задержки на пиксель), чтобы избежать фотообесцвечивания. - Выполните сбор данных и сохраните их в нужном формате с соответствующими метаданными для использования в будущем.
- После завершения сбора поместите образец обратно в 6-луночный планшет, добавив небольшое количество деионизированной воды для облегчения переноса с помощью пинцета.
ПРИМЕЧАНИЕ: Шаг 6.12 выполняется только в том случае, если требуется расширение данного конкретного образца. В противном случае утилизируйте образец и используйте другие реплики для выполнения следующих шагов.
7. Протокол расширенной микроскопии
ПРИМЕЧАНИЕ: Образцы максимально защищены от света во избежание фотообесцвечивания. Этапы анкеровки и гелеобразования выполняются под вытяжным шкафом.
- Анкеровка
- Образцы инкубируют с N-акрилоилсукцинимидом (НАС) в концентрации 3,2 мг/мл в PBS на механическом вибростенде в течение 1 ч при комнатной температуре. Приготовьте достаточное количество раствора для добавления 500 μл раствора на лунку (исходный раствор: 16 мг/мл NAS в ДМСО).
NAS вступает в реакцию с остатками лизина и N-концами белков с образованием акрилоильной группы, что позволяет белкам закрепиться в гидрогеле на последующих этапах. - Умойтесь 3 раза с 1 мл PBS.
- Образцы инкубируют с N-акрилоилсукцинимидом (НАС) в концентрации 3,2 мг/мл в PBS на механическом вибростенде в течение 1 ч при комнатной температуре. Приготовьте достаточное количество раствора для добавления 500 μл раствора на лунку (исходный раствор: 16 мг/мл NAS в ДМСО).
- Застывание
- Приготовьте раствор мономера, составленный следующим образом: в 50 мл 1x PBS (pH 7,4) добавьте 5,843 г NaCl, 1,25 г акриламида, 0,075 г бис-акриламида и 4,313 г акрилата натрия. Приготовьте достаточное количество раствора, чтобы нанести 70 μL на каждый покровный лист. Заморозьте 1 мл аликвот не менее чем за 24 часа до гелеобразования.
ВНИМАНИЕ: Мономеры токсичны; С ними необходимо обращаться осторожно с помощью соответствующего защитного оборудования и взвешивать под вытяжным шкафом. - На кусочек парапленки помещают каплю 70 мкл раствора мономера, после чего добавляют 1,4 мкл 10% (v/v) N,N,N',N'-тетраметилэтилендиамина (TMEDA), затем 1,4 мкл 10% (w/v) персульфата аммония (APS), которые подмешивают в каплю.
ПРИМЕЧАНИЕ: Сшивающие реагенты должны быть добавлены в следующем определенном порядке: сначала TMEDA, затем APS. - Быстро осторожно положите покровную крышку на раствор ячейками вниз.
- Дайте раствору полимеризоваться в течение 1 ч при комнатной температуре во влажной камере.
- Приготовьте раствор мономера, составленный следующим образом: в 50 мл 1x PBS (pH 7,4) добавьте 5,843 г NaCl, 1,25 г акриламида, 0,075 г бис-акриламида и 4,313 г акрилата натрия. Приготовьте достаточное количество раствора, чтобы нанести 70 μL на каждый покровный лист. Заморозьте 1 мл аликвот не менее чем за 24 часа до гелеобразования.
- Пищеварение
- Приготовьте буферный раствор для разложения, состоящий из 1x буфера TAE, 0,5% (v/v) Triton X-100, 0,8 M гуанидина HCl и 8 U/mL протеиназы K.
ПРИМЕЧАНИЕ: Буфер для сбраживания должен быть свежеприготовленным и предварительно инкубирован в течение 30 минут при 37 °C перед использованием. - Добавьте 1 мл буфера для разложения в гидрогель, образованный на шаге 7.2. Дайте процессу разложения продолжаться в течение 3 часов при температуре 37 °C на механическом шейкере.
- Удалите буфер для пищеварения и аккуратно промойте гель 3 раза 2 мл деионизированной воды.
ПРИМЕЧАНИЕ: Гидрогель немного расширится и отделится от покровного стекла.
- Приготовьте буферный раствор для разложения, состоящий из 1x буфера TAE, 0,5% (v/v) Triton X-100, 0,8 M гуанидина HCl и 8 U/mL протеиназы K.
- Расширение
- Оставьте гидрогель расширяться в 3 мл деионизированной воды на 2 ч. Меняйте воду каждые 30 минут.
8. Визуализация образцов после расширения
- Установите покровное стекло диаметром 32 мм (толщина 130-170 мкм) и закрепите его на держателе.
- Вырежьте кусочек гидрогеля и поместите его на покровную пластинку, с ячейками на дне геля.
ПРИМЕЧАНИЕ: Вырезанные кусочки должны быть достаточно большими, чтобы обеспечить достаточную площадь поверхности для наблюдения, но не слишком большими, так как это может затруднить работу с гелем и увеличить риск поломки (рекомендуемый размер: от 5 до 8 мм). Поместите достаточное количество кусочков гидрогеля, чтобы покрыть всю поверхность покровного стекла; Это поможет закрепить детали на месте и предотвратить смещение во время визуализации. В случае проблем с дрифтингом может оказаться целесообразным предварительное покрытие покровных стекол поли-D-лизином6. - Поместите держатель на предметный столик микроскопа над объективом.
- Выполните получение изображения на лазерном сканирующем конфокальном микроскопе с масляным иммерсионным объективом, как описано в шаге 6.
9. Расчет коэффициента расширения (EF) в ImageJ
- Откройте данные изображения в бесплатной программе ImageJ или аналогичной.
- Если вы работаете с изображением нескольких каналов, разделите каналы и работайте только с каналом ядра, перейдя в раздел Выбрать изображение | Цвет | Раздельные каналы.
- Чтобы измерить диаметр ядра, выделите сигнал, соответствующий ядру, определив порог, нажав на Выбрать изображение | Настройка | Порог.... Выберите метод в раскрывающемся меню по умолчанию , который лучше всего подходит для изображения (например, Оцу), и настройте порог до тех пор, пока форма ядра не будет четко вырезана из фона.
ПРИМЕЧАНИЕ: Пороговое значение необходимо корректировать для каждого изображения, так как одна настройка может не подходить для всех изображений или каждого образца. - Установите измерение для определения диаметра Ферета , нажав на кнопку «Выбрать анализ» | Установите мерки.... В меню выберите Диаметр Ферета и при необходимости отрегулируйте десятичную дробь .
- Чтобы начать анализ изображения, нажмите на кнопку Выбрать анализ | Анализ частиц для установки размера частиц; Для ядра выберите 5-бесконечность μм² | Отображение результатов | Добавить в менеджер | Исключить по краям и Наложение. Начните анализ.
- Когда начнется анализ, появится несколько окон. В результатах окна найдите максимальный диаметр Feret каждого ядра в столбце Feret. Скопируйте и вставьте необработанные данные в таблицу и рассчитайте средний размер ядра для предварительно развернутых и развернутых образцов.
ПРИМЕЧАНИЕ: Убедитесь, что области интереса (ROI), соответствующие каждому ядру, следуют за всей периферией ядра. - Рассчитайте коэффициент расширения (EF) следующим образом:
ЭФ =
ПРИМЕЧАНИЕ: Коэффициент EF определяет, насколько была расширена выборка.
Результаты
Ниже показано применение протокола для визуализации сиалированных гликопротеинов в клетках HeLa (рис. 3A) и клетках MCF7 (рис. 3B), без лечения CQ (раздел протокола 2) и иммунофлуоресцентного ко-локализационного окрашивания (шаг протокола 5.3).

Рисунок 3: Сравнение шаблона сиалирования-мечения до (слева) и после (справа) протокола ExM. (A) Клетки Hela и (B) клетки MCF7 инкубировали в течение 24 ч с 500 мкМ ManNAz. Мечение осуществлялось через CuAAC алкином Alexa Fluor 488 (обозначен зеленым цветом). Ядра были окрашены Hoechst 33342 (изображен синим цветом). Масштабные линейки = 20 мкм. Сокращения: ExM = Экспансионная микроскопия; ManNAz = N-азидоацетилманнозамин; CuAAC = катализируемый медью циклоприсоединение к азид-алкину. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Как правило, сиалирование-мечение состоит из трех основных пулов флуоресценции: пула Гольджи, указывающей на синтезируемые гликоконъюгаты, везикулярного пула (обычно менее интенсивного), представляющего гликоконъюгаты, экспортируемые в клеточную мембрану или рециркулирующие из нее, и пула мембран, показывающей гликоконъюгаты, которые былиэкспрессированы13. Важно отметить, что обнаруживаются только биополимерные гликоконъюгаты, помеченные метаболически генерируемым Neu5Az, в то время как любые непрореагировавшие избыточные репортеры или зонды удаляются на этапах промывки. Изображения после ExM были получены на конфокальном микроскопе и показывают гораздо более мелкие детали и меньший фон, особенно в аппарате Гольджи. Протокол может быть применен к любому типу адгезивных клеток, экспрессирующих сиалированные гликоконъюгаты.
На различные типы клеток или тканей может в разной степени влиять частичная потеря сигнала, присущего ExM, которая происходит из-за объемного разведения флуорофоров. Это также может усугубляться плохим удержанием флуорофоров во время радикальной полимеризации или биомолекул из-за неоптимального закрепления или переваривания, что может привести к резкой потере сигнала (Рисунок 4). Этот пункт является основной темой обсуждения ниже. В связи с этим рекомендуется при необходимости корректировать параметры этапов пищеварения в соответствии с исследуемым типом клеток или тканей. Пищеварение может быть оптимизировано различными способами, в зависимости от конкретных структур или биомолекул. Мы рекомендуем начать со стандартизированного протокола пищеварения, а затем эмпирически корректировать такие параметры, как время пищеварения, концентрация детергента и/или концентрация фермента для достижения желаемых результатов. Важно отметить, что более эффективное разложение приводит к лучшему изотропному расширению без искажений, но это также может увеличить риск потери сигнала. Поэтому необходимо найти баланс между достижением высококачественного изотропного расширения и сохранением целостности сигнала. Удержание сигнала может быть дополнительно улучшено за счет использования специально разработанных молекулярных якорей. В исследованиях, посвященных наблюдению за белками, было показано, что протоколы, использующие только додецилсульфат натрия (SDS) при повышенных температурах, эффективно переваривают внедренный образец при лучшем сохранении белковых сигналов26,27.
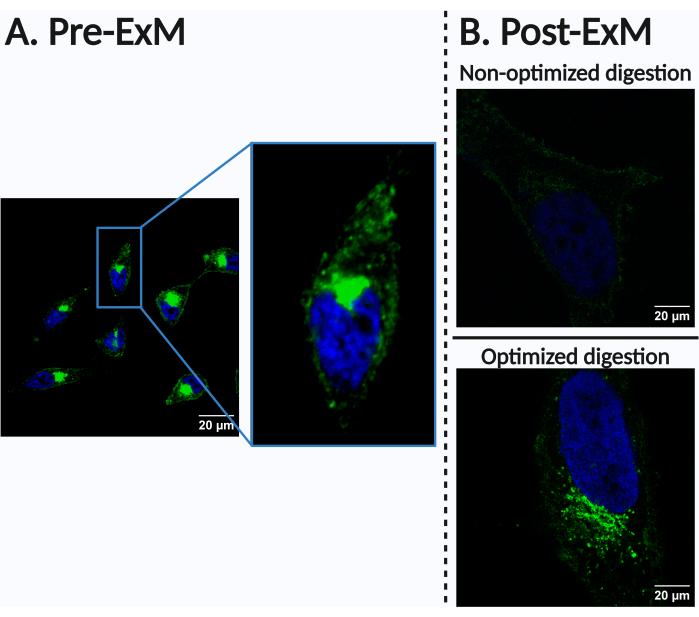
Рисунок 4: Пример неоптимального результата. Этот рисунок иллюстрирует важность адаптации условий для каждого типа клеток, тканей и контролируемых биомолекул, особенно для этапа пищеварения. Клетки HeLa инкубировали в течение 24 ч с 500 мкМ ManNAz и мечили алкином Alexa Fluor 488 (зеленые, сиалированные N-гликопротеины) и Hoechst 33342 (синие, ядра). (A) Нанесение этикеток на предварительное расширение. (B) шаблон маркировки после расширения. (Вверху) Плохо оптимизированные параметры пищеварения с точки зрения состава, концентрации и/или длины могут привести к резкой потере сигнала из-за отсутствия удержания привитых биомолекул в гидрогеле, что препятствует получению данных биовизуализации с достаточной чувствительностью. В данном конкретном случае буфер разложения был аналогичен тому, который использовался на шаге протокола 7.3. Тем не менее, время разложения составило 90 минут, по сравнению со временем переваривания 180 минут, использованным на последующем изображении. (внизу) Изображение, полученное после оптимизации параметров разложения (см. протокол шаг 7.3). Масштабные линейки = 20 мкм. Аббревиатура: ManNAz = N-азидоацетилманнозамин. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Чтобы обеспечить воспроизводимость эксперимента, крайне важно сохранить образцы в растворе и защитить их от света даже после встраивания их в гидрогель. Гидрогель необходимо хранить во влажной камере, чтобы предотвратить его высыхание. Настоятельно рекомендуется выполнять три основных этапа - гелеобразование (протокол шаг 7.2), разложение (протокол шаг 7.3) и расширение (протокол шаг 7.4) - в один и тот же день. После расширения образец стабилен в течение нескольких дней, если его хранить при температуре 4 °C в деионизированной воде и защищать от света, что дает время для получения данных биовизуализации.
При анализе микроскопических изображений рекомендуется оценивать фактор расширения (ФВ) путем измерения среднего отношения диаметра ядра Ферет до (preExM) и после расширения (postExM). Здесь, в этом протоколе, ядра окрашиваются с помощью Hoechst 33342, но более традиционный DAPI также совместим с экспансионной микроскопией. Диаметр Ферета соответствует максимальному расстоянию между двумя точками, расположенными на границе ядра. Как правило, успешные эксперименты дают значение EF от 4 до 5 (рис. 5), что соответствует максимальному латеральному разрешению ~60-70 нм, в зависимости от используемой длины волны и объектива. Средний диаметр ядер Ферета определяется путем измерения не менее 60-100 клеток на нескольких изображениях для статистического подхода. Для большей точности можно систематически собирать и обрабатывать z-стеки, позволяющие проводить 3D-реконструкцию, чтобы убедиться, что измеренное расстояние соответствует фактическому диаметру Ферета для всех ядер. Однако этот подход может быть значительно более трудоемким, как с точки зрения сбора данных в зависимости от микроскопа и используемых целей, так и, в частности, с точки зрения обработки данных. Это можно перепроверить с помощью макромасштабных измерений ЭФ путем сравнения размера гидрогеля до и после расширения, что, по нашему опыту, приводит к аналогичным результатам.

Рисунок 5: Определение коэффициента расширения. Средний размер ядер до и после расширения определяется путем измерения их диаметра Ферета (т.е. наибольшего расстояния между двумя точками на краю ядра) в программном обеспечении ImageJ. Расчет соотношения между средним диаметром Ферета после ExM и предварительным ExM дает коэффициент линейного расширения. Первичные фибробласты человека 533T были включены в протокол расширения. Ядра были окрашены Hoechst 33342 (изображен синим цветом). Масштабные линейки = 20 мкм. Аббревиатура: ExM = Экспансионная микроскопия. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Этот протокол предназначен для решения биологических вопросов, требующих специфического клеточного лечения или сравнения различных физиологических и патологических состояний. Примером этого является его применение на фибробластах человека, обработанных противомалярийным препаратом хлорохином (CQ). CQ, дипротонное слабое основание со значениями pKa 8,4 и 10,8, преимущественно накапливается в лизосомах за счет захвата pH, что приводит к повышению лизосомального pH и последующей потере функции.
В этом эксперименте ManNAz включают в сиалированные гликаны, которые затем мечут Alexa Fluor 488 через CuAAC, в то время как аппарат Гольджи окрашивают мышиным антителом против GM130. Примечательно, что отчетливые различия в относительной интенсивности наблюдаются между контрольными клетками (рисунок 6A) и клетками, обработанными CQ (рисунок 6B). В физиологических условиях в контрольных клетках первичный пул мечения сиалоконъюгатов локализован в аппарате Гольджи. Напротив, клетки, обработанные CQ, демонстрируют накопление сиаловой кислоты в лизосомах, что свидетельствует о захвате переработанных гликоконъюгатов. Это особенно актуально в контексте изучения врожденных нарушений гликозилирования или лизосомальных болезней накопления 13,14,15.

Рисунок 6: ПостExM визуализация влияния хлорохина на локализацию сиатилированных гликопротеинов после ExM. Первичные фибробласты 533T человека либо (А) не обрабатывали CQ, либо (В) обрабатывали 100 мкМ CQ в течение 8 ч перед инкубацией с 500 мкМ ManNAz в течение 24 ч и мечением CuAAC алкином Alexa Fluor 488 (зеленый канал). Колокализационное окрашивание аппарата Гольджи (красный канал) проводили с помощью мышиного первичного антитела против GM130 и меченого против мыши вторичного антитела Alexa Fluor 546. Клетки подвергали закреплению, гелеобразованию, расщеплению и расширению, как описано. Масштабные линейки = 20 мкм. Сокращения: ExM = Экспансионная микроскопия; CQ = хлорохин; ManNAz = N-азидоацетилманнозамин; CuAAC = катализируемый медью циклоприсоединение к азид-алкину. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Обсуждение
Настоящий протокол мечения CuAAC не включает аминогуанидин в реакционный буфер. Поскольку он направлен на визуализацию внутриклеточных гликоконъюгатов, он проводится на клетках, которые фиксируются после этапа метаболического включения, чтобы избежать любых проблем цитотоксичности и улучшить поглощение каталитической системой. Использование аминогуанидина обычно рекомендуется для мечения живых клеток на клеточной поверхности с целью предотвращения побочных реакций между дегидроаскорбатом и остатками белков аргинина, гистидина и лизина. Эти модификации действительно могут влиять на функцию белка и потенциально вызывать нарушения или цитотоксичность. Еще одним важным соображением в отношении реакционного буфера CuAAC является то, что комплексообразование ионов меди с помощью BTTAA происходит быстро, но не сразу. Чтобы обеспечить эффективную маркировку модифицированных сахаров, мы рекомендуем готовить раствор не менее чем за 30 минут до начала процесса маркировки, чтобы обеспечить воспроизводимость результатов для начинающих пользователей.
Для получения данных можно использовать любой конфокальный микроскоп. По мере расширения образца расширяется и наблюдаемое поле. Чтобы захватить всю ячейку, рекомендуется выполнить мозаичное сканирование области с 10% перекрытием между изображениями. Несмотря на то, что сканирование плитки можно проводить одновременно и z-стек, в этом случае мы рекомендуем выбрать сканирование плитки меньшего размера. Это связано с тем, что этот процесс занимает много времени и генерирует значительный объем необработанных данных, что приводит к интенсивной обработке данных. Рекомендуется разделять оба метода, создавая z-стек только для областей интереса, с параметрами, соответствующими z-стеку перед расширением. Поскольку на вспененных гелях не используется защитный от выцветания монтажный материал, мы рекомендуем настроить параметры сбора данных соответствующим образом, чтобы свести к минимуму фотообесцвечивание (высокая скорость сканирования, низкая интенсивность лазера).
Успешные эксперименты с расширением обычно приводят к коэффициенту расширения от 4 до 5, что соответствует объемному увеличению от 64x до 125x. Поскольку после расширения такое же количество молекул флуорофора распределяется по гораздо большему объему, основным недостатком ExM является неизбежное снижение интенсивности сигнала. Чтобы иметь возможность наблюдать флуоресцентный сигнал после расширения, усиление и/или интенсивность возбуждающего лазера могут быть значительно увеличены в зависимости от флуорофора. Отверстие точечного отверстия также может быть модулировано. В дополнение к этому чисто физическому эффекту разбавления флуоресцентного сигнала, существуют и другие возможные причины потери сигнала.
После мечения, фиксации и биоконъюгации молекулярных якорей гелеобразование (этап протокола 7.2) направлено на инкапсуляцию образца в полиэлектролитный гидрогель. Такие полимеры состоят из трех мономеров: акриламида, бис-акриламида и акрилата натрия. Последний придает гелю расширяющее свойство благодаря его ионной природе; Фактически, этот полимер может поглощать воду в несколько раз больше своего веса, обменивая ионы натрия на молекулы воды29. Сшивание геля представляет собой радикальную реакцию, катализируемую TMEDA и APS. Следует отметить, что причиной дальнейшего снижения сигнала является частичная деградация органических флуорофоров во время этой радикально-индуцированной полимеризации. Различные красители воздействуют в разной степени; Например, цианиновые красители почти полностью разрушаются при экспансии, демонстрируя плохое удержание сигнала в 0,3-0,4%30,31, в то время как красители Alexa Fluor 488 позволяют сохранять ~57% интенсивности сигнала после ExM4. Обзор удержания сигнала различными органическими флуорофорами и флуоресцентными белками см. в обзоре Wen et al.31.
Кроме того, на удержание биомолекул также могут влиять определенные этапы протокола. Например, гликановые цепи, расположенные на фрагментах белка, которые не закреплены на гидрогеле, могут вымываться во время переваривания, что еще больше снижает интенсивность сигнала (рис. 4). При расщеплении используется по меньшей мере одно детергентное средство32, такое как Triton X-100, с протеиназой K 4,5,6,31 или без нее, чтобы разрушить мембраны и белковые структуры, такие как цитоскелет. Время разложения и состав буфера для разложения могут быть скорректированы таким образом, чтобы наилучшим образом сохранить определенные флуорофоры и биомолекулы. Таким образом, параметры разложения (этап протокола 7.3) должны быть оптимизированы для типа исследуемого образца с точки зрения состава, концентрации и продолжительности, чтобы получить наилучший баланс между гомогенизацией для обеспечения изотропного расширения и удержания биомолекул и зондов. В некоторых случаях тип буфера для сбраживания может быть полностью модифицирован для более мягких условий, как в Ultrastructure-ExM, где белки образца денатурируются в SDS при 95 °C перед расширением геля26,27.
По возможности, решение проблемы нижнего сигнального поста ExM может быть просто решено путем регулировки мощности источника возбуждения и/или усиления детекторной камеры во время сбора данных визуализации без необходимости использования специальных зондов. В тех случаях, когда отношение сигнал/шум будет недостаточным после ExM, различными лабораториями были разработаны дополнительные стратегии сохранения сигнала и/или усиления, например, с использованием трифункциональных молекул, которые позволяют закрепить сами флуорофоры непосредственно на полимерной матрице 6,14. В качестве альтернативного решения этих проблем окрашивание образца может быть выполнено после расширения, поскольку гель обладает достаточной проницаемостью. Однако это препятствует наблюдению образца до расширения. Недавно сообщалось об этом подходе для иммуноокрашивания33, при котором образцы сначала изотропно расширяются, а затем окрашиваются антителами. Авторы продемонстрировали, что это может привести к улучшению яркости флуоресценции и доступности эпитопов, одновременно уменьшая ошибки компоновки, которые препятствуют точности локализации при сочетании методов ExM и сверхвысокого разрешения.
Были изучены альтернативные стратегии предотвращения снижения интенсивности флуоресценции. Одним из примеров является использование флуорофоров на основе полимеров вместо обычных флуоресцентных молекул. Liu et al. разработали флуоресцентные полимерные точки (Pdots)34 , которые намного ярче, чем обычные флуорофоры, что позволяет улучшить соотношение сигнал/шум. Pdots могут быть функционализированы с помощью якоря и антитела. В другом примере в рамках Click Expansion Microscopy (ClickExM)6 была представлена универсальная стратегия для улучшения удержания сигнала с помощью стратегии непрямого биотин-стрептавидина с использованием флуоресцентного стрептавидина, несущего якорь. Это позволяет напрямую прививать флуоресцентные зонды к полимерному каркасу. Аналогичным образом, наноразмерная флуоресцентная микроскопия in-situ (MAGNIFY)35 с молекулярным якорем гелем в значительной степени полагается на биомолекулярное закрепление для увеличения удержания флуоресцентного сигнала. В отличие от ClickExM, который связывает определенную молекулу с гелем, MAGNIFY использует метакролеин для сшивания широкого спектра биомолекул с каркасом гидрогеля.
Еще одним возможным ограничением ExM с точки зрения получения данных на микроскопе является необходимость получения изображения расширенного образца на большей физической площади, что значительно увеличивает время, необходимое для захвата всего образца. Поскольку в процессе расширения образец увеличивается, для получения изображений с высоким разрешением требуется захват большего количества фрагментов изображения, охватывающих одну и ту же биологическую область, что приводит к увеличению времени сбора. В связи с этим для ряда применений ExM будет рассматриваться не как замена классической конфокальной микроскопии, а как дополнительный метод для всесторонней и детальной визуализации.

Рисунок 7: Сравнение preExM и postExM 3D-визуализации клеток первичного фибробласта 533T человека. Клетки инкубировали с 500 мкМ ManNAz в течение 24 ч и мечили алкином Alexa Fluor 488 с помощью CuAAC (зеленый цвет). Колокализационное окрашивание аппарата Гольджи (красный цвет) проводили мышиным первичным антителом против GM130 и вторичным антителом, меченным против мышей Alexa Fluor 546, а ядра окрашивали препаратом Hoechst 33342 (синий цвет). (Слева) (A) Z-стек и (B,C) 3D-рендеринг поверхности ячеек, визуализированных до ExM. (Справа) Клетки подвергали закреплению, гелеобразованию, расщеплению и экспансии, как описано в описании, (D) до получения z-стека. (E) 3D-рендеринг поверхности сигналов ясно иллюстрирует увеличение разрешения, которое особенно ценно при обнаружении сложных внутриклеточных субструктур. 3D-реконструкция и рендеринг поверхности были созданы с использованием интенсивности сигнала. Масштабные линейки = 20 μм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
ExM стал инновационным методом для получения наноразмерной визуализации без фактического превышения дифракционного предела, что позволяет визуализировать детали биологических образцов, которые в противном случае были бы упущены из виду в стандартныхпротоколах. При использовании оборудования, ограниченного дифракцией ~250 нм (как это обычно бывает с обычными конфокальными микроскопами, оснащенными зелеными лазерами), коэффициент расширения 4,5x обычно приводит к боковому разрешению, близкому к 60 нм. Это очень значительное улучшение при изучении субклеточных структур, таких как аппарат Гольджи или везикулы, которые могут быть использованы в 2D-визуализации, а также при создании 3D-изображений на основе z-стека (рис. 7). Чтобы использовать всю мощь экспансионной микроскопии, достигнутое разрешение может быть дополнительно улучшено за счет комбинации ExM с методами микроскопии сверхвысокого разрешения, такими как STED или STORM, что выходит за рамки данной статьи.
В области интенсивной микроскопии наблюдается очень быстрый рост и значительные достижения, что делает ее захватывающей и динамичной областью исследований. Бойден и его коллеги представили экспансионную микроскопию в 2015 году, достигнув разрешения около 70 нм с помощью конфокальных микроскопов за счет использования гелевых меток для сохранения геометрии биомолекул в полимерной матрице. Вслед за первоначальным интересом, потребность в изготовленных на заказ конъюгатах олигонуклеотид-антитело побудила научное сообщество разработать новые инструменты и подходы для этого метода. Были разработаны различные стратегии прямого закрепления белков на геле с использованием коммерчески доступных агентов, позволяющих использовать флуоресцентно меченные антитела или белки, а последние разработки еще больше упростили экспансионную микроскопию и расширили ее применение на различные биомолекулы без необходимости отдельных этапов закрепления.
Получение мечения MOE с более высоким разрешением с помощью ExM особенно полезно для регулярного изучения пространственного распределения сиатилированных гликанов без необходимости использования микроскопов сверхвысокого разрешения, которые являются дорогостоящими и труднодоступными. Например, с помощью этого метода были визуализированы сиалогликаны на плазматической мембране, выявлено их распределение в микроворсинках и других клеточных структурах6. Возможность визуализации внутриклеточных гликанов с улучшенным разрешением еще более важна для изучения их биосинтеза, транспортировки и переработки 8,13,14,15 и расшифровки их роли в таких патологиях, как метаболические заболевания или рак. Объединение ExM и биоортогональной химии предоставит уникальную возможность лучше понять их локализацию и участие в клеточных путях, функции органелл и взаимодействиях, которые являются ключевыми для клеточной регуляции и механизмов заболевания. Это, несомненно, улучшит наше понимание роли, которую играют сиаловые кислоты в различных патологиях в будущем.
Раскрытие информации
Авторы не имеют конкурирующих финансовых интересов или иного конфликта интересов.
Благодарности
Мы благодарим предприятия TisBio и платформу PLBS за предоставление технической среды, способствующей выполнению этой работы. Эта работа была поддержана грантами CNRS и Ministère de l'Enseignement Supérieur et de la Recherche. Мы хотели бы поблагодарить д-ра Франсуа Фулькье, д-ра Зои Дурин, г-жу Дороти Викон и г-жу Селин Шульц за стимулирование дискуссий и предоставление нам клеточной линии фибробластов 533T и первичного антитела GM130.
Материалы
| Name | Company | Catalog Number | Comments |
| (+) Sodium L-ascorbate | Sigma Aldrich | 11140 | |
| 12 well cell culture plate | Corning | 3513 | |
| Acrylamide | Sigma Aldrich | A8887 | |
| Acrylic acid N-hydroxysuccinimide ester | Sigma Aldrich | A8060 | |
| Alexa Fluor 488 alkyne | Jena Bioscience | CLK-1277-5 | |
| Alexa Fluor 546 goat anti-mouse IgG | Invitrogen | A11003 | |
| Amonium persulfate | Sigma Aldrich | 9913 | |
| Bis-Acrylamide | Sigma Aldrich | 146072 | |
| BSA | Sigma Aldrich | A7906 | |
| BTTAA | Jena Bioscience | CLK-067-100 | |
| Centrifugation tube 2 mL | EPPENDORF | 30120094 | |
| Chloroquine diphosphate salt | Sigma Aldrich | C6628 | |
| Conical tube 15 mL | Falcon | 352097 | |
| cover slips 12 mm #1 | epredia | CB00120RA120MNZ0 | |
| cover slips 32 mm #1 | epredia | CB00320RA140MNZ0 | |
| CuSO4 | Sigma Aldrich | 209198 | |
| DMEM high glucose medium | Dutscher | L0104-500 | |
| Dulbecco's Phosphate Buffered Saline (PBS) | Dutscher | L0615-500 | |
| Fetal Bovine Serum | biowest | S1810-500 | |
| Fibroblast 533T | - | - | Collected from healthy individual |
| FIJI ImageJ 2.9.0 | - | - | |
| Gelatin | Bio-RAD | 170-6537 | |
| Guanidine HCl | Sigma Aldrich | 50950 | |
| HeLa cells | ATCC | CCL-2 | |
| Hoechst 33342 | Sigma Aldrich | 14533 | |
| Imaris 10.2 | - | - | |
| K2HPO4 | Euromedex | PB0447-B | Anhydrous |
| LSM 780 Confocal Microscopy | Zeiss | - | |
| MCF7 | ATCC | HTB-22 | |
| N-acetylmannosamine (ManNAc) | BIOSYNTH | MA05269 | |
| NaCl | Carlo Erba | 479687 | |
| N-azidoacetylmannosamine (ManNAz) | BIOSYNTH | MA46002 | |
| Objectif "Plan-Apochromat" 63x/1,4 Oil DIC M27 | Zeiss | 420782-9900-799 | |
| Phosphate Buffered Saline (PBS) 10x | Euromedex | ET330 | |
| Proteinase K | Sigma Aldrich | P2308 | from Tritirachium album |
| purified mouse GM130 antibody | BD Bioscience | 610822 | 50 µg |
| Sodium acrylate | Sigma Aldrich | 408220 | |
| T75 Flask | Corning | 430641 | |
| TEMED | Sigma Aldrich | T9281 | |
| tris Acetate EDTA (TAE) 10x | Euromedex | EU0202-B | |
| Triton X-100 | Sigma Aldrich | X-100 | |
| Trypan Blue | Dutscher | 702630 | |
| Trypsine-EDTA 1x | Dutscher | L0930-100 |
Ссылки
- De Souza, N. Light microscopy at the limit. Nat Cell Biol. 11 (Suppl 1), S22(2009).
- Tam, J., Merino, D. Stochastic optical reconstruction microscopy (STORM) in comparison with stimulated emission depletion (STED) and other imaging methods. J Neurochem. 135, 643-658 (2015).
- Jeong, S., Widengren, J., Lee, J. C. Fluorescent probes for STED optical nanoscopy. Nanomaterials. 12 (1), 21(2021).
- Chen, F., Tillberg, P. W., Boyden, E. S. Expansion microscopy. Science. 347 (6221), 543548(2015).
- Kang, S., et al. Expansion microscopy with a thermally adjustable expansion factor using thermoresponsive biospecimen-hydrogel hybrids. ACS Appl Mater Interfaces. 13 (24), 2896228974(2021).
- Sun, D., et al. Click-ExM enables expansion microscopy for all biomolecules. Nat Methods. 18 (1), 107113(2020).
- Dube, D., Bertozzi, C. Metabolic oligosaccharide engineering as a tool for glycobiology. Curr Opin Chem Biol. 7 (5), 616625(2003).
- Scache, J., et al. Switching azide and alkyne tags on bioorthogonal reporters in metabolic labeling of sialylated glycoconjugates: a comparative study. Sci Rep. 12 (1), 22129(2022).
- Holst, S., Wuhrer, M., Rombouts, Y. Glycosylation characteristics of colorectal cancer. Adv Cancer Res. 126, 203256(2015).
- Boyaval, F., et al. N-Glycomic signature of stage II colorectal cancer and its association with the tumor microenvironment. Mol Cell Proteomics. 20, 100057(2021).
- Ferreira, J. A., et al. Protein glycosylation in gastric and colorectal cancers: Toward cancer detection and targeted therapeutics. Cancer Lett. 387, 32-45 (2017).
- Jennings, M. P., Day, C. J., Atack, J. M. How bacteria utilize sialic acid during interactions with the host: snip, snatch, dispatch, match and attach. Microbiology. 168 (3), 001157(2022).
- Gilormini, P. A., et al. A sequential bioorthogonal dual strategy: ManNAl and SiaNAl as distinct tools to unravel sialic acid metabolic pathways. Chem Commun. 52 (11), 2318-2321 (2016).
- Vanbeselaere, J., et al. Alkynyl monosaccharide analogues as a tool for evaluating Golgi glycosylation efficiency: application to Congenital Disorders of Glycosylation (CDG). Chem Commun. 49 (96), 11293-11295 (2013).
- Gilormini, P. A., et al. Chemical glycomics enrichment: imaging the recycling of sialic acid in living cells. J Inherit Metab Dis. 4 (3), 515523(2018).
- Rigolot, V., Biot, C., Lion, C. To view your biomolecule, click inside the cell. Angew Chem. 60 (43), 2308423105(2021).
- Qin, W., et al. Artificial cysteine S-glycosylation induced by per-O-acetylated unnatural monosaccharides during metabolic Glycan Labeling. Angew Chem. 130 (7), 1835-1838 (2018).
- Qin, K., Zhang, H., Zhao, Z., Chen, X. Protein S-glyco-modification through an elimination-addition mechanism. J Am Chem Soc. 142 (20), 9382-9388 (2020).
- Rostovtsev, V. V., Green, L. G., Fokin, V. V., Sharpless, K. B. A. Stepwise Huisgen cycloaddition process: Copper(I)-catalyzed regioselective "ligation" of azides and terminal alkynes. Angew Chem. 41 (14), 25962599(2002).
- Agard, N. J., Prescher, J. A., Bertozzi, C. R. A strain-promoted [3 + 2] azide−alkyne cycloaddition for covalent modification of biomolecules in living systems. J Am Chem Soc. 126 (46), 15046-15047 (2004).
- Mbua, N. E., et al. Strain-promoted alkyne-azide cycloadditions (SPAAC) reveal new features of glycoconjugate biosynthesis. ChemBioChem. 12 (12), 19121921(2011).
- Blackman, M. L., Royzen, M., Fox, J. M. Tetrazine ligation: Fast bioconjugation based on inverse-electron-demand Diels-Alder reactivity. J Am Chem Soc. 130 (41), 1351813519(2008).
- Devaraj, N. K., Weissleder, R., Hilderbrand, S. A. Tetrazine-based cycloadditions: Application to pretargeted live cell imaging. Bioconjug Chem. 19 (12), 22972299(2008).
- Bird, R. E., et al. Bioorthogonal chemistry and its applications. Bioconjug Chem. 32 (12), 2457-2479 (2021).
- Slade, P. G., et al. Identifying the CHO secretome using mucin-type O-linked glycosylation and click-chemistry. J Proteome Res. 11 (12), 61756186(2012).
- Gambarotto, D., Hamel, V., Guichard, P. Ultrastructure expansion microscopy (U-ExM). Methods Cell Biol. 161, 5781(2021).
- Gambarotto, D., et al. Imaging cellular ultrastructures using expansion microscopy (U-ExM). Nat. Methods. 16, 71-74 (2019).
- Presolski, S. I., Hong, V. P., Finn, M. Copper-catalyzed azide-alkyne click chemistry for bioconjugation. Curr Protoc Chem Biol. 3 (4), 153-162 (2011).
- Santiago, F., et al. Synthesis and swelling behaviour of poly(sodium acrylate)/sepiolite superabsorbent composites and nanocomposites. Polym Int. 55 (8), 843848(2006).
- Wen, G., et al. Evaluation of direct grafting strategies via trivalent anchoring for enabling lipid membrane and cytoskeleton staining in expansion microscopy. ACS Nano. 14 (7), 78607867(2020).
- Wen, G., et al. Current progress in expansion microscopy: Chemical strategies and applications. Chem Rev. 123 (6), 32993323(2023).
- Drelich, L., et al. Toward high spatially resolved proteomics using expansion microscopy. Anal Chem. 93 (36), 12195-12203 (2021).
- Zwettler, F. U., et al. Molecular resolution imaging by post-labeling expansion single-molecule localization microscopy (Ex-SMLM). Nat Commun. 11 (1), 3388(2020).
- Liu, J., et al. Expansion microscopy with multifunctional polymer dots. Adv Mater. 33 (25), 2007854(2021).
- Klimas, A., et al. Magnify is a universal molecular anchoring strategy for expansion microscopy. Nat Biotechnol. 41 (6), 858869(2023).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены