Method Article
Floresan ve Radyoaktif İzleyicilerle Mikro Kabarcıkların Üretilmesi ve Etiketlenmesi
Bu Makalede
Özet
Bu protokol, lipid mikro kabarcıklarının üretimini ve mikro kabarcık fizikokimyasal özelliklerini koruyan, saflaştırma gerektirmeyen %>95 etiketleme verimliliğine sahip uyumlu bir tek hazneli mikro kabarcık radyoetiketleme yöntemini ana hatlarıyla belirtir. Bu yöntem, çeşitli lipid mikro kabarcık formülasyonlarında etkilidir ve radyoaktif ve/veya floresan mikro kabarcıklar oluşturmak üzere uyarlanabilir.
Özet
Mikro kabarcıklar, vasküler ultrason kontrast maddelerinden devrim niteliğindeki kanser tedavisi platformlarına evrimleşen lipit kabuklu, gazla dolu parçacıklardır. Terapötik odaklı ultrason (FUS) ile birleştirildiğinde, fizyolojik engelleri (örneğin kan-beyin bariyeri) güvenli ve lokal olarak aşabilir, başka türlü erişilemeyen kanserlere (örneğin glioblastoma ve pankreas kanseri) ilaç verebilir ve nörodejeneratif hastalıkları tedavi edebilirler. Mikrokabarcık-FUS'un terapötik cephaneliği, sinerjik kombinasyon radyoterapisi, multimodal görüntüleme ve mikro kabarcık kabuklarından hepsi bir arada ilaç yükleme ve verme dahil olmak üzere yeni yönlerde ilerliyor.
Mikro kabarcıkları radyoizleyicilerle etiketlemek, bu genişletilmiş teranostik yeteneklerin oluşturulmasının anahtarıdır. Bununla birlikte, mevcut mikro kabarcık radyoetiketleme stratejileri, mikro kabarcık fizikokimyasal özelliklerini bozduğu, kısa ömürlü radyoizotoplar kullandığı ve her zaman kararlı şelasyon sağlamadığı bilinen saflaştırma metodolojilerine dayanmaktadır. Toplu olarak, bu, mikro kabarcık radyogörüntülemenin doğruluğunu ve tümör radyoizotop dağıtımının verimliliğini çevreleyen belirsizlik yaratır.
Bu protokol, %>95 radyoizotop şelasyon verimliliği sağlarken mikro kabarcık fizikokimyasal özelliklerini koruyan yeni bir tek hazneli, saflaştırma içermeyen mikro kabarcık etiketleme metodolojisini açıklar. Çok yönlüdür ve farklı asil lipid zincir uzunluğu, şarj ve şelatör / prob (porfirin, DTPA, DiI) bileşimine sahip özel ve ticari mikro kabarcık formülasyonlarında başarıyla uygulanabilir. Öğütülmüş mikro kabarcık üretimi sırasında ve floresan ve multimodal floresan / radyoaktif özelliklerin modüler özelleştirilebilirliği ile önceden yapılmış mikro kabarcık formülasyonlarına uyarlanabilir şekilde uygulanabilir. Buna göre, bu esnek yöntem, mekanik, görüntüleme ve terapötik mikro kabarcık-FUS uygulamalarını ilerletmek için yararlı olan özel, izlenebilir (radyo, floresan veya radyo/floresan aktif) multimodal mikro kabarcıkların üretimini sağlar.
Giriş
Mikro kabarcıklar, bir protein, polimer veya çoğu durumda bir lipid kabuğu ile stabilize edilmiş bir gaz çekirdeğine sahip mikron boyutunda supramoleküler teranostik ajanlardır (Şekil 1A). Kan dolaşımına enjekte edildiğinde, mikro kabarcıklar, gaz çekirdeklerinin 1,2 çözünmesinden önce dakikalar süren zaman dilimleri boyunca ultrason tarafından tespit edilebilen gaz/sıvı arayüzlerini korur. Sonuç olarak, mikro kabarcıkların ilk klinik kullanımı gerçek zamanlı ultrason görüntüleme kontrast maddeleriydi3. Terapötik odaklı ultrasonun (FUS) icadı, mikro kabarcık klinik yardımcı programlarını genişletti. Düşük frekanslı FUS ile uyarıldığında, mikro kabarcıklar salınır ve geçici vasküler geçirgenlikten fokal doku ablasyonunakadar değişen hedeflenmiş, ayarlanabilir mekanik kuvvetler üretir 4,5. Sonuç olarak, son 20 yılda, kan-beyin bariyeri (BBB) açılması, tümör (örneğin, pankreas, beyin ve karaciğer metastatik kanseri) ilaç ve görüntüleme probu dağıtımı, nörodejeneratif hastalık tedavisi ve kanser ablasyonuiçin mikrokabarcık-FUS araştırılmıştır 6,7,8,9,10,11.
Mikro kabarcıkların teranostik cephaneliği yeni ve heyecan verici yönlerde ilerlemeye devam ediyor. Konvansiyonel mikro kabarcık-FUS dağıtım uygulamaları, ticari mikro kabarcıkların yanı sıra terapötik veya görüntüleme kargosunun birlikte uygulanmasına dayanır. Mikro kabarcık kabuğu/biyolojik etkileşimlerini anlayarak, ısmarlama ticari olmayan mikro kabarcık formülasyonlarını keşfederek ve kargonun doğrudan mikro kabarcık kabuğunayüklendiği hepsi bir arada teranostik mikro kabarcıklar üreterek mikro kabarcık-FUS dağıtım yeteneklerini geliştirmeye artan bir ilgi vardır 12,13,14. Aslında, lipid mikro kabarcık ilaç dağıtım çalışmalarının yaklaşık% 40'ı bu tür kabuk yüklü mikro kabarcıkları kullanır15. Görüntüleme ve ilaç dağıtımının ötesinde, mikrokabarcık-FUS ayrıca kanser radyoterapisinin16 arttırılmasında ve sonodinamik tedavi17,18 yoluyla aksi takdirde iyi huylu kabuk yüklü ajanların antineoplastik etkilerinin aktive edilmesinde umut vaat etmiştir.
Mikro kabarcık kanseri uygulamalarındaki bu geleneksel ve genişletilmiş talimatlar, mikro kabarcık kabuklarını radyoaktif izleyicilerle etiketleyerek daha stratejik olarak geliştirilebilir. Hepsi bir arada kargo yüklü mikro kabarcıklar alanında, bu tür radyoetiketleme 1) bu yüklü mikro kabarcık kabuklarının hedef içi ve dışı biyolojik dağılımının altın standart, nicel değerlendirmesini kolaylaştırır, 2) hedefe yönelik teslimatı en üst düzeye çıkarmak için mikro kabarcık bileşimlerinin optimal seçimini bildiren farmakokinetik yapı-aktivite ilişkilerini türetir ve 3) stratejik ve uygun görüntü kılavuzlu uygulama ve tedavi planlamasına rehberlik eder (örneğin, doku hedeflerinin türleri, dozimetri, hedef dışı güvenlik endişelerini azaltmak için ilaç seçimi, geleneksel ortak tedavi paradigmalarına kıyasla fayda) hepsi bir arada kargo yüklü sistemlerin15,19. Klinik öncesi bir aşamada, mikro kabarcık kabuğu kaderinin böyle bir anlayışı, daha geniş mikro kabarcık-FUS etki mekanizmalarını da aydınlatabilir. Örneğin, mikro kabarcık kabuklarından hedef hücrelere lipid transferinin FUS özellikli sonoporasyonu etkilediği gösterilmiştir12,20. Bu tür bir transferin anlaşılması ve optimize edilmesi, sonoporasyonun dahil olduğu preklinik ve klinik mikrokabarcık-FUS tedavilerini (in vitro transfeksiyon, ilaç dağıtımı, tümör ablasyonu, radyasyon duyarlılığı ve sonodinamik tedavi 20,21,22,23,24,25). İkili ultrason ve radyogörüntüleme olanakları, geleneksel çift ajan tasarımları yerine tek bir ajandan FUS damar açma ve tedavi izlemesini (örneğin, BBB açma kinetiği) de mümkün kılacaktır26. Aynı şekilde, lipid mikro kabarcık radyoetiketleme, mikro kabarcık-FUS + radyofarmasötik ortak dağıtım platformlarına hepsi bir arada tek ajanlı mikro kabarcık-FUS / radyoterapi alternatifi olarak hizmet edebilir27.
Mikro kabarcıkların kırılganlığı, bu tür etiketleme için önemsiz bir zorluktur. Mevcut tüm radyoetiketleme stratejileri, mikro kabarcık stabilitesini ve boyutunu bozduğu bilinen saflaştırma metodolojileri ile sınırlıdır, bazıları ise etkisiz ve kararsız radyoetiketlemeözelliğine sahiptir 28,29,30,31,32. Saflaştırma gereksinimleri ayrıca daha uzun protokollere yol açar. Kısa ömürlü radyoizotopların kullanımıyla birleştiğinde (örneğin, 18F t1/2 1.8 h,28,29 99mTc t1/2 6 h,3268Ga t1/2 1 h31), bu, radyoizotop bozunması ile ilgili verimsizlikler yaratır ve radyogörüntüleme ve tedavi planlama zaman dilimlerini sınırlar. Toplu olarak, bu sınırlamalar, kısaltılmış ve temsili olmayan radyogörüntüleme, yanlış farmakokinetik veriler ve verimsiz tümör radyoizotop iletiminin elde edilmesini riske atar.
Bu raporda, porfirinin güçlü ve stabil metal şelasyon yeteneklerinden yararlanılarak bu sınırlamaların üstesinden gelinmektedir. Porfirinler, yüksek oranda konjuge düzlemsel bir halkaya ve çeşitli metalleri barındırabilen merkezi bir koordinasyon bölgesine sahip organik, heterosiklik makromoleküllerdir. Bu, bakır-64 (t1/2 12.7 h), pozitron emisyon tomografisi (PET) olan bir radyofarmasötik ve γ sayma fizibiliteleri33 gibi daha uzun ömürlü radyoizotopları içerir. Bir lipid omurgasına konjuge edildiğinde, porfirinler supramoleküler yapılara kolayca dahil edilebilir ve daha sonra hız, yüksek şelasyon verimliliği ve serum stabilitesi ile bakır-64 ile etiketlenebilirken, ana etiketlenmemiş partiküllerin özelliklerini korurken33,34. Ayrıca, porfirinler, partikül bozulması üzerine eski haline getirilen nano ve mikropartiküllerde modüler kendi kendine söndürme ile floresan olarak aktiftir; hem toplu hem de mikroskobik kabuk kaderi analizini kolaylaştıran PET ve γ sayımına tamamlayıcı bir okuma (Şekil 1A)15.
Bir şelatör olarak porfirin-lipid kullanılarak, bu özellikler, mevcut mikro kabarcık radyoetiketleme yöntemleriyle ilişkili sınırlamaların üstesinden gelen yeni bir tek kaplı, saflaştırma içermeyen mikro kabarcık radyoetiketleme metodolojisi (Şekil 1B, C) oluşturmak için kullanıldı. Bu protokol %>95 bakır-64 şelasyon verimliliğine ulaşır, etiketleme sonrası saflaştırma gerektirmez ve mikro kabarcık fizikokimyasal özelliklerini korur. Aktivasyonlarından önce lipid mikro kabarcıklarının "topraklanmış" imalatına kolayca entegre edilebilir (Şekil 1B). Çok yönlüdür ve farklı asil lipid zincir uzunluğu (C16 ila C22), yük (nötr ve anyonik) ve porfirin-lipid bileşimleri (%1 mol, %10 mol, %30) ile özel ve ticari mikro kabarcık formülasyonlarında başarıyla uygulanabilir ve hem radyo hem de floresan aktiviteye sahip mikro kabarcıklar oluşturur. Uyarlanabilirliği porfirinin ötesine de uzanabilir. Tek kap protokolü, ticari olarak temin edilebilen alternatif şelatörleri (örneğin, dietilentriamin pentaasetat (DTPA)-lipid) ve floroforları (örneğin, DiI) kullanacak şekilde değiştirilebilir. Ayrıca, "spiking" yaklaşımıyla önceden hazırlanmış mikro kabarcık formülasyonlarını etiketlemek için de değiştirilebilir. Buna göre, bu yöntem, mekanik, görüntüleme ve terapötik mikrokabarcık-FUS uygulamalarını ilerletmek için yararlı olan, özelleştirilmiş, izlenebilir (radyo, floresan veya çift radyo/floresan aktif) mikro kabarcıkların üretilmesini sağlar. Aşağıdaki protokol, lipid mikro kabarcıklarının üretimini, tek hazneli radyoetiketleme protokolünün uygulanmasını, gerekli radyoetiketleme ve fizikokimyasal özellik karakterizasyonunu ve potansiyel modifikasyonları özetlemektedir.
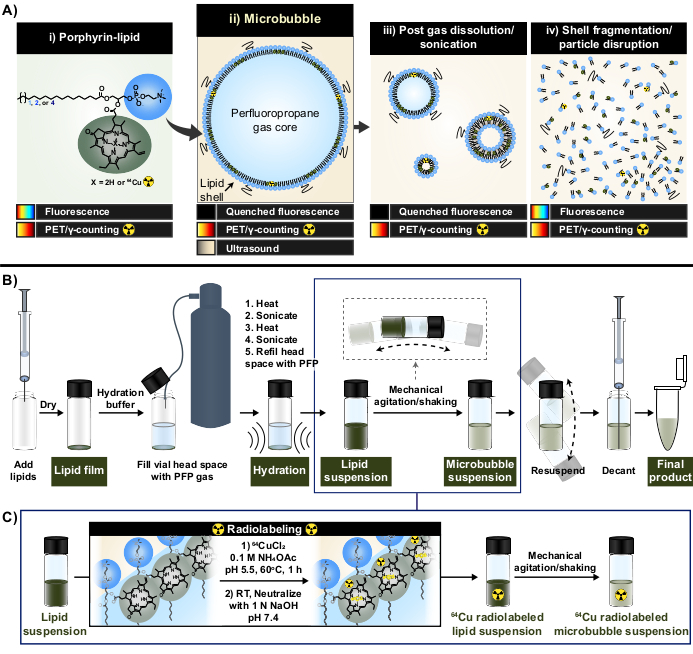
Şekil 1: Mikro kabarcık üretimi ve radyoetiketleme protokolü. (A) Pirofeoforbid-a-lipid formundaki porfirin-lipid, bu protokol içinde multimodal bir şelatör görevi görür. Bakır-64 (i) şelatlı bir monomer olarak, PET ve görüntüleme yeteneklerine sahiptir. Floresansı partikül formunda söndürülür (mikro kabarcıklar (ii) ve çözünme sonrası nanoprogenleri (iii)) ve partikül bozulması (iv) ile söndürülmez. (B) Yerden yukarıya lipid mikro kabarcıkları oluşturmak için bu raporda açıklanan lipit film hidrasyonu/aktivasyon protokolü ve (C) lipid süspansiyon oluşumu ile mikro kabarcık aktivasyonu arasında tek kap radyo etiketlemenin entegrasyonu. Bu rakam Rajora ve ark.15'in izniyle uyarlanmıştır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Protokol
1. Reaktiflerin hazırlanması
- Amonyum asetat tamponu hazırlayın (0.1 M, pH 5.5)
- Analitik bir terazi kullanarak, 770,8 mg amonyum asetat bir tartım kağıdına tartın. Tartılan miktarı 250 mL'lik temiz bir cam kabın içine aktarın.
- Behere dereceli bir pipetle ölçülen 90 mL çift damıtılmış su (ddH2O) ekleyin. Bir karıştırma çubuğu ekleyin ve amonyum asetatı çözmek için beheri manyetik bir karıştırma plakasına yerleştirin. Hafif bir girdap oluşturan, ancak çözelti sıçraması olmayan bir hızda karıştırın.
- pH 4 ve 7 standartlarını kullanarak bir pH metreyi cihaz talimatlarına göre kalibre edin. Kalibre edildikten sonra, pH probunu amonyum asetat tamponuna yerleştirin.
- Çözeltiye 104 μL asetik asit ekleyin, çözünmesi için karıştırın ve pH'ı ölçün.
NOT: Bu noktada pH 5.5'e yakın olmalıdır. - Bir mikropipet kullanarak 5-10 μL'lik artışlarla 10 N sodyum hidroksit (veya tampon çok bazik hale gelirse hidroklorik asit) ekleyerek tamponun pH'ını ayarlayın. Karıştırın, pH'ı ölçün ve gerektiği kadar tekrarlayın. Eklenen baz/asit hacmini not edin.
- Toplam 100 mL tampon oluşturmak için yeterli miktarda ddH2Oekleyin.
NOT: Örneğin, pH ayarlaması sırasında 45 μL 10 N sodyum hidroksit kullanılmışsa, behere 9.851 mL ddH2Oeklenecektir (100 mL [hedef hacim] - 90 mL [adım 1.1.2] - 0.104 mL [adım 1.1.4] - 0.045 mL [adım 1.1.5] = 9.851 mL). - Kapaklı bir saklama kabına aktarmadan önce tamponu son bir kez iyice karıştırın.
- pH metreyi cihaz talimatlarına göre temizleyin.
DİKKAT: Konsantre sulu sodyum hidroksit ve hidroklorik asit cilt reaksiyonlarına neden olabilir ve eldiven kullanılarak kullanılmalıdır.
- Hidrasyon tamponu (PGG) hazırlayın
- Fosfat tamponlu salini (PBS) bir şırıngaya aspire edin ve ucunu bir polietersülfon 0.2 μm gözenek boyutu şırınga filtresi ile donatın. PBS'yi temiz, plastik, kapaklı bir santrifüj tüpüne filtreleyin.
NOT: Alternatif membran malzemelerinin (örneğin, poliviniliden florür) 0,2 μm gözenekli şırınga filtreleri, membran PBS ve amonyum asetat ile uyumlu olduğu sürece kullanılabilir. - Hidrasyon tamponunu (PGG olarak da adlandırılır) yapmak için filtrelenmiş PBS, propilen glikol ve gliserolü mikropipet aracılığıyla 8:1:1 hacimsel oranda birleştirin. Propilen glikol ve gliserol eklerken, reaktifi PBS'ye yavaşça pipetlemeden önce pipet ucunun yüzeyinden kalan propilen glikol veya gliserol damlacıklarını aspire edin ve silin. PBS'de berrak bir sicim benzeri viskoz bulanıklık görülecektir.
NOT: Önce bir santrifüj tüpüne PBS eklemek için bir p1000 mikropipet kullanılması önerilir, ardından propilen glikol ve gliserol kullanılır, çünkü son iki reaktif viskozdur. Bu nedenle, pipet ucunda sıvı hareketi artık görülmeyene ve pipet ucu reaktiften çıkarıldığında hava alınmayacak şekilde mikropipet aracılığıyla yavaşça aspire edilmelidirler. Hacimsel işaretlere sahip mikropipet uçları, bu tür işaretlerle uyumlu reaktif hacimlerini seçmek için ideal olarak kullanılmalıdır (örneğin, 1 mL veya 5 mL PGG yapmak ve sırasıyla propilen glikol ve gliserolün tam aspirasyonunu görselleştirmek için mikropipet ucundaki 0,1 mL veya 0,5 mL işaretini kullanmak). Mikropipet ucunun yüzeyini silerken, uç açıklığından silmeyin, sadece yanlardan silin. - Reaktifler homojen bir şekilde çözülene kadar pipet ucu solüsyon içinde olacak şekilde yukarı ve aşağı pipetleyin. Solüsyonun içine herhangi bir hava kabarcığı girmemesine dikkat edin.
- Hidrasyon tamponunun tam bir karışımını daha da sağlamak için santrifüj tüpünü kapatın ve yavaşça yukarı ve aşağı döndürün. Girdap yapmayın.
- Gözlenemeyen hava kabarcıklarını gidermek için tüpü 20-30 s (minimum sıcaklık 4 °C, maksimum RT) boyunca 1000 x g'dan daha düşük bir sıcaklıkta döndürün.
- Fosfat tamponlu salini (PBS) bir şırıngaya aspire edin ve ucunu bir polietersülfon 0.2 μm gözenek boyutu şırınga filtresi ile donatın. PBS'yi temiz, plastik, kapaklı bir santrifüj tüpüne filtreleyin.
- Hidrasyon/radyoetiketleme tamponu (AA-PGG) hazırlayın
- Şırınga filtresi 0.1 M, pH 5.5 amonyum asetat tamponu (adım 1.1'den itibaren) ve PBS'yi adım 1.2.1'e göre ayrı tüplere koyun.
- Filtrelenmiş amonyum asetat tamponunu, filtrelenmiş PBS'yi, propilen glikolü ve gliserolü bir p1000 mikropipet aracılığıyla 5: 3: 1: 1 amonyum asetat tamponunda bir santrifüj tüpüne birleştirin: PBS: propilen glikol: gliserol hacimsel oranı listelenen sırayla. AA-PGG yapmak için 1.2.2.2.5-1.2.5 adımlarına göre aspirasyon, karıştırma ve santrifüjleme talimatlarını izleyin.
- Anlık ince tabaka kromatografisi (iTLC) eluenti
- 0,1 g'a kadar etilendiamintetraasetik asit (EDTA) tartın ve kapaklı bir şişeye aktarın. ddH2O'da% 2 w / v EDTA çözeltisi yapılacak şekilde çözün (örneğin, 50 mg EDTA için 2.5 mL ddH2O ekleyin).
- %2 w/v EDTA çözeltisini 1.1. adımdaki amonyum asetat tamponu ile 9:1 v/v oranında (%90 EDTA çözeltisi, %10 amonyum asetat tamponu) birleştirin. Elde edilen iTLC eluent'i kapatın ve saklayın.
2. Lipid filmlerin oluşumu
NOT: Bu prosedür, konakçı lipidin yerini alan ve toplam lipidin %30'unu oluşturan porfirin-lipid ile ticari mikro kabarcığı taklit eden bileşimlerle, Definity'ye® sahip bir lipit filminin oluşumunu ana hatlarıyla belirtir. Bununla birlikte, radyo etiketleme protokolü çeşitli lipid formülasyonlarına (C16, C18, C22 zincir uzunlukları, nötr veya anyonik yük, değişen porfirin-lipid molar bileşimleri) uygulanabilir. Açıklanan ve diğer formülasyonlar için hesaplamalar, bileşimler, kütleler ve stok hacimleri sağlayan bir Ek Elektronik Tablo (Ek Dosya 1) eklenmiştir. Sentezi daha önce ayrıntılı olarak tarif edilmiş olan porfirin-lipid, pirofeoforbid-a-lipid (piro-lipid) hariç tüm lipitler ticari olarak temin edilebilir35,36.
- Ek Dosya 1'i kullanarak, gerekli film sayısına bağlı olarak her bir lipit için gereken toplam kütleyi belirleyin.
- Boş bir 0,5 dram cam şişeyi analitik terazide tartın.
NOT: Toz, başarılı mikro kabarcık oluşumunu engeller. Bu nedenle, kapaksız olarak saklanırsa herhangi bir toz/partikülü gidermek için şişeye basınçlı hava üfleyin. - 1,2-dipalmitoil-sn-glisero-3-fosfokolini (DPPC) tartı kağıdına tartın.
NOT: Tartılan kütle, daha sonraki adımlarda numune işleme sırasında herhangi bir kaybı hesaba katmak için adım 2.1'den artı ek bir 0.5-1 mg elde edilmelidir. - DPPC'yi tartılan cam şişeye aktarın ve şişedeki lipit kütlesini belirlemek için yeniden tartın. Bu işlem, cam şişeye daha kolay lipit transferi, lipit tozu kaybının/dökülmesinin azaltılmasına ve lipit kütlesinin daha doğru ölçülmesine olanak tanır.
- 2.2'den 2.4'e kadar olan adımları diğer lipitlerle tekrarlayın: 1,2-dipalmitoil-sn-glisero-3-fosfoetanolamin-N-[metoksi (polietilen glikol)-5000] (DPPE-mPEG), 1,2-dipalmitoil-sn-glisero-3-fosfat (DPPA) ve C16 piro-lipid.
NOT: Piro-lipid tartılabilir bir toz formunda mevcut değilse, bunun yerine bilinmeyen miktarda bir film veya alikot olarak mevcutsa, daha önce açıklandığı gibi Beer-Lambert yasası kullanılarak metanolde UV-Vis absorbans ölçümleri yoluyla konsantrasyonu hesaplanabilen bir stok oluşturmak için kloroform içinde çözülebilir35. - Mikropipetler veya cam şırıngalar kullanarak cam test tüplerinde aşağıdaki organik çözücüleri ve çözeltileri hazırlayın: 1) kloroform, 2) 9:1 v/v kloroform: metanol ve 3) 65:35:8 kloroform: metanol: ddH2O. Son olarak, bileşenleri pipetleyin ve aşağıdaki sırayla karıştırın: ddH2O, metanol, ardından kloroform.
DİKKAT: Metanol ve kloroform sağlığa zararlıdır, yanıcı ve uçucudur. Göz koruması, eldiven ve laboratuvar önlüğü giyin ve çeker ocak kullanın. - Lipid stokları yapmak ve uygun hacimlerde cam şırıngaları seçmek için gereken organik çözücü/çözelti hacmini hesaplamak için Ek Dosya 1'i kullanın.
NOT: Bu hacim, 25-100 μL cam mikrolitre şırıngalar kullanılarak kolayca ölçülebilen, film başına 15-100 μL stok alikot hacimlerine karşılık gelen stok konsantrasyonları vermelidir. - Cam şırıngaları kloroform ile üç kez durulayın. Şırıngayı kurutmak için pistonu ileri geri pompalayın.
- Lipid stokları oluşturmak için temizlenmiş cam şırınga yoluyla organik çözücüyü / çözeltileri ölçün ve adım 2.7'deki elektronik tablo hesaplamalarına göre ayrı lipid şişelerine ekleyin. Piro-lipidi kloroformda çözün (adım 2.5 notuna göre zaten çözünmemişse), DPPC ve DPPE-mPEG'i 9:1 v/v kloroformda çözün: metanol ve DPPA'yı 65:35:8 kloroform:metanol:ddH2O'da çözün. Tüm eklemeler için aynı cam şırıngayı kullanıyorsanız, her bir lipit arasında durulayın ve kurulayın.
NOT: Tercih edilen formülasyon DPPA veya C18 zincir uzunluğu varyantını içermiyorsa, piro-lipid, konak PC lipidi ve PEG lipidinin tümü kloroformda çözülebilir. - Şişeleri ve girdabı kapatın.
- Bir cam mikrolitre şırınga aracılığıyla yeni bir 0.5 dram cam şişeye (film şişesi) hesaplanan hacimlerde stok lipid çözeltileri ekleyin. İlk lipit stoğu için, iğne ucunu şişenin alt ortasına yerleştirin ve şişe duvarlarına sıçramasını önlemek için yavaşça daldırın. Sonraki eklemeler için, iğne ucunu doğrudan sıvı seviyesinin üzerine yerleştirin ve son damlaları iğneyi aşağıdaki sıvıya maruz bırakmayacak şekilde çıkarmak için şişenin yan tarafına dokunun.
NOT: Kontaminasyon meydana geldiğinde lipit ilaveleri arasında cam şırıngayı durulayın ve kurulayın. Birden fazla film yapıyorsanız, solvent buharlaşmasını en aza indirmek için eklemeler arasında hem filmi hem de stok şişelerini kapatın. - İçeriği karıştırmak için şişeyi manuel olarak dik konumda hafifçe döndürün. Flakon duvarlarına herhangi bir çözelti sıçratmaktan kaçının.
- Kapağı açın (kapağı saklayın) ve şişenin üst boşluğuna bir nitrojen hattı yerleştirin. Nitrojen akışını, sıvı yüzeyinde gözle görülür hafif bir rahatsızlığa neden olacak şekilde, ancak herhangi bir huni veya sıçrama olmadan ayarlayın.
- Nitrojen hattını yerleştirdikten hemen sonra şişeyi vorteksleyin. Şişenin dibinden 1 cm'den daha yükseğe çıkmayan çözücü ile bir huni oluşturmaya yetecek kadar düşük bir hızda başlayın. Solvent sıçramasını önleyin. Çözücü buharlaştıkça, girdap hızını yavaşça ve duraklamadan artırın ve tüm sıvı buharlaşana kadar çözücü yüksekliğini koruyun. Sonuç, şişenin alt üçte birlik kısmı boyunca kaplanmış ince bir film olacaktır.
- Şişeyi vakumlu bir kurutucuya yerleştirin ve filmi 8-72 saat vakum altında kurutmaya devam edin. Şişeyi (açıklık hariç) veya kurutucuyu alüminyum folyo ile örtün.
NOT: Protokol buradan duraklatılabilir. Sonraki adımlar, film kuruduktan sonra gerçekleştirilebilir veya filmler argon altında, Parafilm ile kapatılmış, -20 ° C'lik bir dondurucuda 1 aya kadar ve kuru tutulursa daha uzun süre saklanabilir.
3. Lipid film hidrasyonu
NOT: Mikro kabarcıklar in vitro veya in vivo kullanılıyorsa, aksi belirtilmedikçe 3.3 ila 5.4 arasındaki adımlar için steril mikropipet uçları, tüpler, şırıngalar ve iğneler kullanın.
- Filmi vakumdan çıkarın veya dondurucuda saklanıyorsa, RT'ye kadar ısınmasına izin verin.
- 250 mL'lik bir kabı suyla doldurun ve suyu 70-80 °C'ye ısıtın.
- Bir su banyosu sonikatörünü 69 °C'ye ısıtın.
- Kabarcık oluşumunu önlemek için lipid film şişesinin kenarlarından 1 mL AA-PGG (adım 1.3) mikropipetleyin.
NOT: Şelatsız kontrol veya yalnızca floresan mikro kabarcıklar üretirken, AA-PGG yerine PGG (adım 1.2) kullanın. - Flakon açıklığını bir kapakla kısmen kapatın ve bir perfloropropan (PFP) hattı yerleştirmek için yeterli alan bırakın. PFP'yi sıvının üzerinde 20 saniye boyunca flakon üst boşluğuna akıtın, böylece sıvı gözle görülür şekilde bozulur ancak sıçramaz. PFP'yi doğrudan süspansiyona akıtmayın. Şişeyi kapatın.
NOT: Akış güç ve zaman açısından yeterliyse, flakon dokunulduğunda soğumaya başlayacaktır. - Şişenin alt yarısını 1 dakika boyunca 70-80 ° C su banyosuna daldırın. Ardından, 69 ° C banyo sonikatöründe en az 30 saniye boyunca veya lipit filmi AA-PGG'ye homojen bir şekilde dağılana kadar sonikasyon yapın. Kabarcıklar oluşturmaktan veya mikro kabarcık oluşumunu erken aktive etmekten kaçının (erken aktivasyon, lipid süspansiyonunda sütlü / bulanık alanlar olarak görünecektir). Herhangi bir askıya alınmamış lipit kalıp kalmadığını daha iyi ayırt etmek için gerektiğinde flakon yüzeyini silin.
NOT: Lipid film sonikasyondan sonraki 1 dakika içinde hidratlanmazsa, 70-80 °C banyoda yeniden ısıtın ve yeniden sonikasyon yapın. - Lipid film homojen bir şekilde süspanse edildikten sonra, son bir kez 1 dakika ısıtın ve 30 saniye daha sonikat yapın.
- Şişeyi silin ve pasif olarak RT'ye (~ 5-10 dakika) soğumaya bırakın.
- Flakon üst boşluğunu adım 3.5'e göre PFP ile yeniden doldurun, kapatın ve kapak kenarlarını Parafilm ile kapatın.
NOT: Protokol burada duraklatılabilir ve en geç 8 saat sonra devam ettirilebilir.
4. Radyo etiketleme
NOT: Şelatsız kontrol veya yalnızca floresan içeren mikro kabarcıklar için protokol Bölüm 5'e geçin.
DİKKAT: Aksi belirtilmedikçe, bu protokolün 4.4-4.6 adımlarını radyoaktif bir laboratuvarda gerçekleştirin. 64CuCl2 , cilde maruz kalma, soluma veya yutma yoluyla multisistem toksisite riski olan radyolojik bir tehlikedir. Mümkün olduğunda, lastik uçlu forseps kullanarak dolaylı olarak bir çeker ocakta tutun. Kullanırken koruyucu bir laboratuvar önlüğü, kişisel bir yüzük ve rozet dozimetresi ve çift eldiven giyin. 64CuCl2'nin 2 inç kurşun koruma boyunca işlendiğinden emin olun. Gerektiğinde, kurşun kılıflı bir kapta taşıyın. Atık konteynırlarını koruyun ve kullanımdan sonra kontaminasyon için operasyonel bir anket yapın.
- 60 °C'lik bir cam beherde veya manyetik karıştırma çubuğu içeren büyük kristalleştirici bir kapta su banyosu hazırlayın. Suya yerleştirilmiş bir termal prob ile donatılmış, zayıf ancak görünür bir huni oluşturan bir hızda karıştırmaya ayarlanmış, sıcaklık kontrollü bir sıcak/karıştırma plakası kullanın.
- 0.1 N HCl'de 64CuCl2 içeren kapalı bir şişeyi kauçuk uçlu forseps aracılığıyla bir doz kalibratörüne aktarın.
NOT: 64CuCl2 sipariş ederken, 5-20 μL 0.1 N HCl'de çözülmesini isteyin. Mikro kabarcık verimini korumak için daha düşük bir hacim kritik öneme sahiptir. - Doz kalibratöründe ölçülen bakır-64 aktivitesine ve zamana dikkat edin. Forseps kullanarak şişeyi çıkarın ve kurşunlu bir kaba koyun.
- Bir MBq·mL-1 değeri elde etmek için 64CuCl2 için bildirilen hacme not edilen aktiviteyi bölün.
- Lipid süspansiyonunu adım 3.9'dan itibaren açın ve bir şişe tutucusuna sabitleyin.
- 64CuCl2 şişesinin kapağını açın ve forseps ile sabitleyin.
- 40-250 MBq aktiviteye karşılık gelen 64CuCl2 çözeltisinin bir hacmini mikropipetleyin ve lipit süspansiyonuna aktarın. Pipet ucunun süspansiyona daldırıldığından emin olun. 64CuCl2'yi tamamen aktarmak için daldırın ve ardından yukarı ve aşağı pipetleyin.
NOT: Eklenen 64CuCl2 miktarı, radyoaktif işaretli mikro kabarcıklar için amaçlanan uygulamaya ve doz kalibratörünün hassasiyetine bağlı olacaktır. Farelerde uzunlamasına (enjeksiyondan 48 saate kadar) PET ve in vivo kan örneklemesi için sırasıyla en az 220 MBq ve 50 MBq önerilir. - Hem lipid süspansiyonunu hem de 64CuCl2 şişesini kapatın.
- Düz kauçuk uçlu forseps kullanarak, 64CuCl2'yi süspansiyon boyunca nazikçe karıştırmak için radyoaktif lipid süspansiyonunu en az 5 kez manuel olarak yukarı ve aşağı döndürün. Şişeyi sallamaktan veya düşürmekten kaçının ve kabarcık oluşumunu önleyin.
- Sağ taraf yukarı bakacak şekilde, süspansiyonu sabit tutarken şişenin kapağını hafifçe vurun. Bu, kapakta sıkışan herhangi bir sıvının şişenin dibine çekilmesine yardımcı olacaktır. Şişenin kapağını dikkatlice kısmen açın ve 18 G iğneli bir PFP hattı yerleştirin. Flakon üst boşluğunu adım 3.5'e göre 20 saniye boyunca PFP ile doldurun. Şişeyi kapatın ve Parafilm ile kapatın.
- Bir doz kalibratöründe flakon aktivitesini ölçün ve zamanı not edin.
NOT: Şişeye yeterli aktivite aktarılmadıysa, uygun bir ek hacim 64CuCl2 ekleyerek Adım 4.5-4.11'i tekrarlayın. - Şişeyi bir köpük şişe tutucusuna yerleştirin ve şişenin alt yarısı ısıya maruz kalacak şekilde itin. Tutucuyu 60 °C'lik karıştırma su banyosuna yerleştirin ve 1 saat ısıtın.
- Şelasyon reaksiyonu devam ederken, iTLC plakalarını hazırlayın. Taze eldiven giyerken, cam mikrofiber kromatografi kağıdını 1 cm x 8 cm'lik şeritler halinde kesin. Şeritleri 80 °C'lik bir cam kurutma fırınında ısıtın.
NOT: Bu adım, radyoaktif olmayan bir laboratuvarda gerçekleştirilebilir. - 1 saat sonra, adım 4.12'deki şişeyi ocaktan alın ve kenarlarını mendille silin.
- Flakon duvarlarındaki herhangi bir yoğuşmayı lipid süspansiyonuna yeniden yoğunlaştırmak için şişeyi lastik uçlu forseps ile manuel olarak yukarı ve aşağı döndürün.
- Flakon dik konumdayken, tüpü stabilize ederken kapağı hafifçe vurun. Parafilmi çıkarın ve sıkışan banyo suyunu çıkarmak için kapağın etrafını silin.
- Şişenin kapağını dikkatlice açın ve 1-2 μL lipit süspansiyonunu aspire edin. Süspansiyonu bir iTLC şeridinin alt merkezinden 1 cm uzakta bulun ve şişeyi yeniden kapatın. Lekenin kurumasını bekleyin.
NOT: İdeal olarak, reaksiyon karışımı başına en az 2 iTLC tespit edilmeli ve kesinlik için radyoaktif işaretli lipid süspansiyonu başına geliştirilmelidir. - 200 μL iTLC eluentini (adım 1.4'te hazırlanan) 10 mL'lik bir test tüpünün dibine mikropipetleyin. Test tüpünü kurşun bir kaba koyun. Benekli iTLC'yi tüpe ekleyin ve eluent şeridin üst kenarından yaklaşık 1 cm uzakta olana kadar şeridin gelişmesine izin verin.
- Forseps kullanarak geliştirilen iTLC şeritlerini çıkarın. Şeridi dikey olarak tutun ve γ tezgah ve itme kapağı uyumlu yuvarlak bazlı 5 mL plastik tüpler üzerinde, her bir şeridin üçte biri doğrudan ayrı bir üçte birine düşecek şekilde üçe bölün. İtme kapaklarını üç tüpe yerleştirin.
- Bakır-64 aktivitesi için bir γ sayacında şerit içeren tüpleri ve boş/kapaklı bir kontrol tüpünü ölçün ve ilgili dakika başına sayıları (cpm) kaydedin. Arka plan aktivitesini düzeltmek için kontrol tüpü aktivitesini diğer okumalardan çıkarın.
NOT: Şeridin alt üçte birlik kısmı (parça 1) için düzeltilmiş okumalar, lipid süspansiyon partiküllerine şelatlanmış bakır-64 ile ilişkilidir. Orta kısım (parça 2), supramoleküler olmayan formda bir dizi serbest bakır-64 ve 64Cu-piro-lipid şelat içerir. Üst kısım (parça 3) ağırlıklı olarak serbest bakır-64 içerir. - Denklem 1 ile radyokimyasal saflığı hesaplayın.
 (Denklem 1)
(Denklem 1)
NOT: parça 1 için cpm makul olmayan bir şekilde düşük görünüyorsa (örneğin, parça 2 veya 3'e daha düşük veya eşdeğer) veya herhangi bir okuma γ sayacı doğrusal olmayan/doygunluk eşiğinin üzerindeyse, daha düşük bir hacim veya seyreltilmiş bir alikot (1-2 μL) iTLC için radyo etiketli süspansiyonun. - Devam etmek için lipid süspansiyonu başına her iki iTLC şeridinden elde edilen radyokimyasal saflığın ≥ %94 olduğundan emin olun. Değilse, lipid süspansiyonunu 60 ° C'de ısıtmaya devam edin ve şelasyonu iTLC aracılığıyla 30 dakikalık aralıklarla izleyin.
- Radyoaktif işaretli lipid süspansiyon şişesinin kapağını açın ve 8.89 μL 1 N NaOH mikropipetini süspansiyona yerleştirin, tabanı tamamen aktarmak ve süspansiyonu nötralize etmek için yukarı ve aşağı pipetleyin. Şişeyi kapatın, ters çevirmek/geri döndürmek için forseps ile manuel olarak döndürün ve ardından şişe kapağına hafifçe vurun.
- Baş boşluğunu adım 4.10'a göre PFP ile doldurun, kapatın ve Parafilm ile kapatın.
5. Mikro kabarcık aktivasyonu ve izolasyonu
- Sütlü bir mikro kabarcık süspansiyonu oluşturmak için lipid süspansiyonunu 4530 rpm'de 45 saniye boyunca mekanik bir flakon çalkalayıcı ile etkinleştirin. Şişenin yaklaşık 10 dakika boyunca RT'ye pasif olarak soğumasına izin verin. Elde edilen sütlü süspansiyon zamanla iki katmana ayrılacaktır.
NOT: Aktivasyondan sonra flakon içeriği sütlü görünmelidir. Aktivasyon sonrası daha net bir askıya alma, katkıda bulunanları daha sonraki bölümlerde tartışılacak olan başarısız aktivasyonun göstergesidir. - RT'ye geldikten sonra, mikro kabarcık süspansiyonunu yeniden askıya almak için şişeyi nazikçe ters çevirin / geri döndürün. Şişeyi düz bir yüzeye yerleştirin ve istenen mikro kabarcık popülasyonunu elde etmek için boşaltmadan önce 2 dakika bekleyin:
- 1 mL'lik bir plastik şırıngayı 18 G'lik bir iğne ile donatın ve şırıngayı/iğneyi aspire ederek ve havayı içeri/dışarı daldırarak havalandırın. 2 dakika işaretinde, Parafilm contasını tek bir hareketle kırarak şişenin kapağını hızlı bir şekilde açın.
- Şişenin altından (hedef mikro kabarcık popülasyonu) 400-550 μL çekin, daha büyük istenmeyen mikro kabarcık popülasyonlarının üst köpüklü tabakasının aspirasyonunu önleyin.
NOT: Gerekirse, köpüklü / hafif tabakanın aspire edilmesini önlemek için uç hacimleri şırıngada toplamak için şişeyi bir tarafa eğin.
- Köpüklü kirleticileri çıkarmak için iğnenin kenarlarını dikkatlice silin ve izole edilmiş mikro kabarcık süspansiyonunu bir mikrosantrifüj tüpüne aktarın. Yavaşça kapatın (kapağı aniden açıp kapatmayın). Bu, radyoaktif işaretli mikro kabarcıkların son çalışma süspansiyonudur.
- Doz kalibratöründe nihai mikro kabarcık ürününün aktivitesini ölçün ve süreyi not edin. İlgilenilen uygulamaya bağlı olarak enjeksiyon hacimlerini hesaplamak için bir MBq·mL-1 değeri elde etmek için bu değeri adım 5.2'de boşaltılan süspansiyon hacmine bölün.
NOT: Radyo etiketli mikro kabarcıklar artık kullanıma hazırdır. Bölüm 6, 24 saat sonrasına kadar yürütülebilir. Bu radyoaktif işaretli mikro kabarcıkların multimodal (ultrason, PET, floresan) görüntüleme yoluyla in vivo olarak nasıl enjekte edilebileceği ve izlenebileceği hakkında bilgi için Rajora ve ark.15'e bakın.
6. Radyo etiketleme verimliliğinin doğrulanması
- Mikro kabarcık süspansiyonunu hafif pipetleme veya flakon ters çevirme yoluyla yeniden askıya alın.
NOT: Mikro kabarcıklı çalışan bir ürünü asla girdaplamayın. Girdap, mikro kabarcık süspansiyonlarını dengesizleştirir. - 0.5 mL 30.000 moleküler ağırlık kesme (MWCO) santrifüj filtre ünitesine 10-200 μL radyo işaretli süspansiyon ekleyin. <200 μL'lik hacimler kullanılıyorsa, toplam 2 μL'lik bir hacim oluşturmak için filtre ünitesineddH200 O ekleyin. Filtre ünitesini uyumlu bir mikrosantrifüj tüpüne ve kapağına yerleştirin.
NOT: Protokolün başarılı bir şekilde tamamlanmasını sağlamak için uygulanan herhangi bir in vitro veya in vivo radyoaktif işaretli mikro kabarcıkların kullanımından önce ve ayrı olarak bir radyoetiketleme testinin yapılması önerilir. Bu durumda, bu adımda daha büyük bir hacim (örneğin, 200 μL) kullanılabilir. Protokol daha sonra bir tedavi seansı için kullanıldığında, önce tedavi hacimlerini/enjeksiyonlarını hazırlayın ve ardından kalan radyoaktif işaretli mikro kabarcık süspansiyonu ile mümkün olduğunca erken bölüm 6'yı gerçekleştirin. - RT'de 12.000 x g'da 10 dakika santrifüjleyin.
NOT: mikrosantrifüj kurşun koruma ile çevrelenmelidir. - Mikrosantrifüj tüpü ile kapağı arasındaki bağlantıyı makasla kesin.
- Kapağı "kapaklar" etiketli 20 mL'lik bir parıldama şişesine yerleştirin. Filtre ünitesini yeni bir mikrosantrifüj tüpüne (tüp 2) aktarın.
- İlk mikrosantrifüj tüpünü infranatant ile "tüp 1" etiketli 20 mL'lik bir sintilasyon şişesine yerleştirin. Tüp2'dekifiltre ünitesine 200 μL ddH 2 O ekleyin.
- Filtre ünitesini tüp 2'de RT'de 12.000 x g'de santrifüjleyin.
- 6.4 ve 6.5 adımlarını tekrarlayın. Tüp 2 kapağını, tüp 1 kapağını barındıran "kapaklar" parıldama şişesine ekleyin. Tüp 2'yi 20 mL'lik yeni bir sintilasyon şişesine yerleştirin.
- Üçüncü mikrosantrifüj tüpünün kapağını kesin ve adım 6.4'e göre "kapaklar" şişesine yerleştirin. Filtre ünitesini "ünite" etiketli yeni bir 20 mL'lik sintilasyon şişesine aktarın, böylece infranatantın tüp 3'te kaldığından ve "ünite" şişesine aktarılmadığından emin olun. Filtre ünitesinin kenarlarında damlalar görülürse, boru 3'e geri koyun, kaplayın ve 10 saniye aşağı döndürün. Tüp 3'ü 20 mL'lik yeni bir cam sintilasyon şişesine yerleştirin.
- 5 sintilasyon şişesini kapatın (tüp 1, tüp 2, tüp 3, kapaklar ve ünite). Boş bir kontrol olarak boş ve kapaklı 20 mL sintilasyon şişesi hazırlayın.
- Bakır-64 aktivitesi için altı parıldama şişesini γ bir sayaç üzerinde ölçün. Boş flakon aktivitesini diğer flakonlarınkinden çıkarın. Denklem 2'yi kullanarak radyoetiketleme/şelasyon verimliliğini hesaplayın.
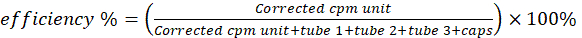 (Denklem 2)
(Denklem 2)
NOT: Birim cpm makul olmayan bir şekilde düşükse (örn, daha düşük veya tüplere eşdeğer) veya herhangi bir okuma γ sayacı doğrusal olmayan/doygunluk eşiğinin üzerindeyse, değerler eşiğin altına düşene kadar aktivitenin bozulmasına izin vermek için sintilasyon şişelerini kurşun kaplarda 4 güne kadar saklayın ve yeniden ölçün.
7. Mikro kabarcık fizikokimyasal karakterizasyonu
NOT: Bir laboratuvar radyoaktif numune işleme için belirlenmiş ekipmana sahip olmadıkça, mikrokabarcık fizikokimyasal karakterizasyonu, radyoaktif olmayan, "soğuk" bakır şelatlı numuneler kullanılarak yapılmalıdır. Bu "soğuk" etiketleme, kişinin amaçlanan uygulaması için kullanılan mikro kabarcıkların dozunu değerlendirmek için hayati önem taşıyan mikro kabarcık veriminin değerlendirilmesini kolaylaştırır. Ek olarak, radyoetiketleme işleminin mikro kabarcıkların özelliklerini bozmamasını sağlamak için kontrol şelatsız mikro kabarcıklarla karşılaştırmaya izin verir. Bu "soğuk" etiketleme ve ilgili fizikokimyasal karakterizasyon, radyoaktif işaretli mikro kabarcık uygulamasından önce yapılmalıdır ve radyoetiketlemede değişiklik yapılması gerekiyorsa geri bildirim olarak kullanılabilir (bkz.
- "Soğuk" bakır mikro kabarcık etiketleme
- Adım 4.7'de lipid süspansiyonuna eklenen 64CuCl2 çözeltisinin hacmini, lipid filmleri içindeki porfirin molar% bileşimini ve 64CuCl2 ürün sayfasında bulunan spesifik aktiviteyi kullanarak, radyoetiketleme sırasında elde edilen yaklaşık metal: porfirin molar oranını hesaplayın. Örnek hesaplamalar Ek Dosya 1'de bulunabilir.
- Mevcut protokolün 1-3 bölümlerini takip edin.
- 0.1 N HCl'de 0.1 mg·mL-1 CuCl2 çözeltisi hazırlayın.
- Bu CuCl2 çözeltisinin uygun hacmini, adım 7.1.1'den hesaplanan lipit süspansiyonuna mikropipetleyin ve şişeyi kapatın.
- CuCl2'yi lipid süspansiyonuna karıştırmak için şişeyi döndürün, üst boşluğu PFP ile doldurun, kapatın ve 4.9, 4.10 ve 4.12 adımlarına göre ısıtın. Flakon kullanımı için kauçuk forseps gerekli değildir.
- 1 saat sonra, şişeyi ocaktan alın ve kuruması için dışını silin. Şişenin RT'ye soğumasına izin verin.
- Lipid süspansiyonunu nötralize edin, karıştırın, üst boşluğu PFP ile doldurun ve adım 4.23 ve 4.24'e göre kapatın.
- Adım 5.1-5.3'e göre çalışan bir ürün elde etmek için mikro kabarcık süspansiyonunu ve boşaltıcıyı etkinleştirin.
- Mikro kabarcık boyutlandırma
NOT: Mikro kabarcık boyutlandırma, aktivasyondan hemen sonra yapılmalıdır. Çalışma süspansiyonunun stabilitesini değerlendiriyorsanız, numune hazırlamayı ve ölçümleri 30 dakikalık aralıklarla tekrarlayın. Tipik olarak, 1-2 saatlik bir pencere, mikro kabarcık çalışma süspansiyonunun aktivasyon sonrası kullanılacağı/uygulanacağı zaman dilimini temsil eder. Stabilite ölçümlerinin amacı, mikro kabarcık boyutunun ve veriminin bu zaman dilimi boyunca korunmasını sağlamaktır, böylece çalışma çözeltisinden uygulanan tüm tedaviler benzer mikro kabarcık popülasyonları içerir.- Coulter Sayacını (CC) açın ve SOP Düzenle aracını kullanarak aşağıdaki parametreleri ayarlayın: 30 μm açıklık, 0,6-18 μm boyut aralığı, açıklık akımı 400-600 μA, preamp kazancı 4-8, 400 bölme, her çalıştırmadan önce ve sonra yıkama, hacimsel analiz, 5 μL örnek hacmi.
- CC elektrolitini 0,2 μm'lik bir ortam vakum filtreleme ünitesinden süzün. Elektrolit kabını ve numune hazırlama için ayrı bir kabı doldurun.
- Arka plan ölçümü: 10 mL'lik tek kullanımlık bir küveti 10 mL filtrelenmiş elektrolitle doldurun ve bir temel ölçüm yapın. Sayımların 400'ün altında olduğundan emin olun. Değilse, cihazı yıkayın.
- Numune ölçümü
- Yeni bir küvete 10 mL filtrelenmiş elektrolit ekleyin. Manuel olarak ters çevirerek/geri alarak mikro kabarcık süspansiyonunu yeniden askıya alın. Şişenin alt ortasından 5 μL mikropipetleyin. Pipet ucunun kenarlarını (açıklık hariç) silin ve numuneyi doğrudan hazırlanan elektrolite daldırın.
- Süspansiyonu tamamen aktarmak için yukarı ve aşağı pipetleyin. Mikro kabarcık süspansiyonunun "tutamları" dağılana kadar elektroliti hafifçe döndürmek için pipet ucunu kullanın.
- Numuneyi CC üzerinde ölçün (analit başına iki çalışma).
NOT: 5 μL'lik bir mikro kabarcık numune hacmi tipik olarak 1-5 x 109 mikro kabarcık·mL-1 konsantrasyonları içeren numuneler için uygundur. Bu numune hacminin, belirli CC cihaz kurulumuna bağlı olarak ve numune mikro kabarcık verimlerinin yukarıdaki aralığın dışında kalıp kalmadığına bağlı olarak ayarlanması gerekebilir.
- Konfokal görüntüleme
NOT: Mikro kabarcık boyutlandırmasından hemen sonra ve adım 7.2'deki nota göre korunan mikro kabarcık stabilitesinin zaman çerçevesi içinde konfokal görüntüleme yapın.- Mikro kabarcık süspansiyonunu yeniden askıya alın ve 1-5 μL'yi bir cam mikroskop lamının merkezine aktarın. Hava kabarcıklarının sıkışmasını önlemek için mikro kabarcık süspansiyon damlacığının üzerine dikkatlice bir örtü kayışı yerleştirin. Süspansiyon, kapak kaymasının altına yayılacaktır.
- Mikro kabarcıkları yağa daldırma objektifi ile 60x büyütmede görüntüleyin. Parlak alanda ve 633 nm uyarma/640-765 nm emisyon altında görüntüler elde edin. Parlak alan ve floresan görüntülerin üst üste bindirilmesi.
NOT: Floresan sinyali, prob homojen bir şekilde mikro kabarcık kabuğuna dahil edildiğinde tüm görünür parçacıkların kabuğu boyunca üst üste gelmelidir.
- Spektroflorometri
NOT: Spektroflorometri ölçümleri, mikro kabarcık aktivasyonundan sonraki 24 saat içinde gerçekleştirilebilir.- Daha önce tarif edildiği gibi% 1 Triton X-100 hazırlayın35.
- İlk ölçümden 15-30 dakika önce spektroflorometreyi açın.
- Bir kuvars küvette 1 nm uyarma ve 100-410 nm emisyon aralığı kullanarak %600 Triton X-800'ün floresan spektrumlarını ölçün. Sinyali referans dedektör sinyaliyle normalleştirme seçeneğini seçin (genellikle S1/R1 olarak anılır).
NOT: Triton X-100 pipetlendiğinde kolayca köpürür. Bu nedenle, bir küvete aktarırken, yalnızca ilk mikropipet durdurucusuna daldırın. - Küveti metanol ile durulayın ve numuneler arasında basınçlı hava ile kurulayın.
- 6 mL %1 Triton X-100'ü 15 mL'lik bir santrifüj tüpüne aktarın. Mikro kabarcık süspansiyonunu yeniden askıya alın ve mikropipet ile 1 μL aspire edin. Pipet ucunun açıklık dışındaki kenarlarını silin ve numuneyi hazırlanan %1 Triton X-100'e aktarın, aktarımı tamamlamak için yukarı ve aşağı pipetleyin. Çözeltiyi girdaplayın ve bir kuvars küvete aktarın.
NOT: Numune oranını ayarlayın:% 1 Triton X-100, cihaz hassasiyetine ve doğrusal olmayan doygunluk eşiğine göre. - Bu numuneyi adım 7.4.3'teki parametreleri kullanarak ölçün. Bu ölçüm, "bozulmuş" parçacıklara karşılık gelir.
- PBS kullanarak 7.4.3-7.4.6 adımlarını tekrarlayın. Bu ölçüm "sağlam" parçacıklara karşılık gelir.
- Sırasıyla% 1 Triton X-100 ve PBS ölçümlerini kullanarak bozulmuş ve sağlam numune spektrumlarını temel olarak düzeltin.
- PBS (F PBS) ve %3 Triton X-1 (FTx) cinsinden bozulmamış numunenin entegre taban çizgisi düzeltmeli floresan sinyalini kullanarak Denklem 100 aracılığıyla su verme verimliliğini (QE) hesaplayın:
 (Denklem 3)
(Denklem 3)
- UV-Vis spektroskopisi
NOT: Spektroskopi ölçümleri, mikro kabarcık aktivasyonundan sonra 72 saate kadar gerçekleştirilebilir.- Süspansiyon şeffaf olana kadar RT'de bir banyo sonikatörü kullanarak bir mikrosantrifüj tüpünde mikro kabarcık süspansiyonunun bir alikotunu sonikleştirin. Bu, spektroskopi sırasında saçılma etkilerini azaltır.
- İlk ölçümden 10 dakika önce spektrofotometreyi açın. 0,25 nm'lik bir tarama aralığı ve 200-800 nm'lik bir alım aralığı seçin. Satır taban çizgisi çıkarmayı etkinleştirin.
- Ölçümler için 1 cm yol uzunluğunda bir kuvars küvet kullanın. Küveti ölçümler arasında metanol ile durulayın ve basınçlı hava ile kurulayın.
- Metanolün temel bir ölçümünü elde edin.
- Sonikasyonlu, şeffaf mikro kabarcık süspansiyonunu girdap haline getirin ve 10-50 μL'yi 200-1000 μL metanol içeren bir mikrosantrifüj tüpüne aktarın. Metanol hacminin ölçüldüğünden ve temiz bir cam mikrolitre şırınga ile tüpe eklendiğinden emin olun. "Bozulmuş" bir numune elde etmek için çözeltiyi girdaplayın.
NOT: Numune seyreltmesi, porfirin yükleme verimliliğine ve molar% bileşime bağlı olacaktır. 30 mol'lük bir piro-lipid mikro kabarcık bileşimi için 20x'lik bir seyreltme uygundur. - UV-Vis spektrumunu toplayın.
- Metanol yerine PBS kullanarak 7.5.4 ile 7.5.6 arasındaki adımları tekrarlayın.
NOT: PBS hacimlerini ölçmek için cam mikrolitre şırınga yerine bir mikropipet kullanılabilir.
8. Protokolde yapılan değişiklikler
- Alternatif şelatör
- Piro-lipidi alternatif bir lipid konjuge bakır şelatör ile değiştirerek bölüm 2'ye göre lipit filmleri hazırlayın (örneğin, 1,2-dipalmitoil-sn-glisero-3-fosfoetanolamin-N-dietilentriamiminpentaasetik asit (amonyum tuzu), bundan böyle DTPA-lipid olarak anılacaktır). Gerekli kütle ve stok hacimlerini hesaplamak için Ek Dosya 1'i kullanın.
NOT: Alternatif bir şelatörün çeşitli molar bileşimlerinin test edilmesi, yüksek verime sahip kararlı mikro kabarcıkların üretilemeyeceği üst sınırı belirlemek için muhtemelen gereklidir. - Radyoaktif işaretli mikro kabarcıklar oluşturmak ve karakterize etmek için 3'ten 6'ya kadar olan bölümleri izleyin.
- "Soğuk" bakır şelatlı mikro kabarcıkları karakterize etmek için 7.1'den 7.3'e kadar olan adımları izleyin. Parçacık morfolojisini değerlendirmek için yalnızca parlak alan konfokal mikroskopi görüntü alımı gereklidir. Alternatif şelatör floresan ise, adım 7.4 ve 7.5'e ek olarak ilişkili uyarma ve emisyon dalga boyları ile konfokal mikroskopi yapın.
- Piro-lipidi alternatif bir lipid konjuge bakır şelatör ile değiştirerek bölüm 2'ye göre lipit filmleri hazırlayın (örneğin, 1,2-dipalmitoil-sn-glisero-3-fosfoetanolamin-N-dietilentriamiminpentaasetik asit (amonyum tuzu), bundan böyle DTPA-lipid olarak anılacaktır). Gerekli kütle ve stok hacimlerini hesaplamak için Ek Dosya 1'i kullanın.
- Alternatif florofor
- Piro-lipidi alternatif bir lipid konjuge veya ara oluşturan florofor (örn., DiI) ile değiştirerek bölüm 2'ye göre lipit filmler hazırlayın. Gerekli kütle ve stok hacimlerini hesaplamak için Ek Dosya 1'i kullanın.
NOT: Alternatif bir floroforun çeşitli molar bileşimlerinin test edilmesi, yüksek verime sahip kararlı mikro kabarcıkların üretilemeyeceği üst sınırı belirlemek için muhtemelen gereklidir. - AA-PGG yerine PGG kullanarak bölüm 3'ü takip edin.
- 5.1 ile 5.3 arasındaki adımları ve 7.2 ile 7.5 arasındaki adımları tamamlayın.
- Piro-lipidi alternatif bir lipid konjuge veya ara oluşturan florofor (örn., DiI) ile değiştirerek bölüm 2'ye göre lipit filmler hazırlayın. Gerekli kütle ve stok hacimlerini hesaplamak için Ek Dosya 1'i kullanın.
- "Spiking" yaklaşımı: Önceden oluşturulmuş mikro kabarcıklı lipid süspansiyonlarının etiketlenmesi
- Başka hiçbir lipid bileşeni içermeyen sadece piro-lipid kullanarak, bölüm 2'ye göre bir porfirin-lipid filmi oluşturun. Piro-lipid miktarları için Ek Dosya 1'e bakın.
- 1 mL hidrasyon tamponu yerine 100-200 μL AA-PGG (veya radyoetiketleme gerekmiyorsa PGG) kullanarak piro-lipid filmi bölüm 3'e göre hidratlayın.
- Tüm piro-lipid süspansiyonunu önceden hazırlanmış bir lipid mikro kabarcık süspansiyonuna aktarın.
- Baş boşluğunu PFP ile doldurun, ısıtın ve süspansiyonu sonikleştirin ve 3.4 ila 3.9 arasındaki adımlara göre PFP altında kapatın. Piro-lipid süspansiyonunun önceden yapılmış lipid mikro kabarcık süspansiyonuna dağılmasını izleyin ve tamamen dağılana kadar ısı / sonikasyon döngüleri gerçekleştirin.
NOT: Septum sızdırmaz bir ticari mikro kabarcık şişesi kullanılıyorsa, piro-lipid süspansiyonu, şişe üst boşluğunu PFP ile yeniden doldurmadan bir şırınga / iğne yoluyla şişeye verilebilir. - Radyoetiketleme (aşağıdaki adım 8.3.5.1'e bakın), aktivasyon, izolasyon (aşağıdaki NOT'a bakın) ve bölüm 4 ila 7'ye göre ilgili karakterizasyonu gerçekleştirin.
- Alternatif bir yaklaşım, önce hidratlı piro-lipid süspansiyonunu radyo-etiketlemek, %>94 radyokimyasal saflığı izlemek, 1 N NaOH ile nötralize etmek (hacmi piro-lipid filmi hidratlamak için kullanılan AA-PGG hacmine göre değiştirmek) ve ardından radyoaktif işaretli piro-lipid süspansiyonunu, adım 8.3.3'e göre önceden hazırlanmış mikro kabarcık lipid süspansiyonuna sokmaktır.
NOT: Bu değiştirilmiş yaklaşım, lipid hidrasyonu sırasında oluşan ancak mikro kabarcıklara dahil edilmeyen mikron altı çok katmanlı vezikülleri ortadan kaldıran bir izolasyon işlemi izlerse, yalnızca floresan veya çok modlu radyoaktif işaretli mikro kabarcıklar oluşturmak için kullanılmalıdır. Daha fazla ayrıntı için Tartışma'ya bakın.
- Alternatif bir yaklaşım, önce hidratlı piro-lipid süspansiyonunu radyo-etiketlemek, %>94 radyokimyasal saflığı izlemek, 1 N NaOH ile nötralize etmek (hacmi piro-lipid filmi hidratlamak için kullanılan AA-PGG hacmine göre değiştirmek) ve ardından radyoaktif işaretli piro-lipid süspansiyonunu, adım 8.3.3'e göre önceden hazırlanmış mikro kabarcık lipid süspansiyonuna sokmaktır.
Sonuçlar
Radyoaktif işaretli mikro kabarcıklar üretilirken ölçülebilir temel sonuçlar, radyokimyasal saflık ve radyo-etiketleme verimliliğidir. Bu protokol, her birini karakterize etmek için sırasıyla iTLC ve doğrulanmış bir santrifüj prosedürü kullanır. Şekil 2A , konakçı lipidin toplam lipidin %1, %10 mol veya %30'lük bileşimlerde piro-lipid ile ikame edildiği ticari mikro kabarcık taklit formülasyonlarında ortalama %≥95'lik radyokimyasal saflıkların ve verimliliklerin elde edildiğini göstermektedir. %1 mol ve %10 piro-lipid formülasyonları, bu değerlere ulaşmak için daha konsantre bir lipid süspansiyonu (0.15 mL'ye karşı 1 mL) gerektiriyordu. Mevcut protokolde elde edilen yüksek radyokimyasal saflıklar ve şelasyon verimlilikleri, etiketleme sonrası saflaştırma ihtiyacını ortadan kaldırmıştır.
Bu aynı zamanda, genel nötr veya anyonik yüzey yüküne sahip C16, C18 ve C22 zincir uzunluğundaki lipitlerden oluşan alternatif formülasyonlar için de geçerliydi (Şekil 2B). Bu varyantlar, ortalama mikro kabarcık boyutunu, kabul edilebilir mikro kabarcık verimlerini (>1 x 109 mikro kabarcık · mL-1) korumak ve piro-lipidi ve aktive edilebilir floresan ve metal şelasyon yeteneklerini en üst düzeye çıkarırken >8 μm mikro kabarcık popülasyon oluşumunu sınırlamak için daha önce belirlenen bir üst sınıra dayalı olarak %30'luk bir piro-lipid bileşimi ile yüklendi15. Bu amaçla, %30'luk formülasyonlar en yüksek (%99'a varan yüksek) radyokimyasal saflıkları ve şelasyon verimliliklerini göstermiştir. Şekil 2'de incelenen tüm formülasyonların temel lipid bileşimleri, en baskın olarak klinik olarak araştırılan ticari mikro kabarcık formülasyonuna dayanırken, zincir uzunlukları ve yük varyantları, klinik öncesi en yaygın olarak araştırılan bileşimleri temsil eder15. Bu, sunulan radyoetiketleme protokolünün, terapötik ultrason alanına ilgi duyan çoğu mikro kabarcık bileşimine uygulanabileceğine dair güven verir.
Kantitatif mikro kabarcık fizikokimyasal karakterizasyonu tipik olarak radyoaktif mikro kabarcıklar için mümkün değildir. Radyoaktivite bozulduğunda (kullanılan izotopa ve aktivite miktarına bağlı olarak günler ve hatta haftalar boyunca), mikro kabarcık gaz çekirdekleri büyük ölçüde çözünmüş olacak ve mikro kabarcık parçaları üretecektir. Bu nedenle, partikül süspansiyonu, ilk olarak aktive edilen veya uygulanan teranostik olarak aktif türleri doğru bir şekilde yakalayamayacaktır. Bu nedenle, radyoaktif mikro kabarcık hazırlığı sırasında görsel gözlem ve eşleştirilmiş bir "soğuk" şelasyon analog protokolü hayati önem taşır. Özellikle, lipid film hidrasyonu ve aktivasyon adımlarında önemli görsel gözlemlere ihtiyaç vardır (Şekil 3). Başarılı, tam bir hidrasyonda, lipit filmler flakon duvarlarından tamamen ayrılacak ve hidrasyon tamponunda homojen bir şekilde dağılan veziküller halinde kendi kendine birleşecektir. Sonuç şeffaf bir çözümdür (Şekil 3A). Eksik hidrasyonlar, süspansiyondaki flakon duvarına veya agregaya yapışmaya devam eden bir lipit filme sahip olacaktır (Şekil 3B). Birincisi kolayca fark edilemeyebilir ve bu nedenle sonikasyon sırasında flakonun yüzeyinden herhangi bir suyun silinmesi ve dikkatli bir inceleme yapılması önerilir. Hidrasyon sırasında mikro kabarcıkların erken aktivasyonundan kaçınılmalıdır ve süspansiyon yüzeyinde kalıcı kabarcıkların oluşması ve süspansiyon içinde sütlü/bulanık fısıltılar olarak kolayca gözlemlenebilir (Şekil 3C). Bu uygun olmayan aktivasyon, mikro kabarcık verimini ve boyut dağılımı tekrarlanabilirliğini azaltabilir. Konakçı lipid bileşeninin geçiş sıcaklığının üzerinde bir banyo suyu sıcaklığı kullanılarak, banyo sonikatörünü, görünür sonikasyon / sıvı rahatsızlığını kolaylaştıran uygun su seviyesine doldurarak, ancak hidrasyon tamponundan veya banyo suyundan "atlamadan" ve flakon sallamasından veya ani çalkalamadan dikkatli bir şekilde kaçınarak önlenebilir. Mikro kabarcık süspansiyonu, kontrollü, yüksek hızlı mekanik çalkalama yoluyla kasıtlı olarak etkinleştirildiğinde, uygun olmayan şekilde büyük parçacıklar içeren daha hafif/daha beyaz ve daha köpüklü bir üst katmana (örneğin >8 μm çap) ve ilgilenilen mikro kabarcıklar içeren hedef alt katmana ayrılan sütlü, opak bir süspansiyon oluşacaktır (Şekil 3D), şırınga / iğne aspirasyonu ile izole edilir. Hedef mikro kabarcık popülasyonlarının daha düşük verimine neden olan suboptimal aktivasyon, hidratlı bir lipid süspansiyonunun bulanık bir versiyonu gibi görünen daha az sütlü/opak ve genellikle yarı saydam bir alt tabaka verir (Şekil 3E).
Objektif radyoaktif işaretli mikro kabarcık fizikokimyasal karakterizasyonu, benzer "soğuk" bakır şelatlı mikro kabarcıklar kullanılarak gerçekleştirilir. Bu karakterizasyon için temel uç noktalar şunları içerir: 1) mikro kabarcık ortalama boyutunun ve veriminin ölçülmesi, 2) mikro kabarcık depolama/çalışma zaman çerçevesi stabilitesinin değerlendirilmesi, 3) mikro kabarcık kabuğu boyunca başarılı piro-lipid yüklemesinin doğrulanması ve 4) bu fizikokimyasal özelliklerin mikro kabarcık üretim prosedürüne entegre edilen radyoetiketleme işlemi ile değişmemesini sağlamak. Şekil 4 ve Şekil 5 , toplam lipidin %30'u kadar bir piro-lipid bileşimine sahip bakır şelatlı bir C16 anyonik mikro kabarcık formülasyonu için bu tür bir karakterizasyonu göstermektedir. Karakterizasyon, kontrol, şelatsız mikro kabarcıkların aksine sunulur.
Şekil 4, şelatlı ve şelatsız mikro kabarcıklar için temsili boyutlandırma verilerini göstermektedir. Sayı dağılımları (Şekil 4A), küçük kabarcıkların daha büyük bir varlığını ve boyutla birlikte mikro kabarcık sayısında monotonik bir bozulma olduğunu göstermektedir. Mikro kabarcık hacim dağılımları (Şekil 4B), ortalama 6 μm'lik bir boyuta karşılık gelen tek modlu zirveler sergiler. Daha büyük mikro kabarcıklar daha büyük gaz hacimleri içerdiğinden, hacim dağılımlarının daha yüksek mikro kabarcık ortalama boyutlarına doğru eğilmesi beklenir. Sayı ağırlıklı ortalama ile ortalaması alındığında, 1.5-2 μm'lik boyutlar ve 3 x 109 mikro kabarcık ·mL-1 mikro kabarcık verimleri elde edilir (Şekil 4C, D), bunlar mikro kabarcık aktivasyonu ve izolasyonundan 1 saat sonra sabit kalır. Bu sonuçlar, daha fazla santrifüj boyutu izolasyonu olmaksızın bir lipid hidrasyon protokolü yoluyla üretilen stabil lipid mikro kabarcıkları için tipiktir. Daha da önemlisi, mikro kabarcıkların boyut dağılımları, ortalama boyutları, konsantrasyonları ve stabilitesi, şelasyon koşullarının mikro kabarcık topraklanmış imalat içine entegrasyonu ile değişmez. Bu değerler, bakır şelasyonu ile fizikokimyasal özelliklerin korunmasını da gösteren diğer mikro kabarcık formülasyonlarının değerleriyle birlikte Tablo 1'de özetlenmiştir.
Mikro kabarcıkların morfolojik ve optik özellikleri (Şekil 5) de "soğuk" bakır şelasyonu ile korunur. Porfirin floresansı, şelatlı ve şelatsız mikro kabarcıkların kabuklarını homojen bir şekilde ana hatlarıyla çizerek gözlemlenebilir, bu da mikro kabarcık kabukları içinde başarılı bir piro-lipid şelatör katılımını gösterir (Şekil 5A). Başarılı yükleme, UV-Vis spektroskopisi ve spektroflorometri ile de ayırt edilebilir. Bozulmuş mikro kabarcıklar monomerik lipid türlerine ayrılır. Bu nedenle, bozulmuş mikro kabarcıkların UV-Vis spektrumları (Şekil 5B), serbest piro-lipidinkiyle eşleşir. İki belirgin tepe içerir: mavi bölgede bir Soret bandı ve kırmızı bölgede bir Q bandı. Konsantrasyonu normalleştirmek ve mikro kabarcıklar arasında daha objektif karşılaştırmayı kolaylaştırmak için, absorbans spektrumları dalga boyları arasında molar emisyon olarak sunulur. Bozulmuş mikro kabarcıkların ham UV-Vis absorbans spektrumları, Beer-Lambert yasasını uygulayarak mikro kabarcık süspansiyonlarında piro-lipid kapsüllemesini ve konsantrasyonunu ölçmek için kullanılabilir (1 cm'lik yol uzunluğu, 97.000 M-1·cm-1 veya 45.000 M-1·cm-1, sırasıyla 410 nm ve 667 nm'de). Şekil 5'te karakterize edilen mikro kabarcıklar, %85-90 piro-lipid kapsülleme verimliliği ve ~ 0.17 mM'lik porfirin konsantrasyonları sergiler. Hem mikro kabarcık hem de porfirin konsantrasyonlarının karakterize edilmesi, uygulanan mikro kabarcık ve porfirin dozlarının tahmin edilmesini sağlar. Yüksek kapsülleme verimliliği, mikro kabarcıklarda etkili piro-lipid yüklemesi gösterir. Bu, Qy bandının 674 nm ve 702 nm'ye imza niteliğindeki kırmızıya kaymasını gösteren bozulmamış mikro kabarcıkların UV-Vis spektrumları tarafından desteklenir. Sonuncusu, özellikle 670-680 nm arasında yalnızca tek bir kırmızıya kaymış zirveyi gösteren veziküler yapılara karşı yüksek yükleme ve porfirinin mikro kabarcık kabuklarına sıralı toplanması ile görülür15,37. Porfirinin %5 mol'den daha büyük bileşimlerde mikro kabarcıklara etkili bir şekilde yüklenmesi, parçacıklar bozulduğunda eski haline getirilen bozulmamış mikro kabarcıklarda>90) porfirin floresansının 15 yüksek (%5) söndürülmesiyle gözlemlenebilir (Şekil 5C). Verilerin boyutlandırılmasına benzer şekilde, bu optik özellikler, mevcut protokolle ilişkili radyo etiketleme koşullarıyla korunur (Tablo 1'de özetlenmiştir). Toplu olarak, bu sonuçlar başarılı mikro kabarcık üretimi, porfirin şelatör dahil edilmesi ve şelatlı mikro kabarcıkların özelliklerinin korunması için tüm uç noktaların başarısını göstermektedir.
Mevcut mikro kabarcık radyoetiketleme protokolü, bakır şelasyon yeteneklerinden ve piro-lipidin multimodalitesinden yararlanılarak oluşturulmuştur. Bununla birlikte, piro-lipid şu anda ticari olarak mevcut değildir. Kurum içinde veya harici olarak sentezi için kaynakların mevcut olmaması durumunda piro-lipid elde etmek için araştırma işbirlikleri teşvik edilir. Her iki seçenek de mevcut değilse, sırasıyla ticari olarak temin edilebilen floroforlar ve şelatörler kullanarak tek modlu floresan veya radyoaktif mikro kabarcıklar oluşturmak için mevcut protokolü değiştirmek mümkündür. Bu alternatif şelatörler / izleyiciler, bir mikro kabarcık lipid kabuğu içine dahil edilemez olmalıdır. Şekil 6 , bu tür iki kısım ile oluşturulmuş temsili mikro kabarcıkları göstermektedir: DiI ve DTPA-lipid.
Bir C16 anyonik mikro kabarcık formülasyonuna DTPA-lipid dahil edilmesi, 11 x 109 mikro kabarcık · mL-1 verimi ve şelatlı C16 anyonik piro-lipid mikro kabarcıkları ile benzer morfoloji ile 1.1 μm mikro kabarcıklar verir (Şekil 6B, C). DTPA mikro kabarcık bakır şelasyon yeteneklerinin bir ön değerlendirmesi "soğuk" CuCl2 kullanılarak yapıldı. Bakır şelasyonu, DTPA mikro kabarcık üretim sürecine entegre edildiğinde, boyut ve verim değişmeden kaldı. Mikro kabarcıklar içindeki DTPA-lipidin bakır şelasyonu için mevcut olduğunu doğrulamak için, ICP-MS santrifüj filtreli mikro kabarcıklar üzerinde gerçekleştirildi. Eşdeğer bakır çivili etiketsiz kontrollerden elde edilen sinyalle karşılaştırıldığında %90-100 şelasyon verimliliğine karşılık gelen kesin bir bakır sinyali tespit edildi. Kurum içi deneyim, ICP-MS'nin γ sayımından daha değişken bakır şelasyon verimlilikleri sağladığıdır ve bu nedenle, mevcut protokolde şelasyon/radyoetiketleme verimliliğini ölçmek için ikincisi önerilir. Bu sonuçlar, bu tavsiyenin önemini vurgulamaktadır, ancak aynı zamanda bu raporda sunulan bakır şelasyon protokolünün piro-lipidin ötesindeki şelatörlere çevrilebilir olduğuna dair kavram kanıtı gösterimi sağlar.
Şekil 6D'de görülebileceği gibi, mevcut protokol, DiI'yi %5'lik bir bileşimde bir C16 anyonik mikro kabarcık formülasyonuna başarılı bir şekilde dahil etmek için de kullanılabilir. Bu, mikro kabarcık kabuğunun güçlü homojen floresan etiketlemesine yol açar (Şekil 6B'de gösterildiği gibi piro-lipidin kullanıldığı duruma benzer şekilde) ve ortalama 1,7 μm boyutunda ve 1,5 x 109 mikro kabarcık·mL-1 verime sahip mikro kabarcıklar oluşturur. Genel olarak, Şekil 6'da sunulan sonuçlar, mevcut mikro kabarcık üretim ve etiketleme protokolünün, piro-lipide erişilememesi durumunda alternatif probları ve şelatörleri mikro kabarcık formülasyonlarına dahil etmek için uygulanabileceğini göstermektedir.
Bu protokol, lipitlerin MB'lerinin radyo-etiketlenmesine odaklanır. Doğal uzantısı, ticari lipid mikro kabarcıklarının15 bir dizi radyoaktif işaretli analogunun parçalanmasını, dolaşım kinetiğini ve kinetik biyodağılımını karakterize eden yakın tarihli bir raporda denenen bu radyoaktif işaretli mikro kabarcıkların in vivo uygulamasıdır. Bu genişletilmiş çalışmanın sonuçları, radyo-işaretli mikro kabarcıkların uygulamaları ve gelecekteki faydaları bağlamında bir sonraki bölümde tartışılacaktır.

Şekil 2: Radyoetiketleme saflıkları ve verimlilikleri. (A) değişen piro-lipid şelatör bileşimleri ve (B) lipid zincir uzunlukları ve mikro kabarcık yükü ile mikro kabarcıkların topraklanmış sentezi sırasında mevcut mikro kabarcık radyoetiketleme protokolünün uygulanmasının ardından elde edilen radyoetiketleme saflıkları ve verimlilikleri. Anyonik mikro kabarcıklar (-) ile belirtilirken, zwitteriyonik (yani nötr) "n" ile belirtilir. Veriler ortalama ± standart sapma olarak sunulur. Bu rakam Rajora ve ark.15'in izniyle uyarlanmıştır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
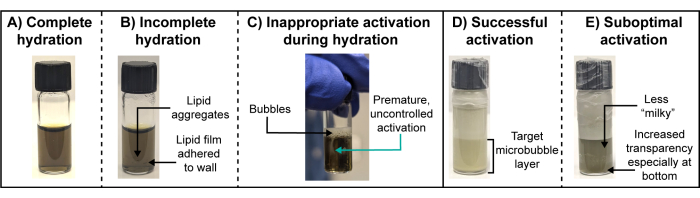
Şekil 3: Optimal ve suboptimal lipid film hidrasyonları ve mikro kabarcık aktivasyonları. (A-E) (A,D) optimal ve (B,C,E) suboptimal lipid film hidrasyonlarının ve mikro kabarcık aktivasyonlarının temsili fotoğrafları. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 4: Şelatsız ve bakır şelatlı porfirin mikro kabarcıklarının temsili boyutlandırması, verimleri ve stabilitesi. (A) sayı boyutu dağılımı, (B) hacim boyutu dağılımı, (C) mikro kabarcık verimi ve (D) %30 mol piro-lipid bileşimine sahip şelatsız (siyah) ve bakır şelatlı (pembe renkte) porfirin mikro kabarcıklarının sayı ortalama boyutları. Mikro kabarcıkların (C ve D) verimi ve boyutu, çalışma süspansiyonu stabilitesini sağlamak için 30 dakikalık aralıklarla ölçüldü. Veriler, n = 4-7 kopyanın (C) ve (D) için ortalama standart sapma olarak sunulur. Bu rakam Rajora ve ark.15'in izniyle uyarlanmıştır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
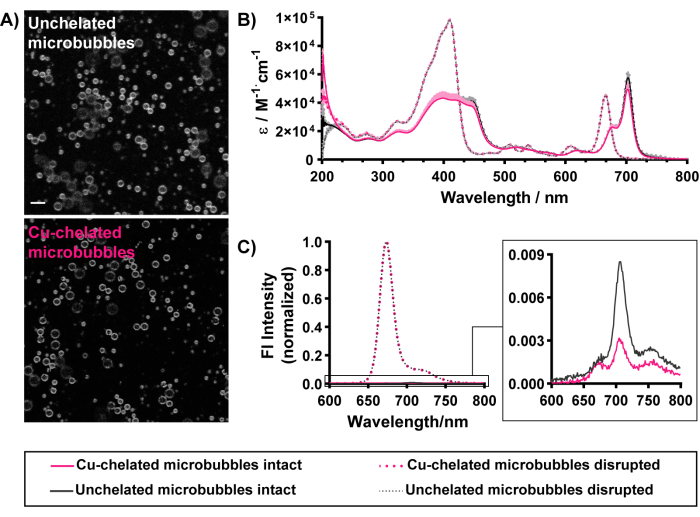
Şekil 5: %30 mol piro-lipid bileşimine sahip şelatsız (siyah) ve bakır şelatlı (pembe renkte) porfirin mikro kabarcıklarının morfolojik ve optik karakterizasyonu. (A) Gri ölçekli konfokal görüntüleme (gösterilen piro sinyali), şelatlı ve şelatsız mikro kabarcık kabukları (ölçek çubuğu = 5 μm) içinde piro-lipidin homojen bir şekilde dahil edildiğini gösterir. (B) Bozulmamış mikro kabarcıklar (PBS'de, katı çizgilerde) ve metanol ile bozulmuş mikro kabarcıklar (kesikli çizgiler) için elde edilen UV-Vis spektrumları. (C) PBS'deki bozulmamış mikro kabarcıkların floresan spektrumları (düz çizgiler, büyütülmüş iç kısım) ve% 1 Triton X-100 bozulmuş mikro kabarcıklar (kesikli çizgiler). Bu rakam Rajora ve ark.15'in izniyle uyarlanmıştır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
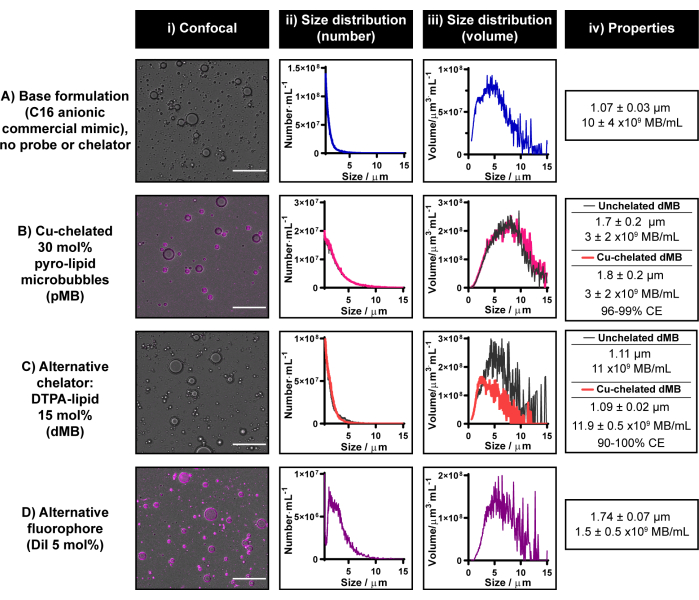
Şekil 6: Piyasada bulunan floroforlar ve şelatörler ile oluşturulmuş temsili mikro kabarcıklar. (M.S.) (C) alternatif şelatör (DTPA-lipid) ve (D) florofor (DiI) ila (B) piro-lipidin (A) C16 anyonik ticari lipid mikro kabarcık formülasyonuna ayrı ayrı dahil edilmesinin örnek kullanımı. Mikro kabarcıklar, konfokal mikroskopi (ölçek çubuğu = 20 μm) (i) ve elektriksel empedans boyutlandırma ile karakterize edildi ve sayı ağırlıklı (ii) ve hacim ağırlıklı (iii) boyut dağılımları oluşturuldu. Mikro kabarcıkların ortalama boyutu ve verimi (iv)'de özetlenmiştir. Veriler, ii-iv'te ortalama n = 2-7 kopya olarak sunulur. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
| Mikro kabarcık varyantı | Rekolte | Gaz hacmi | Sayı dağılımına göre ortalama boyut [μm] | Hacim dağılımına göre ortalama boyut [μm] | Q702nm: Q674nm | Fl su verme verimliliği [%] |
| [x109 MB▪mL-1] | [x1010 μm3 ▪mL-1] | |||||
| Şirket İçi Tanımlama | 10 ± 4 | 1.8 ± 0.2 | 1,07 ± 0,03 | 3,64 ± 0,09 | YOK | YOK |
| C16 (-) | 3 ± 2 | 6 ± 3 | 1.7 ± 0.2 | 6.0 ± 0.8 | 2.5 ± 0.1 | 97,5 ± 0,8 |
| Cu-C16 (-) | 3 ± 2 | 4 ± 2 | 1.8 ± 0.2 | 6.6 ± 0.8 | 2.3 ± 0.2 | 98 ± 2 |
| C16 n | 8.4 ± 0.4 | 2.3 ± 0.8 | 1.1 ± 0.2 | 4.6 ± 0.1 | 2.1 ± 0.5 | 98,2 ± 0,3 |
| Cu-C16 n | 6.2 ± 0.5 | 2.9 ± 0.9 | 1.3 ± 0.2 | 5.1 ± 0.3 | 1.8 ± 0.6 | 98,7 ± 0,2 |
| C18 (-) | 8 ± 1 | 3.9 ± 0.9 | 1.5 ± 0.1 | 4.0 ± 0.5 | 2.5 ± 0.3 | 97 ± 1 |
| Cu-C18 (-) | 7 ± 2 | 4 ± 1 | 1.5 ± 0.2 | 4.9 ± 0.9 | 2.2 ± 0.5 | 98,5 ± 0,6 |
| C18 n | 8 ± 1 | 3 ± 1 | 1.5 ± 0.1 | 4.0 ± 0.8 | 1.8 ± 0.7 | 98,6 ± 0,5 |
| Cu-C18 Serisi | 7.8 ± 0.2 | 3.9 ± 0.2 | 1,42 ± 0,04 | 4.8 ± 0.1 | 1.8 ± 0.7 | 98,7 ± 0,3 |
Tablo 1: Şelatsız ve Cu şelatlı pDef'lerin fizikokimyasal özellikleri. Anyonik mikro kabarcıklar (-) ile belirtilirken, zwitteriyonik (yani nötr) "n" ile belirtilir. Tüm ölçümler ortalama bir ± standart sapmasını temsil eder (n = 3-7). Bu rakam Rajora ve ark.15'in izniyle uyarlanmıştır.
Ek Şekil 1: Lipid mikro kabarcık kabuklarına piro-lipid girişi için "topraklama" (gri) ve "sivri" (pembe) yaklaşımların karşılaştırılması. (A) Toplam lipidin %1, %10 mol ve %30 mol'lük toplam piro-lipid bileşimlerine karşılık gelen miktarlarda piro-lipid ile "çivili" mikro kabarcıkların konfokal görüntülenmesi (ölçek çubuğu = 20 μm). (B) "çivili" (macenta) veya "topraklanmış" yaklaşım (siyah) yoluyla üretilen piro-lipid mikro kabarcıkların UV-Vis spektrumları (i-iii). (Biv) Mikron altı türlerin santrifüjle uzaklaştırılmasını takiben mikrokabarcıklı keklerdeki piro-lipid yüzdesi. (C) "Topraklama" (siyah) ve "sivri" yaklaşımlarla yapılan piro-lipid mikro kabarcıkların sayı ve hacim dağılımları (i-iii) ve karşılık gelen ortalama mikro kabarcık boyutları (iv) ve verimler (v). Bu dosyayı indirmek için lütfen buraya tıklayın.
Ek Şekil 2: %1 mol, %10 mol ve %30 piro-lipidden oluşan ve bakır-64 ile radyoaktif etiketli mikrokabarcık lipid süspansiyonlarının radyo-UPLC karakterizasyonu. Soldaki spektrumlar bir radyasyon dedektöründen, sağdaki ise 400 nm'lik bir soğurma kanalından geliyor. Ne yazık ki, potansiyel kirleticiler nedeniyle, bu veriler radyokimyasal saflığı ölçmek için kullanılamadı. Bununla birlikte, [64Cu]Cu2 + sinyali ve piro-lipid ile ilişkili piklerin elüsyon sürelerinde bir örtüşme gösterir ve bu da başarılı radyoetiketlemeyi gösterir. Bu rakam Rajora ve ark.15'in izniyle uyarlanmıştır. Bu dosyayı indirmek için lütfen buraya tıklayın.
Ek Şekil 3: Artan piro-lipid molar bileşimin etkisi. (A) ilişkili sayı dağılımları, (B) hacim dağılımları, (C) sayı ortalama boyutu, (D) hacim ortalama boyutu, (E) verim, (F) floresan söndürme verimliliği ve entegre floresan sinyali (410 nm uyarma, 600-800 nm uyarma) üzerindeki etkisi bozulmamış (PBS) ve bozulmuş (% 1 Triton X-100'de) ile ilişkili. Veriler, standart sapma ± ortalama n = 3 kopya olarak sunulur. Bu rakam Rajora ve ark.15'in izniyle uyarlanmıştır. Bu dosyayı indirmek için lütfen buraya tıklayın.
Ek Dosya 1. Bu dosyayı indirmek için lütfen buraya tıklayın.
Tartışmalar
Mevcut lipid mikro kabarcık radyoetiketleme protokolü, herhangi bir etiketleme sonrası saflaştırma gerektirmeden %>95 radyokimyasal saflık, %>95 şelasyon verimliliği ve mikro kabarcık fizikokimyasal özelliklerinin korunmasına ulaşır. Bu başarılar, mevcut etiketleme protokolleri için daha önce elde edilemeyen ilerlemeleri temsil etmektedir. Saflaştırma adımlarının olmaması, radyoizotopların (bu durumda bakır-64) daha hızlı kullanılmasına ve böylece radyoaktif bozunmadan kaynaklanan verimsiz aktivite kaybının azaltılmasına izin verir. Bakır-porfirin şelasyonunun33 bilinen stabilitesi ile birlikte ortaya çıkan mikro kabarcık özelliklerinin korunması, sonraki herhangi bir radyogörüntüleme veya tedavinin, serbest radyoizotop veya saflaştırma ile modifiye edilmiş mikro kabarcık popülasyonları ile ilişkili olana kıyasla ilgilenilen mikro kabarcığı temsil etmesini daha iyi sağlar.
Mevcut protokol aynı zamanda, mikro kabarcık fizikokimyasal özelliklerinin bu şekilde korunmasını sağlamak için paralel "soğuk" etiketleme ve temel karakterizasyon tekniklerini entegre eden ilk protokoldür. Aslında bu, mikro kabarcık boyutunun, veriminin ve stabilitesinin sağlam bir şekilde karakterize edildiği ilk mikro kabarcık radyoetiketleme protokolüdür. Bu özelliklerin anlaşılması, radyoaktif işaretli mikro kabarcıkların uygulanması için çok önemlidir. Mikro kabarcık dozlarını belirlemek için mikro kabarcık boyutu, gaz hacimleri ve verim bilgisi gereklidir ve bu da mikro kabarcık-FUS tedavisinin güvenliğini ve etkinliğini etkiler. Örneğin, mikro kabarcık-FUS BBB açılması, mikro kabarcık dozu/gaz hacmi için bir üst sınır ile ilişkilidir, bunun ötesinde FUS sonrası kanama ve iltihaplanma güvenlik endişeleri oluşturur38. Hepsi bir arada kabuk yüklü mikro kabarcıklar için, bu doz aynı zamanda yüklenen ilacın dozuna da bağlıdır. Boyut ve verim aynı zamanda görüntüleme uygulamalarını da etkiler ve yüksek konsantrasyonlarda mikro kabarcık gazı hacimlerine sahip koruyucu artefaktlar oluşturur39. Büyük, >8 μm'lik mikro kabarcıklar, kılcal damarlara yerleşme ve gaz embolisi40 oluşturma konusunda ek güvenlik riski taşır. Sezgisel olarak, bu aynı zamanda mikro kabarcık kabuklarının farmakokinetiğini ve biyolojik dağılımını da etkileyecektir. Örneğin, akciğerler daha önce radyoaktif işaretli mikro kabarcık kabuk birikiminin birincil bölgesi olarak rapor edilmişti 28,32. Mikro kabarcık karakterizasyonunun yokluğunda, daha büyük boyutlu mikro kabarcıkların akciğer sıkışmasının bu biyodağılım profiline katkıda bulunup bulunmadığı belirsizliğini korumaktadır. Porfirin kullanımına özgü olarak, mikro kabarcık optik özelliklerinin karakterize edilmesi, aşağıda tartışılacağı gibi metal: porfirin oranlarını ve dolayısıyla şelasyon verimliliğini etkileyebilen etkili porfirin kabuğu yüklemesini sağlar. Porfirin ayrıca mikro kabarcık multimodal görüntüleme37, sinerjik fotodinamik terapi41 ve sonodinamik tedavi42 için ilgi çekici bir teranostik ajandır. Mikro kabarcıklar içindeki yüklenmesini ve floresansını karakterize etmek, terapötik porfirin mikro kabarcık çalışmalarına rehberlik eder ve gerçek görüntü kılavuzluğunda tedavi planlamasını kolaylaştırmak için bu özelliklerin radyoetiketleme ile değişmemesini sağlar. Bu nedenle, "soğuk" etiketleme ve etiketlenmemiş mikro kabarcıkların imalatının, radyoetiketlemeye paralel olarak yürütülmesi şiddetle rica edilmektedir.
Bu protokol, porfirinlerin güçlü bakır şelasyon yeteneklerinden ve porfirin-lipidin mikro kabarcık kabukları37 içinde bilinen kendi kendine montajından yararlanır. Bakır-64'e odaklanmış olmasına rağmen, bu protokol, daha geniş porfirin sınıfları Zn, Ni, Mn, Pd, In, Lu, Cd, Sn, Ga, Co ve 43,44,45,46'nın ötesine bağlanabildiğinden, alternatif tek kap metaloşelatlı mikro kabarcık preparatlarına kapı açar. Bu tür porfirin-metal şelasyonu tipik olarak porfirin supramoleküler sentezi sırasında iki adımdan birinde meydana gelir: 1) porfirin yapı taşlarının partiküllere girmeden önce şelatlandığı ön yerleştirme veya 2) porfirinin metal şelasyonu gerçekleştirmeden önce bir partiküle zaten monte edildiği yerleştirme sonrası33,43. Radyoizotoplar kullanılırken, ilki, lipit film kurutma sırasında verimsiz radyoaktif bozunma ile ilişkilidir ve bu da radyasyon güvenliği risklerini artırır. İkincisi, mikro kabarcıklara uygulandığında, partikül dengesizleşmesi riski taşır. Bu nedenle, şelatörün "topraklanmış" lipit film oluşumu sırasında tanıtıldığı mevcut protokolde hibrit bir yaklaşım oluşturuldu, ancak radyo-etiketleme, lipit film hidrasyonundan sonra ve mikro kabarcık aktivasyonundan önce gerçekleştirildi. Bu strateji, radyoetiketlemenin tipik bir mikro kabarcık üretim sürecine kolayca dahil edilmesine izin vererek, onu çeşitli mikro kabarcık formülasyonlarına uygun hale getirdi. Ayrıca, bu entegrasyon basit enstrümantasyonun kullanılmasını sağladı ve özel radyoaktif "sıcak" ekipman sayısını en aza indirdi.
Bu hibrit yaklaşım, büyük ölçüde iki baskın yaklaşıma ayrılan mevcut mikro kabarcık radyoetiketleme protokollerinden de farklıdır: 1) Daha sonra önceden oluşturulmuş mikro kabarcık lipid süspansiyonlarına "çivilenen"bir şelatörün sentezi ve radyo-etiketlemesi 28,47 ve 2) daha sonra ticari streptavidin ile işlevselleştirilmiş ticari mikro kabarcıklar32,29 ile inkübe edilen biyotinile edilmiş bir parçanın radyo-etiketlemesi. Bu ikinci yaklaşım, radyoizotop kullanımını koruma avantajını taşır. Sunulan "topraklanmış" ve rapor edilen "çivili" protokollerde, radyoizotop şelatörü mikro kabarcık aktivasyonundan önce dahil edilir ve böylece hem hedef boşaltılmış mikro kabarcıklar hem de istenmeyen büyük, köpüklü parçacık popülasyonları etiketlenir. Bu sınırlama, yarısı boşa giden "topraklama" ve "çivili" yaklaşımlar için daha yüksek miktarda radyoizotopun gerekli olduğu anlamına gelir. Bununla birlikte, yukarıda açıklandığı gibi, aktivasyon sonrası radyoetiketleme, mikro kabarcık dengesizleşmesini riske atar ve önceki "spiking" protokollerinin yanı sıra, entegre olmayan radyoaktif işaretli şelatörün çıkarılmasını gerektirir.
Bununla birlikte, "spiking" yaklaşımı, lipid film üretimi mümkün olmadığında veya istenmediğinde, önceden oluşturulmuş mikro kabarcık lipid süspansiyonlarının (örneğin ticari mikro kabarcıklar) radyo-etiketleme yollarını açar. Mevcut "temelden yukarıya" radyo etiketleme protokolü, böyle bir "sivri" yaklaşımı taklit edecek şekilde uyarlanabilir (adım 8.3). Burada, bir piro-lipid film üretilir ve daha sonra veziküllerin bir piro-lipid süspansiyonunu oluşturmak için hidratlanır. Bu süspansiyon daha sonra önceden oluşturulmuş bir mikro kabarcık lipid süspansiyonuna "çivilenir" ve piro-lipidi entegre etmek için ısıtılır / sonikasyona tabi tutulur. Radyoetiketleme, "spiking"den önce veya hemen sonra (ancak aktivasyondan önce) gerçekleşebilir. Ek Şekil 1A'da görülebileceği gibi, bu uyarlanmış protokol, toplam lipidin %1 mol, %10 mol veya %30'luk bileşimlerde "çivili" piro-lipid şelatör ile kurum içi ticari mikro kabarcık formülasyonlarını etiketler.
Bu "spiking" yaklaşımı, mevcut protokolde odak noktası olan değiştirilmemiş "temelden yukarı" yaklaşıma kıyasla önemli bir sınırlamaya sahiptir: eksik piro-lipid entegrasyonu. Konfokal görüntülemede görülebileceği gibi (Ek Şekil 1A), piro-lipid sinyali, "topraklama" birleştirme sırasında olduğu gibi mikro kabarcık kabuğunun etrafında kesinlikle halka benzeri, homojen bir şekilde lokalize olmaz. Bunun yerine, "sivri uç" yaklaşımı, bazıları bulanık ve net floresan ana hatlarına sahip olan mikro kabarcıklar boyunca görülebilen yamalı floresan alanlarıyla ilişkilidir. Daha yüksek düzgün olmayan arka plan floresansı da gözlemlenebilir. Mikron altı türleri uzaklaştırmak için bu "çivili" mikro kabarcıkların santrifüjlenmesi, bu arka plan floresansını ve düzensiz sinyalin çoğunu ortadan kaldırır. Bu, piro-lipid veziküllerinin emilmiş olabileceğini, ancak mikro kabarcık kabuğuna tamamen entegre edilmemiş olabileceğini, piro-lipidin "çivili" ve "topraklanmış" dahil edilmesinin UV-Vis karakterizasyonu ile desteklenen bir varsayım olduğunu düşündürmektedir (Ek Şekil 1B). Spesifik olarak mikro kabarcıklarda (% >5 mol bileşimde) piro-lipid katılımı ile ilişkili 704 nm Q-bandı "spiking" ile azaltılır. Bunun yerine, 674 nm'de daha belirgin bir zirve gözlenir. Mikrokabarcıklı keklere dağıtılan piro-lipidin infranatant mikron altı türlere karşı miktar tayini, piro-lipidin sadece dörtte birinin mikro kabarcıklara "sivri" ile dağıtıldığını göstermektedir. Aksine, "topraklanmış" şelatör girişi için mikro kabarcıklara daha yüksek piro-lipid miktarları dahil edilir. "Çivili" mikro kabarcıklar içindeki daha düşük piro-lipid katılımı, muhtemelen ilişkili "topraklanmış" mikro kabarcıklara karşı probsuz mikro kabarcıklara benzeyen boyut dağılımlarına katkıda bulunan faktördür (Ek Şekil 1C). Dahil edilmemiş radyoaktif işaretli piro-lipid yapıların varlığı, radyogörüntüleme veya tedavi sonuçlarını karıştırabilir. Bu nedenle, mevcut protokollere benzer şekilde, bir "spiking" yaklaşımını, dahil edilmemiş piro-lipid türlerini ortadan kaldıran bir santrifüjleme veya boşaltma adımı izlemelidir. Yukarıdakilerin tümü dikkate alındığında, mevcut protokolde sunulan "temelden yukarıya" radyo etiketleme stratejisi daha güçlü bir şekilde tavsiye edilir. "Spiking" ile karşılaştırıldığında daha yüksek şelatör entegrasyonuna izin verir ve önceden oluşturulmuş ticari mikro kabarcıkların aksine mikro kabarcık formülasyonunun özelleştirilebilirliğini sağlar.
"Topraklanmış" bakır şelasyon protokolü, daha önce tarif edildiği gibi reaksiyon parametrelerinin sistematik bir şekilde araştırılması yoluyla oluşturulmuştur48. Bu optimizasyon süreci, kaliteli mikro kabarcıklar üretmek için kritik adımlar hakkında bilgi sağlarken aynı zamanda verimli ve zamanında bakır şelasyonunu mümkün kılmıştır: 1) mikro kabarcık aktivasyonundan önce %10 gliserol ve %10 propilen glikol eksipiyan içeriğinin korunması, 2) şelasyon sıcaklığının 60-80 °C arasında kalmasının sağlanması, 3) filmlerin radyoetiketleme ile aynı gün AA-PGG ile nemlendirilmesi (lipid süspansiyonunun asidik koşullara uzun süre maruz kalmasından kaçınılmalıdır), 4) aktivasyondan önce lipit süspansiyonunun nötralize edilmesi ve 5) hidrasyon, şelasyon ve aktivasyonun ardından "soğuma" adımlarının sağlanması. Porfirin:bakır oranı 10:1'in üzerinde tutulmalıdır. Bakır şelasyonu porfirin floresansını söndürdüğü için mikro kabarcık boyutunu, verimini, stabilitesini ve şelasyon verimliliğini ve ayrıca çift radyo ve floresan görüntüleme yeteneklerini korumak için bakıra göre fazla porfirin gereklidir. 1 mL reaksiyon hacmi ve 1 saatlik şelasyon süresi, etiketlenen mikro kabarcıklardaki piro-lipid kısımlarının %<1'ine karşılık gelen %30 mol piro-lipid süspansiyon bileşimleri için verimli ve saf radyoetiketleme sağladı. Lipid filmlerdeki piro-lipid bileşimlerinin %1 mol ve %10 mol'e düşürülmesi, aynı bakır-64 ilavesi için piro-lipid fazlalığını azalttı ve radyo-etiketleme reaksiyonunda modifikasyon gerektirdi. Daha konsantre bir reaksiyon gerekliydi ve bu nedenle, ilişkili mikro kabarcık filmleri 0.15 mL AA-PGG ile hidratlandı. Nötralizasyondan sonra, mikro kabarcık aktivasyonundan önce 1 mL radyoaktif işaretli lipid süspansiyon hacmi elde etmek için PGG ilave edildi. %1 mol'lük bileşim, %≥95 radyoetiketleme verimliliği ve saflığı elde etmek için daha uzun ısıtma (1,5-2 saat) gerektirdi. Bu nedenle, radyoetiketleme zorluklarıyla karşılaşılırsa (yani, %≤90 radyokimyasal saflık ve verimlilik), daha uzun bir reaksiyon süresi ve daha düşük reaksiyon hacmi (yani, daha konsantre lipid süspansiyonu) denenebilir.
Bu protokol, sırasıyla radyokimyasal saflığı ve radyoetiketleme verimliliğini ölçmek için iTLC ve doğrulanmış bir santrifüj filtrasyon tekniği15 kullandı. Başarılı ve stabil bakır-64 şelasyonu için in vivo bir okuma, mesane sinyalinin olmamasıdır (serbest bakır-64 renal atılıma uğrarken, mikrokabarcık kabukları gibi lipid supramoleküler yapılar hepatobiliyer / dışkı atılımına uğrar)15. Şelasyon etkinliği, varsa, radyokimyasal saflığı ve etiketleme verimliliğini değerlendirmenin başka bir yolu olan radyo-yüksek performanslı sıvı kromatografisi (Ek Şekil 2) ile doğrulanmıştır. Bu protokol, iTLC ve santrifüj filtrasyonu, özel beceriler veya aletler gerektirmeyen ve daha ziyade araştırma laboratuvarı nükleer tesislerinin sahip olma olasılığının daha yüksek olacağı ekipmanı kullanan daha hızlı ve daha basit yöntemler olarak sundu. Bu amaçla, santrifüjlü filtrasyon protokolü, 30.000 MWCO ünitesi kullanılarak serbest ve şelatlı bakırın ayrılması için doğrulanmıştır (100.000 MWCO ünitesi de kullanılabilir). Alternatif bir radyoizotop/metal kullanılıyorsa, santrifüj hızının, süresinin ve yıkama sayısının değiştirilmesi gerekebilir. Bakır-metal şelasyon stabilitesinin bilinmediği veya tehlikeli olduğu alternatif bir metal kullanılıyorsa, uygun bir serum stabilite testi de yapılmalıdır.
Radyoetiketleme zorluklarının ötesinde, mikro kabarcık üretim zorlukları da ortaya çıkabilir. Daha önce tanıtıldığı gibi, mikro kabarcıklar kırılgandır ve imalatlarına yönelik adımlar hassas ve dikkatli kullanım gerektirir, bu olmadan Şekil 3'te gösterildiği gibi hidrasyon, aktivasyon, tekrarlanabilirlik, stabilite ve verim sorunlarıyla karşılaşılabilir. Başarılı mikro kabarcık üretimini destekleyen diğer faktörler arasında 1) taze, kuru lipitlerin kullanılması (kuru lipitlerin bir desikatörde saklanması ve buzdan korunması), 2) ısıya maruz kalmış lipit alikotlarının kullanılmasından kaçınılması (örneğin, hızlı vakumlama yoluyla) ve 3) hava kabarcıkları içermeyen taze hidrasyon tamponunun hazırlanması. Kontrol mikro kabarcıklarının imalatının uygun ürünler verdiği ancak radyoetiketlemeyi takiben üretilenleri vermediği durumlarda, ek hususlar söz konusu olabilir. Şelasyon reaksiyonunun sıcaklığı ve uzunluğu, mevcut protokolün doğrulandığı 60-80 °C ve 0-2 saatlik zaman dilimlerinin dışında olabilir. Ek olarak, bakır-64 veya diğer radyoizotopların spesifik aktivitesinin, mevcut çalışma ile ilişkili olandan önemli ölçüde daha düşük olması mümkün olabilir. Bu, aynı aktivite seviyesi için etiketlenen porfirin türlerinin daha büyük bir oranıyla sonuçlanacaktır (örneğin, bu protokolün onaylandığı 10: 1 porfirin: bakır fazlalığından daha düşük), bu da mikro kabarcık aktivasyonunu bozabilir.
Başarılı mikro kabarcık üretimindeki yukarıdaki zorlukların çoğu, özellikle kullanıcılar mikro kabarcık sentezinde yeniyse, radyoetiketleme yokluğunda önce açıklanan mikro kabarcık üretiminin denenmesiyle hafifletilebilir. Önce kontrol şelatsız mikro kabarcıkların üretilmesi ve ardından etiketleme protokolünün "soğuk" radyoaktif olmayan bakır ile denenmesi önerilir. Yukarıda tarif edildiği gibi, bu "soğuk" şelasyon işlemi, radyoaktif işaretli mikro kabarcıkların temsili fizikokimyasal karakterizasyonunu elde etmek için hayati önem taşır. "Soğuk" şelasyon ayrıca, tarif edilen protokolde yapılan herhangi bir değişikliğin (örneğin, değiştirilmiş şelasyon sıcaklığı, hacmi, reaksiyon süresi, porfirin: bakır oranı, radyoizotop, alternatif şelatör) istenen mikro kabarcık fizikokimyasal özelliklerini korumasını sağlamada önemli bir ilk adım olarak hizmet eder.
Böyle bir değişiklik, alternatif şelatörlerin ve probların kullanılması olabilir. Mevcut protokolün bir sınırlaması, ticari olarak kullanılamayan bir şelatörün temel kullanımıdır. Bu nedenle, piro-lipid yerine ticari olarak temin edilebilen şelatörlerin ve floresan probların kullanılmasını sağlayan modifikasyonlar (protokolün 8. bölümü) sunulmaktadır. Piro-lipide alternatif olarak DiI veya DTPA-lipidin dahil edilmesiyle ilişkili test verileri elde edildi (Şekil 6). DiI, mikro kabarcık-FUS mekanizmalarını incelemek ve ilaç ajanlarınımodellemek için mikro kabarcık kabuklarına dahil edilmiş, ticari olarak temin edilebilen bir probdur 49,50,51. Bildiğimiz kadarıyla, bu bir DTPA-lipid mikro kabarcığının ilk raporudur. Piro-lipidin bu alternatif parçalarla başarılı bir şekilde ikame edilmesi, mevcut mikro kabarcık üretim ve etiketleme protokolünün çok yönlülüğüne işaret eder. Muhtemelen daha geniş bir prob dizisine, özellikle de fosfolipidlere bağlı veya fosfolipidler arasında entegre olabilen problara uygulanabilir.
Bu protokolde ikame edilebilmesine rağmen, piro-lipid, tek bir organik molekül içinde tamamlayıcı radyogörüntüleme ve floresan izleme yeteneklerini barındırmanın benzersiz avantajını sağlar. Bu multimodalite, mikro kabarcık kabuğu dağıtımını ve biyolojik dağılımı izlemek için avantajlı olabilir. Bu, özellikle piro-lipid bileşimleri kullanıldığında geçerlidir ≥% 10 mol. Artan bileşimlerde, mikro kabarcık kabukları (ve genel olarak supramoleküler yapılar) içindeki piro-lipid giderek floresan olarak söndürülür15. Partikül bozulması üzerine, daha yüksek porfirin bileşimleri önemli ölçüde daha güçlü floresan sinyalleri verir (Ek Şekil 3). Bu floresan söndürme, mikro kabarcık kabuğu kaderini görüntülerken ek bir okuma görevi görebilir. Örneğin, PET mutlak kabuk dağıtımının/biyodağılımının ölçülmesini kolaylaştırırken, floresan görüntüleme bu tür bir birikimin partikül bozulması ile ilişkili olup olmadığını yakalayabilir.
Bununla birlikte, daha yüksek piro-lipid molar bileşimlerinin sınırlamalarından biri, mikro kabarcık boyutu ve verimi üzerindeki etkileridir. Ticari bir lipid mikro kabarcık formülasyonu içinde konakçı lipitlerin artan piro-lipid bileşimleri ile değiştirilmesinin daha büyük kabarcıklar, daha düşük mikro kabarcık verimleri ve daha kararsız mikro kabarcıklar ürettiği bulunmuştur15. Referans kolaylığı için, bu bulgular, mevcut radyoetiketleme protokolünün doğrulandığı 1 mol%, %10 mol ve %30 piro-lipid bileşimleri için Ek Şekil 3'te özetlenmiştir. Prob ilavesi ile mikro kabarcık boyutundaki bu değişiklik, piro-lipide özel değildir. Örneğin, %5'lik bir bileşimde, ticari bir lipid mikro kabarcık formülasyonuna DiI dahil edilmesi, mikro kabarcık verimini 10 kat azalttı ve mikro kabarcık boyutunu %60'ın üzerinde artırdı (Şekil 6). Karşılaştırıldığında, %5'lik bir piro-lipid bileşimi, önemli ölçüde farklı verim, hacim ortalama boyutu veya tepe hacmi sergilemedi, ancak mikro kabarcık sayısı ortalaması boyutunu %25 oranında artırdı15. Ayrıca, piro-lipid bileşiminin %1 mol'den %30 mol'e çıkarılması, kabuk sirkülasyonunu ve boşluk yollarını önemli ölçüde etkilemez15. Bununla birlikte, probsuz veya ticari formülasyonlarla ilişkili boyut dağılımlarının korunması isteniyorsa, mevcut mikro kabarcık üretimi ve radyoetiketleme protokolü, %1'lik bir piro-lipid bileşimi kullanılarak uygulanabilir. Bu düşük miktarda piro-lipid inklüzyonu temel probsuz formülasyonlarla ilişkili herhangi bir boyutlandırma veya verim parametresini önemli ölçüde değiştirmez (Ek Şekil 3). Bununla birlikte, daha yüksek piro-lipid bileşimleri ile ilişkili güçlü aktive edilebilir floresan yeteneklerini kaybetme pahasına gelir. Uzlaşmacı bir çözüm, %10'luk bir piro-lipid bileşiminin seçilmesi olabilir. Genel olarak, %1 mol kadar düşük piro-lipid bileşimlerinin mevcut radyoetiketleme protokolüne uygun olduğu göz önüne alındığında, mikro kabarcık boyutlandırma, verim ve floresan yeteneklerinin uyarlanabileceği büyük bir modülerlik derecesi mevcuttur.
Genel olarak, mevcut radyo etiketleme protokolünün kapsayıcı uyarlanabilirliği, Giriş bölümünde gözden geçirilen çok sayıda radyo etiketli mikro kabarcık uygulamasını mümkün kılabilir. Mikro kabarcık-FUS alanının mevcut manzarasıyla belki de en alakalı olanı, görüntü güdümlü ilaç dağıtım platformu tasarımı için mikro kabarcık kabuğu kaderinin radyotracing'idir. Radyoaktif işaretli mikro kabarcıkların bu uygulaması, yakın tarihli bir çalışmadaaraştırılmıştır 15. Mevcut radyoetiketleme protokolü, klinik ve klinik öncesi literatürde en yaygın olarak çalışılan lipid mikro kabarcık bileşimlerini temsil eden, değişen asil zincir uzunluğu ve yüküne sahip bir dizi multimodal bakır-64 etiketli porfirin mikro kabarcıkları oluşturmak için uygulandı. İn vivo gaz çözünmesi, kabuk klerensi, biyodağılım ve sökme kinetiği, sağlıklı ve tümör taşıyan farelerde ultrason, PET ve floresan görüntüleme yoluyla izlendi ve türünün ilk örneği olan uzunlamasına ve sistematik lipid mikro kabarcık farmakokinetik çalışma elde edildi. Temel bulgular şunları içeriyordu: 1) Mikro kabarcık çekirdekleri, artan mikro kabarcık lipid zinciri uzunluğunun nötr mikro kabarcıkların daha yavaş çözünmesine ve anyonik mikro kabarcıkların daha hızlı çözünmesine (en çok ticari formülasyonlara benzer) yol açtığı dakikalar içinde çözülür; 2) Kalan kabuklar kanda 24 saatten fazla dolaştı ve hepatobiliyer / splenik / dışkı yolu yoluyla temizlendi; 3) Bu tür bir boşluk, mikro kabarcık bileşimine bağlıydı, öyle ki daha kısa zincir uzunluğundaki kabuklar daha yüksek hepatik işleme tabi tutulurken, daha uzun zincir uzunluğundaki kabuklar daha yüksek dalak alımı sergiledi; 4) Mikro kabarcık kabukları, enjeksiyondan sonraki ilk PET zaman noktası (1 saat) kadar erken bir tarihte çevredeki dokuya kıyasla tümörlerde tercihli birikime maruz kaldı, C18 nötr kabuklu mikro kabarcıklar, benzer seviyelerde FUS aracılı damar açılmasını kolaylaştırmasına rağmen (Evans mavisinin birlikte uygulanmasıyla belirlendiği gibi) en yüksek pasif ve FUS ile geliştirilmiş alımı (tedaviden 3.5 saat sonra maksimum artış) sergiledi; 5) Genel olarak, tümör kabuğu dağıtımındaki FUS artışları mütevazıydı ve tüm mikro kabarcık formülasyonları arasında eşit değildi, bu da FUS ile geliştirilmiş kargo yüklü kabuk dağıtımının çeşitli mikro kabarcıklar arasında her yerde elde edilemeyeceğini ve daha yüksek FUS basınçları gerektirebileceğini gösterdi; 6) tümör, karaciğer ve dalak içindeki mikro kabarcık kabukları ağırlıklı olarak ekstravasküler boşlukta bulundu; ve 7) daha kısa zincir uzunluğundaki kabuklar daha hızlı sökülmeye tabi tutuldu, burada tümör en yüksek kabuk parçası sökme oranlarına sahipti. Bu bulgular, mikro kabarcık-FUS alanındaki geleneksel bilgeliği açıklığa kavuşturdu ve kabuk bazlı tümör iletimi için optimal mikro kabarcık tasarımlarını çevreleyen bazı varsayımları tersine çevirdi. Temel başlangıç kılavuzu, splenik hedefler için ilaç yüklü mikro kabarcıkları formüle etmek için C18 lipidlerinin kullanımını, hepatik hedefler için C16 lipidlerinin, ultrason kontrast görüntüleme ve daha uzun kan dolaşımı için nötr daha uzun zincirlerin, tümör hedefleri için nötr C18 lipidlerinin, hepsi bir arada kabuk yüklü lipid mikro kabarcıklar içinde hepatosplenik toksisiteye sahip ilaçların kontrendike kullanımını ve düşük başlangıç vasküler geçirgenliğine sahip tümörler için bu tür sistemlerin uygulanmasını içeriyordu. Böylece bu çalışma, daha optimal mikro kabarcık tasarımını bilgilendirebilecek yapı-aktivite ilişkilerini başlattı ve tümü mevcut radyoetiketleme protokolü tarafından sağlanan daha fazla keşif için bir plan sağladı. Bu kapasite, daha verimli farmakokinetik veri analizine olanak tanıyan otomatik PET/CT organ segmentasyonu için uyarlanmış bir derin öğrenme aracı oluşturmak için elde edilen mikro kabarcık farmakokinetik veri seti kullanılarak daha da geliştirildi. 52
Mevcut protokolün odak noktası, lipid mikro kabarcıklarının radyo-etiketlenmesine yerleştirildi. Bununla birlikte, kargo yüklü ultrason ajanı tasarımları bağlamında, nano damlacıkları ve polimerik mikro kabarcıkları gözden kaçırmak yanlış olacaktır. Nanodamlacıklar, lipit, protein veya polimer kabukları ile kapsüllenmiş sıvı bir perflorokarbon çekirdekten oluşan faz değiştiren sistemlerdir. Daha yüksek yoğunluklu FUS altında, bu nano damlacıklar, sıvı çekirdeğin akustik buharlaşması yoluyla mikro kabarcıklara dönüştürülür. FUS aktivitesinin bu mekanizması ve daha küçük boyutlu nanodamlacıklar, kabuk yüklü dağıtım için potansiyel avantajlar taşır: 1) in vivo olarak daha uzun stabilite, 2) dokuda daha fazla geçirgenlik ve daha yüksek tümör iletimi, 3) hem vasküler hem de ekstravasküler aktivite için tesis ve 4) akustik buharlaşmayı takiben hızlı ilaç salınımı 50,53,54. Bu nedenle, kargo yüklü nanodamlacıkların radyo-etiketlemesi, gelecekteki çalışmalarda radyoizleme ve görüntü kılavuzluğunda tedavi planlaması için de faydalı olacaktır. Mevcut radyoetiketleme protokolü, daha önce nanodamlacık kabukları35 içinde porfirin-lipid yüklemesine izin verdiği gösterilen yoğunlaştırma yöntemiyle üretilen nanodamlacıklara kolayca dahil edilebilir.
Polimerik mikro kabarcıkların ayrıca, polimer kabuk kalınlığı ve malzeme bileşimi modülasyonu55,56,57 yoluyla ilaç yükleme, kargo kapsülleme ve ilaç yükleme ayarlanabilirliği için daha yüksek varsayılan stabilite sağlayan sert ve modüler kabukları nedeniyle lipid mikro kabarcıklara göre kabuk yüklü ilaç dağıtım avantajları sergilediği düşünülmektedir. Stabiliteleri nedeniyle, polimerik mikro kabarcıklar, mevcut protokolün üstesinden gelmek için tasarlandığı lipid mikro kabarcıkları ile aynı radyoetiketleme sınırlamalarıyla karşılaşmayabilir. Bununla birlikte, mevcut protokol iki hesapta polimerik mikro kabarcık radyoetiketlemeyi bilgilendirmek için hala kullanılabilir: 1) mikro kabarcık karakterizasyonu ve 2) şelasyon verimliliği. Polimerik mikro kabarcık radyo-etiketleme çalışmada sınırlıdır, ancak tipik olarak polimerik kabukların yüzeyinin şelatörlerle (örneğin, DOTA ve NOTA) işlevselleştirilmesini, ardından serbest izotopunçıkarılması için izotop eklenmesini, ısıtılmasını ve yıkanmasını içerir 27,58. Mevcut lipid mikro kabarcık radyoetiketleme protokollerine benzer şekilde, bu raporlar etiketleme sonrası mikro kabarcık fizikokimyasal özelliklerini karakterize etmez. Bu nedenle, mevcut protokol, herhangi bir tür mikro kabarcık kabuğunu radyo-etiketleme yaparken "soğuk" etiketleme ve karakterizasyonun kullanımını standartlaştırmak için bir plan olarak kullanılabilir. Ayrıca, polimerik mikro kabarcık radyoetiketleme verimlerinde iyileştirme için yer vardır (şelatör aşılı mikro kabarcıklar için rapor edilen% 42 -% 85 aralığı58). Bu çalışmada porfirinin güçlü ve verimli bir radyoizotop şelatörü olarak kullanılması, bakır şelasyonundan önce mevcut porfirin-polimer kabuk konjugasyon tekniklerinin59 uyarlanmasıyla gelecekteki çalışmalara çevrilebilir. Genel olarak, polimerik mikro kabarcıklar, lipid mikro kabarcıklar kadar popüler değildir. Lipid mikro kabarcıklar, şu anda insan kullanımı için klinik olarak onaylanmış tek kabuk varyantıdır ve bu da onları terapötik mikro kabarcık-FUS platformlarının daha hızlı çevirisi için tercih edilen malzeme haline getirir. Ayrıca, lipid kabuklu terapötik FUS karşılaştırmalarına karşı birkaç kafa kafaya polimer, lipid kabuklarının daha fazla damar geçirgenliğini, daha hızlı FUS ile tetiklenen ilaç salınımını, daha güçlü doku ablasyonunu ve yüksek yoğunluklu FUS paradigmalarında daha hızlı sıcaklık artışlarını kolaylaştırdığını göstermektedir 60,61,62. Toplu olarak, lipid mikro kabarcıkları bu nedenle terapötik-FUS uygulamaları için diğer kabuk varyantlarından daha yaygın olarak incelenmiştir. Buna göre, mevcut radyoetiketleme protokolünün lipid mikro kabarcıkları üzerindeki odağı, daha geniş mikro kabarcık-FUS alanınınkiyle uyumludur.
Mikro kabarcık-FUS mekanizmalarını ve kargo yüklü mikro kabarcık tasarımlarını bilgilendirmenin ötesinde, radyoaktif işaretli mikro kabarcıklar ayrıca radyoterapi için önerilen faydalara sahiptir27. FUS ve radyofanotik aktiviteyi tek bir ajan içinde birleştirmeye olan ilgi, mikrokabarcık-FUS'un radyoterapi antineoplastik yanıtı güçlendirmek için radyoterapi ile sinerjik olarak hareket ettiğine dair kanıtlar üzerine inşa edilmiştir16. Mevcut radyoetiketleme protokolü, böyle bir radyoteranostik mikro kabarcık oluşturmak için bakır-64 yerine bakır-67 (radyoterapi63 için daha uygun) kullanacak şekilde uyarlanabilir. Bununla birlikte, mevcut lipid mikro kabarcık radyoetiketleme stratejisinin temeli üzerinde tamamlanan farmakokinetik çalışma, mikro kabarcık kabuklarının15 yüksek hepatosplenik birikimini göstermiştir. Bu hedef dışı birikim, radyoaktif işaretli mikro kabarcıklar ikili FUS/radyoterapi ajanları olarak uygulanmışsa önemli bir husustur.
Bu bağlamda, hepatosplenik toksisite azaltma stratejilerine ihtiyaç duyulacaktır. Örneğin, Navarro-Becerra ve Borden64 tarafından kapsamlı bir şekilde gözden geçirildiği gibi, çok sayıda yazar, biyotin / avidin eşleşmesi ve elektrostatik absorpsiyon yoluyla tümör hedefleme ligandları (örneğin, VEGFR2 mAb, RGD, folat) ile lipid mikro kabarcıklarını işlevselleştirmiştir. Bu biyofonksiyonelleştirme, tümörlere kabuk yüklü kargo iletimini arttırır, hedef dışı doku birikimini azaltır ve tümör tedavisini geliştirir 32,65,66. İşlevselleştirme doğası gereği tipik olarak elektrostatik olduğundan, mevcut radyoetiketleme ve mikro kabarcık üretim protokolü, ligand absorpsiyonundan önce olduğu gibi kullanılabilir. Kovalent olarak dahil edilmesi gereken ısıya duyarlı peptit ve protein ligandlarını (örneğin, PEG-lipid konjuge peptitler) barındırmak için radyo etiketleme protokolünde ayarlamalar gerekebilir. Bu durumlarda, şelasyon reaksiyon süresi, reaksiyon sıcaklığı 37 ° C'ye düşürülürken uzatılabilir, bu da hedefleme yeteneklerini korurken lipoprotein nanopartikülleri içinde verimli porfirin-bakır şelasyonu sağlayan bir yaklaşımdır34. Bununla birlikte, radyoaktif işaretli mikro kabarcıkların yüzeyine hedefleme ligandlarının eklenmesinin, daha yüksek doz bakır-67 mikro kabarcık radyoterapisi ile ilişkili hepatosplenik toksisite endişelerini tamamen hafifletmesi olası değildir. Örneğin, p-selektin antikorları ile mikro kabarcıkların işlevselleştirilmesi, farelerde tümör iletimini iki katına çıkardı ve karaciğer birikimini 4 kat azalttı, ancak karaciğer birikimi enjeksiyondan 1 saat sonra hala% 9 ID / g (tümör birikiminin iki katı kadar yüksek)idi 32. Ligandları hedeflemek için daha umut verici bir alternatif, intratümöral enjeksiyon yoluyla radyoterapötik mikro kabarcıkların lokorejyonel olarak verilmesi olabilir. Mikrokabarcıkların uygulanmasının atipik bir yolu olmasına rağmen, mikrokabarcıkların intratümöral enjeksiyonunun Bizmuth ve ark.39 tarafından tek bir 60 s (MI 0.9) FUS tedavisi ile güçlü tümör ablasyonu (%50 doku perforasyonu) elde ettiği gösterilmiştir. Söz konusu mikro kabarcıkların ek radyoterapötik yeteneklere sahip olması durumunda daha da güçlü tümör ablasyonu beklenebilir. Bu amaçla, gelecekteki çalışmalar, tümör hipoksisinihafifleterek mikro kabarcık-FUS / radyoterapi sinerjisini daha da geliştirmek için radyoaktif işaretli mikro kabarcıklarda oksijen çekirdeklerinin kullanılmasından da yararlanabilir 67,68. İkili FUS/radyoterapötik ajanlar olarak uygulanmadan önce, intratümöral olarak verilen radyoaktif işaretli mikro kabarcıklar, lokorejyonel iletimin sistemik sızıntıya neden olmadığından emin olmak için farmakokinetik olarak değerlendirilmelidir. Bu, mevcut çalışma tarafından mümkün kılınan radyoaktif işaretli mikro kabarcıkların önerilen tüm uygulamalarında radyotracing'in içsel önemini vurgulamaktadır.
Özetle, mevcut protokol mikro kabarcık radyoetiketlemede ilerlemeler sağlar. Kolektif avantajları arasında gelişmiş "topraklama" şelatör katılımı, yüksek şelasyon verimliliği, etiketleme sonrası serbest radyoizotop veya şelatör saflaştırmasının olmaması, mikro kabarcık fizikokimyasal özelliklerinin korunması, çeşitli mikro kabarcık formülasyonlarında çok yönlü uygulama, alternatif şelatörlere ve floroforlara uyarlanabilirlik ve şelatör bileşiminin özelleştirilmesi ve ilişkili multimodalite ve partikül boyutu. Sonuç olarak, mikro kabarcık-FUS'un mekanik içgörülerini ve teranostik yeteneklerini geliştirebilen özel radyo ve/veya floresan aktif mikro kabarcıklar sağlar. Bu uygulamalar, temsili, kantitatif farmakokinetik verilerin elde edilmesini, mikro kabarcık multimodal görüntüleme yeteneklerinin genişletilmesini, görüntü kılavuzluğunda tedavi optimizasyonunun kolaylaştırılmasını ve sinerjik mikro kabarcık-FUS radyo (ve/veya porfirin) tedavilerinin etkinleştirilmesini içerebilir.
Açıklamalar
Yazarlar herhangi bir çıkar çatışması bildirmemiştir.
Teşekkürler
Deborah Scollard ve Teesha Komal'a (Üniversite Sağlık Ağı Uzaysal-Zamansal Hedefleme ve Radyasyon Yanıtının Amplifikasyonu (STTARR) programı, Toronto, Ontario) teknik hizmetleri ve rehberlikleri için teşekkür ederiz. Ayrıca Mark Zheng ve Dr. Alex Dhaliwal'a konfokal mikroskopi sırasındaki teknik yardımları için ve ilgili ekipmanı sağladıkları için Gelişmiş Optik Mikroskopi Tesisi'ne (Toronto, Ontario) teşekkür ederiz. Finansman kaynaklarımızı kabul ediyoruz: Kanada Sağlık Araştırmaları Enstitüleri, Terry Fox Araştırma Enstitüsü, Kanada Doğa Bilimleri ve Mühendislik Araştırma Konseyi, Kanada İnovasyon Vakfı, Prenses Margaret Kanser Vakfı, Kanada Araştırma Koltukları Programı, McLaughlin Merkezi, Vanier Burs Programı, Ontario Lisansüstü Öğrenci Burs Programı, Prostat Kanseri Kanada ve Peterborough K. M. Hunter Yardım Vakfı.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 64CuCl2 | Washington University School of Medicine, Mallinckrodt Institute of Radiology | N/A | Order in small volume (<10 µL) dissolved in 0.1 N HCl |
| Acetic acid | Any company | ≥ 95% purity | |
| Aluminum foil | Any company | ||
| Ammonium acetate | Any company | Purity: ≥ 98% | |
| Balance - analytical | Any company | Able to measure down to 0.1 mg | |
| Bath sonicator | Any company | Can be heated to 69 oC | |
| CC aperture - 30 micron | Beckman Coulter | A36391 | Particle diameter range: 0.6-18 um |
| CC electrolyte | Beckman Coulter | 8546719 | Isoton II diluent |
| CC Software | Beckman Coulter | Multisizer 4e | |
| Centrifuge filter units (0.5 mL 30,000 MWCO) with compatible microcentrifuge tubes | MilliporeSigma | UFC503096 | Amicon Ultra - 0.5 mL |
| Centrifuge tubes - 15 mL with caps | Any company | ||
| Chloroform | Any company | Purity: ≥ 99.8% | |
| Coulter counter | Beckman Coulter | B43905 | Multisizer 4e Coulter Counter |
| Cover slips | VWR | 48393081 | VWR micro cover glass |
| CuCl2 | Any company | Ensure not oxidized | |
| CuCl2 | |||
| Cuvette- quarts, 1 cm path length | Any company | ||
| Cuvettes - 10 mL plastic for CC measurements | Beckman Coulter | A35471 | Coulter Counter Accuvette ST |
| ddH2O | Any company | Can be obtained through an ultrapure water purification system | |
| DiI (1,1'-Dioctadecyl-3,3,3',3'-Tetramethylindocarbocyanine Perchlorate) | Any company | Powder form | |
| Dose calibrator | Any company | Able to read copper-64 | |
| DPPA (1,2-dipalmitoyl-sn-glycero-3-phosphate (sodium salt)) | Avanti Polar Lipids | 830855P | Powder form |
| DPPC (1,2-dipalmitoyl-sn-glycero-3-phosphocholine) | Avanti Polar Lipids | 850355P | Powder form |
| DPPE-MPEG (1,2-dipalmitoyl-sn-glycero-3-phosphoethanolamine-N-[methoxy(polyethylene glycol)-5000] (ammonium salt)) | Avanti Polar Lipids | 880200P | Powder form |
| DTPA-lipid (1,2-dipalmitoyl-sn-glycero-3-phosphoethanolamine-N-diethylenetriaminepentaacetic acid (ammonium salt)) | Avanti Polar Lipids | 790106P | Powder form |
| EDTA (Ethylenediaminetetraacetic acid) | Any company | ||
| Gamma counter | Any company | Able to read copper-64 | |
| Gamma counting tube push caps | Globe Scientific | 22-171-665 | Flanged plug caps for 12 mm tubes |
| Gamma counting tubes | Sarstedt | 55.1579 | 5 mL, 75 x 12 mm, PS |
| Glass beaker - 250 mL | Any company | Able to withstand temperatures up to 100 oC | |
| Glass drying oven | Any company | Can be heated to 80 oC | |
| Glass microliter syringes - 25, 50, 100, 1000 µL | Any company | Compatible with organic solvents | |
| Glass scintillation vials - 20 mL | VWR | 66022-081 | VWR® Scintillation Vials, Borosilicate Glass, with Screw Caps, With pulp foil liner |
| Glass vials - 0.5 dram | VWR | 66011-020 | VWR Vial 1/2 dram, with black phenolic screw cap and polyvinyl-faced pulp liner |
| Glycerol | Sigma Aldrich | G7757-1L | Purity: ≥ 99.0% |
| Graduated pipette/gun | Any company | ||
| Hot/stir plate | Equipped with temperature prob for automatic tempearture control | ||
| Hydrochloric acid - 0.1 N | Any company | ||
| iTLC plates | Agilent | A120B12 | iTLC-SA chromatography paper |
| Laboratory tissues | Any company | ||
| Media vaccuum filtration unit | Any company | 0.22 micron pore size, PES membrane, 500 mL funnel capacity | |
| Methanol | Any company | Purity: ≥ 99.8%, HPLC grade, meets ACS specifications | |
| Microcentrifuge tubes non sterile - 1.5 mL | Any company | ||
| Microcentrifuge tubes sterile - 1.5 mL | Any company | ||
| Micropipetes - p1000, p200, p20, p10 | Any company | Ensure are calibrated | |
| Microscope slides | Fisher Scientific | 12-550-15 | Superfrost Plus Microscope Slides Precleaned |
| Needles - 18 G | Sterile | ||
| Parafilm | Any company | ||
| PBS | Sigma Aldrich | D8537-500ML | DPBS, modified, without calcium chloride and magnesium chloride, liquid, sterile-filtered, suitable for cell culture |
| PFP | FluoroMed | APF-N40HP | Purity: ≥ 99.8% |
| PFP line | Any company | 1/4 inch diameter plastic hose cut about 50 cm in length | |
| PFP regulator | Swagelok | SS-1RF4 and SS-4HC-1-4 | |
| pH meter | Any company | ||
| pH standards 4 and 7 | Any company | ||
| Pipette tips for p1000, p200, p10 - non sterile | Any company | ||
| Pipette tips for p1000, p200, p10 - sterile | Any company | ||
| Plastic syringe - 1 mL | Any company | Sterile | |
| Propylene glycol | BioShop | PRO888.500 | Purity: ≥ 99.5% |
| Pyro-lipid | N/A | Made in-house | |
| Rubber tipped forceps | Any company | Mix of fine-tipped and flat/square edges recommended | |
| Scissors | Any company | ||
| Sodium hydroxide - 1 N | Any company | ||
| Sodium hydroxide - 10 N | Any company | ||
| Spectrofluorometer | Any company | Capable of 410 nm excitation and 600-850 nm emission | |
| Spectrofluorometry software | Horiba | FluorEssence | |
| Spectrometer | Any company | ||
| Syringe - 1 mL | Any company | Disposible, plastic, sterile | |
| Syringe filters - 0.2 micron pore size | Any company | Membrane material: PES or other compatible with ammonium acetate/acetic acid and PBS | |
| Test tube - 10 mL | |||
| Triton X-100 | Any company | ||
| Vacuum desicator/vacuum | Any company | ||
| Vialmix | Lantheus Medical Imaging | 515030-0508 | Referred to in protocol as a mechanical vial shaker |
| Weigh paper | Any company | To avoid losing product, cutting weigh paper into 3x3 cm squares is recommended |
Referanslar
- Itani, M., Mattrey, R. F. The effect of inhaled gases on ultrasound contrast agent longevity in vivo. Mol Imaging Biol. 14 (1), 40-46 (2012).
- Kong, W. T., Wang, W. P., Huang, B. J., Ding, H., Mao, F. Value of wash-in and wash-out time in the diagnosis between hepatocellular carcinoma and other hepatic nodules with similar vascular pattern on contrast-enhanced ultrasound. J Gastroenterol Hepatol. 29 (3), 576-580 (2014).
- Wilson, S. R., Burns, P. N. Microbubble-enhanced us in body imaging: What role. Radiology. 257 (1), 24-39 (2010).
- Hynynen, K., Mcdannold, N., Vykhodtseva, N., Jolesz, F. Noninvasive mr imaging-guided focal opening of the blood-brain barrier bbb in rabbits. Radiology. 220 (3), 640-646 (2001).
- He, W., et al. Enhanced ablation of high intensity focused ultrasound with microbubbles: An experimental study on rabbit hepatic vx2 tumors. Cardiovasc Intervent Radiol. 34 (5), 1050-1057 (2011).
- Lipsman, N., et al. Blood-brain barrier opening in alzheimer's disease using mr-guided focused ultrasound. Nat Commun. 9 (1), 2336 (2018).
- Burke, C. W., Klibanov, A. L., Sheehan, J. P., Price, R. J. Inhibition of glioma growth by microbubble activation in a subcutaneous model using low duty cycle ultrasound without significant heating. J Neurosurg. 114 (6), 1654-1661 (2011).
- Dimcevski, G., et al. A human clinical trial using ultrasound and microbubbles to enhance gemcitabine treatment of inoperable pancreatic cancer. J Control Release. 243, 172-181 (2016).
- Haram, M., Hansen, R., Bouget, D., Myhre, O. F., Davies, C. L., Hofsli, E. Treatment of liver metastases with focused ultrasound and microbubbles in patients with colorectal cancer receiving chemotherapy. Ultrasound Med Biol. 49 (9), 2081-2088 (2023).
- Mainprize, T., et al. Blood-brain barrier opening in primary brain tumors with non-invasive MR-guided focused ultrasound: A clinical safety and feasibility study. Sci Rep. 9 (1), 321 (2019).
- Karakatsani, M. E., et al. Focused ultrasound mitigates pathology and improves spatial memory in alzheimer's mice and patients. Theranostics. 13 (12), 4102-4120 (2023).
- Aron, M., Vince, O., Gray, M., Mannaris, C., Stride, E. Investigating the role of lipid transfer in microbubble-mediated drug delivery. Langmuir. 35 (40), 13205-13215 (2019).
- Wang, S., Samiotaki, G., Olumolade, O., Feshitan, J. A., Konofagou, E. E. Microbubble type and distribution dependence of focused ultrasound-induced blood-brain barrier opening. Ultrasound Med Biol. 40 (1), 130-137 (2014).
- Huynh, E., Rajora, M. A., Zheng, G. Multimodal micro, nano, and size conversion ultrasound agents for imaging and therapy. Wiley Interdiscip Rev Nanomed Nanobiotechnol. 8 (6), 796-813 (2016).
- Rajora, M. A., et al. Quantitative pharmacokinetics reveal impact of lipid composition on microbubble and nanoprogeny shell fate. Adv Sci. 11 (4), 2304453 (2024).
- Leong, K. X., Sharma, D., Czarnota, G. J. Focused ultrasound and ultrasound stimulated microbubbles in radiotherapy enhancement for cancer treatment. Technol Cancer Res Treat. 22, 1-9 (2023).
- Li, Y., et al. Ultrasound-triggered release of sinoporphyrin sodium from liposome-microbubble complexes and its enhanced sonodynamic toxicity in breast cancer. Nano Research. 11, 1038-1056 (2017).
- Nomikou, N., Fowley, C., Byrne, N. M., Mccaughan, B., Mchale, A. P., Callan, J. F. Microbubble-sonosensitiser conjugates as therapeutics in sonodynamic therapy. Chem Commun. 48 (67), 8332-8334 (2012).
- Chakravarty, R., Hong, H., Cai, W. Positron emission tomography image-guided drug delivery: Current status and future perspectives. Mol Pharm. 11 (11), 3777-3797 (2014).
- Delalande, A., Leduc, C., Midoux, P., Postema, M., Pichon, C. Efficient gene delivery by sonoporation is associated with microbubble entry into cells and the clathrin-dependent endocytosis pathway. Ultrasound Med Biol. 41 (7), 1913-1926 (2015).
- Sheikov, N., Mcdannold, N., Vykhodtseva, N., Jolesz, F., Hynynen, K. Cellular mechanisms of the blood-brain barrier opening induced by ultrasound in presence of microbubbles. Ultrasound Med Biol. 30 (7), 979-989 (2004).
- Conway, G. E., Paranjape, A. N., Chen, X., Villanueva, F. S. Development of an in vitro model to study mechanisms of ultrasound-targeted microbubble cavitation-mediated blood-brain barrier opening. Ultrasound Med Biol. 50 (3), 425-433 (2024).
- Hu, S., Zhang, X., Unger, M., Patties, I., Melzer, A., Landgraf, L. Focused ultrasound-induced cavitation sensitizes cancer cells to radiation therapy and hyperthermia. Cells. 9 (12), 2595 (2020).
- Zhao, C., et al. Synergistically augmenting cancer immunotherapy by physical manipulation of pyroptosis induction. Phenomics. , (2024).
- Tachibana, K., Uchida, T., Ogawa, K., Yamashita, N., Tamura, K. Induction of cell-membrane porosity by ultrasound. Lancet. 353 (9162), 1409 (1999).
- Arif, W. M., et al. Focused ultrasound for opening blood-brain barrier and drug delivery monitored with positron emission tomography. J Control Release. 324, 303-316 (2020).
- Da Ros, V., et al. PVA-microbubbles as a radioembolization platform: Formulation and the in vitro proof of concept. Pharmaceutics. 15 (1), 217 (2023).
- Tartis, M. S., et al. Dynamic micropet imaging of ultrasound contrast agents and lipid delivery. J Control Release. 131 (3), 160-166 (2008).
- Willmann, J. K., et al. Targeted microbubbles for imaging tumor angiogenesis: Assessment of whole-body biodistribution with dynamic micro-pet in mice. Radiology. 249 (1), 212-219 (2008).
- Ingram, N., et al. Ultrasound-triggered therapeutic microbubbles enhance the efficacy of cytotoxic drugs by increasing circulation and tumor drug accumulation and limiting bioavailability and toxicity in normal tissues. Theranostics. 10 (24), 10973-10992 (2020).
- Hernández-Gil, J., et al. Development of 68ga-labelled ultrasound microbubbles for whole-body pet imaging. Chem Sci. 10 (215), 5603-5615 (2019).
- Warram, J. M., et al. Biodistribution of p-selectin targeted microbubbles. J Drug Target. 22 (5), 387-394 (2014).
- Liu, T. W., Macdonald, T. D., Shi, J., Wilson, B. C., Zheng, G. Intrinsically copper-64-labeled organic nanoparticles as radiotracers. Angew Chem Int Ed Engl. 51 (52), 13128-13131 (2012).
- Rajora, M. A., et al. Tailored theranostic apolipoprotein e3 porphyrin-lipid nanoparticles target glioblastoma. Chem Sci. 8 (8), 5371-5384 (2017).
- Yoo, K., Dhaliwal, A., Chen, J., Sheeran, P. S., Zheng, G. Synthesis and characterization of multi-modal phase-change porphyrin droplets. J Vis Exp. 176, e62665 (2021).
- Lovell, J. F., et al. Porphysome nanovesicles generated by porphyrin bilayers for use as multimodal biophotonic contrast agents. Nat Mater. 10 (4), 324-332 (2011).
- Huynh, E., Jin, C. S., Wilson, B. C., Zheng, G. Aggregate enhanced trimodal porphyrin shell microbubbles for ultrasound, photoacoustic, and fluorescence imaging. Bioconjug Chem. 25 (4), 796-801 (2014).
- Mcmahon, D., Hynynen, K. Acute inflammatory response following increased blood-brain barrier permeability induced by focused ultrasound is dependent on microbubble dose. Theranostics. 7 (16), 3989-4000 (2017).
- Bismuth, M., Katz, S., Rosenblatt, H., Twito, M., Aronovich, R., Ilovitsh, T. Acoustically detonated microbubbles coupled with low frequency insonation: Multiparameter evaluation of low energy mechanical ablation. Bioconjug Chem. 33 (6), 1069-1079 (2022).
- Kutscher, H. L., et al. Threshold size for optimal passive pulmonary targeting and retention of rigid microparticles in rats. J Control Release. 143 (1), 31-37 (2010).
- You, Y., et al. Porphyrin-grafted lipid microbubbles for the enhanced efficacy of photodynamic therapy in prostate cancer through ultrasound-controlled in situ accumulation. Theranostics. 8 (6), 1665-1677 (2018).
- Chen, X., Qin, B., Whitehurst, D., Helfield, B., Lavery, L., Villanueva, F. S. Sonodynamic therapy using protoporphyrin ix encapsulated microbubbles inhibits tumor growth. 2017 IEEE International Ultrasonics Symposium. , 1-4 (2017).
- Cheng, M. H. Y., et al. Targeted theranostic 111in/lu-nanotexaphyrin for spect imaging and photodynamic therapy. Mol Pharm. 19 (6), 1803-1813 (2022).
- Cheng, M. H. Y., Cevallos, A., Rajora, M. A., Zheng, G. Fast, facile, base-free microwave-assisted metallation of bacteriochlorophylls and corresponding high yield synthesis of tookad. J Porphyrins Phthalocyanines. 25 (07n08), 703-713 (2021).
- Macdonald, T. D., Liu, T. W., Zheng, G. An MRI-sensitive, non-photobleachable porphysome photothermal agent. Angew Chem Int Ed Engl. 53 (27), 6956-6959 (2014).
- Shao, S., et al. Functionalization of cobalt porphyrin-phospholipid bilayers with his-tagged ligands and antigens. Nat Chem. 7 (5), 438-446 (2015).
- Teh, J. H., et al. A kit-based aluminium-[(18)f]fluoride approach to radiolabelled microbubbles. Chem Commun (Camb). 57 (88), 11677-11680 (2021).
- Rajora, M. A. . Supramolecular Structure-Enabled Delivery of Porphyrin to Glioblastomas Beyond the Blood-Brain Barrier [Doctor of Philosophy thesis]. , (2024).
- Carugo, D., et al. Modulation of the molecular arrangement in artificial and biological membranes by phospholipid-shelled microbubbles. Biomaterials. 113, 105-117 (2017).
- Dhaliwal, A. . Utilizing Porphyrin to Improve Ultrasound-Activated Supramolecular Agent Design for Solid Tumor Delivery [Doctor of Philosophy thesis]. , (2023).
- Kilroy, J. P., Klibanov, A. L., Wamhoff, B. R., Bowles, D. K., Hossack, J. A. Localized in vivo model drug delivery with intravascular ultrasound and microbubbles. Ultrasound Med Biol. 40 (10), 2458-2467 (2014).
- Dhaliwal, A., et al. Deep learning for automatic organ and tumor segmentation in nanomedicine pharmacokinetics. Theranostics. 14 (3), 973-987 (2024).
- Shakya, G., Cattaneo, M., Guerriero, G., Prasanna, A., Fiorini, S., Supponen, O. Ultrasound-responsive microbubbles and nanodroplets: A pathway to targeted drug delivery. Adv Drug Deliv Rev. 206, 115178 (2024).
- Honari, A., Merillat, D. A., Bellary, A., Ghaderi, M., Sirsi, S. R. Improving release of liposome-encapsulated drugs with focused ultrasound and vaporizable droplet-liposome nanoclusters. Pharmaceutics. 13 (5), 609 (2021).
- Barmin, R. A., et al. Polymeric materials for ultrasound imaging and therapy. Chem Sci. 14 (43), 11941-11954 (2023).
- Chen, Y., Liang, Y., Jiang, P., Li, F., Yu, B., Yan, F. Lipid/PLGA hybrid microbubbles as a versatile platform for noninvasive image-guided targeted drug delivery. ACS Appl Mater Interfaces. 11 (45), 41842-41852 (2019).
- Barmin, R. A., et al. Engineering the acoustic response and drug loading capacity of pbca-based polymeric microbubbles with surfactants. Mol Pharm. 19 (9), 3256-3266 (2022).
- Barrefelt, A. A., et al. Multimodality imaging using SPECT/CT and MRI and ligand functionalized 99mTc-labeled magnetic microbubbles. EJNMMI Res. 3 (1), 12 (2013).
- Song, R., Hu, D., Chung, H. Y., Sheng, Z., Yao, S. Lipid-polymer bilaminar oxygen nanobubbles for enhanced photodynamic therapy of cancer. ACS Appl Mater Interfaces. 10 (43), 36805-36813 (2018).
- Böhmer, M. R., Chlon, C. H. T., Raju, B. I., Chin, C. T., Shevchenko, T., Klibanov, A. L. Focused ultrasound and microbubbles for enhanced extravasation. J Control Release. 148 (1), 18-24 (2010).
- Zhang, S., et al. Compare ultrasound-mediated heating and cavitation between flowing polymer- and lipid-shelled microbubbles during focused ultrasound exposures. J Acoust Soc Am. 131 (6), 4845-4855 (2012).
- Cao, Y., et al. Drug release from phase-changeable nanodroplets triggered by low-intensity focused ultrasound. Theranostics. 8 (5), 1327-1339 (2018).
- Krasnovskaya, O. O., et al. Recent advances in (64)cu/(67)cu-based radiopharmaceuticals. Int J Mol Sci. 24 (11), 9154 (2023).
- Navarro-Becerra, J. A., Borden, M. A. Targeted microbubbles for drug, gene, and cell delivery in therapy and immunotherapy. Pharmaceutics. 15 (6), 1625 (2023).
- Fan, C. -. H., et al. Antiangiogenic-targeting drug-loaded microbubbles combined with focused ultrasound for glioma treatment. Biomaterials. 34 (8), 2142-2155 (2013).
- Luo, T., et al. Ultrasound-mediated destruction of oxygen and paclitaxel loaded dual-targeting microbubbles for intraperitoneal treatment of ovarian cancer xenografts. Cancer Lett. 391, 1-11 (2017).
- Fix, S. M., et al. Oxygen microbubbles improve radiotherapy tumor control in a rat fibrosarcoma model - a preliminary study. PLoS One. 13 (4), e0195667 (2018).
- Eisenbrey, J. R., et al. Sensitization of hypoxic tumors to radiation therapy using ultrasound-sensitive oxygen microbubbles. Int J Radiat Oncol Biol Phys. 101 (1), 88-96 (2018).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır