Method Article
Изготовление и маркировка микропузырьков с помощью флуоресцентных и радиоактивных индикаторов
В этой статье
Резюме
В этом протоколе описывается изготовление липидных микропузырьков и совместимый метод радиоактивного мечения микропузырьков с эффективностью мечения без очистки >95% и сохранением физико-химических свойств микропузырьков. Этот метод эффективен для различных составов липидных микропузырьков и может быть адаптирован для создания радиоактивных и/или флуоресцентных микропузырьков.
Аннотация
Микропузырьки — это заполненные газом частицы в липидной оболочке, которые превратились из сосудистых ультразвуковых контрастных веществ в революционные платформы для лечения рака. В сочетании с терапевтическим сфокусированным ультразвуком (FUS) они могут безопасно и локально преодолевать физиологические барьеры (например, гематоэнцефалический барьер), доставлять лекарства к недоступным иначе видам рака (например, глиобластоме и раку поджелудочной железы) и лечить нейродегенеративные заболевания. Терапевтический арсенал микропузырьковой ФУС развивается в новых направлениях, включая синергетическую комбинированную лучевую терапию, мультимодальную визуализацию, а также комплексную загрузку и доставку лекарств из оболочек микропузырьков.
Мечение микропузырьков радиоиндикаторами является ключом к созданию этих расширенных тераностических возможностей. Тем не менее, существующие стратегии радиоактивного мечения микропузырьков основаны на методологиях очистки, которые, как известно, нарушают физико-химические свойства микропузырьков, используют короткоживущие радиоизотопы и не всегда приводят к стабильному хелатированию. В совокупности это создает неопределенность в отношении точности микропузырьковой радиовизуализации и эффективности доставки радиоизотопов опухолей.
В этом протоколе описывается новая методология мечения микропузырьков в одном котле, не требующая очистки, которая сохраняет физико-химические свойства микропузырьков при достижении эффективности хелатирования радиоизотопов >95%. Он универсален и может успешно применяться в специализированных и коммерческих микропузырьковых составах с различной длиной ацильной липидной цепи, зарядом и составом хелатора/зонда (порфирин, DTPA, DiI). Его можно адаптивно применять при изготовлении микропузырьков и к готовым рецептурам микропузырьков с модульной настраиваемостью флуоресценции и мультимодальных флуоресцентных/радиоактивных свойств. Соответственно, этот гибкий метод позволяет производить специализированные, отслеживаемые (радио, флуоресцентные или радио/флуоресцентные активные) мультимодальные микропузырьки, которые полезны для совершенствования механистических, визуализирующих и терапевтических микропузырьковых применений-FUS.
Введение
Микропузырьки представляют собой надмолекулярные тераностики микронного размера с газовым ядром, стабилизированным белком, полимером или, в большинстве случаев, липидной оболочкой (рис. 1А). При введении в кровоток микропузырьки сохраняют границы раздела газ/жидкость, которые обнаруживаются ультразвуком в течение нескольких минут до растворения их газовых ядер 1,2. Следовательно, первое клиническое использование микропузырьков было в качестве контрастных веществ для ультразвуковой визуализации в реальном времени3. Изобретение терапевтического сфокусированного ультразвука (FUS) расширило клинические возможности микропузырьков. При стимуляции низкочастотным FUS микропузырьки колеблются и генерируют целевые, настраиваемые механические силы в диапазоне от транзиторной проницаемости сосудов до фокальной абляции тканей 4,5. В результате, за последние 20 лет микропузырьковый FUS был исследован для открытия гематоэнцефалического барьера (ГЭБ), доставки лекарств и зондов для визуализации, терапии нейродегенеративных заболеваний и абляции рака 6,7,8,9,10,11.
Тераностический арсенал микропузырьков продолжает развиваться в новых и захватывающих направлениях. Традиционные приложения для доставки микропузырьков FUS основаны на совместном введении терапевтического или визуализирующего груза вместе с коммерческими микропузырьками. Растет интерес к расширению возможностей доставки микропузырьков-FUS за счет понимания взаимодействия оболочки микропузырька с биологией, изучения индивидуальных некоммерческих составов микропузырьков и создания тераностических микропузырьков «все в одном» с грузом, загруженным непосредственно на оболочку микропузырька 12,13,14. На самом деле, примерно в 40% исследований доставки лекарств с помощью липидных микропузырьков используются такие микропузырьки, наполненные оболочкой. Помимо визуализации и доставки лекарств, микропузырьковый FUS также показал многообещающие результаты в улучшении лучевой терапии рака16 и активации противоопухолевых эффектов доброкачественных агентов, нагруженных оболочкой, с помощью сонодинамической терапии17,18.
Эти традиционные и расширенные направления в применении микропузырькового рака могут быть более стратегически продвинуты путем маркировки оболочек микропузырьков радиоактивными индикаторами. В области микропузырьков, нагруженных грузом «все в одном», такая радиоактивная маркировка 1) способствует количественной оценке золотого стандарта биораспределения этих нагруженных оболочек микропузырьков на мишени и вне их, 2) выводит фармакокинетические взаимосвязи между структурой и активностью, которые информируют об оптимальном выборе композиций микропузырьков для максимизации доставки к мишени, и 3) определяет стратегические и надлежащие методы применения и планирования лечения под визуальным контролем (например, типы тканевых мишеней, дозиметрия, выбор лекарств для смягчения нецелевых проблем безопасности, полезность по сравнению с традиционными парадигмами совместного лечения) систем «все в одном» с грузом15,19. На доклинической стадии такое понимание судьбы оболочки микропузырька может также пролить свет на более широкие механизмы действия микропузырьков-FUS. Например, было показано, что перенос липидов из оболочек микропузырьков в клетки-мишени влияет на сонопорацию с поддержкой FUS12,20. Таким образом, понимание и оптимизация такого переноса могут быть использованы для доклинической и клинической микропузырьковой FUS-терапии, в которой участвует сонопорация (трансфекция in vitro, доставка лекарств, абляция опухоли, лучевая сенсибилизация и сонодинамическая терапия) 20,21,22,23,24,25). Двойные ультразвуковые и радиовизуальные установки также позволили бы осуществлять мониторинг вскрытия сосудов FUS и лечения (например, кинетика открытия ГЭБ) с помощью одного агента, а не обычных конструкций с двумя агентами26. Аналогичным образом, липидное микропузырьковое радиомечение может служить в качестве универсальной альтернативы платформам совместной доставки микропузырьковых микропузырьков/лучевой терапии с использованием одного агента microbubble-FUS + радиофармацевтических препаратов27.
Хрупкость микропузырьков является нетривиальной проблемой для такой маркировки. Все существующие стратегии радиоактивного мечения ограничены методами очистки, которые, как известно, нарушают стабильность и размер микропузырьков, в то время как некоторые из них также характеризуются неэффективным и нестабильным радиоактивным мечением 28,29,30,31,32. Требования к очистке также приводят к более длительным протоколам. В сочетании с использованием короткоживущих радиоизотопов (например, 18F t1/2 1,8 ч, 28,29 99mTct 1/2 6 ч, 3268Ga t1/2 1 ч31) это создает неэффективность, связанную с распадом радиоизотопов, и ограничивает временные рамки радиовизуализации и планирования лечения. В совокупности эти ограничения чреваты получением сокращенной и нерепрезентативной радиовизуализации, неточными фармакокинетическими данными и неэффективной доставкой радиоизотопов опухолей.
В данном отчете эти ограничения преодолеваются за счет использования сильных и стабильных хелатных свойств порфирина. Порфирины представляют собой органические, гетероциклические макромолекулы с высококонъюгированным планарным кольцом и центральным координационным сайтом, который может вмещать различные металлы. К ним относятся радиоизотопы с более длительным сроком действия, такие как медь-64 (t1/2 12,7 ч), радиофармпрепарат с позитронно-эмиссионной томографией (ПЭТ) и возможности подсчета γ33. При конъюгации с липидным остовом порфирины могут быть легко включены в супрамолекулярные структуры и впоследствии мечены медью-64 с быстротой, высокой эффективностью хелатирования и стабильностью сыворотки, сохраняя при этом свойства родительских немеченых частиц33,34. Кроме того, порфирины флуоресцентно активны с модульным самогашением в нано- и микрочастицах, которое восстанавливается при разрушении частиц; дополнительное считывание к ПЭТ и подсчету γ, которое облегчает как объемный, так и микроскопический анализ судьбы раковины (рис. 1A)15.
Используя порфирин-липид в качестве хелатора, эти свойства были использованы для создания новой методологии микропузырькового радиомечения с использованием одного горшка без очистки (рис. 1B, C), которая преодолевает ограничения, связанные с существующими методами микропузырькового радиомечения. Этот протокол обеспечивает эффективность хелатирования меди-64 на >95%, не требует очистки после маркировки и сохраняет физико-химические свойства микропузырьков. Он может быть легко интегрирован в «измельченное» производство липидных микропузырьков до их активации (Рисунок 1B). Он универсален и может успешно применяться в специализированных и коммерческих микропузырьковых составах с различной длиной ациллипидной цепи (от C16 до C22), зарядом (нейтральным и анионным) и порфирин-липидными композициями (1 моль, 10 моль, 30 моль), генерируя микропузырьки с радио- и флуоресцентной активностью. Его приспособляемость также может выходить за рамки порфирина. Протокол one-pot может быть модифицирован для использования альтернативных коммерчески доступных хелаторов (например, диэтилентриамина пентаацетата (DTPA)-липида) и флуорофоров (например, DiI). Его также можно модифицировать для маркировки готовых составов микропузырьков с помощью «спайкового» подхода. Соответственно, этот метод позволяет получать специализированные, отслеживаемые (радио, флуоресцентные или двойные радио/флуоресцентные активные) микропузырьки, полезные для совершенствования механистических, визуализирующих и терапевтических микропузырьков-FUS. В приведенном ниже протоколе описывается изготовление липидных микропузырьков, применение протокола однореакторного радиоактивного мечения, необходимая радиоактивная маркировка и физико-химическая характеристика свойств, а также возможные модификации.
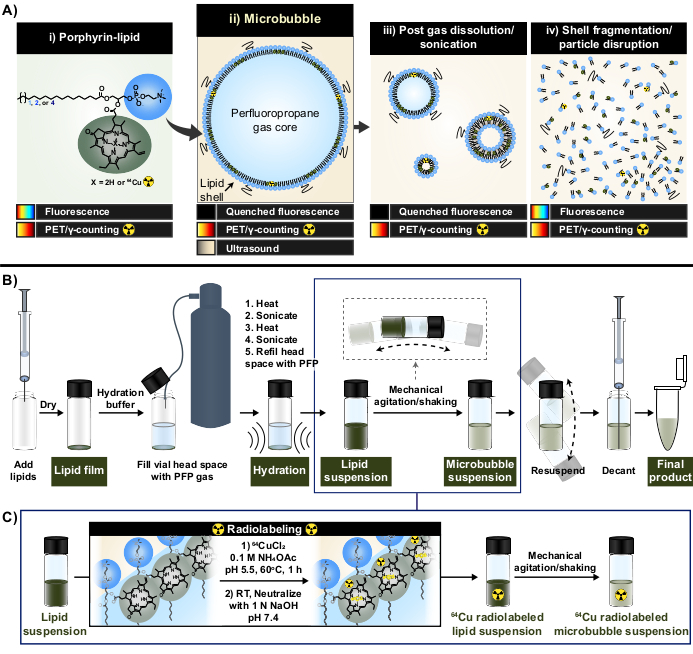
Рисунок 1: Протокол изготовления микропузырьков и радиоактивного мечения. (A) Порфирин-липид в форме пирофеофорбида-а-липида служит мультимодальным хелатором в рамках этого протокола. Будучи мономером, хелатированным до меди-64 (i), он обладает возможностями ПЭТ и визуализации. Его флуоресценция гасится в форме частиц (микропузырьков (ii) и их нанопотомства после растворения (iii)) и не гасится с разрушением частиц (iv). (B) Протокол гидратации/активации липидной пленки, описанный в этом отчете, для получения липидных микропузырьков из измельченного и (C) интеграция одноточечного радиоактивного мечения между образованием липидной суспензии и активацией микропузырьков. Этот рисунок был адаптирован с разрешения Rajora et al.15. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
протокол
1. Препараты реагентов
- Приготовьте буфер из ацетата аммония (0,1 М, pH 5,5)
- С помощью аналитических весов извесьте 770,8 мг ацетата аммония на бумаге для взвешивания. Переложите взвешенное количество в чистую стеклянную стакан объемом 250 мл.
- Добавьте в стакан 90 мл воды двойной дистилляции (ddH2O), измеренной с помощью градуированной пипетки. Добавьте мешалку и поместите стакан на магнитную пластину для перемешивания, чтобы растворить ацетат аммония. Перемешивайте со скоростью, создающей легкий вихрь, но без разбрызгивания раствора.
- Откалибруйте pH-метр в соответствии с инструкциями прибора с использованием стандартов pH 4 и 7. После калибровки вставьте датчик pH в буфер из ацетата аммония.
- Добавьте в раствор 104 мкл уксусной кислоты, перемешайте до растворения и измерьте pH.
ПРИМЕЧАНИЕ: На этом этапе pH должен быть близок к 5,5. - Отрегулируйте pH буфера, добавив 10 Н гидроксида натрия (или соляную кислоту, если буфер становится слишком основным) с шагом 5-10 мкл с помощью микропипетки. Перемешайте, измерьте pH и повторите по мере необходимости. Обратите внимание на объем добавленного основания/кислоты.
- Добавьте достаточный объем ddH2O, чтобы создать в общей сложности 100 мл буфера.
ПРИМЕЧАНИЕ: Например, если во время коррекции pH использовать 45 мкл 10 Н гидроксида натрия, то в стакан будет добавлено 9,851 мл ddH2O (100 мл [целевой объем] - 90 мл [шаг 1.1.2] - 0,104 мл [шаг 1.1.4] - 0,045 мл [шаг 1.1.5] = 9,851 мл). - Тщательно перемешайте буфер в последний раз, прежде чем переложить его в контейнер для хранения с крышкой.
- Очистите pH-метр в соответствии с инструкциями прибора.
ВНИМАНИЕ: Концентрированный водный гидроксид натрия и соляная кислота могут вызвать кожные реакции, поэтому с ними следует обращаться в перчатках.
- Приготовьте гидратационный буфер (PGG)
- Аспиратуйте фосфатно-солевой буфер (PBS) в шприц и оснастите конец полиэфирсульфоновым фильтром размером пор 0,2 мкм. Отфильтруйте PBS в чистую пластиковую центрифужную пробирку с крышкой.
ПРИМЕЧАНИЕ: Можно использовать пористые шприцевые фильтры размером 0,2 мкм из альтернативных мембранных материалов (например, поливинилиденфторида) при условии, что мембрана совместима с PBS и ацетатом аммония. - Смешайте отфильтрованный PBS, пропиленгликоль и глицерин с помощью микропипетки в объемном соотношении 8:1:1, чтобы получить гидратационный буфер (также называемый PGG). При добавлении пропиленгликоля и глицерина отсадите и сотрите все остаточные капли пропиленгликоля или глицерина с поверхности наконечника пипетки, прежде чем медленно дозировать реагент в PBS. В PBS будет наблюдаться четкая вязкая мутность, похожая на струну.
ПРИМЕЧАНИЕ: Рекомендуется использовать микропипетку p1000 для добавления PBS в центрифужную пробирку, а затем пропиленгликоля и глицерина, поскольку последние два реагента являются вязкими. Таким образом, их следует медленно отсасывать через микропипетку до тех пор, пока движение жидкости в наконечнике пипетки не исчезнет и таким образом, чтобы воздух не всасывался при извлечении наконечника пипетки из реагента. Наконечники для микропипеток с объемной маркировкой в идеале следует использовать для выбора объемов реагентов, которые соответствуют такой маркировке (например, делая 1 мл или 5 мл PGG, и соответственно используя маркировку 0,1 мл или 0,5 мл на наконечнике микропипетки для визуализации полной аспирации пропиленгликоля и глицерина). Протирая поверхность наконечника микропипетки, не протирайте отверстие наконечника, а только по бокам. - Проводите пипетку вверх и вниз кончиком пипетки в растворе до тех пор, пока реагенты не растворятся однородно. Будьте осторожны, чтобы не ввести в раствор пузырьки воздуха.
- Чтобы еще больше обеспечить полную смесь гидратационного буфера, закройте пробирку центрифуги и медленно вращайте вверх и вниз. Не делайте вихрей.
- Вращайте трубку при давлении менее 1000 x g в течение 20-30 с (минимальная температура 4 °C, максимальная RT), чтобы удалить незаметные пузырьки воздуха.
- Аспиратуйте фосфатно-солевой буфер (PBS) в шприц и оснастите конец полиэфирсульфоновым фильтром размером пор 0,2 мкм. Отфильтруйте PBS в чистую пластиковую центрифужную пробирку с крышкой.
- Подготовка буфера для гидратации/радиоактивного мечения (AA-PGG)
- Шприцевой фильтр 0,1 М, буфер из ацетата аммония pH 5,5 (с шага 1.1) и PBS в отдельные пробирки в соответствии с шагом 1.2.1.
- Смешайте отфильтрованный буфер из ацетата аммония, отфильтрованный PBS, пропиленгликоль и глицерин с помощью микропипетки p1000 в центрифужной пробирке в буфере из ацетата аммония 5:3:1:1: PBS: пропиленгликоль: объемное соотношение глицерина в указанном порядке. Следуйте инструкциям по аспирации, смешиванию и центрифугированию в соответствии с шагами 1.2.2-1.2.5, чтобы получить AA-PGG.
- Элюент тонкослойной хроматографии мгновенного действия (iTLC)
- Взвесьте до 0,1 г этилендиаминтетрауксусной кислоты (ЭДТА) и переложите в закрытый флакон. Растворите в ddH2O таким образом, чтобы образовался 2% w/v раствор ЭДТА (например, для 50 мг ЭДТА добавьте 2,5 мл ddH2O).
- Соедините 2% w/v раствор ЭДТА с буфером ацетата аммония из шага 1.1 в соотношении 9:1 об/в (90% раствор ЭДТА, 10% буфер ацетата аммония). Закройте крышкой и храните полученный элюент iTLC.
2. Образование липидных пленок
ПРИМЕЧАНИЕ: Эта процедура описывает образование липидной пленки с композициями, имитирующими коммерческий микропузырь Definity®, с порфирин-липидом, замещающим липид хозяина и составляющим 30 мол.% от общего липида. Тем не менее, протокол радиоактивного мечения может быть применен к различным липидным составам (длины цепей C16, C18, C22, нейтральный или анионный заряд, различные молярные составы порфирин-липидов). К письму прилагается дополнительная таблица (Supplementary File 1), в которой представлены расчеты, составы, массы и объемы запасов для описываемой и других рецептур. Коммерчески доступны все липиды за исключением порфирин-липидного, пирофеофорбид-а-липида (пиро-липид), синтез которого ранее был подробно описан35,36.
- Используя дополнительный файл 1, определите общую необходимую массу для каждого липида в зависимости от количества необходимых пленок.
- Взвесьте пустой стеклянный флакон 0,5 драма на аналитических весах.
ПРИМЕЧАНИЕ: Пыль препятствует успешному образованию микропузырьков. Таким образом, вдувайте воздух под давлением в флакон, чтобы удалить пыль / твердые частицы при хранении без крышки. - Взвесьте 1,2-дипальмитоил-sn-глицеро-3-фосфохолин (ДППК) на бумаге для взвешивания.
ПРИМЕЧАНИЕ: Взвешенная масса должна быть получена на этапе 2.1 плюс дополнительные 0,5-1 мг для учета любых потерь при работе с пробой на последующих этапах. - Переложите DPPC в взвешенный стеклянный флакон и повторно взвесьте его, чтобы определить липидную массу во флаконе. Этот процесс обеспечивает более легкий перенос липидов в стеклянный флакон, снижение потерь/разлива липидного порошка и более точное измерение липидной массы.
- Повторите шаги с 2.2 по 2.4 с другими липидами: 1,2-дипальмитоил-sn-глицеро-3-фосфоэтаноламин-N-[метокси(полиэтиленгликоль)-5000] (DPPE-mPEG), 1,2-дипальмитоил-sn-глицеро-3-фосфат (DPPA) и пиролипид C16.
Примечание: Если пиролипид доступен не в виде весового порошка, а в виде пленки или аликвоты в неизвестном количестве, его можно растворить в хлороформе с образованием исходного материала, концентрация которого может быть рассчитана с помощью измерений поглощения УФ-ВИД в метаноле с использованием закона Бера-Ламберта,как описано ранее. - В стеклянных пробирках с помощью микропипеток или стеклянных шприцев приготовьте следующие органические растворители и растворы: 1) хлороформ, 2) 9:1 об/в хлороформа: метанол и 3) 65:35:8 хлороформ: метанол: ddH2O. Для последнего пипеткой пипетируйте компоненты и смешивайте их в следующем порядке: ddH2O, метанол, затем хлороформ.
ВНИМАНИЕ: Метанол и хлороформ опасны для здоровья, легковоспламеняющиеся и летучие. Наденьте защитные очки, перчатки и лабораторный халат, а также используйте вытяжной шкаф. - Используйте Дополнительный файл 1 для расчета объема органического растворителя/раствора, необходимого для изготовления липидных запасов, и выберите стеклянные шприцы соответствующего объема.
ПРИМЕЧАНИЕ: Этот объем должен давать исходные концентрации, соответствующие 15-100 мкл исходных аликвот на пленку, которые можно легко измерить с помощью стеклянных микролитровых шприцев объемом 25-100 мкл. - Стеклянные шприцы трижды промыть хлороформом. Прокачивайте поршень вперед и назад, чтобы высушить шприц.
- Измерьте и добавьте органический растворитель/растворы с помощью шприца из очищенного стекла в отдельные липидные флаконы в соответствии с расчетами в таблице на шаге 2.7, чтобы сформировать запасы липидов. Растворите пиролипид в хлороформе (если он уже не растворен в соответствии с примечанием к шагу 2.5), DPPC и DPPE-mPEG в 9:1 v/v хлороформ: метанол и DPPA в 65:35:8 хлороформ:метанол:ddH2O. Если для всех добавок используется один и тот же стеклянный шприц, промойте и высушите между каждым липидом.
ПРИМЕЧАНИЕ: Если выбранный состав не содержит DPPA или его вариант с длиной цепи C18, то пиролипид, липид PC-хозяина и липид PEG могут быть растворены в хлороформе. - Закупорьте флаконы и вортекс.
- Добавьте рассчитанные объемы исходных липидных растворов в новый 0,5-драмовый стеклянный флакон (пленочный флакон) через стеклянный микролитровый шприц. Для первого липидного бульона вставьте кончик иглы в нижний центр флакона и медленно погружайте, чтобы избежать разбрызгивания стенок флакона. При последующих добавлениях поместите кончик иглы непосредственно над уровнем жидкости и коснитесь боковой стороны флакона, чтобы удалить все последние капли таким образом, чтобы не подвергать иглу воздействию жидкости, находящейся ниже.
ПРИМЕЧАНИЕ: Промойте и высушите стеклянный шприц между добавлением липидов при возникновении загрязнения. При изготовлении нескольких пленок закрывайте колбусы как пленкой, так и пробирками между добавлениями, чтобы свести к минимуму испарение растворителя. - Осторожно перемешайте флакон вручную в вертикальном положении, чтобы перемешать содержимое. Избегайте разбрызгивания раствора на стенки флакона.
- Откупорьте (сохраните крышку) и вставьте азотную линию в свободное пространство флакона. Отрегулируйте поток азота так, чтобы вызвать небольшое видимое возмущение на поверхности жидкости, но без воронки или разбрызгивания.
- Сделайте вихревой пробирку сразу после введения азотной линии. Начинают с небольшой скорости, достаточной для образования воронки с растворителем, поднимающейся не выше 1 см от дна флакона. Избегайте разбрызгивания растворителя. По мере испарения растворителя медленно и без паузы увеличивайте скорость вихря, сохраняя высоту растворителя до тех пор, пока вся жидкость не испарится. В результате на нижнюю треть флакона будет нанесена тонкая пленка.
- Поместите флакон в вакуумный эксикатор и продолжайте сушить пленку под вакуумом в течение 8-72 часов. Накройте флакон (кроме отверстия) или влагопоглотитель алюминиевой фольгой.
ПРИМЕЧАНИЕ: Протокол может быть приостановлен здесь. Следующие шаги могут быть выполнены после высыхания пленки или пленки могут храниться под аргоном, запечатанным парапленкой, в морозильной камере при температуре -20 °C до 1 месяца, и дольше, если хранить их в сухом состоянии.
3. Увлажнение липидной пленки
ПРИМЕЧАНИЕ: Если микропузырьки используются in vitro или in vivo, используйте стерильные наконечники для микропипеток, пробирки, шприцы и иглы для этапов с 3.3 по 5.4, если не указано иное.
- Снимите пленку с пылесоса или, если она хранится в морозильной камере, дайте ей нагреться до температуры температуры.
- Наполните стакан объемом 250 мл водой и нагрейте воду до 70-80 °C.
- Нагрейте ультразвуковую баню на водяной бане до 69 °C.
- Нанесите микропипеткой 1 мл AA-PGG (шаг 1.3) по краям флакона с липидной пленкой, чтобы избежать образования пузырьков.
ПРИМЕЧАНИЕ: При изготовлении нехелатированных контрольных микропузырьков или микропузырьков, содержащих только флуоресцентные лампы, используйте PGG (шаг 1.2) вместо AA-PGG. - Частично закройте отверстие флакона крышкой, оставив достаточно места для вставки линии перфторпропана (PFP). Подайте PFP в свободное пространство флакона на 20 с над жидкостью таким образом, чтобы жидкость была заметно нарушена, но не разбрызгивалась. Не подавайте PFP непосредственно в суспензию. Закройте флакон крышкой.
ПРИМЕЧАНИЕ: Если поток достаточен по силе и времени, флакон начнет остывать на ощупь. - Погрузите нижнюю половину флакона в водяную баню при температуре 70-80 °C на 1 минуту. Затем обрабатывайте ультразвуком в течение не менее 30 с в ультразвуковом аппарате для ванны при температуре 69 °C или до тех пор, пока липидная пленка равномерно не диспергируется в AA-PGG. Избегайте образования пузырьков или преждевременной активации микропузырьков (преждевременная активация будет проявляться в виде молочных/мутных участков липидной суспензии). При необходимости протрите поверхность флакона, чтобы лучше определить, остались ли невзвешенные липиды.
ПРИМЕЧАНИЕ: Если липидная пленка не увлажняется в течение 1 минуты после ультразвуковой обработки, повторно нагрейте в ванне при температуре 70-80 °C и повторно произведите ультразвуковую обработку. - После того, как липидная пленка станет однородно взвешенной, нагрейте в последний раз в течение 1 минуты и обработайте ультразвуком еще 30 секунд.
- Протрите флакон и дайте ему пассивно остыть до RT (~5-10 минут).
- Наполните свободное пространство флакона PFP в соответствии с шагом 3.5, закройте крышку и запечатайте края крышки парапленкой.
ПРИМЕЧАНИЕ: Протокол может быть приостановлен здесь и возобновлен не позднее, чем через 8 часов.
4. Радиоактивное мечение
ПРИМЕЧАНИЕ: Для нехелатных контрольных микропузырьков или микропузырьков, содержащих только флуоресцентные лампы, перейдите к разделу 5 протокола.
ВНИМАНИЕ: Выполняйте шаги 4.4-4.6 настоящего протокола в радиоактивной лаборатории, если не указано иное. 64CuCl2 представляет собой радиологическую опасность с риском мультисистемной токсичности при воздействии на кожу, вдыхании или проглатывании. По возможности обрабатывайте его в вытяжном шкафу непрямым способом с помощью щипцов с резиновыми наконечниками. При работе с ним надевайте защитный лабораторный халат, персональное кольцо и дозиметр для бейджа, а также двойную перчатку. Убедитесь, что 64CuCl2 работает с 2-дюймовым свинцовым экранированием. При необходимости транспортируйте его в контейнере со свинцовой обшивкой. Защитите контейнеры для отходов и проведите эксплуатационное обследование на предмет загрязнения после использования.
- Приготовьте водяную баню с температурой 60 °C в стеклянном стакане или большой кристаллизующей чашке с магнитной мешалкой. Используйте нагревательную пластину с регулируемой температурой, оснащенную термозондом, вставленным в воду, настроенным на перемешивание со скоростью, которая дает слабую, но заметную воронку.
- Перенесите герметичный флакон, содержащий 64CuCl2 в 0,1 Н HCl, в калибратор дозы с помощью щипцов с резиновыми наконечниками.
ПРИМЕЧАНИЕ: При заказе 64CuCl2 попросите растворить его в 5-20 мкл 0,1 Н HCl. Меньший объем имеет решающее значение для сохранения выхода микропузырьков. - Обратите внимание на активность меди-64, измеренную на калибраторе дозы, и время. Извлеките флакон с помощью щипцов и поместите его в контейнер со свинцом.
- Разделите отмеченную активность на объем, зарегистрированный для 64CuCl2, чтобы получить значение MBq·mL-1.
- Снимите липидную суспензию с шага 3.9 и закрепите ее в держателе флакона.
- Откупорьте флакон 64CuCl2 и зафиксируйте его щипцами.
- Микропипеткой объем раствора 64CuCl2 , соответствующий 40-250 МБк активности, и перенос в липидную суспензию. Убедитесь, что наконечник пипетки погружен в суспензию. Погрузите, а затем проведите пипеткой вверх и вниз, чтобы полностью передать 64CuCl2.
ПРИМЕЧАНИЕ: Количество добавляемого 64CuCl2 будет зависеть от предполагаемого применения микропузырьков, меченных радиоактивными веществами, и чувствительности калибратора дозы. Для продольного (до 48 ч после инъекции) отбора ПЭТ и забора крови in vivo у мышей рекомендуется минимум 220 МБк и 50 МБк соответственно. - Крышка как липидной суспензии, так и 64флакона CuCl2 .
- С помощью плоских щипцов с резиновыми наконечниками вручную поворачивайте радиоактивную липидную суспензию вверх и вниз не менее 5 раз, чтобы аккуратно перемешать 64CuCl2 через суспензию. Не трясите и не роняйте флакон, а также избегайте образования пузырьков.
- Когда вы находитесь правой стороной вверх, осторожно щёлкните крышку флакона, удерживая суспензию в неподвижном положении. Это поможет любой жидкости, попавшей в колпачок, притягиваться к дну флакона. Осторожно частично откупорьте флакон и вставьте в него игольчатую линию PFP 18 G. Заполните свободное пространство флакона PFP на 20 с, как указано на шаге 3.5. Закройте флакон крышкой и запечатайте парапленкой.
- Измерьте активность флакона на калибраторе дозы и запишите время.
ПРИМЕЧАНИЕ: Если адекватная активность не была перенесена во флакон, повторите шаги 4.5-4.11, добавив соответствующий дополнительный объем 64CuCl2. - Поместите флакон в держатель флакона из пенопласта и протолкните внутрь, чтобы нижняя половина флакона подвергалась воздействию тепла. Поместите держатель на водяную баню при температуре 60 °C и нагревайте в течение 1 часа.
- Пока происходит реакция хелирования, подготовьте планшеты iTLC. Надев свежие перчатки, разрежьте стеклянную бумагу для хроматографии из микрофибры на полоски размером 1 см х 8 см. Нагрейте полоски в стеклянной сушильной печи при температуре 80 °C.
ПРИМЕЧАНИЕ: Этот этап может быть выполнен в нерадиоактивной лаборатории. - Через 1 ч снимите флакон на шаге 4.12 с огня и протрите края салфеткой.
- Вращайте флакон вверх и вниз вручную с помощью щипцов с резиновыми наконечниками, чтобы конденсировать конденсат на стенках флакона в липидную суспензию.
- Когда флакон находится в вертикальном положении, задерните крышку, стабилизируя пробирку. Снимите парапленку и протрите колпачок, чтобы удалить попавшую воду из ванны.
- Осторожно откройте флакон и аспирируйте 1-2 мкл липидной суспензии. Найдите суспензию на расстоянии 1 см от центра нижней части полоски iTLC и снова закройте флакон. Дайте пятну высохнуть.
ПРИМЕЧАНИЕ: В идеале минимум 2 iTLC должны быть обнаружены на одну реакционную смесь и разработаны на каждую меченую липидную суспензию для уверенности. - Микропипетка 200 мкл элюента iTLC (полученного на этапе 1.4) на дно пробирки объемом 10 мл. Поместите пробирку в свинцовый контейнер. Добавьте пятнистый iTLC в пробирку и дайте полоске проявиться, пока элюент не окажется примерно в 1 см от верхнего края полоски.
- Снимите разработанные полоски iTLC с помощью щипцов. Держите полоску вертикально и разрежьте на три части над круглыми пластиковыми трубками объемом 5 мл объемом 5 мл с γ счетчиком и крышками так, чтобы каждая треть полоски попадала прямо в отдельную треть. Вставьте нажимные колпачки в три пробирки.
- Измерьте количество трубок, содержащих полоски, и пустую/закрытую контрольную трубку на счетчике γ на предмет активности меди-64 и запишите соответствующее количество очков в минуту (cpm). Вычтите активность контрольной трубки из других показаний, чтобы скорректировать фоновую активность.
ПРИМЕЧАНИЕ: Скорректированные показания нижней трети полоски (часть 1) связаны с хелатированными до липидных взвешенными частицами меди-64. Средний срез (часть 2) содержит полосу свободных хелатов меди-64 и 64Cu-пиролипидов в несупрамолекулярной форме. Верхняя секция (часть 3) содержит преимущественно свободную медь-64. - Рассчитайте радиохимическую чистоту с помощью уравнения 1.
 (Уравнение 1)
(Уравнение 1)
ПРИМЕЧАНИЕ: если cpm для части 1 кажется необоснованно низкой (например, ниже или эквивалентна для части 2 или 3) или если какие-либо показания превышают порог нелинейности/насыщения счетчика γ, обратите внимание на меньший объем или разбавленную аликвоту (1-2 мкл) меченой радиоактивной суспензии для iTLC. - Убедитесь, что радиохимическая чистота, полученная из обеих полосок iTLC на липидную суспензию, составляет ≥ 94%. Если нет, продолжайте нагревать липидную суспензию до 60 °C и контролируйте хелатирование с интервалом в 30 минут с помощью iTLC.
- Разкупорьте флакон с липидной суспензией с радиоактивной меткой и микропипеткой 8,89 мкл 1 N NaOH в суспензию, пипетируя вверх и вниз для полного переноса основания и нейтрализации суспензии. Закройте флакон, поверните вручную щипцами, чтобы перевернуть/вернуть, а затем осторожно постучите по крышке флакона.
- Заполните свободное пространство PFP в соответствии с шагом 4.10, закройте крышкой и запечатайте парапленкой.
5. Активация и изоляция микропузырьков
- Активируйте липидную суспензию с помощью механического вибратора в течение 45 с при 4530 об/мин, чтобы получить молочную микропузырьковую суспензию. Дайте флакону пассивно остыть до состояния RT в течение примерно 10 минут. Полученная молочная суспензия со временем разделится на два слоя.
ПРИМЕЧАНИЕ: Содержимое флакона должно выглядеть молочным после активации. Более четкая приостановка после активации указывает на неудачную активацию, участники которой будут рассмотрены в следующих разделах. - Оказавшись на RT, аккуратно переверните флакон, чтобы снова суспендировать микропузырьковую суспензию. Установите флакон на плоскую поверхность и подождите 2 минуты перед сцеживанием, чтобы получить желаемую популяцию микропузырьков следующим образом:
- Вооружите пластиковый шприц объемом 1 мл иглой 18 G и продуйте шприц/иглу путем аспирации и втягивания воздуха. На отметке 2 минуты быстро откупорьте флакон, сломав пломбу Parafilm одним движением.
- Наберите 400-550 мкл из нижней части флакона (целевой микропузырьковой популяции), избегая аспирации верхнего пенистого слоя более крупных нежелательных микропузырьков.
ПРИМЕЧАНИЕ: При необходимости наклоните флакон в одну сторону, чтобы собрать концевые объемы в шприц, чтобы избежать аспирации пенистого/более легкого слоя.
- Тщательно протрите края иглы, чтобы удалить любые пенистые загрязнения, и перенесите выделенную микропузырьковую суспензию в микроцентрифужную пробирку. Аккуратно закройте колпачок (не открывайте или не закрывайте его резко). Это окончательная рабочая суспензия радиоактивно меченых микропузырьков.
- Измерьте активность конечного продукта микропузырьков на калибраторе дозы и запишите время. Разделите это значение на объем суспензии, сцеженной на шаге 5.2, чтобы получить значение MBq·mL-1 для расчета объемов впрыска в зависимости от интересующего приложения.
ПРИМЕЧАНИЕ: Микропузырьки с радиоактивной меткой теперь готовы к использованию. Раздел 6 может быть выполнен через 24 часа. Для получения информации о том, как эти меченые радиоактивными метками микропузырьки могут быть введены и отслежены in vivo с помощью мультимодальной (ультразвук, ПЭТ, флуоресцентная) визуализации, см. Rajora et al.15.
6. Валидация эффективности радиоактивного мечения
- Суспендируйте суспензию микропузырьков с помощью щадящего пипетирования или инверсии флакона.
ПРИМЕЧАНИЕ: Никогда не нагнетайте на рабочий продукт микропузырьков. Вихревой процесс дестабилизирует микропузырьковые взвеси. - Добавьте 10-200 мкл меченой радиоактивной суспензии в центрифужный фильтр объемом 0,5 мл 30 000 молекулярных отсечек (MWCO). При использовании объемов <200 мкл добавьте ddH2O в фильтрующий блок, чтобы получить общий объем 200 мкл. Поместите фильтрующий блок в совместимую микроцентрифужную трубку и крышку.
ПРИМЕЧАНИЕ: Для обеспечения успешного завершения протокола рекомендуется проводить тест на радиоактивное мечение до и отдельно от любого примененного in vitro или in vivo использования радиоактивных меченых микропузырьков. В этом случае на этом этапе можно использовать больший объем (например, 200 мкл). Когда протокол впоследствии используется для сеанса лечения, сначала подготовьте объемы лечения/инъекции, а затем как можно раньше проведите секцию 6 с оставшейся меченой радиоактивными метками суспензией микропузырьков. - Центрифуга в течение 10 мин при 12 000 x g при RT.
ПРИМЕЧАНИЕ: микроцентрифуга должна быть окружена свинцовым экраном. - Ножницами разрежьте соединение между микроцентрифужной пробиркой и ее крышкой.
- Поместите колпачок в сцинтилляционный флакон объемом 20 мл с надписью «caps». Перенесите фильтрующий блок в новую микроцентрифужную трубку (трубка 2).
- Поместите первую микроцентрифужную пробирку с инфранатантом в сцинтилляционный флакон объемом 20 мл с надписью «пробирка 1». Добавьте 200 мкл ddH2O в фильтрующий блок в пробирке 2.
- Центрифугируйте фильтрующий блок в пробирке 2 при давлении 12 000 x g при RT.
- Повторите шаги 6.4 и 6.5. Добавьте тюбик 2 колпачка в "колпачки" сцинтилляционного флакона, укрывающего пробирку 1 колпачком. Поместите пробирку 2 в новый сцинтилляционный флакон объемом 20 мл.
- Разрежьте крышку третьей микроцентрифужной пробирки и поместите во флакон «крышки» в соответствии с шагом 6.4. Переложите фильтрующий блок в новый сцинтилляционный флакон объемом 20 мл с маркировкой «единица», следя за тем, чтобы инфранатант оставался в пробирке 3 и не переносился в пробирку «единица». Если на краях фильтрующего блока видны капли, верните его в пробирку 3, крышку, и поверните вниз в течение 10 с. Поместите пробирку 3 в новый стеклянный сцинтилляционный флакон объемом 20 мл.
- Закройте крышками 5 сцинтилляционных флаконов (пробирка 1, пробирка 2, пробирка 3, крышки и единица). Приготовьте один пустой и закрытый флакон со сцинтилляцией объемом 20 мл в качестве пустого контроля.
- Измерьте шесть сцинтилляционных флаконов на γ-счетчике на предмет активности меди-64. Вычтите активность пустого флакона из активности других флаконов. Рассчитайте эффективность радиоактивного мечения/хелатирования с помощью уравнения 2.
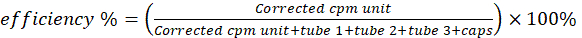 (Уравнение 2)
(Уравнение 2)
ПРИМЕЧАНИЕ: Если единичный cpm необоснованно низок (например, ниже или эквивалентен пробиркам) или если какие-либо показания превышают порог нелинейности/насыщения счетчика γ, храните сцинтилляционные флаконы в свинцовых контейнерах до 4 дней, чтобы позволить активности снизиться до тех пор, пока значения не станут ниже порогового значения, и повторите измерение.
7. Физико-химическая характеристика микропузырьков
ПРИМЕЧАНИЕ: Если в лаборатории нет специального оборудования для обработки радиоактивных образцов, физико-химическое определение микропузырьков должно проводиться с использованием нерадиоактивных, «холодных» образцов с хелированной медью. Такая «холодная» маркировка облегчает оценку выхода микропузырьков, что жизненно важно для оценки дозы микропузырьков, используемых для предполагаемого применения. Кроме того, он позволяет сравнивать их с контрольными нехелатированными микропузырьками, чтобы гарантировать, что процесс радиоактивного мечения не нарушает свойства микропузырьков. Это «холодное» мечение и связанная с ним физико-химическая характеристика должны быть выполнены до нанесения микропузырьков с радиоактивным мечением и могут быть использованы в качестве обратной связи, если требуются модификации радиоактивного мечения (см. Обсуждение).
- «Холодная» маркировка медными микропузырьками
- Используя объем раствора 64CuCl2 , добавленного в липидную суспензию на этапе 4.7, молярный состав порфирина в липидных пленках и специфическую активность, указанную в описании продукта 64CuCl2 , рассчитать приблизительное молярное соотношение металл:порфирин, полученное при радиоактивном мечении. Примеры расчетов можно найти в дополнительном файле 1.
- Следуйте разделам 1-3 текущего протокола.
- Приготовьте 0,1 мг·мл-1 раствора CuCl2 в 0,1 Н HCl.
- Нанесите микропипетку соответствующего объема этого раствора CuCl2 в липидную суспензию, рассчитанную на основании шага 7.1.1, и закупорьте флакон.
- Поверните флакон, чтобы смешать CuCl2 с липидной суспензией, заполните свободное пространство PFP, запечатайте и нагрейте в соответствии с шагами 4.9, 4.10 и 4.12. Резиновые щипцы не нужны для работы с флаконами.
- Через 1 ч снимите флакон с огня и протрите его снаружи до полного высыхания. Дайте флакону остыть до состояния RT.
- Нейтрализуйте липидную суспензию, перемешайте, заполните свободное пространство PFP и запечатайте в соответствии с шагами 4.23 и 4.24.
- Активируйте микропузырьковую суспензию и сцедите ее для получения рабочего продукта в соответствии с шагами 5.1-5.3.
- Микропузырьковый размер
ПРИМЕЧАНИЕ: Определение размера микропузырьков следует проводить сразу после активации. При оценке устойчивости рабочей суспензии повторите пробоподготовку и измерения с интервалом в 30 минут. Как правило, окно в 1-2 часа является репрезентативным для периода времени, в течение которого рабочая суспензия микропузырьков будет использоваться/вводиться после активации. Цель измерений стабильности состоит в том, чтобы обеспечить сохранение размера и выхода микропузырьков в течение этого периода времени, чтобы все обработки, проводимые из рабочего раствора, содержали аналогичные популяции микропузырьков.- Включите счетчик сошников (CC) и установите следующие параметры с помощью инструмента Редактировать СОП : апертура 30 мкм, диапазон размеров 0,6-18 мкм, ток апертуры 400-600 мкА, коэффициент усиления предусилителя 4-8, 400 обводров, промывка до и после каждого прогона, объемный анализ, объем образца 5 мкл.
- Отфильтруйте электролит CC через установку вакуумной фильтрации фильтрующего материала 0,2 мкм. Заполните емкость с электролитом и отдельную емкость для пробоподготовки.
- Фоновое измерение: Заполните одноразовую кювету объемом 10 мл отфильтрованным электролитом объемом 10 мл и выполните базовое измерение. Убедитесь, что их количество меньше 400. Если нет, промойте прибор.
- Измерение образца
- Добавьте 10 мл отфильтрованного электролита в новую кювету. Восстановите суспензию микропузырьков путем ручного инвертирования/возврата. Микропипетка 5 μл от центра дна флакона. Протрите края наконечника пипетки (кроме отверстия) и погрузите образец непосредственно в подготовленный электролит.
- Проводите пипеткой вверх и вниз, чтобы полностью перенести суспензию. С помощью наконечника пипетки осторожно поворачивайте электролит до тех пор, пока «огоньки» микропузырьковой суспензии не рассеются.
- Измерьте образец на КК (два прогона на анализируемый материал).
ПРИМЕЧАНИЕ: Объем образца размером 5 мкл обычно подходит для образцов, содержащих концентрации 1-5 x 109 микропузырьков·мл-1 . Этот объем образца может потребоваться скорректировать в зависимости от конкретной настройки прибора CC и от того, выходит ли выход микропузырьков образца за пределы указанного выше диапазона.
- Конфокальная визуализация
ПРИМЕЧАНИЕ: Проводите конфокальную визуализацию сразу после определения размера микропузырьков и в течение периода сохранения стабильности микропузырьков, как указано в шаге 7.2.- Снова суспензируйте микропузырьковую суспензию и перенесите 1-5 мкл в центр предметного стекла микроскопа. Осторожно наденьте крышку на каплю микропузырьковой суспензии, избегая попадания пузырьков воздуха. Суспензия растечется под чехлом покрытия.
- Визуализируйте микропузырьки с 60-кратным увеличением с помощью масляного иммерсионного объектива. Получение изображений в светлом поле и при возбуждении 633 нм/640-765 нм. Наложите светлопольные и флуоресцентные изображения.
ПРИМЕЧАНИЕ: Флуоресцентный сигнал должен перекрываться по всей оболочке всех видимых частиц, когда зонд однородно встроен в оболочку микропузырьков.
- Спектрофлуориметрия
ПРИМЕЧАНИЕ: Спектрофлуориметрические измерения могут быть проведены в течение 24 часов после активации микропузырьков.- Приготовьте 1% Тритон Х-100 как описано ранее35.
- Включите спектрофлуориметр за 15-30 минут до первого измерения.
- Измерьте спектры флуоресценции 1% Triton X-100 с использованием волнения 410 нм и диапазона излучения 600-800 нм в кварцевой кювете. Выберите опцию нормализации сигнала по сигналу опорного детектора (часто обозначаемому как S1/R1).
ПРИМЕЧАНИЕ: Triton X-100 легко пузырится при пипетировании. Таким образом, при переносе в кювету погружайтесь только до первого упора микропипетки. - Промойте кювету метанолом и высушите сжатым воздухом между образцами.
- Перелейте 6 мл 1% Triton X-100 в центрифужную пробирку объемом 15 мл. Суспендируйте суспензию микропузырьков и аспирируйте 1 мкл с помощью микропипетки. Протрите края наконечника пипетки, кроме отверстия, и переложите образец в подготовленный 1% Triton X-100, пипетируя вверх и вниз до завершения переноса. Сделайте раствор вихревым и переложите его на кварцевую кювету.
ПРИМЕЧАНИЕ: Отрегулируйте соотношение выборки: 1% Triton X-100 в соответствии с чувствительностью прибора и порогом нелинейного насыщения. - Измерьте этот образец, используя параметры, описанные на шаге 7.4.3. Это измерение соответствует «разрушенным» частицам.
- Повторите шаги 7.4.3-7.4.6 с использованием PBS. Это измерение соответствует «неповрежденным» частицам.
- Коррекция спектров поврежденных и неповрежденных образцов с использованием 1% измерений Triton X-100 и PBS соответственно.
- Рассчитайте эффективность гашения (QE) с помощью уравнения 3 с использованием интегрированного скорректированного на базовую линию флуоресцентного сигнала неповрежденного образца в PBS (FPBS) и в 1% Triton X-100 (FTx):
 (Уравнение 3)
(Уравнение 3)
- УФ-ВИД спектроскопия
ПРИМЕЧАНИЕ: Спектроскопические измерения могут быть проведены в течение 72 часов после активации микропузырьков.- Ультразвуком окуните аликвоту микропузырьковой суспензии в микроцентрифужную пробирку с помощью ультразвуковой ванны при РТ до тех пор, пока суспензия не станет прозрачной. Это уменьшает эффекты рассеяния во время спектроскопии.
- Включите спектрофотометр за 10 минут до первого измерения. Выберите интервал сканирования 0,25 нм и диапазон захвата 200-800 нм. Включите базовое вычитание.
- Для измерений используйте кварцевую кювету длиной 1 см. Между измерениями промойте кювету метанолом и высушите сжатым воздухом.
- Получите исходное измерение метанола.
- Сделайте вихревую промозглую прозрачную микропузырьковую суспензию и перенесите 10-50 μL в микроцентрифужную пробирку, содержащую 200-1000 μL метанола. Убедитесь, что объем метанола измерен и добавлен в пробирку с помощью чистого стеклянного микролитрового шприца. Вихревой раствор для получения «нарушенного» образца.
ПРИМЕЧАНИЕ: Разведение образца будет зависеть от эффективности загрузки порфирина и молярного состава. 20-кратное разведение подходит для 30-мольной пиро-липидной микропузырьковой композиции. - Сбор УФ-ВИД спектра.
- Повторите шаги с 7.5.4 по 7.5.6, используя PBS вместо метанола.
ПРИМЕЧАНИЕ: Для измерения объемов PBS можно использовать микропипетку вместо стеклянного микролитрового шприца.
8. Внесение изменений в протокол
- Альтернативный хелатор
- Получить липидные пленки в соответствии с разделом 2, заменив пиролипид на альтернативный липид-сопряженный медный хелатор (например, 1,2-дипальмитоил-sn-глицеро-3-фосфоэтаноламин-N-диэтилентриаминпентауксусная кислота (соль аммония), далее именуемая DTPA-липид). Используйте Дополнительный файл 1 для расчета требуемой массы и объемов запасов.
ПРИМЕЧАНИЕ: Вероятно, потребуется тестирование различных молярных составов альтернативного хелатора для определения верхнего предела, за которым стабильные микропузырьки с высоким выходом не могут быть сгенерированы. - Следуйте разделам с 3 по 6 для создания и определения характеристик микропузырьков, помеченных радиоактивными метками.
- Выполните шаги с 7.1 по 7.3, чтобы охарактеризовать «холодные» микропузырьки в хелатной меди. Для оценки морфологии частиц требуется только получение изображений с помощью светлопольной конфокальной микроскопии. Если альтернативный хелатор является флуоресцентным, проведите конфокальную микроскопию с соответствующими длинами волн возбуждения и излучения в дополнение к шагам 7.4 и 7.5.
- Получить липидные пленки в соответствии с разделом 2, заменив пиролипид на альтернативный липид-сопряженный медный хелатор (например, 1,2-дипальмитоил-sn-глицеро-3-фосфоэтаноламин-N-диэтилентриаминпентауксусная кислота (соль аммония), далее именуемая DTPA-липид). Используйте Дополнительный файл 1 для расчета требуемой массы и объемов запасов.
- Альтернативный флуорофор
- Готовят липидные пленки в соответствии с разделом 2, заменяя пиролипид на альтернативный липид-конъюгированный или интеркалирующий флуорофор (например, DiI). Используйте дополнительный файл 1 для расчета требуемой массы и объемов запасов.
ПРИМЕЧАНИЕ: Вероятно, потребуется тестирование различных молярных составов альтернативного флуорофора, чтобы определить верхний предел, за которым стабильные микропузырьки с высоким выходом не могут генерироваться. - Следуйте разделу 3, используя PGG вместо AA-PGG.
- Выполните шаги с 5.1 по 5.3 и шаги с 7.2 по 7.5.
- Готовят липидные пленки в соответствии с разделом 2, заменяя пиролипид на альтернативный липид-конъюгированный или интеркалирующий флуорофор (например, DiI). Используйте дополнительный файл 1 для расчета требуемой массы и объемов запасов.
- «Спайкинговый» подход: маркировка предварительно сформированных микропузырьковых липидных суспензий
- Создайте порфирин-липидную пленку в соответствии с разделом 2, используя только пиролипид без других липидных компонентов. Количество пиролипидов см. в дополнительном файле 1 .
- Гидратируйте пиролипидную пленку в соответствии с разделом 3, используя 100-200 мкл AA-PGG (или PGG, если радиоактивное мечение не требуется) вместо 1 мл гидратационного буфера.
- Переложите всю пиро-липидную суспензию в заранее изготовленную липидную микропузырьковую суспензию.
- Заполните свободное пространство PFP, нагрейте и произведите ультразвуковую обработку суспензии и уплотнения под PFP в соответствии с шагами с 3.4 по 3.9. Следите за диспергированием пиролипидной суспензии в готовой липидной микропузырьковой суспензии и проводите циклы нагрева/ультразвука до полного диспергирования.
ПРИМЕЧАНИЕ: При использовании коммерческого флакона с микропузырьками с запайкой перегородки пиролипидная суспензия может быть введена во флакон через шприц/иглу без повторного наполнения пробирки PFP. - Проведите радиоактивное мечение (см. шаг 8.3.5.1 ниже), активацию, изоляцию (см. ПРИМЕЧАНИЕ ниже) и связанную с этим характеристику в соответствии с разделами 4–7.
- Альтернативный подход заключается в том, чтобы сначала радиоактивно пометить гидратированную пиро-липидную суспензию, контролировать радиохимическую чистоту >94%, нейтрализовать 1 N NaOH (изменить объем в соответствии с объемом AA-PGG, используемым для гидратации пиролипидной пленки), а затем ввести меченую радиоактивной пиро-липидную суспензию в предварительно изготовленную микропузырьковую липидную суспензию в соответствии с шагом 8.3.3.
ПРИМЕЧАНИЕ: Этот модифицированный подход следует использовать для создания флуоресцентных или мультимодальных микропузырьков, меченных радиоактивными метками, только если следует процессу выделения, который удаляет субмикронные многослойные везикулы, образующиеся во время гидратации липидов, но не входящие в состав микропузырьков. Для получения более подробной информации см. Обсуждение.
- Альтернативный подход заключается в том, чтобы сначала радиоактивно пометить гидратированную пиро-липидную суспензию, контролировать радиохимическую чистоту >94%, нейтрализовать 1 N NaOH (изменить объем в соответствии с объемом AA-PGG, используемым для гидратации пиролипидной пленки), а затем ввести меченую радиоактивной пиро-липидную суспензию в предварительно изготовленную микропузырьковую липидную суспензию в соответствии с шагом 8.3.3.
Результаты
Ключевыми количественными результатами при изготовлении микропузырьков с радиоактивной меткой являются радиохимическая чистота и эффективность радиоактивного мечения. В этом протоколе используется iTLC и валидированная центробежная процедура, соответственно, для определения характеристик каждого из них. На рисунке 2А показано, что средняя радиохимическая чистота и эффективность в ≥95% были достигнуты в коммерческих составах, имитирующих микропузырьки, в которых липид хозяина был заменен на пиролипид в композициях 1 моль, 10 моль % или 30 моль % от общего липида. Для получения пиролипидных составов с концентрацией 1 моль и 10 моль % требовалась более концентрированная липидная суспензия (0,15 мл против 1 мл). Высокая радиохимическая чистота и эффективность хелатирования, достигнутые в текущем протоколе, свели на нет необходимость в очистке после мечения.
Это также верно для альтернативных составов, состоящих из липидов цепи C16, C18 и C22 с общим нейтральным или анионным поверхностным зарядом (рис. 2B). Эти варианты были загружены пиролипидной композицией в 30 мол.%, основанной на ранее определенном верхнем пределе для поддержания среднего размера микропузырьков, приемлемого выхода микропузырьков (>1 x 109 микропузырьков·мл-1) и ограничения генерации популяции микропузырьков >8 мкм при максимальном увеличении пиролипида и его активируемой флуоресценции и хелатирования металлов15. В связи с этим составы с концентрацией 30 моль продемонстрировали высочайшую (до 99%) радиохимическую чистоту и эффективность хелатирования. Базовые липидные композиции всех композиций, рассмотренных на рисунке 2 , были основаны на наиболее преимущественно клинически исследованной коммерческой композиции микропузырьков, в то время как длины цепей и варианты заряда представляют собой наиболее широко исследованные доклинически исследованные композиции15. Это дает уверенность в том, что представленный протокол радиоактивного мечения может быть применен к большинству микропузырьковых композиций, представляющих интерес для терапевтического ультразвука.
Количественная физико-химическая характеристика микропузырьков, как правило, невозможна для радиоактивных микропузырьков. К тому времени, когда радиоактивность ослабевает (в течение нескольких дней и даже недель, в зависимости от изотопа и количества используемой активности), ядра микропузырькового газа в значительной степени растворяются, образуя фрагменты микропузырьков. Таким образом, суспензия частиц не будет точно захватывать тераностически активные вещества, которые были впервые активированы или введены. Таким образом, визуальное наблюдение во время подготовки радиоактивных микропузырьков и парный аналоговый протокол «холодного» хелатирования имеют жизненно важное значение. В частности, необходимы ключевые визуальные наблюдения на этапах гидратации и активации липидной пленки (рис. 3). При успешной, полной гидратации липидные пленки полностью диссоциируют от стенок флакона и самоорганизуются в пузырьки, которые равномерно распределяются в буфере для гидратации. Конечным результатом является прозрачное решение (рис. 3А). При неполной гидратации липидная пленка продолжает прилипать к стенке флакона или агрегату в суспензии (Рисунок 3B). Первые могут быть нелегко заметить, поэтому во время ультразвуковой обработки рекомендуется вытирать воду с поверхности флакона и проводить тщательный осмотр. Следует избегать преждевременной активации микропузырьков во время гидратации, и это может быть легко наблюдаемо в виде создания стойких пузырьков на поверхности суспензии и молочного/мутного шепота внутри суспензии (Рисунок 3C). Эта ненадлежащая активация может снизить выход микропузырьков и воспроизводимость распределения по размерам. Этого можно избежать, используя температуру воды для ванны выше температуры перехода липидной составляющей хозяина, наполняя ультразвуковой аппарат для ванны до соответствующего уровня воды, который способствует видимому ультразвуковому воздействию/нарушению жидкости, но не «отскакивая» от гидратационного буфера или воды для ванны, и тщательно избегая тряски флакона или резкого перемешивания. После целенаправленной активации суспензии микропузырьков с помощью контролируемого высокоскоростного механического перемешивания образуется молочная непрозрачная суспензия, которая разделяется на более светлый/белый и пенистый верхний слой, содержащий неуместно крупные частицы (например, диаметр >8 мкм), и целевой нижний слой, содержащий микропузырьки, представляющие интерес (Рисунок 3D)), который выделяется с помощью аспирации шприца/иглы. Субоптимальная активация, приводящая к более низкому выходу целевых популяций микропузырьков, дает менее молочный/непрозрачный и часто полупрозрачный нижний слой, который выглядит как мутная версия гидратированной липидной суспензии (рис. 3E).
Объективная физико-химическая характеристика микропузырьков, меченных радиоактивными метками, проводится с использованием аналогичных «холодных» микропузырьков, хелатированных медью. Основные конечные точки для этой характеристики включают: 1) количественную оценку среднего размера и выхода микропузырьков, 2) оценку стабильности хранения микропузырьков/временных рамок работы, 3) валидацию успешной пиро-липидной загрузки через оболочку микропузырька и 4) обеспечение неизменности этих физико-химических свойств с помощью процесса радиоактивного мечения, интегрированного в процедуру изготовления микропузырьков. На рисунках 4 и 5 показана такая характеристика для анионного микропузырькового состава C16 на основе хелатной меди и пиролипидной композиции 30 мол.% от общего липида. Характеристика представлена в отличие от контрольных, нехелатных микропузырьков.
На рисунке 4 представлены репрезентативные данные о размерах хелатных и нехелатных микропузырьков. Числовые распределения (рис. 4A) демонстрируют большее присутствие мелких пузырьков и монотонный затухание числа микропузырьков с размером. Распределение объема микропузырьков (рис. 4B) демонстрирует одномодальные пики, соответствующие среднему размеру 6 мкм. Поскольку более крупные микропузырьки содержат большие объемы газа, ожидается, что распределение объема будет смещено в сторону более высоких средних размеров микропузырьков. При усреднении по средневзвешенному числу достигаются размеры 1,5-2 мкм и выход микропузырьков 3 x 109 микропузырьков·мл-1 (рис. 4C, D), которые остаются стабильными в течение 1 ч после активации и выделения микропузырьков. Эти результаты типичны для стабильных липидных микропузырьков, образующихся с помощью протокола гидратации липидов без дальнейшего выделения размеров центробежкой. Важно отметить, что распределение по размерам, средние размеры, концентрации и стабильность микропузырьков не изменяются при интеграции условий хелатирования в измельченное производство микропузырьков. Эти значения обобщены в таблице 1, наряду с другими микропузырьковыми составами, которые также демонстрируют сохранение физико-химических свойств при хелатировании меди.
Морфологические и оптические свойства (рис. 5) микропузырьков сохраняются и при «холодном» хелировании меди. Флуоресценция порфирина может наблюдаться в однородном контурировании оболочек хелатированных и нехелатированных микропузырьков, демонстрируя успешное встраивание пиролипидного хелатора в оболочки микропузырьков (рис. 5A). Успешная загрузка также может быть отмечена с помощью УФ-ВИД спектроскопии и спектрофлуориметрии. Разрушенные микропузырьки распадаются на мономерные липидные формы. Таким образом, спектры УФ-ВИД (рис. 5B) разрушенных микропузырьков совпадают со спектрами свободного пиролипида. Он содержит два заметных пика: полосу Соре в синей области и Q-полосу в красной области. Для нормализации концентрации и более объективного сравнения микропузырьков спектры поглощения представлены в виде молярной излучательной способности на длинах волн. Необработанные УФ-ВИД спектры поглощения разрушенных микропузырьков могут быть использованы для количественной оценки пиро-липидной инкапсуляции и концентрации в микропузырьковых суспензиях с применением закона Бера-Ламберта (длина пути 1 см, коэффициенты экстинкции 97 000 М-1·см-1 или 45 000 М-1·см-1 при 410 нм и 667 нм соответственно). Микропузырьки, описанные на рисунке 5, демонстрируют 85%-90% эффективность пиро-липидной инкапсуляции и концентрацию порфирина ~0,17 мМ. Характеристика концентраций микропузырьков и порфиринов позволяет оценить вводимые дозы микропузырьков и порфирина. Высокая эффективность инкапсуляции демонстрирует эффективную пиро-липидную загрузку в микропузырьках. Это подтверждается УФ-ВИД спектрами неповрежденных микропузырьков, изображающими характерное красное смещение диапазона Qy до 674 нм и 702 нм. Последнее особенно заметно при высокой нагрузке и упорядоченной агрегации порфирина в микропузырьковые оболочки в отличие от везикулярных структур, которые демонстрируют только один пик с красным смещением между 670-680 нм15,37. Эффективная загрузка порфирина в микропузырьки при составах более 5 моль может наблюдаться за счет высокого (>90%) гашения флуоресценции порфирина в неповрежденных микропузырьках15, которое восстанавливается при разрушении частиц (рис. 5В). Как и в случае с данными о размерах, эти оптические свойства сохраняются в соответствии с условиями радиоактивного мечения, связанными с текущим протоколом (обобщены в таблице 1). В совокупности эти результаты демонстрируют достижение всех конечных точек для успешного изготовления микропузырьков, включения хелаторов порфирина и сохранения свойств хелатированных микропузырьков.
Текущий протокол радиоактивного мечения микропузырьков был разработан с использованием возможностей хелатирования меди и мультимодальности пиролипидов. Тем не менее, пиролипид в настоящее время коммерчески недоступен. Сотрудничество в области исследований поощряется для получения пиролипида в случае отсутствия ресурсов для его синтеза внутри компании или за ее пределами. Если ни один из вариантов недоступен, можно модифицировать текущий протокол для генерации одномодальных флуоресцентных или радиоактивных микропузырьков с использованием коммерчески доступных флуорофоров и хелаторов соответственно. Эти альтернативные хелаторы/индикаторы должны быть неотъемлемыми в микропузырьковой липидной оболочке. На рисунке 6 показаны репрезентативные микропузырьки, сконструированные с двумя такими фрагментами: DiI и DTPA-липидами.
Включение DTPA-липидов в состав анионных микропузырьков C16 дает микропузырьки размером 1,1 мкм с выходом 11 x 109 микропузырьков·мл-1 и аналогичной морфологией, что и хелатированные анионные пиро-липидные микропузырьки C16 (рис. 6B, C). Предварительная оценка способностей АКДП к хелатированию меди микропузырьков проводилась с использованием «холодного» CuCl2. Когда хелатирование меди было интегрировано в процесс изготовления микропузырьков DTPA, размер и выход остались неизменными. Чтобы подтвердить, что DTPA-липид в микропузырьках доступен для хелатирования меди, ICP-MS был проведен на микропузырьках, отфильтрованных центрифугой. Был обнаружен определенный медный сигнал, который соответствовал 90%-100% эффективности хелатирования по сравнению с сигналом, полученным от эквивалентных немеченых контрольных элементов с медными шипами. Собственный опыт показывает, что ICP-MS обеспечивает более переменную эффективность хелатирования меди, чем метод γ, и, таким образом, последний рекомендуется для количественной оценки эффективности хелатирования/радиоактивного мечения в текущем протоколе. Эти результаты подчеркивают важность данной рекомендации, а также являются доказательством того, что протокол хелатирования меди, представленный в этом отчете, может быть транслирован на хелаторы помимо пиро-липидов.
Как видно на рисунке 6D, текущий протокол также может быть использован для успешного включения DiI в состав анионных микропузырьков C16 с содержанием 5 мол.%. Это приводит к сильному однородному флуоресцентному мечению оболочки микропузырька (аналогично использованию пиролипидов, как показано на рисунке 6B) и генерирует микропузырьки со средним размером 1,7 мкм и выходом 1,5 x 109 микропузырьков·мл-1. В целом, результаты, представленные на рисунке 6 , демонстрируют, что текущий протокол изготовления и маркировки микропузырьков может быть реализован для включения альтернативных зондов и хелаторов в составы микропузырьков, если пиролипиды недоступны.
Этот протокол фокусируется на радиоактивном мечении липидов МБ. Его естественным продолжением является применение in vivo этих радиоактивно меченых микропузырьков, что было описано в недавнем докладе, в котором была охарактеризована фрагментация, кинетика циркуляции и кинетическое биораспределение ряда радиоактивно меченых аналогов коммерческихлипидных микропузырьков. Результаты этой расширенной работы будут обсуждаться в следующем разделе в контексте применения и будущей полезности микропузырьков, меченных радиоактивными метками.

Рисунок 2: Чистота и эффективность радиоактивного мечения. Чистота и эффективность радиоактивного мечения, полученные в результате применения современного протокола радиоактивного мечения микропузырьков при измельченном синтезе микропузырьков с (А) различными пиро-липидными хелататорными составами и (В) длиной липидной цепи и зарядом микропузырьков. Анионные микропузырьки обозначаются знаком (-), в то время как цвиттерионные (т.е. нейтральные) обозначаются буквой "n". Данные представлены в виде средних значений ± стандартного отклонения. Этот рисунок был адаптирован с разрешения Rajora et al.15. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
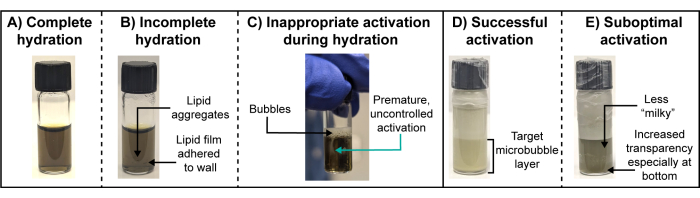
Рисунок 3: Оптимальная и субоптимальная гидратация липидной пленки и активация микропузырьков. (А-Е) Репрезентативные фотографии (A,D) оптимальной и (B,C,E) субоптимальной гидратации липидной пленки и активации микропузырьков. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 4: Репрезентативные размеры, выход и стабильность микропузырьков нехелатированного и медно-хелатного порфирина. (А) численное распределение по размерам, (В) объемное распределение по размерам, (В) выход микропузырьков и (Г) усредненные по числу размеры нехелатированных (черного цвета) и медно-хелатированных (розового) порфириновых микропузырьков с пиролипидным составом 30 моляльных. Выход и размер микропузырьков (C и D) измеряли с интервалом в 30 минут для обеспечения стабильности рабочей суспензии. Данные представлены в виде среднего стандартного отклонения для (C) и (D) n = 4-7 повторений. Этот рисунок был адаптирован с разрешения Rajora et al.15. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
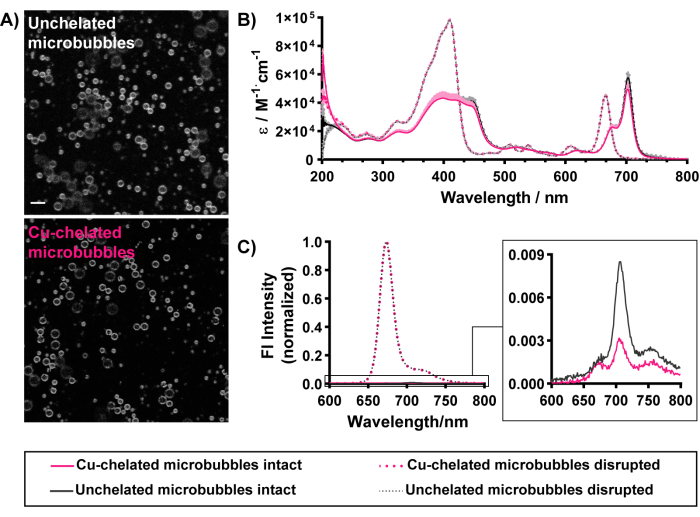
Рисунок 5: Морфологическая и оптическая характеристика нехелатированных (в черном цвете) и медно-хелатных (в розовом цвете) микропузырьков порфирина с пиролипидным составом 30 моль. (A) Конфокальная визуализация в оттенках серого (изображен пиросигнал) демонстрирует гомогенное включение пиролипидов в хелатированные и нехелатированные оболочки микропузырьков (масштабная линейка = 5 мкм). (B) УФ-ВИД спектры, полученные для интактных микропузырьков (в PBS, сплошные линии) и микропузырьков, разрушенных метанолом (пунктирные линии). (C) Флуоресцентные спектры интактных микропузырьков в PBS (сплошные линии, увеличенная вставка) и 1% разрушенных микропузырьков Triton X-100 (пунктирные линии). Этот рисунок был адаптирован с разрешения Rajora et al.15. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
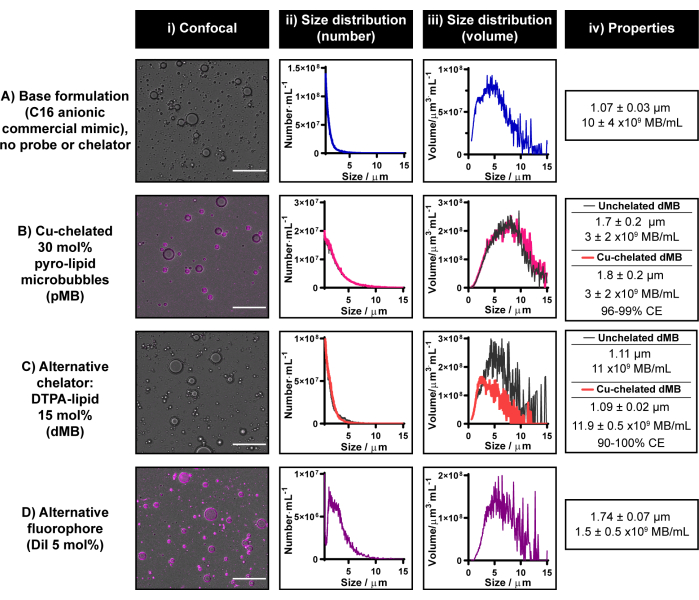
Рисунок 6: Репрезентативные микропузырьки, сконструированные из коммерчески доступных флуорофоров и хелаторов. (А-Г) Пример использования (C) альтернативного хелатора (DTPA-липид) и (D) флуорофора (DiI) до (B) пиролипида, включенных отдельно в (A) анионную коммерческую липидную микропузырьковую композицию C16. Микропузырьки были охарактеризованы с помощью конфокальной микроскопии (масштабная линейка = 20 мкм) (i) и определения размеров электрического импеданса, что позволило получить численно-взвешенное (ii) и объемно-взвешенное (iii) распределение размеров. Средний размер и выход микропузырьков обобщены в (iv). Данные представлены в виде в среднем n = 2-7 повторений в II-IV. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
| Вариант с микропузырьками | Урожай | Объем газа | Средний размер по численному распределению [мкм] | Средний размер по объемному распределению [мкм] | Q702 нм: Q674 нм | Эффективность закалки [%] |
| [x109 МБ▪мл-1] | [x1010 мкм3 ▪мл-1] | |||||
| Собственная Definity | 10 ± 4 | 1,8 ± 0,2 | 1,07 ± 0,03 | 3.64 ± 0.09 | Н/Д | Н/Д |
| С16 (-) | 3 ± 2 | 6 ± 3 | 1,7 ± 0,2 | 6,0 ± 0,8 | 2,5 ± 0,1 | 97,5 ± 0,8 |
| Cu-C16 (-) | 3 ± 2 | 4 ± 2 | 1,8 ± 0,2 | 6,6 ± 0,8 | 2.3 ± 0.2 | 98 ± 2 |
| С16 н | 8,4 ± 0,4 | 2,3 ± 0,8 | 1.1 ± 0.2 | 4,6 ± 0,1 | 2,1 ± 0,5 | 98,2 ± 0,3 |
| Cu-C16 n | 6,2 ± 0,5 | 2,9 ± 0,9 | 1,3 ± 0,2 | 5,1 ± 0,3 | 1,8 ± 0,6 | 98,7 ± 0,2 |
| С18 (-) | 8 ± 1 | 3,9 ± 0,9 | 1,5 ± 0,1 | 4,0 ± 0,5 | 2,5 ± 0,3 | 97 ± 1 |
| Cu-C18 (-) | 7 ± 2 | 4 ± 1 | 1,5 ± 0,2 | 4,9 ± 0,9 | 2,2 ± 0,5 | 98,5 ± 0,6 |
| С18 н | 8 ± 1 | 3 ± 1 | 1,5 ± 0,1 | 4,0 ± 0,8 | 1,8 ± 0,7 | 98,6 ± 0,5 |
| Cu-C18 | 7,8 ± 0,2 | 3,9 ± 0,2 | 1.42 ± 0.04 | 4,8 ± 0,1 | 1,8 ± 0,7 | 98,7 ± 0,3 |
Таблица 1: Физико-химические свойства нехелатированных и Cu-хелатированных pDefs. Анионные микропузырьки обозначаются знаком (-), в то время как цвиттерионные (т.е. нейтральные) обозначаются буквой "n". Все измерения представляют собой среднее ± стандартное отклонение (n = 3-7). Этот рисунок был адаптирован с разрешения Rajora et al.15.
Дополнительный рисунок 1: Сравнение «измельченного» (серого) и «спайкового» (розового) подходов к введению пиролипидов в оболочки липидных микропузырьков. (А) Конфокальная визуализация микропузырьков, "шипованных" пиролипидами в количествах, соответствующих общему пиролипидному составу 1 моль, 10 моль% и 30 моль % от общего липида (масштабная линейка = 20 мкм). (B) УФ-ВИД спектры (i-iii) пиро-липидных микропузырьков, образующихся с помощью «шипового» (пурпурного) или «измельченного» подхода (черный). (Бив) Процентное содержание пиролипидов в микропузырьковых кексах по сравнению с инфранатантами после центробежного удаления субмикронных частиц. (C) Распределение количества и объема (i-iii) пиро-липидных микропузырьков, полученных с помощью «измельченного» (черного) и «спайкингового» подходов, и соответствующие средние размеры микропузырьков (iv) и выходы (v). Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный рисунок 2: Радио-UPLC характеристика микропузырьковых липидных суспензий, состоящих из 1 моль, 10 моль % и 30 моль % пиролипида и меченных радиоактивной меткой медью-64. Левый спектр получен от детектора излучения, а правый — от канала поглощения 400 нм. К сожалению, из-за потенциальных загрязнителей эти данные не могут быть использованы для количественной оценки радиохимической чистоты. Тем не менее, он демонстрирует перекрытие времен элюирования пиков, связанных с сигналом [64Cu]Cu2+ и пиролипидами, что указывает на успешное радиомечение. Этот рисунок был адаптирован с разрешения Rajora et al.15. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный рисунок 3: Эффект увеличения пиро-липидного молярного состава. Влияние на (A) связанные с числовыми распределениями, (B) объемные распределения, (C) усредненный по числам размер, (D) объемный усредненный размер, (E) выход, (F) эффективность гашения флуоресценции и интегрированный флуоресцентный сигнал (возбуждение 410 нм, возбуждение 600-800 нм), связанный с интактным (PBS) и разрушенным (у 1% Triton X-100). Данные представлены в виде среднего значения n = 3 повторений ± стандартным отклонением. Этот рисунок был адаптирован с разрешения Rajora et al.15. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный файл 1. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Обсуждение
Текущий протокол радиоактивного мечения липидных микропузырьков обеспечивает радиохимическую чистоту >95%, эффективность хелатирования >95% и сохранение физико-химических свойств микропузырьков без необходимости какой-либо очистки после мечения. Эти достижения представляют собой достижения, ранее недостижимые для существующих протоколов маркировки. Отсутствие ступеней очистки позволяет быстрее использовать радиоизотопы (в данном случае медь-64) и, таким образом, снизить потери неэффективной активности от радиоактивного распада. Результирующее сохранение свойств микропузырьков в сочетании с известной стабильностью хелатирования медно-порфиринового волокна33 лучше гарантирует, что любая последующая радиовизуализация или терапия являются репрезентативными для представляющего интерес микропузырька по сравнению с тем, что связано со свободными радиоизотопами или популяциями микропузырьков, модифицированных очисткой.
Текущий протокол также является первым, в котором интегрированы методы параллельного «холодного» мечения и ключевых характеристик для обеспечения такого сохранения физико-химических свойств микропузырьков. Фактически, это первый протокол радиоактивного мечения микропузырьков, в котором надежно охарактеризованы размер, выход и стабильность микропузырьков. Понимание этих свойств имеет решающее значение для применения микропузырьков, меченных радиоактивными метками. Знание размера микропузырьков, объема газа и выхода требуется для определения доз микропузырьков, которые, в свою очередь, влияют на безопасность и эффективность лечения микропузырьков-FUS. Например, открытие микропузырькового FUS BBB связано с верхним пределом дозы микропузырьков/объема газа, за пределами которого кровоизлияние и воспаление после FUS создают угрозу безопасности38. Для микропузырьков, заряженных оболочкой «все в одном», эта доза также привязана к дозе загруженного препарата. Размер и выход также влияют на приложения визуализации, создавая артефакты экранирования с высокими концентрациями объемов микропузырькового газа39. Крупные, размером >8 мкм микропузырьки представляют дополнительный риск для безопасности, заселяясь в капиллярах и образуя газовую эмболию40. Интуитивно понятно, что это также влияет на фармакокинетику и биораспределение оболочек микропузырьков. Например, ранее сообщалось, что легкие являются основным местом накопления радиоактивных меток в оболочках микропузырьков28,32. В отсутствие характеристики микропузырьков остается неясным, способствовало ли захват легких микропузырьков большего размера этому профилю биораспределения. Специфичные для использования порфирина, характеризующие оптические свойства микропузырьков, обеспечивают эффективную загрузку порфириновой оболочки, которая может влиять на соотношение металл:порфирин и, в свою очередь, на эффективность хелатирования, о чем будет сказано ниже. Порфирин также является тераностическим агентом, представляющим интерес для мультимодальной визуализации микропузырьков37, синергетической фотодинамической терапии41 и сонодинамической терапии42. Определение его нагрузки и флуоресценции в микропузырьках позволяет проводить терапевтические исследования микропузырьков порфирина и обеспечивает неизменность этих свойств с помощью радиоактивного мечения, что облегчает планирование терапии под визуальным контролем. Таким образом, настоятельно рекомендуется, чтобы «холодная» маркировка и изготовление немеченых микропузырьков проводились параллельно с радиоактивным мечением.
Этот протокол использует сильные способности порфиринов к хелатированию меди и известную самосборку порфирин-липида в оболочках микропузырьков37. Несмотря на то, что этот протокол ориентирован на медь-64, он открывает двери для альтернативных одногорковых металлохелатных микропузырьковых препаратов, поскольку более широкие классы порфиринов могут связывать Zn, Ni, Mn, Pd, In, Lu, Cd, Sn, Ga, Co и далее 43,44,45,46. Такое хелирование порфирина-металла обычно происходит на одной из двух стадий супрамолекулярного синтеза порфирина: 1) предварительная инсерция, когда строительные блоки порфирина хелатируются до их введения в частицы, или 2) постинсердиция, при которой порфирин уже собран в частицу до проведения хелатирования металла33,43. При использовании радиоизотопов первый связан с неэффективным радиоактивным распадом при высыхании липидной пленки, что в свою очередь повышает риски радиационной безопасности. Последнее, при нанесении на микропузырьки, может привести к дестабилизации частиц. Таким образом, в текущем протоколе был разработан гибридный подход, в котором хелатор вводился во время «измельченного» образования липидной пленки, но радиоактивное мечение проводилось после гидратации липидной пленки и до активации микропузырьков. Эта стратегия позволила легко включить радиоактивное мечение в типичный процесс изготовления микропузырьков, что сделало его пригодным для различных составов микропузырьков. Кроме того, такая интеграция позволила использовать простую контрольно-измерительную аппаратуру и свести к минимуму количество специализированного радиоактивно «горячего» оборудования.
Этот гибридный подход также отличается от существующих протоколов радиоактивного мечения микропузырьков, которые в значительной степени разделены на два преобладающих подхода: 1) синтез и радиоактивное мечение хелатора, который затем «спайзируют» в предварительно сформированные микропузырьковые липидные суспензии28,47, и 2) радиоактивное мечение биотинилированной части, которая впоследствии инкубируется с коммерческими коммерческими микропузырьками стрептавидина32,29. Последний подход имеет преимущество в плане экономии радиоизотопов. В представленных «измельченных» и заявленных «спайковых» протоколах радиоизотопный хелатор встраивается до активации микропузырьков, и, таким образом, мечаются как целевые декантированные микропузырьки, так и нежелательные большие популяции пенистых частиц. Это ограничение означает, что для «измельченного» и «спайкового» подходов требуется большее количество радиоизотопов, половина из которых идет впустую. Однако, как описано выше, постактивационное радиоразмечение сопряжено с риском дестабилизации микропузырьков и, наряду с предыдущими протоколами «спайкинга», требует удаления неинтегрированного хелатора с радиоактивной меткой.
Тем не менее, «спайковый» подход открывает возможности для радиоактивного мечения предварительно сформированных липидных суспензий микропузырьков (например, коммерческих микропузырьков), когда получение липидной пленки нецелесообразно или нежелательно. Существующий протокол радиоактивного мечения «с нуля» может быть адаптирован для имитации такого «спайкового» подхода (шаг 8.3). Здесь создается пиролипидная пленка, а затем гидратируется с образованием пиролипидной суспензии везикул. Затем эту суспензию «вкраливают» в предварительно сформированную микропузырьковую липидную суспензию и нагревают/обрабатывают ультразвуком для интеграции пиролипидов. Радиоактивное мечение может происходить как до, так и сразу после «спайкинга» (но до активации). Как видно на дополнительном рисунке 1А, этот адаптированный протокол маркирует собственные коммерческие микропузырьковые составы «спайковым» пиролипидным хелататором в композициях 1 моль, 10 моль % или 30 моль % от общего липида.
Этот «спайковый» подход имеет ключевое ограничение по сравнению с немодифицированным подходом «с нуля», который находится в центре внимания в текущем протоколе: неполная пиро-липидная интеграция. Как видно на конфокальной визуализации (дополнительный рисунок 1A), пиролипидный сигнал не локализуется строго кольцеобразно, однородно вокруг оболочки микропузырька, как это происходит при «измельченном» встраивании. Вместо этого «спайковый» подход связан с пятнистыми областями флуоресценции, видимыми на микропузырьках, некоторые из которых имеют нечеткие или четкие флуоресцентные контуры. Также наблюдается более высокая неоднородная фоновая флуоресценция. Центрифугирование этих «шипастых» микропузырьков для удаления субмикронных частиц устраняет эту фоновую флуоресценцию и большую часть неоднородного сигнала. Это говорит о том, что пиролипидные везикулы могли быть поглощены, но не полностью интегрированы в оболочку микропузырьков, что подтверждается характеристикой УФ-ВИД «спайкового» и «измельченного» включения пиролипидов (дополнительный рисунок 1B). Q-диапазон 704 нм, специфически связанный с пиролипидным включением в микропузырьки (при >5 мол.% состава), уменьшается при «спайкинге». Вместо этого более заметный пик наблюдается на длине волны 674 нм. Количественное определение пиро-липидов, распределенных в микропузырьковых пирожках, по сравнению с инфранатантными субмикронными формами показывает, что только четверть пиро-липидов распределяется в микропузырьках с «спайкингом». Напротив, более высокие количества пиро-липидов включаются в микропузырьки для «измельченного» введения хелаторов. Более низкое включение пиро-липидов в «шипастые» микропузырьки, вероятно, является фактором, способствующим их распределению по размерам, напоминающему микропузырьки без зонда по сравнению с связанными с ними «измельченными» микропузырьками (дополнительный рисунок 1C). Наличие неинкорпорированных пиролипидных структур, меченных радиоактивными веществами, может исказить результаты радиовизуализации или терапии. Таким образом, как и в случае с существующими протоколами, «спайковый» подход должен сопровождаться этапом центрифугирования или декантации, который удаляет неинкорпорированные пиролипидные соединения. Принимая во внимание все вышеизложенное, более настоятельно рекомендуется использовать стратегию радиоактивного мечения, представленную в текущем протоколе. Это обеспечивает более высокую интеграцию хелатора по сравнению с «спайкингом» и позволяет настраивать рецептуру микропузырьков, в отличие от предварительно сформированных коммерческих микропузырьков.
«Измельченный» протокол хелатирования меди был разработан в результате систематического исследования параметров реакции, как описаноранее48. Этот процесс оптимизации позволил получить представление о критических этапах производства качественных микропузырьков с одновременным обеспечением эффективного и своевременного хелатирования меди: 1) поддержание содержания 10% глицерина и 10% вспомогательного вещества пропиленгликоля до активации микропузырьков, 2) обеспечение поддержания температуры хелатирования в диапазоне 60-80 °C, 3) увлажнение пленок AA-PGG в день радиоактивного мечения (следует воздержаться от длительного воздействия липидной суспензии в кислых условиях), 4) нейтрализация липидной суспензии перед активацией и 5) обеспечение этапов «охлаждения» после гидратации, хелирования и активации. Соотношение порфирин:медь должно быть выше 10:1. Избыток порфирина по отношению к меди необходим для поддержания размера микропузырьков, выхода, стабильности и эффективности хелатирования, а также для двойной радио- и флуоресцентной визуализации, поскольку хелатирование меди гасит флуоресценцию порфирина. Объем реакции 1 мл и время хелатирования в 1 ч позволили получить эффективное и чистое радиоактивное мечение для пиро-липидных суспензийных композиций с концентрацией 30 мол.%, что соответствует <1% пиро-липидных фрагментов в меченых микропузырьках. Снижение пиролипидных композиций в липидных пленках до 1 моль % и 10 моль % снижало избыток пиролипидов при том же добавлении меди-64 и требовало модификации реакции радиоактивного мечения. Требовалась более концентрированная реакция, и, таким образом, связанные с ними пленки микропузырьков гидратировали 0,15 мл AA-PGG. После нейтрализации добавляли PGG для получения объема липидной суспензии с радиоактивной меткой в 1 мл до активации микропузырьков. Композиция с концентрацией 1 моль требовала более длительного нагрева (1,5-2 ч) для получения ≥95% эффективности и чистоты радиоактивного мечения. Таким образом, при возникновении проблем с радиоактивным мечением (т.е. ≤90% радиохимической чистоты и эффективности), можно опробовать более длительное время реакции и меньший объем реакции (т.е. более концентрированную липидную суспензию).
В этом протоколе использовали iTLC и валидированный метод центробежной фильтрации15 для количественной оценки радиохимической чистоты и эффективности радиоактивного мечения, соответственно. Признаком успешного и стабильного хелатирования меди-64 in vivo является отсутствие сигнала мочевого пузыря (свободный медь-64 подвергается почечной экскреции, в то время как липидные надмолекулярные структуры, такие как оболочки микропузырьков, подвергаются гепатобилиарной/фекальной экскреции)15. Эффективность хелатирования была подтверждена с помощью высокоэффективной жидкостной хроматографии (дополнительный рисунок 2), которая, если таковая имеется, является еще одним средством оценки радиохимической чистоты и эффективности мечения. В этом протоколе iTLC и центробежная фильтрация были представлены как более быстрые и простые методы, которые не требуют специальных навыков или инструментов, а скорее используют оборудование, которым с большей вероятностью обладают ядерные объекты исследовательских лабораторий. С этой целью протокол центробежной фильтрации был валидирован для разделения свободной и хелатной меди с использованием 30 000 установок MWCO (также можно использовать 100 000 установок MWCO). При использовании альтернативного радиоизотопа/металла может потребоваться изменить скорость центрифуги, время и количество промывок. Если используется альтернативный металл, для которого хелатная стабильность медь-металл неизвестна или нестабильна, следует также провести соответствующее испытание на стабильность сыворотки.
Помимо проблем с радиоактивным мечением, могут также возникнуть проблемы с изготовлением микропузырьков. Как уже было сказано ранее, микропузырьки хрупкие, и шаги по их изготовлению требуют точности и бережного обращения, без чего могут возникнуть проблемы с гидратацией, активацией, воспроизводимостью, стабильностью и выходом, как показано на рисунке 3. Другие факторы, способствующие успешному изготовлению микропузырьков, включают: 1) использование свежих, сухих липидов (храните сухие липиды в эксикаторе и защищайте от льда), 2) отказ от использования липидных аликвот, которые подвергались воздействию тепла (например, при быстром вакуумировании), и 3) приготовление свежего гидратационного буфера, лишенного пузырьков воздуха. В тех случаях, когда при изготовлении контрольных микропузырьков получаются подходящие продукты, но не те, которые образуются после радиоактивного мечения, могут быть задействованы дополнительные соображения. Температура и продолжительность реакции хелатирования могут находиться за пределами 60-80 °C и 0-2 ч, для которых был валидирован настоящий протокол. Кроме того, вполне возможно, что удельная активность меди-64 или других радиоизотопов может быть значительно ниже, чем та, которая связана с текущим исследованием. Это приведет к большему соотношению видов порфирина, меченных для одного и того же уровня активности (например, ниже, чем избыток порфирина:меди 10:1, для которого был валидирован этот протокол), что может нарушить активацию микропузырьков.
Многие из вышеперечисленных проблем при успешном изготовлении микропузырьков можно смягчить, сначала опробовав описанную схему изготовления микропузырьков в отсутствие радиоактивного мечения, особенно если пользователи являются новичками в синтезе микропузырьков. Рекомендуется сначала генерировать контрольные нехелатные микропузырьки, а затем очерчивать протокол маркировки «холодной» нерадиоактивной медью. Как описано выше, этот процесс «холодного» хелатирования жизненно важен для получения репрезентативной физико-химической характеристики радиоактивно меченых микропузырьков. «Холодное» хелатирование также служит важным первым шагом в обеспечении того, чтобы любые изменения, внесенные в описываемый протокол (например, изменение температуры хелатирования, объема, времени реакции, соотношение порфирин:медь, радиоизотоп, альтернативный хелатор), сохраняли желаемые физико-химические свойства микропузырьков.
Одним из таких изменений может стать использование альтернативных хелаторов и зондов. Ограничением текущего протокола является использование в нем коммерчески недоступного хелатора. В связи с этим представлены модификации (раздел 8 протокола), которые позволяют использовать коммерчески доступные хелаторы и флуоресцентные зонды вместо пиролипидов. Были получены данные испытаний, связанных с включением DiI или DTPA-липидов в качестве альтернатив пиролипидам (рис. 6). DiI представляет собой коммерчески доступный зонд, который был встроен в оболочки микропузырьков для изучения механизмов микропузырьков-FUS и моделирования лекарственных агентов 49,50,51. Насколько нам известно, это первое сообщение о липидном микропузыре DTPA. Успешная замена пиролипидов этими альтернативными фрагментами говорит об универсальности текущего протокола изготовления микропузырьков и маркировки. Вероятно, он может быть применен к более широкому спектру зондов, особенно к тем, которые привязаны к фосфолипидам или которые могут интегрироваться между ними.
Несмотря на то, что пиролипид является заменителем в этом протоколе, он обладает уникальным преимуществом, заключающимся в том, что он обладает дополнительными возможностями радиовизуализации и отслеживания флуоресценции в пределах одной органической молекулы. Такая мультимодальность может быть полезной для мониторинга доставки скорлупы микропузырьков и биораспределения. Особенно это актуально при использовании пиролипидных составов ≥10 моль%. При увеличении состава пиролипиды в оболочках микропузырьков (и в супрамолекулярных структурах в целом) становятся все более флуоресцентно гасящимися15. При разрушении частиц более высокие порфириновые составы дают значительно более сильные флуоресцентные сигналы (дополнительный рисунок 3). Это негашение флуоресценции может служить дополнительным считыванием при визуализации судьбы оболочки микропузырьков. Например, в то время как ПЭТ облегчает количественную оценку абсолютной доставки оболочки/биораспределения, флуоресцентная визуализация может зафиксировать, связано ли такое накопление с разрушением частиц.
Тем не менее, одним из ограничений более высоких пиро-липидных молярных композиций является влияние, которое они оказывают на размер и выход микропузырьков. Было обнаружено, что замена липидов хозяина на увеличивающиеся пиролипидные композиции в коммерческом составе липидных микропузырьков приводит к образованию более крупных пузырьков, более низкому выходу микропузырьков и более нестабильным микропузырькам. Для удобства ознакомления эти результаты обобщены на дополнительном рисунке 3 для пиролипидных композиций 1 мол, 10 моль % и 30 моль %, для которых был валидирован текущий протокол радиоактивного мечения. Это изменение размера микропузырьков при добавлении зонда характерно не только для пиролипидов. Например, при композиции 5 моль включение DiI в коммерческую рецептуру липидных микропузырьков снизило выход микропузырьков в 10 раз и увеличило размер микропузырьков более чем на 60% (Рисунок 6). Для сравнения, пиролипидная композиция с содержанием 5 моль не демонстрировала существенной разницы в выходе, среднем объеме или пиковом объеме, но увеличивала средний размер микропузырьков на 25%15. Кроме того, увеличение пиролипидного состава с 1 моль % до 30 моль не оказывает существенного влияния на циркуляцию раковины и пути выведения15. Однако, если желательно сохранение распределений по размерам, связанных с бесзондовыми или коммерческими составами, можно применять текущий протокол изготовления микропузырьков и радиоактивного мечения с использованием пиро-липидной композиции в 1 мол.%. Это низкое количество пиро-липидного включения существенно не изменяет какие-либо параметры размера или выхода, связанные с исходными составами без зондов (дополнительный рисунок 3). Однако это происходит за счет потери сильных активируемых флуоресцентных способностей, связанных с более высокими пиролипидными составами. Компромиссным решением может стать подбор пиролипидной композиции с содержанием 10 мол.%. В целом, учитывая, что пиролипидные композиции с концентрацией всего в 1 моль поддаются текущему протоколу радиоактивного мечения, существует большая степень модульности, на основе которой можно адаптировать размеры микропузырьков, выход и флуоресценцию.
В целом, всеобъемлющая адаптируемость текущего протокола радиоактивного мечения может сделать возможным множество применений микропузырьков с радиоактивной меткой, рассмотренных во Введении. Возможно, наиболее актуальным для современного ландшафта области микропузырьков-FUS является радиоточное отслеживание судьбы оболочки микропузырьков для проектирования платформ доставки лекарств под визуальным контролем. Это применение меченых радиоактивными микропузырьками было изучено в недавнем исследовании15. Текущий протокол радиоактивного мечения был применен для создания серии мультимодальных меченых медью-64 порфириновых микропузырьков с различной длиной и зарядом ацильной цепи, представляющих собой наиболее широко изученные композиции липидных микропузырьков в клинической и доклинической литературе. Растворение газов in vivo , очищение оболочки, биораспределение и кинетика разборки контролировались у здоровых мышей и мышей с опухолями с помощью ультразвука, ПЭТ и флуоресцентной визуализации, что привело к первому в своем роде продольному и систематическому фармакокинетическому исследованию липидных микропузырьков. Основные выводы включали: 1) ядра микропузырьков растворяются в течение нескольких минут, в то время как увеличение длины липидной цепи микропузырьков приводит к более медленному растворению нейтральных микропузырьков и более быстрому растворению анионных микропузырьков (наиболее похоже на коммерческие составы); 2) Остатки оболочек циркулировали в крови более 24 ч и выводились через гепатобилиарный/селезеночный/фекальный путь; 3) Такой клиренс зависел от состава микропузырьков, так что оболочки с более короткой длиной цепи подвергались более высокой печеночной обработке, в то время как оболочки с более длинной цепью демонстрировали более высокое поглощение селезенкой; 4) Оболочки микропузырьков претерпевали преимущественное накопление в опухолях по сравнению с окружающими тканями уже в первую временную точку после инъекции ПЭТ (1 ч), при этом микропузырьки с нейтральной оболочкой C18 демонстрировали самое высокое пассивное и усиленное FUS поглощение (максимальное усиление через 3,5 ч после лечения), несмотря на содействие аналогичным уровням FUS-опосредованного открытия сосудов (как определено при совместном введении синего Эванса); 5) В целом, усиление FUS при доставке опухолевых оболочек было скромным и неодинаковым среди всех составов микропузырьков, демонстрируя, что доставка оболочки с нагрузкой на груз с помощью FUS не может быть достигнута повсеместно через различные микропузырьки и может потребовать более высокого давления FUS; 6) оболочки микропузырьков внутри опухоли, печени и селезенки обнаружены преимущественно во внесосудистом пространстве; и 7) оболочки с более короткой длиной цепи подвергались более быстрой разборке, при этом опухоль имела самые высокие показатели разборки фрагментов оболочки. Эти результаты прояснили общепринятые представления в области микропузырьков-FUS и опровергли некоторые предположения, связанные с оптимальным дизайном микропузырьков для доставки опухолей на основе оболочек. Основные первоначальные рекомендации включали использование липидов C18 для создания микропузырьков, наполненных лекарствами, для мишеней селезенки, липидов C16 для мишеней печени, нейтральных более длинных цепей для ультразвуковой контрастной визуализации и более длительного кровообращения, нейтральных липидов C18 для опухолевых мишеней, противопоказано использование препаратов с гепатоспленической токсичностью в липидных микропузырьках, загруженных оболочкой «все в одном», и применение таких систем для опухолей с низкой исходной проницаемостью сосудов. Таким образом, это исследование положило начало взаимоотношениям между структурой и активностью, которые могли бы помочь в более оптимальном дизайне микропузырьков и послужили основой для дальнейших исследований, которые стали возможными благодаря текущему протоколу радиоактивного мечения. Эта способность была расширена за счет использования полученного набора данных фармакокинетики микропузырьков для создания адаптированного инструмента глубокого обучения для автоматической сегментации органов ПЭТ/КТ, что позволяет более эффективно анализировать фармакокинетические данные. 52
Основное внимание в настоящем протоколе было уделено радиоактивному мечению липидных микропузырьков. Однако в контексте конструкций ультразвуковых агентов с грузом было бы упущением упустить из виду нанокапли и полимерные микропузырьки. Нанокапли представляют собой системы с фазовым переходом, которые состоят из жидкого перфторуглеродного ядра, инкапсулированного липидной, белковой или полимерной оболочкой. При более интенсивном FUS эти нанокапли превращаются в микропузырьки путем акустического испарения жидкого ядра. Этот механизм активности FUS и меньший размер нанокапель имеют потенциальные преимущества для доставки через оболочку: 1) более длительная стабильность in vivo, 2) большая проницаемость в тканях и более высокая доставка опухоли, 3) возможность как сосудистой, так и внесосудистой активности, и 4) быстрое высвобождение препарата после акустической вапоризации 50,53,54. Таким образом, радиоактивное мечение нанокапель с грузом также будет полезно для радиослежения и планирования лечения под визуальным контролем в будущей работе. Существующий протокол радиоактивного мечения может быть легко включен в нанокапли, изготовленные методом конденсации, который, как было показано ранее, обеспечивает загрузку порфирин-липидов внутри нанокапельных оболочек35.
Также считается, что полимерные микропузырьки демонстрируют преимущества доставки лекарств через оболочку по сравнению с липидными микропузырьками из-за их жесткой и модульной оболочки, обеспечивающей более высокую предполагаемую стабильность при загрузке лекарств, инкапсуляции груза и настраиваемости загрузки лекарств за счет модуляции толщины полимерной оболочки и состава материала 55,56,57. Благодаря своей стабильности полимерные микропузырьки могут не сталкиваться с теми ограничениями радиоактивного мечения, что и липидные микропузырьки, для преодоления которых был разработан текущий протокол. Тем не менее, текущий протокол все еще может быть использован для информирования о полимерном микропузырьковом радиомечении по двум причинам: 1) характеристика микропузырьков и 2) эффективность хелатирования. Радиоактивное мечение полимерных микропузырьков в исследовании ограничено, но обычно включает в себя функционализацию поверхности полимерных оболочек с помощью хелаторов (например, DOTA и NOTA) с последующим добавлением изотопов, нагреванием и промывкой для удаления свободного изотопа27,58. Подобно существующим протоколам радиоактивного мечения липидных микропузырьков, эти отчеты не характеризуют физико-химические свойства микропузырьков после мечения. Таким образом, текущий протокол может быть использован в качестве основы для стандартизации использования «холодной» маркировки и характеризации при радиоактивном мечении любого типа оболочки микропузырьков. Кроме того, существуют возможности для улучшения выхода радиоактивного мечения полимерных микропузырьков (сообщается о диапазоне 42%-85% для микропузырьков, привитых хелатором58). Использование порфирина в качестве сильного и эффективного радиоизотопного хелатора в данном исследовании может быть реализовано в будущей работе путем адаптации существующих методов сопряжения порфирина и полимерной оболочки59 перед хелированием меди. В целом, полимерные микропузырьки не так популярны, как липидные микропузырьки. Липидные микропузырьки являются единственным вариантом оболочки, в настоящее время клинически одобренным для использования человеком, что делает их предпочтительным материалом для более быстрой трансляции терапевтических платформ микропузырьков-FUS. Кроме того, несколько прямых сравнений полимера и терапевтического ФУЗ с липидной оболочкой позволяют предположить, что липидные оболочки способствуют большей проницаемости сосудов, более быстрому высвобождению препарата, высвобождению препарата, инициируемому ФУЗ, более сильной абляции тканей и более быстрому повышению температуры в парадигмах высокоинтенсивного ФУЗ 60,61,62. Таким образом, в совокупности липидные микропузырьки более широко изучаются для применения в терапевтических ФУС, чем другие варианты оболочек. Соответственно, фокус текущего протокола радиоактивного мечения на липидных микропузырьках совпадает с фокусом более широкого поля микропузырьков-FUS.
Помимо информирования о механизмах микропузырьков-FUS и конструкциях микропузырьков, нагруженных грузом, микропузырьки с радиоактивной меткой также могут быть полезны длялучевой терапии. Интерес к сочетанию ФУС и радиотераностики в рамках одного препарата основан на доказательствах того, что микропузырьковый ФУС действует синергетически с лучевой терапией для усиления лучевой терапии противоопухолевогоответа 16. Текущий протокол радиоактивного мечения может быть адаптирован для использования меди-67 (более подходящей для лучевой терапии63) вместо меди-64 для создания такого радиотерановостного микропузырька. Тем не менее, фармакокинетическое исследование, проведенное на основе современной стратегии радиомечения липидных микропузырьков, показало высокое накопление в печени оболочек микропузырьков15. Это нецелевое накопление является важным фактором, если меченые радиоактивными метками микропузырьки применялись в качестве двойных агентов FUS/лучевой терапии.
В этом контексте необходимы стратегии смягчения токсичности гепатосплении. Например, как подробно рассмотрели Navarro-Becerra и Borden64, многие авторы функционализировали липидные микропузырьки с помощью лигандов, нацеленных на опухоль (например, VEGFR2 mAb, RGD, фолат) посредством связи биотин/авидин и электростатической абсорбции. Эта биофункционализация увеличивает доставку груза в раковину к опухолям, уменьшает накопление нецелевых тканей и улучшает терапию опухолей 32,65,66. Поскольку функционализация, как правило, является электростатической по своей природе, текущий протокол радиоактивного мечения и изготовления микропузырьков может быть использован «как есть» до поглощения лиганда. Может потребоваться корректировка протокола радиоактивного мечения для учета любых термочувствительных пептидных и белковых лигандов, которые должны быть включены ковалентно (например, PEG-липидные конъюгированные пептиды). В этих случаях время реакции хелатирования может быть увеличено при одновременном снижении температуры реакции до 37 °С, что позволяет обеспечить эффективное хелатирование порфирин-медь в наночастицах липопротеинов при сохранении возможностей нацеливания34. Тем не менее, маловероятно, что добавление нацеленных лигандов на поверхность меченых радиоактивных микропузырьков полностью уменьшит опасения по поводу токсичности гепатосплении, связанные с лучевой терапией более высокими дозами микропузырьков меди-67. Например, функционализация микропузырьков с антителами p-селектина удвоила их доставку опухоли у мышей и снизила накопление печени в 4 раза, при этом накопление печени все еще оставалось на существенном уровне 9% ID/г (в два раза выше, чем накопление опухоли) через 1 ч после инъекции. Более перспективной альтернативой таргетным лигандам может быть локорегионарная доставка радиотерапевтических микропузырьков через внутриопухолевое введение. Несмотря на то, что внутриопухолевое введение микропузырьков является нетипичным способом введения микропузырьков, Bismuth et al.39 показало, что достигается сильная абляция опухоли (50% перфорация тканей) при однократном лечении FUS в течение 60 с (MI 0,9). Можно было бы ожидать еще более сильной абляции опухоли, если бы указанные микропузырьки обладали дополнительными радиотерапевтическими возможностями. С этой целью будущая работа также может выиграть от использования кислородных ядер в радиоактивно меченых микропузырьках для дальнейшего усиления синергии микропузырьков-FUS/лучевой терапии за счет снижения гипоксии опухоли67,68. Перед их применением в качестве двойных ФУС/радиотерапевтических агентов, внутриопухолевые микропузырьки, меченные радиоактивными метками, должны быть фармакокинетически оценены, чтобы гарантировать, что локорегионарная доставка не вызывает системной утечки. Это подчеркивает внутреннюю важность радиослежения во всех предполагаемых применениях меченых микропузырьков, которые стали возможными благодаря текущему исследованию.
Таким образом, текущий протокол обеспечивает достижения в области микропузырькового радиомечения. К его совокупным преимуществам относятся улучшенное «измельченное» включение хелаторов, высокая эффективность хелатирования, отсутствие очистки свободных радиоизотопов или хелататоров после мечения, сохранение физико-химических свойств микропузырьков, универсальное применение в различных составах микропузырьков, адаптивность к альтернативным хелаторам и флуорофорам, а также индивидуализация хелаторного состава и связанной с ним мультимодальности и размера частиц. В конечном счете, он дает специализированные радио- и/или флуоресцентно активные микропузырьки, которые могут улучшить механистическое понимание и тераностические возможности микропузырьков-FUS. Эти приложения могут включать в себя получение репрезентативных количественных фармакокинетических данных, расширение возможностей мультимодальной визуализации микропузырьков, облегчение оптимизации терапии под визуальным контролем и обеспечение синергетической радиотерапии микропузырьковой ФУС (и/или порфирин).
Раскрытие информации
Авторы не сообщают о конфликте интересов.
Благодарности
Мы благодарим Дебору Сколлард и Тишу Комал (программа Университетской сети здравоохранения по пространственно-временному таргетированию и усилению радиационного ответа (STTARR), Торонто, Онтарио) за их технические услуги и руководство. Мы также благодарим Марка Чжэна и доктора Алекса Даливала за их техническую помощь во время конфокальной микроскопии и Advanced Optical Microscopy Facility (Торонто, Онтарио) за предоставление соответствующего оборудования. Мы выражаем признательность нашим источникам финансирования: Канадские институты исследований в области здравоохранения, Научно-исследовательский институт Терри Фокса, Совет по естественным наукам и инженерным исследованиям Канады, Канадский фонд инноваций, Фонд принцессы Маргарет по борьбе с раком, Канадская программа исследовательских кафедр, Центр Маклафлина, Стипендиальная программа Ванье, Программа стипендий для аспирантов Онтарио, Канада по раку предстательной железы и Благотворительный фонд Питерборо имени К. М. Хантера.
Материалы
| Name | Company | Catalog Number | Comments |
| 64CuCl2 | Washington University School of Medicine, Mallinckrodt Institute of Radiology | N/A | Order in small volume (<10 µL) dissolved in 0.1 N HCl |
| Acetic acid | Any company | ≥ 95% purity | |
| Aluminum foil | Any company | ||
| Ammonium acetate | Any company | Purity: ≥ 98% | |
| Balance - analytical | Any company | Able to measure down to 0.1 mg | |
| Bath sonicator | Any company | Can be heated to 69 oC | |
| CC aperture - 30 micron | Beckman Coulter | A36391 | Particle diameter range: 0.6-18 um |
| CC electrolyte | Beckman Coulter | 8546719 | Isoton II diluent |
| CC Software | Beckman Coulter | Multisizer 4e | |
| Centrifuge filter units (0.5 mL 30,000 MWCO) with compatible microcentrifuge tubes | MilliporeSigma | UFC503096 | Amicon Ultra - 0.5 mL |
| Centrifuge tubes - 15 mL with caps | Any company | ||
| Chloroform | Any company | Purity: ≥ 99.8% | |
| Coulter counter | Beckman Coulter | B43905 | Multisizer 4e Coulter Counter |
| Cover slips | VWR | 48393081 | VWR micro cover glass |
| CuCl2 | Any company | Ensure not oxidized | |
| CuCl2 | |||
| Cuvette- quarts, 1 cm path length | Any company | ||
| Cuvettes - 10 mL plastic for CC measurements | Beckman Coulter | A35471 | Coulter Counter Accuvette ST |
| ddH2O | Any company | Can be obtained through an ultrapure water purification system | |
| DiI (1,1'-Dioctadecyl-3,3,3',3'-Tetramethylindocarbocyanine Perchlorate) | Any company | Powder form | |
| Dose calibrator | Any company | Able to read copper-64 | |
| DPPA (1,2-dipalmitoyl-sn-glycero-3-phosphate (sodium salt)) | Avanti Polar Lipids | 830855P | Powder form |
| DPPC (1,2-dipalmitoyl-sn-glycero-3-phosphocholine) | Avanti Polar Lipids | 850355P | Powder form |
| DPPE-MPEG (1,2-dipalmitoyl-sn-glycero-3-phosphoethanolamine-N-[methoxy(polyethylene glycol)-5000] (ammonium salt)) | Avanti Polar Lipids | 880200P | Powder form |
| DTPA-lipid (1,2-dipalmitoyl-sn-glycero-3-phosphoethanolamine-N-diethylenetriaminepentaacetic acid (ammonium salt)) | Avanti Polar Lipids | 790106P | Powder form |
| EDTA (Ethylenediaminetetraacetic acid) | Any company | ||
| Gamma counter | Any company | Able to read copper-64 | |
| Gamma counting tube push caps | Globe Scientific | 22-171-665 | Flanged plug caps for 12 mm tubes |
| Gamma counting tubes | Sarstedt | 55.1579 | 5 mL, 75 x 12 mm, PS |
| Glass beaker - 250 mL | Any company | Able to withstand temperatures up to 100 oC | |
| Glass drying oven | Any company | Can be heated to 80 oC | |
| Glass microliter syringes - 25, 50, 100, 1000 µL | Any company | Compatible with organic solvents | |
| Glass scintillation vials - 20 mL | VWR | 66022-081 | VWR® Scintillation Vials, Borosilicate Glass, with Screw Caps, With pulp foil liner |
| Glass vials - 0.5 dram | VWR | 66011-020 | VWR Vial 1/2 dram, with black phenolic screw cap and polyvinyl-faced pulp liner |
| Glycerol | Sigma Aldrich | G7757-1L | Purity: ≥ 99.0% |
| Graduated pipette/gun | Any company | ||
| Hot/stir plate | Equipped with temperature prob for automatic tempearture control | ||
| Hydrochloric acid - 0.1 N | Any company | ||
| iTLC plates | Agilent | A120B12 | iTLC-SA chromatography paper |
| Laboratory tissues | Any company | ||
| Media vaccuum filtration unit | Any company | 0.22 micron pore size, PES membrane, 500 mL funnel capacity | |
| Methanol | Any company | Purity: ≥ 99.8%, HPLC grade, meets ACS specifications | |
| Microcentrifuge tubes non sterile - 1.5 mL | Any company | ||
| Microcentrifuge tubes sterile - 1.5 mL | Any company | ||
| Micropipetes - p1000, p200, p20, p10 | Any company | Ensure are calibrated | |
| Microscope slides | Fisher Scientific | 12-550-15 | Superfrost Plus Microscope Slides Precleaned |
| Needles - 18 G | Sterile | ||
| Parafilm | Any company | ||
| PBS | Sigma Aldrich | D8537-500ML | DPBS, modified, without calcium chloride and magnesium chloride, liquid, sterile-filtered, suitable for cell culture |
| PFP | FluoroMed | APF-N40HP | Purity: ≥ 99.8% |
| PFP line | Any company | 1/4 inch diameter plastic hose cut about 50 cm in length | |
| PFP regulator | Swagelok | SS-1RF4 and SS-4HC-1-4 | |
| pH meter | Any company | ||
| pH standards 4 and 7 | Any company | ||
| Pipette tips for p1000, p200, p10 - non sterile | Any company | ||
| Pipette tips for p1000, p200, p10 - sterile | Any company | ||
| Plastic syringe - 1 mL | Any company | Sterile | |
| Propylene glycol | BioShop | PRO888.500 | Purity: ≥ 99.5% |
| Pyro-lipid | N/A | Made in-house | |
| Rubber tipped forceps | Any company | Mix of fine-tipped and flat/square edges recommended | |
| Scissors | Any company | ||
| Sodium hydroxide - 1 N | Any company | ||
| Sodium hydroxide - 10 N | Any company | ||
| Spectrofluorometer | Any company | Capable of 410 nm excitation and 600-850 nm emission | |
| Spectrofluorometry software | Horiba | FluorEssence | |
| Spectrometer | Any company | ||
| Syringe - 1 mL | Any company | Disposible, plastic, sterile | |
| Syringe filters - 0.2 micron pore size | Any company | Membrane material: PES or other compatible with ammonium acetate/acetic acid and PBS | |
| Test tube - 10 mL | |||
| Triton X-100 | Any company | ||
| Vacuum desicator/vacuum | Any company | ||
| Vialmix | Lantheus Medical Imaging | 515030-0508 | Referred to in protocol as a mechanical vial shaker |
| Weigh paper | Any company | To avoid losing product, cutting weigh paper into 3x3 cm squares is recommended |
Ссылки
- Itani, M., Mattrey, R. F. The effect of inhaled gases on ultrasound contrast agent longevity in vivo. Mol Imaging Biol. 14 (1), 40-46 (2012).
- Kong, W. T., Wang, W. P., Huang, B. J., Ding, H., Mao, F. Value of wash-in and wash-out time in the diagnosis between hepatocellular carcinoma and other hepatic nodules with similar vascular pattern on contrast-enhanced ultrasound. J Gastroenterol Hepatol. 29 (3), 576-580 (2014).
- Wilson, S. R., Burns, P. N. Microbubble-enhanced us in body imaging: What role. Radiology. 257 (1), 24-39 (2010).
- Hynynen, K., Mcdannold, N., Vykhodtseva, N., Jolesz, F. Noninvasive mr imaging-guided focal opening of the blood-brain barrier bbb in rabbits. Radiology. 220 (3), 640-646 (2001).
- He, W., et al. Enhanced ablation of high intensity focused ultrasound with microbubbles: An experimental study on rabbit hepatic vx2 tumors. Cardiovasc Intervent Radiol. 34 (5), 1050-1057 (2011).
- Lipsman, N., et al. Blood-brain barrier opening in alzheimer's disease using mr-guided focused ultrasound. Nat Commun. 9 (1), 2336 (2018).
- Burke, C. W., Klibanov, A. L., Sheehan, J. P., Price, R. J. Inhibition of glioma growth by microbubble activation in a subcutaneous model using low duty cycle ultrasound without significant heating. J Neurosurg. 114 (6), 1654-1661 (2011).
- Dimcevski, G., et al. A human clinical trial using ultrasound and microbubbles to enhance gemcitabine treatment of inoperable pancreatic cancer. J Control Release. 243, 172-181 (2016).
- Haram, M., Hansen, R., Bouget, D., Myhre, O. F., Davies, C. L., Hofsli, E. Treatment of liver metastases with focused ultrasound and microbubbles in patients with colorectal cancer receiving chemotherapy. Ultrasound Med Biol. 49 (9), 2081-2088 (2023).
- Mainprize, T., et al. Blood-brain barrier opening in primary brain tumors with non-invasive MR-guided focused ultrasound: A clinical safety and feasibility study. Sci Rep. 9 (1), 321 (2019).
- Karakatsani, M. E., et al. Focused ultrasound mitigates pathology and improves spatial memory in alzheimer's mice and patients. Theranostics. 13 (12), 4102-4120 (2023).
- Aron, M., Vince, O., Gray, M., Mannaris, C., Stride, E. Investigating the role of lipid transfer in microbubble-mediated drug delivery. Langmuir. 35 (40), 13205-13215 (2019).
- Wang, S., Samiotaki, G., Olumolade, O., Feshitan, J. A., Konofagou, E. E. Microbubble type and distribution dependence of focused ultrasound-induced blood-brain barrier opening. Ultrasound Med Biol. 40 (1), 130-137 (2014).
- Huynh, E., Rajora, M. A., Zheng, G. Multimodal micro, nano, and size conversion ultrasound agents for imaging and therapy. Wiley Interdiscip Rev Nanomed Nanobiotechnol. 8 (6), 796-813 (2016).
- Rajora, M. A., et al. Quantitative pharmacokinetics reveal impact of lipid composition on microbubble and nanoprogeny shell fate. Adv Sci. 11 (4), 2304453 (2024).
- Leong, K. X., Sharma, D., Czarnota, G. J. Focused ultrasound and ultrasound stimulated microbubbles in radiotherapy enhancement for cancer treatment. Technol Cancer Res Treat. 22, 1-9 (2023).
- Li, Y., et al. Ultrasound-triggered release of sinoporphyrin sodium from liposome-microbubble complexes and its enhanced sonodynamic toxicity in breast cancer. Nano Research. 11, 1038-1056 (2017).
- Nomikou, N., Fowley, C., Byrne, N. M., Mccaughan, B., Mchale, A. P., Callan, J. F. Microbubble-sonosensitiser conjugates as therapeutics in sonodynamic therapy. Chem Commun. 48 (67), 8332-8334 (2012).
- Chakravarty, R., Hong, H., Cai, W. Positron emission tomography image-guided drug delivery: Current status and future perspectives. Mol Pharm. 11 (11), 3777-3797 (2014).
- Delalande, A., Leduc, C., Midoux, P., Postema, M., Pichon, C. Efficient gene delivery by sonoporation is associated with microbubble entry into cells and the clathrin-dependent endocytosis pathway. Ultrasound Med Biol. 41 (7), 1913-1926 (2015).
- Sheikov, N., Mcdannold, N., Vykhodtseva, N., Jolesz, F., Hynynen, K. Cellular mechanisms of the blood-brain barrier opening induced by ultrasound in presence of microbubbles. Ultrasound Med Biol. 30 (7), 979-989 (2004).
- Conway, G. E., Paranjape, A. N., Chen, X., Villanueva, F. S. Development of an in vitro model to study mechanisms of ultrasound-targeted microbubble cavitation-mediated blood-brain barrier opening. Ultrasound Med Biol. 50 (3), 425-433 (2024).
- Hu, S., Zhang, X., Unger, M., Patties, I., Melzer, A., Landgraf, L. Focused ultrasound-induced cavitation sensitizes cancer cells to radiation therapy and hyperthermia. Cells. 9 (12), 2595 (2020).
- Zhao, C., et al. Synergistically augmenting cancer immunotherapy by physical manipulation of pyroptosis induction. Phenomics. , (2024).
- Tachibana, K., Uchida, T., Ogawa, K., Yamashita, N., Tamura, K. Induction of cell-membrane porosity by ultrasound. Lancet. 353 (9162), 1409 (1999).
- Arif, W. M., et al. Focused ultrasound for opening blood-brain barrier and drug delivery monitored with positron emission tomography. J Control Release. 324, 303-316 (2020).
- Da Ros, V., et al. PVA-microbubbles as a radioembolization platform: Formulation and the in vitro proof of concept. Pharmaceutics. 15 (1), 217 (2023).
- Tartis, M. S., et al. Dynamic micropet imaging of ultrasound contrast agents and lipid delivery. J Control Release. 131 (3), 160-166 (2008).
- Willmann, J. K., et al. Targeted microbubbles for imaging tumor angiogenesis: Assessment of whole-body biodistribution with dynamic micro-pet in mice. Radiology. 249 (1), 212-219 (2008).
- Ingram, N., et al. Ultrasound-triggered therapeutic microbubbles enhance the efficacy of cytotoxic drugs by increasing circulation and tumor drug accumulation and limiting bioavailability and toxicity in normal tissues. Theranostics. 10 (24), 10973-10992 (2020).
- Hernández-Gil, J., et al. Development of 68ga-labelled ultrasound microbubbles for whole-body pet imaging. Chem Sci. 10 (215), 5603-5615 (2019).
- Warram, J. M., et al. Biodistribution of p-selectin targeted microbubbles. J Drug Target. 22 (5), 387-394 (2014).
- Liu, T. W., Macdonald, T. D., Shi, J., Wilson, B. C., Zheng, G. Intrinsically copper-64-labeled organic nanoparticles as radiotracers. Angew Chem Int Ed Engl. 51 (52), 13128-13131 (2012).
- Rajora, M. A., et al. Tailored theranostic apolipoprotein e3 porphyrin-lipid nanoparticles target glioblastoma. Chem Sci. 8 (8), 5371-5384 (2017).
- Yoo, K., Dhaliwal, A., Chen, J., Sheeran, P. S., Zheng, G. Synthesis and characterization of multi-modal phase-change porphyrin droplets. J Vis Exp. 176, e62665 (2021).
- Lovell, J. F., et al. Porphysome nanovesicles generated by porphyrin bilayers for use as multimodal biophotonic contrast agents. Nat Mater. 10 (4), 324-332 (2011).
- Huynh, E., Jin, C. S., Wilson, B. C., Zheng, G. Aggregate enhanced trimodal porphyrin shell microbubbles for ultrasound, photoacoustic, and fluorescence imaging. Bioconjug Chem. 25 (4), 796-801 (2014).
- Mcmahon, D., Hynynen, K. Acute inflammatory response following increased blood-brain barrier permeability induced by focused ultrasound is dependent on microbubble dose. Theranostics. 7 (16), 3989-4000 (2017).
- Bismuth, M., Katz, S., Rosenblatt, H., Twito, M., Aronovich, R., Ilovitsh, T. Acoustically detonated microbubbles coupled with low frequency insonation: Multiparameter evaluation of low energy mechanical ablation. Bioconjug Chem. 33 (6), 1069-1079 (2022).
- Kutscher, H. L., et al. Threshold size for optimal passive pulmonary targeting and retention of rigid microparticles in rats. J Control Release. 143 (1), 31-37 (2010).
- You, Y., et al. Porphyrin-grafted lipid microbubbles for the enhanced efficacy of photodynamic therapy in prostate cancer through ultrasound-controlled in situ accumulation. Theranostics. 8 (6), 1665-1677 (2018).
- Chen, X., Qin, B., Whitehurst, D., Helfield, B., Lavery, L., Villanueva, F. S. Sonodynamic therapy using protoporphyrin ix encapsulated microbubbles inhibits tumor growth. 2017 IEEE International Ultrasonics Symposium. , 1-4 (2017).
- Cheng, M. H. Y., et al. Targeted theranostic 111in/lu-nanotexaphyrin for spect imaging and photodynamic therapy. Mol Pharm. 19 (6), 1803-1813 (2022).
- Cheng, M. H. Y., Cevallos, A., Rajora, M. A., Zheng, G. Fast, facile, base-free microwave-assisted metallation of bacteriochlorophylls and corresponding high yield synthesis of tookad. J Porphyrins Phthalocyanines. 25 (07n08), 703-713 (2021).
- Macdonald, T. D., Liu, T. W., Zheng, G. An MRI-sensitive, non-photobleachable porphysome photothermal agent. Angew Chem Int Ed Engl. 53 (27), 6956-6959 (2014).
- Shao, S., et al. Functionalization of cobalt porphyrin-phospholipid bilayers with his-tagged ligands and antigens. Nat Chem. 7 (5), 438-446 (2015).
- Teh, J. H., et al. A kit-based aluminium-[(18)f]fluoride approach to radiolabelled microbubbles. Chem Commun (Camb). 57 (88), 11677-11680 (2021).
- Rajora, M. A. . Supramolecular Structure-Enabled Delivery of Porphyrin to Glioblastomas Beyond the Blood-Brain Barrier [Doctor of Philosophy thesis]. , (2024).
- Carugo, D., et al. Modulation of the molecular arrangement in artificial and biological membranes by phospholipid-shelled microbubbles. Biomaterials. 113, 105-117 (2017).
- Dhaliwal, A. . Utilizing Porphyrin to Improve Ultrasound-Activated Supramolecular Agent Design for Solid Tumor Delivery [Doctor of Philosophy thesis]. , (2023).
- Kilroy, J. P., Klibanov, A. L., Wamhoff, B. R., Bowles, D. K., Hossack, J. A. Localized in vivo model drug delivery with intravascular ultrasound and microbubbles. Ultrasound Med Biol. 40 (10), 2458-2467 (2014).
- Dhaliwal, A., et al. Deep learning for automatic organ and tumor segmentation in nanomedicine pharmacokinetics. Theranostics. 14 (3), 973-987 (2024).
- Shakya, G., Cattaneo, M., Guerriero, G., Prasanna, A., Fiorini, S., Supponen, O. Ultrasound-responsive microbubbles and nanodroplets: A pathway to targeted drug delivery. Adv Drug Deliv Rev. 206, 115178 (2024).
- Honari, A., Merillat, D. A., Bellary, A., Ghaderi, M., Sirsi, S. R. Improving release of liposome-encapsulated drugs with focused ultrasound and vaporizable droplet-liposome nanoclusters. Pharmaceutics. 13 (5), 609 (2021).
- Barmin, R. A., et al. Polymeric materials for ultrasound imaging and therapy. Chem Sci. 14 (43), 11941-11954 (2023).
- Chen, Y., Liang, Y., Jiang, P., Li, F., Yu, B., Yan, F. Lipid/PLGA hybrid microbubbles as a versatile platform for noninvasive image-guided targeted drug delivery. ACS Appl Mater Interfaces. 11 (45), 41842-41852 (2019).
- Barmin, R. A., et al. Engineering the acoustic response and drug loading capacity of pbca-based polymeric microbubbles with surfactants. Mol Pharm. 19 (9), 3256-3266 (2022).
- Barrefelt, A. A., et al. Multimodality imaging using SPECT/CT and MRI and ligand functionalized 99mTc-labeled magnetic microbubbles. EJNMMI Res. 3 (1), 12 (2013).
- Song, R., Hu, D., Chung, H. Y., Sheng, Z., Yao, S. Lipid-polymer bilaminar oxygen nanobubbles for enhanced photodynamic therapy of cancer. ACS Appl Mater Interfaces. 10 (43), 36805-36813 (2018).
- Böhmer, M. R., Chlon, C. H. T., Raju, B. I., Chin, C. T., Shevchenko, T., Klibanov, A. L. Focused ultrasound and microbubbles for enhanced extravasation. J Control Release. 148 (1), 18-24 (2010).
- Zhang, S., et al. Compare ultrasound-mediated heating and cavitation between flowing polymer- and lipid-shelled microbubbles during focused ultrasound exposures. J Acoust Soc Am. 131 (6), 4845-4855 (2012).
- Cao, Y., et al. Drug release from phase-changeable nanodroplets triggered by low-intensity focused ultrasound. Theranostics. 8 (5), 1327-1339 (2018).
- Krasnovskaya, O. O., et al. Recent advances in (64)cu/(67)cu-based radiopharmaceuticals. Int J Mol Sci. 24 (11), 9154 (2023).
- Navarro-Becerra, J. A., Borden, M. A. Targeted microbubbles for drug, gene, and cell delivery in therapy and immunotherapy. Pharmaceutics. 15 (6), 1625 (2023).
- Fan, C. -. H., et al. Antiangiogenic-targeting drug-loaded microbubbles combined with focused ultrasound for glioma treatment. Biomaterials. 34 (8), 2142-2155 (2013).
- Luo, T., et al. Ultrasound-mediated destruction of oxygen and paclitaxel loaded dual-targeting microbubbles for intraperitoneal treatment of ovarian cancer xenografts. Cancer Lett. 391, 1-11 (2017).
- Fix, S. M., et al. Oxygen microbubbles improve radiotherapy tumor control in a rat fibrosarcoma model - a preliminary study. PLoS One. 13 (4), e0195667 (2018).
- Eisenbrey, J. R., et al. Sensitization of hypoxic tumors to radiation therapy using ultrasound-sensitive oxygen microbubbles. Int J Radiat Oncol Biol Phys. 101 (1), 88-96 (2018).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены