Method Article
Fabricação e Rotulagem de Microbolhas com Traçadores Fluorescentes e Radioativos
Neste Artigo
Resumo
Este protocolo descreve a fabricação de microbolhas lipídicas e um método de radiomarcação de microbolhas de um pote compatível com eficiência de marcação de >95% sem purificação que conserva as propriedades físico-químicas das microbolhas. Este método é eficaz em diversas formulações de microbolhas lipídicas e pode ser adaptado para gerar microbolhas radioativas e/ou fluorescentes.
Resumo
As microbolhas são partículas cheias de gás com casca lipídica que evoluíram de agentes de contraste de ultrassom vascular para plataformas revolucionárias de terapia contra o câncer. Quando combinados com ultrassom focalizado terapêutico (FUS), eles podem superar com segurança e localmente as barreiras fisiológicas (por exemplo, barreira hematoencefálica), administrar medicamentos para cânceres inacessíveis (por exemplo, glioblastoma e câncer de pâncreas) e tratar doenças neurodegenerativas. O arsenal terapêutico do microbubble-FUS está avançando em novas direções, incluindo radioterapia combinada sinérgica, imagem multimodal e carregamento e entrega de medicamentos tudo-em-um a partir de conchas de microbolhas.
A marcação de microbolhas com radiotraçadores é fundamental para estabelecer essas capacidades teranósticas expandidas. No entanto, as estratégias existentes de radiomarcação de microbolhas dependem de metodologias de purificação conhecidas por perturbar as propriedades físico-químicas das microbolhas, usam radioisótopos de vida curta e nem sempre produzem quelação estável. Coletivamente, isso cria ambigüidade em torno da precisão da radioimagem de microbolhas e da eficiência da entrega de radioisótopos tumorais.
Este protocolo descreve uma nova metodologia de marcação de microbolhas sem purificação que preserva as propriedades físico-químicas das microbolhas enquanto atinge >95% de eficiência de quelação de radioisótopos. É versátil e pode ser aplicado com sucesso em formulações de microbolhas personalizadas e comerciais com diferentes comprimentos de cadeia lipídica de acila, carga e composição de quelante/sonda (porfirina, DTPA, DiI). Pode ser aplicado de forma adaptativa durante a fabricação de microbolhas moídas e em formulações de microbolhas pré-fabricadas com personalização modular de fluorescência e propriedades multimodais de fluorescência/radioativas. Assim, este método flexível permite a produção de microbolhas multimodais personalizadas e rastreáveis (rádio, fluorescente ou rádio/fluorescente ativa) que são úteis para o avanço de aplicações mecanicistas, de imagem e terapêuticas de microbolhas-FUS.
Introdução
Microbolhas são agentes teranósticos supramoleculares de tamanho mícron com um núcleo de gás estabilizado por uma proteína, polímero ou, na maioria dos casos, uma casca lipídica (Figura 1A). Quando injetadas na corrente sanguínea, as microbolhas mantêm interfaces gás/líquido que são detectáveis por ultrassom por períodos de minutos antes da dissolução de seus núcleos de gás 1,2. Consequentemente, o primeiro uso clínico das microbolhas foi como agentes de contraste de ultrassom em tempo real3. A invenção do ultrassom focalizado terapêutico (FUS) expandiu as utilidades clínicas de microbolhas. Quando estimuladas por FUS de baixa frequência, as microbolhas oscilam e geram forças mecânicas direcionadas e sintonizáveis que variam de permeabilização vascular transitória a ablação tecidual focal 4,5. Como resultado, nos últimos 20 anos, o FUS de microbolhas foi explorado para abertura da barreira hematoencefálica (BBB), administração de drogas tumorais (por exemplo, câncer metastático pancreático, cerebral e hepático), administração de sondas de imagem, terapia de doenças neurodegenerativas e ablação do câncer 6,7,8,9,10,11.
O arsenal teranóstico de microbolhas continua a avançar em novas e excitantes direções. As aplicações convencionais de entrega de microbolhas-FUS dependem da coadministração de carga terapêutica ou de imagem ao lado de microbolhas comerciais. Há um interesse crescente em aprimorar os recursos de entrega de microbolhas-FUS, entendendo as interações biológicas/casca de microbolhas, explorando formulações de microbolhas não comerciais personalizadas e gerando microbolhas teranósticas tudo-em-um com carga carregada diretamente no invólucro da microbolha 12,13,14. De fato, aproximadamente 40% dos estudos de liberação de medicamentos com microbolhas lipídicas fazem uso dessas microbolhas carregadas de concha15. Além da imagem e da administração de medicamentos, o microbubble-FUS também se mostrou promissor no aprimoramento da radioterapia contra o câncer16 e na ativação dos efeitos antineoplásicos de agentes benignos por meio da terapia sonodinâmica17,18.
Essas direções convencionais e expandidas em aplicações de câncer de microbolhas podem ser mais estrategicamente avançadas rotulando conchas de microbolhas com marcadores radioativos. No domínio das microbolhas carregadas de carga tudo-em-um, essa radiomarcação 1) facilita a avaliação quantitativa padrão-ouro da biodistribuição dentro e fora do alvo dessas conchas de microbolhas carregadas, 2) deriva relações farmacocinéticas de estrutura-atividade que informam a seleção ideal de composições de microbolhas para maximizar a entrega no alvo e 3) orienta a aplicação estratégica e apropriada guiada por imagem e o planejamento de tratamento (por exemplo, tipos de alvos de tecido, dosimetria, seleção de medicamentos para mitigar preocupações de segurança fora do alvo, utilidade em comparação com paradigmas convencionais de co-tratamento) de sistemas carregados de carga tudo-em-um15,19. Em um estágio pré-clínico, essa compreensão do destino da casca das microbolhas também pode iluminar mecanismos de ação mais amplos do microbolhas-FUS. Por exemplo, a transferência de lipídios de conchas de microbolhas para células-alvo demonstrou influenciar a sonoporação habilitada por FUS12,20. Compreender e otimizar essa transferência pode, portanto, informar as terapias pré-clínicas e clínicas de microbolhas-FUS nas quais a sonoporação está implicada (transfecção in vitro, administração de medicamentos, ablação de tumores, sensibilização à radiação e terapia sonodinâmica 20,21,22,23,24,25). As instalações duplas de ultrassom e radioimagem também permitiriam o monitoramento da abertura do vaso FUS e do tratamento (por exemplo, cinética de abertura da BHE) a partir de um único agente, em vez de projetos convencionais de agente duplo26. Na mesma linha, a radiomarcação de microbolhas lipídicas pode servir como uma alternativa completa de microbolhas-FUS/radioterapia de agente único às plataformas de co-entrega de microbolhas-FUS + radiofármacos27.
A fragilidade das microbolhas é um desafio não trivial para essa rotulagem. Todas as estratégias de radiomarcação existentes são limitadas por metodologias de purificação conhecidas por perturbar a estabilidade e o tamanho das microbolhas, enquanto algumas também apresentam radiomarcação ineficaz e instável 28,29,30,31,32. Os requisitos de purificação também levam a protocolos mais longos. Combinado com o uso de radioisótopos de vida curta (por exemplo, 18F t1/2 1,8 h,28,29 99mTc t1/2 6 h,3268Ga t1/2 1 h31), isso cria ineficiências relacionadas ao decaimento do radioisótopo e limita os prazos de radioimagem e planejamento de tratamento. Coletivamente, essas limitações correm o risco de aquisição de imagens de rádio encurtadas e não representativas, dados farmacocinéticos imprecisos e entrega ineficiente de radioisótopos tumorais.
Neste relatório, essas limitações são superadas aproveitando as capacidades de quelação de metais fortes e estáveis da porfirina. As porfirinas são macromoléculas orgânicas e heterocíclicas com um anel planar altamente conjugado e um local de coordenação central que pode acomodar uma variedade de metais. Isso inclui radioisótopos de vida mais longa, como cobre-64 (t1/2 12,7 h), um radiofármaco com tomografia por emissão de pósitrons (PET) e viabilidade de contagem de γ33. Quando conjugadas a uma estrutura lipídica, as porfirinas podem ser prontamente incorporadas em estruturas supramoleculares e subsequentemente marcadas com cobre-64 com velocidade, alta eficiência de quelação e estabilidade sérica, mantendo as propriedades das partículas originais não marcadas33,34. Além disso, as porfirinas são fluorescentemente ativas com auto-extinção modular em nano e micropartículas que é restaurada após a ruptura das partículas; uma leitura complementar ao PET e à contagem de γ que facilita a análise do destino da concha em massa e microscópica (Figura 1A)15.
Ao usar porfirina-lipídio como quelante, essas propriedades foram exploradas para gerar uma nova metodologia de radiomarcação de microbolhas sem purificação (Figura 1B, C) que supera as limitações associadas aos métodos de radiomarcação de microbolhas existentes. Este protocolo atinge >95% de eficiência de quelação de cobre-64, não requer purificação pós-rotulagem e preserva as propriedades físico-químicas das microbolhas. Ele pode ser facilmente integrado na fabricação "moída" de microbolhas lipídicas antes de sua ativação (Figura 1B). É versátil e pode ser aplicado com sucesso em formulações de microbolhas personalizadas e comerciais com diferentes comprimentos de cadeia lipídica de acila (C16 a C22), carga (neutra e aniônica) e composições lipídicas de porfirina (1 mol%, 10 mol%, 30 mol%), gerando microbolhas com atividade de rádio e fluorescência. Sua adaptabilidade também pode se estender além da porfirina. O protocolo de um pote pode ser modificado para usar quelantes alternativos disponíveis comercialmente (por exemplo, dietilenotriamina pentaacetato (DTPA)-lipídio) e fluoróforos (por exemplo, DiI). Ele também pode ser modificado para rotular formulações de microbolhas pré-fabricadas por meio de uma abordagem de "pico". Assim, este método permite a produção de microbolhas personalizadas e rastreáveis (rádio, fluorescentes ou rádio / fluorescente ativas duplas) úteis para o avanço de aplicações mecanicistas, de imagem e terapêuticas de microbolhas-FUS. O protocolo abaixo descreve a fabricação de microbolhas lipídicas, aplicação do protocolo de radiomarcação de um pote, radiomarcação necessária e caracterização de propriedades físico-químicas e possíveis modificações.
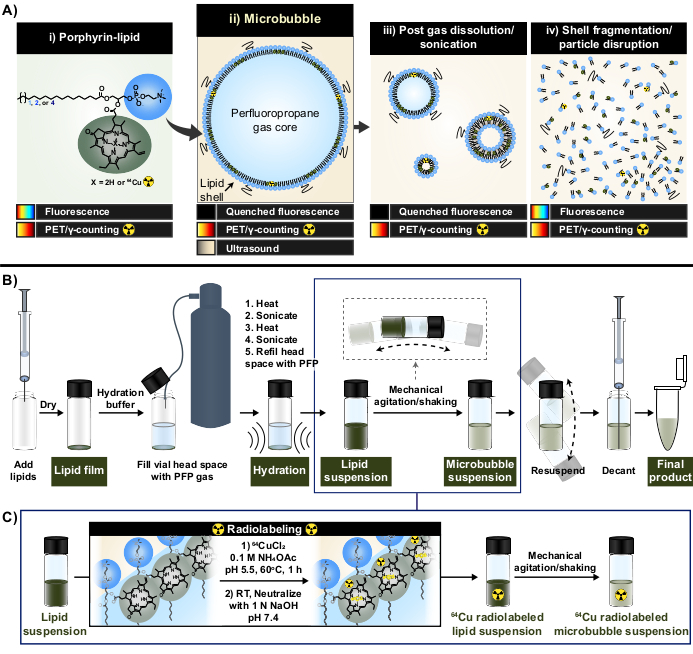
Figura 1: Protocolo de fabricação e radiomarcação de microbolhas. (A) O lipídio porfirina, na forma de pirofeoforbida-a-lipídio, serve como um quelante multimodal dentro deste protocolo. Como um monômero quelatado a cobre-64 (i), possui recursos de PET e imagem. Sua fluorescência é extinta na forma de partícula (microbolhas (ii) e sua nanoprogênie pós-dissolução (iii)) e não extinta com ruptura de partículas (iv). (B) Protocolo de hidratação/ativação do filme lipídico descrito neste relatório para gerar microbolhas lipídicas a partir do solo e (C) integração da radiomarcação de um pote entre a formação da suspensão lipídica e a ativação das microbolhas. Essa figura foi adaptada com permissão de Rajora et al.15. Clique aqui para ver uma versão maior desta figura.
Protocolo
1. Preparações de reagentes
- Prepare tampão de acetato de amônio (0,1 M, pH 5,5)
- Usando uma balança analítica, pesar 770,8 mg de acetato de amônio em um papel de pesagem. Transfira a quantidade pesada para um copo de vidro limpo de 250 mL.
- Adicionar ao copo 90 ml de água bidestilada (ddH2O), medida através de uma pipeta graduada. Adicione uma barra de agitação e coloque o copo em uma placa de agitação magnética para dissolver o acetato de amônio. Mexa a uma velocidade que crie um leve vórtice, mas sem respingos de solução.
- Calibre um medidor de pH de acordo com as instruções do instrumento usando os padrões de pH 4 e 7. Uma vez calibrado, insira a sonda de pH no tampão de acetato de amônio.
- Adicione 104 μL de ácido acético à solução, mexa para dissolver e meça o pH.
NOTA: O pH deve estar próximo de 5,5 neste ponto. - Ajuste o pH do tampão adicionando hidróxido de sódio 10 N (ou ácido clorídrico se o tampão se tornar muito básico) em incrementos de 5-10 μL usando uma micropipeta. Mexa, meça o pH e repita conforme necessário. Anote o volume de base/ácido adicionado.
- Adicione volume suficiente de ddH2O para criar um total de 100 mL de tampão.
NOTA: Por exemplo, se 45 μL de hidróxido de sódio 10 N foram usados durante o ajuste do pH, 9,851 mL de ddH2O seriam adicionados ao béquer (100 mL [volume alvo] - 90 mL [etapa 1.1.2] - 0,104 mL [etapa 1.1.4] - 0,045 mL [etapa 1.1.5] = 9,851 mL). - Mexa bem o tampão uma última vez antes de transferi-lo para um recipiente de armazenamento com tampa.
- Limpe o medidor de pH de acordo com as instruções do instrumento.
CUIDADO: O hidróxido de sódio aquoso concentrado e o ácido clorídrico podem causar reações cutâneas e devem ser manuseados com luvas.
- Prepare o tampão de hidratação (PGG)
- Aspire solução salina tamponada com fosfato (PBS) em uma seringa e equipe a extremidade com um filtro de seringa de polietersulfona de 0,2 μm de tamanho de poro. Filtre o PBS em um tubo de centrífuga com tampa de plástico limpo.
NOTA: Filtros de seringa de poros de 0,2 μm de materiais alternativos de membrana (por exemplo, fluoreto de polivinilideno) podem ser usados desde que a membrana seja compatível com PBS e acetato de amônio. - Combine PBS filtrado, propilenoglicol e glicerol via micropipeta em uma proporção volumétrica de 8:1:1 para fazer o tampão de hidratação (também conhecido como PGG). Ao adicionar propilenoglicol e glicerol, aspire e limpe quaisquer gotículas residuais de propilenoglicol ou glicerol da superfície da ponta da pipeta antes de pipetar lentamente o reagente no PBS. Uma turbidez viscosa clara em forma de corda será vista no PBS.
NOTA: Recomenda-se usar uma micropipeta p1000 para adicionar primeiro PBS a um tubo de centrífuga, seguido de propilenoglicol e glicerol, pois os dois últimos reagentes são viscosos. Como tal, eles devem ser aspirados lentamente através da micropipeta até que o movimento do fluido não seja mais visto na ponta da pipeta e de modo que nenhum ar seja absorvido quando a ponta da pipeta for removida do reagente. Idealmente, as ponteiras de micropipeta com marcações volumétricas devem ser usadas para escolher volumes de reagentes que se alinhem com essas marcações (por exemplo, fazendo 1 mL ou 5 mL de PGG e, respectivamente, usando a marcação de 0,1 mL ou 0,5 mL na ponta da micropipeta para visualizar a aspiração completa de propilenoglicol e glicerol). Ao limpar a superfície da ponta da micropipeta, não limpe a abertura da ponteira, apenas nas laterais. - Pipetar para cima e para baixo com a ponta da pipeta na solução até que os reagentes estejam homogeneamente dissolvidos. Tenha cuidado para não introduzir bolhas de ar na solução.
- Para garantir ainda mais uma mistura completa do tampão de hidratação, tampe o tubo da centrífuga e gire para cima e para baixo lentamente. Não vórtice.
- Girar o tubo a menos de 1000 x g durante 20-30 s (temperatura mínima de 4 °C, RT máximo) para remover bolhas de ar não observáveis.
- Aspire solução salina tamponada com fosfato (PBS) em uma seringa e equipe a extremidade com um filtro de seringa de polietersulfona de 0,2 μm de tamanho de poro. Filtre o PBS em um tubo de centrífuga com tampa de plástico limpo.
- Prepare tampão de hidratação/radiomarcação (AA-PGG)
- Filtro de seringa 0,1 M, tampão de acetato de amônio pH 5,5 (da etapa 1.1) e PBS em tubos separados conforme a etapa 1.2.1.
- Combine tampão de acetato de amônio filtrado, PBS filtrado, propilenoglicol e glicerol por meio de uma micropipeta p1000 em um tubo de centrífuga em um tampão de acetato de amônio 5:3:1:1: PBS: propilenoglicol: proporção volumétrica de glicerol na ordem listada. Siga as instruções de aspiração, mistura e centrifugação de acordo com as etapas 1.2.2-1.2.5 para fazer AA-PGG.
- Eluente de cromatografia instantânea em camada delgada (iTLC)
- Pesar até 0,1 g de ácido etilenodiaminotetracético (EDTA) e transferir para um frasco com tampa. Dissolva em ddH2O de modo que uma solução a 2% p / v de EDTA seja feita (por exemplo, para 50 mg de EDTA, adicione 2,5 mL de ddH2O).
- Combine a solução de EDTA a 2% p/v com o tampão de acetato de amônio da etapa 1.1 em uma proporção de 9:1 v/v (solução de EDTA a 90%, tampão de acetato de amônio a 10%). Tampe e armazene o eluente iTLC resultante.
2. Formação de filmes lipídicos
NOTA: Este procedimento descreve a formação de um filme lipídico com composições que imitam a microbolha comercial, Definity®, com porfirina-lipídio substituindo o lipídio do hospedeiro e constituindo 30% molar do lipídio total. No entanto, o protocolo de radiomarcação pode ser aplicado a diversas formulações lipídicas (comprimentos de cadeia C16, C18, C22, carga neutra ou aniônica, composições molares variadas de porfirina-lipídio). Uma Planilha Suplementar (Arquivo Suplementar 1) está anexada que fornece cálculos, composições, massas e volumes de estoque para as formulações descritas e outras. Todos os lipídios estão disponíveis comercialmente, com exceção da porfirina-lipídio, pirofeoforbita-a-lipídio (piro-lipídio), cuja síntese foi previamente descrita em detalhes35,36.
- Usando o Arquivo Suplementar 1, determine a massa total necessária para cada lipídio com base no número de filmes necessários.
- Pesar um frasco para injetáveis vazio de vidro de 0,5 dram numa balança analítica.
NOTA: A poeira interfere na formação bem-sucedida de microbolhas. Assim, sopre ar pressurizado no frasco para remover qualquer poeira/partículas se armazenado sem tampa. - Pesar 1,2-dipalmitoil-sn-glicero-3-fosfocolina (DPPC) em papel de pesagem.
NOTA: A massa pesada deve ser obtida na etapa 2.1 mais 0,5-1 mg adicional para compensar qualquer perda durante o manuseio da amostra em etapas posteriores. - Transfira o DPPC para o frasco de vidro pesado e pese-o novamente para determinar a massa lipídica no frasco. Esse processo permite uma transferência mais fácil de lipídios para o frasco de vidro, redução da perda/derramamento de pó lipídico e medição mais precisa da massa lipídica.
- Repita as etapas 2.2 a 2.4 com os outros lipídios: 1,2-dipalmitoil-sn-glicero-3-fosfoetanolamina-N-[metoxi(polietilenoglicol)-5000] (DPPE-mPEG), 1,2-dipalmitoil-sn-glicero-3-fosfato (DPPA) e C16 pirolipídio.
NOTA: Se o pirolipídio não estiver disponível na forma de pó pesável, mas sim como um filme ou alíquota de quantidade desconhecida, ele pode ser dissolvido em clorofórmio para formar um estoque cuja concentração pode ser calculada por meio de medições de absorbância UV-Vis em metanol usando a lei de Beer-Lambert, conforme descrito anteriormente35. - Prepare os seguintes solventes orgânicos e soluções em tubos de ensaio de vidro usando micropipetas ou seringas de vidro: 1) clorofórmio, 2) clorofórmio 9:1 v/v: metanol e 3) clorofórmio 65:35:8: metanol: ddH2O. Para o último, pipete os componentes e misture-os na seguinte ordem: ddH2O, metanol e clorofórmio.
CUIDADO: O metanol e o clorofórmio são perigosos para a saúde, inflamáveis e voláteis. Use proteção para os olhos, luvas e jaleco e use um exaustor. - Use o Arquivo Suplementar 1 para calcular o volume de solvente/solução orgânica necessário para fazer estoques de lipídios e selecionar seringas de vidro de volumes apropriados.
NOTA: Este volume deve produzir concentrações de estoque que correspondam a volumes de alíquota de estoque de 15-100 μL por filme que podem ser facilmente medidos usando seringas de microlitros de vidro de 25-100 μL. - Enxágue as seringas de vidro três vezes com clorofórmio. Bombeie o êmbolo para frente e para trás para secar a seringa.
- Meça e adicione o solvente/soluções orgânicas através da seringa de vidro limpa aos frascos lipídicos individuais de acordo com os cálculos da planilha na etapa 2.7 para formar estoques de lipídios. Dissolva o pirolipídio em clorofórmio (a menos que já esteja dissolvido de acordo com a nota da etapa 2.5), DPPC e DPPE-mPEG em 9:1 v/v clorofórmio: metanol e DPPA em 65:35:8 clorofórmio:metanol:ddH2O. Se estiver usando a mesma seringa de vidro para todas as adições, enxágue e seque entre cada lipídio.
NOTA: Se a formulação de escolha não contiver DPPA ou sua variante de comprimento de cadeia C18, então o pirolipídio, o lipídio do PC do hospedeiro e o lipídio PEG podem ser dissolvidos em clorofórmio. - Tampe os frascos e o vórtice.
- Adicione volumes calculados de soluções lipídicas estoque a um novo frasco de vidro de 0,5 dram (frasco de filme) por meio de uma seringa de microlitro de vidro. Para o primeiro estoque de lipídios, insira a ponta da agulha no centro inferior do frasco e mergulhe lentamente para evitar respingos nas paredes do frasco. Para adições subsequentes, coloque a ponta da agulha diretamente acima do nível do líquido e toque na lateral do frasco para remover quaisquer gotas finais de uma maneira que não exponha a agulha ao líquido abaixo.
NOTA: Enxágue e seque a seringa de vidro entre as adições de lipídios quando ocorrer contaminação. Se estiver fazendo vários filmes, tampe o filme e os frascos de estoque entre as adições para minimizar a evaporação do solvente. - Agite suavemente o frasco manualmente na posição vertical para misturar o conteúdo. Evite salpicar qualquer solução nas paredes do frasco para injetáveis.
- Destampe (guarde a tampa) e insira uma linha de nitrogênio no espaço livre do frasco. Ajuste o fluxo de nitrogênio para causar uma leve perturbação visível na superfície do líquido, mas sem qualquer afunilamento ou respingos.
- Vortex o frasco imediatamente após a inserção da linha de nitrogênio. Comece a uma velocidade baixa o suficiente para formar um funil com o solvente subindo não mais do que 1 cm do fundo do frasco. Evite respingos de solvente. À medida que o solvente evapora, aumente a velocidade do vórtice lentamente e sem pausa, mantendo a altura do solvente até que todo o líquido evapore. O resultado será uma película fina revestida no terço inferior do frasco.
- Coloque o frasco para injetáveis num dessecador equipado com vácuo e continue a secar a película sob vácuo durante 8-72 h. Cubra o frasco (exceto a abertura) ou o dessecador com papel alumínio.
NOTA: O protocolo pode ser pausado aqui. As próximas etapas podem ser realizadas após a secagem do filme, ou os filmes podem ser armazenados sob argônio, selados com Parafilm, em um freezer de -20 °C por até 1 mês e por mais tempo se mantidos secos.
3. Hidratação do filme lipídico
NOTA: Se as microbolhas forem usadas in vitro ou in vivo, use pontas, tubos, seringas e agulhas de micropipeta estéreis para as etapas 3.3 a 5.4, a menos que especificado de outra forma.
- Remova o filme do vácuo ou, se armazenado no freezer, deixe-o aquecer até o RT.
- Encha um copo de 250 ml com água e aqueça a água a 70-80 °C.
- Aquecer um sonicador em banho-maria a 69 °C.
- Micropipete 1 mL de AA-PGG (etapa 1.3) nas bordas do frasco para injetáveis de filme lipídico para evitar a formação de bolhas.
NOTA: Ao fabricar microbolhas de controle não quelatadas ou somente fluorescentes, use PGG (etapa 1.2) em vez de AA-PGG. - Cubra parcialmente a abertura do frasco com uma tampa, deixando espaço suficiente para inserir uma linha de perfluoropropano (PFP). Flua o PFP para o headspace do frasco por 20 s acima do líquido, de modo que o líquido seja visivelmente perturbado, mas não respingue. Não flua PFP diretamente para a suspensão. Tampe o frasco.
NOTA: Se o fluxo for adequado em força e tempo, o frasco começará a esfriar ao toque. - Mergulhe a metade inferior do frasco para injetáveis no banho-maria a 70-80 °C durante 1 min. Em seguida, sonicar durante pelo menos 30 s no sonicador de banho a 69 °C ou até que a película lipídica se disperse homogeneamente no AA-PGG. Evite criar bolhas ou ativar prematuramente a formação de microbolhas (a ativação prematura aparecerá como áreas leitosas/turvas na suspensão lipídica). Limpe a superfície do frasco quando necessário para discernir melhor se ainda restam lipídios não suspensos.
NOTA: Se o filme lipídico não hidratar dentro de 1 minuto após a sonicação, reaqueça no banho de 70-80 ° C e re-sonicate. - Assim que o filme lipídico estiver homogeneamente suspenso, aqueça uma última vez por 1 min e sonice por mais 30 s.
- Limpe o frasco para injetáveis e deixe-o arrefecer passivamente até à RT (~5-10 min).
- Reabasteça o headspace do frasco com PFP de acordo com a etapa 3.5, tampe e sele as bordas da tampa com Parafilm.
NOTA: O protocolo pode ser pausado aqui e retomado após o mais tardar 8 h.
4. Radiomarcação
NOTA: Para controle não quelado ou microbolhas somente fluorescentes, pule para a Seção 5 do protocolo.
CUIDADO: Execute as etapas 4.4-4.6 deste protocolo em um laboratório radioativo, a menos que especificado de outra forma. 64CuCl2 é um risco radiológico com risco de toxicidade multissistêmica por exposição, inalação ou ingestão da pele. Sempre que possível, manuseie-o em uma hotte indiretamente usando uma pinça com ponta de borracha. Use um jaleco protetor, um dosímetro pessoal de anel e crachá e luva dupla ao manusear. Certifique-se de que 64CuCl2 seja manuseado em blindagem de chumbo de 2 polegadas. Quando necessário, transporte-o em um recipiente com bainha de chumbo. Proteja os recipientes de resíduos e realize uma pesquisa operacional quanto à contaminação após o uso.
- Preparar um banho-maria a 60 °C num copo de vidro ou numa grande cápsula de cristalização contendo uma barra de agitação magnética. Use uma placa quente/agitadora com temperatura controlada equipada com uma sonda térmica inserida na água, configurada para mexer a uma taxa que produza um funil fraco, mas visível.
- Transfira um frasco selado contendo 64CuCl2 em HCl 0,1 N para um calibrador de dose por meio de uma pinça com ponta de borracha.
NOTA: Ao solicitar 64CuCl2, solicite que seja dissolvido em 5-20 μL de HCl 0.1 N. Um volume menor é fundamental para preservar o rendimento das microbolhas. - Observe a atividade do cobre-64 medida no calibrador de dose e o tempo. Remova o frasco com uma pinça e coloque-o em um recipiente com chumbo.
- Divida a atividade observada pelo volume relatado para o 64CuCl2 para obter um valor MBq·mL-1 .
- Destampe a suspensão lipídica da etapa 3.9 e prenda-a em um suporte para frascos.
- Destampe o frasco para injetáveis 64CuCl2 e prenda-o com uma pinça.
- Micropipetar um volume da solução de 64CuCl2 correspondente a 40-250 MBq de atividade e transferir para a suspensão lipídica. Certifique-se de que a ponta da pipeta esteja submersa na suspensão. Mergulhe e depois pipete para cima e para baixo para transferir completamente o 64CuCl2.
NOTA: A quantidade de 64CuCl2 adicionada dependerá da aplicação pretendida para as microbolhas radiomarcadas e da sensibilidade do calibrador de dose. Para PET longitudinal (até 48 h após a injeção) e amostragem de sangue in vivo em camundongos, recomenda-se um mínimo de 220 MBq e 50 MBq, respectivamente. - Tampe a suspensão lipídica e 64frascos para injetáveis de CuCl2 .
- Usando uma pinça plana com ponta de borracha, gire manualmente a suspensão lipídica radioativa para cima e para baixo pelo menos 5 vezes para misturar suavemente o 64CuCl2 através da suspensão. Evite agitar ou deixar cair o frasco para injetáveis e evite a formação de bolhas.
- Quando estiver com o lado direito para cima, sacuda suavemente a tampa do frasco para injetáveis, mantendo a suspensão estabilizada. Isso ajudará qualquer líquido preso na tampa a gravitar para o fundo do frasco. Destampar parcialmente o frasco para injetáveis com cuidado e inserir uma linha PFP equipada com agulha de 18 G. Encha o headspace do frasco com PFP por 20 s de acordo com a etapa 3.5. Tampe o frasco e feche com Parafilm.
- Meça a atividade do frasco em um calibrador de dose e anote o tempo.
NOTA: Se a atividade adequada não foi transferida para o frasco, repita as etapas 4.5-4.11, adicionando um volume adicional apropriado de 64CuCl2. - Coloque o frasco para injetáveis num suporte de espuma e empurre-o para que a metade inferior do frasco para injetáveis fique exposta ao calor. Coloque o suporte no banho-maria de agitação a 60 °C e aqueça por 1 h.
- Enquanto a reação de quelação ocorre, prepare as placas iTLC. Enquanto estiver usando luvas novas, corte o papel de cromatografia de microfibra de vidro em tiras de 1 cm x 8 cm. Aquecer as tiras num forno de secagem de vidro a 80 °C.
NOTA: Esta etapa pode ser realizada em um laboratório não radioativo. - Após 1 h, retire o frasco para injetáveis do fogo na etapa 4.12 e limpe as bordas com um lenço de papel.
- Gire o frasco para cima e para baixo manualmente com uma pinça com ponta de borracha para recondensar qualquer condensação nas paredes do frasco para a suspensão lipídica.
- Com o frasco para injetáveis na posição vertical, sacuda a tampa enquanto estabiliza o tubo. Remova o Parafilm e limpe ao redor da tampa para remover qualquer água do banho presa.
- Destampar cuidadosamente o frasco para injetáveis e aspirar 1-2 μL da suspensão lipídica. Coloque a suspensão a 1 cm do centro inferior de uma tira iTLC e tampe novamente o frasco. Deixe o local secar.
NOTA: Idealmente, um mínimo de 2 iTLCs devem ser detectados por mistura de reação e desenvolvidos por suspensão lipídica radiomarcada para maior certeza. - Micropipeta 200 μL do eluente iTLC (preparado na etapa 1.4) no fundo de um tubo de ensaio de 10 mL. Alojar o tubo de ensaio em um recipiente de chumbo. Adicione o iTLC manchado ao tubo e deixe a tira desenvolver-se até que o eluente esteja a cerca de 1 cm do bordo superior da tira.
- Remova as tiras iTLC desenvolvidas usando uma pinça. Segure a tira verticalmente e corte em terços sobre tubos de plástico de 5 mL compatíveis com γ balcão e tampa de pressão, de modo que cada terço da tira caia diretamente em um terço individual. Insira as tampas de pressão nos três tubos.
- Meça os tubos contendo tiras e um tubo de controle vazio/tampado em um contador de γ para atividade de cobre-64 e registre as contagens por minuto (cpm) associadas. Subtraia a atividade do tubo de controle das outras leituras para corrigir a atividade de fundo.
NOTA: As leituras corrigidas para o terço inferior da tira (peça 1) estão associadas a partículas de cobre-64 quelatadas a suspensão lipídica. A seção intermediária (peça 2) contém uma faixa de quelatos pirolipídicos de cobre-64 e 64-livres na forma não supramolecular. A seção superior (peça 3) contém predominantemente cobre-64 livre. - Calcule a pureza radioquímica por meio da Equação 1.
 (Equação 1)
(Equação 1)
NOTA: se o cpm para a peça 1 parecer excessivamente baixo (por ex.ample, menor ou equivalente às peças 2 ou 3) ou se alguma leitura estiver acima do limite de não linear/saturação do contador de γ, identifique um volume menor ou uma alíquota diluída (1-2 μL) da suspensão radiomarcada para iTLC. - Certifique-se de que a pureza radioquímica obtida de ambas as tiras de iTLC por suspensão lipídica seja ≥ 94% para continuar. Caso contrário, continue a aquecer a suspensão lipídica a 60 °C e monitore a quelação em intervalos de 30 minutos via iTLC.
- Destampe o frasco para injetáveis de suspensão lipídica radiomarcada e micropipete 8,89 μL de NaOH 1 N na suspensão, pipetando para cima e para baixo para transferir completamente a base e neutralizar a suspensão. Tampe o frasco, gire manualmente com uma pinça para inverter/reverter e, em seguida, bata suavemente na tampa do frasco.
- Preencha o headspace com PFP conforme a etapa 4.10, tampe e sele com Parafilm.
5. Ativação e isolamento de microbolhas
- Ative a suspensão lipídica por meio de um agitador mecânico por 45 s a 4530 rpm para gerar uma suspensão de microbolhas leitosas. Deixe o frasco esfriar passivamente até RT por aproximadamente 10 min. A suspensão leitosa resultante se separará em duas camadas ao longo do tempo.
NOTA: O conteúdo do frasco para injetáveis deve parecer leitoso após a ativação. Uma suspensão mais clara após a ativação é indicativa de ativação malsucedida, cujos colaboradores serão discutidos em seções posteriores. - Uma vez em RT, inverta / reverta suavemente o frasco para ressuspender a suspensão de microbolhas. Coloque o frasco sobre uma superfície plana e aguarde 2 minutos antes da decantação para obter a população de microbolhas desejada da seguinte forma:
- Equipe uma seringa de plástico de 1 mL com uma agulha de 18 G e ventile a seringa/agulha aspirando e mergulhando o ar para dentro/para fora. Na marca de 2 minutos, destampe rapidamente o frasco, quebrando o selo Parafilm em um movimento.
- Retire 400-550 μL do fundo do frasco (população alvo de microbolhas), evitando a aspiração da camada espumosa superior de populações maiores de microbolhas indesejadas.
NOTA: Se necessário, incline o frasco para um lado para coletar os volumes finais na seringa para evitar aspirar a camada espumosa / mais leve.
- Limpe as bordas da agulha cuidadosamente para remover quaisquer contaminantes espumosos e transfira a suspensão isolada de microbolhas para um tubo de microcentrífuga. Tampe suavemente (não abra ou feche abruptamente a tampa). Esta é a suspensão final de trabalho de microbolhas radiomarcadas.
- Meça a atividade do produto final de microbolhas no calibrador de dose e anote o tempo. Divida este valor pelo volume de suspensão decantado na etapa 5.2 para obter um valor MBq·mL-1 para calcular os volumes de injeção em função da aplicação de interesse.
NOTA: As microbolhas radiomarcadas estão agora prontas a usar. A seção 6 pode ser executada até 24 h depois. Para obter informações sobre como essas microbolhas radiomarcadas podem ser injetadas e rastreadas in vivo por meio de imagens multimodais (ultrassom, PET, fluorescência), consulte Rajora et al.15.
6. Validando a eficiência da radiomarcação
- Ressuspenda a suspensão de microbolhas por meio de pipetagem suave ou inversão do frasco.
NOTA: Nunca vórtice um produto de trabalho de microbolhas. O vórtice desestabiliza as suspensões de microbolhas. - Adicione 10-200 μL da suspensão radiomarcada a uma unidade de filtro de centrífuga de corte de peso molecular (MWCO) de 0,5 mL e 30.000. Se estiver usando volumes <200 μL, adicione ddH2O à unidade de filtro para constituir um volume total de 200 μL. Aloje a unidade de filtro em um tubo de microcentrífuga compatível e tampa.
NOTA: Recomenda-se a realização de um teste de radiomarcação antes e separadamente de qualquer uso aplicado in vitro ou in vivo de microbolhas radiomarcadas para garantir a conclusão bem-sucedida do protocolo. Nesse caso, um volume maior (por exemplo, 200 μL) pode ser usado nesta etapa. Quando o protocolo for usado posteriormente para uma sessão de tratamento, prepare os volumes/injeções de tratamento primeiro e, em seguida, conduza a seção 6 com a suspensão de microbolhas radiomarcada restante o mais cedo possível. - Centrifugue por 10 min a 12.000 x g em RT.
NOTA: a microcentrífuga deve ser cercada por blindagem de chumbo. - Corte a conexão entre o tubo da microcentrífuga e sua tampa com uma tesoura.
- Coloque a tampa em um frasco de cintilação de 20 mL rotulado como "tampas". Transfira a unidade de filtro para um novo tubo de microcentrífuga (tubo 2).
- Coloque o primeiro tubo de microcentrífuga com infranadante em um frasco de cintilação de 20 mL rotulado como "tubo 1". Adicione 200 μL ddH2O à unidade de filtro no tubo 2.
- Centrifugue a unidade de filtro no tubo 2 a 12.000 x g em RT.
- Repita as etapas 6.4 e 6.5. Adicione a tampa do tubo 2 ao frasco de cintilação "tampas" que abriga a tampa do tubo 1. Coloque o tubo 2 em um novo frasco de cintilação de 20 mL.
- Corte a tampa do terceiro tubo de microcentrífuga e coloque no frasco para "tampas" conforme a etapa 6.4. Transfira a unidade de filtro para um novo frasco de cintilação de 20 mL rotulado como "unidade", garantindo que o infranadante permaneça no tubo 3 e não seja transferido para o frasco "unidade". Se forem vistas gotas nas bordas da unidade de filtro, coloque-a de volta no tubo 3, tampe e gire para baixo por 10 s. Coloque o tubo 3 em um novo frasco de cintilação de vidro de 20 mL.
- Tampe os 5 frascos para injetáveis de cintilação (tubo 1, tubo 2, tubo 3, tampas e unidade). Prepare um frasco para injetáveis de cintilação de 20 mL vazio e tampado como um controle em branco.
- Meça os seis frascos de cintilação em um balcão de γ para atividade de cobre-64. Subtraia a atividade do frasco em branco da de outros frascos. Calcule a eficiência de radiomarcação/quelação usando a Equação 2.
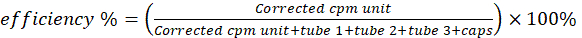 (Equação 2)
(Equação 2)
NOTA: Se o cpm da unidade for excessivamente baixo (ex, inferior ou equivalente aos tubos) ou se alguma leitura estiver acima do limite não linear/saturação de γ contadores, armazene os frascos de cintilação em recipientes de chumbo por até 4 dias para permitir que a atividade decaia até que os valores estejam abaixo do limite e meça novamente.
7. Caracterização físico-química de microbolhas
NOTA: A menos que um laboratório tenha equipamento designado para processamento de amostras radioativas, a caracterização físico-química de microbolhas deve ser realizada usando amostras quelatadas de cobre "frias" não radioativas. Essa rotulagem "fria" facilita a avaliação do rendimento das microbolhas, o que é vital para avaliar a dose de microbolhas usada para a aplicação pretendida. Além disso, permite a comparação com microbolhas não quelatadas de controle para garantir que o processo de radiomarcação não perturbe as propriedades das microbolhas. Essa marcação "fria" e a caracterização físico-química associada devem ocorrer antes da aplicação de microbolhas radiomarcadas e podem ser usadas como feedback se forem necessárias modificações na marcação radioativa (consulte Discussão).
- Rotulagem de microbolhas de cobre "frias"
- Usando o volume de solução de 64CuCl2 adicionado à suspensão lipídica na etapa 4.7, composição molar de porfirina% dentro dos filmes lipídicos e atividade específica encontrada na ficha do produto 64CuCl2 , calcule a proporção molar aproximada de metal: porfirina alcançada durante a radiomarcação. Exemplos de cálculos podem ser encontrados no Arquivo Suplementar 1.
- Siga as seções 1-3 do protocolo atual.
- Prepare uma solução de CuCl2 0,1 mg · mL-1 em HCl 0,1 N.
- Micropipete o volume apropriado desta solução de CuCl2 para a suspensão lipídica calculada a partir do passo 7.1.1 e tampe o frasco para injetáveis.
- Gire o frasco para misturar o CuCl2 na suspensão lipídica, preencha o headspace com PFP, sele e aqueça de acordo com as etapas 4.9, 4.10 e 4.12. Não são necessárias pinças de borracha para o manuseio do frasco.
- Após 1 h, retire o frasco do fogo e limpe o exterior para secar. Deixe o frasco esfriar até RT.
- Neutralize a suspensão lipídica, misture, preencha o headspace com PFP e sele de acordo com as etapas 4.23 e 4.24.
- Ative a suspensão de microbolhas e transvase para obter um produto funcional de acordo com as etapas 5.1-5.3.
- Dimensionamento de microbolhas
NOTA: O dimensionamento de microbolhas deve ser realizado imediatamente após a ativação. Se estiver avaliando a estabilidade da suspensão de trabalho, repita a preparação da amostra e as medições em intervalos de 30 minutos. Normalmente, uma janela de 1-2 h é representativa do período de tempo durante o qual a suspensão de trabalho de microbolhas seria usada/administrada após a ativação. O objetivo das medições de estabilidade é garantir que o tamanho e o rendimento das microbolhas sejam mantidos durante esse período, de modo que todos os tratamentos administrados a partir da solução de trabalho contenham populações de microbolhas semelhantes.- Ligue o Coulter Counter (CC) e defina os seguintes parâmetros usando a ferramenta Edit SOP : abertura de 30 μm, faixa de tamanho de 0,6-18 μm, corrente de abertura 400-600 μA, préamp ganho 4-8, 400 caixas, nivelamento antes e depois de cada execução, análise volumétrica, 5 μL sample volume.
- Filtre o eletrólito CC através de uma unidade de filtragem a vácuo de mídia de 0,2 μm. Encha o recipiente de eletrólitos e um recipiente separado para preparação de amostras.
- Medição de fundo: Encha uma cubeta descartável de 10 mL com eletrólito filtrado de 10 mL e execute uma medição de linha de base. Certifique-se de que as contagens estejam abaixo de 400. Caso contrário, lave o instrumento.
- Medição de amostra
- Adicione 10 mL de eletrólito filtrado a uma nova cubeta. Ressuspenda a suspensão de microbolhas invertendo/revertendo manualmente. Micropipeta a 5 μL do centro inferior do frasco. Limpe as bordas da ponta da pipeta (exceto a abertura) e mergulhe a amostra diretamente no eletrólito preparado.
- Pipete para cima e para baixo para transferir completamente a suspensão. Use a ponta da pipeta para girar suavemente o eletrólito até que os "tufos" da suspensão de microbolhas se dispersem.
- Meça a amostra no CC (duas corridas por analito).
NOTA: Um volume de amostra de microbolhas de 5 μL é normalmente apropriado para amostras contendo concentrações de 1-5 x 109 microbolhas · mL-1 . Este volume de amostra pode precisar ser ajustado dependendo da configuração específica do instrumento CC e se os rendimentos de microbolhas da amostra estiverem fora da faixa acima.
- Imagem confocal
NOTA: Realize imagens confocais imediatamente após o dimensionamento das microbolhas e dentro do prazo de estabilidade das microbolhas retidas, conforme a nota na etapa 7.2.- Ressuspenda a suspensão de microbolhas e transfira 1-5 μL para o centro de uma lâmina de microscópio de vidro. Coloque uma lamínula cuidadosamente sobre a gota de suspensão de microbolhas, evitando qualquer aprisionamento de bolhas de ar. A suspensão se espalhará sob a lamínula.
- Visualize as microbolhas com ampliação de 60x com uma objetiva de imersão em óleo. Obtenha imagens em campo claro e sob excitação de 633 nm/emissão de 640-765 nm. Sobreponha as imagens de campo claro e fluorescência.
NOTA: O sinal de fluorescência deve se sobrepor ao invólucro de todas as partículas visíveis quando a sonda for incorporada de forma homogênea ao invólucro da microbolha.
- Espectrofluorometria
NOTA: As medições de espectrofluorometria podem ser realizadas dentro de 24 h após a ativação das microbolhas.- Prepare 1% de Triton X-100 conforme descrito anteriormente35.
- Ligue o espectrofluorômetro 15-30 minutos antes da primeira medição.
- Meça os espectros de fluorescência de 1% Triton X-100 usando uma excitação de 410 nm e uma faixa de emissão de 600-800 nm em uma cubeta de quartzo. Selecione a opção para normalizar o sinal pelo sinal do detector de referência (geralmente chamado de S1/R1).
NOTA: Triton X-100 borbulha facilmente quando pipetado. Como tal, ao transferir para uma cubeta, mergulhe apenas na primeira parada da micropipeta. - Enxágue a cubeta com metanol e seque com ar pressurizado entre as amostras.
- Transfira 6 mL de Triton X-100 a 1% para um tubo de centrífuga de 15 mL. Ressuspenda a suspensão de microbolhas e aspire 1 μL por meio de micropipeta. Limpe as bordas da ponta da pipeta, exceto a abertura, e transfira a amostra para o Triton X-100 a 1% preparado, pipetando para cima e para baixo para completar a transferência. Vortex a solução e transfira-a para uma cubeta de quartzo.
NOTA: Ajuste a proporção da amostra: 1% Triton X-100 de acordo com a sensibilidade do instrumento e o limite de saturação não linear. - Meça esta amostra usando os parâmetros da etapa 7.4.3. Essa medida corresponde a partículas "interrompidas".
- Repita as etapas 7.4.3-7.4.6 usando PBS. Esta medida corresponde a partículas "intactas".
- Corrija a linha de base dos espectros de amostra interrompidos e intactos usando medições Triton X-100 e PBS de 1%, respectivamente.
- Calcule a eficiência de têmpera (QE) por meio da Equação 3 usando o sinal de fluorescência corrigido pela linha de base integrado da amostra intacta em PBS (FPBS) e em 1% Triton X-100 (FTx):
 (Equação 3)
(Equação 3)
- Espectroscopia UV-Vis
NOTA: As medições de espectroscopia podem ser realizadas até 72 h após a ativação das microbolhas.- Sonicar uma alíquota da suspensão de microbolhas num tubo de microcentrífuga utilizando um sonicador de banho à RT até que a suspensão fique transparente. Isso reduz os efeitos de dispersão durante a espectroscopia.
- Ligue o espectrofotômetro 10 minutos antes da primeira medição. Selecione um intervalo de varredura de 0,25 nm e uma faixa de aquisição de 200-800 nm. Ative a subtração da linha de base.
- Use uma cubeta de quartzo de 1 cm de comprimento de caminho para as medições. Enxágue a cubeta com metanol entre as medições e seque com ar pressurizado.
- Obtenha uma medição de linha de base de metanol.
- Vortex a suspensão de microbolhas transparente e sonicada e transfira 10-50 μL para um tubo de microcentrífuga contendo 200-1000 μL de metanol. Certifique-se de que o volume de metanol seja medido e adicionado ao tubo por meio de uma seringa de microlitro de vidro limpa. Vortex a solução para obter uma amostra "interrompida".
NOTA: A diluição da amostra dependerá da eficiência de carregamento de porfirina e da composição molar%. Uma diluição de 20x é apropriada para uma composição de microbolhas pirolipídicas de 30 mol%. - Colete o espectro UV-Vis.
- Repita as etapas 7.5.4 a 7.5.6 usando PBS em vez de metanol.
NOTA: Uma micropipeta pode ser usada para medir volumes de PBS em vez de uma seringa de microlitro de vidro.
8. Modificações no protocolo
- Quelante alternativo
- Preparar as películas lipídicas de acordo com o ponto 2, substituindo o pirolípido por um quelante de cobre conjugado com lípidos alternativo [por exemplo, ácido 1,2-dipalmitoil-sn-glicero-3-fosfoetanolamina-N-dietilenotriaminapentaacético (sal de amónio), doravante designado por DTPA-lípidos]. Use o Arquivo Suplementar 1 para calcular a massa e os volumes de estoque necessários.
NOTA: Testar várias composições molares de um quelante alternativo é provavelmente necessário para determinar o limite superior além do qual microbolhas estáveis com alto rendimento não podem ser geradas. - Siga as seções 3 a 6 para gerar e caracterizar microbolhas radiomarcadas.
- Siga as etapas 7.1 a 7.3 para caracterizar microbolhas quelatadas de cobre "frias". Apenas a aquisição de imagens de microscopia confocal de campo claro é necessária para avaliar a morfologia das partículas. Se o quelante alternativo for fluorescente, realizar microscopia confocal com os comprimentos de onda de excitação e emissão associados, além das etapas 7.4 e 7.5.
- Preparar as películas lipídicas de acordo com o ponto 2, substituindo o pirolípido por um quelante de cobre conjugado com lípidos alternativo [por exemplo, ácido 1,2-dipalmitoil-sn-glicero-3-fosfoetanolamina-N-dietilenotriaminapentaacético (sal de amónio), doravante designado por DTPA-lípidos]. Use o Arquivo Suplementar 1 para calcular a massa e os volumes de estoque necessários.
- Fluoróforo alternativo
- Prepare filmes lipídicos de acordo com a seção 2, substituindo o pirolipídio por um fluoróforo conjugado ou intercalante lipídico alternativo (por exemplo, DiI). Use o Arquivo Suplementar 1 para calcular os volumes de massa e estoque necessários.
NOTA: Testar várias composições molares de um fluoróforo alternativo é provavelmente necessário para determinar o limite superior além do qual microbolhas estáveis com altos rendimentos não podem ser geradas. - Siga a seção 3 usando PGG em vez de AA-PGG.
- Conclua as etapas 5.1 a 5.3 e as etapas 7.2 a 7.5.
- Prepare filmes lipídicos de acordo com a seção 2, substituindo o pirolipídio por um fluoróforo conjugado ou intercalante lipídico alternativo (por exemplo, DiI). Use o Arquivo Suplementar 1 para calcular os volumes de massa e estoque necessários.
- Abordagem "spikeing": Rotulagem de suspensões lipídicas de microbolhas pré-formadas
- Gere um filme lipídico de porfirina conforme a seção 2, usando apenas pirolipídio sem outros constituintes lipídicos. Consulte o Arquivo Suplementar 1 para quantidades de pirolipídios.
- Hidrate o filme pirolipídico de acordo com a seção 3 usando 100-200 μL de AA-PGG (ou PGG se a marcação radioativa não for necessária) em vez de 1 mL de tampão de hidratação.
- Transfira toda a suspensão pirolipídica para uma suspensão de microbolhas lipídicas pré-fabricada.
- Preencha o headspace com PFP, aqueça e sonique a suspensão e sele sob PFP de acordo com as etapas 3.4 a 3.9. Monitore a dispersão da suspensão pirolipídica na suspensão de microbolhas lipídicas pré-fabricada e conduza ciclos de calor / sonicação até que esteja completamente dispersa.
NOTA: Se estiver usando um frasco de microbolhas comercial selado com septo, a suspensão pirolipídica pode ser introduzida no frasco através de uma seringa/agulha sem reabastecer o headspace do frasco com PFP. - Realize radiomarcação (consulte a etapa 8.3.5.1 abaixo), ativação, isolamento (consulte NOTA abaixo) e caracterização associada de acordo com as seções 4 a 7.
- Uma abordagem alternativa é primeiro radiomarcar a suspensão pirolipídica hidratada, monitorar a pureza radioquímica de >94%, neutralizar com 1 N NaOH (modificar o volume de acordo com o volume AA-PGG usado para hidratar o filme pirolipídico) e, em seguida, introduzir a suspensão pirolipídica radiomarcada na suspensão lipídica de microbolhas pré-fabricada de acordo com a etapa 8.3.3.
NOTA: Esta abordagem modificada só deve ser usada para gerar microbolhas radiomarcadas fluorescentes ou multimodais se seguida por um processo de isolamento que remova vesículas multilamelares submicrônicas criadas durante a hidratação lipídica, mas não incorporadas em microbolhas. Consulte Discussão para obter mais detalhes.
- Uma abordagem alternativa é primeiro radiomarcar a suspensão pirolipídica hidratada, monitorar a pureza radioquímica de >94%, neutralizar com 1 N NaOH (modificar o volume de acordo com o volume AA-PGG usado para hidratar o filme pirolipídico) e, em seguida, introduzir a suspensão pirolipídica radiomarcada na suspensão lipídica de microbolhas pré-fabricada de acordo com a etapa 8.3.3.
Resultados
Os principais resultados quantificáveis ao fabricar microbolhas radiomarcadas são a pureza radioquímica e a eficiência da radiomarcação. Este protocolo usa iTLC e um procedimento centrífugo validado, respectivamente, para caracterizar cada um. A Figura 2A mostra que as purezas e eficiências radioquímicas médias de ≥95% foram alcançadas em formulações comerciais que imitam microbolhas nas quais o lipídio do hospedeiro foi substituído por pirolipídio em composições de 1 mol%, 10 mol% ou 30 mol% do lipídio total. As formulações pirolipídicas de 1 mol% e 10% mol exigiram uma suspensão lipídica mais concentrada (0,15 mL vs 1 mL) para atingir esses valores. As altas purezas radioquímicas e eficiências de quelação alcançadas no protocolo atual anularam qualquer necessidade de purificação pós-rotulagem.
Isso também foi verdade para formulações alternativas compostas por lipídios de comprimento de cadeia C16, C18 e C22 com uma carga superficial neutra ou aniônica geral ( Figura 2B ). Essas variantes foram carregadas com uma composição pirolipídica de 30% mol, com base em um limite superior previamente determinado para manter o tamanho médio das microbolhas, rendimentos aceitáveis de microbolhas (>1 x 109 microbolhas · mL-1) e limitar a geração de população de microbolhas de >8 μm, maximizando o pirolipídio e suas capacidades de fluorescência e quelação de metaisativáveis 15. Para esse fim, as formulações de 30% mol demonstraram as mais altas (até 99%) purezas radioquímicas e eficiências de quelação. As composições lipídicas fundamentais de todas as formulações exploradas na Figura 2 foram baseadas na formulação comercial de microbolhas mais predominantemente explorada clinicamente, enquanto os comprimentos de cadeia e variantes de carga representam as composições pré-exploradas mais amplamente exploradas15. Isso dá confiança de que o protocolo de radiomarcação apresentado pode ser aplicado na maioria das composições de microbolhas de interesse para o campo do ultrassom terapêutico.
A caracterização físico-química quantitativa de microbolhas é tipicamente inviável para microbolhas radioativas. No momento em que a radioatividade decai (ao longo de dias e até semanas, dependendo do isótopo e da quantidade de atividade usada), os núcleos de gás das microbolhas terão se dissolvido em grande parte, gerando fragmentos de microbolhas. Assim, a suspensão de partículas não capturará com precisão as espécies teranosticamente ativas que foram ativadas ou administradas pela primeira vez. Como tal, a observação visual durante a preparação de microbolhas radioativas e um protocolo analógico de quelação "frio" emparelhado são vitais. Especificamente, são necessárias observações visuais importantes nas etapas de hidratação e ativação do filme lipídico (Figura 3). Em uma hidratação completa e bem-sucedida, os filmes lipídicos se dissociam completamente das paredes do frasco e se automontam em vesículas que se distribuem homogeneamente no tampão de hidratação. O resultado final é uma solução transparente (Figura 3A). As hidratações incompletas apresentarão um filme lipídico que continua a aderir à parede do frasco ou agregado na suspensão (Figura 3B). O primeiro pode não ser facilmente notado e, portanto, recomenda-se limpar a água da superfície do frasco e uma inspeção cuidadosa durante a sonicação. A ativação prematura das microbolhas deve ser evitada durante a hidratação e pode ser facilmente observada como a criação de bolhas persistentes na superfície da suspensão e chiados leitosos / turvos dentro da suspensão ( Figura 3C ). Essa ativação inadequada pode reduzir o rendimento das microbolhas e a reprodutibilidade da distribuição de tamanho. Pode ser evitado usando uma temperatura da água do banho acima da temperatura de transição do constituinte lipídico do hospedeiro, enchendo o sonicador do banho até o nível de água apropriado que facilite a sonicação visível / perturbação do líquido, mas sem "pular" do tampão de hidratação ou da água do banho e evitar cuidadosamente a agitação do frasco ou agitação abrupta. Uma vez que a suspensão de microbolhas é propositalmente ativada por meio de agitação mecânica controlada e de alta velocidade, formar-se-á uma suspensão leitosa e opaca que se separa em uma camada superior mais leve / branca e espumosa contendo partículas inadequadamente grandes (>8 μm de diâmetro, por exemplo) e a camada inferior alvo contendo microbolhas de interesse (Figura 3D), que é isolado por aspiração com seringa/agulha. A ativação abaixo do ideal, resultando em rendimentos mais baixos das populações alvo de microbolhas, produz uma camada inferior menos leitosa / opaca e muitas vezes translúcida que se parece com uma versão turva de uma suspensão lipídica hidratada ( Figura 3E ).
A caracterização físico-química objetiva de microbolhas radiomarcadas é conduzida usando microbolhas quelatadas de cobre "frias" análogas. Os principais pontos finais para esta caracterização incluem: 1) quantificação do tamanho médio e rendimento das microbolhas, 2) avaliação da estabilidade do período de armazenamento/trabalho das microbolhas, 3) validação do carregamento pirolipídico bem-sucedido através da casca da microbolha e 4) garantia de que essas propriedades físico-químicas não sejam alteradas pelo processo de radiomarcação integrado ao procedimento de fabricação de microbolhas. As Figuras 4 e 5 ilustram essa caracterização para uma formulação de microbolhas aniônicas C16 quelatadas com cobre com uma composição pirolipídica de 30 mol% do lipídio total. A caracterização é apresentada em contraste com a das microbolhas não quelatadas de controle.
A Figura 4 ilustra dados de dimensionamento representativos para microbolhas quelatadas e não quelatadas. As distribuições numéricas (Figura 4A) demonstram uma maior presença de pequenas bolhas e um decaimento monotônico no número de microbolhas com o tamanho. As distribuições de volume de microbolhas (Figura 4B) exibem picos unimodais correspondentes a um tamanho médio de 6 μm. Como microbolhas maiores compreendem volumes de gás maiores, espera-se que as distribuições de volume se inclinem para tamanhos médios de microbolhas mais altos. Quando a média ponderada pelo número é alcançada, tamanhos de 1,5-2 μm e rendimentos de microbolhas de 3 x 109 microbolhas · mL-1 são alcançados ( Figura 4C , D ), que permanecem estáveis 1 h após a ativação e isolamento das microbolhas. Esses resultados são típicos para microbolhas lipídicas estáveis geradas por meio de um protocolo de hidratação lipídica sem qualquer isolamento adicional do tamanho centrífugo. É importante ressaltar que as distribuições de tamanho, tamanhos médios, concentrações e estabilidade das microbolhas permanecem inalteradas com a integração das condições de quelação na fabricação de microbolhas. Esses valores estão resumidos na Tabela 1, juntamente com os de outras formulações de microbolhas, que também mostram a retenção de propriedades físico-químicas com a quelação do cobre.
As propriedades morfológicas e ópticas (Figura 5) das microbolhas também são mantidas com quelação de cobre "frio". A fluorescência da porfirina pode ser observada de forma homogênea delineando as conchas de microbolhas quelatadas e não quelatadas, demonstrando a incorporação bem-sucedida de quelantes pirolipídicos nas camadas de microbolhas (Figura 5A). O carregamento bem-sucedido também pode ser discernido por meio de espectroscopia UV-Vis e espectrofluorometria. Microbolhas rompidas se desmontam em espécies lipídicas monoméricas. Como tal, os espectros UV-Vis (Figura 5B) das microbolhas rompidas correspondem aos do pirolipídio livre. Ele contém dois picos proeminentes: uma banda de Soret na região azul e uma banda Q na região vermelha. Para normalizar a concentração e facilitar uma comparação mais objetiva entre as microbolhas, os espectros de absorbância são apresentados como a emissividade molar em todos os comprimentos de onda. Os espectros brutos de absorbância UV-Vis de microbolhas rompidas podem ser usados para quantificar o encapsulamento e a concentração de pirolipídios em suspensões de microbolhas aplicando a lei de Beer-Lambert (comprimento do caminho de 1 cm, coeficientes de extinção de 97.000 M-1 · cm-1 ou 45.000 M-1 · cm-1 a 410 nm e 667 nm, respectivamente). As microbolhas caracterizadas na Figura 5 exibem 85%-90% de eficiência de encapsulamento pirolipídico e concentrações de porfirina de ~0,17 mM. A caracterização das concentrações de microbolhas e porfirinas permite estimar as doses administradas de microbolhas e porfirinas. A alta eficiência de encapsulamento demonstra carga pirolipídica eficaz em microbolhas. Isso é suportado por espectros UV-Vis de microbolhas intactas, representando um desvio para o vermelho característico da banda Qy para 674 nm e 702 nm. Este último é visto especificamente com alta carga e agregação ordenada de porfirina em conchas de microbolhas versus estruturas vesiculares, que representam apenas um único pico com desvio para o vermelho entre 670-680 nm15,37. O carregamento efetivo de porfirina em microbolhas em composições superiores a 5 mol% pode ser observado por meio de alta (>90%) extinção da fluorescência da porfirina em microbolhas intactas15, que é restaurada quando as partículas são interrompidas ( Figura 5C ). Semelhante aos dados de dimensionamento, essas propriedades ópticas são preservadas com as condições de radiomarcação associadas ao protocolo atual (resumidas na Tabela 1). Coletivamente, esses resultados demonstram a realização de todos os endpoints para a fabricação bem-sucedida de microbolhas, incorporação de quelantes de porfirina e retenção de propriedades de microbolhas quelatadas.
O atual protocolo de radiomarcação de microbolhas foi estabelecido explorando as capacidades de quelação de cobre e multimodalidade de pirolipídios. No entanto, o pirolipídio não está disponível comercialmente no momento. Colaborações de pesquisa são incentivadas para obter pirolipídios se os recursos não estiverem disponíveis para sua síntese interna ou externamente. Se nenhuma das opções estiver disponível, é possível modificar o protocolo atual para gerar microbolhas fluorescentes ou radioativas unimodais usando fluoróforos e quelantes disponíveis comercialmente, respectivamente. Esses quelantes / traçadores alternativos devem ser incorporáveis dentro de uma casca lipídica de microbolhas. A Figura 6 demonstra microbolhas representativas construídas com duas dessas metades: DiI e DTPA-lipídio.
A incorporação de DTPA-lipídio em uma formulação de microbolhas aniônicas C16 produz microbolhas de 1,1 μm com um rendimento de 11 x 109 microbolhas · mL-1 e morfologia semelhante às microbolhas pirolipídicas aniônicas C16 quelatadas ( Figura 6B, C ). Uma avaliação preliminar das habilidades de quelação de cobre de microbolhas DTPA foi conduzida usando CuCl2 "frio". Quando a quelação de cobre foi integrada ao processo de fabricação de microbolhas DTPA, o tamanho e o rendimento permaneceram inalterados. Para confirmar que o DTPA-lipídio dentro das microbolhas estava disponível para quelação de cobre, ICP-MS foi conduzido em microbolhas filtradas por centrífuga. Um sinal de cobre definitivo foi detectado, o que correspondeu a 90%-100% de eficiência de quelação quando comparado ao sinal obtido a partir de controles não rotulados com cobre equivalente. A experiência interna é que o ICP-MS produz eficiências de quelação de cobre mais variáveis do que a contagem de γ e, portanto, esta última é recomendada para quantificar a eficiência de quelação/radiomarcação no protocolo atual. Esses resultados destacam a importância dessa recomendação, mas também fornecem uma demonstração de prova de conceito de que o protocolo de quelação de cobre apresentado neste relatório é traduzível para quelantes além do pirolipídio.
Como pode ser visto na Figura 6D, o protocolo atual também pode ser usado para incorporar com sucesso DiI em uma formulação de microbolhas aniônicas C16 em uma composição de 5 mol%. Isso leva a uma forte marcação fluorescente homogênea da casca da microbolha (semelhante a quando o pirolipídio é usado, conforme ilustrado na Figura 6B) e gera microbolhas com tamanho médio de 1,7 μm e rendimento de 1,5 x 109 microbolhas · mL-1. No geral, os resultados apresentados na Figura 6 demonstram que o atual protocolo de fabricação e rotulagem de microbolhas pode ser implementado para incorporar sondas e quelantes alternativos em formulações de microbolhas se o pirolipídio for inacessível.
Este protocolo se concentra na radiomarcação de MBs lipídicos. Sua extensão natural é a aplicação in vivo dessas microbolhas radiomarcadas, que foi ensaiada em um relatório recente que caracterizou a fragmentação, a cinética de circulação e a biodistribuição cinética de uma série de análogos radiomarcados de microbolhas lipídicas comerciais15. Os resultados deste trabalho estendido serão discutidos na seção subsequente no contexto das aplicações e utilidade futura das microbolhas radiomarcadas.

Figura 2: Purezas e eficiências de radiomarcação. Purezas, e eficiências de radiomarcação obtidas após a aplicação do atual protocolo de radiomarcação de microbolhas durante a síntese de microbolhas com (A) composições variáveis de quelantes pirolipídicos e (B) comprimentos de cadeia lipídica e carga de microbolhas. As microbolhas aniônicas são especificadas com (-), enquanto as zwitteriônicas (ou seja, neutras) são especificadas com "n". Os dados são apresentados como médias ± desvio padrão. Essa figura foi adaptada com permissão de Rajora et al.15. Clique aqui para ver uma versão maior desta figura.
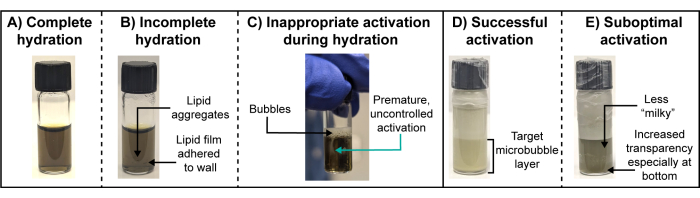
Figura 3: Hidratações de filme lipídico ótimas e abaixo do ideal e ativações de microbolhas. (A-E) Fotografias representativas de (A,D) hidratações de filme lipídico ótimas e (B,C,E) subótimas e ativações de microbolhas. Clique aqui para ver uma versão maior desta figura.

Figura 4: Dimensionamento representativo, rendimentos e estabilidade de microbolhas de porfirina não quelatadas e quelatadas de cobre. (A) distribuição do tamanho do número, (B) distribuição do tamanho do volume, (C) rendimento de microbolhas e (D) tamanho médio do número de microbolhas de porfirina não quelatadas (em preto) e quelatadas de cobre (em rosa) com uma composição pirolipídica de 30% molar. O rendimento e o tamanho das microbolhas (C e D) foram medidos em intervalos de 30 min para garantir a estabilidade da suspensão de trabalho. Os dados são apresentados como um desvio padrão médio para (C) e (D) de n = 4-7 repetições. Essa figura foi adaptada com permissão de Rajora et al.15. Clique aqui para ver uma versão maior desta figura.
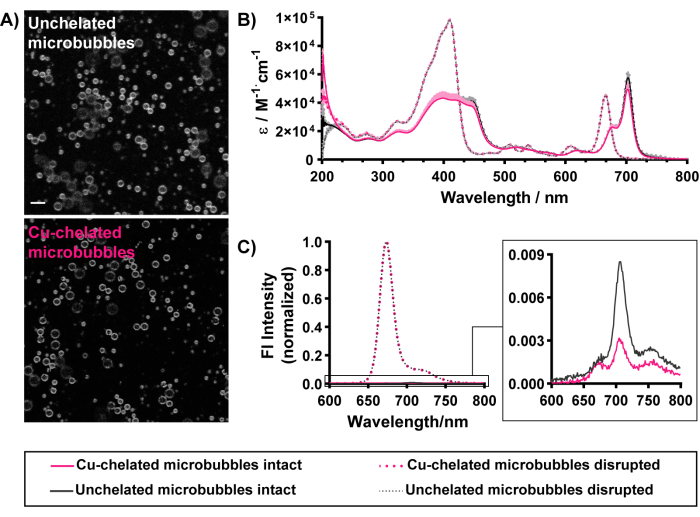
Figura 5: Caracterização morfológica e óptica de microbolhas de porfirina não quelatadas (em preto) e quelatadas de cobre (em rosa) com uma composição pirolipídica de 30% molar. (A) A imagem confocal em escala de cinza (sinal piro representado) demonstra a incorporação homogênea de pirolipídios dentro de conchas de microbolhas quelatadas e não quelatadas (barra de escala = 5 μm). (B) Espectros UV-Vis obtidos para microbolhas intactas (em PBS, linhas sólidas) e microbolhas interrompidas por metanol (linhas tracejadas). (C) Espectros de fluorescência de microbolhas intactas em PBS (linhas sólidas, inserção ampliada) e microbolhas interrompidas Triton X-100 a 1% (linhas tracejadas). Essa figura foi adaptada com permissão de Rajora et al.15. Clique aqui para ver uma versão maior desta figura.
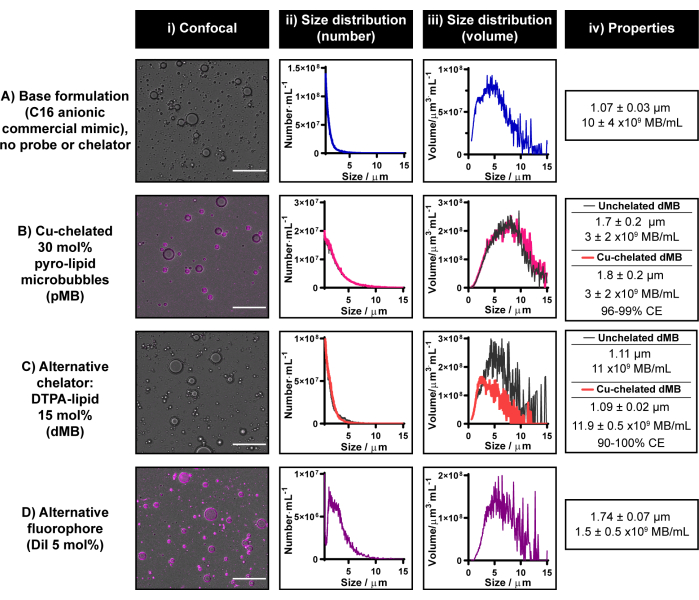
Figura 6: Microbolhas representativas construídas com fluoróforos e quelantes disponíveis comercialmente. (A-D) Exemplo de uso de (C) quelante alternativo (DTPA-lipídio) e (D) fluoróforo (DiI) para (B) pirolipídio incorporado separadamente em uma formulação de microbolhas lipídicas comerciais aniônicas (A) C16. As microbolhas foram caracterizadas por microscopia confocal (barra de escala = 20 μm) (i) e dimensionamento de impedância elétrica, gerando distribuições de tamanho ponderadas em número (ii) e volume (iii). O tamanho médio e o rendimento das microbolhas estão resumidos em (iv). Os dados são apresentados como uma média de n = 2-7 repetições em ii-iv. Clique aqui para ver uma versão maior desta figura.
| Variante de microbolhas | Rendimento | Volume de gás | Tamanho médio por distribuição numérica [μm] | Tamanho médio por distribuição de volume [μm] | Q702nm: Q674nm | Eficiência de têmpera de fl [%] |
| [x109 MB▪mL-1] | [x1010 μm3 ▪mL-1] | |||||
| Definity interno | 10 ± 4 | 1,8 ± 0,2 | 1,07 ± 0,03 | 3,64 ± 0,09 | N/A | N/A |
| C16 (-) | 3 ± 2 | 6 ± 3 | 1,7 ± 0,2 | 6,0 ± 0,8 | 2,5 ± 0,1 | 97,5 ± 0,8 |
| -C16 (-) | 3 ± 2 | 4 ± 2 | 1,8 ± 0,2 | 6,6 ± 0,8 | 2,3 ± 0,2 | 98 ± 2 |
| C16 n | 8,4 ± 0,4 | 2,3 ± 0,8 | 1,1 ± 0,2 | 4,6 ± 0,1 | 2,1 ± 0,5 | 98,2 ± 0,3 |
| -C16 n | 6,2 ± 0,5 | 2,9 ± 0,9 | 1,3 ± 0,2 | 5,1 ± 0,3 | 1,8 ± 0,6 | 98,7 ± 0,2 |
| C18 (-) | 8 ± 1 | 3,9 ± 0,9 | 1,5 ± 0,1 | 4,0 ± 0,5 | 2,5 ± 0,3 | 97 ± 1 |
| -C18 (-) | 7 ± 2 | 4 ± 1 | 1,5 ± 0,2 | 4,9 ± 0,9 | 2,2 ± 0,5 | 98,5 ± 0,6 |
| C18 n | 8 ± 1 | 3 ± 1 | 1,5 ± 0,1 | 4,0 ± 0,8 | 1,8 ± 0,7 | 98,6 ± 0,5 |
| -C18 | 7,8 ± 0,2 | 3,9 ± 0,2 | 1,42 ± 0,04 | 4,8 ± 0,1 | 1,8 ± 0,7 | 98,7 ± 0,3 |
Tabela 1: Propriedades físico-químicas de pDefs não quelatados e-quelatados. As microbolhas aniônicas são especificadas com (-), enquanto as zwitteriônicas (ou seja, neutras) são especificadas com "n". Todas as medidas representam uma média ± desvio padrão (n = 3-7). Essa figura foi adaptada com permissão de Rajora et al.15.
Figura suplementar 1: Comparação das abordagens "ground-up" (cinza) e "spiking" (rosa) para a introdução de pirolipídios em conchas de microbolhas lipídicas. (A) Imagem confocal de microbolhas "enriquecidas" com pirolipídios em quantidades correspondentes a composições pirolipídicas totais de 1 mol%, 10 mol% e 30% mol de lipídios totais (barra de escala = 20 μm). (B) Espectros UV-Vis (i-iii) de microbolhas pirolipídicas geradas por meio da abordagem "enriquecida" (magenta) ou "moída" (preta). (Biv) Porcentagem de pirolipídios em bolos de microbolhas versus infranadantes após a remoção centrífuga de espécies submicrônicas. (C) Distribuições de número e volume (i-iii) de microbolhas pirolipídicas feitas por meio de abordagens "moídas" (pretas) e "cravadas", e tamanhos médios de microbolhas correspondentes (iv) e rendimentos (v). Clique aqui para baixar este arquivo.
Figura suplementar 2: Caracterização de radio-UPLC de suspensões lipídicas de microbolhas compostas por 1 mol%, 10 mol% e 30 mol% pirolipídicos e radiomarcadas com cobre-64. Os espectros da esquerda são de um detector de radiação, enquanto os da direita são de um canal de absorbância de 400 nm. Infelizmente, devido a potenciais contaminantes, esses dados não puderam ser usados para quantificar a pureza radioquímica. No entanto, demonstra uma sobreposição nos tempos de eluição de picos associados ao sinal [64]2+ e pirolipídio, indicando radiomarcação bem-sucedida. Essa figura foi adaptada com permissão de Rajora et al.15. Clique aqui para baixar este arquivo.
Figura suplementar 3: Efeito do aumento da composição molar pirolipídica. Efeito em (A) distribuições numéricas associadas, (B) distribuições de volume, (C) tamanho médio do número, (D) tamanho médio do volume, (E) rendimento, (F) eficiência de extinção de fluorescência e sinal de fluorescência integrado (excitação de 410 nm, excitação de 600-800 nm) associado a intacto (PBS) e interrompido (em 1% Triton X-100). Os dados são apresentados como uma média de n = 3 repetições ± desvio padrão. Essa figura foi adaptada com permissão de Rajora et al.15. Clique aqui para baixar este arquivo.
Arquivo Suplementar 1. Clique aqui para baixar este arquivo.
Discussão
O atual protocolo de radiomarcação de microbolhas lipídicas atinge >95% de pureza radioquímica, eficiência de quelação de >95% e retenção de propriedades físico-químicas de microbolhas sem a necessidade de qualquer purificação pós-rotulagem. Essas realizações representam avanços anteriormente não alcançados para os protocolos de rotulagem existentes. A falta de etapas de purificação permite o uso mais rápido de radioisótopos (neste caso, cobre-64) e, portanto, a redução da perda de atividade ineficiente do decaimento radioativo. A retenção resultante das propriedades das microbolhas, combinada com a estabilidade conhecida da quelação de cobre-porfirina33, garante melhor que qualquer radioimagem ou terapia subsequente seja representativa da microbolha de interesse versus aquela associada a populações de radioisótopos livres ou microbolhas modificadas por purificação.
O protocolo atual também é o primeiro a integrar técnicas paralelas de rotulagem "fria" e caracterização-chave para garantir essa retenção das propriedades físico-químicas das microbolhas. Na verdade, este é o primeiro protocolo de radiomarcação de microbolhas no qual o tamanho, o rendimento e a estabilidade das microbolhas são caracterizados de forma robusta. Compreender essas propriedades é crucial para a aplicação de microbolhas radiomarcadas. O conhecimento do tamanho das microbolhas, volumes de gás e rendimento são necessários para determinar as doses de microbolhas, que por sua vez afetam a segurança e a eficácia do tratamento com microbolhas-FUS. Por exemplo, a abertura da microbolha-FUS BBB está associada a um limite superior para a dose de microbolhas/volume de gás, além do qual a hemorragia e a inflamação pós-FUS representam preocupações de segurança38. Para microbolhas carregadas de concha tudo-em-um, essa dose também está vinculada à dose do medicamento carregado. O tamanho e o rendimento também afetam as aplicações de imagem, gerando artefatos de blindagem com altas concentrações de volumes de gás de microbolhas39. Microbolhas grandes de >8 μm apresentam o risco adicional de segurança de se alojar nos capilares e formar êmbolos gasosos40. Intuitivamente, isso também afetaria a farmacocinética e a biodistribuição das conchas de microbolhas. Por exemplo, os pulmões foram relatados anteriormente como um local primário de acúmulo de conchas de microbolhas radiomarcadas28,32. Na ausência de caracterização de microbolhas, ainda não está claro se o aprisionamento pulmonar de microbolhas de tamanho maior contribuiu para esse perfil de biodistribuição. Especificamente para o uso de porfirina, a caracterização das propriedades ópticas das microbolhas garante uma carga eficaz da casca da porfirina, o que pode influenciar as proporções metal:porfirina e, por sua vez, a eficiência da quelação, como será discutido abaixo. A porfirina também é um agente teranóstico de interesse para imagens multimodais de microbolhas37, terapia fotodinâmica sinérgica41 e terapia sonodinâmica42. A caracterização de sua carga e fluorescência dentro de microbolhas orienta os estudos terapêuticos de microbolhas de porfirina e garante que essas propriedades permaneçam inalteradas com a radiomarcação para facilitar o verdadeiro planejamento da terapia guiada por imagem. Assim, é fortemente implorado que a rotulagem "fria" e a fabricação de microbolhas não marcadas sejam conduzidas em paralelo à radiomarcação.
Este protocolo aproveita as fortes capacidades de quelação de cobre das porfirinas e a conhecida automontagem de porfirina-lipídio dentro de conchas de microbolhas37. Embora focado no cobre-64, este protocolo abre as portas para preparações alternativas de microbolhas metaloqueladas de um pote, pois as classes mais amplas de porfirinas podem se ligar a Zn, Ni, Mn, Pd, In, Lu, Cd, Sn, Ga, Co e além 43,44,45,46. Essa quelação de porfirina-metal normalmente ocorre em uma das duas etapas durante a síntese supramolecular de porfirina: 1) pré-inserção, onde os blocos de construção da porfirina são quelatados antes de sua introdução nas partículas, ou 2) pós-inserção, na qual a porfirina já está montada em uma partícula antes de conduzir a quelação do metal33,43. Ao usar radioisótopos, o primeiro está associado ao decaimento radioativo ineficiente durante a secagem do filme lipídico, o que, por sua vez, aumenta os riscos de segurança da radiação. Este último, quando aplicado a microbolhas, arriscaria a desestabilização das partículas. Como tal, uma abordagem híbrida foi gerada no protocolo atual em que o quelante foi introduzido durante a formação do filme lipídico "moído", mas a radiomarcação foi realizada após a hidratação do filme lipídico e antes da ativação das microbolhas. Essa estratégia permitiu que a radiomarcação fosse facilmente incorporada a um processo típico de fabricação de microbolhas, tornando-o passível de várias formulações de microbolhas. Além disso, essa integração permitiu o uso de instrumentação simples e minimizou o número de equipamentos radioativamente "quentes" especializados.
Essa abordagem híbrida também é distinta dos protocolos de radiomarcação de microbolhas existentes, que são amplamente divididos em duas abordagens predominantes: 1) Síntese e radiomarcação de um quelante, que é então "enriquecido" em suspensões lipídicas de microbolhas pré-formadas28,47, e 2) radiomarcação de uma porção biotinilada que é subsequentemente incubada com microbolhas comerciais funcionalizadas com estreptavidina comercial 32,29. Esta última abordagem tem a vantagem de conservar o uso de radioisótopos. Nos protocolos "ground-up" e "enriquecidos" apresentados, o radioisótopo-quelante é incorporado antes da ativação das microbolhas e, portanto, tanto as microbolhas decantadas alvo quanto as populações indesejadas de partículas grandes e espumosas são marcadas. Essa limitação significa que uma quantidade maior de radioisótopo é necessária para abordagens "trituradas" e "enriquecidas", metade das quais é desperdiçada. No entanto, conforme descrito acima, a radiomarcação pós-ativação corre o risco de desestabilização de microbolhas e, juntamente com os protocolos anteriores de "pico", requer a remoção do quelante radiomarcado não integrado.
No entanto, a abordagem de "pico" abre caminhos para a radiomarcação de suspensões lipídicas de microbolhas pré-formadas (por exemplo, microbolhas comerciais) quando a geração de filme lipídico não é viável ou desejada. O atual protocolo de radiomarcação "ground-up" pode ser adaptado para imitar essa abordagem de "pico" (etapa 8.3). Aqui, um filme pirolipídico é gerado e depois hidratado para formar uma suspensão pirolipídica de vesículas. Esta suspensão é então "enriquecida" em uma suspensão lipídica de microbolhas pré-formada e aquecida / sonicada para integrar o pirolipídio. A radiomarcação pode ocorrer antes ou diretamente após o "pico" (mas antes da ativação). Como pode ser visto na Figura Suplementar 1A, este protocolo adaptado rotula formulações comerciais internas de microbolhas com quelante pirolipídico "enriquecido" em composições de 1 mol%, 10 mol% ou 30 mol% do lipídio total.
Essa abordagem de "pico" apresenta uma limitação importante em comparação com a abordagem "de baixo para cima" não modificada em foco no protocolo atual: integração pirolipídica incompleta. Como pode ser visto na imagem confocal (Figura 1A suplementar), o sinal pirolipídico não se localiza estritamente de forma homogênea e semelhante a um anel ao redor da concha da microbolha, como ocorre durante a incorporação "moída". Em vez disso, a abordagem de "pico" está associada a áreas irregulares de fluorescência visíveis através das microbolhas, algumas das quais têm contornos fluorescentes difusos versus nítidos. Maior fluorescência de fundo não uniforme também é observável. A centrifugação dessas microbolhas "pontiagudas" para remover espécies submicrônicas elimina essa fluorescência de fundo e grande parte do sinal irregular. Isso sugere que as vesículas pirolipídicas podem ter sido absorvidas, mas não completamente integradas à concha da microbolha, uma conjectura apoiada pela caracterização UV-Vis da incorporação "enriquecida" versus "triturada" de pirolipídios (Figura Suplementar 1B). A banda Q de 704 nm associada especificamente à inclusão de pirolipídios em microbolhas (com composição de >5 mol%) é reduzida com "spiking". Em vez disso, um pico mais proeminente é observado em 674 nm. A quantificação de pirolipídios distribuídos para bolos de microbolhas versus espécies infranadantes submicrométricas demonstra que apenas um quarto do pirolipídio é distribuído para as microbolhas com "cravação". Ao contrário, quantidades mais altas de pirolipídios são incorporadas às microbolhas para a introdução de quelantes "moídos". A menor incorporação de pirolipídios dentro de microbolhas "enriquecidas" é provavelmente o fator que contribui para suas distribuições de tamanho semelhantes a microbolhas sem sonda versus microbolhas "moídas" associadas (Figura Suplementar 1C). A presença de estruturas pirolipídicas radiomarcadas não incorporadas pode confundir os resultados da radioimagem ou da terapia. Como tal, à semelhança dos protocolos existentes, uma abordagem de "cravação" deve ser seguida por uma etapa de centrifugação ou decantação que remova as espécies pirolipídicas não incorporadas. Levando em consideração todos os itens acima, a estratégia de radiomarcação "básica" apresentada no protocolo atual é mais fortemente recomendada. Ele permite maior integração do quelante em comparação com o "spiking" e permite a personalização da formulação de microbolhas, ao contrário das microbolhas comerciais pré-formadas.
O protocolo de quelação de cobre "ground-up" foi estabelecido por meio de uma exploração sistemática dos parâmetros de reação, conforme descrito anteriormente48. Esse processo de otimização forneceu informações sobre as etapas críticas para a produção de microbolhas de qualidade, ao mesmo tempo em que permite uma quelação de cobre eficiente e oportuna: 1) manter um conteúdo de excipiente de 10% de glicerol e 10% de propilenoglicol antes da ativação das microbolhas, 2) garantir que a temperatura de quelação permaneça entre 60-80 °C, 3) filmes hidratantes com AA-PGG no mesmo dia da radiomarcação (a exposição prolongada da suspensão lipídica a condições ácidas deve ser evitada), 4) neutralizar a suspensão lipídica antes da ativação e 5) garantir as etapas de "resfriamento" após a hidratação, quelação e ativação. A proporção porfirina:cobre deve ser mantida acima de 10:1. Um excesso de porfirina em relação ao cobre é necessário para manter o tamanho da microbolha, rendimento, estabilidade e eficiência da quelação, bem como recursos duplos de imagem de rádio e fluorescência, uma vez que a quelação do cobre extingue a fluorescência da porfirina. O volume de reação de 1 mL e o tempo de quelação de 1 h produziram radiomarcação eficiente e pura para composições de suspensão pirolipídica de 30 mol%, correspondendo a <1% das porções pirolipídicas nas microbolhas que estão sendo marcadas. A redução das composições pirolipídicas em filmes lipídicos para 1 mol% e 10% mol reduziu o excesso de pirolipídios para a mesma adição de cobre-64 e exigiu modificação na reação de radiomarcação. Foi necessária uma reação mais concentrada e, assim, os filmes de microbolhas associados foram hidratados com 0,15 mL de AA-PGG. Após a neutralização, o PGG foi adicionado para produzir um volume de suspensão lipídica radiomarcada de 1 mL antes da ativação das microbolhas. A composição de 1 mol% exigiu um aquecimento mais longo (1,5-2 h) para produzir ≥95% de eficiência e pureza de radiomarcação. Assim, se forem encontrados desafios de radiomarcação (ou seja, ≤90% de pureza e eficiência radioquímica), um tempo de reação mais longo e menor volume de reação (ou seja, suspensão lipídica mais concentrada) podem ser testados.
Este protocolo usou iTLC e uma técnica de filtração centrífuga validada15 para quantificar a pureza radioquímica e a eficiência da radiomarcação, respectivamente. Uma leitura in vivo para quelação bem-sucedida e estável do cobre-64 é a ausência de sinal da bexiga (o cobre-64 livre sofre excreção renal, enquanto as estruturas supramoleculares lipídicas, como as conchas de microbolhas, sofrem excreção hepatobiliar/fecal)15. A eficácia da quelação foi validada por cromatografia líquida de radio-alta eficiência (Figura Suplementar 2), que, se disponível, é outro meio de avaliar a pureza radioquímica e a eficiência da marcação. Este protocolo apresentou o iTLC e a filtragem centrífuga como métodos mais rápidos e simples que não requerem habilidades ou instrumentos especializados e, em vez disso, usam equipamentos que as instalações nucleares de laboratórios de pesquisa teriam maior probabilidade de possuir. Para este fim, o protocolo de filtração centrífuga foi validado para separação de cobre livre e quelatado usando 30.000 unidades MWCO (100.000 unidades MWCO também podem ser usadas). Se estiver usando um radioisótopo/metal alternativo, a velocidade da centrífuga, o tempo e o número de lavagens podem precisar ser modificados. Se for utilizado um metal alternativo para o qual a estabilidade da quelação cobre-metal é desconhecida ou precária, deve também ser realizado um ensaio de estabilidade sérica adequado.
Além dos desafios de radiomarcação, também podem surgir desafios de fabricação de microbolhas. Conforme apresentado anteriormente, as microbolhas são frágeis e as etapas para sua fabricação exigem precisão e manuseio cuidadoso, sem os quais problemas de hidratação, ativação, reprodutibilidade, estabilidade e rendimento podem ser encontrados, conforme ilustrado na Figura 3. Outros fatores que promovem a fabricação bem-sucedida de microbolhas incluem 1) uso de lipídios frescos e secos (armazene os lipídios secos em um dessecador e proteja do gelo), 2) evitar o uso de alíquotas lipídicas que foram submetidas ao calor (por exemplo, por meio de aspiração rápida) e 3) preparar um tampão de hidratação fresco sem bolhas de ar. Em circunstâncias em que a fabricação de microbolhas de controle produz produtos adequados, mas não aqueles gerados após a radiomarcação, considerações adicionais podem estar em jogo. A temperatura e a duração da reação de quelação podem estar fora dos prazos de 60-80 °C e 0-2 h para os quais o protocolo atual foi validado. Além disso, pode ser viável que a atividade específica do cobre-64 ou de outros radioisótopos possa ser significativamente menor do que a associada ao estudo atual. Isso resultaria em uma proporção maior de espécies de porfirinas sendo marcadas para o mesmo nível de atividade (ex menor do que o excesso de porfirina: cobre de 10: 1 para o qual este protocolo foi validado), o que poderia interromper a ativação de microbolhas.
Muitos dos desafios acima na fabricação bem-sucedida de microbolhas podem ser mitigados testando primeiro a fabricação de microbolhas descrita na ausência de radiomarcação, especialmente se os usuários forem novos na síntese de microbolhas. Recomenda-se primeiro gerar microbolhas não quelatadas de controle e, posteriormente, ensaiar o protocolo de marcação com cobre não radioativo "frio". Conforme descrito acima, este processo de quelação "frio" é vital para obter uma caracterização físico-química representativa das microbolhas radiomarcadas. A quelação "fria" também serve como um primeiro passo importante para garantir que quaisquer modificações feitas no protocolo descrito (por exemplo, temperatura de quelação alterada, volume, tempo de reação, proporção porfirina:cobre, radioisótopo, quelante alternativo) retenham as propriedades físico-químicas desejadas das microbolhas.
Uma dessas mudanças pode ser o uso de quelantes e sondas alternativas. Uma limitação do protocolo atual é o uso fundamental de um quelante comercialmente indisponível. Como tal, são apresentadas modificações (seção 8 do protocolo) que permitem o uso de quelantes e sondas fluorescentes disponíveis comercialmente em vez de pirolipídios. Foram obtidos dados de teste associados à incorporação de DiI ou DTPA-lipídio como alternativas ao pirolipídio (Figura 6). DiI é uma sonda comercialmente disponível que foi incorporada em conchas de microbolhas para estudar mecanismos de microbolhas-FUS e agentes medicamentosos modelo 49,50,51. Até onde sabemos, este é o primeiro relato de uma microbolha lipídica DTPA. A substituição bem-sucedida de pirolipídios por essas porções alternativas mostra a versatilidade do atual protocolo de fabricação e rotulagem de microbolhas. Provavelmente pode ser aplicado a uma gama mais ampla de sondas, particularmente aquelas amarradas ou que podem se integrar entre os fosfolipídios.
Embora substituível neste protocolo, o pirolipídio oferece a vantagem única de abrigar habilidades complementares de radioimagem e rastreamento de fluorescência em uma única molécula orgânica. Essa multimodalidade pode ser vantajosa para monitorar a entrega e a biodistribuição de conchas de microbolhas. Isso é especialmente verdadeiro ao usar composições pirolipídicas ≥10 mol%. Em composições crescentes, o pirolipídio dentro das conchas de microbolhas (e estruturas supramoleculares em geral) torna-se cada vez mais extinto com fluorescência15. Após a ruptura das partículas, composições de porfirinas mais altas produzem sinais de fluorescência substancialmente mais fortes (Figura Suplementar 3). Essa extinção de fluorescência pode servir como uma leitura adicional ao obter imagens do destino da casca da microbolha. Por exemplo, enquanto o PET facilita a quantificação da entrega/biodistribuição absoluta da casca, a imagem de fluorescência pode capturar se esse acúmulo está associado à ruptura de partículas.
No entanto, uma das limitações das composições molares pirolipídicas mais altas são os efeitos que elas têm no tamanho e no rendimento das microbolhas. Descobriu-se que a substituição dos lipídios do hospedeiro por composições pirolipídicas crescentes em uma formulação comercial de microbolhas lipídicas produz bolhas maiores, menores rendimentos de microbolhas e microbolhas mais instáveis15. Para facilitar a referência, esses achados estão resumidos na Figura Suplementar 3 para as composições pirolipídicas de 1 mol%, 10 mol% e 30% mol% para as quais o protocolo de radiomarcação atual foi validado. Essa alteração no tamanho das microbolhas com adição de sonda não é exclusiva do pirolipídio. Por exemplo, em uma composição de 5 mol%, a inclusão de DiI em uma formulação comercial de microbolhas lipídicas reduziu o rendimento das microbolhas em 10 vezes e aumentou o tamanho das microbolhas em mais de 60% (Figura 6). Em comparação, uma composição pirolipídica de 5% mol não exibiu rendimento, tamanho médio de volume ou volume de pico significativamente diferentes, mas aumentou o tamanho médio do número de microbolhas em 25% 15 . Além disso, o aumento da composição pirolipídica de 1 mol% para 30% não afeta significativamente a circulação da casca e as vias de depuração15. No entanto, se a retenção de distribuições de tamanho associadas a formulações comerciais ou sem sonda for desejada, o atual protocolo de fabricação de microbolhas e radiomarcação pode ser aplicado usando uma composição pirolipídica de 1 mol%. Essa baixa quantidade de inclusão de pirolipídios não altera significativamente nenhum parâmetro de dimensionamento ou rendimento associado às formulações sem sonda de linha de base (Figura Suplementar 3). No entanto, isso ocorre às custas da perda de fortes capacidades de fluorescência ativáveis associadas a composições pirolipídicas mais altas. Uma solução comprometedora poderia ser a seleção de uma composição pirolipídica de 10% mol. No geral, dado que composições pirolipídicas tão baixas quanto 1 mol% eram passíveis de radiomarcação atual, existe um grande grau de modularidade a partir do qual as capacidades de dimensionamento, rendimento e fluorescência de microbolhas podem ser adaptadas.
No geral, a adaptabilidade abrangente do protocolo de radiomarcação atual pode permitir a multiplicidade de aplicações de microbolhas radiomarcadas analisadas na Introdução. Talvez o mais relevante para o cenário atual do campo de microbolhas-FUS seja o radiotraçado do destino da casca de microbolhas para o projeto de plataforma de entrega de medicamentos guiada por imagem. Essa aplicação de microbolhas radiomarcadas foi explorada em um estudo recente15. O protocolo de radiomarcação atual foi aplicado para gerar uma série de microbolhas de porfirina marcadas com cobre-64 multimodais com comprimento e carga de cadeia acila variados, representando as composições de microbolhas lipídicas mais amplamente estudadas na literatura clínica e pré-clínica. A dissolução de gás in vivo , a depuração da casca, a biodistribuição e a cinética de desmontagem foram monitoradas em camundongos saudáveis e portadores de tumor por meio de ultrassom, PET e imagens de fluorescência, produzindo um estudo farmacocinético longitudinal e sistemático de microbolhas lipídicas inédito. As principais descobertas incluíram: 1) Os núcleos de microbolhas se dissolvem em minutos, onde o aumento do comprimento da cadeia lipídica das microbolhas levou a uma dissolução mais lenta de microbolhas neutras e dissolução mais rápida de microbolhas aniônicas (mais semelhantes às formulações comerciais); 2) As conchas remanescentes circularam por mais de 24 h no sangue e foram eliminadas por uma via hepatobiliar/esplênica/fecal; 3) Essa depuração dependia da composição das microbolhas, de modo que as conchas de cadeia mais curta sofriam maior processamento hepático, enquanto as conchas de cadeia mais longa exibiam maior absorção esplênica; 4) As conchas de microbolhas sofreram acúmulo preferencial nos tumores em comparação com o tecido circundante já no primeiro ponto de tempo PET após a injeção (1 h), com microbolhas com casca neutra C18 exibindo a maior captação passiva e aumentada por FUS (realce máximo em 3,5 h pós-tratamento), apesar de facilitar níveis semelhantes de abertura do vaso mediada por FUS (conforme determinado pela co-administração de azul de Evans); 5) Em geral, os aprimoramentos do FUS na entrega do invólucro do tumor foram modestos e não iguais entre todas as formulações de microbolhas, demonstrando que a entrega do invólucro carregado com carga aprimorada pelo FUS não pode ser alcançada de forma onipresente em diversas microbolhas e pode exigir pressões mais altas do FUS; 6) conchas de microbolhas dentro do tumor, fígado e baço foram encontradas predominantemente no espaço extravascular; e 7) conchas de menor comprimento de cadeia sofreram desmontagem mais rápida, em que o tumor apresentou as maiores taxas de desmontagem do fragmento de concha. Essas descobertas esclareceram a sabedoria convencional dentro do campo de microbolhas-FUS e derrubaram certas suposições em torno de projetos ideais de microbolhas para entrega de tumor baseada em concha. As principais orientações iniciais incluíram o uso de lipídios C18 para formular microbolhas carregadas de drogas para alvos esplênicos, lipídios C16 para alvos hepáticos, cadeias neutras mais longas para imagens de contraste de ultrassom e circulação sanguínea mais longa, lipídios C18 neutros para alvos tumorais, uso contraindicado de drogas com toxicidade hepatoesplênica em microbolhas lipídicas carregadas com concha tudo-em-um e aplicação de tais sistemas para tumores com baixa permeabilidade vascular basal. Este estudo, portanto, iniciou relações estrutura-atividade que poderiam informar um design de microbolhas mais ideal e forneceu um plano para novas explorações, todas possibilitadas pelo atual protocolo de radiomarcação. Essa capacidade foi ampliada usando o conjunto de dados farmacocinéticos de microbolhas obtido para construir uma ferramenta de aprendizado profundo adaptada para segmentação automática de órgãos PET/CT, permitindo uma análise de dados farmacocinéticos mais eficiente. 52
O foco do protocolo atual foi colocado na radiomarcação de microbolhas lipídicas. No entanto, no contexto de projetos de agentes de ultrassom carregados com carga, seria negligente ignorar nanogotículas e microbolhas poliméricas. As nanogotículas são sistemas de mudança de fase que consistem em um núcleo de perfluorocarbono líquido encapsulado por camadas de lipídios, proteínas ou polímeros. Sob FUS de alta intensidade, essas nanogotículas são convertidas em microbolhas por meio da vaporização acústica do núcleo líquido. Este mecanismo de atividade FUS e o tamanho menor das nanogotículas apresentam vantagens potenciais para a entrega carregada por concha: 1) maior estabilidade in vivo, 2) maior permeabilidade no tecido e maior entrega do tumor, 3) facilidade para atividade vascular e extravascular e 4) rápida liberação do medicamento após vaporização acústica 50,53,54. Assim, a radiomarcação de nanogotículas carregadas de carga também seria benéfica para o rastreamento de rádio e o planejamento de tratamento guiado por imagem em trabalhos futuros. O protocolo de radiomarcação atual pode ser incorporado prontamente em nanogotículas fabricadas por meio do método de condensação, que já demonstrou permitir o carregamento de lipídios de porfirina dentro de cascas de nanogotículas35.
Acredita-se também que as microbolhas poliméricas exibam vantagens de entrega de medicamentos carregados com concha sobre as microbolhas lipídicas devido às suas conchas rígidas e modulares, proporcionando maior estabilidade putativa ao carregamento de drogas, encapsulamento de carga e ajuste de carga de drogas por meio da espessura da casca do polímero e modulação da composição do material 55,56,57. Devido à sua estabilidade, as microbolhas poliméricas podem não encontrar as mesmas limitações de radiomarcação que as microbolhas lipídicas, que o protocolo atual foi projetado para superar. No entanto, o protocolo atual ainda pode ser usado para informar a radiomarcação de microbolhas poliméricas em duas contas: 1) caracterização de microbolhas e 2) eficiência de quelação. A radiomarcação de microbolhas poliméricas é limitada no estudo, mas normalmente envolve a funcionalização da superfície de conchas poliméricas com quelantes (por exemplo, DOTA e NOTA), seguida de adição de isótopos, aquecimento e lavagem para remover o isótopo livre27,58. Da mesma forma que os protocolos existentes de radiomarcação de microbolhas lipídicas, esses relatórios não caracterizam as propriedades físico-químicas das microbolhas após a marcação. Assim, o protocolo atual pode ser usado como um modelo para padronizar o uso de marcação e caracterização "fria" ao radiomarcar qualquer tipo de concha de microbolhas. Além disso, há espaço para melhorias nos rendimentos de radiomarcação de microbolhas poliméricas (intervalo relatado de 42% a 85% para microbolhas enxertadas com quelante58). O uso de porfirina como um quelante de radioisótopo forte e eficiente neste estudo pode ser traduzido em trabalhos futuros, adaptando as técnicas existentes de conjugação de casca de porfirina-polímero59 antes da quelação do cobre. No geral, as microbolhas poliméricas não são tão populares quanto as microbolhas lipídicas. As microbolhas lipídicas são a única variante de concha atualmente clinicamente aprovada para uso humano, tornando-as o material de escolha para uma tradução mais rápida de plataformas terapêuticas de microbolhas-FUS. Além disso, as poucas comparações diretas de polímero versus FUS terapêutico com casca lipídica sugerem que as camadas lipídicas facilitam maior permeabilização do vaso, liberação mais rápida do medicamento desencadeada por FUS, ablação tecidual mais forte e elevações de temperatura mais rápidas em paradigmas FUS de alta intensidade 60,61,62. Coletivamente, as microbolhas lipídicas são, portanto, mais amplamente estudadas para aplicações terapêuticas de FUS do que outras variantes de concha. Consequentemente, o foco do atual protocolo de radiomarcação em microbolhas lipídicas se alinha com o do campo mais amplo de microbolhas-FUS.
Além de informar os mecanismos de microbolhas-FUS e os projetos de microbolhas carregadas de carga, as microbolhas radiomarcadas também propuseram utilidade para a radioterapia27. O interesse em combinar FUS e atividade radioteranóstica em um único agente é construído com base em evidências de que o FUS de microbolhas atua sinergicamente com a radioterapia para fortalecer a resposta antineoplásica da radioterapia16. O protocolo de radiomarcação atual pode ser adaptado para empregar cobre-67 (mais adequado para radioterapia63) em vez de cobre-64 para gerar uma microbolha radioteranóstica. No entanto, o estudo farmacocinético concluído com base na atual estratégia de radiomarcação de microbolhas lipídicas demonstrou alto acúmulo hepatoesplênico das conchas de microbolhas15. Esse acúmulo fora do alvo é uma consideração importante se as microbolhas radiomarcadas forem aplicadas como agentes duplos de FUS/radioterapia.
Nesse contexto, estratégias de mitigação da toxicidade hepatoesplênica seriam necessárias. Por exemplo, conforme revisado minuciosamente por Navarro-Becerra e Borden64, vários autores funcionalizaram microbolhas lipídicas com ligantes direcionados ao tumor (por exemplo, VEGFR2 mAb, RGD, folato) por meio do acoplamento biotina/avidina e absorção eletrostática. Essa biofuncionalização aumenta a entrega de carga carregada aos tumores, diminui o acúmulo de tecido fora do alvo e melhora a terapia tumoral 32,65,66. Como a funcionalização é tipicamente de natureza eletrostática, o protocolo atual de radiomarcação e fabricação de microbolhas pode ser usado no estado em que se encontra antes da absorção do ligante. Ajustes no protocolo de radiomarcação podem ser necessários para acomodar qualquer peptídeo sensível ao calor e ligantes proteicos que devam ser incorporados covalentemente (por exemplo, peptídeos conjugados com lipídios PEG). Nesses casos, o tempo de reação de quelação pode ser estendido enquanto reduz a temperatura de reação para 37 ° C, uma abordagem que produziu uma quelação eficiente de porfirina-cobre dentro de nanopartículas de lipoproteína, preservando as capacidades de direcionamento34. No entanto, é improvável que a adição de ligantes direcionados à superfície das microbolhas radiomarcadas alivie completamente as preocupações de toxicidade hepatoesplênica associadas à radioterapia com microbolhas de cobre-67 em doses mais altas. Por exemplo, a funcionalização de microbolhas com anticorpos p-selectina dobrou sua entrega de tumor em camundongos e diminuiu o acúmulo de fígado em 4x, mas o acúmulo de fígado ainda estava em 9% de ID / g (duas vezes mais alto que o acúmulo de tumor) 1 h apósa injeção 32. Uma alternativa mais promissora ao direcionamento de ligantes pode ser a entrega locorregional de microbolhas radioterapêuticas por meio de injeção intratumoral. Embora seja um meio atípico de administrar microbolhas, a injeção intratumoral de microbolhas foi demonstrada por Bismuto et al.39 para alcançar forte ablação tumoral (50% de perfuração tecidual) com um único tratamento FUS de 60 s (MI 0,9). Seria de se esperar uma ablação tumoral ainda mais forte se essas microbolhas tivessem capacidades radioterapêuticas adicionais. Para esse fim, trabalhos futuros também podem se beneficiar do uso de núcleos de oxigênio em microbolhas radiomarcadas para aumentar ainda mais a sinergia microbolha-FUS/radioterapia, aliviando a hipóxia tumoral67,68. Antes de sua aplicação como agentes radioterapêuticos/FUS duplos, as microbolhas radiomarcadas administradas intratumorais devem ser avaliadas farmacocinéticamente para garantir que a entrega locorregional não cause vazamento sistêmico. Isso destaca a importância intrínseca do radiotraçado em todas as aplicações propostas de microbolhas radiomarcadas viabilizadas pelo estudo atual.
Em resumo, o protocolo atual oferece avanços na radiomarcação de microbolhas. Suas vantagens coletivas incluem incorporação aprimorada de quelantes "triturados", alta eficiência de quelação, ausência de purificação de radioisótopos ou quelantes livres pós-marcação, preservação das propriedades físico-químicas das microbolhas, aplicação versátil em diversas formulações de microbolhas, adaptabilidade a quelantes e fluoróforos alternativos e personalização da composição do quelante e multimodalidade e tamanho de partícula associados. Em última análise, produz microbolhas personalizadas de rádio e/ou fluorescentemente ativas que podem promover insights mecanicistas e capacidades teranósticas do microbubble-FUS. Essas aplicações podem incluir a aquisição de dados farmacocinéticos quantitativos representativos, ampliando os recursos de imagem multimodal de microbolhas, facilitando a otimização da terapia guiada por imagem e permitindo terapias sinérgicas de rádio (e/ou porfirina) microbolhas-FUS.
Divulgações
Os autores não relatam conflitos de interesse.
Agradecimentos
Agradecemos a Deborah Scollard e Teesha Komal (programa de Direcionamento Espaço-Temporal e Amplificação de Resposta à Radiação (STTARR) da University Health Network, Toronto, Ontário) por seus serviços técnicos e orientação. Também agradecemos a Mark Zheng e ao Dr. Alex Dhaliwal por sua assistência técnica durante a microscopia confocal e ao Advanced Optical Microscopy Facility (Toronto, Ontário) por fornecer equipamentos associados. Reconhecemos nossas fontes de financiamento: os Institutos Canadenses de Pesquisa em Saúde, o Instituto de Pesquisa Terry Fox, o Conselho de Pesquisa em Ciências Naturais e Engenharia do Canadá, a Fundação Canadense para Inovação, a Fundação Princesa Margaret Câncer, o Programa de Cátedras de Pesquisa do Canadá, o Centro McLaughlin, o Programa de Bolsas de Estudo Vanier, o Programa de Bolsas de Estudo para Estudantes de Pós-Graduação de Ontário, o Câncer de Próstata Canadá e a Fundação de Caridade Peterborough KM Hunter.
Materiais
| Name | Company | Catalog Number | Comments |
| 64CuCl2 | Washington University School of Medicine, Mallinckrodt Institute of Radiology | N/A | Order in small volume (<10 µL) dissolved in 0.1 N HCl |
| Acetic acid | Any company | ≥ 95% purity | |
| Aluminum foil | Any company | ||
| Ammonium acetate | Any company | Purity: ≥ 98% | |
| Balance - analytical | Any company | Able to measure down to 0.1 mg | |
| Bath sonicator | Any company | Can be heated to 69 oC | |
| CC aperture - 30 micron | Beckman Coulter | A36391 | Particle diameter range: 0.6-18 um |
| CC electrolyte | Beckman Coulter | 8546719 | Isoton II diluent |
| CC Software | Beckman Coulter | Multisizer 4e | |
| Centrifuge filter units (0.5 mL 30,000 MWCO) with compatible microcentrifuge tubes | MilliporeSigma | UFC503096 | Amicon Ultra - 0.5 mL |
| Centrifuge tubes - 15 mL with caps | Any company | ||
| Chloroform | Any company | Purity: ≥ 99.8% | |
| Coulter counter | Beckman Coulter | B43905 | Multisizer 4e Coulter Counter |
| Cover slips | VWR | 48393081 | VWR micro cover glass |
| CuCl2 | Any company | Ensure not oxidized | |
| CuCl2 | |||
| Cuvette- quarts, 1 cm path length | Any company | ||
| Cuvettes - 10 mL plastic for CC measurements | Beckman Coulter | A35471 | Coulter Counter Accuvette ST |
| ddH2O | Any company | Can be obtained through an ultrapure water purification system | |
| DiI (1,1'-Dioctadecyl-3,3,3',3'-Tetramethylindocarbocyanine Perchlorate) | Any company | Powder form | |
| Dose calibrator | Any company | Able to read copper-64 | |
| DPPA (1,2-dipalmitoyl-sn-glycero-3-phosphate (sodium salt)) | Avanti Polar Lipids | 830855P | Powder form |
| DPPC (1,2-dipalmitoyl-sn-glycero-3-phosphocholine) | Avanti Polar Lipids | 850355P | Powder form |
| DPPE-MPEG (1,2-dipalmitoyl-sn-glycero-3-phosphoethanolamine-N-[methoxy(polyethylene glycol)-5000] (ammonium salt)) | Avanti Polar Lipids | 880200P | Powder form |
| DTPA-lipid (1,2-dipalmitoyl-sn-glycero-3-phosphoethanolamine-N-diethylenetriaminepentaacetic acid (ammonium salt)) | Avanti Polar Lipids | 790106P | Powder form |
| EDTA (Ethylenediaminetetraacetic acid) | Any company | ||
| Gamma counter | Any company | Able to read copper-64 | |
| Gamma counting tube push caps | Globe Scientific | 22-171-665 | Flanged plug caps for 12 mm tubes |
| Gamma counting tubes | Sarstedt | 55.1579 | 5 mL, 75 x 12 mm, PS |
| Glass beaker - 250 mL | Any company | Able to withstand temperatures up to 100 oC | |
| Glass drying oven | Any company | Can be heated to 80 oC | |
| Glass microliter syringes - 25, 50, 100, 1000 µL | Any company | Compatible with organic solvents | |
| Glass scintillation vials - 20 mL | VWR | 66022-081 | VWR® Scintillation Vials, Borosilicate Glass, with Screw Caps, With pulp foil liner |
| Glass vials - 0.5 dram | VWR | 66011-020 | VWR Vial 1/2 dram, with black phenolic screw cap and polyvinyl-faced pulp liner |
| Glycerol | Sigma Aldrich | G7757-1L | Purity: ≥ 99.0% |
| Graduated pipette/gun | Any company | ||
| Hot/stir plate | Equipped with temperature prob for automatic tempearture control | ||
| Hydrochloric acid - 0.1 N | Any company | ||
| iTLC plates | Agilent | A120B12 | iTLC-SA chromatography paper |
| Laboratory tissues | Any company | ||
| Media vaccuum filtration unit | Any company | 0.22 micron pore size, PES membrane, 500 mL funnel capacity | |
| Methanol | Any company | Purity: ≥ 99.8%, HPLC grade, meets ACS specifications | |
| Microcentrifuge tubes non sterile - 1.5 mL | Any company | ||
| Microcentrifuge tubes sterile - 1.5 mL | Any company | ||
| Micropipetes - p1000, p200, p20, p10 | Any company | Ensure are calibrated | |
| Microscope slides | Fisher Scientific | 12-550-15 | Superfrost Plus Microscope Slides Precleaned |
| Needles - 18 G | Sterile | ||
| Parafilm | Any company | ||
| PBS | Sigma Aldrich | D8537-500ML | DPBS, modified, without calcium chloride and magnesium chloride, liquid, sterile-filtered, suitable for cell culture |
| PFP | FluoroMed | APF-N40HP | Purity: ≥ 99.8% |
| PFP line | Any company | 1/4 inch diameter plastic hose cut about 50 cm in length | |
| PFP regulator | Swagelok | SS-1RF4 and SS-4HC-1-4 | |
| pH meter | Any company | ||
| pH standards 4 and 7 | Any company | ||
| Pipette tips for p1000, p200, p10 - non sterile | Any company | ||
| Pipette tips for p1000, p200, p10 - sterile | Any company | ||
| Plastic syringe - 1 mL | Any company | Sterile | |
| Propylene glycol | BioShop | PRO888.500 | Purity: ≥ 99.5% |
| Pyro-lipid | N/A | Made in-house | |
| Rubber tipped forceps | Any company | Mix of fine-tipped and flat/square edges recommended | |
| Scissors | Any company | ||
| Sodium hydroxide - 1 N | Any company | ||
| Sodium hydroxide - 10 N | Any company | ||
| Spectrofluorometer | Any company | Capable of 410 nm excitation and 600-850 nm emission | |
| Spectrofluorometry software | Horiba | FluorEssence | |
| Spectrometer | Any company | ||
| Syringe - 1 mL | Any company | Disposible, plastic, sterile | |
| Syringe filters - 0.2 micron pore size | Any company | Membrane material: PES or other compatible with ammonium acetate/acetic acid and PBS | |
| Test tube - 10 mL | |||
| Triton X-100 | Any company | ||
| Vacuum desicator/vacuum | Any company | ||
| Vialmix | Lantheus Medical Imaging | 515030-0508 | Referred to in protocol as a mechanical vial shaker |
| Weigh paper | Any company | To avoid losing product, cutting weigh paper into 3x3 cm squares is recommended |
Referências
- Itani, M., Mattrey, R. F. The effect of inhaled gases on ultrasound contrast agent longevity in vivo. Mol Imaging Biol. 14 (1), 40-46 (2012).
- Kong, W. T., Wang, W. P., Huang, B. J., Ding, H., Mao, F. Value of wash-in and wash-out time in the diagnosis between hepatocellular carcinoma and other hepatic nodules with similar vascular pattern on contrast-enhanced ultrasound. J Gastroenterol Hepatol. 29 (3), 576-580 (2014).
- Wilson, S. R., Burns, P. N. Microbubble-enhanced us in body imaging: What role. Radiology. 257 (1), 24-39 (2010).
- Hynynen, K., Mcdannold, N., Vykhodtseva, N., Jolesz, F. Noninvasive mr imaging-guided focal opening of the blood-brain barrier bbb in rabbits. Radiology. 220 (3), 640-646 (2001).
- He, W., et al. Enhanced ablation of high intensity focused ultrasound with microbubbles: An experimental study on rabbit hepatic vx2 tumors. Cardiovasc Intervent Radiol. 34 (5), 1050-1057 (2011).
- Lipsman, N., et al. Blood-brain barrier opening in alzheimer's disease using mr-guided focused ultrasound. Nat Commun. 9 (1), 2336 (2018).
- Burke, C. W., Klibanov, A. L., Sheehan, J. P., Price, R. J. Inhibition of glioma growth by microbubble activation in a subcutaneous model using low duty cycle ultrasound without significant heating. J Neurosurg. 114 (6), 1654-1661 (2011).
- Dimcevski, G., et al. A human clinical trial using ultrasound and microbubbles to enhance gemcitabine treatment of inoperable pancreatic cancer. J Control Release. 243, 172-181 (2016).
- Haram, M., Hansen, R., Bouget, D., Myhre, O. F., Davies, C. L., Hofsli, E. Treatment of liver metastases with focused ultrasound and microbubbles in patients with colorectal cancer receiving chemotherapy. Ultrasound Med Biol. 49 (9), 2081-2088 (2023).
- Mainprize, T., et al. Blood-brain barrier opening in primary brain tumors with non-invasive MR-guided focused ultrasound: A clinical safety and feasibility study. Sci Rep. 9 (1), 321 (2019).
- Karakatsani, M. E., et al. Focused ultrasound mitigates pathology and improves spatial memory in alzheimer's mice and patients. Theranostics. 13 (12), 4102-4120 (2023).
- Aron, M., Vince, O., Gray, M., Mannaris, C., Stride, E. Investigating the role of lipid transfer in microbubble-mediated drug delivery. Langmuir. 35 (40), 13205-13215 (2019).
- Wang, S., Samiotaki, G., Olumolade, O., Feshitan, J. A., Konofagou, E. E. Microbubble type and distribution dependence of focused ultrasound-induced blood-brain barrier opening. Ultrasound Med Biol. 40 (1), 130-137 (2014).
- Huynh, E., Rajora, M. A., Zheng, G. Multimodal micro, nano, and size conversion ultrasound agents for imaging and therapy. Wiley Interdiscip Rev Nanomed Nanobiotechnol. 8 (6), 796-813 (2016).
- Rajora, M. A., et al. Quantitative pharmacokinetics reveal impact of lipid composition on microbubble and nanoprogeny shell fate. Adv Sci. 11 (4), 2304453 (2024).
- Leong, K. X., Sharma, D., Czarnota, G. J. Focused ultrasound and ultrasound stimulated microbubbles in radiotherapy enhancement for cancer treatment. Technol Cancer Res Treat. 22, 1-9 (2023).
- Li, Y., et al. Ultrasound-triggered release of sinoporphyrin sodium from liposome-microbubble complexes and its enhanced sonodynamic toxicity in breast cancer. Nano Research. 11, 1038-1056 (2017).
- Nomikou, N., Fowley, C., Byrne, N. M., Mccaughan, B., Mchale, A. P., Callan, J. F. Microbubble-sonosensitiser conjugates as therapeutics in sonodynamic therapy. Chem Commun. 48 (67), 8332-8334 (2012).
- Chakravarty, R., Hong, H., Cai, W. Positron emission tomography image-guided drug delivery: Current status and future perspectives. Mol Pharm. 11 (11), 3777-3797 (2014).
- Delalande, A., Leduc, C., Midoux, P., Postema, M., Pichon, C. Efficient gene delivery by sonoporation is associated with microbubble entry into cells and the clathrin-dependent endocytosis pathway. Ultrasound Med Biol. 41 (7), 1913-1926 (2015).
- Sheikov, N., Mcdannold, N., Vykhodtseva, N., Jolesz, F., Hynynen, K. Cellular mechanisms of the blood-brain barrier opening induced by ultrasound in presence of microbubbles. Ultrasound Med Biol. 30 (7), 979-989 (2004).
- Conway, G. E., Paranjape, A. N., Chen, X., Villanueva, F. S. Development of an in vitro model to study mechanisms of ultrasound-targeted microbubble cavitation-mediated blood-brain barrier opening. Ultrasound Med Biol. 50 (3), 425-433 (2024).
- Hu, S., Zhang, X., Unger, M., Patties, I., Melzer, A., Landgraf, L. Focused ultrasound-induced cavitation sensitizes cancer cells to radiation therapy and hyperthermia. Cells. 9 (12), 2595 (2020).
- Zhao, C., et al. Synergistically augmenting cancer immunotherapy by physical manipulation of pyroptosis induction. Phenomics. , (2024).
- Tachibana, K., Uchida, T., Ogawa, K., Yamashita, N., Tamura, K. Induction of cell-membrane porosity by ultrasound. Lancet. 353 (9162), 1409 (1999).
- Arif, W. M., et al. Focused ultrasound for opening blood-brain barrier and drug delivery monitored with positron emission tomography. J Control Release. 324, 303-316 (2020).
- Da Ros, V., et al. PVA-microbubbles as a radioembolization platform: Formulation and the in vitro proof of concept. Pharmaceutics. 15 (1), 217 (2023).
- Tartis, M. S., et al. Dynamic micropet imaging of ultrasound contrast agents and lipid delivery. J Control Release. 131 (3), 160-166 (2008).
- Willmann, J. K., et al. Targeted microbubbles for imaging tumor angiogenesis: Assessment of whole-body biodistribution with dynamic micro-pet in mice. Radiology. 249 (1), 212-219 (2008).
- Ingram, N., et al. Ultrasound-triggered therapeutic microbubbles enhance the efficacy of cytotoxic drugs by increasing circulation and tumor drug accumulation and limiting bioavailability and toxicity in normal tissues. Theranostics. 10 (24), 10973-10992 (2020).
- Hernández-Gil, J., et al. Development of 68ga-labelled ultrasound microbubbles for whole-body pet imaging. Chem Sci. 10 (215), 5603-5615 (2019).
- Warram, J. M., et al. Biodistribution of p-selectin targeted microbubbles. J Drug Target. 22 (5), 387-394 (2014).
- Liu, T. W., Macdonald, T. D., Shi, J., Wilson, B. C., Zheng, G. Intrinsically copper-64-labeled organic nanoparticles as radiotracers. Angew Chem Int Ed Engl. 51 (52), 13128-13131 (2012).
- Rajora, M. A., et al. Tailored theranostic apolipoprotein e3 porphyrin-lipid nanoparticles target glioblastoma. Chem Sci. 8 (8), 5371-5384 (2017).
- Yoo, K., Dhaliwal, A., Chen, J., Sheeran, P. S., Zheng, G. Synthesis and characterization of multi-modal phase-change porphyrin droplets. J Vis Exp. 176, e62665 (2021).
- Lovell, J. F., et al. Porphysome nanovesicles generated by porphyrin bilayers for use as multimodal biophotonic contrast agents. Nat Mater. 10 (4), 324-332 (2011).
- Huynh, E., Jin, C. S., Wilson, B. C., Zheng, G. Aggregate enhanced trimodal porphyrin shell microbubbles for ultrasound, photoacoustic, and fluorescence imaging. Bioconjug Chem. 25 (4), 796-801 (2014).
- Mcmahon, D., Hynynen, K. Acute inflammatory response following increased blood-brain barrier permeability induced by focused ultrasound is dependent on microbubble dose. Theranostics. 7 (16), 3989-4000 (2017).
- Bismuth, M., Katz, S., Rosenblatt, H., Twito, M., Aronovich, R., Ilovitsh, T. Acoustically detonated microbubbles coupled with low frequency insonation: Multiparameter evaluation of low energy mechanical ablation. Bioconjug Chem. 33 (6), 1069-1079 (2022).
- Kutscher, H. L., et al. Threshold size for optimal passive pulmonary targeting and retention of rigid microparticles in rats. J Control Release. 143 (1), 31-37 (2010).
- You, Y., et al. Porphyrin-grafted lipid microbubbles for the enhanced efficacy of photodynamic therapy in prostate cancer through ultrasound-controlled in situ accumulation. Theranostics. 8 (6), 1665-1677 (2018).
- Chen, X., Qin, B., Whitehurst, D., Helfield, B., Lavery, L., Villanueva, F. S. Sonodynamic therapy using protoporphyrin ix encapsulated microbubbles inhibits tumor growth. 2017 IEEE International Ultrasonics Symposium. , 1-4 (2017).
- Cheng, M. H. Y., et al. Targeted theranostic 111in/lu-nanotexaphyrin for spect imaging and photodynamic therapy. Mol Pharm. 19 (6), 1803-1813 (2022).
- Cheng, M. H. Y., Cevallos, A., Rajora, M. A., Zheng, G. Fast, facile, base-free microwave-assisted metallation of bacteriochlorophylls and corresponding high yield synthesis of tookad. J Porphyrins Phthalocyanines. 25 (07n08), 703-713 (2021).
- Macdonald, T. D., Liu, T. W., Zheng, G. An MRI-sensitive, non-photobleachable porphysome photothermal agent. Angew Chem Int Ed Engl. 53 (27), 6956-6959 (2014).
- Shao, S., et al. Functionalization of cobalt porphyrin-phospholipid bilayers with his-tagged ligands and antigens. Nat Chem. 7 (5), 438-446 (2015).
- Teh, J. H., et al. A kit-based aluminium-[(18)f]fluoride approach to radiolabelled microbubbles. Chem Commun (Camb). 57 (88), 11677-11680 (2021).
- Rajora, M. A. . Supramolecular Structure-Enabled Delivery of Porphyrin to Glioblastomas Beyond the Blood-Brain Barrier [Doctor of Philosophy thesis]. , (2024).
- Carugo, D., et al. Modulation of the molecular arrangement in artificial and biological membranes by phospholipid-shelled microbubbles. Biomaterials. 113, 105-117 (2017).
- Dhaliwal, A. . Utilizing Porphyrin to Improve Ultrasound-Activated Supramolecular Agent Design for Solid Tumor Delivery [Doctor of Philosophy thesis]. , (2023).
- Kilroy, J. P., Klibanov, A. L., Wamhoff, B. R., Bowles, D. K., Hossack, J. A. Localized in vivo model drug delivery with intravascular ultrasound and microbubbles. Ultrasound Med Biol. 40 (10), 2458-2467 (2014).
- Dhaliwal, A., et al. Deep learning for automatic organ and tumor segmentation in nanomedicine pharmacokinetics. Theranostics. 14 (3), 973-987 (2024).
- Shakya, G., Cattaneo, M., Guerriero, G., Prasanna, A., Fiorini, S., Supponen, O. Ultrasound-responsive microbubbles and nanodroplets: A pathway to targeted drug delivery. Adv Drug Deliv Rev. 206, 115178 (2024).
- Honari, A., Merillat, D. A., Bellary, A., Ghaderi, M., Sirsi, S. R. Improving release of liposome-encapsulated drugs with focused ultrasound and vaporizable droplet-liposome nanoclusters. Pharmaceutics. 13 (5), 609 (2021).
- Barmin, R. A., et al. Polymeric materials for ultrasound imaging and therapy. Chem Sci. 14 (43), 11941-11954 (2023).
- Chen, Y., Liang, Y., Jiang, P., Li, F., Yu, B., Yan, F. Lipid/PLGA hybrid microbubbles as a versatile platform for noninvasive image-guided targeted drug delivery. ACS Appl Mater Interfaces. 11 (45), 41842-41852 (2019).
- Barmin, R. A., et al. Engineering the acoustic response and drug loading capacity of pbca-based polymeric microbubbles with surfactants. Mol Pharm. 19 (9), 3256-3266 (2022).
- Barrefelt, A. A., et al. Multimodality imaging using SPECT/CT and MRI and ligand functionalized 99mTc-labeled magnetic microbubbles. EJNMMI Res. 3 (1), 12 (2013).
- Song, R., Hu, D., Chung, H. Y., Sheng, Z., Yao, S. Lipid-polymer bilaminar oxygen nanobubbles for enhanced photodynamic therapy of cancer. ACS Appl Mater Interfaces. 10 (43), 36805-36813 (2018).
- Böhmer, M. R., Chlon, C. H. T., Raju, B. I., Chin, C. T., Shevchenko, T., Klibanov, A. L. Focused ultrasound and microbubbles for enhanced extravasation. J Control Release. 148 (1), 18-24 (2010).
- Zhang, S., et al. Compare ultrasound-mediated heating and cavitation between flowing polymer- and lipid-shelled microbubbles during focused ultrasound exposures. J Acoust Soc Am. 131 (6), 4845-4855 (2012).
- Cao, Y., et al. Drug release from phase-changeable nanodroplets triggered by low-intensity focused ultrasound. Theranostics. 8 (5), 1327-1339 (2018).
- Krasnovskaya, O. O., et al. Recent advances in (64)cu/(67)cu-based radiopharmaceuticals. Int J Mol Sci. 24 (11), 9154 (2023).
- Navarro-Becerra, J. A., Borden, M. A. Targeted microbubbles for drug, gene, and cell delivery in therapy and immunotherapy. Pharmaceutics. 15 (6), 1625 (2023).
- Fan, C. -. H., et al. Antiangiogenic-targeting drug-loaded microbubbles combined with focused ultrasound for glioma treatment. Biomaterials. 34 (8), 2142-2155 (2013).
- Luo, T., et al. Ultrasound-mediated destruction of oxygen and paclitaxel loaded dual-targeting microbubbles for intraperitoneal treatment of ovarian cancer xenografts. Cancer Lett. 391, 1-11 (2017).
- Fix, S. M., et al. Oxygen microbubbles improve radiotherapy tumor control in a rat fibrosarcoma model - a preliminary study. PLoS One. 13 (4), e0195667 (2018).
- Eisenbrey, J. R., et al. Sensitization of hypoxic tumors to radiation therapy using ultrasound-sensitive oxygen microbubbles. Int J Radiat Oncol Biol Phys. 101 (1), 88-96 (2018).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados