Method Article
蛍光および放射性トレーサーによるマイクロバブルの作製と標識
要約
このプロトコルでは、脂質マイクロバブルの作製と、マイクロバブルの物理化学的特性を保存する精製フリーの>95%のラベリング効率を備えた互換性のあるワンポットマイクロバブル放射性標識法の概要を説明します。この方法は、多様な脂質マイクロバブル製剤に有効であり、放射性および/または蛍光マイクロバブルを生成するように調整できます。
要約
マイクロバブルは、血管超音波造影剤から革新的ながん治療プラットフォームへと進化した、脂質シェルのガス充填粒子です。治療用焦点超音波(FUS)と組み合わせることで、生理学的障壁(血液脳関門など)を安全かつ局所的に克服し、他の方法ではアクセスできないがん(膠芽腫や膵臓がんなど)に薬物を送達し、神経変性疾患を治療することができます。マイクロバブルFUSの治療薬は、相乗的併用放射線療法、マルチモーダルイメージング、マイクロバブルシェルからのオールインワンの薬物ローディングと送達など、新たな方向に進んでいます。
放射性トレーサーによるマイクロバブルの標識は、これらの拡張されたセラノスティクス機能を確立するための鍵です。しかし、既存のマイクロバブル放射性標識戦略は、マイクロバブルの物理化学的特性を乱すことが知られている精製方法に依存しており、短寿命の放射性同位元素を使用し、常に安定したキレート化をもたらすとは限りません。全体として、これはマイクロバブル放射線画像の精度と腫瘍放射性同位元素送達の効率を取り巻く曖昧さを生み出します。
このプロトコルは、マイクロバブルの物理化学的特性を維持しながら、>95%の放射性同位元素キレート化効率を達成する、新しいワンポットの精製フリーマイクロバブルラベリング法を説明しています。汎用性が高く、アシル脂質鎖の長さ、電荷、およびキレート剤/プローブ(ポルフィリン、DTPA、DiI)組成が異なるカスタムおよび市販のマイクロバブル製剤にうまく適用できます。これは、ゼロからのマイクロバブル製造中や、蛍光およびマルチモーダル蛍光/放射性特性のモジュール式のカスタマイズ性を備えた既製のマイクロバブル製剤に適応的に適用できます。したがって、この柔軟な方法により、メカニズム、イメージング、および治療用マイクロバブルFUSアプリケーションの進歩に役立つ、カスタマイズされたトレーサブル(ラジオ、蛍光、またはラジオ/蛍光活性)マルチモーダルマイクロバブルの生成が可能になります。
概要
マイクロバブルは、タンパク質、ポリマー、またはほとんどの場合脂質シェルによって安定化されたガスコアを持つミクロンサイズの超分子セラノスティクス剤です(図1A)。血流に注入されると、マイクロバブルは、それらのガスコア1,2が溶解する前の数分間の時間枠で超音波によって検出可能なガス/液体界面を維持する。その結果、マイクロバブルの最初の臨床使用は、リアルタイム超音波画像造影剤3としてであった。治療用焦点付き超音波(FUS)の発明により、マイクロバブルの臨床ユーティリティが拡大しました。低周波FUSによって刺激されると、マイクロバブルは振動し、一過性の血管透過化から局所組織アブレーションまで、標的を絞った調整可能な機械的力を生成します4,5。その結果、過去20年間で、マイクロバブルFUSは、血液脳関門(BBB)の開門、腫瘍(膵臓がん、脳がん、肝臓転移がんなど)の薬物およびイメージングプローブの送達、神経変性疾患治療、およびがんアブレーションについて研究されてきました6,7,8,9,10,11。
マイクロバブルのセラノスティックな武器庫は、新しくエキサイティングな方向に進歩し続けています。従来のマイクロバブル-FUS送達アプリケーションは、市販のマイクロバブルと並行して治療用またはイメージングカーゴを同時投与することに依存していました。マイクロバブルシェル/生物学的相互作用を理解し、カスタムメイドの非商用マイクロバブル製剤を探索し、マイクロバブルシェル12,13,14に直接貨物をロードしたオールインワンセラノスティックマイクロバブルを生成することにより、マイクロバブルFUS送達能力を強化することへの関心が高まっている。実際、脂質マイクロバブル薬物送達研究の約40%は、このようなシェルロードマイクロバブルを利用しています15。イメージングと薬物送達を超えて、マイクロバブルFUSは、がん放射線療法16を強化し、ソノダイナミックセラピー17,18を通じて、他の点では良性のシェルロード剤の抗腫瘍効果を活性化することにも有望であることが示されています。
マイクロバブルがんアプリケーションにおけるこれらの従来型および拡張された方向性は、放射性トレーサーでマイクロバブルシェルを標識することにより、より戦略的に進めることができます。オールインワンのカーゴロードマイクロバブルの領域では、このような放射性標識は、1)これらのロードされたマイクロバブルシェルのオンターゲットおよびオフターゲットの生体分布のゴールドスタンダードの定量的評価を促進し、2)オンターゲット送達を最大化するためのマイクロバブル組成物の最適な選択を通知する薬物動態学的構造活性相関を導き出し、3)戦略的かつ適切な画像誘導アプリケーションおよび治療計画(例:組織ターゲットの種類、 線量測定、オフターゲットの安全性懸念を軽減するための薬剤選択、従来の協調治療パラダイムと比較した有用性)オールインワンカーゴロードシステム15,19。前臨床段階では、マイクロバブルシェルの運命をこのように理解することで、より広範なマイクロバブルFUSの作用機序を明らかにすることもできます。例えば、マイクロバブルシェルから標的細胞への脂質移動は、FUS対応ソノポレーションに影響を与えることが示されている12,20。したがって、このような移植を理解し最適化することで、ソノポレーションが関与する前臨床および臨床のマイクロバブルFUS療法(in vitroトランスフェクション、薬物送達、腫瘍アブレーション、放射線感作、およびソノダイナミックセラピー20,21,22,23,24,25).二重の超音波および放射線画像施設はまた、従来の二重の薬剤設計ではなく、単一の薬剤からのFUS血管開口および治療モニタリング(例えば、BBB開口速度論)を可能にするであろう26。同様に、脂質マイクロバブル放射性標識は、マイクロバブル-FUS +放射性医薬品の同時送達プラットフォーム27に代わるオールインワンの単一薬剤マイクロバブル-FUS/放射線療法として役立つ可能性がある。
マイクロバブルの脆弱性は、このようなラベリングにとって大きな課題です。既存のすべての放射性標識戦略は、マイクロバブルの安定性とサイズを乱すことが知られている精製方法によって制限されていますが、一部のものは効果がなく不安定な放射性標識28,29,30,31,32も備えています。精製要件は、より長いプロトコルにもつながります。短寿命放射性同位元素(例えば、18F t1/2 1.8 h,28,29 99mTct 1/2 6 h,3268Ga t1/2 1 h31)の使用と組み合わせると、放射性同位元素の崩壊に関連する非効率性が生じ、放射線画像と治療計画の時間枠が狭くなります。全体として、これらの制限は、短くて代表性の低い放射線画像の取得、不正確な薬物動態データ、および非効率的な腫瘍放射性同位元素送達のリスクがあります。
本稿では、ポルフィリンの強力で安定した金属キレート化能力を活用することで、これらの制限を克服しています。ポルフィリンは、高度に共役した平面環と、さまざまな金属を収容できる中央配位部位を持つ有機複素環式高分子です。これには、銅-64(t1/2 12.7時間)、陽電子放出断層撮影法(PET)を備えた放射性医薬品、およびγ計数の実現可能性33などの長寿命放射性同位元素が含まれる。脂質骨格に結合すると、ポルフィリンは、親の非標識粒子33,34の特性を維持しながら、速度、高いキレート化効率、および血清安定性で銅-64で容易に取り込むことができる。さらに、ポルフィリンは蛍光活性があり、ナノ粒子および微粒子のモジュール式自己消光により、粒子の破壊時に回復します。PETおよびγカウントを補完する読み出しにより、バルクおよび顕微鏡の両方のシェルフェイト分析が容易になります(図1A)15。
ポルフィリン脂質をキレート剤として使用することにより、これらの特性を利用して、既存のマイクロバブル放射性標識法に関連する制限を克服する、新しいワンポットの精製不要のマイクロバブル放射性標識法(図1B、C)を生成しました。このプロトコルは、>95%の銅-64キレート化効率を達成し、標識後の精製を必要とせず、マイクロバブルの物理化学的特性を維持します。これは、活性化する前に脂質マイクロバブルの「ゼロアップ」製造に容易に統合できます(図1B)。汎用性が高く、アシル脂質鎖の長さ(C16〜C22)、電荷(中性および陰イオン性)、およびポルフィリン-脂質組成物(1 mol%、10 mol%、30 mol%)が異なるカスタムおよび市販のマイクロバブル製剤にうまく適用でき、ラジオ活性と蛍光活性の両方を持つマイクロバブルを生成します。その適応性は、ポルフィリンを超えて拡張することもできます。ワンポットプロトコールは、市販の代替キレート剤(ジエチレントリアミンペンタアセテート(DTPA)-脂質など)および蛍光色素(DiIなど)を使用するように変更することができます。また、「スパイキング」アプローチにより、既製のマイクロバブル製剤を標識するように変更することもできます。したがって、この方法により、機構、イメージング、および治療用マイクロバブルFUSアプリケーションの進歩に役立つ、カスタマイズされたトレーサブル(ラジオ、蛍光、またはデュアルラジオ/蛍光アクティブ)マイクロバブルの製造が可能になります。以下のプロトコルでは、脂質マイクロバブルの作製、ワンポット放射性標識プロトコルの適用、必要な放射性標識と物理化学的特性の特性評価、および潜在的な修飾について概説しています。
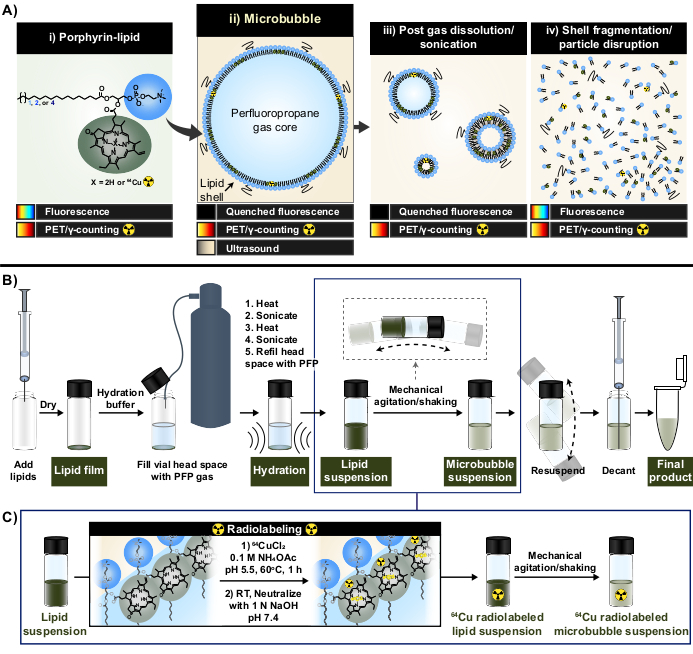
図1:マイクロバブル製造および放射性標識プロトコル (A)ポルフィリン脂質は、ピロフェオフォルビド-a-脂質の形で、このプロトコル内でマルチモーダルキレート剤として機能します。銅-64(i)にキレート化されたモノマーとして、PETおよびイメージング機能を備えています。その蛍光は粒子の形で消光され(マイクロバブル(ii)および溶解後のナノ子孫(iii))、粒子破壊(iv)で消光されません。(B)このレポートに記載されている脂質膜の水和/活性化プロトコルにより、脂質マイクロバブルをゼロから生成し、(C)脂質懸濁液形成とマイクロバブル活性化との間のワンポット放射性標識の統合。この図は、Rajora et al.15の許可を得て改作されました。 この図の拡大版を表示するには、ここをクリックしてください。
プロトコル
1. 試薬の調製
- 酢酸アンモニウム緩衝液(0.1 M、pH 5.5)を調製
- 分析天びんを使用して、770.8 mgの酢酸アンモニウムを計量紙に秤量します。秤量した量を清潔な250mLガラスビーカーに移します。
- 目盛り付きピペットで測定した90mLの二重蒸留水(ddH2O)をビーカーに加えます。攪拌子を追加し、ビーカーを磁気攪拌板に置き、酢酸アンモニウムを溶解します。わずかな渦が発生する速度で攪拌しますが、溶液が飛散することはありません。
- pH 4 および 7 の標準試料を使用して、装置の指示に従って pH メーターを校正します。キャリブレーションが完了したら、pHプローブを酢酸アンモニウムバッファーに挿入します。
- 溶液に酢酸104μLを加え、撹拌して溶解させ、pHを測定します。
注:この時点で、pHは5.5に近くする必要があります。 - マイクロピペットを使用して、10 Nの水酸化ナトリウム(または緩衝液が塩基性になりすぎる場合は塩酸)を5〜10 μL刻みで加えて、緩衝液のpHを調整します。攪拌し、pHを測定し、必要に応じて繰り返します。添加された塩基/酸の量をメモします。
- 十分な量のddH2Oを添加して、合計100 mLのバッファーを作成します。
注:例えば、pH調整中に45 μLの10 N水酸化ナトリウムを使用した場合、9.851 mLのddH2Oがビーカーに添加されます(100 mL [目標容量]-90 mL [ステップ1.1.2] - 0.104 mL [ステップ1.1.4] - 0.045 mL [ステップ1.1.5] = 9.851 mL)。 - バッファを蓋付きの保存容器に移す前に、最後にもう一度完全に攪拌します。
- 機器の指示に従ってpHメーターを清掃します。
注意: 濃水酸化ナトリウム水溶液と塩酸は皮膚反応を引き起こす可能性があるため、手袋を使用して取り扱う必要があります。
- ハイドレーションバッファー(PGG)の準備
- リン酸緩衝生理食塩水(PBS)をシリンジに吸引し、端部にポリエーテルスルホン0.2μmの細孔サイズシリンジフィルターを装備します。PBSをきれいなプラスチック製の蓋付き遠心分離管にろ過します。
注:代替メンブレン材料(ポリフッ化ビニリデンなど)の0.2μmポアシリンジフィルターは、メンブレンがPBSおよび酢酸アンモニウムと互換性がある限り使用できます。 - ろ過したPBS、プロピレングリコール、およびグリセロールをマイクロピペットで8:1:1の容量比で組み合わせて、水和バッファー(PGGとも呼ばれる)を作製します。プロピレングリコールとグリセロールを添加する場合は、ピペットチップの表面に残っているプロピレングリコールまたはグリセロールの液滴を吸引して拭き取ってから、試薬をゆっくりとPBSにピペッティングします。PBSには、明確なひも状の粘性濁りが見られます。
注:p1000マイクロピペットを使用して、最初にPBSを遠心チューブに加え、次にプロピレングリコールとグリセロールを追加することをお勧めします。そのため、ピペットチップに液体の動きが見えなくなり、ピペットチップを試薬から取り出すときに空気が取り込まれなくなるまで、マイクロピペットでゆっくりと吸引する必要があります。容量マーキングのあるマイクロピペットチップは、理想的には、そのようなマーキングと一致する試薬容量を選択するために使用する必要があります(たとえば、1 mLまたは5 mLのPGGを作成し、マイクロピペットチップの0.1 mLまたは0.5 mLのマーキングをそれぞれ使用して、プロピレングリコールとグリセロールの完全な吸引を視覚化します)。マイクロピペットの先端の表面を拭くときは、先端の開口部を拭かず、側面のみを拭いてください。 - 試薬が均一に溶解するまで、ピペットチップを溶液に入れたままピペットを上下に動かします。溶液に気泡が入らないように注意してください。
- 水和バッファーの完全な混合物をさらに確保するには、遠心分離チューブをキャップし、ゆっくりと上下に回転させます。渦巻きにしないでください。
- チューブを1000 x g 未満で20〜30秒間回転させ(最低温度4°C、最大RT)、観察できない気泡を取り除きます。
- リン酸緩衝生理食塩水(PBS)をシリンジに吸引し、端部にポリエーテルスルホン0.2μmの細孔サイズシリンジフィルターを装備します。PBSをきれいなプラスチック製の蓋付き遠心分離管にろ過します。
- 水和/放射性標識バッファー(AA-PGG)を調製します。
- シリンジフィルター0.1 M、pH 5.5酢酸アンモニウム緩衝液(ステップ1.1から)、およびPBSをステップ1.2.1に従って別々のチューブに入れます。
- ろ過された酢酸アンモニウム緩衝液、ろ過されたPBS、プロピレングリコール、およびグリセロールをp1000マイクロピペットを介して5:3:1:1の酢酸アンモニウム緩衝液(PBS:プロピレングリコール:グリセロール容積比)の遠心分離管に組み合わせます。手順1.2.2〜1.2.5に従って、吸引、混合、および遠心分離の手順に従ってAA-PGGを作成します。
- インスタント薄層クロマトグラフィー(iTLC)溶離液
- 最大0.1gのエチレンジアミン四酢酸(EDTA)を秤量し、キャップ付きバイアルに移します。2% w/vのEDTA溶液が作れるようにddH2Oに溶解します(例えば、50 mgのEDTAに対して、2.5 mLのddH2Oを添加します)。
- 2% w/v EDTA溶液とステップ1.1の酢酸アンモニウム緩衝液を9:1 v/v比(90% EDTA溶液、10%酢酸アンモニウム緩衝液)で組み合わせます。得られたiTLC溶離液をキャップして保存します。
2. 脂質膜の形成
注:この手順では、市販のマイクロバブルDefinity®を模倣した組成物で脂質膜の形成を概説し、ポルフィリン-脂質が宿主脂質を置換し、全脂質の30 mol%を構成する。しかし、放射性標識プロトコルは、多様な脂質製剤(C16、C18、C22鎖長、中性または陰イオン電荷、さまざまなポルフィリン-脂質モル組成)に適用することができます。補足スプレッドシート(補足ファイル1)が添付されており、記載されている配合およびその他の配合の計算、組成、質量、およびストック体積を提供します。すべての脂質は、ポルフィリン-脂質、ピロフェオフォルビド-a-脂質(pyro-lipid)を除いて市販されており、その合成は以前に詳細に記載されている35,36。
- 補足ファイル1を使用して、必要なフィルム数に基づいて各脂質に必要な総質量を決定します。
- 空の0.5ドラムガラスバイアルを分析天びんに載せて計量します。
注:ほこりは、マイクロバブルの形成の成功を妨げます。したがって、キャップなしで保管されている場合は、バイアルに加圧空気を吹き込んで、ほこり/微粒子を取り除きます。 - 1,2-ジパルミトイル-sn-グリセロ-3-ホスホコリン(DPPC)を計量紙に秤量します。
注:秤量した質量は、ステップ2.1から取得し、さらに0.5〜1 mgを追加して、後のステップでサンプル処理中の損失を考慮する必要があります。 - DPPCを秤量したガラスバイアルに移し、再秤量してバイアル中の脂質質量を決定します。このプロセスにより、ガラスバイアルへの脂質の転写が容易になり、脂質粉末の損失/こぼれが減少し、脂質質量のより正確な測定が可能になります。
- 他の脂質(1,2-ジパルミトイル-sn-グリセロ-3-ホスホエタノールアミン-N-[メトキシ(ポリエチレングリコール)-5000](DPPE-mPEG)、1,2-ジパルミトイル-sn-グリセロ-3-リン酸(DPPA)、およびC16ピロ脂質)について、ステップ2.2から2.4を繰り返します。
注:パイロ脂質が秤量可能な粉末の形で利用できず、むしろ未知の量のフィルムまたはアリコートとして利用できない場合、それをクロロホルムに溶解して、その濃度を前に説明したランベルトベールの法則を使用してメタノール中のUV-Vis吸光度測定を通じて計算できるストックを形成することができる35。 - マイクロピペットまたはガラスシリンジを使用して、ガラス試験管に次の有機溶媒と溶液を調製します:1)クロロホルム、2)9:1 v / vクロロホルム:メタノール、および3)65:35:8クロロホルム:メタノール:ddH2O。最後に、成分をピペットで動かし、ddH2O、メタノール、クロロホルムの順に混合します。
注意:メタノールとクロロホルムは健康に害を及ぼし、可燃性で揮発性です。目の保護具、手袋、白衣を着用し、ドラフトを使用してください。 - 補足ファイル1を使用して、脂質ストックの作製に必要な有機溶媒/溶液の量を計算し、適切な容量のガラスシリンジを選択します。
注:この容量は、25〜100μLのガラスマイクロリットルシリンジを使用して容易に測定できるフィルムあたり15〜100μLのストックアリコート容量に対応するストック濃度をもたらすはずです。 - ガラスシリンジをクロロホルムで3回すすぎます。プランジャーを前後にポンプで動かして、シリンジを乾燥させます。
- ステップ2.7のスプレッドシート計算に従って、洗浄したガラスシリンジを介して有機溶媒/溶液を測定し、個々の脂質バイアルに追加して脂質ストックを形成します。パイロ脂質をクロロホルムに溶解し(ステップ2.5の注に従ってすでに溶解している場合を除く)、DPPCおよびDPPE-mPEGを9:1 v / vクロロホルムに溶解します:メタノールおよびDPPAを65:35:8クロロホルム:メタノール:ddH2Oに溶解します。すべての添加に同じガラスシリンジを使用する場合は、各脂質の間をすすぎ、乾燥させます。.
注:選択した製剤にDPPAまたはそのC18鎖長バリアントが含まれていない場合、パイロ脂質、ホストPC脂質、およびPEG脂質はすべてクロロホルムに溶解できます。 - バイアルとボルテックスにキャップをします。
- 計算した量のストック脂質溶液を、ガラスマイクロリットルシリンジを介して新しい0.5ドラムガラスバイアル(フィルムバイアル)に加えます。最初の脂質ストックの場合、針先をバイアルの下部中央に挿入し、バイアルの壁が飛び散らないようにゆっくりと突っ込みます。その後の追加では、針先を液面の真上に置き、バイアルの側面に触れて、針を下の液体にさらさないように最終的な滴を取り除きます。.
注:汚染が発生した場合は、脂質添加物の間にガラスシリンジをすすぎ、乾燥させてください。複数のフィルムを作成する場合は、溶媒の蒸発を最小限に抑えるために、フィルムとストックバイアルの両方を添加物の間にキャップします。 - バイアルを手動で直立させて静かに回転させ、内容物を混合します。バイアルの壁に溶液をはねかけないでください。
- キャップを外し(キャップを保管)、バイアルのヘッドスペースに窒素ラインを挿入します。窒素の流れを調整して、液体表面にわずかな目に見える乱れを引き起こしますが、漏斗や飛沫はありません。
- 窒素ラインを挿入した直後にバイアルをボルテックスします。バイアルの底から1 cm以下のところに溶媒が上昇した漏斗を形成するのに十分な低速から開始します。溶剤の飛散を避けてください。溶媒が蒸発するにつれて、渦速度をゆっくりと一時停止せずに上げ、すべての液体が蒸発するまで溶媒の高さを維持します。その結果、バイアルの下3分の1全体に薄膜がコーティングされます。
- バイアルを真空装備のデシケーターに入れ、フィルムを真空下で8〜72時間乾燥させます。バイアル(開口部を除く)またはデシケーターをアルミホイルで覆います。
注:プロトコルはここで一時停止できます。次のステップは、フィルムの乾燥後に行うか、フィルムをアルゴンの下に保管し、パラフィルムで密封し、-20°Cの冷凍庫で最大1か月間、乾燥させておくとさらに長く保管することができます。
3.脂質フィルムの水分補給
注:マイクロバブルを in vitro または in vivoで使用する場合は、特に指定がない限り、ステップ3.3から5.4には滅菌済みのマイクロピペットチップ、チューブ、シリンジ、および針を使用してください。
- フィルムを真空から取り外すか、冷凍庫で保管されている場合は、RTまで温めます。
- 250mLのビーカーに水を入れ、水を70〜80°Cに加熱します。
- ウォーターバスソニケーターを69°Cに加熱します。
- マイクロピペットで1mLのAA-PGG(ステップ1.3)を脂質フィルムバイアルの端に下ろし、気泡の発生を防ぎます。
注:非キレート化コントロールまたは蛍光のみのマイクロバブルを作製する場合は、AA-PGGの代わりにPGG(ステップ1.2)を使用してください。 - バイアルの開口部をキャップで部分的に覆い、パーフルオロプロパン(PFP)ラインを挿入するのに十分なスペースを残します。PFPをバイアルのヘッドスペースに液体の20秒間流し込み、液体が目に見えて乱れるが飛散しないようにします。PFPを直接懸濁液に流さないでください。バイアルにキャップをします。
注意: 流れの強度と時間が適切である場合、バイアルは触ると冷え始めます。 - バイアルの下半分を70〜80°Cのウォーターバスに1分間浸します。次に、69°Cのバスソニケーターで少なくとも30秒間、または脂質膜がAA-PGGに均一に分散するまで超音波処理します。気泡の発生やマイクロバブルの形成を早期に活性化することは避けてください(早期の活性化は、脂質懸濁液の乳白色/曇った領域として現れます)。必要に応じてバイアルの表面を拭いて、懸濁していない脂質が残っているかどうかをよりよく識別します。.
注:超音波処理後1分以内に脂質膜が水和しない場合は、70〜80°Cの浴で再加熱し、再度超音波処理してください。 - 脂質フィルムが均一に懸濁されたら、最後にもう一度1分間加熱し、さらに30秒間超音波処理します。
- バイアルを拭き取り、受動的にRTまで冷まします(~5〜10分)。
- ステップ3.5に従ってバイアルのヘッドスペースにPFPを補充し、キャップの端をパラフィルムで密封します。
注:プロトコルはここで一時停止し、8時間以内に再開できます。
4.放射性ラベリング
注:非キレート化コントロールまたは蛍光のみのマイクロバブルについては、プロトコルセクション5にスキップしてください。
注意:特に指定がない限り、このプロトコルの手順4.4〜4.6を放射線実験室で実行してください。 64名CuCl2 は放射線学的危険性であり、皮膚への曝露、吸入、または摂取による多系統毒性のリスクがあります。可能な限り、先端がゴム製の鉗子を使用して間接的にヒュームフードで取り扱ってください。取り扱いの際は、保護用の白衣、個人用のリングとバッジの線量計、ダブルグローブを着用してください。 64CuCl2 が2インチのリードシールド全体で処理されていることを確認します。必要に応じて、鉛で覆われた容器に入れて輸送してください。廃棄物容器をふるい、使用後の汚染状況について運用調査を実施します。
- ガラスビーカーまたは磁気攪拌棒を含む大きな結晶化皿に60°Cの水浴を準備します。サーマルプローブを水に挿入した温度制御されたホット/スタープレートを使用し、弱いが目に見える漏斗を生成する速度で攪拌するように設定します。
- 0.1 N HCl中に 64CuCl2 を含む密封されたバイアルを、ゴム先端鉗子を介して用量キャリブレーターに移します。
注: 64CuCl2を注文する場合は、5-20 μLの0.1 N HClに溶解するようにリクエストしてください。マイクロバブルの収率を維持するためには、少量が重要です。 - 線量キャリブレーターで測定された銅-64活性と時間に注意してください。鉗子を使用してバイアルを取り出し、リード付き容器に入れます。
- 64 CuCl2について報告された容量で記録された活性を除算して、MBq·mL-1値を求めます。
- ステップ3.9の脂質懸濁液のキャップを外し、バイアルホルダーに固定します。
- 64CuCl2バイアルのキャップを外し、鉗子で固定します。
- マイクロピペットは、40〜250MBqの活性に対応する64CuCl2溶液の容量を脂質懸濁液に移します。ピペットチップが懸濁液に沈んでいることを確認してください。プランジしてからピペットで上下に動かして、64CuCl2を完全に移します。
注:添加される 64CuCl2 の量は、放射性標識マイクロバブルの意図されたアプリケーションおよび線量キャリブレータの感度に依存する。マウスの縦方向(注射後最大48時間)のPETおよび in vivo での採血には、それぞれ最低220MBqおよび50MBqが推奨されます。 - 脂質懸濁液と 64CuCl2 バイアルの両方をキャップします。
- 平らなゴム先端の鉗子を使用して、放射性脂質懸濁液を手動で少なくとも5回上下に回転させ、懸濁液を介して 64CuCl2 を穏やかに混合します。バイアルを振ったり落としたりしたり、気泡が発生しないようにしてください。
- 右側を上にしたら、懸濁液を安定させたまま、バイアルのキャップをそっとフリックします。これにより、キャップに閉じ込められた液体がバイアルの底に引き寄せられます。バイアルのキャップを慎重に部分的に外し、18 Gの針付きPFPラインを挿入します。ステップ3.5に従って、バイアルのヘッドスペースにPFPを20秒間充填します。バイアルにキャップをし、パラフィルムで密封します。
- 用量キャリブレーターでバイアルの活性を測定し、時間をメモします。
注:十分な活性がバイアルに移らなかった場合は、ステップ4.5〜4.11を繰り返し、 64CuCl2の適切な追加容量を追加します。 - バイアルをフォームバイアルホルダーに入れ、バイアルの下半分が熱にさらされるように押し込みます。ホルダーを攪拌する60°Cのウォーターバスに入れ、1時間加熱します。
- キレート化反応が進行している間に、iTLCプレートを調製します。新しい手袋を着用しながら、ガラス製のマイクロファイバークロマトグラフィー紙を1 cm x 8 cmのストリップにカットします。ストリップを80°Cのガラス乾燥オーブンで加熱します。
注:この手順は、非放射性実験室で実行できます。 - 1時間後、ステップ4.12のバイアルを火から下ろし、ティッシュで端を拭きます。
- バイアルをゴム先端の鉗子で手動で上下に回転させ、バイアル壁の結露を脂質懸濁液に再凝縮させます。
- バイアルを直立させた状態で、チューブを安定させながらキャップをはじきます。パラフィルムをはがし、キャップの周りを拭いて、溜まったお風呂の水を取り除きます。
- バイアルを慎重に外し、脂質懸濁液を1〜2μL吸引します。懸濁液をiTLCストリップの下部中央から1 cmの位置に置き、バイアルを再度キャップします。スポットを乾かします。
注:理想的には、反応混合物ごとに最低2つのiTLCを見つけ、放射性標識脂質懸濁液ごとに確実に開発する必要があります。 - マイクロピペットで、iTLC溶離液200μL(ステップ1.4で調製)を10 mL試験管の底に注入します。試験管を鉛容器に収納します。斑点のあるiTLCをチューブに加え、溶離液がストリップの上端から約1 cmになるまでストリップが発達するのを待ちます。
- 開発されたiTLCストリップを鉗子を使用して取り外します。ストリップを垂直に持ち、γカウンターおよびプッシュキャップ対応の丸型5 mLプラスチックチューブで3分の1にカットし、各ストリップの3分の1が個々の3分の1に直接収まるようにします。プッシュキャップを3本のチューブに挿入します。
- γカウンターでストリップ含有チューブと空/キャップ付きコントロールチューブを測定し、銅-64活性を測定し、関連する1分あたりのカウント数(cpm)を記録します。他の読み取り値からコントロールチューブのアクティビティを差し引いて、バックグラウンドアクティビティを修正します。
注:ストリップの下3分の1(ピース1)の補正された測定値は、脂質懸濁粒子にキレート化された銅-64に関連付けられています。中央のセクション(ピース2)には、非超分子の形で遊離銅-64および 64のCu-パイロ脂質キレートの筋が含まれています。上部(ピース3)には、主に遊離銅-64が含まれています。 - 式1で放射性化学純度を計算します。
 (式1)
(式1)
注:ピース1のcpmが不当に低いと思われる場合(たとえば、ピース2または3よりも低い、または同等)、または読み取り値がγカウンター非線形/飽和しきい値を超えている場合は、iTLCの放射性標識懸濁液の低容量または希釈アリコート(1〜2μL)を見つけてください。 - 脂質懸濁液あたりの両方の iTLC ストリップから得られる放射性化学的純度が 94% ≥であることを確認してください。そうでない場合は、脂質懸濁液を60°Cで加熱し続け、iTLCを介して30分間隔でキレート化をモニターします。
- 放射性標識脂質懸濁液バイアルとマイクロピペット8.89μLの1 N NaOHを懸濁液にキャップを外し、ピペッティングで上下させて塩基を完全に移し、懸濁液を中和します。バイアルにキャップをし、鉗子で手動で回転させて反転/元に戻してから、バイアルキャップを軽くたたきます。
- ステップ4.10に従ってヘッドスペースをPFPで満たし、パラフィルムでキャップしてシールします。
5. マイクロバブルの活性化と分離
- 機械式バイアルシェーカーを介して脂質懸濁液を4530rpmで45秒間活性化し、乳白色のマイクロバブル懸濁液を生成します。バイアルを受動的にRTまで約10分間冷却します。結果として生じる乳白色の懸濁液は、時間の経過とともに2つの層に分離します。
注意: バイアルの内容物は、活性化後に乳白色に見えるはずです。アクティベーション後の一時停止がより明確になることは、アクティベーションの失敗を示しており、その貢献者については後のセクションで説明します。 - RTになったら、バイアルを静かに反転/戻し、マイクロバブル懸濁液を再懸濁します。バイアルを平らな面にセットし、デカンテーションする前に2分間待ってから、次のように目的のマイクロバブル集団を取得します。
- 1mLのプラスチックシリンジに18Gの針を装備し、空気を吸引して注入してシリンジ/針を排出します。2分経過したら、バイアルのキャップを素早く外し、パラフィルムのシールを一気に破ります。
- バイアルの底部(ターゲットマイクロバブル集団)から400〜550μLを引き出し、より大きな望ましくないマイクロバブル集団の上部の泡状層が吸引されないようにします。
注意: 必要に応じて、バイアルを片側に傾けて端部ボリュームをシリンジに集め、泡沫状/軽い層が吸引されないようにします。
- 針の端を慎重に拭いて泡状の汚染物質を取り除き、分離されたマイクロバブル懸濁液をマイクロ遠心チューブに移します。キャップをそっと閉めます(キャップを急に開けたり閉じたりしないでください)。これは、放射性標識マイクロバブルの最終的な作動懸濁液です。
- 線量キャリブレーターで最終マイクロバブル製品の活性を測定し、時間を記録します。この値をステップ 5.2 でデカントした懸濁液の量で割ると、MBq·mL-1 値が得られ、目的のアプリケーションに応じて注入量が計算されます。
注:放射性標識されたマイクロバブルを使用する準備が整いました。セクション 6 は、最大 24 時間後まで実行できます。これらの放射性標識マイクロバブルをマルチモーダル(超音波、PET、蛍光)イメージングを通じてin vivoで注入および追跡する方法については、Rajora et al.15を参照してください。
6. 放射性標識の効率の検証
- マイクロバブル懸濁液を穏やかなピペッティングまたはバイアル反転により再懸濁します。
注:マイクロバブルの作業製品を渦巻きにしないでください。ボルテックスはマイクロバブル懸濁液を不安定にします。 - 放射性標識懸濁液10-200 μLを0.5 mL 30,000 Molecular Weight Cut-Off(MWCO)遠心分離フィルターユニットに加えます。容量<200μLを使用する場合は、フィルターユニットにddH2Oを追加して、合計200μLの容量を構成します。フィルターユニットは、互換性のあるマイクロ遠心チューブとキャップに収納します。
注:放射性標識マイクロバブルの in vitro または in vivo での使用に適用される前に、およびそれとは別に放射性標識試験を実施することは、プロトコルを正常に完了するために推奨されます。この場合、このステップでは、より大きな容量(例えば、200μL)を使用することができます。その後、プロトコールを治療セッションに使用する場合は、まず治療量/注射液を準備し、次に残りの放射性標識マイクロバブル懸濁液でセクション6をできるだけ早く実施します。 - RTで12,000 x g で10分間遠心分離します。
注:微量遠心分離機は鉛シールドで囲む必要があります。 - 微量遠心チューブとそのキャップの間の接続をはさみで切断します。
- 「キャップ」とラベル付けされた20mLシンチレーションバイアルにキャップを入れます。フィルターユニットを新しい微量遠心チューブ(チューブ2)に移します。
- 1本目の微量遠心チューブに尿中液を入れ、「チューブ1」とラベル付けした20 mLシンチレーションバイアルに入れます。200 μL ddH2Oをチューブ2のフィルターユニットに加えます。
- チューブ2のフィルターユニットをRTで12,000 x g で遠心分離します。
- 手順 6.4 と 6.5 を繰り返します。チューブ1キャップを挟んだ「キャップ」シンチレーションバイアルにチューブ2キャップを追加します。チューブ2を新しい20 mLシンチレーションバイアルに入れます。
- 3本目の微量遠心チューブのキャップをカットし、ステップ6.4に従って「キャップ」バイアルに入れます。フィルターユニットを「ユニット」とラベル付けされた新しい20 mLシンチレーションバイアルに移し、低清がチューブ3に残り、「ユニット」バイアルに移されないことを確認します。フィルターユニットの端に液滴が見られる場合は、フィルターユニットをチューブ3に戻し、キャップをして、10秒間回転させます。チューブ3を新しい20 mLガラスシンチレーションバイアルに入れます。
- 5つのシンチレーションバイアル(チューブ1、チューブ2、チューブ3、キャップ、ユニット)にキャップをします。ブランクコントロールとして、空で蓋付きの20 mLシンチレーションバイアルを1つ調製します。
- 6つのシンチレーションバイアルをγカウンターで銅-64活性を測定します。ブランクバイアルの活性を他のバイアルの活性から差し引きます。式2を使用して放射性標識/キレート化効率を計算します。
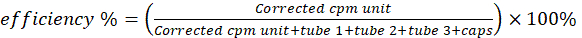 (式2)
(式2)
注:ユニットのcpmが不当に低い場合(例:チューブと同等)、または読み取り値がγカウンター非線形/飽和しきい値を超えている場合は、シンチレーションバイアルを最大4日間鉛容器に保管して、値がしきい値を下回るまで活性が減衰し、再測定します。
7. マイクロバブル物理化学的特性評価
注:ラボが放射性サンプル処理用の指定された機器を持っていない限り、マイクロバブルの物理化学的特性評価は、非放射性の「冷たい」銅キレートサンプルを使用して実施する必要があります。この「コールド」ラベリングは、意図したアプリケーションに使用されるマイクロバブルの投与量を評価するために不可欠なマイクロバブルの収量の評価を容易にします。さらに、制御された非キレート化マイクロバブルとの比較が可能になり、放射性標識プロセスがマイクロバブルの特性を乱さないようにすることができます。この「コールド」ラベリングと関連する物理化学的特性評価は、放射性標識マイクロバブルの適用前に行うべきであり、放射性標識の変更が必要な場合にフィードバックとして使用できます(ディスカッションを参照)。
- 「コールド」銅マイクロバブルラベリング
- ステップ4.7で脂質懸濁液に添加した 64CuCl2 溶液の容量、脂質膜内のポルフィリンモル%組成、 および64CuCl2 製品シートに記載されている比活性を使用して、放射性標識中に達成されるおおよその金属:ポルフィリンモル比を計算します。計算例は、補足ファイル 1 にあります。
- 現在のプロトコルのセクション 1 から 3 に従います。
- 0.1 N HCl中に0.1 mg·mL-1 CuCl2 溶液を調製します。
- ステップ7.1.1から計算した脂質懸濁液にこのCuCl2 溶液の適切な量をマイクロピペットで注入し、バイアルにキャップをします。
- バイアルを回転させてCuCl2 を脂質懸濁液に混合し、ステップ4.9、4.10、および4.12に従ってヘッドスペースをPFPで満たし、シールし、加熱します。バイアルの取り扱いにはゴム製の鉗子は必要ありません。
- 1時間後、バイアルを火から下ろし、外側を拭いて乾かします。バイアルをRTまで冷まします。
- 脂質懸濁液を中和し、混合し、ヘッドスペースにPFPを充填し、ステップ4.23および4.24に従ってシールします。
- マイクロバブル懸濁液とデカントを活性化して、ステップ5.1〜5.3に従って動作する製品を取得します。
- マイクロバブルサイジング
注:マイクロバブルのサイジングは、アクティベーション後すぐに実施する必要があります。作業懸濁液の安定性を評価する場合は、サンプル調製と測定を30分間隔で繰り返します。通常、1〜2時間のウィンドウは、活性化後にマイクロバブル作動懸濁液が使用/投与される時間枠を表しています。安定性測定の目的は、この時間枠全体でマイクロバブルのサイズと収率が維持され、作業溶液から投与されるすべての処理に同様のマイクロバブル集団が含まれるようにすることです。- コールターカウンター(CC)をオンにし、 Edit SOP ツールを使用して次のパラメータを設定します:30 μmアパーチャ、0.6-18 μmサイズ範囲、アパーチャ電流400-600 μA、プリアンプゲイン4-8、400ビン、各実行の前後のフラッシュ、容量分析、5 μLサンプル量。
- 0.2 μmの媒体真空ろ過ユニットを通じてCC電解質をろ過します。電解質容器とサンプル調製用の別の容器を満たします。
- バックグラウンド測定:10 mLの使い捨てキュベットに10 mLのろ過済み電解質を充填し、ベースライン測定を実行します。カウントが 400 未満であることを確認します。そうでない場合は、機器をフラッシュします。
- サンプル測定
- 10 mLのろ過済み電解質を新しいキュベットに加えます。マイクロバブルサスペンションを手動で反転/元に戻すことにより、再一時停止します。バイアルの下部中央から5μLのマイクロピペット。ピペットチップの端(開口部を除く)を拭き、サンプルを準備した電解質に直接突っ込みます。
- ピペットを上下に動かして、懸濁液を完全に移します。ピペットチップを使用して、マイクロバブル懸濁液の「小片」が分散するまで電解質を静かに渦巻かせます。
- CCでサンプルを測定します(分析物ごとに2回の実行)。
注:5μLのマイクロバブルサンプル容量は、通常、1-5 x 109 マイクロバブル・mL-1 濃度を含むサンプルに適しています。このサンプル量は、特定の CC 装置のセットアップや、サンプルのマイクロバブル収量が上記の範囲外にあるかどうかに応じて、調整が必要な場合があります。
- 共焦点イメージング
注:マイクロバブルサイジングの直後、ステップ7.2の注記に従って、マイクロバブルの安定性が保持される時間枠内で共焦点イメージングを実施します。- マイクロバブル懸濁液を再懸濁し、1〜5μLをスライドガラス顕微鏡の中心に移します。マイクロバブル懸濁液滴の上にカバースリップを慎重に置き、気泡が閉じ込められないようにします。サスペンションはカバースリップの下に広がります。
- 油浸対物レンズを使用して、マイクロバブルを60倍の倍率で画像化します。明視野および633nm励起/ 640-765nmの発光下で画像を取得します。明視野画像と蛍光画像を重ね合わせます。
注:プローブがマイクロバブルシェル内に均一に組み込まれている場合、蛍光シグナルは目に見えるすべての粒子のシェルを横切って重なる必要があります。
- スペクトロフルオロメトリー
注:分光蛍光測定測定は、マイクロバブルの活性化から24時間以内に行うことができます。- 前述のように1%Triton X-100を調製します35。
- 最初の測定の15〜30分前に分光蛍光光度計の電源を入れます。
- 1% Triton X-100の蛍光スペクトルを、石英キュベット内の410 nm励起および600-800 nmの発光範囲を使用して測定します。リファレンス検出器信号 (S1/R1 と呼ばれることが多い) で信号を正規化するオプションを選択します。
注:Triton X-100はピペットで移動すると簡単に泡立ちます。そのため、キュベットに移すときは、最初のマイクロピペットストップにのみ突入してください。 - キュベットをメタノールですすぎ、サンプルの間に加圧空気を入れて乾燥させます。
- 1% Triton X-100 6 mLを15 mL遠心チューブに移します。マイクロバブル懸濁液を再懸濁し、マイクロピペットで1μLを吸引します。ピペットチップの開口部以外の端を拭き、準備した1% Triton X-100にサンプルを移し、ピペッティングで上下に動かして移し替えを完了します。溶液をボルテックスし、石英キュベットに移します。
注:サンプルの比率を調整します:機器の感度と非線形飽和しきい値に応じて1%Triton X-100。 - このサンプルは、ステップ 7.4.3 のパラメーターを使用して測定します。この測定値は、「破壊された」粒子に対応します。
- PBSを使用して手順7.4.3〜7.4.6を繰り返します。この測定値は「無傷」の粒子に対応します。
- 1% Triton X-100 および PBS 測定値を使用して、破壊されたサンプルスペクトルと無傷のサンプルスペクトルをベースライン補正します。
- PBS(FPBS)および 1% Triton X-100(FTx)中のインタクトサンプルのベースライン補正蛍光シグナルを積分して、式 3 でクエンチング効率(QE)を計算します。
 (式3)
(式3)
- UV-Vis分光法
注:分光法測定は、マイクロバブル活性化後72時間まで行うことができます。- 懸濁液が透明になるまで、RTの浴超音波処理器を使用して、マイクロ遠心チューブ内のマイクロバブル懸濁液のアリコートを超音波処理します。これにより、分光法中の散乱効果が減少します。
- 最初の測定の10分前に分光光度計の電源を入れます。0.25 nmのスキャン間隔と200〜800 nmの取得範囲を選択します。ベースライン減算を有効にします。
- 測定には、パス長1cmの石英キュベットを使用してください。測定の合間にキュベットをメタノールですすぎ、加圧空気で乾燥させます。
- メタノールのベースライン測定値を取得します。
- 超音波処理された透明なマイクロバブル懸濁液をボルテックスし、10〜50μLを200〜1000μLのメタノールを含むマイクロ遠心チューブに移します。メタノールの量が測定され、清潔なガラスマイクロリットルシリンジを介してチューブに追加されることを確認します。溶液をボルテックスして、「破壊された」サンプルを取得します。
注:サンプルの希釈は、ポルフィリンのローディング効率とモル%組成に依存します。20 mol% のパイロ脂質マイクロバブル組成物には、20 倍希釈が適しています。 - UV-Visスペクトルを収集します。
- ステップ7.5.4から7.5.6を繰り返し、メタノールの代わりにPBSを使用します。
注:マイクロピペットを使用して、ガラスマイクロリットルシリンジの代わりにPBS容量を測定できます。
8. プロトコルの変更
- 代替キレート剤
- セクション2に従って脂質膜を調製し、パイロ脂質を代替の脂質共役銅キレート剤(例えば、1,2-ジパルミトイル-sn-グリセロ-3-ホスホエタノールアミン-N-ジエチレントリアミン五酢酸(アンモニウム塩)で置き換え、以下DTPA-脂質と呼ぶ)。 補足ファイル 1 を使用して、必要な質量とストック体積を計算します。
注:代替キレート剤のさまざまなモル組成の試験は、高収率の安定したマイクロバブルが生成できない上限を決定するために必要になる可能性があります。 - セクション3から6に従って、放射性標識マイクロバブルを生成し、特性評価します。
- ステップ 7.1 から 7.3 に従って、「冷たい」銅キレート化マイクロバブルを特徴付けます。粒子の形態を評価するには、明視野共焦点顕微鏡の画像取得のみが必要です。代替キレート剤が蛍光性の場合は、ステップ7.4および7.5に加えて、関連する励起波長と発光波長を使用して共焦点顕微鏡検査を実施します。
- セクション2に従って脂質膜を調製し、パイロ脂質を代替の脂質共役銅キレート剤(例えば、1,2-ジパルミトイル-sn-グリセロ-3-ホスホエタノールアミン-N-ジエチレントリアミン五酢酸(アンモニウム塩)で置き換え、以下DTPA-脂質と呼ぶ)。 補足ファイル 1 を使用して、必要な質量とストック体積を計算します。
- 代替蛍光色素
- セクション2に従って脂質フィルムを調製し、パイロ脂質を別の脂質標識またはインターカレート蛍光色素(DiIなど)に置き換えます。 補足ファイル 1 を使用して、必要な質量とストック体積を計算します。
注:代替蛍光色素のさまざまなモル組成の試験は、高収率の安定したマイクロバブルが生成できない上限を決定するために必要になる可能性があります。 - AA-PGG の代わりに PGG を使用してセクション 3 に従います。
- ステップ 5.1 から 5.3 とステップ 7.2 から 7.5 を完了します。
- セクション2に従って脂質フィルムを調製し、パイロ脂質を別の脂質標識またはインターカレート蛍光色素(DiIなど)に置き換えます。 補足ファイル 1 を使用して、必要な質量とストック体積を計算します。
- 「スパイキング」アプローチ:事前に形成されたマイクロバブル脂質懸濁液の標識
- セクション2に従って、他の脂質成分を含まないパイロ脂質のみを使用して、ポルフィリン脂質膜を生成します。パイロ脂質の量については、 補足ファイル1 を参照してください。
- 1mLの水和緩衝液の代わりに100〜200μLのAA-PGG(または放射性標識が不要な場合はPGG)を使用して、セクション3に従ってパイロ脂質フィルムを水和します。
- パイロ脂質懸濁液全体を既製の脂質マイクロバブル懸濁液に移します。
- ヘッドスペースをPFPで満たし、加熱し、懸濁液を超音波処理し、ステップ3.4から3.9に従ってPFPの下に密封します。パイロ脂質懸濁液が既製の脂質マイクロバブル懸濁液に分散するのを監視し、完全に分散するまで加熱/超音波処理サイクルを行います。
注:セプタムシールされた市販のマイクロバブルバイアルを使用する場合、パイロ脂質懸濁液は、バイアルのヘッドスペースにPFPを補充することなく、シリンジ/ニードルを介してバイアルに導入できます。 - セクション4から7に従って、放射性標識(以下のステップ8.3.5.1を参照)、活性化、分離(以下の注を参照)、および関連する特性評価を実施します。
- 別のアプローチは、最初に水和したパイロ脂質懸濁液を放射性標識し、>94%の放射性化学的純度を監視し、1 N NaOHで中和し(パイロ脂質フィルムを水和するために使用されるAA-PGG体積に応じて体積を変更します)、次に放射性標識されたパイロ脂質懸濁液をステップ8.3.3に従って既製のマイクロバブル脂質懸濁液に導入することです。
注:この修正されたアプローチは、脂質の水和中に生成されたがマイクロバブルに組み込まれていないサブミクロンのマルチラメラ小胞を除去する単離プロセスが続く場合にのみ、蛍光またはマルチモーダル放射性標識マイクロバブルを生成するために使用する必要があります。詳細については、ディスカッションを参照してください。
- 別のアプローチは、最初に水和したパイロ脂質懸濁液を放射性標識し、>94%の放射性化学的純度を監視し、1 N NaOHで中和し(パイロ脂質フィルムを水和するために使用されるAA-PGG体積に応じて体積を変更します)、次に放射性標識されたパイロ脂質懸濁液をステップ8.3.3に従って既製のマイクロバブル脂質懸濁液に導入することです。
結果
放射性標識マイクロバブルを製造する際の定量化可能な主な結果は、放射性化学的純度と放射性標識効率です。このプロトコルでは、iTLCと検証済みの遠心法をそれぞれ使用して、それぞれを特徴付けます。 図2A は、全脂質の1 mol%、10 mol%、または30 mol%の組成で、宿主脂質をパイロ脂質に置換した市販のマイクロバブル模倣製剤全体で、平均≥95%の放射化学的純度と効率が達成されたことを示しています。1 mol% および 10 mol% の発熱脂質製剤では、これらの値を達成するために、より濃縮された脂質懸濁液(0.15 mL 対 1 mL)が必要でした。現在のプロトコルで達成された高い放射性化学的純度とキレート化効率により、標識後の精製の必要性はなくなりました。
これは、C16、C18、および C22 鎖長脂質で構成され、全体的に中性または陰イオン性の表面電荷を持つ代替製剤にも当てはまりました(図 2B)。これらの変異体は、平均マイクロバブルサイズ、許容可能なマイクロバブル収率(>1 x 109 マイクロバブル・mL-1)、およびパイロ脂質とその活性化可能な蛍光および金属キレート化能力を最大化しながら、>8μmのマイクロバブル集団生成を制限するために以前に決定された上限に基づいて、30mol%のパイロ脂質組成物をロードした15.この目的のために、30 mol%の製剤は、最高の(99 %もの高い)放射性化学純度とキレート化効率を示しました。 図2 で検討したすべての製剤の基本的な脂質組成は、最も臨床的に探索された市販のマイクロバブル製剤に基づいており、一方、鎖長と電荷変異体は、最も広く前臨床で探索された組成物を表している15。これにより、提示された放射性標識プロトコルが、治療用超音波領域に関心のあるほとんどのマイクロバブル組成物に適用できるという確信が持てる。
定量的なマイクロバブルの物理化学的特性評価は、放射性マイクロバブルに対しては通常実行不可能です。放射能が崩壊するまでに(同位体や使用される放射能の量によっては、数日から数週間もかけて)、マイクロバブルガスのコアは大部分が溶解し、マイクロバブルの破片が生成されます。したがって、粒子懸濁液は、最初に活性化または投与されたセラノスト活性種を正確に捕捉することはできない。そのため、放射性マイクロバブル調製中の目視観察と、ペアになった「コールド」キレート化アナログプロトコルが不可欠です。具体的には、脂質膜の水和と活性化のステップで重要な視覚的観察が必要です(図3)。完全な水和が成功すると、脂質膜はバイアル壁から完全に解離し、自己組織化して小胞になり、水和バッファーに均一に分布します。最終結果は透明なソリューションです(図3A)。不完全な水和は、懸濁液中のバイアル壁または凝集体に付着し続ける脂質膜を特徴とします(図3B)。前者は簡単には気付かれないかもしれません、そしてそれ故にバイアルの表面から任意の水を拭き取りそして慎重な検査が超音波処理中に推奨される。マイクロバブルの早期活性化は、水和中に避けるべきであり、懸濁液表面での持続的な気泡の生成や懸濁液内での乳白色/曇りのささやき声として容易に観察できます(図3C)。この不適切な活性化は、マイクロバブルの収率とサイズ分布の再現性を低下させる可能性があります。これは、宿主脂質成分の転移温度を超える浴水温度を使用し、目に見える超音波処理/液体の乱れを容易にする適切な水位まで浴超音波処理器を充填することによって回避することができますが、水和緩衝液または浴槽水を「ジャンプ」することなく、バイアルの揺れや突然の攪拌を慎重に回避します。マイクロバブル懸濁液が制御された高速の機械的攪拌によって意図的に活性化されると、乳白色の不透明な懸濁液が形成され、不適切に大きな粒子(たとえば、直径>8μm)を含むより軽く、より白く泡立つ上層と、目的のマイクロバブルを含むターゲット最下層に分離します(図3D))は、シリンジ/針吸引によって分離されます。最適でない活性化により、標的マイクロバブル集団の収量が低下すると、水和脂質懸濁液の曇ったバージョンのように見える、乳白色/不透明でなく、しばしば半透明の下層が生成されます(図3E)。
客観的な放射性標識マイクロバブルの物理化学的特性評価は、類似の「冷たい」銅キレート化マイクロバブルを使用して行われます。この特性評価の主なエンドポイントには、1)マイクロバブルの平均サイズと収率の定量化、2)マイクロバブルの貯蔵/作業時間枠の安定性の評価、3)マイクロバブルシェル全体でのパイロ脂質ローディングの成功の検証、および4)マイクロバブル製造プロセスに組み込まれた放射性標識プロセスによってこれらの物理化学的特性が変化しないことを確認することが含まれます。 図4 および 図5 は、全脂質の30 mol%のパイロ脂質組成を持つ銅キレート化C16アニオンマイクロバブル製剤のこのような特性評価を示しています。特性評価は、制御された非キレート化マイクロバブルの特性評価とは対照的です。
図4は、キレート化マイクロバブルと非キレート化マイクロバブルの代表的なサイジングデータを示しています。数分布(図4A)は、小さな泡の存在が大きく、サイズとともにマイクロバブル数が単調に減衰することを示しています。マイクロバブルの体積分布(図4B)は、平均サイズ6μmに対応する単峰性のピークを示します。より大きなマイクロバブルはより大きなガス量を構成するため、体積分布はより高いマイクロバブル平均サイズに偏ると予想されます。数値加重平均で平均すると、1.5〜2μmのサイズと3×109 マイクロバブル・mL-1 のマイクロバブル収率が達成され(図4C、D)、マイクロバブルの活性化および分離後1時間で安定しています。これらの結果は、脂質ハイドレーションプロトコルによって生成された安定した脂質マイクロバブルで、遠心サイズをさらに分離せずに典型的なものです。重要なことは、マイクロバブルのサイズ分布、平均サイズ、濃度、および安定性は、マイクロバブルのグラインドアップ製造におけるキレート化条件の統合によって変化しないことです。これらの値は、銅キレート化による物理化学的特性の保持を示す他のマイクロバブル製剤の値とともに 、表1にまとめられています。
マイクロバブルの形態学的および光学的特性(図5)も「冷」銅キレート化によって維持されます。ポルフィリン蛍光は、キレート化されたマイクロバブルとキレート化されていないマイクロバブルの殻の輪郭を均一に示し、マイクロバブルの殻内にパイロ脂質キレート剤がうまく取り込まれることを示しています(図5A)。ローディングの成功は、UV-Vis分光法と蛍光分光法によっても識別できます。破壊されたマイクロバブルは、モノマー脂質種に分解します。そのため、破壊されたマイクロバブルのUV-Visスペクトル(図5B)は、遊離パイロリピッドのスペクトルと一致します。これには、青色の領域のソレットバンドと赤色の領域のQバンドの2つの顕著なピークが含まれています。濃度を正規化し、マイクロバブル間のより客観的な比較を容易にするために、吸光度スペクトルは波長間のモル放射率として表されます。破壊されたマイクロバブルの生のUV-Vis吸光度スペクトルは、ランベルトベールの法則(光路長1 cm、吸光係数97,000 M-1・cm-1または45,000 M-1・cm-1、410 nmおよび667 nm)を適用することにより、マイクロバブル懸濁液中のパイロ脂質カプセル化および濃度を定量化するために使用できます。図5で特徴付けられるマイクロバブルは、85%〜90%のパイロ脂質カプセル化効率と~0.17mMのポルフィリン濃度を示します。マイクロバブルとポルフィリンの両方の濃度を特徴付けることで、マイクロバブルとポルフィリンの投与量を推定することができます。高いカプセル化効率は、マイクロバブル中の効果的なパイロ脂質ローディングを示しています。これは、無傷のマイクロバブルのUV-Visスペクトルによってサポートされており、QYバンドの674nmおよび702nmへの特徴的な赤方偏移を示しています。後者は、特に、670〜680 nmの単一の赤方偏移ピークのみを示す小胞構造に対して、ポルフィリンのマイクロバブルシェルへの高負荷および規則的な凝集で見られます15,37。5 mol%を超える組成のマイクロバブルへのポルフィリンの効果的なローディングは、無傷のマイクロバブル15におけるポルフィリン蛍光の高(>90%)消光を通じて観察でき、粒子が破壊されると回復する(図5C)。サイジングデータと同様に、これらの光学特性は、現在のプロトコルに関連付けられた放射性標識条件で保持されます(表1に要約されています)。まとめると、これらの結果は、マイクロバブルの製造、ポルフィリンキレート剤の取り込み、およびキレート化マイクロバブルの特性保持を成功させるためのすべてのエンドポイントの達成を示しています。
現在のマイクロバブル放射性標識プロトコルは、銅キレート化能力とパイロ脂質のマルチモダリティを利用して確立されました。ただし、パイロリピッドは現在市販されていません。研究協力は、社内または外部でパイロ脂質を合成するためのリソースが利用できない場合は、パイロ脂質を取得することをお勧めします。どちらのオプションも利用できない場合は、現在のプロトコルを変更して、市販の蛍光色素とキレート剤をそれぞれ使用して、単峰性の蛍光または放射性マイクロバブルを生成することができます。これらの代替キレート剤/トレーサーは、マイクロバブル脂質シェル内に組み込まれていない必要があります。 図6 は、DiIとDTPA-lipidという2つの部分で構築された代表的なマイクロバブルを示しています。
DTPA-脂質をC16アニオン性マイクロバブル製剤に組み込むと、11 x 109 マイクロバブル・mL-1 の収率とキレート化されたC16アニオン性パイロ脂質マイクロバブルと同様の形態を持つ1.1μmのマイクロバブルが得られます(図6B、C)。DTPAマイクロバブル銅キレート化能力の予備評価は、「コールド」CuCl2を用いて行われました。銅キレート化をDTPAマイクロバブルの作製プロセスに組み込んだところ、サイズと歩留まりは変わりませんでした。マイクロバブル中のDTPA-脂質が銅キレート化に利用可能であることを確認するために、遠心ろ過されたマイクロバブルでICP-MSを実施しました。決定的な銅シグナルが検出され、これは、同等の銅スパイク非標識コントロールから得られたシグナルと比較した場合、90%〜100%のキレート化効率に対応しました。社内の経験では、ICP-MS は γ カウンティングよりも銅キレート化効率の変動が大きいため、現在のプロトコルでは カウンティングよりも銅キレート化効率が変動することが推奨されます。これらの結果は、この推奨事項の重要性を強調するだけでなく、このレポートで提示された銅キレート化プロトコルがパイロ脂質以外のキレート剤にも翻訳可能であることを概念実証するものでもあります。
図6Dに見られるように、現在のプロトコルは、5mol%組成でDiIをC16アニオン性マイクロバブル製剤にうまく組み込むためにも使用できます。これにより、マイクロバブルシェルの強く均質な蛍光標識が実現し(図6Bに示すようにパイロ脂質を使用する場合と同様)、平均サイズ1.7μm、収率1.5×10の9マイクロバブル・mL-1のマイクロバブルが生成されます。全体として、図6に示す結果は、現在のマイクロバブル製造および標識プロトコルを実装して、パイロ脂質にアクセスできない場合に代替プローブとキレート剤をマイクロバブル製剤に組み込むことができることを示しています。
このプロトコルは、脂質MBの放射性標識に焦点を当てています。その自然な拡張は、これらの放射性標識マイクロバブルの in vivo での応用であり、これは、市販の脂質マイクロバブル15の一連の放射性標識類似体の断片化、循環速度論、および速度論的生体内分布を特徴付ける最近の報告でエッセイされた。この拡張された作業の結果は、放射性標識マイクロバブルの応用と将来の有用性の文脈で、次のセクションで議論されます。

図2:放射性標識の純度と効率。 (A)さまざまなパイロ脂質キレート剤組成、および(B)脂質鎖の長さとマイクロバブル電荷を持つマイクロバブルのグラインド合成中に、現在のマイクロバブル放射性標識プロトコルの適用後に得られる放射性標識の純度と効率。アニオン性マイクロバブルは(-)で指定され、双性イオン性(つまり中性)は「n」で指定されます。データは、平均±標準偏差として表示されます。この図は、Rajora et al.15の許可を得て改作されました。 この図の拡大版を表示するには、ここをクリックしてください。
図3:脂質フィルムの最適および最適でない水分補給とマイクロバブル活性化。 (ア-E)(A,D)最適および(B,C,E)最適脂質膜の水和とマイクロバブル活性化の代表的な写真。この図の拡大版を表示するには、ここをクリックしてください。

図4:非キレート化および銅キレート化ポルフィリンマイクロバブルの代表的なサイジング、収率、安定性。 (A)数サイズ分布、(B)体積サイズ分布、(C)マイクロバブル収率、および(D)30 mol%のパイロ脂質組成を持つ非キレート化(黒色)および銅キレート化(ピンク色)ポルフィリンマイクロバブルの数平均サイズ。マイクロバブル(C および D)の収率とサイズを30分間隔で測定し、作業懸濁液の安定性を確保しました。データは、n = 4-7回の反復の(C)と(D)の平均標準偏差として表されます。この図は、Rajora et al.15の許可を得て改作されました。 この図の拡大版を表示するには、ここをクリックしてください。
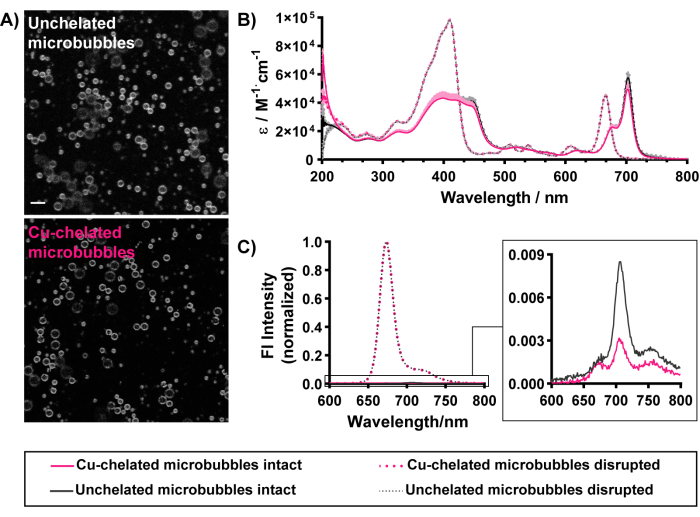
図5:30 mol%のパイロ脂質組成を持つ非キレート化(黒色)および銅キレート化(ピンク色)のポルフィリンマイクロバブルの形態学的および光学的特性評価。 (A)グレースケールの共焦点イメージング(図に示されているパイロシグナル)は、キレート化および非キレート化マイクロバブルシェル(スケールバー= 5 μm)内にパイロ脂質が均一に取り込まれていることを示しています。(B)無傷のマイクロバブル(PBSで、実線)およびメタノールで破壊されたマイクロバブル(破線)について得られたUV-Visスペクトル。(C)PBS中のインタクトマイクロバブルの蛍光スペクトル(実線、拡大挿入図)および1%Triton X-100破壊マイクロバブル(破線)。この図は、Rajora et al.15の許可を得て改作されました。 この図の拡大版を表示するには、ここをクリックしてください。
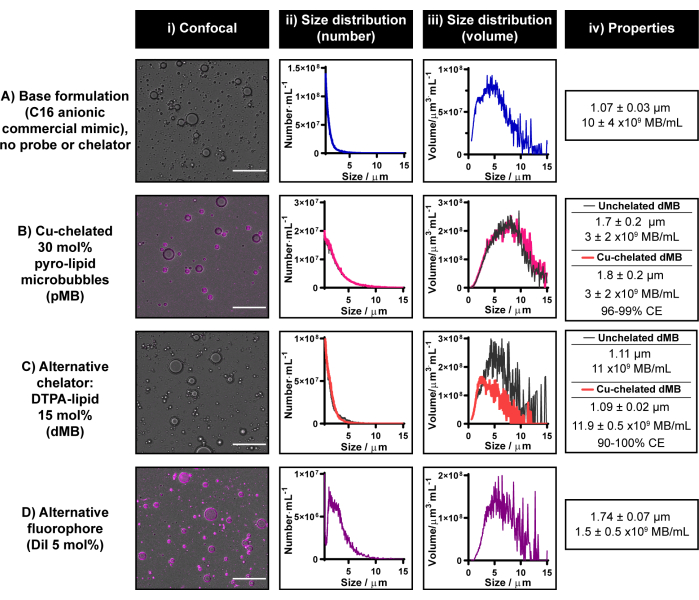
図6:市販の蛍光色素とキレート剤で構築された代表的なマイクロバブル。 (A-D)(C)代替キレート剤(DTPA脂質)および(D)フルオロフォア(DiI)〜(B)パイロ脂質を(A)C16アニオン性市販脂質マイクロバブル製剤に別々に組み込んだ使用例。マイクロバブルは、共焦点顕微鏡(スケールバー= 20μm)(i)および電気インピーダンスサイジングによって特徴付けられ、数加重(ii)および体積加重(iii)のサイズ分布を生成しました。マイクロバブルの平均サイズと収率は(iv)にまとめられています。データは、ii-iv で n = 2-7 の反復の平均として表されます。この図の拡大版を表示するには、ここをクリックしてください。
| マイクロバブルの変種 | 歩留まり | ガス量 | 数分布別平均サイズ [μm] | 体積分布別平均サイズ [μm] | Q702nm:Q674nm | FL焼入れ効率 [%] |
| [x109 MB▪mL-1] | [x1010 μm3 ▪mL-1] | |||||
| インハウスデフィニティ | 10±4 | 1.8 ± 0.2 | 1.07±0.03 | 3.64±0.09 | 該当なし | 該当なし |
| C16 (-) | 3 ± 2 | 6 ± 3 | 1.7 ± 0.2 | 6.0 ± 0.8 | 2.5 ± 0.1 | 97.5 ± 0.8 |
| Cu-C16(-) | 3 ± 2 | 4 ± 2 | 1.8 ± 0.2 | 6.6 ± 0.8 | 2.3 ± 0.2 | 98±2 |
| C16 n | 8.4 ± 0.4 | 2.3 ± 0.8 | 1.1 ± 0.2 | 4.6 ± 0.1 | 2.1 ± 0.5 | 98.2 ± 0.3 |
| Cu-C16 n | 6.2 ± 0.5 | 2.9 ± 0.9 | 1.3 ± 0.2 | 5.1 ± 0.3 | 1.8 ± 0.6 | 98.7 ± 0.2 |
| C18 (-) | 8 ± 1 | 3.9 ± 0.9 | 1.5 ± 0.1 | 4.0 ± 0.5 | 2.5 ± 0.3 | 97±1 |
| Cu-C18(-) | 7 ± 2 | 4 ± 1 | 1.5 ± 0.2 | 4.9 ± 0.9 | 2.2 ± 0.5 | 98.5 ± 0.6 |
| C18 n | 8 ± 1 | 3 ± 1 | 1.5 ± 0.1 | 4.0 ± 0.8 | 1.8 ± 0.7 | 98.6 ± 0.5 |
| Cu-C18 | 7.8 ± 0.2 | 3.9 ± 0.2 | 1.42 ± 0.04 | 4.8 ± 0.1 | 1.8 ± 0.7 | 98.7 ± 0.3 |
表1:非キレート化およびCuキレート化pDefの物理化学的特性。 アニオン性マイクロバブルは(-)で指定され、双性イオン性(つまり中性)は「n」で指定されます。すべての測定値は、平均±標準偏差(n = 3-7)を表します。この図は、Rajora et al.15の許可を得て改作されました。
補足図1:脂質マイクロバブルシェルへのパイロ脂質導入のための「グラインドアップ」(灰色)と「スパイキング」(ピンク)アプローチの比較。 (A)全脂質の1 mol%、10 mol%、および30 mol%の全パイロ脂質組成に対応する量でパイロ脂質を「スパイク」したマイクロバブルの共焦点イメージング(スケールバー= 20 μm)。(B)「スパイク」(マゼンタ)または「グラウンドアップ」アプローチ(黒)によって生成されたパイロ脂質マイクロバブルのUV-Visスペクトル(i-iii)。(ビブ)サブミクロン種の遠心除去後のマイクロバブルケーキと下清中のパイロ脂質の割合。(C)「グラウンドアップ」(ブラック)および「スパイキング」アプローチによって作製されたパイロ脂質マイクロバブルの数と体積分布(i-iii)、および対応する平均マイクロバブルサイズ(iv)と収率(v)。 このファイルをダウンロードするには、ここをクリックしてください。
補足図2:1 mol%、10 mol%、30 mol%の発熱脂質で構成され、銅-64で放射性標識されたマイクロバブル脂質懸濁液のRadio-UPLC特性評価。 左側のスペクトルは放射線検出器からのもので、右側のスペクトルは400nmの吸光度チャネルからのものです。残念ながら、潜在的な汚染物質のため、このデータを使用して放射性化学純度を定量することはできませんでした。しかし、[64Cu]Cu2+ シグナルとパイロ脂質に関連するピークの溶出時間が重複していることは示されており、放射性標識が成功したことを示しています。この図は、Rajora et al.15の許可を得て改作されました。 このファイルをダウンロードするには、ここをクリックしてください。
補足図3:パイロ脂質モル組成の増加の影響。 (A)関連する数分布、(B)体積分布、(C)数平均サイズ、(D)体積平均サイズ、(E)収率、(F)蛍光消光効率、およびインタクト(PBS)および破壊(1% Triton X-100)に関連する統合蛍光シグナル(410 nm励起、600-800 nm励起)への影響。データは、n = 3 の平均が標準偏差±反復として表されます。この図は、Rajora et al.15の許可を得て改作されました。 このファイルをダウンロードするには、ここをクリックしてください。
補足ファイル1。このファイルをダウンロードするには、ここをクリックしてください。
ディスカッション
現在の脂質マイクロバブル放射性標識プロトコルは、>95%の放射性純度、>95%のキレート化効率、および標識後の精製を必要とせずにマイクロバブル物理化学的特性の保持を達成します。これらの成果は、既存のラベリングプロトコルでは達成できなかった進歩を表しています。精製手順がないため、放射性同位元素(この場合は銅-64)をより迅速に使用でき、放射性崩壊による非効率的な放射能損失を減らすことができます。結果として生じるマイクロバブル特性の保持は、銅-ポルフィリンキレート化33の既知の安定性と組み合わされ、その後の任意の放射線画像または治療が、遊離放射性同位元素または精製修飾マイクロバブル集団に関連するものと比較して、目的のマイクロバブルを代表することをより確実にする。
現在のプロトコルは、マイクロバブルの物理化学的特性のそのような保持を確実にするために、並行した「コールド」ラベリングと主要な特性評価技術を統合した最初のプロトコルでもあります。実際、これは、マイクロバブルのサイズ、収率、および安定性が堅牢に特徴付けられた最初のマイクロバブル放射性標識プロトコルです。これらの特性を理解することは、放射性標識マイクロバブルの適用にとって非常に重要です。マイクロバブルの投与量を決定するには、マイクロバブルのサイズ、ガス量、および収率に関する知識が必要であり、これがマイクロバブル-FUS処理の安全性と有効性に影響を与えます。例えば、マイクロバブル−FUS BBBの開口部は、マイクロバブルの投与量/ガス量の上限と関連しており、それを超えるとFUS後の出血および炎症が安全性上の懸念をもたらす38。オールインワンのシェルロードマイクロバブルの場合、この用量はロードされた薬物の用量にも結びついています。サイズと歩留まりもイメージングアプリケーションに影響を与え、高濃度のマイクロバブルガスボリューム39でシールドアーティファクトを生成します。大きな>8μmのマイクロバブルは、毛細血管に留まり、ガス塞栓を形成するという追加の安全リスクを提示する40。直感的には、これはマイクロバブルシェルの薬物動態と生体内分布にも影響を与えるでしょう。例えば、肺は以前に放射性標識されたマイクロバブルシェル蓄積の主要な部位として報告されていた28,32。マイクロバブルの特性評価が行われていないため、より大きなサイズのマイクロバブルの肺の閉じ込めがこの生体内分布プロファイルに寄与したかどうかは不明のままです。ポルフィリンの使用に特化して、マイクロバブルの光学特性を特徴付けることで、以下で説明するように、金属:ポルフィリン比、ひいてはキレート化効率に影響を与える可能性のある効果的なポルフィリンシェルローディングが保証されます。ポルフィリンは、マイクロバブルマルチモーダルイメージング37、相乗的光線力学療法41、およびソノダイナミック療法42にも関心のあるセラノスティック剤です。マイクロバブル内でのその負荷と蛍光を特徴づけることで、ポルフィリンマイクロバブル治療研究の指針となり、これらの特性が放射性標識によって変わらないことを確認し、真の画像誘導治療計画を促進します。したがって、「コールド」ラベリングと非標識マイクロバブルの作製は、放射性ラベリングと並行して行われることが強く求められています。
このプロトコルは、ポルフィリンの強力な銅キレート化能力と、マイクロバブルシェル37内のポルフィリン脂質の既知の自己組織化を活用している。銅-64に焦点を当てていますが、このプロトコルは、ポルフィリンの広範なクラスがZn、Ni、Mn、Pd、In、Lu、Cd、Sn、Ga、Co、および43,44,45,46を超えて結合できるため、代替のワンポットメタロキレート化マイクロバブル調製物への扉を開きます。このようなポルフィリン-金属キレート化は、典型的には、ポルフィリン超分子合成中の2つのステップのいずれかで起こる:1)挿入前、ポルフィリンビルディングブロックが粒子に導入される前にキレート化される、または2)挿入後、金属キレート化を行う前にポルフィリンがすでに粒子に組み立てられている33,43.放射性同位元素を使用する場合、1つ目は脂質膜の乾燥中の非効率的な放射性崩壊と関連しており、その結果、放射線の安全性リスクが高まります。後者をマイクロバブルに適用すると、粒子が不安定化するリスクがあります。そのため、現在のプロトコルでは、キレート剤を「粉砕」脂質膜形成中に導入するハイブリッドアプローチが生み出されましたが、放射性標識は脂質膜の水和後、マイクロバブル活性化の前に行われました。この戦略により、放射性標識を一般的なマイクロバブル製造プロセスに容易に組み込むことができ、さまざまなマイクロバブル製剤に対応することができました。さらに、この統合により、単純な機器の使用が可能になり、特殊な放射能の「高温」機器の数が最小限に抑えられました。
このハイブリッドアプローチは、既存のマイクロバブル放射性標識プロトコルとも異なり、1)キレート剤の合成と放射性標識、次いで予め形成されたマイクロバブル脂質懸濁液に「スパイク」される28,47、および2)ビオチン化部分の放射性標識であり、その後市販のストレプトアビジン官能化市販マイクロバブルとインキュベートされる32,29.この後者のアプローチには、放射性同位元素の使用を節約できるという利点があります。提示された「グラインドアップ」および報告された「スパイク」プロトコルでは、放射性同位元素キレート剤はマイクロバブルの活性化に先立って組み込まれ、したがって、標的デカントされたマイクロバブルと望ましくない大きな泡状の粒子集団の両方が標識されます。この制限は、「グラインドアップ」および「スパイク」アプローチに大量の放射性同位元素が必要であり、その半分が無駄になることを意味します。しかし、上述したように、活性化後の放射性標識はマイクロバブルの不安定化のリスクがあり、以前の「スパイク」プロトコルと並んで、未統合された放射性標識キレート剤の除去が必要となる。
しかし、「スパイク」アプローチは、脂質膜の生成が不可能または望ましくない場合に、事前に形成されたマイクロバブル脂質懸濁液(例えば、市販のマイクロバブル)を放射性標識する道を開く。現在の「ゼロアップ」放射性標識プロトコルは、このような「スパイク」アプローチを模倣するように適応させることができます(ステップ8.3)。ここでは、パイロ脂質膜が生成され、次いで水和されて、パイロ脂質懸濁液が小胞を形成する。次いで、この懸濁液を予め形成されたマイクロバブル脂質懸濁液に「スパイク」し、加熱/超音波処理してパイロ脂質を統合させる。放射性標識は、「スパイク」の前または直後(ただし、活性化前)に発生する可能性があります。 補足図1Aに見られるように、この適応プロトコルは、全脂質の1 mol%、10 mol%、または30 mol%の組成で、「スパイク」パイロ脂質キレート剤を使用して社内の市販マイクロバブル製剤を標識します。
この「スパイク」アプローチには、現在のプロトコルで焦点を当てている未修正の「ゼロアップ」アプローチと比較して、不完全なパイロ脂質の統合という重要な制限があります。共焦点イメージング(補足図1A)で見られるように、パイロ脂質シグナルは、「グラウンディング」取り込み中のように、マイクロバブルシェルの周囲に厳密にリング状で均質に局在しません。それどころか、「スパイキング」アプローチは、マイクロバブル全体に見える蛍光の斑状の領域に関連付けられており、その一部はぼやけた蛍光の輪郭と鮮明な蛍光輪郭を持っています。また、より高い不均一なバックグラウンド蛍光も観察できます。これらの「スパイクされた」マイクロバブルを遠心分離してサブミクロン種を除去すると、このバックグラウンド蛍光と斑状シグナルの多くが除去されます。これは、パイロ脂質小胞が吸収されたが、マイクロバブルシェルに完全には組み込まれていない可能性があることを示唆しており、パイロ脂質の「スパイク」と「グラインドアップ」の取り込みのUV-Vis特性によって裏付けられた推測です(補足図1B)。マイクロバブル(>5 mol%組成)中のパイロ脂質包入に特異的に関連する704 nmのQバンドは、「スパイク」によって減少します。代わりに、674 nmでより顕著なピークが観察されます。マイクロバブルケーキに分布するパイロ脂質とサブミクロン亜ミクロン種に分布するパイロ脂質の定量化は、パイロ脂質の4分の1のみが「スパイク」でマイクロバブルに分布することを示しています。逆に、高パイロ脂質量は、「粉砕」キレート剤の導入のためにマイクロバブルに取り込まれます。「スパイクされた」マイクロバブル内のパイロ脂質の取り込みが少ないことが、プローブなしのマイクロバブルと関連する「グラインドアップ」マイクロバブルに似たサイズ分布の一因である可能性が高いです(補足図1C)。取り込まれていない放射性標識パイロ脂質構造の存在は、放射線画像または治療結果を混乱させる可能性があります。そのため、既存のプロトコルと同様に、「スパイキング」アプローチの後に、取り込まれていないパイロ脂質種を除去する遠心分離またはデカントステップを行う必要があります。上記のすべてを考慮に入れると、現在のプロトコルで提示されている「ゼロアップ」の放射性標識戦略がより強く推奨されます。これにより、「スパイク」と比較してキレート剤の高集積化が可能になり、あらかじめ形成された市販のマイクロバブルとは異なり、マイクロバブル製剤のカスタマイズが可能になります。
「グラウンドアップ」銅キレート化プロトコルは、前述の48のように反応パラメータの体系的な調査を通じて確立された。この最適化プロセスは、高品質のマイクロバブルを生成するための重要なステップへの洞察を提供し、同時に効率的でタイムリーな銅キレート化を可能にします:1)マイクロバブル活性化前に10%のグリセロールと10%のプロピレングリコール賦形剤含有量を維持する、2)キレート化温度が60〜80°Cに保たれるようにする、3)放射性標識と同じ日にAA-PGGでフィルムを水和する(脂質懸濁液を酸性条件に長時間さらすことは控えるべきです)。 4)活性化前に脂質懸濁液を中和し、5)水分補給、キレート化、活性化後の「クールダウン」ステップを確保します。ポルフィリン:銅の比率は10:1以上に保つ必要があります。マイクロバブルのサイズ、収率、安定性、およびキレート化効率を維持するためには、銅に対する過剰なポルフィリンが必要であり、また、銅キレート化はポルフィリン蛍光を消光するため、二重の無線および蛍光イメージング機能も必要です。1 mLの反応容量と1時間のキレート化時間により、標識対象のマイクロバブル中のパイロ脂質部分の<1%に相当する30 mol%のパイロ脂質懸濁液組成物の効率的で純粋な放射性標識が得られました。脂質膜中のパイロ脂質組成物を1 mol%および10 mol%に下げると、同じ銅-64添加物に対するパイロ脂質の過剰が減少し、放射性標識反応に修正が必要になりました。より濃縮された反応が必要であったため、関連するマイクロバブルフィルムを0.15mLのAA−PGGで水和した。中和後、PGGを添加して、マイクロバブル活性化前に1 mLの放射性標識脂質懸濁液量を得ました。1 mol%の組成物は、≥95%の放射性標識効率と純度を得るために、より長い加熱(1.5〜2時間)を必要としました。したがって、放射性標識の課題(すなわち、放射性化学物質の純度と効率が≤90%)に直面した場合、より長い反応時間とより少ない反応量(すなわち、より濃縮された脂質懸濁液)を試すことができます。
このプロトコルでは、iTLCと検証済みの遠心ろ過技術15 を使用して、放射性化学的純度と放射性標識効率をそれぞれ定量化しました。銅-64のキレート化が成功し安定していることを示すin vivo での読み出しは、膀胱シグナルの欠如です(遊離銅-64は腎排泄を受け、マイクロバブルシェルのような脂質超分子構造は肝胆道/糞便排泄を受けます)15。キレート化の有効性は、放射性化学純度と標識効率を評価する別の手段であるラジオ高速液体クロマトグラフィー(補足図2)によって検証されました(補足図2)。このプロトコルでは、iTLCと遠心ろ過は、専門的なスキルセットや機器を必要とせず、むしろ研究所の原子力施設が所有している可能性が高い機器を使用する、より迅速でシンプルな方法として提示されました。この目的のために、遠心ろ過プロトコルは、30,000 MWCOユニット(100,000 MWCOユニットも使用可能)を使用して、遊離銅とキレート銅の分離について検証されました。代替の放射性同位元素/金属を使用する場合は、遠心分離の速度、時間、および洗浄回数を変更する必要がある場合があります。銅-金属キレート化の安定性が不明または不安定な代替金属を使用する場合は、適切な血清安定性試験も実施する必要があります。
放射性標識の課題を超えて、マイクロバブル製造の課題も発生する可能性があります。先に紹介したように、マイクロバブルは壊れやすく、その製造に向けたステップでは、 図3に示すように、水和、活性化、再現性、安定性、および収率の問題に遭遇する可能性のある精密で慎重な取り扱いが必要です。マイクロバブル製造を成功させるその他の要因には、1)新鮮で乾燥した脂質の使用(乾燥脂質をデシケーターに保管し、氷から保護する)、2)熱にさらされた脂質アリコートの使用を避ける(例えば、スピードバキュームによる)、3)気泡のない新鮮な水和バッファーの調製などがあります。制御マイクロバブルの作製が適切な生成物をもたらすが、放射性標識後に生成される生成物が得られない場合、追加の考慮事項が作用する可能性があります。キレート化反応の温度と長さは、現在のプロトコールが検証されている60-80°Cおよび0-2時間の時間枠の範囲外である可能性があります。さらに、銅-64または他の放射性同位元素の比活性が、現在の研究に関連するものよりも大幅に低い可能性がある可能性があります。これにより、同じレベルの活性で標識されるポルフィリン種の割合が高くなり(例:このプロトコルが検証された10:1のポルフィリン:銅過剰よりも低い)、マイクロバブルの活性化を阻害する可能性があります。
マイクロバブル製造の成功における上記の課題の多くは、特にユーザーがマイクロバブル合成に不慣れな場合は、放射性標識がない場合に、最初に記載されたマイクロバブル製造を試すことによって軽減することができます。最初に制御された非キレート化マイクロバブルを生成し、その後、「冷たい」非放射性銅で標識プロトコルをエッセイすることをお勧めします。上述したように、この「冷たい」キレート化プロセスは、放射性標識マイクロバブルの代表的な物理化学的特性を得るために不可欠です。「コールド」キレート化は、記載されたプロトコルに加えられた任意の変更(例えば、キレート化温度、体積、反応時間、ポルフィリン:銅比の変更、放射性同位体、代替キレート剤)が所望のマイクロバブル物理化学的特性を保持することを保証するための重要な第一歩としても役立つ。
そのような変化の1つは、代替のキレート剤とプローブの使用かもしれません。現在のプロトコルの制限は、商業的に入手できないキレート剤の基本的な使用です。そのため、パイロ脂質の代わりに市販のキレート剤および蛍光プローブの使用を可能にする修飾(プロトコルのセクション8)が提示されます。DiIまたはDTPA脂質をパイロ脂質の代替として組み込んだことに関連する試験データが得られました(図6)。DiIは、マイクロバブルFUSメカニズムおよびモデル薬物剤49,50,51を研究するためにマイクロバブルシェルに組み込まれた市販のプローブである。私たちの知る限り、これはDTPA脂質マイクロバブルの最初の報告です。パイロ脂質をこれらの代替部分にうまく置き換えることは、現在のマイクロバブル製造および標識プロトコルの多様性を物語っています。これは、より広範なプローブ、特にリン脂質につながれているプローブやリン脂質間で統合できるプローブに適用できる可能性があります。
このプロトコルでは置換可能ですが、パイロ脂質は、単一の有機分子内に相補的な放射線イメージングおよび蛍光追跡能力を秘めているという独自の利点を提供します。このマルチモダリティは、マイクロバブルシェルの送達と生体内分布のモニタリングに有利です。これは、パイロ脂質組成物≥10モル%を使用する場合に特に当てはまります。組成が増加すると、マイクロバブルシェル(および一般に超分子構造)内のパイロ脂質はますます蛍光的に消光されるようになる15。粒子が破壊されると、高分子ポルフィリン組成物は大幅に強い蛍光シグナルをもたらします(補足図3)。この蛍光消光は、マイクロバブルシェルの運命をイメージングする際の追加の読み出しとして役立ちます。例えば、PETは絶対的な殻の送達/生体内分布の定量化を容易にしますが、蛍光イメージングは、そのような蓄積が粒子の破壊と関連しているかどうかを捉えることができます。
しかし、高パイロ脂質モル組成物の限界の1つは、マイクロバブルのサイズと収率に及ぼす影響です。市販の脂質マイクロバブル製剤内で宿主脂質を増加したパイロ脂質組成物に置き換えると、より大きな気泡、より低いマイクロバブル収率、およびより不安定なマイクロバブルを生成することがわかった15。参照を容易にするために、これらの知見は、現在の放射性標識プロトコルが検証されている1 mol%、10 mol%、および30 mol%のパイロ脂質組成物について 、補足図3 にまとめられています。プローブの添加によるマイクロバブルサイズのこの変化は、パイロリピッドに限ったことではありません。例えば、5 mol%の組成で、市販の脂質マイクロバブル製剤にDiIを封入すると、マイクロバブルの収率は10倍に減少し、マイクロバブルのサイズは60%以上増加しました(図6)。これに対し、5 mol% のパイロ脂質組成物は、収量、体積平均サイズ、またはピーク体積に有意な差は見られませんでしたが、マイクロバブル数平均サイズは 25% 増加しました15。さらに、パイロ脂質組成を1 mol%から30 mol%に増加させても、貝殻の循環経路およびクリアランス経路には大きな影響を与えない15。しかし、プローブレスまたは市販の製剤に関連するサイズ分布の保持が望ましい場合、現在のマイクロバブル作製および放射性標識プロトコルは、1mol%のパイロ脂質組成物を使用して適用できます。この少量のパイロ脂質インクルージョンは、ベースラインのプローブレス製剤に関連するサイジングまたは収量パラメーターを大きく変更しません(補足図3)。しかし、それは、高パイロ脂質組成物に関連する強力な活性化可能な蛍光能力を失うという犠牲を払っています。妥協的な解決策は、10 mol%のパイロ脂質組成物を選択することです。全体として、1 mol%という低いパイロ脂質組成物が現在の放射性標識プロトコルに適合していたことを考えると、マイクロバブルのサイジング、収率、および蛍光能力を調整できる大きなモジュール性が存在します。
全体として、現在の放射性標識プロトコルの包括的な適応性により、序論で概説した多数の放射性標識マイクロバブルアプリケーションが可能になります。おそらく、マイクロバブル-FUS分野の現在の状況に最も関連性があるのは、画像誘導薬物送達プラットフォーム設計のためのマイクロバブルシェル運命の放射線追跡です。放射性標識マイクロバブルのこの応用は、最近の研究15で調査されました。現在の放射性標識プロトコルは、アシル鎖の長さと電荷が異なる一連のマルチモーダル銅-64標識ポルフィリンマイクロバブルを生成するために適用されました。これは、臨床および前臨床の文献で最も広く研究されている脂質マイクロバブル組成を表しています。健康なマウスと担がんマウスのin vivoガス溶解、シェルクリアランス、生体内分布、および分解速度を超音波、PET、および蛍光イメージングによってモニターし、この種のものとしては初めての縦断的かつ体系的な脂質マイクロバブル薬物動態研究を行いました。主な調査結果には以下が含まれます:1)マイクロバブルのコアは数分で溶解し、マイクロバブルの脂質鎖の長さが長くなると、中性マイクロバブルの溶解が遅くなり、アニオン性マイクロバブルの溶解が速くなります(市販の製剤に最も類似しています)。2)残った殻は血液中を24時間以上循環し、肝胆道/脾臓/糞便経路を通じて除去されました。3)このようなクリアランスはマイクロバブル組成に依存しており、鎖長の短い殻は高い肝臓処理を受け、鎖長の長い殻は脾臓の取り込みが高いことを示しました。4)マイクロバブルシェルは、注射後の最初のPET時点(1時間)という早い時期に、周囲の組織と比較して腫瘍に優先的に蓄積し、C18中性シェルマイクロバブルは、同様のレベルのFUS媒介血管開放(Evans blueの同時投与によって決定される)を促進するにもかかわらず、最も高い受動的およびFUS増強取り込み(治療後3.5時間で最大増強)を示しました。5)一般に、腫瘍シェル送達におけるFUS増強は控えめであり、すべてのマイクロバブル製剤間で同等ではなく、FUS増強カーゴロードシェル送達は多様なマイクロバブル間で遍在的に達成できず、より高いFUS圧力を必要とする可能性があることを実証しています。6)腫瘍、肝臓、脾臓内のマイクロバブルシェルは、主に血管外腔に見られました。7)鎖長が短い貝殻はより速い分解を受け、腫瘍は貝殻断片の分解率が最も高いことを示しました。これらの知見は、マイクロバブルFUS分野における従来の常識を解き明かし、シェルベースの腫瘍送達のための最適なマイクロバブル設計をめぐる特定の仮定を覆しました。主な初期ガイダンスには、脾臓標的用の薬物負荷マイクロバブルを製剤化するためのC18脂質の使用、肝臓標的用のC16脂質、超音波造影イメージングとより長い血液循環のための中性長鎖、腫瘍標的に対する中性C18脂質の使用、オールインワンシェル負荷脂質マイクロバブル内での肝脾毒性を有する薬物の禁忌使用、およびベースライン血管透過性が低い腫瘍に対するそのようなシステムの適用が含まれていました。したがって、この研究は、より最適なマイクロバブル設計に情報を提供できる構造活性関係を開始し、さらなる探索の青写真を提供しました。これらはすべて、現在の放射性標識プロトコルによって可能になりました。この能力は、得られたマイクロバブル薬物動態データセットを使用して、自動PET/CT臓器セグメンテーションに適応した深層学習ツールを構築することでさらに強化され、より効率的な薬物動態データ分析が可能になりました。52名
現在のプロトコルの焦点は、脂質マイクロバブルの放射性標識に置かれました。しかし、貨物を装填した超音波剤の設計の文脈では、ナノ液滴や高分子マイクロバブルを見落とすことはできません。ナノ液滴は、脂質、タンパク質、またはポリマーシェルによってカプセル化された液体パーフルオロカーボンコアからなる相変化システムです。高強度のFUSでは、これらのナノ液滴は液体コアの音響気化によってマイクロバブルに変換されます。このFUS活性のメカニズムとナノ液滴の小型化は、シェルロード送達に潜在的な利点をもたらします:1)in vivoでの安定性が長い、2)組織内での透過性が高く、腫瘍送達が高い、3)血管活性と血管外活動の両方に対する施設、4)音響気化後の迅速な薬物放出50,53,54.したがって、貨物を装填したナノ液滴の放射性標識は、将来の研究における放射線追跡および画像誘導治療計画にも有益です。現在の放射性標識プロトコルは、縮合法によって作製されたナノ液滴に容易に組み込むことができ、これにより、ナノ液滴シェル35内でポルフィリン-脂質のローディングが可能になることが以前に示されている。
高分子マイクロバブルはまた、その硬くてモジュール化されたシェルにより、薬物ローディング、カーゴカプセル化、およびポリマーシェルの厚さと材料組成の調節を通じて薬物ローディングの同調性に対する推定安定性が高いため、脂質マイクロバブルよりもシェルロード薬物送達の利点を示すとも考えられている55,56,57.その安定性により、高分子マイクロバブルは、現在のプロトコルが克服するために設計された脂質マイクロバブルのような放射性標識の制限に遭遇しない可能性がある。しかし、現在のプロトコルは、1)マイクロバブルの特性評価と2)キレート化効率の2つのアカウントで、高分子マイクロバブル放射性標識に情報を提供するために引き続き使用できます。高分子マイクロバブル放射性標識は、この研究では限定的であるが、典型的には、キレート剤(例えば、DOTAおよびNOTA)による高分子シェルの表面を官能基化し、続いて同位体を添加し、加熱し、および洗浄して遊離同位体を除去することを含む27,58。既存の脂質マイクロバブル放射性標識プロトコルと同様に、これらの報告は標識後のマイクロバブルの物理化学的特性を特徴付けていません。したがって、現在のプロトコルは、あらゆるタイプのマイクロバブルシェルを放射性標識する際に、「コールド」ラベリングと特性評価の使用を標準化するための青写真として使用できます。さらに、高分子マイクロバブル放射性標識の収率には改善の余地がある(キレート剤グラフトマイクロバブルについては42%〜85%の範囲が報告されている58)。この研究における強力で効率的な放射性同位体キレート剤としてのポルフィリンの使用は、銅キレート化に先立って既存のポルフィリン-ポリマーシェル結合技術59を適応させることにより、将来の研究に応用できる可能性がある。全体として、高分子マイクロバブルは脂質マイクロバブルほど人気がありません。脂質マイクロバブルは、現在ヒトでの使用が臨床的に承認されている唯一のシェルバリアントであり、治療用マイクロバブル-FUSプラットフォームのより迅速な翻訳に最適な材料となっています。さらに、ポリマーと脂質シェルを用いた治療用FUSの比較は、脂質シェルが高強度FUSパラダイム60,61,62において、より大きな血管透過化、より迅速なFUS誘発薬物放出、より強力な組織アブレーション、およびより速い温度上昇を促進することを示唆している。したがって、脂質マイクロバブルは、他のシェルバリアントよりも治療用FUSアプリケーションについてより広く研究されています。したがって、脂質マイクロバブルに関する現在の放射性標識プロトコルの焦点は、より広範なマイクロバブル-FUS分野の焦点と一致しています。
放射性標識マイクロバブルは、マイクロバブルFUSメカニズムと貨物積載マイクロバブルの設計を知らせるだけでなく、放射線治療の有用性も提案しています27。FUSと放射線治療活性を1つの薬剤内で組み合わせることへの関心は、マイクロバブルFUSが放射線療法と相乗的に作用して放射線療法の抗腫瘍反応を強化するという証拠に基づいています16。現在の放射性標識プロトコルは、銅-64の代わりに銅-67(放射線療法63により適している)を使用して、そのような放射線光学マイクロバブルを生成するように適合させることができる。しかし、現在の脂質マイクロバブル放射性標識戦略に基づいて完了した薬物動態研究では、マイクロバブルシェル15の肝脾細胞の蓄積が高いことが示された。このオフターゲット蓄積は、放射性標識マイクロバブルを二重のFUS/放射線療法剤として適用した場合に重要な考慮事項です。
これに関連して、肝脾毒性緩和戦略が必要になります。例えば、Navarro-BecerraとBorden64によって徹底的にレビューされたように、多くの著者が、ビオチン/アビジンカップリング、および静電吸収を通じて、腫瘍標的リガンド(VEGFR2 mAb、RGD、葉酸など)を持つ脂質マイクロバブルを官能基化しています。この生物学的機能化は、腫瘍へのシェルロードカーゴ送達を増加させ、オフターゲット組織の蓄積を減少させ、腫瘍治療を強化する32,65,66。官能基化は通常、本質的に静電的であるため、現在の放射性標識およびマイクロバブル製造プロトコルは、リガンド吸収前にそのまま使用できます。共有結合的に組み込む必要がある熱感受性ペプチドおよびタンパク質リガンド(例えば、PEG脂質標識ペプチド)に対応するために、放射性標識プロトコルの調整が必要になる場合があります。これらの場合、反応温度を37°Cに下げながらキレート化反応時間を延長することができ、このアプローチにより、標的化能力を維持しながらリポタンパク質ナノ粒子内で効率的なポルフィリン-銅キレート化が得られた34。しかし、放射性標識マイクロバブルの表面に標的リガンドを添加することで、高線量の銅-67マイクロバブル放射線療法に伴う肝脾の毒性懸念が完全に緩和される可能性は低い。例えば、p-セレクチン抗体でマイクロバブルを機能化すると、マウスでの腫瘍送達が2倍になり、肝臓の蓄積が4倍に減少したが、肝臓の蓄積は注射後1時間で依然として9%ID/g(腫瘍の蓄積の2倍)という実質的なものであった32。リガンドを標的とすることに代わるより有望な方法は、腫瘍内注射による放射線治療用マイクロバブルの局所領域送達である可能性があります。マイクロバブルを投与する非定型の手段ですが、Bismuthら39は、マイクロバブルの腫瘍内注射が、単一の60 s(MI 0.9)FUS治療で強力な腫瘍アブレーション(50%組織穿孔)を達成することを示しています。上記のマイクロバブルに追加の放射線治療能力がある場合、さらに強力な腫瘍アブレーションが予想されます。この目的のために、将来の研究は、放射性標識マイクロバブル中の酸素コアを使用して、腫瘍の低酸素症67,68を緩和することにより、マイクロバブル-FUS/放射線療法の相乗効果をさらに強化することも有益である可能性がある。二重FUS/放射線治療薬として適用する前に、腫瘍内に送達された放射性標識マイクロバブルを薬物動態学的に評価して、局所領域送達が全身漏出を引き起こさないことを確認する必要があります。このことは、今回の研究で実現可能になった放射性標識マイクロバブルの提案されたすべての用途における放射性トレーシングの本質的な重要性を浮き彫りにしています。
要約すると、現在のプロトコルはマイクロバブル放射性標識の進歩をもたらします。その集合的な利点には、強化された「ゼロ」キレート剤の組み込み、高いキレート化効率、標識後の遊離放射性同位元素またはキレート剤精製の欠如、マイクロバブル物理化学的特性の保存、多様なマイクロバブル製剤にわたる汎用性の高いアプリケーション、代替キレート剤および蛍光色素への適応性、キレート剤組成および関連するマルチモダリティおよび粒子サイズのカスタマイズが含まれます。最終的には、マイクロバブル-FUSのメカニズムの洞察とセラノスティックな能力を進歩させることができる、カスタマイズされたラジオおよび/または蛍光活性マイクロバブルを生成します。これらのアプリケーションには、代表的な定量的薬物動態データの取得、マイクロバブルマルチモーダルイメージング機能の拡大、画像誘導療法の最適化の促進、相乗的なマイクロバブルFUSラジオ(および/またはポルフィリン)療法の実現が含まれます。
開示事項
著者らは、利益相反を報告していません。
謝辞
Deborah Scollard氏とTeesha Komal氏(University Health Network Spatio-Temporal Targeting and Amplification of Radiation Response (STTARR) program、オンタリオ州トロント)の技術サービスと指導に感謝します。また、共焦点顕微鏡法の技術支援をいただいたMark Zheng氏とAlex Dhaliwal博士、および関連機器を提供してくださったAdvanced Optical Microscopy Facility(オンタリオ州トロント)にも感謝します。カナダ衛生研究所、テリー・フォックス研究所、カナダ自然科学工学研究評議会、カナダイノベーション財団、プリンセス・マーガレットがん財団、カナダ研究チェアプログラム、マクラフリンセンター、バニエ奨学金プログラム、オンタリオ大学院生奨学金プログラム、カナダ前立腺がん、ピーターバラK.M.ハンター慈善財団。
資料
| Name | Company | Catalog Number | Comments |
| 64CuCl2 | Washington University School of Medicine, Mallinckrodt Institute of Radiology | N/A | Order in small volume (<10 µL) dissolved in 0.1 N HCl |
| Acetic acid | Any company | ≥ 95% purity | |
| Aluminum foil | Any company | ||
| Ammonium acetate | Any company | Purity: ≥ 98% | |
| Balance - analytical | Any company | Able to measure down to 0.1 mg | |
| Bath sonicator | Any company | Can be heated to 69 oC | |
| CC aperture - 30 micron | Beckman Coulter | A36391 | Particle diameter range: 0.6-18 um |
| CC electrolyte | Beckman Coulter | 8546719 | Isoton II diluent |
| CC Software | Beckman Coulter | Multisizer 4e | |
| Centrifuge filter units (0.5 mL 30,000 MWCO) with compatible microcentrifuge tubes | MilliporeSigma | UFC503096 | Amicon Ultra - 0.5 mL |
| Centrifuge tubes - 15 mL with caps | Any company | ||
| Chloroform | Any company | Purity: ≥ 99.8% | |
| Coulter counter | Beckman Coulter | B43905 | Multisizer 4e Coulter Counter |
| Cover slips | VWR | 48393081 | VWR micro cover glass |
| CuCl2 | Any company | Ensure not oxidized | |
| CuCl2 | |||
| Cuvette- quarts, 1 cm path length | Any company | ||
| Cuvettes - 10 mL plastic for CC measurements | Beckman Coulter | A35471 | Coulter Counter Accuvette ST |
| ddH2O | Any company | Can be obtained through an ultrapure water purification system | |
| DiI (1,1'-Dioctadecyl-3,3,3',3'-Tetramethylindocarbocyanine Perchlorate) | Any company | Powder form | |
| Dose calibrator | Any company | Able to read copper-64 | |
| DPPA (1,2-dipalmitoyl-sn-glycero-3-phosphate (sodium salt)) | Avanti Polar Lipids | 830855P | Powder form |
| DPPC (1,2-dipalmitoyl-sn-glycero-3-phosphocholine) | Avanti Polar Lipids | 850355P | Powder form |
| DPPE-MPEG (1,2-dipalmitoyl-sn-glycero-3-phosphoethanolamine-N-[methoxy(polyethylene glycol)-5000] (ammonium salt)) | Avanti Polar Lipids | 880200P | Powder form |
| DTPA-lipid (1,2-dipalmitoyl-sn-glycero-3-phosphoethanolamine-N-diethylenetriaminepentaacetic acid (ammonium salt)) | Avanti Polar Lipids | 790106P | Powder form |
| EDTA (Ethylenediaminetetraacetic acid) | Any company | ||
| Gamma counter | Any company | Able to read copper-64 | |
| Gamma counting tube push caps | Globe Scientific | 22-171-665 | Flanged plug caps for 12 mm tubes |
| Gamma counting tubes | Sarstedt | 55.1579 | 5 mL, 75 x 12 mm, PS |
| Glass beaker - 250 mL | Any company | Able to withstand temperatures up to 100 oC | |
| Glass drying oven | Any company | Can be heated to 80 oC | |
| Glass microliter syringes - 25, 50, 100, 1000 µL | Any company | Compatible with organic solvents | |
| Glass scintillation vials - 20 mL | VWR | 66022-081 | VWR® Scintillation Vials, Borosilicate Glass, with Screw Caps, With pulp foil liner |
| Glass vials - 0.5 dram | VWR | 66011-020 | VWR Vial 1/2 dram, with black phenolic screw cap and polyvinyl-faced pulp liner |
| Glycerol | Sigma Aldrich | G7757-1L | Purity: ≥ 99.0% |
| Graduated pipette/gun | Any company | ||
| Hot/stir plate | Equipped with temperature prob for automatic tempearture control | ||
| Hydrochloric acid - 0.1 N | Any company | ||
| iTLC plates | Agilent | A120B12 | iTLC-SA chromatography paper |
| Laboratory tissues | Any company | ||
| Media vaccuum filtration unit | Any company | 0.22 micron pore size, PES membrane, 500 mL funnel capacity | |
| Methanol | Any company | Purity: ≥ 99.8%, HPLC grade, meets ACS specifications | |
| Microcentrifuge tubes non sterile - 1.5 mL | Any company | ||
| Microcentrifuge tubes sterile - 1.5 mL | Any company | ||
| Micropipetes - p1000, p200, p20, p10 | Any company | Ensure are calibrated | |
| Microscope slides | Fisher Scientific | 12-550-15 | Superfrost Plus Microscope Slides Precleaned |
| Needles - 18 G | Sterile | ||
| Parafilm | Any company | ||
| PBS | Sigma Aldrich | D8537-500ML | DPBS, modified, without calcium chloride and magnesium chloride, liquid, sterile-filtered, suitable for cell culture |
| PFP | FluoroMed | APF-N40HP | Purity: ≥ 99.8% |
| PFP line | Any company | 1/4 inch diameter plastic hose cut about 50 cm in length | |
| PFP regulator | Swagelok | SS-1RF4 and SS-4HC-1-4 | |
| pH meter | Any company | ||
| pH standards 4 and 7 | Any company | ||
| Pipette tips for p1000, p200, p10 - non sterile | Any company | ||
| Pipette tips for p1000, p200, p10 - sterile | Any company | ||
| Plastic syringe - 1 mL | Any company | Sterile | |
| Propylene glycol | BioShop | PRO888.500 | Purity: ≥ 99.5% |
| Pyro-lipid | N/A | Made in-house | |
| Rubber tipped forceps | Any company | Mix of fine-tipped and flat/square edges recommended | |
| Scissors | Any company | ||
| Sodium hydroxide - 1 N | Any company | ||
| Sodium hydroxide - 10 N | Any company | ||
| Spectrofluorometer | Any company | Capable of 410 nm excitation and 600-850 nm emission | |
| Spectrofluorometry software | Horiba | FluorEssence | |
| Spectrometer | Any company | ||
| Syringe - 1 mL | Any company | Disposible, plastic, sterile | |
| Syringe filters - 0.2 micron pore size | Any company | Membrane material: PES or other compatible with ammonium acetate/acetic acid and PBS | |
| Test tube - 10 mL | |||
| Triton X-100 | Any company | ||
| Vacuum desicator/vacuum | Any company | ||
| Vialmix | Lantheus Medical Imaging | 515030-0508 | Referred to in protocol as a mechanical vial shaker |
| Weigh paper | Any company | To avoid losing product, cutting weigh paper into 3x3 cm squares is recommended |
参考文献
- Itani, M., Mattrey, R. F. The effect of inhaled gases on ultrasound contrast agent longevity in vivo. Mol Imaging Biol. 14 (1), 40-46 (2012).
- Kong, W. T., Wang, W. P., Huang, B. J., Ding, H., Mao, F. Value of wash-in and wash-out time in the diagnosis between hepatocellular carcinoma and other hepatic nodules with similar vascular pattern on contrast-enhanced ultrasound. J Gastroenterol Hepatol. 29 (3), 576-580 (2014).
- Wilson, S. R., Burns, P. N. Microbubble-enhanced us in body imaging: What role. Radiology. 257 (1), 24-39 (2010).
- Hynynen, K., Mcdannold, N., Vykhodtseva, N., Jolesz, F. Noninvasive mr imaging-guided focal opening of the blood-brain barrier bbb in rabbits. Radiology. 220 (3), 640-646 (2001).
- He, W., et al. Enhanced ablation of high intensity focused ultrasound with microbubbles: An experimental study on rabbit hepatic vx2 tumors. Cardiovasc Intervent Radiol. 34 (5), 1050-1057 (2011).
- Lipsman, N., et al. Blood-brain barrier opening in alzheimer's disease using mr-guided focused ultrasound. Nat Commun. 9 (1), 2336 (2018).
- Burke, C. W., Klibanov, A. L., Sheehan, J. P., Price, R. J. Inhibition of glioma growth by microbubble activation in a subcutaneous model using low duty cycle ultrasound without significant heating. J Neurosurg. 114 (6), 1654-1661 (2011).
- Dimcevski, G., et al. A human clinical trial using ultrasound and microbubbles to enhance gemcitabine treatment of inoperable pancreatic cancer. J Control Release. 243, 172-181 (2016).
- Haram, M., Hansen, R., Bouget, D., Myhre, O. F., Davies, C. L., Hofsli, E. Treatment of liver metastases with focused ultrasound and microbubbles in patients with colorectal cancer receiving chemotherapy. Ultrasound Med Biol. 49 (9), 2081-2088 (2023).
- Mainprize, T., et al. Blood-brain barrier opening in primary brain tumors with non-invasive MR-guided focused ultrasound: A clinical safety and feasibility study. Sci Rep. 9 (1), 321 (2019).
- Karakatsani, M. E., et al. Focused ultrasound mitigates pathology and improves spatial memory in alzheimer's mice and patients. Theranostics. 13 (12), 4102-4120 (2023).
- Aron, M., Vince, O., Gray, M., Mannaris, C., Stride, E. Investigating the role of lipid transfer in microbubble-mediated drug delivery. Langmuir. 35 (40), 13205-13215 (2019).
- Wang, S., Samiotaki, G., Olumolade, O., Feshitan, J. A., Konofagou, E. E. Microbubble type and distribution dependence of focused ultrasound-induced blood-brain barrier opening. Ultrasound Med Biol. 40 (1), 130-137 (2014).
- Huynh, E., Rajora, M. A., Zheng, G. Multimodal micro, nano, and size conversion ultrasound agents for imaging and therapy. Wiley Interdiscip Rev Nanomed Nanobiotechnol. 8 (6), 796-813 (2016).
- Rajora, M. A., et al. Quantitative pharmacokinetics reveal impact of lipid composition on microbubble and nanoprogeny shell fate. Adv Sci. 11 (4), 2304453 (2024).
- Leong, K. X., Sharma, D., Czarnota, G. J. Focused ultrasound and ultrasound stimulated microbubbles in radiotherapy enhancement for cancer treatment. Technol Cancer Res Treat. 22, 1-9 (2023).
- Li, Y., et al. Ultrasound-triggered release of sinoporphyrin sodium from liposome-microbubble complexes and its enhanced sonodynamic toxicity in breast cancer. Nano Research. 11, 1038-1056 (2017).
- Nomikou, N., Fowley, C., Byrne, N. M., Mccaughan, B., Mchale, A. P., Callan, J. F. Microbubble-sonosensitiser conjugates as therapeutics in sonodynamic therapy. Chem Commun. 48 (67), 8332-8334 (2012).
- Chakravarty, R., Hong, H., Cai, W. Positron emission tomography image-guided drug delivery: Current status and future perspectives. Mol Pharm. 11 (11), 3777-3797 (2014).
- Delalande, A., Leduc, C., Midoux, P., Postema, M., Pichon, C. Efficient gene delivery by sonoporation is associated with microbubble entry into cells and the clathrin-dependent endocytosis pathway. Ultrasound Med Biol. 41 (7), 1913-1926 (2015).
- Sheikov, N., Mcdannold, N., Vykhodtseva, N., Jolesz, F., Hynynen, K. Cellular mechanisms of the blood-brain barrier opening induced by ultrasound in presence of microbubbles. Ultrasound Med Biol. 30 (7), 979-989 (2004).
- Conway, G. E., Paranjape, A. N., Chen, X., Villanueva, F. S. Development of an in vitro model to study mechanisms of ultrasound-targeted microbubble cavitation-mediated blood-brain barrier opening. Ultrasound Med Biol. 50 (3), 425-433 (2024).
- Hu, S., Zhang, X., Unger, M., Patties, I., Melzer, A., Landgraf, L. Focused ultrasound-induced cavitation sensitizes cancer cells to radiation therapy and hyperthermia. Cells. 9 (12), 2595 (2020).
- Zhao, C., et al. Synergistically augmenting cancer immunotherapy by physical manipulation of pyroptosis induction. Phenomics. , (2024).
- Tachibana, K., Uchida, T., Ogawa, K., Yamashita, N., Tamura, K. Induction of cell-membrane porosity by ultrasound. Lancet. 353 (9162), 1409 (1999).
- Arif, W. M., et al. Focused ultrasound for opening blood-brain barrier and drug delivery monitored with positron emission tomography. J Control Release. 324, 303-316 (2020).
- Da Ros, V., et al. PVA-microbubbles as a radioembolization platform: Formulation and the in vitro proof of concept. Pharmaceutics. 15 (1), 217 (2023).
- Tartis, M. S., et al. Dynamic micropet imaging of ultrasound contrast agents and lipid delivery. J Control Release. 131 (3), 160-166 (2008).
- Willmann, J. K., et al. Targeted microbubbles for imaging tumor angiogenesis: Assessment of whole-body biodistribution with dynamic micro-pet in mice. Radiology. 249 (1), 212-219 (2008).
- Ingram, N., et al. Ultrasound-triggered therapeutic microbubbles enhance the efficacy of cytotoxic drugs by increasing circulation and tumor drug accumulation and limiting bioavailability and toxicity in normal tissues. Theranostics. 10 (24), 10973-10992 (2020).
- Hernández-Gil, J., et al. Development of 68ga-labelled ultrasound microbubbles for whole-body pet imaging. Chem Sci. 10 (215), 5603-5615 (2019).
- Warram, J. M., et al. Biodistribution of p-selectin targeted microbubbles. J Drug Target. 22 (5), 387-394 (2014).
- Liu, T. W., Macdonald, T. D., Shi, J., Wilson, B. C., Zheng, G. Intrinsically copper-64-labeled organic nanoparticles as radiotracers. Angew Chem Int Ed Engl. 51 (52), 13128-13131 (2012).
- Rajora, M. A., et al. Tailored theranostic apolipoprotein e3 porphyrin-lipid nanoparticles target glioblastoma. Chem Sci. 8 (8), 5371-5384 (2017).
- Yoo, K., Dhaliwal, A., Chen, J., Sheeran, P. S., Zheng, G. Synthesis and characterization of multi-modal phase-change porphyrin droplets. J Vis Exp. 176, e62665 (2021).
- Lovell, J. F., et al. Porphysome nanovesicles generated by porphyrin bilayers for use as multimodal biophotonic contrast agents. Nat Mater. 10 (4), 324-332 (2011).
- Huynh, E., Jin, C. S., Wilson, B. C., Zheng, G. Aggregate enhanced trimodal porphyrin shell microbubbles for ultrasound, photoacoustic, and fluorescence imaging. Bioconjug Chem. 25 (4), 796-801 (2014).
- Mcmahon, D., Hynynen, K. Acute inflammatory response following increased blood-brain barrier permeability induced by focused ultrasound is dependent on microbubble dose. Theranostics. 7 (16), 3989-4000 (2017).
- Bismuth, M., Katz, S., Rosenblatt, H., Twito, M., Aronovich, R., Ilovitsh, T. Acoustically detonated microbubbles coupled with low frequency insonation: Multiparameter evaluation of low energy mechanical ablation. Bioconjug Chem. 33 (6), 1069-1079 (2022).
- Kutscher, H. L., et al. Threshold size for optimal passive pulmonary targeting and retention of rigid microparticles in rats. J Control Release. 143 (1), 31-37 (2010).
- You, Y., et al. Porphyrin-grafted lipid microbubbles for the enhanced efficacy of photodynamic therapy in prostate cancer through ultrasound-controlled in situ accumulation. Theranostics. 8 (6), 1665-1677 (2018).
- Chen, X., Qin, B., Whitehurst, D., Helfield, B., Lavery, L., Villanueva, F. S. Sonodynamic therapy using protoporphyrin ix encapsulated microbubbles inhibits tumor growth. 2017 IEEE International Ultrasonics Symposium. , 1-4 (2017).
- Cheng, M. H. Y., et al. Targeted theranostic 111in/lu-nanotexaphyrin for spect imaging and photodynamic therapy. Mol Pharm. 19 (6), 1803-1813 (2022).
- Cheng, M. H. Y., Cevallos, A., Rajora, M. A., Zheng, G. Fast, facile, base-free microwave-assisted metallation of bacteriochlorophylls and corresponding high yield synthesis of tookad. J Porphyrins Phthalocyanines. 25 (07n08), 703-713 (2021).
- Macdonald, T. D., Liu, T. W., Zheng, G. An MRI-sensitive, non-photobleachable porphysome photothermal agent. Angew Chem Int Ed Engl. 53 (27), 6956-6959 (2014).
- Shao, S., et al. Functionalization of cobalt porphyrin-phospholipid bilayers with his-tagged ligands and antigens. Nat Chem. 7 (5), 438-446 (2015).
- Teh, J. H., et al. A kit-based aluminium-[(18)f]fluoride approach to radiolabelled microbubbles. Chem Commun (Camb). 57 (88), 11677-11680 (2021).
- Rajora, M. A. . Supramolecular Structure-Enabled Delivery of Porphyrin to Glioblastomas Beyond the Blood-Brain Barrier [Doctor of Philosophy thesis]. , (2024).
- Carugo, D., et al. Modulation of the molecular arrangement in artificial and biological membranes by phospholipid-shelled microbubbles. Biomaterials. 113, 105-117 (2017).
- Dhaliwal, A. . Utilizing Porphyrin to Improve Ultrasound-Activated Supramolecular Agent Design for Solid Tumor Delivery [Doctor of Philosophy thesis]. , (2023).
- Kilroy, J. P., Klibanov, A. L., Wamhoff, B. R., Bowles, D. K., Hossack, J. A. Localized in vivo model drug delivery with intravascular ultrasound and microbubbles. Ultrasound Med Biol. 40 (10), 2458-2467 (2014).
- Dhaliwal, A., et al. Deep learning for automatic organ and tumor segmentation in nanomedicine pharmacokinetics. Theranostics. 14 (3), 973-987 (2024).
- Shakya, G., Cattaneo, M., Guerriero, G., Prasanna, A., Fiorini, S., Supponen, O. Ultrasound-responsive microbubbles and nanodroplets: A pathway to targeted drug delivery. Adv Drug Deliv Rev. 206, 115178 (2024).
- Honari, A., Merillat, D. A., Bellary, A., Ghaderi, M., Sirsi, S. R. Improving release of liposome-encapsulated drugs with focused ultrasound and vaporizable droplet-liposome nanoclusters. Pharmaceutics. 13 (5), 609 (2021).
- Barmin, R. A., et al. Polymeric materials for ultrasound imaging and therapy. Chem Sci. 14 (43), 11941-11954 (2023).
- Chen, Y., Liang, Y., Jiang, P., Li, F., Yu, B., Yan, F. Lipid/PLGA hybrid microbubbles as a versatile platform for noninvasive image-guided targeted drug delivery. ACS Appl Mater Interfaces. 11 (45), 41842-41852 (2019).
- Barmin, R. A., et al. Engineering the acoustic response and drug loading capacity of pbca-based polymeric microbubbles with surfactants. Mol Pharm. 19 (9), 3256-3266 (2022).
- Barrefelt, A. A., et al. Multimodality imaging using SPECT/CT and MRI and ligand functionalized 99mTc-labeled magnetic microbubbles. EJNMMI Res. 3 (1), 12 (2013).
- Song, R., Hu, D., Chung, H. Y., Sheng, Z., Yao, S. Lipid-polymer bilaminar oxygen nanobubbles for enhanced photodynamic therapy of cancer. ACS Appl Mater Interfaces. 10 (43), 36805-36813 (2018).
- Böhmer, M. R., Chlon, C. H. T., Raju, B. I., Chin, C. T., Shevchenko, T., Klibanov, A. L. Focused ultrasound and microbubbles for enhanced extravasation. J Control Release. 148 (1), 18-24 (2010).
- Zhang, S., et al. Compare ultrasound-mediated heating and cavitation between flowing polymer- and lipid-shelled microbubbles during focused ultrasound exposures. J Acoust Soc Am. 131 (6), 4845-4855 (2012).
- Cao, Y., et al. Drug release from phase-changeable nanodroplets triggered by low-intensity focused ultrasound. Theranostics. 8 (5), 1327-1339 (2018).
- Krasnovskaya, O. O., et al. Recent advances in (64)cu/(67)cu-based radiopharmaceuticals. Int J Mol Sci. 24 (11), 9154 (2023).
- Navarro-Becerra, J. A., Borden, M. A. Targeted microbubbles for drug, gene, and cell delivery in therapy and immunotherapy. Pharmaceutics. 15 (6), 1625 (2023).
- Fan, C. -. H., et al. Antiangiogenic-targeting drug-loaded microbubbles combined with focused ultrasound for glioma treatment. Biomaterials. 34 (8), 2142-2155 (2013).
- Luo, T., et al. Ultrasound-mediated destruction of oxygen and paclitaxel loaded dual-targeting microbubbles for intraperitoneal treatment of ovarian cancer xenografts. Cancer Lett. 391, 1-11 (2017).
- Fix, S. M., et al. Oxygen microbubbles improve radiotherapy tumor control in a rat fibrosarcoma model - a preliminary study. PLoS One. 13 (4), e0195667 (2018).
- Eisenbrey, J. R., et al. Sensitization of hypoxic tumors to radiation therapy using ultrasound-sensitive oxygen microbubbles. Int J Radiat Oncol Biol Phys. 101 (1), 88-96 (2018).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved
当社はcookieを使用しています。
「続行」をクリックすることで、当社のcookieへの同意となります。