Method Article
Fabricating and Labeling Microbubbles with Fluorescent and Radioactive Tracers
요약
이 프로토콜은 지질 마이크로버블의 제조와 마이크로버블 물리화학적 특성을 보존하는 정제가 없는 >95% 라벨링 효율을 가진 호환 가능한 원팟 마이크로버블 방사성 라벨링 방법을 설명합니다. 이 방법은 다양한 지질 마이크로버블 제형에 효과적이며 방사성 및/또는 형광 마이크로버블을 생성하도록 맞춤화할 수 있습니다.
초록
마이크로버블은 지질 껍질의 가스로 채워진 입자로, 혈관 초음파 조영제에서 혁신적인 암 치료 플랫폼으로 진화했습니다. 치료용 집속 초음파(FUS)와 결합하면 생리학적 장벽(예: 혈뇌장벽)을 안전하고 국소적으로 극복하고, 다른 방법으로는 접근할 수 없는 암(예: 교모세포종 및 췌장암)에 약물을 전달하고, 신경퇴행성 질환을 치료할 수 있습니다. 마이크로버블-FUS의 치료제는 시너지 조합 방사선 요법, 멀티모달 이미징, 일체형 약물 로딩 및 마이크로버블 쉘 전달 등 새로운 방향으로 발전하고 있습니다.
방사성 추적자로 마이크로버블을 라벨링하는 것은 이러한 확장된 테라노스틱 기능을 확립하는 데 중요합니다. 그러나 기존 마이크로버블 방사성 표지 전략은 마이크로버블의 물리화학적 특성을 교란하고, 수명이 짧은 방사성 동위원소를 사용하며, 항상 안정적인 킬레이트화를 생성하지는 않는 것으로 알려진 정제 방법론에 의존합니다. 총체적으로, 이는 마이크로버블 방사성 방사선 영상의 정확성과 종양 방사성 동위원소 전달의 효율성을 둘러싼 모호성을 야기합니다.
이 프로토콜은 >95%의 방사성 동위원소 킬레이트화 효율을 달성하면서 미세버블 물리화학적 특성을 보존하는 새로운 원팟, 정제가 필요 없는 마이크로버블 라벨링 방법론을 설명합니다. 이 제품은 다재다능하며 아실 지질 사슬 길이, 전하 및 킬레이터/프로브(포르피린, DTPA, DiI) 조성이 다른 맞춤형 및 상업용 마이크로버블 제형에 성공적으로 적용할 수 있습니다. 그것은 ground-up microbubble 제작 도중 그리고 형광 및 multimodal 형광/방사성 재산의 모듈 커스터마이징 가능성으로 pre-made microbubble 정립에 적응하게 적용될 수 있습니다. 그러므로, 이 가동 가능한 방법은 기계론, 화상 진찰 및 치료 microbubble-FUS 응용을 전진해서 유용한 맞춤형, 추적 가능한 (라디오, 형광성, 또는 방사선/형광 활동적) multimodal microbubbles의 생산을 가능하게 합니다.
서문
마이크로버블은 단백질, 폴리머 또는 대부분의 경우 지질 껍질에 의해 안정화된 가스 코어를 가진 미크론 크기의 초분자 테라노스틱 제제입니다(그림 1A). 혈류량으로 주입될 때, microbubbles는 그들의 가스 중핵 1,2의 해체 이전에 분 긴 timeframe 동안 초음파에 의해 검출될 수 있는 가스/액체 공용영역을 유지합니다. 결과적으로, 마이크로버블의 첫 번째 임상적 사용은 실시간 초음파 영상 조영제였다3. 치료용 집속 초음파(FUS)의 발명으로 마이크로 버블 임상 유틸리티가 확장되었습니다. 저주파 FUS에 의해 자극될 때, microbubbles는 진동하고 일시적인 관 투과성에서 국소 조직 절제 4,5에 배열하는 표적으로 한, 조정 가능한 기계적인 힘을 생성한다. 그 결과, 지난 20년 동안 마이크로버블-FUS는 혈액뇌장벽(BBB) 개방, 종양(예: 췌장암, 뇌암, 간 전이성 암) 약물 및 이미징 프로브 전달, 신경퇴행성 질환 치료 및 암 절제 6,7,8,9,10,11에 대해 탐구되었습니다.
마이크로버블의 테라노스틱 무기고는 새롭고 흥미로운 방향으로 계속 발전하고 있습니다. 기존의 microbubble-FUS 전달 응용 분야는 상업용 microbubbles와 함께 치료 또는 이미징 화물의 공동 투여에 의존합니다. 마이크로버블 쉘/생물학적 상호 작용을 이해하고, 맞춤형 비상업적 마이크로버블 제형을 탐색하고, 마이크로버블 쉘에 직접 적재된 화물로 올인원 테라노스틱 마이크로버블을 생성함으로써 마이크로버블-FUS 전달 능력을 향상시키는 데 관심이 높아지고 있습니다 12,13,14. 실제로, 지질 microbubble 약 납품 학문의 대략 40%는 그런 포탄 적재된 microbubbles15를 이용한다. 이미징 및 약물 전달 외에도 microbubble-FUS는 암 방사선 요법을 강화하고(16), 초음파 역학 요법을 통해 양성 쉘 적재 제제의 항종양 효과를 활성화하는 데 유망한 것으로 나타났습니다17,18.
microbubble 암 신청에 있는 이 전통적인 그리고 확장된 방향은 microbubble 포탄에 방사성 tracer를 표기해서 전략적으로 전진될 수 있습니다. 올인원(all-in-one) 화물 적재 마이크로버블의 영역에서, 이러한 방사선 라벨링은 1) 이러한 적재된 마이크로버블 쉘의 온/오프 타겟 생체분포의 골드 스탠다드, 정량적 평가를 촉진하고, 2) 온-타겟 전달을 극대화하기 위해 마이크로버블 구성의 최적 선택을 알리는 약동학 구조-활성 관계를 도출하고, 3) 전략적이고 적절한 이미지 유도 적용 및 치료 계획(예: 조직 표적 유형, 선량 측정, off-target 안전 문제를 완화하기 위한 약물 선택, 기존 공동 치료 패러다임과 비교한 유용성) all-in-one 화물 적재 시스템15,19. 전임상 단계에서 마이크로버블 쉘 운명에 대한 이러한 이해는 더 광범위한 마이크로버블-FUS 작용 메커니즘을 조명할 수도 있습니다. 예를 들어, 마이크로버블 쉘에서 표적 세포로의 지질 전달은 FUS 기반 초음파전달 12,20에 영향을 미치는 것으로 나타났습니다. 따라서 이러한 전달을 이해하고 최적화하면 초음파 처리와 관련된 전임상 및 임상 마이크로버블-FUS 요법(체외 형질주입, 약물 전달, 종양 절제, 방사선 감작 및 초음파 역학 요법 20,21,22,23,24,25). 이중 초음파 및 방사선 이미징 시설은 또한 기존의 이중 제제 설계가 아닌 단일 제제에서 FUS 혈관 개방 및 치료 모니터링(예: BBB 개방 역학)을 가능하게 합니다26. 같은 맥락에서, 지질 마이크로버블 방사성 표지는 마이크로버블-FUS + 방사성의약품 공동 전달 플랫폼에 대한 올인원 단일 제제 마이크로버블-FUS/방사선 요법 대안으로 작용할 수 있습니다27.
마이크로 버블의 취약성은 그러한 라벨링에 대한 사소한 도전입니다. 기존의 모든 방사성 표지 전략은 마이크로 버블의 안정성과 크기를 교란시키는 것으로 알려진 정제 방법론에 의해 제한되며, 일부는 비효율적이고 불안정한 방사성 표지 28,29,30,31,32를 특징으로 합니다. 정제 요구 사항으로 인해 프로토콜이 더 길어집니다. 수명이 짧은 방사성 동위원소(예: 18F t1/2 1.8 h,28,29 99mTc t1/2 6 h,3268Ga t1/2 1 h31)의 사용과 결합하면 방사성 동위원소 붕괴와 관련된 비효율성이 발생하고 방사선 이미징 및 치료 계획 기간이 제한됩니다. 총체적으로 이러한 한계는 짧고 대표성이 없는 방사선 이미징, 부정확한 약동학 데이터, 비효율적인 종양 방사성 동위원소 전달의 위험을 초래합니다.
이 보고서에서는 포르피린의 강력하고 안정적인 금속 킬레이트 기능을 활용하여 이러한 한계를 극복합니다. 포르피린은 다양한 금속을 수용할 수 있는 고도로 공액된 평면 고리와 중앙 배위 부위를 가진 유기 헤테로사이클릭 거대분자입니다. 여기에는 구리-64(t1/2 12.7 h)와 같은 수명이 긴 방사성 동위원소, 양전자 방출 단층촬영(PET)을 이용한 방사성 의약품 및 γ 계수 타당성33이 포함된다. 지질 골격에 접합될 때, 포르피린은 초분자 구조에 쉽게 통합될 수 있으며 이후에 부모의 표지되지 않은 입자33,34의 특성을 유지하면서 속도, 높은 킬레이트화 효율 및 혈청 안정성으로 구리-64로 표지될 수 있습니다. 또한, 포르피린은 입자 파괴 시 복원되는 나노 및 미세 입자의 모듈식 자체 담금질로 형광 활성입니다. PET 및 γ 계수에 대한 보완적인 판독으로 벌크 및 현미경 껍질 운명 분석을 모두 용이하게 합니다(그림 1A)15.
포르피린-지질을 킬레이트로 사용함으로써 이러한 특성을 활용하여 기존 마이크로버블 방사성 표지 방법과 관련된 한계를 극복하는 새로운 단일 냄비, 정제가 필요 없는 마이크로버블 방사성 표지 방법(그림 1B, C)을 생성했습니다. 이 프로토콜은 >95%의 구리-64 킬레이트화 효율을 달성하고, 라벨링 후 정제가 필요하지 않으며, 미세버블 물리화학적 특성을 보존합니다. 그것은 그들의 활성화 (숫자 1B) 전에 지질 microbubbles의 "지상 위로" 제작으로 쉽게 통합될 수 있습니다. 그것은 다재다능하 아실 지질 사슬 길이 (C16에 C22), 책임 (중립성과 음이온성), 및 라디오 둘 다 형광 활동을 가진 microbubbles를 생성하는 porphyrin 지질 구성 (1 mol%, 10 mol%, 30 mol%)를 가진 관례와 상업적인 microbubble 정립의 맞은편에 성공적으로 적용될 수 있습니다. 그 적응력은 포르피린을 넘어서기도 합니다. 원-팟 프로토콜은 상업적으로 이용 가능한 대체 킬레이터(예: 디에틸렌트리아민 펜타아세테이트(DTPA)-지질) 및 형광단(예: DiI)을 사용하도록 수정할 수 있습니다. 또한 "스파이킹" 접근 방식을 통해 미리 만들어진 microbubble 제형에 라벨을 붙이도록 수정할 수 있습니다. 그러므로, 이 방법은 기계론의, 화상 진찰 및 치료 microbubble-FUS 신청 전진을 위해 유용한 맞춤형, traceable (라디오, 형광성, 또는 이중 방사선/형광성 활동적인) microbubbles의 생산을 가능하게 합니다. 아래 프로토콜은 지질 마이크로버블의 제조, 원팟 방사성 표지 프로토콜의 적용, 필요한 방사성 표지 및 물리화학적 특성 특성화, 잠재적 변형에 대해 설명합니다.
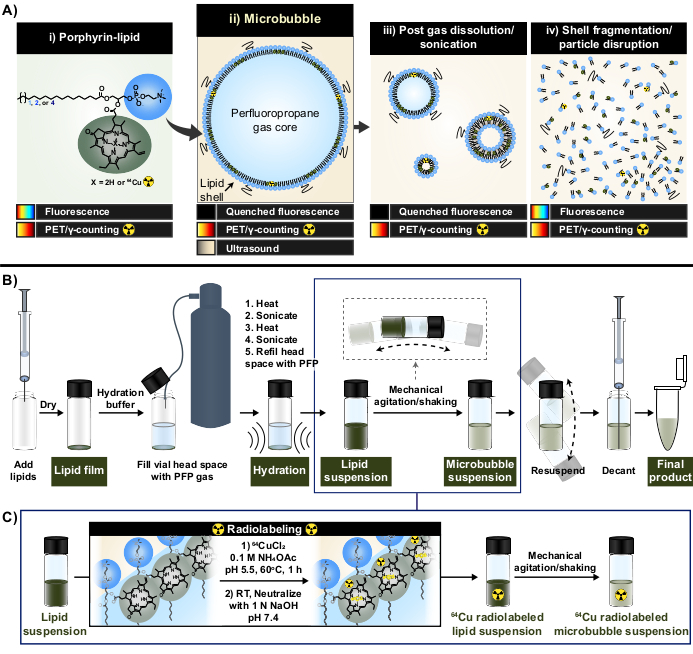
그림 1: 마이크로버블 제조 및 방사성 표지 프로토콜. (A) pyropheophorbide-a-lipid 형태의 포르피린 지질은 이 프로토콜 내에서 다중 모드 킬레이터 역할을 합니다. 구리-64(i)에 킬레이트화된 단량체로서 PET 및 이미징 기능이 있습니다. 그것의 형광은 입자 형태 (마이크로 버블 (ii) 및 용해 후 나노 자손 (iii))으로 담금질되고 입자 파괴 (iv)로 담금질됩니다. (B) 이 보고서에 설명된 지질막 수화/활성화 프로토콜은 처음부터 지질 마이크로버블을 생성하고 (C) 지질 현탁액 형성과 마이크로버블 활성화 사이의 원팟 방사성 표지의 통합. 이 그림은 Rajora et al.15의 허가를 받아 각색되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
프로토콜
1. 시약의 준비
- 아세트산 암모늄 완충액(0.1M, pH 5.5)을 준비합니다.
- 분석 저울을 사용하여 770.8mg의 아세트산암모늄을 계량지에 올려 칭량합니다. 계량된 양을 깨끗한 250mL 유리 비커에 옮깁니다.
- 눈금이 매겨진 피펫을 통해 측정한 90mL의 이중 증류수(ddH2O)를 비커에 추가합니다. 교반 막대를 추가하고 비커를 마그네틱 교반 플레이트에 올려 놓아 아세트산 암모늄을 용해시킵니다. 약간의 소용돌이를 생성하지만 용액이 튀지 않는 속도로 저어줍니다.
- pH 4 및 7 표준을 사용하여 기기 지침에 따라 pH 측정기를 교정합니다. 보정이 완료되면 pH 프로브를 아세트산 암모늄 버퍼에 삽입합니다.
- 용액에 아세트산 104μL를 첨가하고 저어 용해시킨 후 pH를 측정합니다.
참고: 이 시점에서 pH는 5.5에 가까워야 합니다. - 마이크로피펫을 사용하여 10N 수산화나트륨(또는 완충액이 너무 염기성이 되는 경우 염산)을 5-10μL 단위로 첨가하여 완충액의 pH를 조정합니다. 젓고 pH를 측정하고 필요에 따라 반복합니다. 첨가된 염기/산의 부피를 기록해 두십시오.
- ddH2O를 충분히 추가하여 총 100mL의 완충액을 생성합니다.
참고: 예를 들어, pH 조정 중에 45μL의 10N 수산화나트륨을 사용한 경우 9.851mL의 ddH2O를 비커에 추가합니다(100mL [목표 부피]- 90mL [단계 1.1.2] - 0.104mL [단계 1.1.4] - 0.045mL [단계 1.1.5] = 9.851mL). - 뚜껑이 있는 보관 용기로 옮기기 전에 버퍼를 마지막으로 한 번 철저히 저어줍니다.
- 기기 지침에 따라 pH 측정기를 청소하십시오.
주의 : 농축된 수산화나트륨 수성 및 염산은 피부 반응을 일으킬 수 있으므로 장갑을 사용하여 다루어야 합니다.
- 수화 완충액(PGG) 준비
- 인산염 완충 식염수(PBS)를 주사기에 흡입하고 말단에 폴리에테르설폰 0.2μm 공극 크기 주사기 필터를 장착합니다. PBS를 뚜껑이 있는 깨끗한 플라스틱 원심분리기 튜브에 여과합니다.
참고: 멤브레인이 PBS 및 아세트산암모늄과 호환되는 한 대체 멤브레인 재료(예: 폴리비닐리덴 플루오라이드)의 0.2μm 기공 주사기 필터를 사용할 수 있습니다. - 마이크로피펫을 통해 여과된 PBS, 프로필렌 글리콜 및 글리세롤을 8:1:1 부피 비율로 결합하여 수화 완충액(PGG라고도 함)을 만듭니다. 프로필렌 글리콜과 글리세롤을 첨가할 때 시약을 PBS에 천천히 피펫팅하기 전에 피펫 팁 표면에서 프로필렌 글리콜 또는 글리세롤의 잔류 방울을 흡인하고 닦아냅니다. PBS에서 투명한 끈 같은 점성 탁도를 볼 수 있습니다.
참고: p1000 마이크로피펫을 사용하여 PBS를 먼저 원심분리 튜브에 첨가한 다음 프로필렌 글리콜과 글리세롤을 첨가하는 것이 좋습니다. 따라서 피펫 팁에서 유체의 움직임이 더 이상 보이지 않고 시약에서 피펫 팁을 제거할 때 공기가 흡입되지 않을 때까지 마이크로피펫을 통해 천천히 흡인해야 합니다. 부피 표시가 있는 마이크로피펫 팁을 사용하여 이러한 표시와 일치하는 시약 부피를 선택하는 것이 좋습니다(예: 1mL 또는 5mL PGG를 만들고 각각 마이크로피펫 팁의 0.1mL 또는 0.5mL 표시를 사용하여 프로필렌 글리콜 및 글리세롤의 완전한 흡인을 시각화). 마이크로피펫 팁의 표면을 닦을 때 팁 개구부를 닦지 말고 측면만 닦으십시오. - 시약이 균질하게 용해될 때까지 용액의 피펫 팁을 사용하여 피펫을 위아래로 움직입니다. 용액에 기포가 유입되지 않도록 주의하십시오.
- 수화 버퍼의 완전한 혼합을 더욱 보장하려면 원심분리기 튜브에 캡을 씌우고 위아래로 천천히 회전합니다. 소용돌이치지 마십시오.
- 1000 x g 미만으로 20-30초(최소 온도 4°C, 최대 RT) 동안 튜브를 돌려 눈에 띄지 않는 기포를 제거합니다.
- 인산염 완충 식염수(PBS)를 주사기에 흡입하고 말단에 폴리에테르설폰 0.2μm 공극 크기 주사기 필터를 장착합니다. PBS를 뚜껑이 있는 깨끗한 플라스틱 원심분리기 튜브에 여과합니다.
- 수화/방사성 표지 완충액(AA-PGG) 준비
- 주사기 필터 0.1M, pH 5.5 아세트산 암모늄 완충액(1.1단계) 및 PBS를 1.2.1단계에 따라 별도의 튜브에 넣습니다.
- p1000 마이크로피펫을 통해 여과된 아세트산 암모늄 완충액, 여과된 PBS, 프로필렌 글리콜 및 글리세롤을 5:3:1:1 아세트산 암모늄 완충액의 원심분리 튜브에 결합합니다: PBS: 프로필렌 글리콜: 글리세롤 부피 비율. 나열된 순서에 따라 AA-PGG를 만들려면 1.2.2-1.2.5 단계에 따라 흡입, 혼합 및 원심분리 지침을 따르십시오.
- 순간 박막 크로마토그래피(iTLC) 용리액
- 최대 0.1g의 에틸렌디아민테트라아세트산(EDTA)의 무게를 측정하고 뚜껑이 있는 바이알에 옮깁니다. EDTA의 2% w/v 용액이 만들어지도록 ddH2O에 용해시킵니다(예: EDTA 50mg의 경우 ddH2O2.5mL 추가).
- 2% w/v EDTA 용액을 1.1단계의 암모늄 아세테이트 완충액과 9:1 v/v 비율(90% EDTA 용액, 10% 암모늄 아세테이트 완충액)로 결합합니다. 생성된 iTLC 용리액을 뚜껑을 닫고 보관합니다.
2. 지질막의 형성
참고: 이 절차는 포르피린-지질이 숙주 지질을 대체하고 총 지질의 30 mol%를 구성하는 상업용 마이크로버블인 Definity®를 모방한 조성을 가진 지질 필름의 형성을 간략하게 설명합니다. 그러나 방사성 표지 프로토콜은 다양한 지질 제형(C16, C18, C22 사슬 길이, 중성 또는 음이온 전하, 다양한 포르피린-지질 어금니 조성)에 적용할 수 있습니다. Supplementary Spreadsheet (Supplementary File 1)가 첨부되어 있으며, 이 스프레드시트는 설명된 제형 및 기타 제형에 대한 계산, 구성, 질량 및 재고 볼륨을 제공합니다. 모든 지질은 포르피린-지질, 피로페오포르바이드-a-지질(pyro-lipid)을 제외하고 상업적으로 입수할 수 있으며, 이의 합성은 이전에 상세히 기술되어 있다35,36.
- 보충 파일 1을 사용하여 필요한 필름의 수에 따라 각 지질에 필요한 총 질량을 측정합니다.
- 빈 0.5 드람 유리 바이알을 분석 저울에서 칭량합니다.
참고: 먼지는 성공적인 미세기포 형성을 방해합니다. 따라서 뚜껑을 닫지 않고 보관하는 경우 먼지/미립자를 제거하기 위해 가압된 공기를 바이알에 불어넣습니다. - 계량지에 1,2-dipalmitoyl-sn-glycero-3-phosphocholine(DPPC)의 무게를 잰다.
참고: 계량된 질량은 2.1단계에서 얻어야 하며 이후 단계에서 샘플 취급 중 손실을 설명하기 위해 추가로 0.5-1mg을 얻어야 합니다. - DPPC를 계량된 유리 바이알로 옮기고 다시 칭량하여 바이알의 지질 질량을 측정합니다. 이 과정을 통해 유리 바이알로의 지질 전달이 더 쉬워지고, 지질 분말 손실/유출이 감소하며, 지질 질량을 보다 정확하게 측정할 수 있습니다.
- 다른 지질에 대해 2.2-2-2.4-단계를 반복합니다: 1,2-dipalmitoyl-sn-glycero-3-phosphoethanolamine-N-[methoxy(polyethylene glycol)-5000] (DPPE-mPEG), 1,2-dipalmitoyl-sn-glycero-3-phosphate (DPPA) 및 C16 pyro-lipid.
참고: 파이로-지질이 계량 가능한 분말 형태가 아니라 알 수 없는 양의 필름 또는 분취액으로 사용할 수 있는 경우, 클로로포름에 용해시켜 앞서 설명한 바와 같이 Beer-Lambert 법칙을 사용하여 메탄올의 UV-Vis 흡광도 측정을 통해 농도를 계산할 수 있는 스톡을 형성할 수 있습니다35. - 마이크로피펫 또는 유리 주사기를 사용하여 유리 시험관에 다음 유기 용매 및 용액을 준비합니다: 1) 클로로포름, 2) 9:1 V/V 클로로포름: 메탄올 및 3) 65:35:8 클로로포름:메탄올:ddH2O. 마지막으로 성분을 피펫으로 만들고 ddH2O, 메탄올, 클로로포름 순서로 혼합합니다.
주의: 메탄올과 클로로포름은 건강에 해롭고 가연성이며 휘발성입니다. 보안경, 장갑, 실험복을 착용하고 흄 후드를 사용하십시오. - 보충 파일 1을 사용하여 지질 원료를 만드는 데 필요한 유기 용매/용액의 부피를 계산하고 적절한 부피의 유리 주사기를 선택합니다.
참고: 이 부피는 25-100μL 유리 마이크로리터 주사기를 사용하여 쉽게 측정할 수 있는 필름당 15-100μL 스톡 분취 부피에 해당하는 스톡 농도를 생성해야 합니다. - 유리 주사기를 클로로포름으로 세 번 헹굽니다. 플런저를 앞뒤로 펌핑하여 주사기를 건조시킵니다.
- 세척된 유리 주사기를 통해 유기 용매/용액을 측정하고 2.7단계의 스프레드시트 계산에 따라 개별 지질 바이알에 추가하여 지질 원을 형성합니다. 클로로포름에 파이로 지질을 용해 (2.5 단계 노트에 따라 이미 용해되지 않은 경우), DPPC 및 DPPE-mPEG를 9 : 1 v / v 클로로포름 : 메탄올 및 DPPA를 65 : 35 : 8 클로로포름 : 메탄올 : ddH2O. 모든 첨가에 동일한 유리 주사기를 사용하는 경우 각 지질 사이를 헹구고 말리십시오.
참고: 선택한 제형에 DPPA 또는 C18 사슬 길이 변형체가 포함되어 있지 않은 경우 파이로 지질, 숙주 PC 지질 및 PEG 지질이 모두 클로로포름에 용해될 수 있습니다. - 바이알과 소용돌이의 뚜껑을 닫습니다.
- 계산된 부피의 원천 지질 용액을 유리 마이크로리터 주사기를 통해 새로운 0.5드람 유리 바이알(필름 바이알)에 추가합니다. 첫 번째 지질 스톡의 경우 바늘 끝을 바이알의 하단 중앙에 삽입하고 바이알 벽이 튀지 않도록 천천히 떨어뜨립니다. 후속 첨가를 위해 바늘 끝을 액체 레벨 바로 위에 놓고 바이알 측면을 만져 바늘이 아래의 액체에 노출되지 않는 방식으로 최종 방울을 제거합니다.
알림: 오염이 발생할 때 지질 첨가물 사이에 유리 주사기를 헹구고 말리십시오. 여러 필름을 만드는 경우 용매 증발을 최소화하기 위해 첨가물 사이에 필름과 스톡 바이알을 모두 덮으십시오. - 내용물을 섞기 위해 바이알을 수직으로 수동으로 부드럽게 휘젓습니다. 바이알 벽에 용액이 튀지 않도록 하십시오.
- 뚜껑을 열고(캡 보관) 바이알의 헤드 스페이스에 질소 라인을 삽입합니다. 질소 흐름을 조정하여 액체 표면에서 약간의 눈에 띄는 방해를 일으키지만 깔때기나 튀는 현상은 없도록 합니다.
- 질소 라인을 삽입한 직후 바이알을 소용돌이치십시오. 바이알 바닥에서 1cm 이하로 솟아오르는 용매로 깔때기를 형성하기에 충분한 저속으로 시작합니다. 용제가 튀지 않도록 하십시오. 용매가 증발함에 따라 와류 속도를 천천히 그리고 쉬지 않고 증가시켜 모든 액체가 증발할 때까지 용매 높이를 유지합니다. 그 결과 바이알의 아래쪽 1/3에 걸쳐 코팅된 박막이 생성됩니다.
- 바이알을 진공 설비된 데시케이터에 넣고 진공 상태에서 8-72시간 동안 필름을 계속 건조시킵니다. 바이알(개구부 제외) 또는 건조제를 알루미늄 호일로 덮습니다.
참고: 여기에서 프로토콜을 일시 중지할 수 있습니다. 다음 단계는 필름 건조 후 수행하거나 필름을 파라 필름으로 밀봉 한 아르곤 아래에 -20 ° C 냉동고에서 최대 1 개월 동안 보관할 수 있으며 건조한 상태로 유지하면 더 오래 보관할 수 있습니다.
3. 지질막 수화
참고: 마이크로버블이 in vitro 또는 in vivo에서 사용되는 경우 달리 명시되지 않는 한 3.3-5.4단계에서 멸균 마이크로피펫 팁, 튜브, 주사기 및 바늘을 사용하십시오.
- 진공 청소기에서 필름을 제거하거나 냉동실에 보관된 경우 RT로 데워지도록 합니다.
- 250mL 비커에 물을 채우고 물을 70-80°C로 가열합니다.
- 수조 초음파 처리기를 69 ° C로 가열합니다.
- 마이크로피펫 1mL의 AA-PGG(1.3단계)를 지질막 바이알의 가장자리 아래로 내려가 기포 생성을 방지합니다.
알림: 킬레이트되지 않은 제어 또는 형광 전용 미세 기포를 제조할 때는 AA-PGG 대신 PGG(1.2단계)를 사용하십시오. - 바이알 입구를 캡으로 부분적으로 덮어 과불화프로판(PFP) 라인을 삽입할 수 있는 충분한 공간을 남겨둡니다. PFP를 액체 위 20초 동안 바이알 헤드 스페이스로 흐르게 하여 액체가 눈에 띄게 방해를 받지만 튀지 않도록 합니다. PFP를 현탁액에 직접 흘려보내지 마십시오. 바이알의 뚜껑을 닫습니다.
알림: 흐름의 강도와 시간이 적절하면 바이알을 만졌을 때 냉각되기 시작합니다. - 바이알의 아래쪽 절반을 70-80°C 수조에 1분 동안 담그십시오. 그런 다음 69°C 수조 초음파 처리기에서 최소 30초 동안 또는 지질 필름이 AA-PGG로 균일하게 분산될 때까지 초음파 처리합니다. 기포를 생성하거나 미세 기포 형성을 조기에 활성화하지 마십시오(조기 활성화는 지질 현탁액에서 유백색/흐린 영역으로 나타납니다). 부유하지 않은 지질이 남아 있는지 더 잘 식별하기 위해 필요할 때 바이알 표면을 닦습니다.
참고 : 초음파 처리 후 1 분 이내에 지질 필름이 수화되지 않으면 70-80 ° C 수조에서 다시 가열하고 다시 초음파 처리합니다. - 지질 필름이 균일하게 현탁되면 마지막으로 1분 동안 가열하고 추가로 30초 동안 초음파 처리합니다.
- 바이알을 닦고 RT(~5-10분)로 수동적으로 냉각시킵니다.
- 3.5단계에 따라 바이알 헤드스페이스를 PFP로 다시 채우고, 뚜껑을 씌우고, 파라필름으로 뚜껑을 씌우고 밀봉합니다.
참고: 여기에서 프로토콜을 일시 중지하고 8시간 이내에 다시 시작할 수 있습니다.
4. 방사선 표지
알림: 킬레이트화되지 않은 제어 또는 형광등 전용 마이크로버블의 경우 프로토콜 섹션 5로 건너뜁니다.
주의: 달리 명시되지 않는 한 방사성 실험실에서 이 프로토콜의 4.4-4.6단계를 수행하십시오. 64의CuCl2 는 피부 노출, 흡입 또는 섭취를 통한 다계통 독성의 위험이 있는 방사선학적 위험입니다. 가능하면 고무 팁 집게를 사용하여 간접적으로 흄 후드에서 처리하십시오. 취급 시 보호용 실험실 가운, 개인 반지 및 배지 선량계, 이중 장갑을 착용하십시오. 64CuCl2 가 2인치 리드 차폐에서 처리되는지 확인합니다. 필요한 경우 납으로 덮인 용기에 넣어 운반하십시오. 폐기물 용기를 차폐하고 사용 후 오염에 대한 운영 조사를 수행합니다.
- 유리 비커 또는 마그네틱 교반 막대가 들어있는 큰 결정화 접시에 60 ° C의 수조를 준비합니다. 물에 삽입된 열 프로브가 장착된 온도 제어 핫/교반 플레이트를 사용하여 약하지만 눈에 띄는 깔때기를 생성하는 속도로 교반하도록 설정합니다.
- 0.1 N HCl에서 64CuCl2 가 들어 있는 밀봉된 바이알을 고무 팁 겸자를 통해 투여 교정기로 옮깁니다.
참고 : 64CuCl2를 주문할 때 0.1 N HCl의 5-20 μL에 용해되도록 요청하십시오. 더 적은 부피는 마이크로버블 수율을 보존하는 데 중요합니다. - 용량 보정기와 시간에서 측정된 구리-64 활성을 주목하십시오. 집게를 사용하여 바이알을 제거하고 납이 함유된 용기에 넣습니다.
- 64CuCl2 에 대해 보고된 부피로 기록된 활성을 나누어 MBq·mL-1 값을 얻습니다.
- 3.9단계의 지질 현탁액의 캡을 풀고 바이알 홀더에 고정합니다.
- 64CuCl2 바이알의 뚜껑을 풀고 집게로 고정합니다.
- 40-250 MBq의 활성에 해당하는 64CuCl2 용액의 부피를 마이크로피펫팅하고 지질 현탁액으로 전달합니다. 피펫 팁이 현탁액에 잠겨 있는지 확인하십시오. 플런지 한 다음 위아래로 피펫을 사용하여 64CuCl2를 완전히 옮깁니다.
참고: 추가되는 64CuCl2 의 양은 방사성 표지된 마이크로버블에 대한 의도된 응용 분야와 선량 교정기의 감도에 따라 달라집니다. 마우스에서 종방향(주입 후 최대 48시간) PET 및 생체 내 혈액 샘플링의 경우 각각 최소 220MBq 및 50MBq가 권장됩니다. - 지질 현탁액과 64CuCl2 바이알을 모두 캡으로 닫습니다.
- 평평한 고무 팁 집게를 사용하여 방사성 지질 현탁액을 수동으로 위아래로 최소 5회 회전하여 현탁액을 통해 64CuCl2 를 부드럽게 혼합합니다. 바이알을 흔들거나 떨어뜨리지 말고 기포가 생기지 않도록 하십시오.
- 오른쪽이 위로 향할 때 현탁액을 안정된 상태로 유지하면서 바이알의 뚜껑을 부드럽게 튕깁니다. 이렇게 하면 캡에 갇힌 액체가 바이알 바닥으로 끌어당기는 데 도움이 됩니다. 바이알의 뚜껑을 조심스럽게 부분적으로 풀고 18G 바늘이 장착된 PFP 라인을 삽입합니다. 3.5단계에 따라 바이알 헤드 공간을 20초 동안 PFP로 채웁니다. 바이알의 뚜껑을 닫고 파라필름으로 밀봉합니다.
- 용량 보정기에서 바이알 활성을 측정하고 시간을 기록합니다.
참고: 적절한 활성이 바이알로 전달되지 않은 경우 4.5-4.11단계를 반복하여 64CuCl2의 적절한 부피를 추가합니다. - 바이알을 폼 바이알 홀더에 넣고 바이알의 아래쪽 절반이 열에 노출되도록 밀어 넣습니다. 홀더를 60°C의 교반 수조에 넣고 1시간 동안 가열합니다.
- 킬레이트 반응이 계속되는 동안 iTLC 플레이트를 준비합니다. 새 장갑을 끼고 유리 극세사 크로마토그래피 용지를 1cm x 8cm 스트립으로 자릅니다. 스트립을 80°C의 유리 건조 오븐에서 가열합니다.
참고: 이 단계는 비방사성 실험실에서 수행할 수 있습니다. - 1시간 후 4.12단계의 바이알을 불에서 제거하고 티슈로 가장자리를 닦습니다.
- 끝이 고무로 된 집게를 사용하여 바이알을 수동으로 위아래로 회전하여 바이알 벽의 응결을 지질 현탁액으로 재응축합니다.
- 바이알을 똑바로 세운 상태에서 튜브를 고정하면서 캡을 튕깁니다. 파라필름을 제거하고 캡 주위를 닦아 갇힌 목욕물을 제거합니다.
- 바이알의 뚜껑을 조심스럽게 열고 지질 현탁액 1-2 μL를 흡입합니다. iTLC 스트립의 하단 중앙에서 1cm 떨어진 곳에서 현탁액을 찾아 바이알의 뚜껑을 다시 닫습니다. 반점을 말리십시오.
참고: 이상적으로는 반응 혼합물당 최소 2개의 iTLC를 발견하고 확실성을 위해 방사성 표지된 지질 현탁액당 개발해야 합니다. - 마이크로피펫 200μL의 iTLC 용리액(단계 1.4에서 준비)을 10mL 시험관 바닥에 넣습니다. 테스트 튜브를 납 용기에 보관합니다. 점박이 iTLC를 튜브에 넣고 용리액이 스트립의 상단 가장자리에서 약 1cm 떨어질 때까지 스트립이 현상되도록 합니다.
- 집게를 사용하여 현상된 iTLC 스트립을 제거합니다. 스트립을 수직으로 잡고 γ 카운터 및 푸시 캡 호환 원형 기반 5mL 플라스틱 튜브를 통해 각 스트립 3분의 1이 개별 3분의 1에 직접 떨어지도록 합니다. 세 개의 튜브에 푸시 캡을 삽입합니다.
- γ 카운터에서 스트립이 포함된 튜브와 빈/뚜껑이 있는 제어 튜브를 구리-64 활성으로 측정하고 관련 분당 계수(cpm)를 기록합니다. 배경 활동을 수정하기 위해 다른 판독값에서 제어 튜브 활동을 뺍니다.
알림: 스트립의 하단 1/3(조각 1)에 대한 수정된 판독값은 구리-64 킬레이트화된 지질 현탁 입자와 관련이 있습니다. 중간 부분(조각 2)에는 비초분자 형태의 유리 구리-64 및 64Cu-pyro-지질 킬레이트 줄무늬가 포함되어 있습니다. 상단 섹션(조각 3)에는 주로 유리 구리-64가 포함되어 있습니다. - 방정식 1을 통해 방사화학적 순도를 계산합니다.
 (수식 1)
(수식 1)
참고: 피스 1의 cpm이 불합리하게 낮아 보이거나(예: 피스 2 또는 3보다 낮거나 이에 상응하는 경우) 판독값이 γ-counter 비선형/포화 임계값보다 높은 경우, iTLC에 대한 방사성 표지된 현탁액의 더 낮은 부피 또는 희석된 부분 표본(1-2 μL)을 찾으십시오. - 계속하려면 지질 현탁액당 두 iTLC 스트립에서 얻은 방사성 화학적 순도가 ≥ 94%인지 확인하십시오. 그렇지 않은 경우 60°C에서 지질 현탁액을 계속 가열하고 iTLC를 통해 30분 간격으로 킬레이트화를 모니터링합니다.
- 방사성 표지된 지질 현탁액 바이알과 마이크로피펫 8.89 μL의 1 N NaOH를 현탁액에 넣고 위아래로 피펫팅하여 베이스를 완전히 옮기고 현탁액을 중화합니다. 바이알의 뚜껑을 닫고 집게로 수동으로 돌려 뒤집거나 되돌린 다음 바이알 뚜껑을 부드럽게 두드립니다.
- 4.10단계에 따라 헤드 스페이스를 PFP로 채우고 파라필름으로 캡을 씌우고 밀봉합니다.
5. 마이크로버블 활성화 및 절연
- 4530rpm에서 45초 동안 기계식 바이알 셰이커를 통해 지질 현탁액을 활성화하여 유백색 마이크로버블 현탁액을 생성합니다. 바이알을 약 10분 동안 RT로 수동 냉각시킵니다. 그 결과 유백색 현탁액은 시간이 지남에 따라 두 개의 층으로 분리됩니다.
알림: 바이알 내용물은 활성화 후 유백색으로 보여야 합니다. 활성화 후 중단이 더 명확해지면 활성화가 실패했음을 나타내며, 이에 대한 원인은 이후 섹션에서 논의될 것입니다. - RT에 도착하면 바이알을 부드럽게 뒤집거나 되돌려 마이크로 버블 현탁액을 다시 현탁시킵니다. 바이알을 평평한 표면에 놓고 다음과 같이 원하는 마이크로버블 집단을 얻기 위해 디캔팅 전에 2분 동안 기다립니다.
- 1mL 플라스틱 주사기에 18G 바늘을 장착하고 공기를 흡입하고 흡입하여 주사기/바늘을 배출합니다. 2분 표시에서 바이알의 뚜껑을 빠르게 열어 한 번의 동작으로 파라필름 밀봉을 뜹습니다.
- 바이알 바닥에서 400-550 μL를 추출하여(대상 마이크로버블 집단) 더 큰 원치 않는 마이크로버블 집단의 상단 거품 층의 흡인을 방지합니다.
알림: 필요한 경우 바이알을 한쪽으로 기울여 거품이 많은/가벼운 층을 흡인하지 않도록 말단 부피를 주사기에 모으십시오.
- 바늘 가장자리를 조심스럽게 닦아 거품 오염 물질을 제거하고 분리된 마이크로버블 현탁액을 마이크로 원심분리기 튜브로 옮깁니다. 부드럽게 캡을 씌웁니다(캡을 갑자기 열거나 닫지 마십시오). 이것은 방사성 표지된 미세기포의 최종 작동 현탁액입니다.
- 용량 보정기에서 최종 microbubble 생성물의 활성을 측정하고 시간을 기록합니다. 이 값을 5.2단계에서 디캔팅된 현탁액의 부피로 나누어 MBq·mL-1 값을 구하고 관심 분야에 따라 주입 부피를 계산합니다.
참고: 방사성 표지된 마이크로버블은 이제 사용할 준비가 되었습니다. 섹션 6은 최대 24시간 후까지 실행할 수 있습니다. 이러한 방사성 표지된 마이크로버블을 멀티모달(초음파, PET, 형광) 이미징을 통해 생체 내에서 주입 및 추적할 수 있는 방법에 대한 자세한 내용은 Rajora et al.15를 참조하십시오.
6. 방사성 표지 효율성 검증
- 부드러운 피펫팅 또는 바이알 반전을 통해 microbubble 현탁액을 재현합니다.
참고: 마이크로 버블 작업 제품을 와류로 만들지 마십시오. 볼텍싱은 마이크로버블 현탁액을 불안정하게 만듭니다. - 방사성 표지된 현탁액 10-200μL를 0.5mL 30,000분자량 컷오프(MWCO) 원심분리 필터 장치에 추가합니다. <200 μL 부피를 사용하는 경우 필터 장치에 ddH2O를 추가하여 총 200 μL 부피를 구성합니다. 필터 장치를 호환 가능한 마이크로 원심분리기 튜브와 캡에 넣습니다.
참고: 성공적인 프로토콜 완료를 보장하기 위해 방사선 표지된 마이크로버블의 시험관 내 또는 생체 내 사용 전에 그리고 별도로 방사선 표지 테스트를 수행하는 것이 좋습니다. 이 경우, 이 단계에서 더 큰 부피(예: 200μL)를 사용할 수 있습니다. 프로토콜이 이후에 치료 세션에 사용되는 경우, 먼저 치료 볼륨/주사를 준비한 다음 가능한 한 빨리 나머지 방사성 표지된 마이크로버블 현탁액으로 섹션 6을 수행합니다. - 상온에서 12,000 x g 에서 10분 동안 원심분리기.
알림: 마이크로 원심분리기는 납 차폐로 둘러싸여 있어야 합니다. - 마이크로 원심분리기 튜브와 캡 사이의 연결을 가위로 자릅니다.
- "caps"라고 표시된 20mL 섬광 바이알에 캡을 넣습니다. 필터 장치를 새 마이크로 원심분리기 튜브(튜브 2)로 옮깁니다.
- infranatant가 포함된 첫 번째 마이크로 원심분리 튜브를 "tube 1"이라고 표시된 20mL 섬광 바이알에 넣습니다. 튜브 2의 필터 장치에 200μL ddH2O를 추가합니다.
- 튜브 2의 필터 장치를 실온에서 12,000 x g 로 원심분리합니다.
- 6.4단계와 6.5단계를 반복합니다. 튜브 2 캡을 튜브 1 캡이 있는 "캡" 섬광 바이알에 추가합니다. 튜브 2를 새 20mL 섬광 바이알에 넣습니다.
- 세 번째 마이크로 원심분리기 튜브의 캡을 자르고 6.4단계에 따라 "캡" 바이알에 넣습니다. 필터 장치를 "unit"이라고 표시된 새 20mL 섬광 바이알로 옮기고, 인프라란트가 튜브 3에 남아 있고 "unit" 바이알로 옮겨지지 않도록 합니다. 필터 장치의 가장자리에 방울이 보이면 튜브 3에 다시 넣고 뚜껑을 씌운 다음 10초 동안 스핀다운합니다. 튜브 3을 새 20mL 유리 섬광 바이알에 넣습니다.
- 5개의 섬광 바이알(튜브 1, 튜브 2, 튜브 3, 캡 및 장치)의 캡을 씌웁니다. 뚜껑이 닫힌 빈 20mL 섬광 바이알 1개를 빈 대조군으로 준비합니다.
- γ 카운터에서 구리-64 활성을 위해 6개의 섬광 바이알을 측정합니다. 다른 바이알의 활성에서 빈 바이알 활성을 뺍니다. 방정식 2를 사용하여 방사성 표지/킬레이트화 효율을 계산합니다.
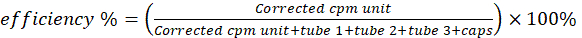 (수식 2)
(수식 2)
알림: 단위 cpm이 비합리적으로 낮거나(예: 튜브보다 낮거나 이에 상응하는 경우) 판독값이 γ-counter 비선형/포화 임계값보다 높은 경우 섬광 바이알을 납 용기에 최대 4일 동안 보관하여 값이 임계값 미만이 될 때까지 활성이 감소할 때까지 감소하고 다시 측정합니다.
7. Microbubble 물리 화학적 특성화
참고: 실험실에서 방사성 시료 처리를 위한 장비를 지정하지 않는 한, 비방사성 "차가운" 구리 킬레이트 시료를 사용하여 미세기포 물리화학적 특성 분석을 수행해야 합니다. 이 "감기" 레테르를 붙이는 것은 one의 예정한 신청에 사용된 microbubbles의 복용량을 사정하기를 위해 생명 인 microbubble 수확량의 평가를 촉진합니다. 게다가, 그것은 통제 unchelated microbubbles와 비교를 허용해서 radiolabeling 과정이 microbubbles의 재산을 교란하지 않다는 것을 지키기 위하여. 이 "저온" 라벨링 및 관련 물리화학적 특성화는 방사성 표지된 마이크로버블을 적용하기 전에 이루어져야 하며 방사성 표지에 대한 수정이 필요한 경우 피드백으로 사용할 수 있습니다(논의 참조).
- "차가운" 구리 마이크로버블 라벨링
- 4.7단계에서 지질 현탁액에 첨가된 64CuCl2 용액의 부피, 지질 필름 내 포르피린 어금니 % 조성 및 64CuCl2 제품 시트에서 발견된 특정 활성을 사용하여 방사성 표지 중에 달성된 대략적인 금속:포르피린 몰 비율을 계산합니다. 계산 예는 보충 파일 1에서 찾을 수 있습니다.
- 현재 프로토콜의 섹션 1-3을 따릅니다.
- 0.1 mg · mL-1 CuCl2 용액을 0.1 N HCl에 준비한다.
- 이 CuCl2 용액을 7.1.1 단계에서 계산 된 지질 현탁액에 적절한 부피로 마이크로 피펫하고 바이알을 마개합니다.
- 바이알을 회전하여 CuCl2 를 지질 현탁액에 혼합하고 4.9, 4.10 및 4.12 단계에 따라 헤드 스페이스를 PFP, 밀봉 및 가열로 채웁니다. 바이알 취급에는 고무 집게가 필요하지 않습니다.
- 1시간 후 불에서 바이알을 제거하고 외부를 닦아 말리십시오. 바이알을 RT로 식히십시오.
- 지질 현탁액을 중화하고, 혼합하고, 헤드 스페이스를 PFP로 채우고, 4.23 및 4.24 단계에 따라 밀봉합니다.
- microbubble 현탁액 및 디캔트를 활성화하여 5.1-5.3 단계에 따라 작동하는 제품을 얻습니다.
- 마이크로버블 사이징
참고: 마이크로 버블 사이징은 활성화 직후에 수행해야 합니다. 작업 현탁액의 안정성을 평가하는 경우 30분 간격으로 샘플 준비 및 측정을 반복합니다. 일반적으로 1-2시간의 창은 마이크로 버블 작업 현탁액이 활성화 후 사용/투여되는 기간을 나타냅니다. 안정성 측정의 목적은 이 기간 동안 미세 기포 크기와 수율이 유지되도록 하여 작업 용액에서 투여되는 모든 처리에 유사한 미세 기포 집단이 포함되도록 하는 것입니다.- 쿨터 카운터(CC)를 켜고 SOP 편집 도구를 사용하여 다음 매개변수를 설정합니다: 30μm 조리개, 0.6-18μm 크기 범위, 조리개 전류 400-600μA, 프리앰프 게인 4-8, 400bin, 각 실행 전후 플러시, 부피 분석, 5μL 샘플 부피.
- 0.2μm 매체 진공 여과 장치를 통해 CC 전해질을 여과합니다. 전해질 용기와 시료 준비를 위한 별도의 용기를 채웁니다.
- 백그라운드 측정: 10mL 일회용 큐벳에 10mL 여과된 전해질을 채우고 기준선 측정을 실행합니다. 개수가 400 미만인지 확인합니다. 그렇지 않은 경우 기기를 세척하십시오.
- 시료 측정
- 여과된 전해질 10mL를 새 큐벳에 추가합니다. 수동으로 반전/되돌리기를 통해 microbubble 현탁액을 재현합니다. 마이크로피펫은 바이알 하단 중앙에서 5μL입니다. 피펫 팁의 가장자리(개구부 제외)를 닦고 시료를 준비된 전해질에 직접 주입합니다.
- 서스펜션을 완전히 옮기기 위해 위아래로 피펫을 움직입니다. 피펫 팁을 사용하여 microbubble 현탁액의 "위습"이 분산될 때까지 전해질을 부드럽게 휘젓습니다.
- CC에서 샘플을 측정합니다(분석물당 2회 실행).
참고: 5μL 마이크로버블 샘플 볼륨은 일반적으로 1-5 x 109 마이크로버블·mL-1 농도를 포함하는 샘플에 적합합니다. 이 시료 부피는 특정 CC 기기 설정에 따라 그리고 시료 마이크로 버블 수율이 위 범위를 벗어나는 경우 조정해야 할 수 있습니다.
- 컨포칼 이미징
참고: 마이크로버블 사이징 직후 및 7.2단계의 메모에 따라 유지된 마이크로버블 안정성이 유지되는 기간 내에 컨포칼 이미징을 수행합니다.- 마이크로버블 현탁액을 재현탁하고 1-5μL를 유리 현미경 슬라이드의 중앙으로 옮깁니다. 기포가 갇히지 않도록 마이크로 버블 서스펜션 방울 위에 커버 슬립을 조심스럽게 놓습니다. 서스펜션은 커버 슬립 아래로 퍼집니다.
- 오일 이멀젼 대물렌즈로 60배 배율로 마이크로버블을 이미지화합니다. 명시야 및 633nm 여기/640-765nm 방출 미만의 이미지를 얻을 수 있습니다. 명시야 영상과 형광 영상을 겹쳐 놓습니다.
알림: 형광 신호는 프로브가 마이크로 버블 껍질 내에 균일하게 통합될 때 보이는 모든 입자의 껍질을 가로질러 겹쳐야 합니다.
- 분광 형광 측정법
참고: 분광 형광 측정 측정은 마이크로버블 활성화 후 24시간 이내에 수행할 수 있습니다.- 앞서 설명한 바와 같이 1% Triton X-100을 준비합니다35.
- 첫 번째 측정 15-30분 전에 분광형광측정기를 켭니다.
- 석영 큐벳에서 410nm 여기 및 600-800nm 방출 범위를 사용하여 1% Triton X-100의 형광 스펙트럼을 측정합니다. 참조 검출기 신호(종종 S1/R1이라고 함)로 신호를 정규화하는 옵션을 선택합니다.
참고: Triton X-100은 피펫을 넣었을 때 쉽게 거품이 일어납니다. 따라서 큐벳으로 옮길 때는 첫 번째 마이크로피펫 정지까지만 급락하십시오. - 큐벳을 메탄올로 헹구고 샘플 사이에 압축 공기로 건조시킵니다.
- 6mL의 1% Triton X-100을 15mL 원심분리 튜브에 넣습니다. 마이크로버블 현탁액을 재현탁하고 마이크로피펫을 통해 1μL를 흡입합니다. 개구부를 제외한 피펫 팁의 가장자리를 닦고 시료를 준비된 1% Triton X-100에 옮기고 위아래로 피펫팅하여 전달을 완료합니다. 용액을 소용돌이치고 석영 큐벳으로 옮깁니다.
참고: 샘플의 비율을 조정하십시오: 기기 감도 및 비선형 포화 임계값에 따라 1% Triton X-100. - 7.4.3단계의 파라미터를 사용하여 이 샘플을 측정합니다. 이 측정은 "파괴된" 입자에 해당합니다.
- PBS를 사용하여 7.4.3-7.4.6단계를 반복합니다. 이 측정은 "온전한" 입자에 해당합니다.
- 각각 1% Triton X-100 및 PBS 측정을 사용하여 중단된 시료 스펙트럼과 손상되지 않은 시료 스펙트럼을 기준선으로 보정합니다.
- PBS(FPBS) 및 1% Triton X-100(FTx)의 온전한 샘플에 대한 통합 베이스라인 보정 형광 신호를 사용하여 방정식 3을 통해 담금질 효율(QE)을 계산합니다.
 (수식 3)
(수식 3)
- UV-Vis 분광도계
참고: 분광학 측정은 마이크로버블 활성화 후 최대 72시간까지 수행할 수 있습니다.- 현탁액이 투명해질 때까지 RT에서 수조 초음파 처리기를 사용하여 마이크로 원심분리기 튜브에서 microbubble 현탁액의 부분 표본을 초음파 처리합니다. 이렇게 하면 분광학 중 산란 효과가 줄어듭니다.
- 첫 번째 측정 10분 전에 분광 광도계를 켭니다. 0.25nm의 스캐닝 간격과 200-800nm의 획득 범위를 선택합니다. 기준선 빼기를 사용하도록 설정합니다.
- 측정을 위해 1cm 경로 길이의 석영 큐벳을 사용합니다. 측정 사이에 큐벳을 메탄올로 헹구고 압축 공기로 건조시킵니다.
- 메탄올의 기준선 측정값을 얻습니다.
- 초음파 처리된 투명한 마이크로버블 현탁액을 소용돌이치고 10-50μL를 200-1000μL의 메탄올을 포함하는 미세 원심분리기 튜브로 전달합니다. 메탄올 부피가 측정되고 깨끗한 유리 마이크로리터 주사기를 통해 튜브에 추가되었는지 확인합니다. Vortex는 "중단된" 샘플을 얻기 위한 솔루션입니다.
참고: 샘플 희석은 포르피린 로딩 효율과 어금니 % 구성에 따라 달라집니다. 20배 희석은 30 mol% pyro-lipid microbubble 조성에 적합합니다. - UV-Vis 스펙트럼을 수집합니다.
- 메탄올 대신 PBS를 사용하여 7.5.4-7.5.6단계를 반복합니다.
참고: 유리 마이크로리터 주사기 대신 마이크로피펫을 사용하여 PBS 부피를 측정할 수 있습니다.
8. 프로토콜 수정
- 대체 킬레이터
- 대안적인 지질 접합 구리 킬레이트(예: 1,2-dipalmitoyl-sn-glycero-3-phosphoethanolamine-N-diethylenetriaminepentaacetic acid, 이하 DTPA-지질이라고 함)를 pyro-lipid로 대체하여 섹션 2에 따라 지질 필름을 준비합니다. 보충 파일 1 을 사용하여 필요한 질량 및 재고 부피를 계산합니다.
참고: 대체 킬레이터의 다양한 어금니 구성을 테스트하는 것은 높은 수율을 가진 안정적인 미세 기포가 생성될 수 없는 상한을 결정하는 데 필요할 수 있습니다. - 섹션 3에서 6을 따라 방사성 표지된 마이크로버블을 생성하고 특성화합니다.
- 7.1단계부터 7.3단계까지 단계를 수행하여 "차가운" 구리 킬레이트 마이크로버블을 특성화합니다. 입자 형태를 평가하기 위해서는 명시야 컨포칼 현미경 이미지 획득만 필요합니다. 대체 킬레이터가 형광성인 경우 7.4 및 7.5 단계 외에도 관련 여기 및 방출 파장을 사용하여 컨포칼 현미경 검사를 수행합니다.
- 대안적인 지질 접합 구리 킬레이트(예: 1,2-dipalmitoyl-sn-glycero-3-phosphoethanolamine-N-diethylenetriaminepentaacetic acid, 이하 DTPA-지질이라고 함)를 pyro-lipid로 대체하여 섹션 2에 따라 지질 필름을 준비합니다. 보충 파일 1 을 사용하여 필요한 질량 및 재고 부피를 계산합니다.
- 대체 형광단
- 섹션 2에 따라 지질 필름을 준비하고, 파이로 지질을 대체 지질 접합 또는 간간 형광단(예: DiI)으로 대체합니다. 보충 파일 1 을 사용하여 필요한 질량 및 재고 부피를 계산합니다.
참고: 양자택일 형광단의 다양한 어금니 구성을 테스트하는 것은 높은 수율을 가진 안정적인 미세 기포가 생성될 수 없는 상한을 결정하는 데 필요할 수 있습니다. - AA-PGG 대신 PGG를 사용하여 섹션 3을 따릅니다.
- 5.1-5.3단계와 7.2-7.5단계를 완료합니다.
- 섹션 2에 따라 지질 필름을 준비하고, 파이로 지질을 대체 지질 접합 또는 간간 형광단(예: DiI)으로 대체합니다. 보충 파일 1 을 사용하여 필요한 질량 및 재고 부피를 계산합니다.
- "스파이킹(Spiking)" 접근법: 사전 형성된 마이크로버블 지질 현탁액 라벨링
- 다른 지질 성분이 없는 파이로-지질만 사용하여 섹션 2에 따라 포르피린-지질 필름을 생성합니다. 파이로 지질의 양에 대해서는 Supplementary File 1 을 참조하십시오.
- 1mL의 수화 완충액 대신 100-200μL의 AA-PGG(또는 방사선 표지가 필요하지 않은 경우 PGG)를 사용하여 섹션 3에 따라 파이로 지질 필름을 수화합니다.
- 전체 파이로 지질 현탁액을 미리 만들어진 지질 마이크로버블 현탁액으로 옮깁니다.
- 헤드 스페이스를 PFP로 채우고, 가열하고, 3.4-3.9 단계에 따라 PFP 아래에서 서스펜션과 씰을 초음파 처리합니다. 사전 제작된 지질 마이크로버블 현탁액으로의 pyro-lipid 현탁액의 분산을 모니터링하고 완전히 분산될 때까지 가열/초음파 처리 주기를 수행합니다.
참고: 격막으로 밀봉된 상업용 마이크로버블 바이알을 사용하는 경우, 바이알 헤드 스페이스를 PFP로 다시 채우지 않고도 주사기/바늘을 통해 파이로 지질 현탁액을 바이알에 주입할 수 있습니다. - 섹션 4에서 7까지 방사성 라벨링(아래 8.3.5.1 단계 참조), 활성화, 격리(아래 참고 참조) 및 관련 특성화를 수행합니다.
- 대안적인 접근법은 먼저 수화된 파이로 지질 현탁액을 방사 표지하고, >94% 방사성 화학적 순도를 모니터링하고, 1 N NaOH로 중화하고(파이로 지질 필름을 수화하는 데 사용되는 AA-PGG 부피에 따라 부피 수정), 그런 다음 8.3.3 단계에 따라 사전 제작된 마이크로 버블 지질 현탁액에 방사성 표지된 파이로 지질 현탁액을 도입하는 것입니다.
참고: 이 수정된 접근 방식은 지질 수화 중에 생성되었지만 미세 기포에 통합되지 않은 서브미크론 다층 소포를 제거하는 분리 프로세스를 따르는 경우에만 형광 또는 다중 모드 방사성 표지 마이크로버블을 생성하는 데 사용해야 합니다. 자세한 내용은 토론을 참조하십시오.
- 대안적인 접근법은 먼저 수화된 파이로 지질 현탁액을 방사 표지하고, >94% 방사성 화학적 순도를 모니터링하고, 1 N NaOH로 중화하고(파이로 지질 필름을 수화하는 데 사용되는 AA-PGG 부피에 따라 부피 수정), 그런 다음 8.3.3 단계에 따라 사전 제작된 마이크로 버블 지질 현탁액에 방사성 표지된 파이로 지질 현탁액을 도입하는 것입니다.
결과
방사성 표지된 마이크로버블을 제조할 때 정량화할 수 있는 주요 결과는 방사성 화학적 순도와 방사성 표지 효율입니다. 이 프로토콜은 각각 iTLC와 검증된 원심 절차를 사용하여 각각을 특성화합니다. 그림 2A 는 총 지질의 1 mol%, 10 mol% 또는 30 mol%의 조성에서 숙주 지질이 pyro-lipid를 치환한 상용 마이크로버블 모방 제형에서 평균 방사화학적 순도와 ≥95%의 효율이 달성되었음을 보여줍니다. 1 mol% 및 10 mol% 파이로 지질 제형은 이러한 값을 달성하기 위해 더 농축된 지질 현탁액(0.15 mL 대 1 mL)이 필요했습니다. 현재 프로토콜에서 달성된 높은 방사성 화학 순도와 킬레이트 효율은 사후 라벨링 정제의 필요성을 상쇄했습니다.
이는 전체 중성 또는 음이온 표면 전하를 가진 C16, C18 및 C22 사슬 길이 지질로 구성된 대체 제형의 경우에도 마찬가지였습니다(그림 2B). 이 변이체는 이전에 평균 microbubble 크기, 수락가능한 microbubbles 수확량 (>1 x 109 microbubbles·mL-1)를 유지하고 >8 μm microbubble 집단 발생을 제한하고 pyro-lipid 및 그것의 activeatable 형광 및 금속 킬레이트화 기능을 확대하고 있기 위하여 결정된 상한에 근거하여 30 mol% pyrolipid 구성으로 적재되었다15. 이를 위해 30 mol% 제형은 가장 높은(최대 99%) 방사성 화학적 순도와 킬레이트 효율을 보여주었습니다. 그림 2 에서 조사된 모든 제형의 기본 지질 조성은 가장 우세하게 임상적으로 탐구된 상업용 마이크로버블 제형을 기반으로 하는 반면, 사슬 길이 및 전하 변형체는 가장 널리 전임상적으로 탐구된 조성물을 나타냅니다15. 이는 제시된 방사선 표지 프로토콜이 치료 초음파 분야에 관심 있는 대부분의 마이크로 버블 조성에 적용될 수 있다는 확신을 줍니다.
정량적 미세기포 물리화학적 특성화는 일반적으로 방사성 미세기포에 대해 실현 불가능합니다. 방사능이 붕괴할 때쯤이면(동위원소와 사용된 활동의 양에 따라 며칠, 심지어 몇 주에 걸쳐) 마이크로버블 가스 코어가 크게 용해되어 마이크로버블 파편이 생성될 것입니다. 따라서 입자 현탁액은 처음 활성화되거나 투여된 테라노스틱 활성 종을 정확하게 포착하지 못합니다. 따라서 방사성 마이크로버블 준비 중 육안 관찰과 한 쌍의 "저온" 킬레이트 아날로그 프로토콜이 중요합니다. 특히, 지질막 수화 및 활성화 단계에서 중요한 시각적 관찰이 필요합니다(그림 3). 성공적이고 완전한 수화 과정에서, 지질 필름은 바이알 벽에서 완전히 분리되어 수화 완충액에서 균질하게 분포하는 소포로 자체 조립됩니다. 최종 결과는 투명한 솔루션이다(그림 3A). 불완전한 수화는 바이알 벽 또는 현탁액의 응집체에 계속 부착되는 지질 필름을 특징으로 합니다(그림 3B). 전자는 쉽게 눈에 띄지 않을 수 있으므로 바이알 표면의 물을 닦아내고 초음파 처리 중에 신중한 검사가 권장됩니다. microbubbles의 조숙한 활성화는 수화 도중 피해야 하고 현탁액 내의 유백색 및 흐린 whisps 및 현탁액 (그림 3C)에 지속적인 거품의 창조로 쉽게 관찰될 수 있습니다. 이러한 부적절한 활성화는 마이크로버블 수율과 크기 분포 재현성을 감소시킬 수 있습니다. 숙주 지질 성분의 전이 온도보다 높은 수조수를 사용하고, 수화 완충액 또는 수조물에서 "점프"하지 않고 수화 완충액 또는 수조물에서 "뛰어내리지" 않고 바이알의 흔들림이나 갑작스러운 교반을 조심스럽게 피하지 않도록 수조 초음파 발생기를 적절한 수위까지 채우면 피할 수 있습니다. 일단 microbubble 현탁액이 통제된 고속 기계적인 교반을 통해 의도적으로 활성화되면, 부적절하게 큰 입자(예를 들면 >8 μm 직경)를 포함하는 더 가볍고/더 하얗고 더 거품이 많은 상부층과 관심 있는 microbubbles를 포함하는 표적 바닥층으로 분리되는 유백색의 불투명한 현탁액이 형성될 것입니다(그림 3D)는 주사기/바늘 흡인을 통해 격리됩니다. 차선의 활성화로 인해 표적 마이크로버블 집단의 수율이 낮아지면 수화된 지질 현탁액의 흐린 버전처럼 보이는 유백색/불투명 및 종종 반투명 하층이 생성됩니다(그림 3E).
객관적인 방사성 표지된 마이크로버블 물리화학적 특성화는 유사한 "차가운" 구리 킬레이트 마이크로버블을 사용하여 수행됩니다. 이 특성화를 위한 중요한 종점에는 다음이 포함됩니다: 1) 마이크로 버블 평균 크기 및 수율의 정량화, 2) 마이크로 버블 보관/작업 기간 안정성 평가, 3) 마이크로 버블 쉘의 맞은편에 성공적인 파이로 지질 로딩 검증, 4) 이러한 물리화학적 특성이 마이크로버블 제조 절차 내에 통합된 방사성 라벨링 프로세스에 의해 변경되지 않도록 합니다. 도 4 및 도 5 는 총 지질의 30 mol%의 파이로-지질 조성을 갖는 구리 킬레이트 C16 음이온 마이크로버블 제형에 대한 이러한 특성화를 보여줍니다. 특성화는 통제, 킬레이트화되지 않은 미세기포의 그것과 대조적으로 제시됩니다.
그림 4는 킬레이트화 및 비킬레이트 마이크로버블에 대한 대표적인 사이징 데이터를 보여줍니다. 수 분포(그림 4A)는 작은 기포의 존재가 더 크고 크기에 따른 미세 기포 수의 단조 감소를 보여줍니다. 마이크로버블 부피 분포(그림 4B)는 평균 6μm 크기에 해당하는 단봉 피크를 나타냅니다. 더 큰 마이크로버블이 더 큰 가스 부피를 구성하기 때문에 부피 분포는 더 높은 마이크로버블 평균 크기로 왜곡될 것으로 예상됩니다. 수 가중 평균으로 평균화할 때, 1.5-2 μm의 크기와 3 x 109 마이크로 버블·mL-1 의 마이크로 버블 수율이 달성되며(그림 4C, D), 마이크로 버블 활성화 및 분리 후 1시간 동안 안정적으로 유지됩니다. 이러한 결과는 추가 원심 크기 분리 없이 지질 수화 프로토콜을 통해 생성된 안정적인 지질 마이크로버블에 일반적입니다. 중요하게, microbubbles의 크기 배급, 평균 크기, 농도 및 안정성은 microbubble ground-up 제작 내의 킬레이트화 조건의 통합으로 불변합니다. 이 가치는 다른 microbubble 정립의 그들과 함께 도표 1에서, 또한 구리 킬레이트화를 가진 physicochemical 재산의 보유를 보여줍니다 요약됩니다.
microbubbles의 형태학적인 및 광학적인 재산 (숫자 5)는 또한 "차가운" 구리 킬레이트화로 유지됩니다. 포르피린 형광은 킬레이트 및 비킬레이트 마이크로버블의 껍질을 균일하게 윤곽을 그리는 것을 관찰할 수 있으며, 이는 마이크로버블 껍질 내에서 성공적인 파이로-지질 킬레이트 혼입을 입증합니다(그림 5A). 성공적인 로딩은 UV-Vis 분광법과 분광 형광분석법을 통해서도 식별할 수 있습니다. 파괴된 미세기포는 단량체 지질 종으로 분해됩니다. 이와 같이, 파괴된 마이크로버블의 UV-Vis 스펙트럼(그림 5B)은 유리 파이로 지질의 스펙트럼과 일치합니다. 여기에는 두 개의 두드러진 봉우리가 포함되어 있습니다: 파란색 영역의 Soret 밴드와 빨간색 영역의 Q 밴드. 농도를 위해 정상화하고 microbubbles 사이 더 객관적인 비교를 촉진하기 위하여는, 흡광도 스펙트럼은 파장의 맞은편에 어금니 방사율로 선물됩니다. 파괴된 microbubbles의 익지않는 UV-Vis 흡광도 스펙트럼은 Beer-Lambert 법칙 (각각 410 nm와 667 nm에 97,000 M-1·cm-1 또는 45,000 M-1·cm-1의 흡광 계수)를 적용해서 microbubble 현탁액에 있는 pyro-lipid 캡슐에 넣기 그리고 농도를 정량화하기 위하여 이용될 수 있습니다. 그림 5에서 성격을 나타낸 microbubbles는 85%-90% pyro-lipid 캡슐에 넣기 efficiency 및 ~0.17 mM의 porphyrin 농도를 전시합니다. microbubble와 porphyrin 농도를 둘 다 characterizing는 사람이 microbubble와 porphyrin의 투여된 복용량을 추정하는 것을 허용한다. 높은 캡슐화 효율은 마이크로버블에서 효과적인 파이로 지질 로딩을 보여줍니다. 이는 손상되지 않은 마이크로버블의 UV-Vis 스펙트럼에 의해 뒷받침되며, Qy 대역의 시그니처 적색 이동을 674nm 및 702nm로 묘사합니다. 후자는 특히 670-680 nm 사이의 단일 적색 편이 피크 만 묘사하는 소포 구조에 비해 마이크로 버블 쉘로의 포르피린의 높은 로딩 및 정렬된 응집에서 볼 수 있습니다15,37. 5 mol% 보다 큰 조성에서 미세기포로의 포르피린의 효과적인 로딩은 입자가 파괴될 때 복원되는 온전한 미세기포15에서 포르피린 형광의 높은(>90%) 담금질을 통해 관찰할 수 있습니다(그림 5C). 데이터 크기 조정과 유사하게, 이러한 광학 특성은 현재 프로토콜과 관련된 무선 표지 조건으로 보존됩니다(표 1에 요약됨). 총체적으로, 이러한 결과는 성공적인 마이크로버블 제조, 포르피린 킬레이트 화기 혼입 및 킬레이트 마이크로버블의 속성 유지를 위한 모든 종점의 달성을 보여줍니다.
현재의 microbubble radiolabeling protocol은 구리 킬레이트화 능력과 pyro-lipid의 multimodality를 활용하여 확립되었습니다. 그러나 파이로 리피드는 현재 상업적으로 사용할 수 없습니다. 내부 또는 외부에서 합성을 위한 자원을 사용할 수 없는 경우 pyro-lipid를 얻기 위해 연구 협력을 권장합니다. 두 옵션을 모두 사용할 수 없는 경우 현재 프로토콜을 수정하여 각각 상업적으로 이용 가능한 형광단과 킬레이트를 사용하여 단봉 형광 또는 방사성 마이크로버블을 생성할 수 있습니다. 이러한 대체 킬레이터/추적자는 마이크로버블 지질 껍질 내에 통합될 수 없어야 합니다. 그림 6 은 DiI와 DTPA 지질의 두 가지 부분으로 구성된 대표적인 미세기포를 보여줍니다.
C16 음이온 microbubble 정립으로 DTPA 지질 합치는 11 x 109 microbubbles·mL-1 수확량을 가진 1.1 μm microbubbles를 열매를 산출하고 킬레이트화된 C16 음이온 pyro 지질 microbubbles (숫자 6B, C)와 유사한 형태학을 열매를 맺습니다. DTPA 마이크로 버블 구리 킬레이트 능력에 대한 예비 평가는 "차가운" CuCl2를 사용하여 수행되었습니다. 구리 킬레이트화가 DTPA 마이크로버블 제조 공정에 통합되었을 때 크기와 수율은 변하지 않았습니다. 마이크로버블 내의 DTPA-지질이 구리 킬레이트화에 사용할 수 있는지 확인하기 위해 원심분리기 여과 마이크로버블에 대해 ICP-MS를 수행했습니다. 확실한 구리 신호가 감지되었으며, 이는 등가 구리 스파이크 라벨링되지 않은 대조군에서 얻은 신호와 비교할 때 90%-100% 킬레이트 효율에 해당합니다. 사내 경험에 따르면 ICP-MS는 γ-계수보다 더 다양한 구리 킬레이트 효율을 산출하므로 현재 프로토콜에서 킬레이트/방사성 표지 효율을 정량화하기 위해 후자를 사용하는 것이 좋습니다. 이러한 결과는 이 권장 사항의 중요성을 강조할 뿐만 아니라 이 보고서에 제시된 구리 킬레이트 프로토콜이 파이로 지질을 넘어 킬레이트로 번역될 수 있다는 개념 증명을 제공합니다.
그림 6D에서 볼 수 있듯이, 현재 프로토콜은 5 mol% 조성에서 C16 음이온 마이크로버블 제형에 DiI을 성공적으로 통합하는 데에도 사용할 수 있습니다. 이것은 microbubble 포탄의 강한 균질한 형광성 레테르를 붙이기로 이끌어 내고 (pyro-lipid가 숫자 6B에서 설명되는 것과 같이 이용될 때와 유사한) 1.7 μm의 평균 크기 및 1.5 x 10의 수확량을 가진microbubbles를 생성한다·mL-1. 전반적으로, 숫자 6에서 선물된 결과는 현재의 microbubble 제작 및 레테르를 붙이는 프로토콜이 pyro-lipid가 접근하기 어려운 경우에 microbubble 정립으로 양자택일 조사 및 킬레이터를 통합하기 위하여 실행될 수 있다는 것을 설명합니다.
이 프로토콜은 지질 MB의 방사성 표지에 중점을 둡니다. 그것의 자연적인 연장은 상업적인 지질 microbubbles15의 일련의 radiolabeled 아날로그의 단편화, 순환 동역학 및 활동학 biodistribution를 성격을 나타낸 최근 보고에서 essayed 이 radiolabeled microbubbles의 생체 내 신청입니다. 이 장시간 일의 결과는 방사선 표지한 microbubbles의 신청 그리고 미래 공용품의 맥락에서 후속적인 단면도에서 토론될 것입니다.

그림 2: 방사성 표지의 순도 및 효율성. (A) 다양한 파이로-지질 킬레이트 조성 및 (B) 지질 사슬 길이 및 마이크로버블 전하를 사용하여 마이크로버블을 지상에서 합성하는 동안 현재 마이크로버블 방사성 라벨링 프로토콜을 적용한 후 얻은 방사성 라벨링 순도 및 효율성. 음이온성 미세기포는 (-)로 지정되는 반면, 양쪽성 이온성(즉, 중성)은 "n"으로 지정됩니다. 데이터는 표준 편차± 평균으로 표시됩니다. 이 그림은 Rajora et al.15의 허가를 받아 각색되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
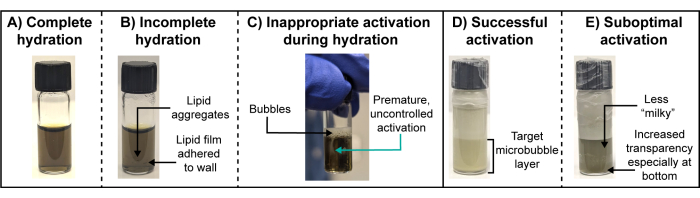
그림 3: 최적 및 차선의 지질막 수화 및 마이크로버블 활성화. (A-E) (A,D) 최적 및 (B,C,E) 최적이 아닌 지질막 수화 및 마이크로버블 활성화에 대한 대표적인 사진. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4: 비킬레이트 및 구리 킬레이트 포르피린 미세 기포의 대표적인 크기, 수율 및 안정성. (A) 수 크기 분포, (B) 부피 크기 분포, (C) 마이크로 버블 수율 및 (D) 30 몰 % 파이로 지질 조성을 갖는 비 킬레이트 (검정색) 및 구리 킬레이트 (분홍색) 포르피린 마이크로 버블의 평균 크기. microbubbles (C 와 D)의 수확량 그리고 크기는 30 분 간격으로 작동되는 현탁액 안정성을 지키기 위하여 측정되었습니다. 데이터는 n = 4-7 반복의 (C) 및 (D)에 대한 평균 표준 편차로 표시됩니다. 이 그림은 Rajora et al.15의 허가를 받아 각색되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
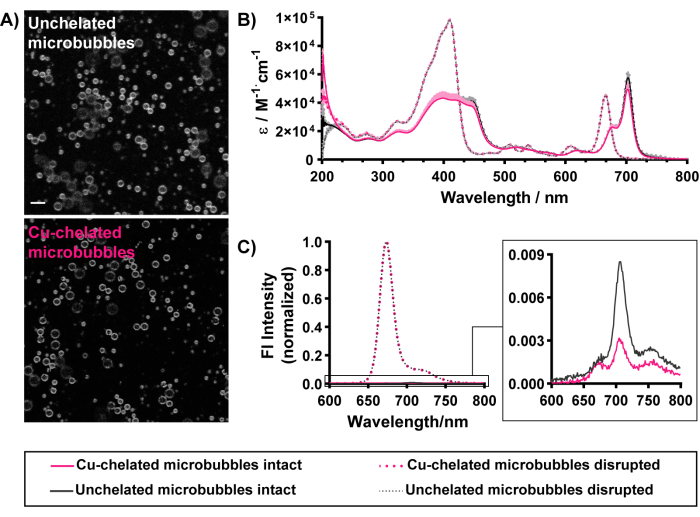
그림 5: 30 mol% 파이로-지질 조성을 가진 비킬레이트(검은색) 및 구리 킬레이트(분홍색) 포르피린 마이크로버블의 형태학적 및 광학적 특성. (A) 그레이 스케일 공초점 이미징(묘사된 파이로 신호)은 킬레이트 및 비킬레이트 마이크로버블 쉘(스케일 바 = 5μm) 내에 파이로 지질의 균일한 통합을 보여줍니다. (B) 온전한 미세기포(PBS, 실선) 및 메탄올 파쇄 미세기포(점선)에 대해 얻은 UV-Vis 스펙트럼. (C) PBS (실선, 확대된 삽입물)와 1% Triton X-100에 있는 본래 microbubbles에 있는 본래 microbubbles의 형광 스펙트럼은 microbubbles (점선)를 중단했습니다. 이 그림은 Rajora et al.15의 허가를 받아 각색되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
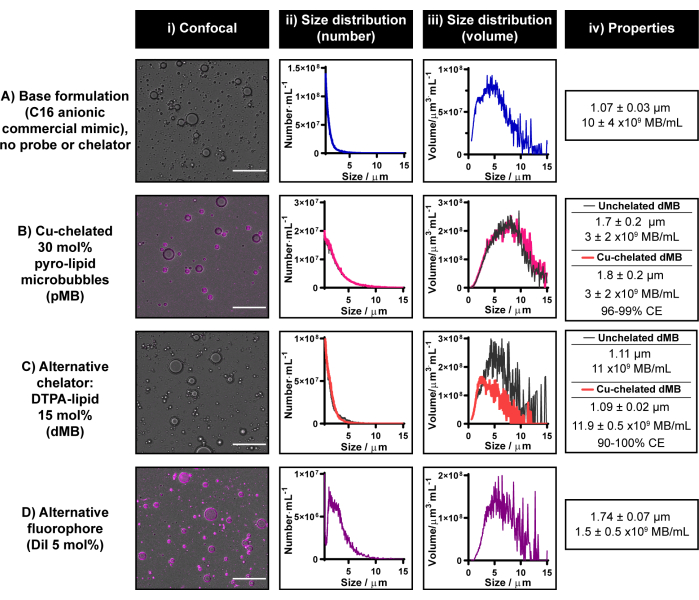
그림 6: 상업적으로 이용 가능한 형광단과 킬레이터로 구성된 대표적인 마이크로버블. (A-D) (C) 대체 킬레이터(DTPA-지질) 및 (D) 형광단(DiI) 내지 (B) 파이로-지질의 사용 예는 (A) C16 음이온성 상용 지질 마이크로버블 제형에 별도로 통합됨. 마이크로 버블은 컨 포칼 현미경 (스케일 바 = 20 μm) (i) 및 전기 임피던스 정립을 통해 특성화되어 숫자 가중 (ii) 및 부피 가중 (iii) 크기 분포를 생성했습니다. 마이크로버블의 평균 크기와 수율은 (iv)에 요약되어 있습니다. 데이터는 ii-iv에서 n = 2-7 반복의 평균으로 표시됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 마이크로버블 변형 | 양도하다 | 가스량 | 숫자 분포에 의한 평균 크기 [μm] | 부피 분포에 의한 평균 크기 [μm] | 큐702nm:큐674nm | Fl 담금질 효율 [%] |
| [x109MB ▪mL-1] | [x1010 μm3 ▪mL-1] | |||||
| 사내 Definity | 10 ± 4 | 1.8 ± 0.2 | 1.07 ± 0.03 | 3.64 ± 0.09 | 해당 사항 없음 | 해당 사항 없음 |
| C16 (-) | 3 ± 2 | 6 ± 3 | 1.7 ± 0.2 | 6.0 ± 0.8 | 2.5 ± 0.1 | 97.5 ± 0.8 |
| Cu-C16 (-) | 3 ± 2 | 4 ± 2 | 1.8 ± 0.2 | 6.6 ± 0.8 | 2.3 ± 0.2 | 98 ± 2 |
| C16 엔 | 8.4 ± 0.4 | 2.3 ± 0.8 | 1.1 ± 0.2 | 4.6 ± 0.1 | 2.1 ± 0.5 | 98.2 ± 0.3 |
| Cu-C16 엔 | 6.2 ± 0.5 | 2.9 ± 0.9 | 1.3 ± 0.2 | 5.1 ± 0.3 | 1.8 ± 0.6 | 98.7 ± 0.2 |
| C18 (-) | 8 ± 1 | 3.9 ± 0.9 | 1.5 ± 0.1 | 4.0 ± 0.5 | 2.5 ± 0.3 | 97 ± 1 |
| Cu-C18 (-) | 7 ± 2 | 4 ± 1 | 1.5 ± 0.2 | 4.9 ± 0.9 | 2.2 ± 0.5 | 98.5 ± 0.6 |
| C18 엔 | 8 ± 1 | 3 ± 1 | 1.5 ± 0.1 | 4.0 ± 0.8 | 1.8 ± 0.7 | 98.6 ± 0.5 |
| 구리-C18 | 7.8 ± 0.2 | 3.9 ± 0.2 | 1.42 ± 0.04 | 4.8 ± 0.1 | 1.8 ± 0.7 | 98.7 ± 0.3 |
표 1: 비킬레이트 및 Cu-킬레이트 pDef의 물리화학적 특성. 음이온성 미세기포는 (-)로 지정되는 반면, 양쪽성 이온성(즉, 중성)은 "n"으로 지정됩니다. 모든 측정값은 평균 ± 표준 편차(n = 3-7)를 나타냅니다. 이 그림은 Rajora et al.15의 허가를 받아 각색되었습니다.
보충 그림 1: 지질 마이크로버블 쉘에 파이로 지질 도입을 위한 "ground-up"(회색) 및 "spiking"(분홍색) 접근법의 비교. (A) 총 지질의 1 mol%, 10 mol% 및 30 mol%의 총 파이로 지질 조성에 해당하는 양에서 파이로 지질로 "스파이크"된 마이크로 버블의 컨포칼 이미징(스케일 바 = 20 μm). (B) "스파이크"(자홍색) 또는 "접지" 접근 방식(검정색)을 통해 생성된 파이로 지질 미세 기포의 UV-Vis 스펙트럼(i-iii). (비브) 마이크로버블 케이크의 파이로 지질과 서브 마이크론 종의 원심 제거에 따른 인프라의 비율. (C) "지상 위로" (검정) 및 "스파이크" 접근을 통해 한 pyro-lipid microbubbles의 수 그리고 양 배급 (i-iii), 및 대응 평균 microbubble 크기 (iv) 및 수확량 (v). 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 그림 2: 1 mol%, 10 mol% 및 30 mol% pyro-lipid로 구성되고 copper-64로 방사성 표지된 microbubble lipid suspension의 Radio-UPLC 특성화. 왼쪽 스펙트럼은 방사선 검출기에서 가져온 것이고 오른쪽 스펙트럼은 400nm 흡광 채널에서 가져온 것입니다. 불행히도 잠재적인 오염 물질로 인해 이 데이터는 방사성 화학적 순도를 정량화하는 데 사용할 수 없었습니다. 그러나 이는 [64Cu]Cu2+ 신호 및 파이로 지질과 관련된 피크의 용출 시간이 겹치는 것을 보여주며, 이는 성공적인 방사성 표지를 나타냅니다. 이 그림은 Rajora et al.15의 허가를 받아 각색되었습니다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 그림 3: pyro-lipid 어금니 조성 증가의 효과. (A) 관련 수 분포, (B) 부피 분포, (C) 수 평균 크기, (D) 부피 평균 크기, (E) 수율, (F) 형광 담금질 효율 및 통합 형광 신호(410nm 여기, 600-800nm 여기)와 온전한(PBS) 및 파괴(1% Triton X-100)와 관련된 영향. 데이터는 n = 3 반복 횟수 ± 표준 편차의 평균으로 표시됩니다. 이 그림은 Rajora et al.15의 허가를 받아 각색되었습니다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 파일 1. 이 파일을 다운로드하려면 여기를 클릭하십시오.
토론
현재의 지질 마이크로버블 방사성 표지 프로토콜은 >95%의 방사화학적 순도, >95%의 킬레이트화 효율 및 사후 라벨링 정제 없이 마이크로버블 물리화학적 특성의 유지를 달성합니다. 이러한 성과는 기존 라벨링 프로토콜에서 이전에는 달성할 수 없었던 발전을 나타냅니다. 정제 단계가 없기 때문에 방사성 동위원소(이 경우 구리-64)를 더 빠르게 사용할 수 있으므로 방사성 붕괴로 인한 비효율적인 활성 손실을 줄일 수 있습니다. 구리-포르피린 킬레이트화33의 알려진 안정성과 결합된 마이크로버블 특성의 결과 유지는 후속 방사선 이미징 또는 요법이 유리 방사성 동위원소 또는 정제 변형 마이크로버블 집단과 관련된 것과 비교하여 관심 마이크로버블을 대표한다는 것을 더 잘 보장합니다.
또한 현재 프로토콜은 미세버블 물리화학적 특성의 유지를 보장하기 위해 병렬 "저온" 라벨링 및 주요 특성화 기술을 통합한 최초의 프로토콜입니다. 실제로, 이것은 마이크로버블 크기, 수율 및 안정성이 강력하게 특성화된 최초의 마이크로버블 방사성 라벨링 프로토콜입니다. 이러한 특성을 이해하는 것은 방사성 표지된 마이크로버블의 적용에 매우 중요합니다. 마이크로버블 용량, 마이크로버블 투여량을 결정하기 위해서는 마이크로버블 크기, 가스 부피 및 수율에 대한 지식이 필요하며, 이는 차례로 마이크로버블-FUS 처리의 안전성과 효능에 영향을 미칩니다. 예를 들어, 마이크로버블-FUS BBB 개구부는 마이크로버블 투여량/기체량의 상한과 관련이 있으며, 이를 넘어서면 FUS 후 출혈 및 염증이 안전성 문제를 야기합니다38. 한세트 포탄 적재된 microbubbles를 위해, 이 복용량은 또한 적재된 약의 복용량에 연결됩니다. 크기와 수율은 또한 이미징 응용 분야에 영향을 미쳐 고농도의 미세 기포 가스 부피를 가진 차폐 아티팩트를 생성합니다39. >8μm의 대형 마이크로버블은 모세혈관에 머무르고 가스 색전을 형성하는 추가적인 안전 위험을 초래합니다40. 직관적으로, 이것은 또한 마이크로 버블 쉘의 약동학 및 생체 분포에 영향을 미칠 것입니다. 예를 들면, 폐는 이전에 방사선 표지한 microbubble 포탄 축적28,32의 1 차적인 위치로 보고되었다. 마이크로버블 특성화가 없는 경우, 더 큰 크기의 마이크로버블의 폐 포획이 이러한 생체 분포 프로파일에 기여했는지 여부는 불분명합니다. 포르피린의 사용과 관련하여, 마이크로버블의 광학 특성을 특성화하면 효과적인 포르피린 포탄 loading이 보장되며, 이는 금속:포르피린 비율에 영향을 미치고 결과적으로 킬레이트 효율에 영향을 미칠 수 있으며, 이에 대해서는 아래에서 설명합니다. 포르피린은 또한 마이크로버블 멀티모달 이미징(microbubble multimodal imaging) 37, 시너지 효과(synergistic photodynamic therapy)41 및 초음파 역학 요법(sonodynamic therapy) 42 에 대한 관심 테라노스틱 제제입니다. 마이크로버블 내 로딩 및 형광을 특성화하면 치료용 포르피린 마이크로버블 연구를 안내하고 방사선 라벨링을 통해 이러한 특성이 변경되지 않도록 하여 진정한 이미지 유도 치료 계획을 용이하게 합니다. 그러므로, "차가운" 라벨링과 라벨링되지 않은 마이크로버블의 제작이 방사성 라벨링과 병행하여 수행되어야 함을 강력히 촉구합니다.
이 프로토콜은 포르피린의 강력한 구리 킬레이트화 능력과 마이크로버블 쉘 내 포르피린-지질의 알려진 자체 조립을 활용합니다37. 구리-64에 초점을 맞추고 있지만, 이 프로토콜은 더 넓은 종류의 포르피린이 Zn, Ni, Mn, Pd, In, Lu, Cd, Sn, Ga, Co 및 43,44,45,46 이상에 결합할 수 있기 때문에 대체 단일 냄비 금속로킬화 마이크로버블 제제의 문을 엽니다. 이러한 포르피린-금속 킬레이트화는 일반적으로 포르피린 초분자 합성 중 두 단계 중 하나에서 발생합니다: 1) 포르피린 구성 요소가 입자에 도입되기 전에 킬레이트화되는 삽입 전 또는 2) 포르피린이 금속 킬레이트화를 수행하기 전에 이미 입자로 조립되는 삽입 후33,43. 방사성 동위원소를 사용할 때 첫 번째는 지질막 건조 중 비효율적인 방사성 붕괴와 관련이 있으며, 이는 다시 방사선 안전 위험을 증가시킵니다. 나중은 마이크로 버블에 적용될 때 입자 불안정화의 위험이 있습니다. 이와 같이, 현재 프로토콜에서는 킬레이트가 "ground-up" 지질막 형성 중에 도입되는 하이브리드 접근법이 생성되었지만, 방사선 표지는 지질막 수화 후 및 마이크로버블 활성화 전에 수행되었습니다. 이 전략을 통해 방사성 표지는 일반적인 마이크로 버블 제조 공정에 쉽게 통합될 수 있었으며, 다양한 마이크로 버블 제형에 적용할 수 있게 되었습니다. 또한 이러한 통합으로 간단한 기기를 사용할 수 있었고 방사능으로 "뜨거운" 특수 장비의 수를 최소화할 수 있었습니다.
이 잡종 접근은 또한 2개의 주된 접근으로 크게 분할되는 기존하는 microbubble radiolabeling 의정서와 구별된다: 1) 미리 형성된 microbubble 지질 현탁액28,47로 그 때 "스파이크"되는 chelator의 종합 그리고 radiolabeling, 및 2) 상업적인 streptavidin에 의하여 기능화된 상업적인 microbubbles32,29로 그 후에 배양되는 biotinylated 부분의 radiolabeling는. 이 후자의 접근 방식은 방사성 동위원소 사용을 절약할 수 있는 이점이 있습니다. 제시된 "ground-up" 및 보고된 "스파이크" 프로토콜에서 방사성 동위원소 킬레이터는 마이크로버블이 활성화되기 전에 통합되므로 표적 디캔트 마이크로버블과 원치 않는 큰 거품 입자 집단이 모두 라벨링됩니다. 이러한 한계는 "ground-up" 및 "spiked" 접근법에 더 많은 양의 방사성 동위원소가 필요하며, 그 중 절반은 폐기물로 사용된다는 것을 의미합니다. 그러나 위에서 설명한 바와 같이 활성화 후 방사성 표지는 미세 기포 불안정화의 위험이 있으며 이전의 "스파이킹" 프로토콜과 함께 통합되지 않은 방사성 표지 킬레이트를 제거해야 합니다.
그러나 "스파이킹" 접근법은 지질 필름 생성이 불가능하거나 바람직하지 않을 때 미리 형성된 마이크로버블 지질 현탁액(예: 상업용 마이크로버블)을 방사성 라벨링할 수 있는 길을 열어줍니다. 현재의 "기초" 방사성 라벨링 프로토콜은 이러한 "스파이킹" 접근 방식을 모방하도록 조정할 수 있습니다(8.3단계). 여기에서 파이로 지질 필름이 생성된 다음 수화되어 소포의 파이로 지질 현탁액을 형성합니다. 이 현탁액은 그 때 미리 형성된 microbubble 지질 현탁액으로 "스파이크"되고 pyro-lipid를 통합하기 위하여 가열되거나 초음파 처리됩니다. 방사성 표지는 "스파이크" 이전 또는 직후(단, 활성화 전)에 발생할 수 있습니다. 보충 그림 1A에서 볼 수 있듯이, 이 조정된 프로토콜은 총 지질의 1 mol%, 10 mol% 또는 30 mol%의 조성에서 "스파이크" 파이로-지질 킬레이터로 사내 상업용 마이크로버블 제형을 라벨링합니다.
이 "스파이킹" 접근 방식은 현재 프로토콜에서 초점을 맞추고 있는 수정되지 않은 "기초" 접근 방식에 비해 불완전한 파이로-지질 통합이라는 주요 제한 사항이 있습니다. 컨포칼 이미징(보충 그림 1A)에서 볼 수 있듯이, 파이로 지질 신호는 "ground-up" 혼입 중일 때와 같이 마이크로 버블 쉘 주위에 고리와 같은 균질한 방식으로 엄격하게 국소화되지 않습니다. 대신, "스파이킹" 접근법은 마이크로버블의 맞은편에 보이는 형광의 고르지 못한 영역과 관련이 있으며, 그 중 일부는 흐릿한 형광 윤곽선과 선명한 형광 윤곽선을 가지고 있습니다. 더 높은 불균일한 배경 형광도 관찰할 수 있습니다. submicron 종을 제거하기 위하여 이 "스파이크한" microbubbles의 분리기는 이 배경 형광 그리고 누더기 신호의 다량을 삭제합니다. 이는 파이로 지질 소포가 흡수되었지만 완전히 통합되지 않았을 수 있음을 시사하며, 이는 파이로 지질의 "스파이크" 대 "접지" 통합에 대한 UV-Vis 특성화에 의해 뒷받침되는 추측입니다(보충 그림 1B). 마이크로버블(>5 mol% 조성에서)에 파이로 지질 함유와 특히 관련된 704nm Q-밴드는 "스파이킹"으로 감소합니다. 대신, 더 두드러진 피크가 674nm에서 관찰됩니다. 마이크로버블 케이크에 분포된 파이로 지질과 인프라스트럭터스 서브 마이크론 종의 정량화는 파이로 지질의 1/4만이 "스파이킹"으로 마이크로 버블에 분포되어 있음을 보여줍니다. 반대로, 더 높은 파이로 지질 양은 "지상" 킬레이터 도입을 위해 마이크로 버블에 통합됩니다. "스파이크" 마이크로버블 내의 더 낮은 파이로 지질 혼입은 프로브가 없는 마이크로버블과 관련된 "지상" 마이크로버블을 닮은 크기 분포에 기여하는 요인일 가능성이 높습니다(보충 그림 1C). 통합되지 않은 방사성 표지된 파이로 지질 구조의 존재는 방사선 영상 또는 치료 결과를 혼동시킬 수 있습니다. 따라서 기존 프로토콜과 유사하게 "스파이킹" 접근법 다음에는 통합되지 않은 파이로 지질 종을 제거하는 원심분리 또는 디캔트 단계가 뒤따라야 합니다. 위의 모든 사항을 고려하여, 현재 프로토콜에 제시된 "기초적인" 방사성 라벨링 전략이 더욱 강력하게 권장됩니다. 그것은 "스파이크"와 비교된 더 높은 킬레이터 통합을 허용하고 미리 형성된 상업적인 microbubbles와 달리 microbubble 정립의 특화성을, 가능하게 합니다.
"ground-up" 구리 킬레이트화 프로토콜은 앞서 설명한 바와 같이 반응 파라미터의 체계적인 탐색을 통해 확립되었습니다48. 이 최적화 과정은 동시에 능률 적이고 및 시용 구리 킬레이트화를 가능하게 하고 있는 동안 질 microbubbles 생성을 위한 긴요한 단계로 통찰력을 제공했습니다: 1) microbubble 활성화 전에 10% 글리세롤 및 10% 프로필렌 글리콜 부형제 내용을 유지, 2) 킬레이트화 온도가 60-80 °C 사이에서 유지한다는 것을 지키기, 3) radiolabeling와 같은 날에 AA-PGG를 가진 필름을 수화하는 (산성 상태에 지질 현탁액의 장기간 노출은 제금되어야 합니다), 4) 활성화 전에 지질 현탁액을 중화하고 5) 수분 공급, 킬레이트화 및 활성화 후 "쿨다운" 단계를 보장합니다. 포르피린:구리 비율은 10:1 이상으로 유지되어야 합니다. 마이크로 버블 크기, 수율, 안정성 및 킬레이트화 효율을 유지하기 위해서는 구리에 대한 포르피린의 과잉이 필요하며, 구리 킬레이트화는 포르피린 형광을 소멸시키기 때문에 이중 무선 및 형광 이미징 기능이 필요합니다. 1 mL 반응 부피 및 1 h 킬레이트 시간은 라벨링되는 마이크로 버블에서 파이로 지질 부분의 <1%에 해당하는 30 mol% 파이로 지질 현탁 조성물에 대한 효율적이고 순수한 방사성 표지를 생성했습니다. 지질 막의 파이로-지질 조성을 1 mol% 및 10 mol%로 낮추면 동일한 구리-64 첨가에 대한 파이로-지질 과잉이 감소하고 방사성 표지 반응에 대한 수정이 필요했습니다. 보다 농축된 반응이 필요했기 때문에 관련 마이크로버블 필름을 0.15mL의 AA-PGG로 수화했습니다. 중화 후, PGG를 첨가하여 마이크로버블이 활성화되기 전에 1mL의 방사성 표지된 지질 현탁액 부피를 생성했습니다. 1 mol% 조성은 ≥95%의 방사성 표지 효율과 순도를 얻기 위해 더 긴 가열(1.5-2시간)이 필요했습니다. 따라서 방사성 표지 문제가 발생하는 경우(즉, ≤90%의 방사화학 순도 및 효율성), 더 긴 반응 시간과 더 낮은 반응 부피(즉, 더 농축된 지질 현탁액)를 시험할 수 있습니다.
이 프로토콜은 iTLC와 검증된 원심 여과 기법15 을 사용하여 방사성 화학적 순도와 방사성 표지 효율을 각각 정량화했습니다. 성공적이고 안정적인 구리-64 킬레이트화를 위한 생체 내 판독은 방광 신호가 없는 것입니다(유리 구리-64는 신장 배설을 받는 반면 마이크로버블 껍질과 같은 지질 초분자 구조는 간담도/분변 배설을 겪음)15. 킬레이트화 효능은 방사성 고성능 액체 크로마토그래피(보충 그림 2)에 의해 검증되었으며, 이는 방사성 화학적 순도 및 라벨링 효율을 평가하는 또 다른 수단입니다. 이 프로토콜은 iTLC 및 원심 여과를 전문 기술이나 장비가 필요하지 않고 연구 실험실 핵 시설에서 보유할 가능성이 더 높은 장비를 사용하는 더 빠르고 간단한 방법으로 제시했습니다. 이를 위해 원심 여과 프로토콜은 30,000MWCO 단위(100,000MWCO 단위도 사용할 수 있음)를 사용하여 유리 구리와 킬레이트 구리를 분리하는 데 대해 검증되었습니다. 대체 방사성 동위원소/금속을 사용하는 경우 원심분리기 속도, 시간 및 세척 횟수를 수정해야 할 수 있습니다. 구리-금속 킬레이트 안정성이 알려지지 않았거나 불안정한 대체 금속을 사용하는 경우 적절한 혈청 안정성 테스트도 수행해야 합니다.
방사성 라벨링 문제 외에도 마이크로버블 제조 문제도 발생할 수 있습니다. 이전에 소개된 것과 같이, microbubbles는 깨지기 쉬운, 그리고 그들의 제조를 향한 단계는 수화, 활성화, 재현성, 안정성 및 수확량에 있는 문제점이 그림 3에서 묘사되는 것과 같이, 만날 수 있는 정밀도와 주의깊은 취급을 요구합니다. 성공적인 마이크로버블 제조를 촉진하는 다른 요인으로는 1) 신선하고 건조한 지질의 사용(건조 지질을 건조기에 보관하고 얼음으로부터 보호), 2) 열에 노출된 지질 분취액의 사용 피하기(예: 고속 진공 청소를 통해), 3) 기포가 없는 신선한 수화 완충액 준비. 통제 microbubbles의 제조가 적당한 제품을 열매를 산출하는 그러나 radiolabeling 후에 생성된 그들은, 추가적인 고려사항이 놀이에 있을 수 있는 상황에서는. 킬레이트 반응의 온도 및 길이는 현재 프로토콜이 검증된 60-80°C 및 0-2시간 범위를 벗어날 수 있습니다. 또한, 구리-64 또는 다른 방사성 동위원소의 특정 활성이 현재 연구와 관련된 것보다 현저히 낮을 수 있다는 것이 실현 가능할 수 있습니다. 이로 인해 동일한 수준의 활성(예: 이 프로토콜이 검증된 10:1 포르피린:구리 초과량보다 낮음)에 대해 표지되는 포르피린 종의 비율이 더 높아져 마이크로버블 활성화를 방해할 수 있습니다.
성공적인 microbubble 제조에 있는 상기 도전의 대부분은 특히 사용자가 microbubble synthesis를 처음 접하는 경우, 방사성 표지가 없는 상태에서 기술된 microbubble fabrication을 먼저 시험함으로써 완화될 수 있습니다. 먼저 제어 비킬레이트 미세 기포를 생성한 다음 "차가운" 비방사성 구리로 라벨링 프로토콜을 작성하는 것이 좋습니다. 위에서 설명한 바와 같이, 이 "차가운" 킬레이트화 과정은 방사성 표지된 마이크로버블의 대표적인 물리화학적 특성을 얻는 데 필수적입니다. "저온" 킬레이트화는 또한 설명된 프로토콜에 대한 모든 수정(예: 변경된 킬레이트화 온도, 부피, 반응 시간, 포르피린:구리 비율, 방사성 동위원소, 대체 킬레이터)이 원하는 마이크로버블 물리화학적 특성을 유지하도록 하는 중요한 첫 번째 단계 역할을 합니다.
그러한 변화 중 하나는 대체 킬레이터 및 프로브의 사용일 수 있습니다. 현재 프로토콜의 한계는 상업적으로 사용할 수 없는 킬레이트를 기본적으로 사용한다는 것입니다. 이와 같이, pyro-lipid 대신 상업적으로 이용 가능한 chelators 및 형광 probes를 사용할 수 있도록 하는 modification (프로토콜의 섹션 8)이 제시됩니다. 파이로 지질의 대안으로 DiI 또는 DTPA-지질의 통합과 관련된 테스트 데이터를 얻었습니다(그림 6). DiI는 microbubble-FUS 메커니즘을 연구하고 약물 제제를 모델링하기 위해 microbubble shell에 통합된 상업적으로 이용 가능한 프로브입니다 49,50,51. 우리가 아는 한, 이것은 DTPA-지질 마이크로버블에 대한 첫 번째 보고입니다. 이러한 대체 부분으로 파이로 지질을 성공적으로 대체한 것은 현재 마이크로 버블 제조 및 라벨링 프로토콜의 다양성을 말해줍니다. 이는 더 광범위한 프로브, 특히 인지질에 묶여 있거나 인지질 사이에 통합될 수 있는 프로브에 적용될 수 있습니다.
이 프로토콜에서 대체될 수 있지만, pyro-lipid는 단일 유기 분자 내에서 보완적인 방사선 이미징 및 형광 추적 기능을 보유하는 고유한 이점을 제공합니다. 이러한 다중 방식은 마이크로버블 쉘 전달 및 생체 내 분포를 모니터링하는 데 유리할 수 있습니다. 이것은 ≥10 mol%의 파이로 지질 조성물을 사용할 때 특히 그렇습니다. 조성이 증가함에 따라 마이크로 버블 쉘 (및 일반적으로 초 분자 구조) 내의 파이로 지질은 점점 더 형광 담금질됩니다15. 입자 파괴 시, 포르피린 조성이 높을수록 상당히 더 강한 형광 신호가 생성됩니다(보충 그림 3). 이 형광 담금질은 마이크로 버블 쉘 운명을 이미징할 때 추가 판독 역할을 할 수 있습니다. 예를 들어, PET는 절대 껍질 전달/생체 내 분포의 정량화를 용이하게 하는 반면, 형광 이미징은 이러한 축적이 입자 파괴와 관련이 있는지 여부를 포착할 수 있습니다.
그러나 더 높은 파이로-지질 어금니 조성의 한계 중 하나는 미세 기포 크기와 수율에 미치는 영향입니다. 숙주 지질을 상업적인 지질 microbubble 정립 내의 증가 pyro-lipid 구성으로 대체하는 것은 더 큰 거품, 더 낮은 microbubble 수율 및 더 불안정한 microbubbles를 생성하는 것으로 밝혀졌다15. 참조의 편의를 위해 이러한 결과는 현재 방사성 표지 프로토콜이 검증된 1 mol%, 10 mol% 및 30 mol% 파이로-지질 조성에 대한 보충 그림 3 에 요약되어 있습니다. 프로브 첨가에 의한 미세 기포 크기의 이러한 변화는 파이로 지질에만 국한되지 않습니다. 예를 들어, 5 mol% 조성에서 상용 지질 마이크로버블 제형에 DiI를 포함하면 마이크로버블 수율이 10배 감소하고 마이크로버블 크기가 60% 이상 증가했습니다(그림 6). 이에 비해 5 mol %의 파이로 지질 조성물은 수율, 부피 평균 크기 또는 피크 부피가 크게 다르지 않았지만 마이크로 버블 수 평균 크기는 25 % 15 증가했습니다. 또한, 파이로-지질 조성을 1 mol%에서 30 mol%로 증가시키는 것은 껍질 순환 및 제거 경로에 큰 영향을 미치지 않습니다15. 그러나, probe-less 또는 상용 제형과 관련된 크기 분포의 유지가 필요한 경우, 현재의 microbubble 제조 및 방사성 표지 프로토콜은 1 mol% pyro-lipid 조성물을 사용하여 적용할 수 있습니다. 이러한 적은 양의 파이로-지질 함유는 베이스라인 프로브가 없는 제형과 관련된 크기 또는 수율 파라미터를 크게 변화시키지 않습니다(보충 그림 3). 그러나 이는 더 높은 파이로-지질 조성과 관련된 강력한 활성성 형광 기능을 잃는 대가를 치르게 됩니다. 타협적인 해결책은 10 mol% pyro-lipid 조성의 선택일 수 있습니다. 전반적으로, 1 mol%의 낮은 파이로 지질 조성이 현재의 방사성 표지 프로토콜에 적합하다는 점을 감안할 때, 마이크로 버블 크기, 수율 및 형광 기능을 조정할 수 있는 상당한 수준의 모듈화가 존재합니다.
전반적으로, 현재 방사성 표지 프로토콜의 가장 중요한 적응성은 소개에서 개괄한 다양한 방사성 표지된 마이크로버블 응용 분야를 가능하게 할 수 있습니다. 아마도 마이크로버블-FUS 분야의 현재 풍경과 가장 관련성이 높은 것은 이미지 유도 약물 전달 플랫폼 설계를 위한 마이크로버블 쉘 운명의 방사 추적일 것입니다. 방사선 표지된 microbubbles의 이 신청은 최근 연구15에서 탐구되었습니다. 현재의 방사성 표지 프로토콜은 다양한 아실 사슬 길이와 전하를 가진 일련의 다중 모드 구리-64 표지 포르피린 미세 기포를 생성하기 위해 적용되었으며, 이는 임상 및 전임상 문헌에서 가장 널리 연구된 지질 미세버블 조성을 나타냅니다. 초음파, PET 및 형광 이미징을 통해 건강한 마우스와 종양이 있는 마우스에서 생체 내 가스 용해, 껍질 제거, 생체 내 분포 및 분해 역학을 모니터링하여 최초의 종단 및 체계적인 지질 마이크로버블 약동학 연구를 수행했습니다. 주요 발견은 다음을 포함했습니다: 1) 마이크로 버블 지질 사슬 길이를 증가시키는 마이크로 버블 코어는 중성 마이크로 버블의 느린 해체 및 음이온 마이크로 버블의 더 빠른 해체로 이어지는 분 동안 용해됩니다 (상업적 제형과 가장 유사); 2) 남은 껍질은 혈액에서 24시간 이상 순환했으며 간담도/비장/대변 경로를 통해 제거되었습니다. 3) 이러한 제거는 마이크로 버블 구성에 따라 달라졌으며 더 짧은 사슬 길이 쉘은 더 높은 간 처리를 거친 반면 더 긴 체인 길이 쉘은 더 높은 비장 흡수를 나타냈습니다. 4) 미세기포 포탄은 주사 (1시간) 후에 첫번째 애완 동물 시점 일찌감치 C18 중립 포탄을 입힌 microbubbles가 FUS 중재한 배 오프닝의 유사한 수준을 촉진했음에도 불구하고 가장 높은 수동적이고 FUS 강화한 흡수 (3.5 h 처리에 최대 향상)를 전시하는 상태에서 주사 (1 h) 후에 주위 조직과 비교된 주위 조직에 있는 우선적인 축적을 겪었습니다; 5) 일반적으로 종양 껍질 전달의 FUS 향상은 모든 마이크로 버블 제형에서 겸손하고 동일하지 않았으며, 이는 FUS 강화 화물 적재 쉘 전달이 다양한 마이크로 버블에서 편재하게 달성될 수 없으며 더 높은 FUS 압력을 요구할 수 있음을 보여줍니다. 6) 종양, 간 및 비장 내의 미세기포 껍질은 주로 혈관 외 공간에서 발견되었습니다. 7) 사슬 길이가 짧은 껍질은 더 빨리 분해되었으며, 종양은 껍질 조각이 분해되는 비율이 가장 높았습니다. 이러한 발견은 마이크로버블-FUS 분야의 통념을 명확히 하고 껍질 기반 종양 전달을 위한 최적의 마이크로버블 설계를 둘러싼 특정 가정을 뒤집었습니다. 중요한 처음 지도는 비장 표적을 위한 약물 적재된 microbubbles, 간 표적을 위한 C16 지질, 초음파 조영제 화상 진찰 및 더 긴 혈액 순환을 위한 중립 더 긴 사슬, 종양 표적을 위한 중립 C18 지질, all-in-one 포탄 적재된 지질 microbubbles 내의 hepatosplenic toxicity를 가진 약의 금기 사용 및 낮은 기준선 혈관 침투성을 가진 종양을 위한 그런 체계의 신청을 공식화하기 위하여 C18 지질의 사용을 포함했습니다. 따라서 이 연구는 보다 최적의 마이크로버블 설계에 정보를 제공할 수 있는 구조-활성 관계를 시작하고 추가 탐사를 위한 청사진을 제공했으며, 이 모든 것은 현재 방사성 표지 프로토콜에 의해 가능했습니다. 이 용량은 획득한 마이크로버블 약동학 데이터 세트를 사용하여 자동 PET/CT 장기 분할을 위한 적응형 딥 러닝 도구를 구축함으로써 더욱 향상되었으며, 이를 통해 보다 효율적인 약동학 데이터 분석이 가능해졌습니다. 52의
현재 프로토콜의 초점은 지질 마이크로버블의 방사성 라벨링에 맞춰져 있습니다. 그러나, 화물 적재된 초음파 대리인 디자인의 맥락에서는, nanodroplets와 고분자 microbubbles를 간과하는 것은 안타까울 것입니다. 나노방울은 지질, 단백질 또는 폴리머 껍질로 캡슐화된 액체 과불화탄소 코어로 구성된 상 변화 시스템입니다. 더 높은 강도의 FUS에서 이러한 나노 방울은 액체 코어의 음향 기화를 통해 미세 기포로 변환됩니다. 이러한 FUS 활성 메커니즘과 더 작은 크기의 나노 방울은 1) 생체 내 더 긴 안정성, 2) 더 큰 조직 투과성 및 더 높은 종양 전달, 3) 혈관 및 혈관 외 활동을 위한 시설, 4) 음향 기화 후 빠른 약물 방출 50,53,54. 따라서 화물이 적재된 나노 방울의 방사성 표지는 향후 작업에서 방사선 추적 및 이미지 유도 처리 계획에도 도움이 될 것입니다. 현재의 방사성 표지 프로토콜은 응축 방법을 통해 제작된 나노 액적에 쉽게 통합될 수 있으며, 이는 이전에 나노 액적 껍질 내에서 포르피린-지질 로딩을 허용하는 것으로 나타났습니다35.
중합체 microbubbles는 또한 중합체 포탄 간격과 물자 구성 조음 55,56,57를 통해 약 선적, 화물 캡슐에 넣기, 및 약 선적 tunability에 더 높은 추정 안정성을 열매를 산출하는 그들의 뻣뻣한 모듈 포탄 때문에 지질 microbubbles에 포탄 적재된 약 납품 이점을 전시하기 위하여 생각됩니다. 그들의 안정성 때문에, 중합 microbubbles는 현재 프로토콜이 극복하기 위하여 디자인된 지질 microbubbles와 동일한 radiolabeling 제한에 부딪히지 않을지도 모릅니다. 그러나 현재 프로토콜은 1) 미세기포 특성화 및 2) 킬레이트화 효율의 두 가지 측면에서 고분자 마이크로버블 방사성 표지를 알리는 데 여전히 사용할 수 있습니다. 고분자 마이크로버블 방사성 표지는 연구에서 제한적이지만 일반적으로 킬레이터(예: DOTA 및 NOTA)로 고분자 껍질의 표면을 기능화한 다음 동위원소 첨가, 가열 및 세척하여 유리 동위원소를 제거하는 것을 포함합니다27,58. 기존 지질 마이크로버블 방사성 라벨링 프로토콜과 유사하게, 이러한 보고서는 라벨링 후 마이크로버블 물리화학적 특성을 특성화하지 않습니다. 따라서 현재 프로토콜은 모든 유형의 마이크로 버블 쉘을 방사성 라벨링할 때 "콜드" 라벨링 및 특성화의 사용을 표준화하기 위한 청사진으로 사용할 수 있습니다. 또한, 고분자 마이크로버블 방사성 표지 수율을 개선할 여지가 있습니다(킬레이터 이식된 마이크로버블의 경우 42%-85% 범위로 보고됨58). 이 연구에서 강력하고 효율적인 방사성 동위원소 킬레이터로서 포르피린을 사용하는 것은 구리 킬레이트화 이전에 기존의 포르피린-폴리머 껍질 접합 기술59을 적용함으로써 향후 연구에서 번역될 수 있습니다. 전반적으로, 중합 microbubbles는 지질 microbubbles만큼 대중적이지 않습니다. 지질 마이크로버블은 현재 인체용으로 임상적으로 승인된 유일한 쉘 변형으로, 치료용 마이크로버블-FUS 플랫폼의 보다 빠른 번역을 위해 선택되는 재료입니다. 또한, 소수의 일대일 고분자와 지질 껍질 치료용 FUS 비교는 지질 껍질이 고강도 FUS 패러다임에서 더 큰 혈관 투과화, 더 빠른 FUS 유발 약물 방출, 더 강력한 조직 절제 및 더 빠른 온도 상승을 촉진한다는 것을 시사합니다 60,61,62. 집합적으로, 지질 microbubbles는 이렇게 다른 포탄 이체체 보다는 치료 FUS 신청을 위해 더 넓게 공부됩니다. 그러므로, 지질 microbubbles에 현재 radiolabeling하는 의정서의 초점은 더 넓은 microbubble-FUS 분야의 그것과 일치합니다.
microbubble-FUS 메커니즘 및 화물 적재 microbubble 디자인을 알리는 것 외에도 방사선 표지된 microbubbles는 방사선 요법에 대한 유용성을 제안했습니다27. FUS와 방사선 항종양 활성을 단일 제제 내에서 결합하는 것에 대한 관심은 마이크로버블-FUS가 방사선 요법과 시너지 효과를 발휘하여 방사선 요법 항종양 반응을 강화한다는 증거에 기반하고 있습니다16. 현재의 방사선 표지 프로토콜은 구리-64 대신 구리-67(방사선 요법63에 더 적합)을 사용하여 이러한 방사선 저자극 마이크로버블을 생성하도록 조정할 수 있습니다. 그러나 현재의 지질 마이크로버블 방사성 표지 전략의 토대 위에서 완료된 약동학 연구는 마이크로버블 껍질의 높은 간비장 축적을 입증했습니다15. 이러한 off-target 축적은 방사선 표지된 마이크로버블이 이중 FUS/방사선 요법제로 적용된 경우 중요한 고려 사항입니다.
이러한 맥락에서 간비장 독성 완화 전략이 필요할 것입니다. 예를 들어, Navarro-Becerra와 Borden64가 철저히 검토한 바와 같이, 수많은 저자는 비오틴/아비딘 결합 및 정전기 흡수를 통해 종양 표적 리간드(예: VEGFR2 mAb, RGD, 엽산)가 있는 지질 미세거품을 기능화했습니다. 이러한 생체 기능화는 종양에 대한 포탄 적재 화물 전달을 증가시키고, off-target 조직 축적을 감소시키며, 종양 치료를 향상시킵니다 32,65,66. 기능화는 일반적으로 정전기적이기 때문에 현재의 방사성 표지 및 마이크로 버블 제조 프로토콜은 리간드 흡수 전에 있는 그대로 사용할 수 있습니다. 공유 결합되어야 하는 열에 민감한 펩타이드 및 단백질 리간드(예: PEG-지질 복합 펩타이드)를 수용하기 위해 방사성 표지 프로토콜에 대한 조정이 필요할 수 있습니다. 이러한 경우, 반응 온도를 37°C로 낮추면서 킬레이트화 반응 시간을 연장할 수 있으며, 이는 표적화 기능을 유지하면서 지단백질 나노입자 내에서 효율적인 포르피린-구리 킬레이트화를 생성하는 접근 방식입니다34. 그러나, 방사선 표지된 microbubbles의 표면에 표적으로 하는 ligands의 추가가 완전히 고량 copper-67 microbubble 방사선 요법과 관련되었던 hepatosplenic toxicity 관심사를 완화할 것이라는 것은 아닙니다. 예를 들면, p-selectin 항체를 가진 microbubbles를 기능화하는 것은 쥐에 있는 그들의 종양 납품을 두배로 하고 4x에 의하여 간 축적을 감소시켰다, 그러나 간 축적은 주입 후에 1 h32 실질적 9% ID/g (종양 축적 2배 높은)에 아직도 이었다. 리간드를 표적으로 하는 것에 대한 더 유망한 대안은 종양내 주사를 통한 방사선 치료 마이크로버블의 국소 전달일 수 있습니다. 마이크로버블을 투여하는 비정형적인 방법이지만, 마이크로버블의 종양내 주사는 Bismuth et al.39에 의해 단일 60초(MI 0.9) FUS 치료로 강력한 종양 절제(50% 조직 천공)를 달성하는 것으로 나타났습니다. 해당 microbubbles가 추가적인 방사선 치료 능력을 가지고 있다면 훨씬 더 강력한 종양 절제를 예상할 수 있습니다. 이를 위해 향후 연구는 종양 저산소증을 완화하여 microbubble-FUS/방사선 요법 시너지 효과를 더욱 향상시키기 위해 방사선 표지된 미세 기포의 산소 코어를 사용하는 데 도움이 될 수도 있습니다 67,68. FUS/방사선 치료제의 이중 작용제로 적용하기 전에, 종양 내 전달 방사선 표지된 마이크로버블은 약동학적으로 평가하여 국소 전달이 전신 누출을 일으키지 않도록 해야 합니다. 이는 현재 연구에 의해 실현 가능하게 된 방사성 표지된 마이크로버블의 모든 제안된 응용 분야에서 방사선 추적의 본질적인 중요성을 강조합니다.
요약하면, 현재 프로토콜은 마이크로버블 방사성 표지의 발전을 제공합니다. 총체적인 이점으로는 향상된 "기초" 킬레이터 통합, 높은 킬레이트화 효율, 라벨링 후 유리 방사성 동위원소 또는 킬레이터 정제의 부재, 미세버블 물리화학적 특성의 보존, 다양한 미세버블 제형에 걸친 다양한 적용, 대체 킬레이터 및 형광단에 대한 적응성, 킬레이터 조성 및 관련 다중 양식 및 입자 크기의 맞춤화가 포함됩니다. 궁극적으로, 그것은 microbubble FUS의 기계론적 통찰력과 테라노스틱 기능을 발전시킬 수 있는 맞춤형 라디오 및/또는 형광 활성 마이크로버블을 생성합니다. 이러한 응용 분야에는 대표적인 정량적 약동학 데이터 수집, 마이크로버블 다중 모드 이미징 기능 확장, 이미지 유도 치료 최적화 촉진, 시너지 효과가 있는 마이크로버블-FUS 라디오(및/또는 포르피린) 요법 활성화가 포함될 수 있습니다.
공개
저자는 이해 상충을 보고하지 않습니다.
감사의 말
기술 서비스와 지도를 제공해 주신 Deborah Scollard와 Teesha Komal(온타리오주 토론토 소재 STTARR(University Health Network Stake-Temporal Targeting and Amplification of Radiation Response) 프로그램)에게 감사드립니다. 또한 컨포칼 현미경 검사 중 기술 지원을 해주신 Mark Zheng과 Alex Dhaliwal 박사님, 그리고 관련 장비를 제공해 주신 Advanced Optical Microscopy Facility(온타리오주 토론토)에 감사드립니다. 캐나다 보건 연구소(Canadian Institutes of Health Research), 테리 폭스 연구소(Terry Fox Research Institute), 캐나다 자연과학 및 공학 연구 위원회(Natural Sciences and Engineering Research Council of Canada), 캐나다 혁신 재단(Canada Foundation for Innovation), 프린세스 마가렛 암 재단(Princess Margaret Cancer Foundation), 캐나다 연구 의자 프로그램(Canada Research Chairs Program), 맥러플린 센터(McLaughlin Centre), 바니에 장학금 프로그램(Vanier Scholarship Program), 온타리오 대학원생 장학금 프로그램(Ontario Graduate Student Scholarship Program), 캐나다 전립선암협회(Prostate Cancer Canada), 피터버러 K. M. 헌터 자선 재단(Peterborough K. M. Hunter Charitable Foundation)을 통해 자금을 지원받습니다.
자료
| Name | Company | Catalog Number | Comments |
| 64CuCl2 | Washington University School of Medicine, Mallinckrodt Institute of Radiology | N/A | Order in small volume (<10 µL) dissolved in 0.1 N HCl |
| Acetic acid | Any company | ≥ 95% purity | |
| Aluminum foil | Any company | ||
| Ammonium acetate | Any company | Purity: ≥ 98% | |
| Balance - analytical | Any company | Able to measure down to 0.1 mg | |
| Bath sonicator | Any company | Can be heated to 69 oC | |
| CC aperture - 30 micron | Beckman Coulter | A36391 | Particle diameter range: 0.6-18 um |
| CC electrolyte | Beckman Coulter | 8546719 | Isoton II diluent |
| CC Software | Beckman Coulter | Multisizer 4e | |
| Centrifuge filter units (0.5 mL 30,000 MWCO) with compatible microcentrifuge tubes | MilliporeSigma | UFC503096 | Amicon Ultra - 0.5 mL |
| Centrifuge tubes - 15 mL with caps | Any company | ||
| Chloroform | Any company | Purity: ≥ 99.8% | |
| Coulter counter | Beckman Coulter | B43905 | Multisizer 4e Coulter Counter |
| Cover slips | VWR | 48393081 | VWR micro cover glass |
| CuCl2 | Any company | Ensure not oxidized | |
| CuCl2 | |||
| Cuvette- quarts, 1 cm path length | Any company | ||
| Cuvettes - 10 mL plastic for CC measurements | Beckman Coulter | A35471 | Coulter Counter Accuvette ST |
| ddH2O | Any company | Can be obtained through an ultrapure water purification system | |
| DiI (1,1'-Dioctadecyl-3,3,3',3'-Tetramethylindocarbocyanine Perchlorate) | Any company | Powder form | |
| Dose calibrator | Any company | Able to read copper-64 | |
| DPPA (1,2-dipalmitoyl-sn-glycero-3-phosphate (sodium salt)) | Avanti Polar Lipids | 830855P | Powder form |
| DPPC (1,2-dipalmitoyl-sn-glycero-3-phosphocholine) | Avanti Polar Lipids | 850355P | Powder form |
| DPPE-MPEG (1,2-dipalmitoyl-sn-glycero-3-phosphoethanolamine-N-[methoxy(polyethylene glycol)-5000] (ammonium salt)) | Avanti Polar Lipids | 880200P | Powder form |
| DTPA-lipid (1,2-dipalmitoyl-sn-glycero-3-phosphoethanolamine-N-diethylenetriaminepentaacetic acid (ammonium salt)) | Avanti Polar Lipids | 790106P | Powder form |
| EDTA (Ethylenediaminetetraacetic acid) | Any company | ||
| Gamma counter | Any company | Able to read copper-64 | |
| Gamma counting tube push caps | Globe Scientific | 22-171-665 | Flanged plug caps for 12 mm tubes |
| Gamma counting tubes | Sarstedt | 55.1579 | 5 mL, 75 x 12 mm, PS |
| Glass beaker - 250 mL | Any company | Able to withstand temperatures up to 100 oC | |
| Glass drying oven | Any company | Can be heated to 80 oC | |
| Glass microliter syringes - 25, 50, 100, 1000 µL | Any company | Compatible with organic solvents | |
| Glass scintillation vials - 20 mL | VWR | 66022-081 | VWR® Scintillation Vials, Borosilicate Glass, with Screw Caps, With pulp foil liner |
| Glass vials - 0.5 dram | VWR | 66011-020 | VWR Vial 1/2 dram, with black phenolic screw cap and polyvinyl-faced pulp liner |
| Glycerol | Sigma Aldrich | G7757-1L | Purity: ≥ 99.0% |
| Graduated pipette/gun | Any company | ||
| Hot/stir plate | Equipped with temperature prob for automatic tempearture control | ||
| Hydrochloric acid - 0.1 N | Any company | ||
| iTLC plates | Agilent | A120B12 | iTLC-SA chromatography paper |
| Laboratory tissues | Any company | ||
| Media vaccuum filtration unit | Any company | 0.22 micron pore size, PES membrane, 500 mL funnel capacity | |
| Methanol | Any company | Purity: ≥ 99.8%, HPLC grade, meets ACS specifications | |
| Microcentrifuge tubes non sterile - 1.5 mL | Any company | ||
| Microcentrifuge tubes sterile - 1.5 mL | Any company | ||
| Micropipetes - p1000, p200, p20, p10 | Any company | Ensure are calibrated | |
| Microscope slides | Fisher Scientific | 12-550-15 | Superfrost Plus Microscope Slides Precleaned |
| Needles - 18 G | Sterile | ||
| Parafilm | Any company | ||
| PBS | Sigma Aldrich | D8537-500ML | DPBS, modified, without calcium chloride and magnesium chloride, liquid, sterile-filtered, suitable for cell culture |
| PFP | FluoroMed | APF-N40HP | Purity: ≥ 99.8% |
| PFP line | Any company | 1/4 inch diameter plastic hose cut about 50 cm in length | |
| PFP regulator | Swagelok | SS-1RF4 and SS-4HC-1-4 | |
| pH meter | Any company | ||
| pH standards 4 and 7 | Any company | ||
| Pipette tips for p1000, p200, p10 - non sterile | Any company | ||
| Pipette tips for p1000, p200, p10 - sterile | Any company | ||
| Plastic syringe - 1 mL | Any company | Sterile | |
| Propylene glycol | BioShop | PRO888.500 | Purity: ≥ 99.5% |
| Pyro-lipid | N/A | Made in-house | |
| Rubber tipped forceps | Any company | Mix of fine-tipped and flat/square edges recommended | |
| Scissors | Any company | ||
| Sodium hydroxide - 1 N | Any company | ||
| Sodium hydroxide - 10 N | Any company | ||
| Spectrofluorometer | Any company | Capable of 410 nm excitation and 600-850 nm emission | |
| Spectrofluorometry software | Horiba | FluorEssence | |
| Spectrometer | Any company | ||
| Syringe - 1 mL | Any company | Disposible, plastic, sterile | |
| Syringe filters - 0.2 micron pore size | Any company | Membrane material: PES or other compatible with ammonium acetate/acetic acid and PBS | |
| Test tube - 10 mL | |||
| Triton X-100 | Any company | ||
| Vacuum desicator/vacuum | Any company | ||
| Vialmix | Lantheus Medical Imaging | 515030-0508 | Referred to in protocol as a mechanical vial shaker |
| Weigh paper | Any company | To avoid losing product, cutting weigh paper into 3x3 cm squares is recommended |
참고문헌
- Itani, M., Mattrey, R. F. The effect of inhaled gases on ultrasound contrast agent longevity in vivo. Mol Imaging Biol. 14 (1), 40-46 (2012).
- Kong, W. T., Wang, W. P., Huang, B. J., Ding, H., Mao, F. Value of wash-in and wash-out time in the diagnosis between hepatocellular carcinoma and other hepatic nodules with similar vascular pattern on contrast-enhanced ultrasound. J Gastroenterol Hepatol. 29 (3), 576-580 (2014).
- Wilson, S. R., Burns, P. N. Microbubble-enhanced us in body imaging: What role. Radiology. 257 (1), 24-39 (2010).
- Hynynen, K., Mcdannold, N., Vykhodtseva, N., Jolesz, F. Noninvasive mr imaging-guided focal opening of the blood-brain barrier bbb in rabbits. Radiology. 220 (3), 640-646 (2001).
- He, W., et al. Enhanced ablation of high intensity focused ultrasound with microbubbles: An experimental study on rabbit hepatic vx2 tumors. Cardiovasc Intervent Radiol. 34 (5), 1050-1057 (2011).
- Lipsman, N., et al. Blood-brain barrier opening in alzheimer's disease using mr-guided focused ultrasound. Nat Commun. 9 (1), 2336 (2018).
- Burke, C. W., Klibanov, A. L., Sheehan, J. P., Price, R. J. Inhibition of glioma growth by microbubble activation in a subcutaneous model using low duty cycle ultrasound without significant heating. J Neurosurg. 114 (6), 1654-1661 (2011).
- Dimcevski, G., et al. A human clinical trial using ultrasound and microbubbles to enhance gemcitabine treatment of inoperable pancreatic cancer. J Control Release. 243, 172-181 (2016).
- Haram, M., Hansen, R., Bouget, D., Myhre, O. F., Davies, C. L., Hofsli, E. Treatment of liver metastases with focused ultrasound and microbubbles in patients with colorectal cancer receiving chemotherapy. Ultrasound Med Biol. 49 (9), 2081-2088 (2023).
- Mainprize, T., et al. Blood-brain barrier opening in primary brain tumors with non-invasive MR-guided focused ultrasound: A clinical safety and feasibility study. Sci Rep. 9 (1), 321 (2019).
- Karakatsani, M. E., et al. Focused ultrasound mitigates pathology and improves spatial memory in alzheimer's mice and patients. Theranostics. 13 (12), 4102-4120 (2023).
- Aron, M., Vince, O., Gray, M., Mannaris, C., Stride, E. Investigating the role of lipid transfer in microbubble-mediated drug delivery. Langmuir. 35 (40), 13205-13215 (2019).
- Wang, S., Samiotaki, G., Olumolade, O., Feshitan, J. A., Konofagou, E. E. Microbubble type and distribution dependence of focused ultrasound-induced blood-brain barrier opening. Ultrasound Med Biol. 40 (1), 130-137 (2014).
- Huynh, E., Rajora, M. A., Zheng, G. Multimodal micro, nano, and size conversion ultrasound agents for imaging and therapy. Wiley Interdiscip Rev Nanomed Nanobiotechnol. 8 (6), 796-813 (2016).
- Rajora, M. A., et al. Quantitative pharmacokinetics reveal impact of lipid composition on microbubble and nanoprogeny shell fate. Adv Sci. 11 (4), 2304453 (2024).
- Leong, K. X., Sharma, D., Czarnota, G. J. Focused ultrasound and ultrasound stimulated microbubbles in radiotherapy enhancement for cancer treatment. Technol Cancer Res Treat. 22, 1-9 (2023).
- Li, Y., et al. Ultrasound-triggered release of sinoporphyrin sodium from liposome-microbubble complexes and its enhanced sonodynamic toxicity in breast cancer. Nano Research. 11, 1038-1056 (2017).
- Nomikou, N., Fowley, C., Byrne, N. M., Mccaughan, B., Mchale, A. P., Callan, J. F. Microbubble-sonosensitiser conjugates as therapeutics in sonodynamic therapy. Chem Commun. 48 (67), 8332-8334 (2012).
- Chakravarty, R., Hong, H., Cai, W. Positron emission tomography image-guided drug delivery: Current status and future perspectives. Mol Pharm. 11 (11), 3777-3797 (2014).
- Delalande, A., Leduc, C., Midoux, P., Postema, M., Pichon, C. Efficient gene delivery by sonoporation is associated with microbubble entry into cells and the clathrin-dependent endocytosis pathway. Ultrasound Med Biol. 41 (7), 1913-1926 (2015).
- Sheikov, N., Mcdannold, N., Vykhodtseva, N., Jolesz, F., Hynynen, K. Cellular mechanisms of the blood-brain barrier opening induced by ultrasound in presence of microbubbles. Ultrasound Med Biol. 30 (7), 979-989 (2004).
- Conway, G. E., Paranjape, A. N., Chen, X., Villanueva, F. S. Development of an in vitro model to study mechanisms of ultrasound-targeted microbubble cavitation-mediated blood-brain barrier opening. Ultrasound Med Biol. 50 (3), 425-433 (2024).
- Hu, S., Zhang, X., Unger, M., Patties, I., Melzer, A., Landgraf, L. Focused ultrasound-induced cavitation sensitizes cancer cells to radiation therapy and hyperthermia. Cells. 9 (12), 2595 (2020).
- Zhao, C., et al. Synergistically augmenting cancer immunotherapy by physical manipulation of pyroptosis induction. Phenomics. , (2024).
- Tachibana, K., Uchida, T., Ogawa, K., Yamashita, N., Tamura, K. Induction of cell-membrane porosity by ultrasound. Lancet. 353 (9162), 1409 (1999).
- Arif, W. M., et al. Focused ultrasound for opening blood-brain barrier and drug delivery monitored with positron emission tomography. J Control Release. 324, 303-316 (2020).
- Da Ros, V., et al. PVA-microbubbles as a radioembolization platform: Formulation and the in vitro proof of concept. Pharmaceutics. 15 (1), 217 (2023).
- Tartis, M. S., et al. Dynamic micropet imaging of ultrasound contrast agents and lipid delivery. J Control Release. 131 (3), 160-166 (2008).
- Willmann, J. K., et al. Targeted microbubbles for imaging tumor angiogenesis: Assessment of whole-body biodistribution with dynamic micro-pet in mice. Radiology. 249 (1), 212-219 (2008).
- Ingram, N., et al. Ultrasound-triggered therapeutic microbubbles enhance the efficacy of cytotoxic drugs by increasing circulation and tumor drug accumulation and limiting bioavailability and toxicity in normal tissues. Theranostics. 10 (24), 10973-10992 (2020).
- Hernández-Gil, J., et al. Development of 68ga-labelled ultrasound microbubbles for whole-body pet imaging. Chem Sci. 10 (215), 5603-5615 (2019).
- Warram, J. M., et al. Biodistribution of p-selectin targeted microbubbles. J Drug Target. 22 (5), 387-394 (2014).
- Liu, T. W., Macdonald, T. D., Shi, J., Wilson, B. C., Zheng, G. Intrinsically copper-64-labeled organic nanoparticles as radiotracers. Angew Chem Int Ed Engl. 51 (52), 13128-13131 (2012).
- Rajora, M. A., et al. Tailored theranostic apolipoprotein e3 porphyrin-lipid nanoparticles target glioblastoma. Chem Sci. 8 (8), 5371-5384 (2017).
- Yoo, K., Dhaliwal, A., Chen, J., Sheeran, P. S., Zheng, G. Synthesis and characterization of multi-modal phase-change porphyrin droplets. J Vis Exp. 176, e62665 (2021).
- Lovell, J. F., et al. Porphysome nanovesicles generated by porphyrin bilayers for use as multimodal biophotonic contrast agents. Nat Mater. 10 (4), 324-332 (2011).
- Huynh, E., Jin, C. S., Wilson, B. C., Zheng, G. Aggregate enhanced trimodal porphyrin shell microbubbles for ultrasound, photoacoustic, and fluorescence imaging. Bioconjug Chem. 25 (4), 796-801 (2014).
- Mcmahon, D., Hynynen, K. Acute inflammatory response following increased blood-brain barrier permeability induced by focused ultrasound is dependent on microbubble dose. Theranostics. 7 (16), 3989-4000 (2017).
- Bismuth, M., Katz, S., Rosenblatt, H., Twito, M., Aronovich, R., Ilovitsh, T. Acoustically detonated microbubbles coupled with low frequency insonation: Multiparameter evaluation of low energy mechanical ablation. Bioconjug Chem. 33 (6), 1069-1079 (2022).
- Kutscher, H. L., et al. Threshold size for optimal passive pulmonary targeting and retention of rigid microparticles in rats. J Control Release. 143 (1), 31-37 (2010).
- You, Y., et al. Porphyrin-grafted lipid microbubbles for the enhanced efficacy of photodynamic therapy in prostate cancer through ultrasound-controlled in situ accumulation. Theranostics. 8 (6), 1665-1677 (2018).
- Chen, X., Qin, B., Whitehurst, D., Helfield, B., Lavery, L., Villanueva, F. S. Sonodynamic therapy using protoporphyrin ix encapsulated microbubbles inhibits tumor growth. 2017 IEEE International Ultrasonics Symposium. , 1-4 (2017).
- Cheng, M. H. Y., et al. Targeted theranostic 111in/lu-nanotexaphyrin for spect imaging and photodynamic therapy. Mol Pharm. 19 (6), 1803-1813 (2022).
- Cheng, M. H. Y., Cevallos, A., Rajora, M. A., Zheng, G. Fast, facile, base-free microwave-assisted metallation of bacteriochlorophylls and corresponding high yield synthesis of tookad. J Porphyrins Phthalocyanines. 25 (07n08), 703-713 (2021).
- Macdonald, T. D., Liu, T. W., Zheng, G. An MRI-sensitive, non-photobleachable porphysome photothermal agent. Angew Chem Int Ed Engl. 53 (27), 6956-6959 (2014).
- Shao, S., et al. Functionalization of cobalt porphyrin-phospholipid bilayers with his-tagged ligands and antigens. Nat Chem. 7 (5), 438-446 (2015).
- Teh, J. H., et al. A kit-based aluminium-[(18)f]fluoride approach to radiolabelled microbubbles. Chem Commun (Camb). 57 (88), 11677-11680 (2021).
- Rajora, M. A. . Supramolecular Structure-Enabled Delivery of Porphyrin to Glioblastomas Beyond the Blood-Brain Barrier [Doctor of Philosophy thesis]. , (2024).
- Carugo, D., et al. Modulation of the molecular arrangement in artificial and biological membranes by phospholipid-shelled microbubbles. Biomaterials. 113, 105-117 (2017).
- Dhaliwal, A. . Utilizing Porphyrin to Improve Ultrasound-Activated Supramolecular Agent Design for Solid Tumor Delivery [Doctor of Philosophy thesis]. , (2023).
- Kilroy, J. P., Klibanov, A. L., Wamhoff, B. R., Bowles, D. K., Hossack, J. A. Localized in vivo model drug delivery with intravascular ultrasound and microbubbles. Ultrasound Med Biol. 40 (10), 2458-2467 (2014).
- Dhaliwal, A., et al. Deep learning for automatic organ and tumor segmentation in nanomedicine pharmacokinetics. Theranostics. 14 (3), 973-987 (2024).
- Shakya, G., Cattaneo, M., Guerriero, G., Prasanna, A., Fiorini, S., Supponen, O. Ultrasound-responsive microbubbles and nanodroplets: A pathway to targeted drug delivery. Adv Drug Deliv Rev. 206, 115178 (2024).
- Honari, A., Merillat, D. A., Bellary, A., Ghaderi, M., Sirsi, S. R. Improving release of liposome-encapsulated drugs with focused ultrasound and vaporizable droplet-liposome nanoclusters. Pharmaceutics. 13 (5), 609 (2021).
- Barmin, R. A., et al. Polymeric materials for ultrasound imaging and therapy. Chem Sci. 14 (43), 11941-11954 (2023).
- Chen, Y., Liang, Y., Jiang, P., Li, F., Yu, B., Yan, F. Lipid/PLGA hybrid microbubbles as a versatile platform for noninvasive image-guided targeted drug delivery. ACS Appl Mater Interfaces. 11 (45), 41842-41852 (2019).
- Barmin, R. A., et al. Engineering the acoustic response and drug loading capacity of pbca-based polymeric microbubbles with surfactants. Mol Pharm. 19 (9), 3256-3266 (2022).
- Barrefelt, A. A., et al. Multimodality imaging using SPECT/CT and MRI and ligand functionalized 99mTc-labeled magnetic microbubbles. EJNMMI Res. 3 (1), 12 (2013).
- Song, R., Hu, D., Chung, H. Y., Sheng, Z., Yao, S. Lipid-polymer bilaminar oxygen nanobubbles for enhanced photodynamic therapy of cancer. ACS Appl Mater Interfaces. 10 (43), 36805-36813 (2018).
- Böhmer, M. R., Chlon, C. H. T., Raju, B. I., Chin, C. T., Shevchenko, T., Klibanov, A. L. Focused ultrasound and microbubbles for enhanced extravasation. J Control Release. 148 (1), 18-24 (2010).
- Zhang, S., et al. Compare ultrasound-mediated heating and cavitation between flowing polymer- and lipid-shelled microbubbles during focused ultrasound exposures. J Acoust Soc Am. 131 (6), 4845-4855 (2012).
- Cao, Y., et al. Drug release from phase-changeable nanodroplets triggered by low-intensity focused ultrasound. Theranostics. 8 (5), 1327-1339 (2018).
- Krasnovskaya, O. O., et al. Recent advances in (64)cu/(67)cu-based radiopharmaceuticals. Int J Mol Sci. 24 (11), 9154 (2023).
- Navarro-Becerra, J. A., Borden, M. A. Targeted microbubbles for drug, gene, and cell delivery in therapy and immunotherapy. Pharmaceutics. 15 (6), 1625 (2023).
- Fan, C. -. H., et al. Antiangiogenic-targeting drug-loaded microbubbles combined with focused ultrasound for glioma treatment. Biomaterials. 34 (8), 2142-2155 (2013).
- Luo, T., et al. Ultrasound-mediated destruction of oxygen and paclitaxel loaded dual-targeting microbubbles for intraperitoneal treatment of ovarian cancer xenografts. Cancer Lett. 391, 1-11 (2017).
- Fix, S. M., et al. Oxygen microbubbles improve radiotherapy tumor control in a rat fibrosarcoma model - a preliminary study. PLoS One. 13 (4), e0195667 (2018).
- Eisenbrey, J. R., et al. Sensitization of hypoxic tumors to radiation therapy using ultrasound-sensitive oxygen microbubbles. Int J Radiat Oncol Biol Phys. 101 (1), 88-96 (2018).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유