Method Article
Rahim dinamiğinin korunması ve transplantasyonunu incelemek için bir domuz modeli oluşturulması
Bu Makalede
Özet
Cerrahi tedarikten makine perfüzyonunun başlatılmasına kadar ayrıntılı ve tekrarlanabilir bir domuz uterus modeli tarif edilmekte ve transplantasyonda uterusun korunmasının incelenmesine olanak sağlanmaktadır.
Özet
Bugüne kadar, rahim nakli, Rokitansky sendromlu olanlar gibi mutlak uterus infertilitesi olan kadınların hamilelik yaşaması ve doğum yapması için tek seçenektir. Son yıllarda uterus transplantasyonuna olan ilginin artmasına rağmen, iskemi-reperfüzyon hasarı ve greft kalitesi ve rejeksiyonu üzerindeki etkisi de dahil olmak üzere birçok konu hala daha fazla araştırma gerektirmektedir. Son literatürde uterus transplantasyonu sonrası trombotik komplikasyon oranının %20'lere kadar çıktığı vurgulanmıştır. Bu tip bir komplikasyon, hipoksiye bağlı endotel hücre hasarından kaynaklanabilir ve sıklıkla uterus greft reddine yol açar. Hipoksi, katı organ transplantasyonunda greft koruması için altın standart olmaya devam eden statik soğuk depolama sırasında indüklenir. Son zamanlarda, makine perfüzyonu kullanılarak yapılan dinamik korumanın, iskemik ve hipoksik hasarı azaltarak konvansiyonel ve marjinal organların uzun süreli depolanmasını iyileştirdiği gösterilmiştir. Bu protokolde, makine perfüzyon protokolünün bağlantısını ve başlatılmasını sağlamak için her iki uterus pedikülüne dayalı olarak domuz uterusu temini ve dinamik koruma ile ilgili her cerrahi adımı tanımlamayı amaçlıyoruz.
Giriş
Rahim nakli (UTx) son on yılda önemli ölçüde gelişmiştir ve birkaç ekip klinik araştırma programlarına başlamıştır. Bugüne kadar, UTx'in ana endikasyonu, Mayer-Rokitansky-Küster-Hauser (MRKH) sendromu da dahil olmak üzere uterus agenezisi nedeniyle mutlak uterus infertilitesidir. MRKH sendromu, 5.000 kadın canlı doğumda bir prevalansı olan konjenital bir hastalıktır1. UTx, malign hastalık, doğum sonrası kanama, uterus fibroidleri, enfeksiyöz sekeller ve çeşitli konjenital malformasyonlara bağlı histerektomiden kaynaklananlar da dahil olmak üzere ek kısırlık nedenlerini potansiyel olarak ele alabilir. Bu, 500 kadından yaklaşık 1'inin UTx için uygun olabileceğini düşündürmektedir.
İlk klinik UTx 2000 yılında Suudi Arabistan'da meydana geldi2, ancak vasküler komplikasyonlar üç ay sonra histerektomiye yol açtı. O zamandan beri, hem yaşayan hem de ölen donörlere dayalı olarak birkaç UTx vakası gerçekleştirildive bu da 80'den fazla canlı doğumla sonuçlandı 3,4. Solid organ transplantasyonu ve vaskülarize kompozit allotransplantlar (VCA) alanına benzer şekilde, immün rejeksiyon UTx'te önemli bir zorluktur. 5 Mikrodolaşım yetmezliği ve venöz staz dahil olmak üzere çeşitli faktörler greft reddine yol açabilir ve her ikisi de trombotik komplikasyona yol açabilir. Transplantasyonda uterus vaskülarizasyonunu inceleyen yakın tarihli bir derlemede, Kristek ve ark. %15'e kadar arteriyel tromboz ve %5'e kadar venöz tromboz bildirmiştir6. Ek olarak, iskemi-reperfüzyon hasarı (IRI) greft disfonksiyonuna ve akut rejeksiyona yol açabileceğinden, soğuk ve sıcak iskemi başarılı bir transplantasyon için ele alınması gereken kritik faktörlerdir 7,8. Miyositler, 6 saat9'a kadar laktat üreterek iskemik strese yanıt verir, bundan sonra kas hücresi hasarı geri döndürülemez. Soğuk iskeminin myometrium üzerindeki etkisi klinik çalışmalarda belgelenmiştir ve statik soğuk depolama (SCS) sırasında hücre içi benzeri Wisconsin Üniversitesi solüsyonunun kullanımının, prostaglandine daha iyi kasılma yanıtı ve Ringer'in asetat çözeltisi10 ile karşılaştırıldığında daha yüksek ATP konsantrasyonları ile korumayı iyileştirdiği gösterilmiştir. Bununla birlikte, sıcak ve soğuk iskeminin etkisi UTx'te yeterince araştırılmamıştır.
SCS, uterus da dahil olmak üzere VCA'nın korunması ve çoğu katı organ nakli için altın standart olmaya devam etmektedir. Bununla birlikte, son yıllarda, makine perfüzyon sistemleri ve koruma çözümlerindeki önemli gelişmeler bir paradigma değişikliğine yol açmıştır. Dinamik makine perfüzyonunun sağlıklı ve marjinal katı organların korunmasını iyileştirebileceğini ve uzatabileceğini destekleyen güçlü kanıtlar bulunmaktadır 11,12,13,14,15. Bu teknik şu anda klinik uygulamada akciğer, kalp, karaciğer ve böbrek nakli için yaygın olarak kullanılmaktadır 14,16,17,18. Dinamik organ koruması, sürekli oksijen ve besin kaynağı sağlayarak soğuk iskemi ve hipoksi yaralanmalarını en aza indirmek, toksik metabolitleri temizlemek ve greft kalitesi ve canlılık parametrelerini iyileştirmek dahil olmak üzere birçok fayda göstermiştir12,19. Hipotermikten normotermik makine perfüzyonuna (oksijen taşıyıcılı veya taşıyıcısız) kadar çeşitli modaliteler geliştirilmiştir, birkaç perfüzat mevcuttur, ancak sadece birkaçı uterus20 üzerinde test edilmiştir. Bu tür araştırma perspektiflerinin önemli katkısını sağlamak için, ilgili klinik öncesi cerrahi modeller çok önemlidir.
Bu çalışmada, subnormotermik makine perfüzyonu (SNMP), oda sıcaklığında (yaklaşık 20 °C) bir perfüzatın bir silindir pompası ve bir oksijenatör aracılığıyla dolaştırılmasıyla oksijenli dinamik organ koruma yöntemi olarak kullanılmıştır. Anatomi, fizyoloji ve damar büyüklüğü açısından insan üreme sistemi ile benzerlikleri nedeniyle UTx ve koruma ile ilgili çalışmalarla ilgili bir domuz modeli kullanılmaktadır21,22. Rahim, dolaşım ölümünü takiben temin edilir, bu da kardiyak ölümden sonra bağış için uygunluk sağlar ve diğer tüm ilgili katı organlardan sonra bir tedarik gecikmesi olasılığını düşündürür 23,24. Ek olarak, bu model, "3R" ilkelerini uygulayarak, diğer organlara odaklanan yerleşik nakil laboratuvarlarında rahim koruma çalışmalarının geliştirilmesini kolaylaştırır25. Amaç, uterus pediküllerine dayalı yeni bir koruma modeli oluşturmak ve dinamik koruma için güvenilirliğini değerlendirmektir. Histerektomiden korumaya kadar tüm prosedür adımları detaylandırılmıştır ve SNMP kullanımıyla ilgili vurgulanan kilit noktaları kapsar.
Aşağıda açıklanan protokol, her iki uterin arter için tek bir pompa ve bir "Y-tubing" giriş sistemine dayanan bir ön deneyden önce geldi (Ek Şekil 1). 4 h-SNMP'den sonra, organ başlangıçtaki ağırlığının% 50'sinden fazlasını kazandı. Akış, basınç, direnç ve ağırlık değişimi Ek Şekil 2'de gösterilmiştir. İki girişe ayrılmış tek bir perfüzyon sistemi, her bir akış hızının her iki tarafın basıncına modülasyonuna izin vermedi. Bu durumda, SNMP organın yarısında önemli miktarda ödeme yol açmıştır (Ek Şekil 3). Bu sistemin rahim modeli için uygun olmadığı kanıtlandı, çünkü kısmen mükemmel simetrik bir model olarak düşünülmemesi gerekiyordu. Bu nedenle, bu protokolde her uterin arter için bir tane olmak üzere iki makine perfüzyon sistemi kullanıldı.
Protokol
Tüm hayvanlar, Laboratuvar Hayvanlarının Bakımı ve Kullanımı için Ulusal Sağlık Enstitüsü Rehberi'ne uygun olarak insancıl bakım aldı ve protokoller Massachusetts Genel Hastanesi Kurumsal Hayvan Bakımı ve Kullanımı Komitesi (IACUC) tarafından onaylandı. Genel olarak, uterus alımı için 30-40 kg ağırlığında 6 dişi Yucatan minipigi kullanıldı ve dört uterusa SNMP uygulandı. Tüm hayvanlar ötenazi öncesi bir tam doz (100 IU / kg) ile heparinize edildi. Organ alımı, 60 dakikadan daha az sıcak iskemi ile ölüm sonrası gerçekleşti. "3R" ilkelerine göre farklı çalışmalar için aynı donörden başka organlar da toplanmış olabilir25. Protokolde kullanılan tüm reaktifler ve ekipmanlarla ilgili ayrıntılar için Malzeme Tablosuna bakın.
1. Ameliyat öncesi hazırlık (ameliyattan bir gün önce)
- Perfüzat çözeltisini hazırlayın. Subnormotermik makine perfüzyonu için VCA için optimize edilmiş bir Steen+ solüsyonu kullanıldı26,27. Rahim başına bir litre çözelti kullanıldı ve bileşim Tablo 1'de detaylandırılmıştır.
NOT: Yaklaşık 7.5-7.6'lık bir pH elde etmek amacıyla perfüzata büyük miktarda sodyum hidroksit eklenir. Bu değer açıkça yüksektir, ancak makine bir karbojen karışımı (%95 oksijen; %5 karbon dioksit) ile sirküle edilirken ve oksijenlendirilirken pH düşme eğiliminde olacağından gereklidir. - Makine perfüzyon sistemini kurun (Şekil 1). Perfüzat sirküle edildiğinde sızıntı ve kabarcık olup olmadığını kontrol edin.
2. Ölüm sonrası rahim temini
NOT: Kardiyak ölüm ve/veya ölüm sonrası tedarikten sonra bağışı simüle etmek için, hayvana yerel IACUC yönergelerine göre ötenazi yapılmalıdır. Çalışmaya müdahale edebilecek toksisiteyi önlemek için intravenöz Pentobarbital enjeksiyona kan durumu tercih edilmelidir.
- Ötenazi yapılmış hayvanı sırtüstü pozisyona getirin. Karın bölgesini fırçalayın ve steril örtüler yerleştirin.
- #20 bıçakla 10 cm'lik medyan göbek altı insizyon yapın.
- Deri altı dokusunu ve aponevrozu monopolar elektrikli bir neşter ile açın.
NOT: Karın boşluğunun açılarak bağırsaklara zarar vermemesine dikkat edilmelidir. - İnce bağırsağı cerrahi bir gazlı bezle bir kenara koyun ve uterusu açığa çıkarın.
NOT: Kullanılan modelin rahim anatomisi Şekil 2A'da gösterilmiştir. - Sol ve sağ taraflar için benzer şekilde aşağıdaki gibi devam edin:
- Rahim damarlarını tanımlayın.
NOT: Uterin ven, uterin artere lateral olarak konumlandırılmıştır (Şekil 3). - Dik açılı forseps ile uterus venine lateral olarak geniş ligament içine bir açıklık oluşturun.
- Bu açıklıktan 2-0 ipek kravat dikişleri yerleştirin ve yumurtalık damarlarını bağlayın ve koter kullanarak uterusu geniş ligamentteki çevre bağ dokusundan serbest bırakın.
- Rahim-yumurtalık damarlarını 2-0 ipek bağ dikişleri ile bağlayın ve yumurtalığı ve tüpü çıkarın.
- Rahim damarlarını iskeletleştirin ve mümkün olduğunca iç iliak damarlara yakın bölün.
NOT: Kanülasyonu kolaylaştırmak ve pedikül koptuktan sonra pedikülün geri çekilmesini tahmin etmek için pedikülün mümkün olduğu kadar uzun süre tutulmasına dikkat edilmelidir. - Karşı taraftaki 2.5.1-2.5.5 adımlarını tekrarlayın.
- Rahim damarlarını tanımlayın.
- Monopolar elektrikli neşter ile rahim ağzını keserek uterusu çıkarın.
NOT: Uygun serviks damarı pıhtılaşmasını sağlamak için uzun bir temas süresi kullanın ve perfüzyon sırasında sızıntıyı önleyin.
3. Perfüzyon için hazırlık
- Bir yan masada, mikrocerrahi bir dilatör kullanarak her iki uterin arteri genişletin ve bir anjiyokateter yerleştirin. Kanülasyonu 3-0 ipek bağlarla sabitleyin (Şekil 2B).
NOT: Burada tüm arterler için 18 G anjiyokateter kullanıldı. Bifurkasyon nispeten yakın olduğundan, seçici kanülasyondan kaçınmak için kateteri çok uzağa yerleştirmemeye özen gösterilmelidir. Rahim damarları kanüle edilmez, çünkü venöz çıkış bu damarların lümenini açık tutmak için yeterlidir ve kolay toplanmaya izin verir. Zaman tasarrufuna ek olarak, travmatik kanülasyon vasküler hasara yol açabilir ve potansiyel olarak venöz akışı etkileyebilir. - Her iki uterin arteri, tüm damarlar yıkanana ve çıkışlar netleşene kadar her iki tarafta 20 mL heparin solüsyonu ile yavaşça manuel olarak yıkayın.
NOT: Mikrovasküler yaralanmalara ve perfüzyon yetmezliğine yol açabilecek yüksek basınçla yıkama yapılmamasına dikkat edilmelidir. - Rahmi tartın.
4. Subnormotermik makine perfüzyonu
NOT: Rahim için iki bağımsız makine perfüzyon sistemi gereklidir. Her uterin arter, bir silindir pompası, bir oksijenatör, bir baloncuk tutucu ve bir basınç sensöründen oluşan bir perfüzyon sistemine bağlanır. Bir rezervuardaki perfüzat, uterus arteri yoluyla organdan her iki taraftaki uterus damarına geçmeden önce yukarıda listelenen elemanlara bağlı silikon tüpler aracılığıyla dolaşır, burada perfüzat çıkar ve aynı rezervuarda serbest bırakılır.
- Uterin arter kanüllerini giriş tüpüne bağlayarak uterusu makine perfüzyon sistemlerine bağlayın (Şekil 1).
- Makaralı pompayı kullanarak, 25-35 mmHg arasında sabit bir arteriyel basıncı korumak için akış hızını düşük (2,5-4,0 mL/dak) olarak ayarlayın.
- 1 mL'lik bir şırınga kullanarak hem giriş hem de çıkışta önceden tanımlanmış her bir zaman noktasında canlılık parametrelerini değerlendirin ve numuneleri kan gazı sistemi makinesiyle analiz edin [örneğin, kan gazı ölçümleri (pH, pCO2, pO2, laktat, baz fazlalığı, bikarbonat), glikoz, sodyum, potasyum, kalsiyum, klorür].
NOT: Bu protokolde perfüzyon 4 saat sürer ve her 30 dakikada bir giriş ve çıkıştan örnekler alınır. - Perfüzyonun sonunda uterusu tartın.
Sonuçlar
Perfüzyon sırasında sistem, deney sırasında basıncı kaydeden bir basınç sensörüne bağlandı. Basınç başlangıçta uterussuz bir sistem için kaydedildi ve gerçek organ basıncını elde etmek için uterus perfüzyonu sırasında basınç kayıtlarından çıkarıldı. Akış hızı, basıncı istenen aralıkta tutacak şekilde uyarlandı ve silindir pompası tarafından kontrol edildi. Direnç, R = P / Q (R: direnç (mmHg.mL.min-1); P: basınç (mmHg); Q: akış hızı (mL / dak)).
Perfüzyon parametrelerinin gelişimi Şekil 4'te gösterilmiştir. Ortalama başlangıç akış hızı her iki tarafta 5.2 (min 2.4, max 10.0) mL / dk idi ve deney sırasında fazla dalgalanma göstermedi. Literatüre ve önceki deneylere dayanarak, hedef basınç 25-35 mmHg olarak ayarlanmıştır. Ortalama başlangıç arter basıncı uterusun sol tarafında 26 (min 10, max 36) mmHg ve sağ tarafta 27 (min 16, max 39) mmHg idi. Akış ve basınç biraz kararlı ve düşük olduğundan, ortaya çıkan arteriyel direnç profili de deney boyunca düz bir eğri gösterdi. Ortalama başlangıç vasküler direnci her iki tarafta 8.5 (min 1, max 13.3) mmHg.mL.min-1 idi (Şekil 4).
SNMP koruması çeşitli metabolik parametrelere göre değerlendirildi (Şekil 5): laktat klerensi (laktat çıkışı ve laktat akışı arasındaki fark), ağırlık değişimi, giriş glukozu ile çıkış glukozu arasındaki fark, glukoz tüketimini yansıtan ve oksijen tüketimi. Oksijen tüketimi, O2tüketimi = 0.0314 x Q x (pO2 girişi - pO2 çıkışı) / W (Q: akış hızı (mL / dak), pO2: kısmi oksijen basıncı (mmHg), W: ağırlık (g) ve 0.0314 Henry'nin 20 ° C ve 1 atm'de suda sabiti) formülü kullanılarak hesaplandı. Perfüzyonun ilk saatinde laktat seviyelerindeki azalma, makine perfüzyonunun sıcak iskemik faz sırasında birikimi takiben laktat klerensine izin verdiğini gösterir. Kilo değişimi, uterusların hiçbirinde ödem olmadığını gösterdi. Eğri, kilo kaybının esas olarak ilk iki saat içinde meydana geldiğini ve kilonun daha sonra stabilize olma eğiliminde olduğunu vurguladı. Giriş ve çıkış arasındaki glikoz farkı, düşük değerlerde stabilize olmadan önce perfüzyonun ilk saatinde azaldı. Perfüzyon sırasında oksijen tüketimi sabit kaldı.
4 saatlik SNMP'den sonra, her uterusta anjiyografi yapıldı ve her uterin arterde 20 mL kontrast madde yavaşça akıtıldı (Şekil 6), bu da koruma aşamasından sonra vasküler ağacın değerlendirilmesini sağladı. Tüm organlarda, mikrovaskülatür serviks, uterus gövdesi ve boynuzlar boyunca iyi tanımlanmıştır.
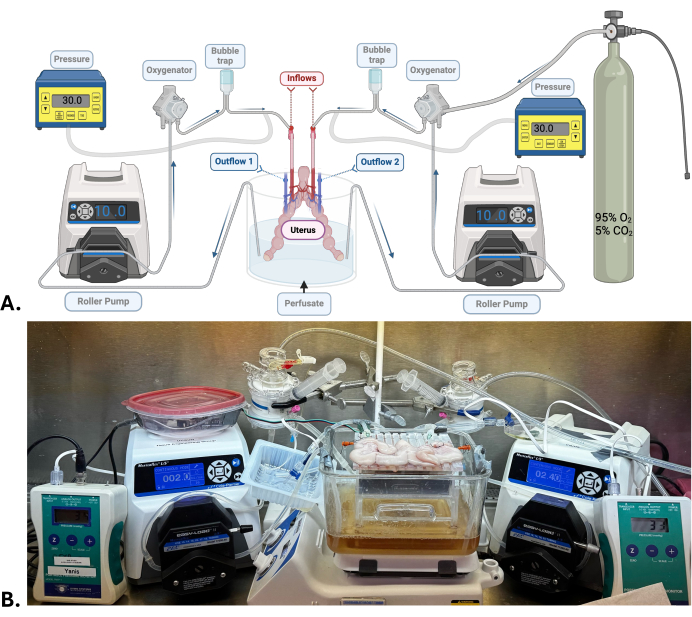
Şekil 1: Cerrahi model ve makine perfüzyon sistemi. (A) Uterus SNMP için kullanılan makine perfüzyon sisteminin şeması. (B) SNMP uygulanan bir domuz rahminin temsili fotoğrafı. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 2: Uterin arter boyunca ana vaskülarizasyonu gösteren insan (solda) ve domuz (sağda) uterus anatomisi diyagramı. Domuz rahminin anatomik özellikleri, esas olarak iki büyük rahim boynuzuna bölünmüş küçük bir gövdenin varlığından kaynaklanmaktadır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 3: Ameliyat içi ve sonrası görüntüler. (A) Rahim damarları tanımlandıktan sonra uterusun intraoperatif resmi. (B) Tedarik ve heparin-salin yıkamasından sonra uterusun ameliyat sonrası görüntüleri. A: külliyat; B: rahim boynuzları; C: rahim ağzı; D: uterus arterleri; E: rahim damarları; F: tüp; G: yumurtalık. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
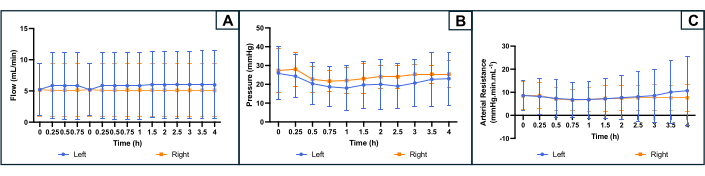
Şekil 4: Her iki uterus tarafında 4 saatlik makine perfüzyonu sırasında perfüzyon parametrelerinin profili. (A) Akış hızı (mL / dak). (B) Basınç (mmHg). (c) Hesaplanan arteriyel direnç (mmHg.min.mL-1). Eğriler uterusun her iki tarafı için ortalamayı gösterir ve hata çubukları ortalamanın standart sapmasını gösterir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
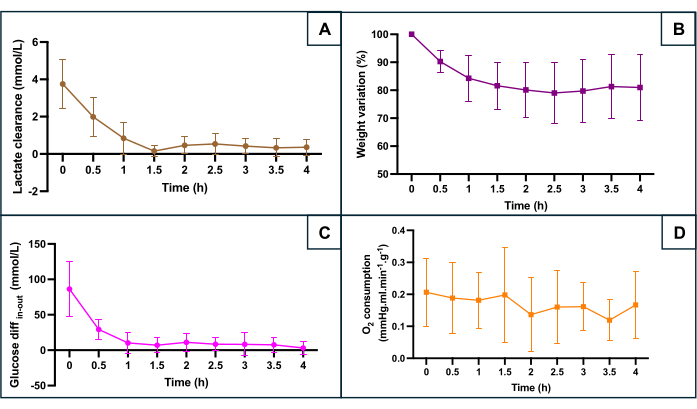
Şekil 5: Makine perfüzyonu sırasında ana hipoksi belirteçlerinin izlenmesi. (A) Stabilizasyondan önce perfüzyonun ilk 90 dakikası boyunca laktat klerensi. (B) Perfüzyon boyunca ağırlık azalır. (C) Giriş ve çıkış glikoz konsantrasyonu arasındaki fark. (D) Hesaplanan O2 tüketimi. Veriler, her uterusun her iki tarafı için ortalamayı temsil eder ve hata çubukları ortalamanın standart sapmasını gösterir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 6: Subnormotermik koruma sonrası uterus vasküler ağacının temsili anjiyografisi. (A) Kontrast madde enjeksiyonundan önce. (B) Kontrast madde enjeksiyonundan sonra. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
| Bileşen adı | Miktar | Bileşen adı | Miktar |
| Deiyonize su | 1 litre | Dekstran düşük fraksiyon (~ 75 kDa) | 5 gr |
| NaCl (Doğal) | 5.026 gr | Sığır Serumu Albümini | 150 gr |
| Kartal | 0.343 gr | Hidrokortizon [50 mg/mL] | 0,2 mL |
| CaCl2 . 2H20 | 0.221 gr | Deksametazon [1.6 g / 100 mg] | 4 mL |
| NaH2PO4 | 0.187 gr | Sodyum hidroksit [1 mol/mL] | 16 mL |
| NaHCO3 | 1.26 gr | Düşük molekül ağırlıklı heparin | 200 IU |
| MgCl2 . 6H2O | 0.244 gr | Insülin | 200 IU |
| D-Glikoz | 4.3 gr | Vankomisin | 1.5 gr |
| PEG (35 kDa) | 5 gr |
Tablo 1: Steen+ çözelti bileşimi. NaCl: sodyum klorür; KCl: potasyum klorür; CaCl2. 2H20: kalsiyum klorür dihidrat; NaH2PO4: sodyum dihidrojen fosfat; NaHCO3: sodyum bikarbonat; MgCl2 . 6H2O: magnezyum klorür hekzahidrat; PİM; polietilen glikol.
Ek Şekil 1: Tek pompa tabanlı perfüzyon sistemi. (A) Ön deney için kullanılan makine perfüzyonu "Y-sistemi" diyagramı. (B) Ön deney için kurulumun temsili fotoğrafı. Bu dosyayı indirmek için lütfen buraya tıklayın.
Ek Şekil 2: Ön deney için 4.5h-SNMP sırasında perfüzyon parametrelerinin profili. (A) Akış hızı (mL/dak). (B) Basınç (mmHg). (c) Hesaplanan arteriyel direnç (mmHg.min.mL-1). (D) Perfüzyon boyunca artan ağırlık. Bu dosyayı indirmek için lütfen buraya tıklayın.
Ek Şekil 3: Ön deneyin sonunda uterusun fotoğrafı (4.5 h-SNMP). Asimetrik bir ödem dağılımı, esas olarak sağ boynuzda (görüntünün sağında) belirgindir. Bu dosyayı indirmek için lütfen buraya tıklayın.
Tartışmalar
Genellikle VCA'nın bir parçası olarak kabul edilen uterus nakli, son birkaç yılda hızla gelişmiştir. Buna paralel olarak, katı organ korumasını iyileştirmede sağlam kanıtlar gösterdiği için VCA'da makine perfüzyonu araştırılmaya başlandı. Hipotermik ve subnormotermik makine perfüzyonu, miyokutanöz ve kemik içeren VCA26,27,28'in domuz modellerinde 24 saate kadar korumaya izin vermiştir. Rahim, kemik ve deri içeren VCA ile karşılaştırılabilir zorluklar sunduğundan, koruma kalitesini ve uzun vadeli sonuçları artırmak için UTx için benzer teknikleri araştırmak çok önemlidir29. Organ kalitesini iyileştirmenin ötesinde, makine perfüzyonu kullanarak dinamik korumanın potansiyel bir yararı da bağışçı havuzunu genişletmektir30. Canlı vericilerden rahim alınması, uterus pedikülünün diseksiyonu sırasında üreter yaralanması gibi önemli risklerin yanı sıra hormonal bozulma ve yapılabilecek overektomiye bağlı erken menopozla ilişkili tüm potansiyel riskleri de beraberinde getirir31,32. Ölen donör organlarının kalitesini artırma amacı, canlı donör tedarik prosedürlerinde bu tür bir ameliyata olan ihtiyacı ortadan kaldıracaktır. Nihai hedef, mutlak uterus infertilitesi olan kadınların ihtiyaçlarını karşılamak için hem yaşayan hem de ölen donörlerde uterus teminini sağlamak olacaktır33.
Bu makale, makine perfüzyonu kullanılarak domuz uterusu temini ve korunması için tekrarlanabilir bir model sunmaktadır. Koruma kalitesinin ve süresinin iyileştirilmesi, beyin ölümü gerçekleşmiş donörlerin rahim temini için güvenilir kaynaklar olmasını sağlayarak donör havuzunun genişletilmesi ile ilgilidir. Klinik olarak, çoğu UTx, çoğunlukla aile üyeleri veya yakın arkadaşlar olmak üzere canlı donörlere dayalı olarak gerçekleştirildi. İskemi süresi, özellikle beyin ölümü gerçekleşmiş donörlerde, nihai organ canlılığında kritik bir faktördür. IRI, genellikle sıcaklık artışı ile ilişkili olan ve hücre hasarlarına katkıda bulunan bir dizi iskemi (organ vasküler ağacında kan dolaşımının kesilmesi) ve reperfüzyonun (oksijen kaynağının geri dönüşü) neden olduğu hücresel hasar ile tanımlanır. Bu olaylar dizisi reaktif oksijen türleri üretir ve sonunda kronik inflamasyona, apoptoza, antijen salınımına ve greft reddine yol açar 7,8,34. Sıcak (WIT) ve soğuk iskemi zamanları IRI sürecinde kritik faktörlerdir, ancak sadece birkaç yazar bunu uterusta incelemiştir. UTx farelerinde uzun süreli SCS korumasının etkisini araştıran bir çalışmada, 24 saatlik SCS'den sonra transplantasyon gerçekleştirildi ve altı hayvandan beşinde başarılı gebelikler gelişti. Bununla birlikte, 48 saatlik SCS'den sonra, tüm nakillernekroz 35 gösterdi. 3 saat SCS (n = 7) ve 24 saat SCS'den (n = 7) sonra 14 koyunda UTx'i karşılaştıran başka bir çalışmada, nakilden 8 gün sonra sadece 7 hayvan hayattaydı, uterusun% 35'i ödem ve nekroz açısından uygun kabul edildi, 3 h SCS grubunda 2 uteri ve 24 h SCS grubunda 3 uteri36. İlginç bir şekilde, myometriumun kasılması canlı uterusta korundu, ancak yöntem değerlendirmesi belirtilmedi. Bu, başarılı bir rahim naklinin sadece uygulanabilir bir grefti değil, aynı zamanda fonksiyonel menstrüasyonu ve başarılı bir hamileliği de içerdiğini düşünmenin kritik önemini vurgulamaktadır. Bu bağlamda, IRI'nin ve olumsuz sonuçlarının azaltılması, greft kalitesinde iyileşme ve daha iyi canlı doğum başarı oranları sağlamak için ilkeldir. Tutarlılığı sağlamak için, tüm organları karşılaştırılabilir WIT'den sonra topladığımızdan emin olduk. Geniş ligament içindeki tüm damarlar, ilgili basınç ölçümünü ve tüm organa yeterli kılcal perfüzyonu sağlamak için pıhtılaştırıldı veya bağlandı. Kateterizasyon, damarlara zarar vermekten kaçınırken kanülü sabitlemek için dikkat edilmesi gereken bir diğer önemli noktadır.
Bir "Y-sistemi" ile yapılan ön deney, her uterin arteri ayrı ayrı ele alan iki bağımsız perfüzyon sisteminin optimizasyonuna yol açtı. Gerçekten de, kritik parametrelerden biri, organın genel vasküler direncini yansıtan akış hızının uyarlanmasına yol açan akış hızı ve perfüzyon basıncıdır26,27. Optimize edilmiş bilateral akış, sonuçlarımızda vurgulandığı gibi organın her iki tarafından laktat klerensine izin verdi (Şekil 5) ve ayrıca tüm metabolik parametreler için sürekli arterio-venöz fark ölçümleri. Subnormotermik sıcaklıkta, makine perfüzyonu ile hücresel reoksijenasyon, tedarik ve kanülasyon sırasında hipoksi ve hipoperfüzyon ile ilişkili anaerobik metabolik faz sırasında biriken laktatların ortadan kaldırılmasına izin verir, metabolik aktiviteyi düşük tutar ve laktat geri tepmesini önler. Sıçan arka ayaklarındada benzer sonuçlar bulunmuştur 19. Başka bir anatomik modelde, Dion ve ark. hipotermik perfüzyon çalışmasında uterusu aort ile birlikte çıkararak farklı bir yaklaşım göstermiştir37. Aort tabanlı tek perfüzyonun protokolümüzde geliştirilen model ile düzgün bir şekilde karşılaştırılması ileride yapılacak çalışmalar için büyük ilgi görecektir.
Domuz uterusunun makine perfüzyonu için tekrarlanabilir bir model burada tarif edilmiş olsa da, önemli bir endişe daha fazla transplantasyon için uygunluktur. Koruma protokollerinin etkinliğini doğrulamak için, transplantasyon klinik ortamı yeniden oluşturduğu için çok önemlidir. Bu, arteriyel ve venöz mikrocerrahi anastomozlar gerektirir. Birçok çalışma, uterus veninin venöz drenajı sağlamak için yetersiz kalibrede olduğu durumlarda utero-over veninin klinik UTx'te kullanılabileceğini göstermiştir38,39. Bu modeldeki bir sınırlama, utero-yumurtalık veninin korunmamasıdır. Bununla birlikte, dahil edilen tüm replikalarda 4 saat SNMP'den sonra majör ödem kaydedilmedi ve tüm uterin venlerden sürekli venöz çıkış kaydedildi. Bu, Yucatan minipiglerinde UTx prosedürlerinin potansiyel olarak basitleştirilmesi ile insan ve domuz modelleri arasında bir fark olduğunu göstermektedir. Daha ileri çalışmalar, dinamik korumanın sınırlarını belirlemek için perfüzyon süresinin 4 saatin üzerine uzatılmasını içermelidir. Sonuç olarak, bu makale, makine perfüzyonuna dayalı korumayı incelemek için tekrarlanabilir bir domuz uterus modelini açıklamakta ve UTx için mevcut organların toplam sayısını artırmak amacıyla IRI'yi hedeflemek için değerli bir kaynak sağlamaktadır.
Açıklamalar
Tüm yazarların beyan edecek herhangi bir mali çıkarı yoktur.
Teşekkürler
Bu çalışma kısmen Ulusal Sağlık Enstitüsü tarafından R01AR082825 No'lu (BEU) ve Shriners Children's 84308 (YB) ödülü altında finanse edilmiştir. HO ve YB, Fondation des Gueules Cassées'den fon aldı. Société Française de Chirurgie Plastique, Reconstructrice et Esthétique (SOFCPRE, Fransa) ve CHU de Rennes'den (Fransa) YB'ye verilen destek büyük ölçüde kabul görmektedir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Affinity Pixie Oxygenation System | Medtronic | BBP241 | Oxygenator |
| Bovin serum albumin | Sigma-Aldrich | A9647 | Perfusate component |
| Calcium chloride dihydrate | Sigma-Aldrich | 223506 | Perfusate component |
| Carbon Dioxide Oxygen | Airgas | UN3156 | Carbon Dioxide Oxygen mix gas |
| D-(+)-Glucose monohydrate | Sigma-Aldrich | 49159 | Perfusate component |
| Dexamethasone | Sigma-Aldrich | D2915 | Perfusate component |
| Dextran | Thermo scientific | 406271000 | Perfusate component |
| Heparin sodium injection | Eugia Pharma | 63739-953-25 | Perfusate component |
| Humulin Regular Insulin human | Lilly | 0002-8215-01 | Perfusate component |
| Hydrocortisone sodium succinate | Pfizer | 0009-0011-03 | Perfusate component |
| Magnesium chloride hexa-hydrate | Sigma-Aldrich | M9272 | Perfusate component |
| MasterFlex L/S | Cole-Parmer | 77200-32 | Roller pump |
| Polyethylene glycol 35000 | Sigma-Aldrich | 25322-68-3 | Perfusate component |
| Potassium chloride | Sigma-Aldrich | 7447-40-7 | Perfusate component |
| Pressure Monitor, Portable, PM-P-1 | Living Systems Instrumentation | PM-P-1 | Pressure sensor |
| Radnoti Bubble Trap Compliance Chamber | Radnoti | 130149 | Bubble trap |
| RAPIDPoint500 | Siemens | 500 | Blood Gas System |
| Sodium bicarbonate | Sigma-Aldrich | S5761 | Perfusate component |
| Sodium chloride | Sigma-Aldrich | S9888 | Perfusate component |
| Sodium hydroxide | Sigma-Aldrich | 72068 | Perfusate component |
| Sodium phosphate monobasique dihydrate | Sigma-Aldrich | 71505 | Perfusate component |
| Syringe 1 mL | BD | 309659 | Sample procurement |
| Vancomycine hydrochloride | Slate run pharmaceuticals | 70436-021-82 | Perfusate component |
Referanslar
- Ejzenberg, D., et al. Livebirth after uterus transplantation from a deceased donor in a recipient with uterine infertility. Lancet. 392 (10165), 2697-2704 (2019).
- Fageeh, W., Raffa, H., Jabbad, H., Marzouki, A. Transplantation of the human uterus. Int J Gynaecol Obstet. 76 (3), 245-251 (2002).
- Lavoue, V., et al. Which donor for uterus transplants: brain-dead donor or living donor? A systematic review. Transplantation. 101 (2), 267-277 (2017).
- Brännström, M., et al. Registry of the International Society of Uterus Transplantation: First report. Transplantation. 107 (1), 172-181 (2023).
- Van Dieren, V., et al. Acute rejection rates in vascularized composite allografts: A systematic review of case reports. J Surg Res. 298, 33-44 (2024).
- Kristek, J., et al. Human uterine vasculature with respect to uterus transplantation: A comprehensive review. J Obs Gynaecol Res. 46 (11), 1999-2007 (2020).
- He, J., Khan, U. Z., Qing, L., Wu, P., Tang, J. Improving the ischemia-reperfusion injury in vascularized composite allotransplantation: Clinical experience and experimental implications. Front Immunol. 13, 998952 (2022).
- Ponticelli, C. Ischaemia-reperfusion injury: A major protagonist in kidney transplantation. Nephrol Dial Transplant. 29 (6), 1134-1140 (2014).
- Harris, K., et al. Metabolic response of skeletal muscle to ischemia. Am J Physiol. 250 (2 Pt 2), H213-H220 (1986).
- Wranning Almen, C., et al. Short-term ischaemic storage of human uterine myometrium--basic studies towards uterine transplantation. Hum Reprod. 20 (10), 2736-2743 (2005).
- Bodewes, S. B., et al. Oxygen transport during ex situ machine perfusion of donor livers using red blood cells or artificial oxygen carriers. Int J Mol Sci. 22 (1), 235 (2020).
- Boncompagni, E., et al. Decreased apoptosis in fatty livers submitted to subnormothermic machine-perfusion respect to cold storage. Eur J Histochem. 55 (4), e40 (2011).
- Czigany, Z., et al. Hypothermic oxygenated machine perfusion reduces early allograft injury and improves post-transplant outcomes in extended criteria donation liver transplantation from donation after brain death: Results from a Multicenter Randomized Controlled Trial (HOPE ECD-DBD). Ann Surg. 274 (5), 705-712 (2021).
- Markmann, J. F., et al. Impact of portable normothermic blood-based machine perfusion on outcomes of liver transplant: The OCS Liver PROTECT randomized clinical trial. JAMA Surg. 157 (3), 189-198 (2022).
- Cypel, M., et al. Normothermic ex vivo lung perfusion in clinical lung transplantation. New Eng J Med. 364 (15), 1431-1440 (2011).
- Roesel, M. J., Ius, F., Knosalla, C., Iske, J. The role of ex-situ perfusion for thoracic organs. Curr Opin Organ Transplant. 27 (5), 466-473 (2022).
- Michel, S. G., et al. Twelve-hour hypothermic machine perfusion for donor heart preservation leads to improved ultrastructural characteristics compared to conventional cold storage. Ann Transplant. 20, 461-468 (2015).
- Ghoneima, A. S., Sousa Da Silva, R. X., Gosteli, M. A., Barlow, A. D., Kron, P. Outcomes of kidney perfusion techniques in transplantation from deceased donors: A systematic review and meta-analysis. J Clin Med. 12 (12), 3221 (2023).
- Charlès, L., et al. Effect of subnormothermic machine perfusion on the preservation of vascularized composite allografts after prolonged warm ischemia. Transplantation. 108 (5), e280-e290 (2024).
- Duru, &. #. 1. 9. 9. ;., et al. Review of machine perfusion studies in vascularized composite allotransplant preservation. Front Transplantation. 2, 103-111 (2023).
- Brännström, M., Diaz-Garcia, C., Hanafy, A., Olausson, M., Tzakis, A. Uterus transplantation: Animal research and human possibilities. Fertil Steril. 97 (6), 1269-1276 (2012).
- Wranning, C. A., et al. Auto-transplantation of the uterus in the domestic pig (Sus scrofa): Surgical technique and early reperfusion events. J Obstet Gynaecol Res. 32 (4), 358-367 (2006).
- Croome, K. P., et al. American Society of Transplant Surgeons recommendations on best practices in donation after circulatory death organ procurement. Am J Transplant. 23 (2), 171-179 (2023).
- Dickens, B. M. Legal and ethical issues of uterus transplantation. Int J Gynaecol Obstet. 133 (1), 125-128 (2016).
- Díaz, L., et al. Ethical considerations in animal research: The Principle of 3R's. Rev Invest Clin. 73 (4), 199-209 (2020).
- Goutard, M., et al. Machine perfusion enables 24-h preservation of vascularized composite allografts in a swine model of allotransplantation. Transpl Int. 37 (1), 102-111 (2024).
- Berkane, Y., et al. Towards optimizing sub-normothermic machine perfusion in fasciocutaneous flaps: A large animal study. Bioengineering (Basel). 10 (12), 1545 (2023).
- Brouwers, K., et al. 24-hour perfusion of porcine myocutaneous flaps mitigates reperfusion injury: a 7-day follow-up study. Plast Reconstr Surg Glob Open. 10 (2), e4123 (2022).
- Richter, O., et al. Extracorporeal perfusion of the human uterus as an experimental model in gynaecology and reproductive medicine. Human Reprod. 15 (6), 1235-1240 (2000).
- O'Neill, K., et al. Availability of deceased donors for uterus transplantation in the United States: Perception vs Reality. Transplantology. 5 (1), 27-36 (2024).
- Chan, J. K., Morrow, J., Manetta, A. Prevention of ureteral injuries in gynecologic surgery. Am J Obstet Gynecol. 188 (5), 1273-1277 (2003).
- Rocca, W. A., et al. Accelerated accumulation of multimorbidity after bilateral oophorectomy: A population-based cohort study. Mayo Clin Proc. 91 (11), 1577-1589 (2016).
- Dion, L., et al. Procurement of uterus in a deceased donor multi-organ donation National Program in France: A scarce resource for uterus transplantation. J Clin Med. 11 (3), 730 (2022).
- Agarwal, A., et al. Clinicopathological analysis of uterine allografts including proposed scoring of ischemia reperfusion injury and t-cell-mediated rejection-dallas uterus transplant study: A pilot study. Transplantation. 106 (1), e10-e20 (2022).
- Díaz-García, L., et al. Pregnancy in transplanted mouse uterus after long-term cold ischaemic preservation. Hum Reprod. 18 (10), 2142-2150 (2003).
- Tricard, J., et al. Uterus tolerance to extended cold ischemic storage after auto-transplantation in ewes. Eur J Obstet Gynecol Reprod Biol. 214, 162-167 (2017).
- Dion, L., et al. Hypothermic machine perfusion for uterus transplantation. Fertil Steril. 120 (6), 1259-1261 (2023).
- Brännström, M., et al. Experimental uterus transplantation. Hum Reprod Update. 16 (3), 329-340 (2010).
- Ozkan, O., Ozkan, O., Dogan, N. U. The Ozkan technique in current use in uterus transplantation: from the first ever successful attempt to clinical reality. J Clin Med. 12 (8), 2812 (2023).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır