Method Article
Establecimiento de un modelo porcino para estudiar la preservación dinámica del útero y el trasplante
En este artículo
Resumen
Se describe un modelo detallado y reproducible de útero porcino, desde la obtención quirúrgica hasta el inicio de la perfusión mecánica, lo que permite el estudio de la preservación del útero en el trasplante.
Resumen
Hasta la fecha, el trasplante de útero es la única opción para que las mujeres con infertilidad uterina absoluta, como las que tienen síndrome de Rokitansky, experimenten el embarazo y den a luz. A pesar del creciente interés en el trasplante de útero en los últimos años, hay varios temas que aún requieren más investigación, incluida la lesión por isquemia-reperfusión y su impacto en la calidad y el rechazo del injerto. La literatura reciente ha puesto de manifiesto una tasa de complicaciones trombóticas de hasta el 20% tras el trasplante de útero. Este tipo de complicación puede ser el resultado del daño de las células endoteliales inducido por la hipoxia, que a menudo conduce al rechazo del injerto uterino. La hipoxia se induce durante el almacenamiento estático en frío, que sigue siendo el estándar de oro para la preservación del injerto en el trasplante de órganos sólidos. Recientemente, se ha demostrado que la preservación dinámica mediante perfusión mecánica mejora el almacenamiento a largo plazo de órganos convencionales y marginales al reducir la lesión isquémica e hipóxica. En este protocolo, nuestro objetivo es describir todas las etapas quirúrgicas involucradas en la obtención y preservación dinámica del útero porcino, a partir de ambos pedículos uterinos, para permitir la conexión e inicio del protocolo de perfusión con máquina.
Introducción
El trasplante de útero (UTx) se ha desarrollado significativamente en los últimos diez años, con varios equipos iniciando programas de investigación clínica. Hasta la fecha, la principal indicación de UTx es la infertilidad uterina absoluta debida a agenesia uterina, incluido el síndrome de Mayer-Rokitansky-Küster-Hauser (MRKH). El síndrome MRKH es un trastorno congénito con una prevalencia de uno de cada 5.000 nacidos vivos femeninos1. UTx podría abordar potencialmente causas adicionales de infertilidad, incluidas las resultantes de la histerectomía debido a una enfermedad maligna, hemorragia posparto, fibromas uterinos, secuelas infecciosas y diversas malformaciones congénitas. Esto sugiere que aproximadamente 1 de cada 500 mujeres puede ser elegible para UTx.
El primer UTx clínico ocurrió en el año 2000 en Arabia Saudita2, pero las complicaciones vasculares llevaron a una histerectomía tres meses después. Desde entonces, se han realizado varios casos de UTx, tanto en donantes vivos como fallecidos, resultando en más de 80 nacidos vivos 3,4. Al igual que en el ámbito del trasplante de órganos sólidos y los alotrasplantes compuestos vascularizados (VCA), el rechazo inmunitario es un desafío importante en UTx. 5 Varios factores pueden conducir al rechazo del injerto, incluida la insuficiencia microcirculatoria y la estasis venosa, los cuales pueden conducir a una complicación trombótica. En una revisión reciente que estudió la vascularización uterina en el trasplante, Kristek et al. reportaron hasta un 15% de trombosis arterial y un 5% de trombosis venosa6. Además, la isquemia fría y caliente son factores críticos que deben abordarse para el éxito del trasplante, ya que la lesión por isquemia-reperfusión (IRI) puede provocar disfunción del injerto y rechazo agudo 7,8. Los miocitos responden al estrés isquémico produciendo lactato durante un máximo de 6 h9, después del cual el daño de las células musculares es irreversible. El impacto de la isquemia fría en el miometrio se ha documentado en estudios clínicos, y se ha demostrado que el uso de una solución intracelular de la Universidad de Wisconsin durante el almacenamiento en frío estático (SCS) mejora la conservación con una mejor respuesta contráctil a la prostaglandina y concentraciones más altas de ATP en comparación con la solución de acetato de Ringer10. Sin embargo, el impacto de la isquemia fría y caliente sigue siendo poco explorado en UTx.
El SCS sigue siendo el estándar de oro para la preservación de VCA, incluido el útero, y para la mayoría de los trasplantes de órganos sólidos. Sin embargo, en los últimos años, los avances significativos en los sistemas de perfusión de máquinas y las soluciones de conservación han llevado a un cambio de paradigma. En la actualidad existen evidencias sólidas que apoyan que la perfusión dinámica con máquina puede mejorar y prolongar la conservación de órganos sólidos sanos y marginales 11,12,13,14,15. En la actualidad, esta técnica es comúnmente utilizada en la práctica clínica para el trasplante de pulmón, corazón, hígado y riñón 14,16,17,18. La preservación dinámica de órganos demostró múltiples beneficios, incluyendo la minimización de las lesiones por isquemia fría e hipoxia al proporcionar un suministro continuo de oxígeno y nutrientes, eliminar metabolitos tóxicos y mejorar la calidad del injerto y los parámetros de viabilidad12,19. Se han desarrollado múltiples modalidades, que van desde la hipotermia hasta la perfusión normotérmica en máquina (con o sin portadores de oxígeno), con varias perfusiones disponibles, pero solo unas pocas han sido probadas en el útero20. Para garantizar la contribución sustancial de estas perspectivas de investigación, los modelos quirúrgicos preclínicos relevantes son de crucial importancia.
En este trabajo, se utiliza la máquina de perfusión subnormotérmica (SNMP) como método de preservación dinámica de órganos oxigenados a temperatura ambiente (alrededor de 20 °C) mediante la circulación de un perfusado a través de una bomba de rodillo y un oxigenador. Se emplea un modelo porcino que es relevante para los estudios de UTx y preservación debido a sus similitudes con el sistema reproductor humano en términos de anatomía, fisiología y tamaño de los vasos21,22. El útero se obtiene después de la muerte circulatoria, lo que proporciona relevancia para la donación después de la muerte cardíaca y sugiere la posibilidad de un retraso en la obtención después de todos los demás órganos sólidos relevantes23,24. Además, este modelo facilita el desarrollo de estudios de preservación de útero dentro de laboratorios de trasplante establecidos, centrados en otros órganos, aplicando los principios de las "3R"25. El objetivo es establecer un nuevo modelo de preservación basado en pedículos uterinos y evaluar su fiabilidad para la preservación dinámica. Se detallan todos los pasos del procedimiento, desde la histerectomía hasta la preservación, abarcando los puntos clave resaltados sobre el uso de SNMP.
El protocolo que se describe a continuación precedió a un experimento preliminar basado en una sola bomba y un sistema de entrada de "tubo en Y" para ambas arterias uterinas (Figura complementaria 1). Después de 4 h-SNMP, el órgano ganó más del 50% de su peso inicial. El flujo, la presión, la resistencia y la variación del peso se muestran en la Figura complementaria 2. Un solo sistema de perfusión separado en dos entradas no permitía la modulación de cada caudal a la presión de cada lado. En este caso, el SNMP provocó un edema importante en la mitad del órgano (Figura complementaria 3). Este sistema resultó inadecuado para el modelo uterino, en parte porque no debía considerarse un modelo perfectamente simétrico. Por lo tanto, se utilizaron dos sistemas de perfusión en máquina en este protocolo, uno para cada arteria uterina.
Protocolo
Todos los animales recibieron atención humanitaria siguiendo la Guía del Instituto Nacional de Salud para el Cuidado y Uso de Animales de Laboratorio, y los protocolos fueron aprobados por el Comité Institucional de Cuidado y Uso de Animales (IACUC) del Hospital General de Massachusetts. En total, se utilizaron 6 minicerdos hembras de Yucatán con un peso de 30 a 40 kg para la obtención del útero, y cuatro úteros se sometieron a SNMP. Todos los animales fueron heparinizados con una dosis completa (100 UI/kg) antes de la eutanasia. La obtención de órganos ocurrió post-mortem con menos de 60 min de isquemia caliente. Otros órganos podrían haber sido extraídos del mismo donante para diferentes estudios, de acuerdo con los principios de las "3R"25. Consulte la Tabla de materiales para obtener detalles sobre todos los reactivos y equipos utilizados en el protocolo.
1. Preparación preoperatoria (día antes de la cirugía)
- Prepare la solución de perfusión. Para la perfusión subnormotérmica se utilizó una solución Steen+ optimizada para VCA26,27. Se utilizó un litro de solución por útero, cuya composición se detalla en la Tabla 1.
NOTA: Se añade una gran cantidad de hidróxido de sodio a la perfusión con el objetivo de conseguir un pH de alrededor de 7,5-7,6. Este valor es expresamente alto pero necesario ya que el pH tenderá a descender a medida que la máquina circule y se oxigene con una mezcla de cárgenos (95% de oxígeno; 5% de dióxido de carbono). - Configure el sistema de perfusión de la máquina (Figura 1). Compruebe si hay fugas y burbujas cuando circule la perfusión.
2. Obtención de útero post mortem
NOTA: Para simular la donación después de la muerte cardíaca y/o la adquisición post-mortem, el animal debe ser sacrificado de acuerdo con las pautas locales de la IACUC. Se debe preferir la exanguinación a la inyección intravenosa de pentobarbital para evitar toxicidad que pueda interferir con el estudio.
- Coloque al animal sacrificado en posición supina. Frote el área abdominal y coloque paños estériles.
- Realice una incisión infraumbilical mediana de 10 cm con una cuchilla #20.
- Abrir el tejido subcutáneo y la aponeurosis con un bisturí eléctrico monopolar.
NOTA: Se debe prestar atención a no dañar los intestinos al abrir la cavidad abdominal. - Apartar el intestino delgado con una gasa quirúrgica y exponer el útero.
NOTA: La anatomía uterina del modelo utilizado se muestra en la Figura 2A. - Proceda de manera similar para los lados izquierdo y derecho de la siguiente manera:
- Identificar los vasos uterinos.
NOTA: La vena uterina se coloca lateralmente a la arteria uterina (Figura 3). - Cree una abertura en el ligamento ancho lateralmente a la vena uterina con pinzas de ángulo recto.
- A través de esta abertura, inserte suturas de seda 2-0 para ligar los vasos ováricos y liberar el útero del tejido conectivo circundante en el ligamento ancho mediante cauterización.
- Ligara los vasos útero-ováricos con suturas de seda 2-0 y extrae el ovario y la trompa.
- Esqueletizar los vasos uterinos y dividirlos lo más cerca posible de los vasos ilíacos internos.
NOTA: Se debe prestar atención a mantener el pedículo el mayor tiempo posible para facilitar la canulación y anticipar la retracción del pedículo después de que se haya cortado. - Repita los pasos 2.5.1-2.5.5 en el lado opuesto.
- Identificar los vasos uterinos.
- Extirpa el útero cortando el cuello uterino con un bisturí eléctrico monopolar.
NOTA: Utilice un tiempo de contacto prolongado para asegurar la coagulación adecuada de los vasos del cuello uterino, evitando fugas durante la perfusión.
3. Preparación para la perfusión
- En una mesa auxiliar, dilate ambas arterias uterinas con un dilatador microquirúrgico e inserte un angiocatéter. Asegure la canulación con bridas de seda 3-0 (Figura 2B).
NOTA: En este caso, se utilizó un angiocatéter de 18 G para todas las arterias. Se debe tener cuidado de no insertar el catéter demasiado lejos para evitar la canulación selectiva, ya que la bifurcación es relativamente cercana. Las venas uterinas no están canuladas, ya que el flujo venoso es suficiente para mantener abierto el lumen de estos vasos, lo que permite una fácil recolección. Además de ahorrar tiempo, la canulación traumática puede provocar daño vascular y afectar potencialmente el flujo venoso. - Enjuague lentamente y manualmente ambas arterias uterinas con 20 ml de solución de heparina en cada lado hasta que todos los vasos se laven y las salidas estén limpias.
NOTA: Se debe prestar atención a no enjuagar con alta presión, lo que puede provocar lesiones microvasculares e insuficiencia de perfusión. - Pesa el útero.
4. Máquina de perfusión subnormotermo
NOTA: Para el útero, se requieren dos sistemas independientes de perfusión a máquina. Cada arteria uterina está conectada a un sistema de perfusión compuesto por una bomba de rodillos, un oxigenador, una trampa de burbujas y un sensor de presión. El perfusado en un reservorio circula a través de tubos de silicona conectados a los elementos enumerados anteriormente antes de correr a través del órgano a través de la arteria uterina hasta la vena uterina a cada lado, donde el perfusionado sale y se libera en el mismo reservorio.
- Conecte el útero a los sistemas de perfusión de la máquina conectando las cánulas de la arteria uterina al tubo de entrada (Figura 1).
- Con la bomba de rodillos, ajuste el caudal a bajo (2,5-4,0 mL/min) para mantener una presión arterial constante entre 25-35 mmHg.
- Evalúe los parámetros de viabilidad en cada punto de tiempo predefinido tanto en el flujo de entrada como en el de salida utilizando una jeringa de 1 mL y analizando muestras con la máquina del sistema de gases en sangre [por ejemplo, métricas de gases en sangre (pH, pCO2, pO2, lactato, exceso de bases, bicarbonato), glucosa, sodio, potasio, calcio, cloruro].
NOTA: En este protocolo, la perfusión dura 4 h, y se toman muestras del flujo de entrada y del flujo de salida cada 30 min. - Pesar el útero al final de la perfusión.
Resultados
Durante la perfusión, el sistema se conectó a un sensor de presión que registró la presión durante el experimento. La presión se registró inicialmente para un sistema libre de útero, que se restó de los registros de presión durante la perfusión uterina para obtener la presión real del órgano. El caudal se adaptó para mantener la presión dentro del rango deseado y se controló mediante la bomba de rodillos. La resistencia se calculó mediante la fórmula R = P / Q (R: resistencia (mmHg.mL.min-1); P: presión (mmHg); Q: caudal (mL/min)).
La evolución de los parámetros de perfusión se muestra en la Figura 4. El caudal medio inicial fue de 5,2 (min 2,4, max 10,0) mL/min en ambos lados y no fluctuó mucho durante el experimento. Sobre la base de la literatura y los experimentos anteriores, la presión objetivo se estableció en 25-35 mmHg. La presión arterial inicial promedio fue de 26 (min 10, max 36) mmHg en el lado izquierdo del útero y de 27 (min 16, max 39) mmHg en el lado derecho. Como el flujo y la presión fueron ligeramente estables y bajos, el perfil de resistencia arterial resultante también mostró una curva plana a lo largo del experimento. La resistencia vascular inicial media fue de 8,5 (min 1, max 13,3) mmHg.mL.min-1 en ambos lados (Figura 4).
La preservación del SNMP se evaluó de acuerdo con varios parámetros metabólicos (Figura 5): aclaramiento de lactato (diferencia entre el flujo de salida y el flujo de entrada de lactato), el cambio de peso, la diferencia entre la glucosa de entrada y la glucosa de salida que refleja el consumo de glucosa y el consumo de oxígeno. El consumo de oxígeno se calculó utilizando la fórmula O2consumo = 0,0314 x Q x (pO2 de entrada - pO2 de salida) / W (Q: caudal (mL/min), pO2: presión parcial de oxígeno (mmHg), W: peso (g) y 0,0314 constante de Henry en agua a 20 °C y 1 atm). La disminución de los niveles de lactato durante la primera hora de perfusión indica que la perfusión de la máquina permitió el aclaramiento de lactato después de la acumulación durante la fase isquémica caliente. El cambio de peso mostró que ninguno de los úteros tenía edema. La curva destacó que la pérdida de peso ocurrió principalmente durante las primeras dos horas y que el peso tendió a estabilizarse después. La diferencia de glucosa entre el flujo de entrada y el flujo de salida disminuyó durante la primera hora de perfusión antes de estabilizarse en valores bajos. El consumo de oxígeno se mantuvo constante durante la perfusión.
Después de 4 h de SNMP, se realizó una angiografía en cada útero, lavando lentamente 20 mL de agente de contraste en cada arteria uterina (Figura 6), lo que permitió la evaluación del árbol vascular después de la fase de conservación. En todos los órganos, la microvasculatura estaba bien identificada a lo largo del cuello uterino, el cuerpo uterino y los cuernos.
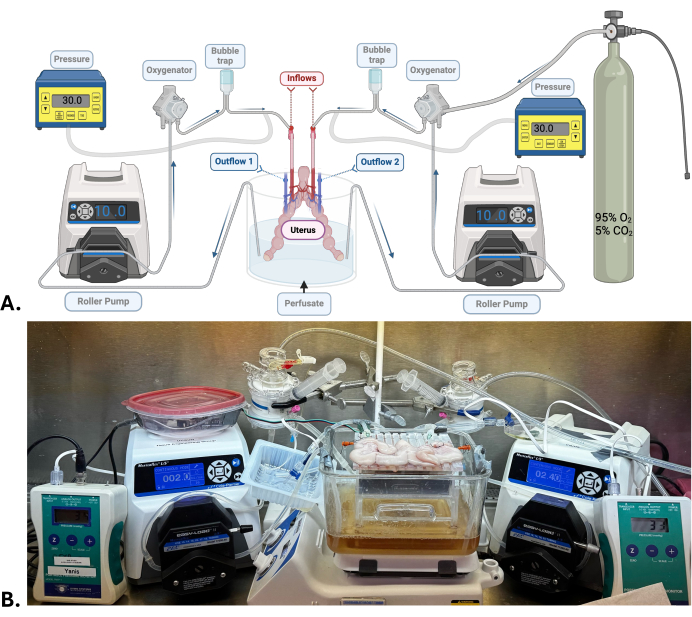
Figura 1: Modelo quirúrgico y sistema de perfusión de la máquina. (A) Diagrama del sistema de perfusión de la máquina utilizado para el SNMP del útero. (B) Fotografía representativa de un útero porcino sometido a SNMP. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Diagrama de la anatomía uterina humana (izquierda) y porcina (derecha) que muestra la vascularización principal a través de la arteria uterina. Las características anatómicas del útero porcino se deben principalmente a la presencia de un pequeño cuerpo dividido en dos grandes cuernos uterinos. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Vistas intra y postoperatorias. (A) Imagen intraoperatoria del útero después de identificar los vasos uterinos. (B) Imágenes postoperatorias del útero después de la obtención y el lavado con solución salina y heparina. A: corpus; B: cuernos uterinos; C: cuello uterino; D: arterias uterinas; E: venas uterinas; F: tubo; G: ovario. Haga clic aquí para ver una versión más grande de esta figura.
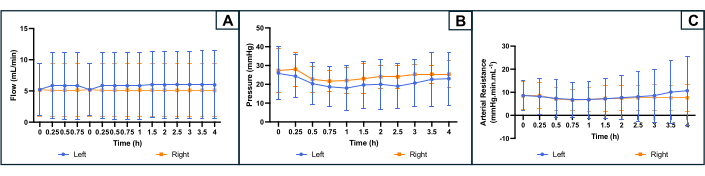
Figura 4: Perfil de los parámetros de perfusión durante 4 h de perfusión en máquina en ambos lados uterinos. (A) Caudal (mL/min). (b) Presión (mmHg). (C) resistencia arterial calculada (mmHg.min.mL-1). Las curvas indican el promedio para cada lado del útero y las barras de error indican la desviación estándar de la media. Haga clic aquí para ver una versión más grande de esta figura.
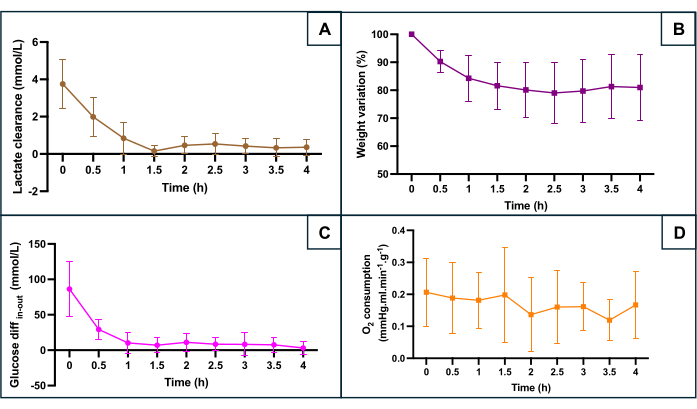
Figura 5: Monitorización de los principales marcadores de hipoxia durante la perfusión de la máquina. (A) Aclaramiento de lactato durante los primeros 90 minutos de perfusión antes de la estabilización. (B) El peso disminuye a lo largo de la perfusión. (C) Diferencia entre la concentración de glucosa de entrada y salida. (D) Consumo calculado de O2 . Los datos representan el promedio de ambos lados de cada útero, y las barras de error muestran la desviación estándar de la media. Haga clic aquí para ver una versión más grande de esta figura.

Figura 6: Angiografía representativa del árbol vascular uterino tras la preservación subnormotérmica. (A) Antes de la inyección del agente de contraste. (B) Después de la inyección del agente de contraste. Haga clic aquí para ver una versión más grande de esta figura.
| Nombre del componente | Cantidad | Nombre del componente | Cantidad |
| Agua desionizada | 1L | Fracción baja de dextrano (~75 kDa) | 5 g |
| NaCl | 5.026 g | Albúmina sérica bovina | 150 g |
| Kcl | 0,343 g | Hidrocortisona [50 mg/mL] | 0,2 ml |
| CaCl2 . 2H20 | 0,221 g | Dexametasona [1,6 g/100 mg] | 4 mL |
| NaH2PO4 | 0,187 g | Hidróxido de sodio [1 mol/mL] | 16 mL |
| NaHCO3 | 1,26 g | Heparina de bajo peso molecular | 200 UI |
| MgCl2 . 6H2O | 0,244 g | Insulina | 200 UI |
| D-Glucosa | 4,3 g | Vancomicina | 1,5 g |
| PEG (35 kDa) | 5 g |
Tabla 1: Composición de la solución Steen+. NaCl: cloruro de sodio; KCl: cloruro de potasio; CaCl2. 2H20: cloruro de calcio dihidratado; NaH2PO4: dihidrógeno fosfato de sodio; NaHCO3: bicarbonato de sodio; MgCl2 . 6H2O: cloruro de magnesio hexahidratado; CLAVIJA; polietilenglicol.
Figura complementaria 1: Sistema de perfusión basado en una sola bomba. (A) Diagrama del "sistema Y" de perfusión de la máquina utilizada para el experimento preliminar. (B) Fotografía representativa de la puesta en escena del experimento preliminar. Haga clic aquí para descargar este archivo.
Figura complementaria 2: Perfil de los parámetros de perfusión durante 4.5h-SNMP para el experimento preliminar. (A) Caudal (mL/min). (b) Presión (mmHg). (C) resistencia arterial calculada (mmHg.min.mL-1). (D) Aumento de peso a lo largo de la perfusión. Haga clic aquí para descargar este archivo.
Figura complementaria 3: Fotografía del útero al final del experimento preliminar (4,5 h-SNMP). Se evidencia una distribución asimétrica del edema, principalmente en el cuerno derecho (a la derecha de la imagen). Haga clic aquí para descargar este archivo.
Discusión
El trasplante de útero, a menudo considerado parte de la VCA, se ha desarrollado rápidamente en los últimos años. Paralelamente, se comenzó a explorar la perfusión mecánica en VCA, ya que demostró pruebas sólidas en la mejora de la preservación de órganos sólidos. La perfusión con máquina hipotérmica y subnormotérmica ha permitido hasta 24 h de conservación en modelos porcinos de VCA miocutáneo y que contiene hueso 26,27,28. Dado que el útero presenta desafíos comparables a los VCA que contienen hueso y piel, es fundamental explorar técnicas similares para UTx para mejorar la calidad de la preservación y los resultados a largo plazo29. Más allá de mejorar la calidad de los órganos, un beneficio potencial de la preservación dinámica mediante perfusión mecánica es ampliar el grupo de donantes30. La extracción de útero de donantes vivas impone riesgos importantes, como lesión ureteral durante la disección del pedículo uterino, pero también alteración hormonal y todos los riesgos potenciales asociados a la menopausia precoz debido a la ovariectomía que se puede realizar31,32. El propósito de mejorar la calidad de los órganos de donantes fallecidos evitaría la necesidad de dicha cirugía en los procedimientos de obtención de donantes vivos. El objetivo final sería posibilitar la obtención de útero tanto en donantes vivas como fallecidas para satisfacer las necesidades de las mujeres con infertilidad uterina absoluta33.
Este artículo proporciona un modelo reproducible para la obtención y preservación del útero porcino mediante perfusión mecánica. La mejora de la calidad y la duración de la preservación es relevante para la expansión del grupo de donantes, ya que permite que las donantes con muerte cerebral sean fuentes fiables para la obtención de útero. Clínicamente, la mayoría de las UTx se realizaron en base a donantes vivos, en su mayoría familiares o amigos cercanos. El tiempo de isquemia es un factor crítico en la viabilidad final del órgano, especialmente en donantes con muerte encefálica. La IRI se define por el daño celular causado por una sucesión de isquemia (interrupción de la circulación sanguínea en el árbol vascular del órgano) y reperfusión (retorno del suministro de oxígeno), a menudo asociada a un aumento de la temperatura, lo que contribuye al daño celular. Esta cascada de eventos produce especies reactivas de oxígeno, lo que eventualmente conduce a inflamación crónica, apoptosis, liberación de antígenos y rechazo del injerto 7,8,34. Los tiempos de isquemia caliente (WIT) y frío son factores críticos en el proceso de IRI, pero solo unos pocos autores lo han estudiado en el útero. En un estudio que exploró el efecto de la conservación a largo plazo del SCS en ratones UTx, el trasplante se realizó después de 24 h de SCS, con embarazos exitosos desarrollados en cinco de los seis animales. Sin embargo, después de 48 h de SCS, todos los trasplantes mostraron necrosis35. En otro estudio que comparó UTx en 14 ovejas después de 3 h de SCS (n = 7) y 24 h de SCS (n = 7), solo 7 animales estaban vivos 8 días después del trasplante, con el 35% de los úteros considerados viables en cuanto a edema y necrosis, 2 úteros en el grupo de SCS de 3 h y 3 úteros en el grupo de SCS de 24 h36. Curiosamente, la contracción del miometrio se mantuvo en el útero viable, pero no se especificó la evaluación del método. Esto pone de manifiesto la importancia crítica de tener en cuenta que un trasplante de útero exitoso implica no solo un injerto viable, sino también una menstruación funcional y un embarazo exitoso. En este sentido, la disminución de la IRI y sus consecuencias negativas es primordial para permitir una mejora en la calidad del injerto y mejores tasas de éxito en nacidos vivos. Para garantizar la consistencia, nos aseguramos de extraer todos los órganos después de un WIT comparable. Todos los vasos dentro del ligamento ancho fueron coagulados o ligados para asegurar una medición de presión relevante y una perfusión capilar adecuada a todo el órgano. El cateterismo es otro punto crucial en el que se debe prestar atención para asegurar la cánula evitando dañar los vasos.
El experimento preliminar con un "sistema Y" condujo a la optimización de dos sistemas de perfusión independientes, abordando cada arteria uterina por separado. De hecho, uno de los parámetros críticos es el caudal y la presión de perfusión 26,27, lo que lleva a adaptar el caudal, reflejando la resistencia vascular global del órgano. La optimización del flujo bilateral permitió el aclaramiento de lactato desde cada lado del órgano, como se destaca en nuestros resultados (Figura 5), así como las mediciones continuas de la diferencia arteriovenosa para todos los parámetros metabólicos. A temperatura subnormotérmica, la reoxigenación celular por perfusión mecánica permite la eliminación de los lactatos acumulados durante la fase metabólica anaerobia asociada a hipoxia e hipoperfusión durante la procuración y la canulación, manteniendo baja la actividad metabólica y evitando el rebote de lactato. Se han encontrado resultados similares en las extremidades traseras de ratas19. En otro modelo anatómico, Dion et al. mostraron un enfoque diferente al extraer el útero con la aorta en su estudio de perfusión hipotérmica37. Sería de gran interés para futuros estudios comparar adecuadamente la perfusión única basada en aorta con el modelo desarrollado en nuestro protocolo.
Si bien aquí se describe un modelo reproducible para la perfusión mecánica del útero porcino, una preocupación importante es la idoneidad para un trasplante posterior. Para confirmar la eficacia de los protocolos de preservación, el trasplante es crucial, ya que reproduce el entorno clínico. Esto requiere anastomosis microquirúrgicas arteriales y venosas. Varios estudios han demostrado que la vena útero-ovárica puede ser utilizada en UTx clínico cuando la vena uterina es de calibre insuficiente para asegurar el drenaje venoso38,39. Una limitación en este modelo es la falta de preservación de la vena útero-ovárica. Sin embargo, no se registró edema importante después de 4 h SNMP en todas las réplicas incluidas, y se observó un flujo venoso continuo de todas las venas uterinas. Esto sugiere una diferencia entre los modelos humano y porcino con una posible simplificación de los procedimientos UTx en minicerdos de Yucatán. Los estudios adicionales deben incluir la extensión del tiempo de perfusión más allá de 4 h para determinar los límites de la conservación dinámica. Para concluir, este artículo describe un modelo de útero porcino reproducible para estudiar la preservación basada en la perfusión de máquinas y proporciona un recurso valioso para dirigirse a IRI con el objetivo de aumentar el número total de órganos disponibles para UTx.
Divulgaciones
Todos los autores no tienen ningún interés financiero que declarar.
Agradecimientos
Este trabajo fue financiado parcialmente por el Instituto Nacional de Salud (NIH, por sus siglas en inglés) en virtud de la subvención n.º R01AR082825 (BEU) y el Hospital Shriners para Niños 84308 (YB). HO y YB recibieron financiación de la Fondation des Gueules Cassées. Se agradece enormemente el apoyo de la Société Française de Chirurgie Plastique, Reconstructrice et Esthétique (SOFCPRE, Francia) y del CHU de Rennes (Francia) a YB.
Materiales
| Name | Company | Catalog Number | Comments |
| Affinity Pixie Oxygenation System | Medtronic | BBP241 | Oxygenator |
| Bovin serum albumin | Sigma-Aldrich | A9647 | Perfusate component |
| Calcium chloride dihydrate | Sigma-Aldrich | 223506 | Perfusate component |
| Carbon Dioxide Oxygen | Airgas | UN3156 | Carbon Dioxide Oxygen mix gas |
| D-(+)-Glucose monohydrate | Sigma-Aldrich | 49159 | Perfusate component |
| Dexamethasone | Sigma-Aldrich | D2915 | Perfusate component |
| Dextran | Thermo scientific | 406271000 | Perfusate component |
| Heparin sodium injection | Eugia Pharma | 63739-953-25 | Perfusate component |
| Humulin Regular Insulin human | Lilly | 0002-8215-01 | Perfusate component |
| Hydrocortisone sodium succinate | Pfizer | 0009-0011-03 | Perfusate component |
| Magnesium chloride hexa-hydrate | Sigma-Aldrich | M9272 | Perfusate component |
| MasterFlex L/S | Cole-Parmer | 77200-32 | Roller pump |
| Polyethylene glycol 35000 | Sigma-Aldrich | 25322-68-3 | Perfusate component |
| Potassium chloride | Sigma-Aldrich | 7447-40-7 | Perfusate component |
| Pressure Monitor, Portable, PM-P-1 | Living Systems Instrumentation | PM-P-1 | Pressure sensor |
| Radnoti Bubble Trap Compliance Chamber | Radnoti | 130149 | Bubble trap |
| RAPIDPoint500 | Siemens | 500 | Blood Gas System |
| Sodium bicarbonate | Sigma-Aldrich | S5761 | Perfusate component |
| Sodium chloride | Sigma-Aldrich | S9888 | Perfusate component |
| Sodium hydroxide | Sigma-Aldrich | 72068 | Perfusate component |
| Sodium phosphate monobasique dihydrate | Sigma-Aldrich | 71505 | Perfusate component |
| Syringe 1 mL | BD | 309659 | Sample procurement |
| Vancomycine hydrochloride | Slate run pharmaceuticals | 70436-021-82 | Perfusate component |
Referencias
- Ejzenberg, D., et al. Livebirth after uterus transplantation from a deceased donor in a recipient with uterine infertility. Lancet. 392 (10165), 2697-2704 (2019).
- Fageeh, W., Raffa, H., Jabbad, H., Marzouki, A. Transplantation of the human uterus. Int J Gynaecol Obstet. 76 (3), 245-251 (2002).
- Lavoue, V., et al. Which donor for uterus transplants: brain-dead donor or living donor? A systematic review. Transplantation. 101 (2), 267-277 (2017).
- Brännström, M., et al. Registry of the International Society of Uterus Transplantation: First report. Transplantation. 107 (1), 172-181 (2023).
- Van Dieren, V., et al. Acute rejection rates in vascularized composite allografts: A systematic review of case reports. J Surg Res. 298, 33-44 (2024).
- Kristek, J., et al. Human uterine vasculature with respect to uterus transplantation: A comprehensive review. J Obs Gynaecol Res. 46 (11), 1999-2007 (2020).
- He, J., Khan, U. Z., Qing, L., Wu, P., Tang, J. Improving the ischemia-reperfusion injury in vascularized composite allotransplantation: Clinical experience and experimental implications. Front Immunol. 13, 998952 (2022).
- Ponticelli, C. Ischaemia-reperfusion injury: A major protagonist in kidney transplantation. Nephrol Dial Transplant. 29 (6), 1134-1140 (2014).
- Harris, K., et al. Metabolic response of skeletal muscle to ischemia. Am J Physiol. 250 (2 Pt 2), H213-H220 (1986).
- Wranning Almen, C., et al. Short-term ischaemic storage of human uterine myometrium--basic studies towards uterine transplantation. Hum Reprod. 20 (10), 2736-2743 (2005).
- Bodewes, S. B., et al. Oxygen transport during ex situ machine perfusion of donor livers using red blood cells or artificial oxygen carriers. Int J Mol Sci. 22 (1), 235 (2020).
- Boncompagni, E., et al. Decreased apoptosis in fatty livers submitted to subnormothermic machine-perfusion respect to cold storage. Eur J Histochem. 55 (4), e40 (2011).
- Czigany, Z., et al. Hypothermic oxygenated machine perfusion reduces early allograft injury and improves post-transplant outcomes in extended criteria donation liver transplantation from donation after brain death: Results from a Multicenter Randomized Controlled Trial (HOPE ECD-DBD). Ann Surg. 274 (5), 705-712 (2021).
- Markmann, J. F., et al. Impact of portable normothermic blood-based machine perfusion on outcomes of liver transplant: The OCS Liver PROTECT randomized clinical trial. JAMA Surg. 157 (3), 189-198 (2022).
- Cypel, M., et al. Normothermic ex vivo lung perfusion in clinical lung transplantation. New Eng J Med. 364 (15), 1431-1440 (2011).
- Roesel, M. J., Ius, F., Knosalla, C., Iske, J. The role of ex-situ perfusion for thoracic organs. Curr Opin Organ Transplant. 27 (5), 466-473 (2022).
- Michel, S. G., et al. Twelve-hour hypothermic machine perfusion for donor heart preservation leads to improved ultrastructural characteristics compared to conventional cold storage. Ann Transplant. 20, 461-468 (2015).
- Ghoneima, A. S., Sousa Da Silva, R. X., Gosteli, M. A., Barlow, A. D., Kron, P. Outcomes of kidney perfusion techniques in transplantation from deceased donors: A systematic review and meta-analysis. J Clin Med. 12 (12), 3221 (2023).
- Charlès, L., et al. Effect of subnormothermic machine perfusion on the preservation of vascularized composite allografts after prolonged warm ischemia. Transplantation. 108 (5), e280-e290 (2024).
- Duru, &. #. 1. 9. 9. ;., et al. Review of machine perfusion studies in vascularized composite allotransplant preservation. Front Transplantation. 2, 103-111 (2023).
- Brännström, M., Diaz-Garcia, C., Hanafy, A., Olausson, M., Tzakis, A. Uterus transplantation: Animal research and human possibilities. Fertil Steril. 97 (6), 1269-1276 (2012).
- Wranning, C. A., et al. Auto-transplantation of the uterus in the domestic pig (Sus scrofa): Surgical technique and early reperfusion events. J Obstet Gynaecol Res. 32 (4), 358-367 (2006).
- Croome, K. P., et al. American Society of Transplant Surgeons recommendations on best practices in donation after circulatory death organ procurement. Am J Transplant. 23 (2), 171-179 (2023).
- Dickens, B. M. Legal and ethical issues of uterus transplantation. Int J Gynaecol Obstet. 133 (1), 125-128 (2016).
- Díaz, L., et al. Ethical considerations in animal research: The Principle of 3R's. Rev Invest Clin. 73 (4), 199-209 (2020).
- Goutard, M., et al. Machine perfusion enables 24-h preservation of vascularized composite allografts in a swine model of allotransplantation. Transpl Int. 37 (1), 102-111 (2024).
- Berkane, Y., et al. Towards optimizing sub-normothermic machine perfusion in fasciocutaneous flaps: A large animal study. Bioengineering (Basel). 10 (12), 1545 (2023).
- Brouwers, K., et al. 24-hour perfusion of porcine myocutaneous flaps mitigates reperfusion injury: a 7-day follow-up study. Plast Reconstr Surg Glob Open. 10 (2), e4123 (2022).
- Richter, O., et al. Extracorporeal perfusion of the human uterus as an experimental model in gynaecology and reproductive medicine. Human Reprod. 15 (6), 1235-1240 (2000).
- O'Neill, K., et al. Availability of deceased donors for uterus transplantation in the United States: Perception vs Reality. Transplantology. 5 (1), 27-36 (2024).
- Chan, J. K., Morrow, J., Manetta, A. Prevention of ureteral injuries in gynecologic surgery. Am J Obstet Gynecol. 188 (5), 1273-1277 (2003).
- Rocca, W. A., et al. Accelerated accumulation of multimorbidity after bilateral oophorectomy: A population-based cohort study. Mayo Clin Proc. 91 (11), 1577-1589 (2016).
- Dion, L., et al. Procurement of uterus in a deceased donor multi-organ donation National Program in France: A scarce resource for uterus transplantation. J Clin Med. 11 (3), 730 (2022).
- Agarwal, A., et al. Clinicopathological analysis of uterine allografts including proposed scoring of ischemia reperfusion injury and t-cell-mediated rejection-dallas uterus transplant study: A pilot study. Transplantation. 106 (1), e10-e20 (2022).
- Díaz-García, L., et al. Pregnancy in transplanted mouse uterus after long-term cold ischaemic preservation. Hum Reprod. 18 (10), 2142-2150 (2003).
- Tricard, J., et al. Uterus tolerance to extended cold ischemic storage after auto-transplantation in ewes. Eur J Obstet Gynecol Reprod Biol. 214, 162-167 (2017).
- Dion, L., et al. Hypothermic machine perfusion for uterus transplantation. Fertil Steril. 120 (6), 1259-1261 (2023).
- Brännström, M., et al. Experimental uterus transplantation. Hum Reprod Update. 16 (3), 329-340 (2010).
- Ozkan, O., Ozkan, O., Dogan, N. U. The Ozkan technique in current use in uterus transplantation: from the first ever successful attempt to clinical reality. J Clin Med. 12 (8), 2812 (2023).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados