Method Article
Etablierung eines Schweinemodells zur Untersuchung der dynamischen Konservierung und Transplantation der Gebärmutter
In diesem Artikel
Zusammenfassung
Es wird ein detailliertes und reproduzierbares Modell der Gebärmutter von Schweinen beschrieben, das von der chirurgischen Beschaffung bis zur Einleitung der maschinellen Perfusion reicht und die Untersuchung der Gebärmuttererhaltung bei der Transplantation ermöglicht.
Zusammenfassung
Bis heute ist die Gebärmuttertransplantation die einzige Möglichkeit für Frauen mit absoluter Gebärmutterunfruchtbarkeit, wie z. B. Frauen mit Rokitansky-Syndrom, eine Schwangerschaft zu erleben und zu gebären. Trotz des wachsenden Interesses an der Gebärmuttertransplantation in den letzten Jahren bedürfen mehrere Themen noch weiterer Forschung, darunter Ischämie-Reperfusionsschäden und ihre Auswirkungen auf die Qualität und Abstoßung des Transplantats. In der neueren Literatur wurde auf eine thrombotische Komplikationsrate von bis zu 20 % nach einer Gebärmuttertransplantation hingewiesen. Diese Art von Komplikation kann aus einer Hypoxie-induzierten Schädigung der Endothelzellen resultieren, die häufig zu einer Abstoßung des Uterustransplantats führt. Hypoxie wird während der statischen Kühllagerung induziert, was nach wie vor der Goldstandard für die Konservierung von Transplantaten bei der Transplantation solider Organe ist. In jüngster Zeit hat sich gezeigt, dass die dynamische Konservierung durch maschinelle Perfusion die Langzeitlagerung konventioneller und marginaler Organe verbessert, indem ischämische und hypoxische Verletzungen reduziert werden. In diesem Protokoll wollen wir jeden chirurgischen Schritt beschreiben, der an der Entnahme und dynamischen Konservierung der Gebärmutter von Schweinen beteiligt ist, basierend auf beiden Uterusstielen, um die Verbindung und Einleitung des maschinellen Perfusionsprotokolls zu ermöglichen.
Einleitung
Die Gebärmuttertransplantation (UTx) hat sich in den letzten zehn Jahren erheblich weiterentwickelt, wobei mehrere Teams klinische Forschungsprogramme gestartet haben. Bisher ist die Hauptindikation von UTx die absolute uterine Unfruchtbarkeit aufgrund einer Agenesie der Gebärmutter, zu der auch das Mayer-Rokitansky-Küster-Hauser-Syndrom (MRKH) gehört. Das MRKH-Syndrom ist eine angeborene Störung mit einer Prävalenz von einer von 5.000 weiblichen Lebendgeburten1. UTx könnte möglicherweise weitere Ursachen für Unfruchtbarkeit angehen, einschließlich solcher, die sich aus Hysterektomie aufgrund von bösartigen Erkrankungen, postpartalen Blutungen, Uterusmyomen, infektiösen Folgeerscheinungen und verschiedenen angeborenen Fehlbildungen ergeben. Dies deutet darauf hin, dass etwa 1 von 500 Frauen für UTx in Frage kommt.
Die erste klinische UTx fand im Jahr 2000 in Saudi-Arabienauf 2, aber vaskuläre Komplikationen führten drei Monate später zu einer Hysterektomie. Seitdem wurden mehrere Fälle von UTx durchgeführt, die sowohl auf lebenden als auch auf verstorbenen Spendern basierten, was zu mehr als 80 Lebendgeburten führte 3,4. Ähnlich wie bei der Transplantation solider Organe und der vaskularisierten Komposit-Allotransplantate (VCA) ist die Immunabstoßung bei UTx eine große Herausforderung. 5 Mehrere Faktoren können zu einer Abstoßung des Transplantats führen, darunter Mikrozirkulationsversagen und venöse Stauung, die beide zu thrombotischen Komplikationen führen können. In einer kürzlich erschienenen Übersichtsarbeit zur Untersuchung der Uterusvaskularisation bei der Transplantation berichteten Kristek et al. über bis zu 15 % arterielle Thrombosen und 5 % venöse Thrombosen6. Darüber hinaus sind kalte und warme Ischämie kritische Faktoren, die für eine erfolgreiche Transplantation berücksichtigt werden müssen, da Ischämie-Reperfusionsschäden (IRI) zu einer Transplantatdysfunktion und einer akuten Abstoßung führen können 7,8. Myozyten reagieren auf ischämischen Stress, indem sie bis zu 6 h lang Laktat produzieren9, wonach die Schädigung der Muskelzellen irreversibel ist. Die Auswirkungen der kalten Ischämie auf das Myometrium wurden in klinischen Studien dokumentiert, und es wurde gezeigt, dass die Verwendung von intrazellulärer Lösung der University of Wisconsin während der statischen Kühllagerung (SCS) die Konservierung mit einer besseren kontraktilen Reaktion auf Prostaglandin und höheren ATP-Konzentrationen im Vergleich zu Ringer-Acetat-Lösung verbessert10. Die Auswirkungen von warmer und kalter Ischämie sind bei UTx jedoch noch wenig erforscht.
SCS ist nach wie vor der Goldstandard für die VCA-Konservierung, einschließlich der Gebärmutter, und für die meisten soliden Organtransplantationen. In den letzten Jahren haben jedoch bedeutende Fortschritte bei maschinellen Perfusionssystemen und Konservierungslösungen zu einem Paradigmenwechsel geführt. Es gibt inzwischen starke Beweise dafür, dass die dynamische maschinelle Perfusion die Erhaltung gesunder und marginaler solider Organe verbessern und verlängern kann 11,12,13,14,15. Diese Technik wird heute in der klinischen Praxis häufig für Lungen-, Herz-, Leber- und Nierentransplantationen eingesetzt 14,16,17,18. Die dynamische Organkonservierung zeigte mehrere Vorteile, darunter die Minimierung von Kälteischämie und Hypoxie-Verletzungen durch kontinuierliche Sauerstoff- und Nährstoffversorgung, die Beseitigung toxischer Metaboliten und die Verbesserung der Transplantatqualität und der Lebensfähigkeitsparameter12,19. Es wurden mehrere Modalitäten entwickelt, die von hypothermer bis hin zu normothermer maschineller Perfusion (mit oder ohne Sauerstoffträger) reichen, wobei mehrere Perfusate zur Verfügung stehen, aber nur wenige wurden an der Gebärmutter getestet20. Um den substanziellen Beitrag solcher Forschungsperspektiven zu gewährleisten, sind relevante präklinische Operationsmodelle von entscheidender Bedeutung.
In dieser Arbeit wird die subnormotherme maschinelle Perfusion (SNMP) als sauerstoffhaltige dynamische Organkonservierungsmethode bei Raumtemperatur (ca. 20 °C) verwendet, indem ein Perfusat durch eine Rollenpumpe und einen Oxygenator zirkuliert wird. Es wird ein Schweinemodell verwendet, das aufgrund seiner Ähnlichkeiten mit dem menschlichen Fortpflanzungssystem in Bezug auf Anatomie, Physiologie und Gefäßgröße für Studien zu UTx und Konservierung relevant ist21,22. Die Beschaffung des Uterus erfolgt nach dem Kreislauftod, was die Relevanz für eine Spende nach dem Herztod erhöht und die Möglichkeit einer Beschaffungsverzögerung nach allen anderen relevanten soliden Organen nahelegt23,24. Darüber hinaus erleichtert dieses Modell die Entwicklung von Studien zur Erhaltung der Gebärmutter in etablierten Transplantationslaboratorien, die sich auf andere Organe konzentrieren und die "3R"-Prinzipien anwenden25. Ziel ist es, ein neues Konservierungsmodell auf Basis von Uterusstielen zu etablieren und seine Zuverlässigkeit für die dynamische Konservierung zu bewerten. Alle Verfahrensschritte werden detailliert beschrieben, von der Hysterektomie bis zur Konservierung, und umfassen die wichtigsten Punkte zur Verwendung von SNMP.
Dem unten beschriebenen Protokoll ging ein vorläufiges Experiment voraus, das auf einer einzigen Pumpe und einem "Y-Schlauch"-Zuflusssystem für beide Uterusarterien basierte (Ergänzende Abbildung 1). Nach 4 h-SNMP nahm das Organ über 50% seines Ausgangsgewichts zu. Durchfluss, Druck, Widerstand und Gewichtsschwankungen sind in der ergänzenden Abbildung 2 dargestellt. Ein einzelnes Perfusionssystem, das in zwei Zuflüsse unterteilt war, erlaubte es nicht, jede Durchflussrate an den Druck jeder Seite anzupassen. In diesem Fall führte SNMP zu erheblichen Ödemen in der Hälfte des Organs (Ergänzende Abbildung 3). Dieses System erwies sich als ungeeignet für das Uterusmodell, unter anderem, weil es nicht als perfekt symmetrisches Modell angesehen werden sollte. Daher wurden in diesem Protokoll zwei Systeme der maschinellen Perfusion verwendet, eines für jede Uterusarterie.
Protokoll
Alle Tiere erhielten eine humane Pflege gemäß dem National Institute of Health Guide for the Care and Use of Laboratory Animals, und die Protokolle wurden vom Massachusetts General Hospital Institutional Animal Care and Use Committee (IACUC) genehmigt. Insgesamt wurden 6 weibliche Yucatan-Minischweine mit einem Gewicht von 30-40 kg für die Uterusentnahme verwendet, wobei vier Uterus einer SNMP unterzogen wurden. Alle Tiere wurden vor der Euthanasie mit einer vollen Dosis (100 I.E./kg) heparinisiert. Die Organentnahme erfolgte post mortem mit weniger als 60 Minuten warmer Ischämie. Andere Organe könnten vom selben Spender für verschiedene Studien entnommen worden sein, gemäß den "3R"-Prinzipien25. In der Materialtabelle finden Sie Einzelheiten zu allen Reagenzien und Geräten, die im Protokoll verwendet werden.
1. Präoperative Vorbereitung (Tag vor der Operation)
- Bereiten Sie die Perfusatlösung vor. Für die subnormotherme Maschinenperfusion wurde eine für VCA optimierte Steen+-Lösung verwendet26,27. Es wurde ein Liter Lösung pro Gebärmutter verwendet, und die Zusammensetzung ist in Tabelle 1 aufgeführt.
HINWEIS: Dem Perfusat wird eine große Menge Natriumhydroxid zugesetzt, mit dem Ziel, einen pH-Wert von etwa 7,5 bis 7,6 zu erreichen. Dieser Wert ist ausdrücklich hoch, aber notwendig, da der pH-Wert tendenziell sinkt, wenn die Maschine umgewälzt und mit einem Carbogen-Gemisch (95 % Sauerstoff; 5 % Kohlendioxid) angereichert wird. - Richten Sie das Perfusionssystem der Maschine ein (Abbildung 1). Auf Undichtigkeiten und Blasen prüfen, wenn Perfusat zirkuliert.
2. Postmortale Entnahme der Gebärmutter
HINWEIS: Um eine Spende nach dem Herztod und/oder der postmortalen Entnahme zu simulieren, sollte das Tier gemäß den lokalen IACUC-Richtlinien eingeschläfert werden. Die Exsanguination sollte der intravenösen Pentobarbital-Injektion vorgezogen werden, um Toxizitäten zu vermeiden, die die Studie beeinträchtigen könnten.
- Bringen Sie das eingeschläferte Tier in Rückenlage. Schrubben Sie den Bauchbereich und legen Sie sterile Tücher auf.
- Machen Sie einen 10 cm langen mittleren Infrarotschnitt mit einer #20-Klinge.
- Öffnen Sie das Unterhautgewebe und die Aponeurose mit einem monopolaren elektrischen Skalpell.
HINWEIS: Es muss darauf geachtet werden, dass der Darm durch das Öffnen der Bauchhöhle nicht beschädigt wird. - Legen Sie den Dünndarm mit einer chirurgischen Gaze beiseite und legen Sie die Gebärmutter frei.
HINWEIS: Die Uterusanatomie des verwendeten Modells ist in Abbildung 2A dargestellt. - Gehen Sie für die linke und rechte Seite ähnlich wie folgt vor:
- Identifiziere die Gebärmuttergefäße.
HINWEIS: Die Gebärmuttervene befindet sich seitlich der Gebärmutterarterie (Abbildung 3). - Mit einer rechtwinkligen Pinzette eine Öffnung in das breite Band seitlich zur Gebärmuttervene schaffen.
- Durch diese Öffnung führen Sie 2-0 Seidenbinder ein, um die Eierstockgefäße zu ligatisieren und die Gebärmutter mit Hilfe des Kauters vom umgebenden Bindegewebe im breiten Band zu befreien.
- Lilizieren Sie die utero-ovariellen Gefäße mit 2-0 Seidenbindernähten und entfernen Sie den Eierstock und die Eileiter.
- Skelettieren Sie die Gebärmuttergefäße und teilen Sie sie so nah wie möglich an den inneren Beckengefäßen.
HINWEIS: Es muss darauf geachtet werden, den Stiel so lange wie möglich zu halten, um die Kanülierung zu erleichtern und eine Pedikelretraktion nach dem Durchtrennen zu antizipieren. - Wiederholen Sie die Schritte 2.5.1-2.5.5 auf der gegenüberliegenden Seite.
- Identifiziere die Gebärmuttergefäße.
- Entfernen Sie die Gebärmutter, indem Sie den Gebärmutterhals mit einem monopolaren elektrischen Skalpell durchschneiden.
HINWEIS: Verwenden Sie eine lange Kontaktzeit, um eine ordnungsgemäße Koagulation der Gebärmutterhalsgefäße zu gewährleisten und ein Auslaufen während der Perfusion zu verhindern.
3. Vorbereitung für die Perfusion
- Auf einem Beistelltisch beide Gebärmutterarterien mit einem mikrochirurgischen Dilatator erweitern und einen Angiokatheter einführen. Sichern Sie die Kanüle mit 3-0 Seidenbindern (Abbildung 2B).
HINWEIS: Hier wurde ein 18 G Angiokatheter für alle Arterien verwendet. Es muss darauf geachtet werden, den Katheter nicht zu weit einzuführen, um eine selektive Kanülierung zu vermeiden, da die Bifurkation relativ eng beieinander liegt. Die Gebärmuttervenen werden nicht kanüliert, da der venöse Abfluss ausreicht, um das Lumen dieser Gefäße offen zu halten, was eine einfache Entnahme ermöglicht. Eine traumatische Kanülierung kann nicht nur Zeit sparen, sondern auch zu Gefäßschäden führen und möglicherweise den venösen Fluss beeinträchtigen. - Spülen Sie beide Uterusarterien langsam manuell mit 20 ml Heparinlösung auf jeder Seite, bis alle Gefäße ausgewaschen und die Abflüsse klar sind.
HINWEIS: Es muss darauf geachtet werden, dass die Spülung nicht mit hohem Druck erfolgt, da dies zu mikrovaskulären Verletzungen und Perfusionsstörungen führen kann. - Wiegen Sie die Gebärmutter.
4. Subnormotherme Maschinenperfusion
HINWEIS: Für die Gebärmutter sind zwei unabhängige Systeme der maschinellen Perfusion erforderlich. Jede Gebärmutterarterie ist mit einem Perfusionssystem verbunden, das aus einer Rollenpumpe, einem Oxygenator, einer Blasenfalle und einem Drucksensor besteht. Das Perfusat in einem Reservoir zirkuliert durch Silikonschläuche, die mit den oben aufgeführten Elementen verbunden sind, bevor es durch das Organ über die Gebärmutterarterie zur Gebärmuttervene auf jeder Seite fließt, wo das Perfusat austritt und in demselben Reservoir freigesetzt wird.
- Verbinden Sie die Gebärmutter mit den maschinellen Perfusionssystemen, indem Sie die Kanülen der Gebärmutterarterie mit dem Zuflussschlauch verbinden (Abbildung 1).
- Stellen Sie mit der Rollenpumpe die Durchflussrate auf niedrig (2,5-4,0 ml/min) ein, um einen konstanten arteriellen Druck zwischen 25-35 mmHg zu halten.
- Bewerten Sie die Viabilitätsparameter zu jedem vordefinierten Zeitpunkt sowohl im Zu- als auch im Abfluss mit einer 1-ml-Spritze und analysieren Sie Proben mit dem Blutgassystemgerät [z. B. Blutgasmetriken (pH, pCO2, pO2, Laktat, Basenüberschuss, Bicarbonat), Glukose, Natrium, Kalium, Kalzium, Chlorid].
HINWEIS: Bei diesem Protokoll dauert die Perfusion 4 Stunden, und alle 30 Minuten werden Proben aus dem Zu- und Abfluss entnommen. - Wiegen Sie die Gebärmutter am Ende der Perfusion.
Ergebnisse
Während der Perfusion wurde das System mit einem Drucksensor verbunden, der den Druck während des Experiments aufzeichnete. Für ein gebärmutterfreies System wurde zunächst der Druck aufgezeichnet, der von den Druckaufzeichnungen während der Gebärmutterperfusion abgezogen wurde, um den realen Organdruck zu erhalten. Die Fördermenge wurde angepasst, um den Druck im gewünschten Bereich zu halten und von der Rollenpumpe gesteuert. Der Widerstand wurde mit der Formel R = P / Q berechnet (R: Widerstand (mmHg.mL.min-1); P: Druck (mmHg); Q: Durchflussrate (mL/min)).
Die Entwicklung der Perfusionsparameter ist in Abbildung 4 dargestellt. Die durchschnittliche anfängliche Flussrate betrug 5,2 (min 2,4, max 10,0) ml/min auf beiden Seiten und schwankte während des Experiments nicht stark. Basierend auf der Literatur und früheren Experimenten wurde der Zieldruck auf 25-35 mmHg festgelegt. Der durchschnittliche arterielle Anfangsdruck betrug 26 (min 10, max 36) mmHg auf der linken Seite der Gebärmutter und 27 (min 16, max 39) mmHg auf der rechten Seite. Da die Strömung und der Druck leicht stabil und niedrig waren, zeigte auch das resultierende arterielle Widerstandsprofil während des gesamten Experiments eine flache Kurve. Der mittlere anfängliche Gefäßwiderstand betrug 8,5 (min 1, max 13,3) mmHg.mL.min-1 auf beiden Seiten (Abbildung 4).
Die SNMP-Konservierung wurde anhand mehrerer metabolischer Parameter bewertet (Abbildung 5): Laktatclearance (Differenz zwischen Laktatabfluss und Laktatzufluss), Gewichtsveränderung, die Differenz zwischen der zugeführten Glukose und der abfließenden Glukose, die den Glukoseverbrauch widerspiegelt, und der Sauerstoffverbrauch. Der Sauerstoffverbrauch wurde nach der Formel O2Verbrauch = 0,0314 x Q x (pO2 Zufluss - pO2 Abfluss) / W (Q: Durchfluss (mL/min), pO2: Sauerstoffpartialdruck (mmHg), W: Gewicht (g) und 0,0314 Henry-Konstante in Wasser bei 20 °C und 1 atm) berechnet. Die Abnahme der Laktatspiegel während der ersten Stunde der Perfusion deutet darauf hin, dass die maschinelle Perfusion nach der Akkumulation während der warmen ischämischen Phase eine Laktatausscheidung ermöglichte. Die Gewichtsveränderung zeigte, dass keine der Gebärmuttern Ödeme aufwies. Die Kurve zeigte, dass der Gewichtsverlust hauptsächlich in den ersten zwei Stunden auftrat und dass sich das Gewicht danach tendenziell stabilisierte. Die Glukosedifferenz zwischen dem Zu- und Abfluss nahm in der ersten Stunde der Perfusion ab, bevor sie sich auf niedrigen Werten stabilisierte. Der Sauerstoffverbrauch blieb während der Perfusion konstant.
Nach 4 h SNMP wurde in jeder Gebärmutter eine Angiographie durchgeführt, bei der langsam 20 ml Kontrastmittel in jede Uterusarterie gespült wurden (Abbildung 6), was eine Beurteilung des Gefäßbaums nach der Konservierungsphase ermöglichte. In allen Organen war das Mikrovaskulatur entlang des Gebärmutterhalses, des Gebärmutterkörpers und der Hörner gut zu erkennen.
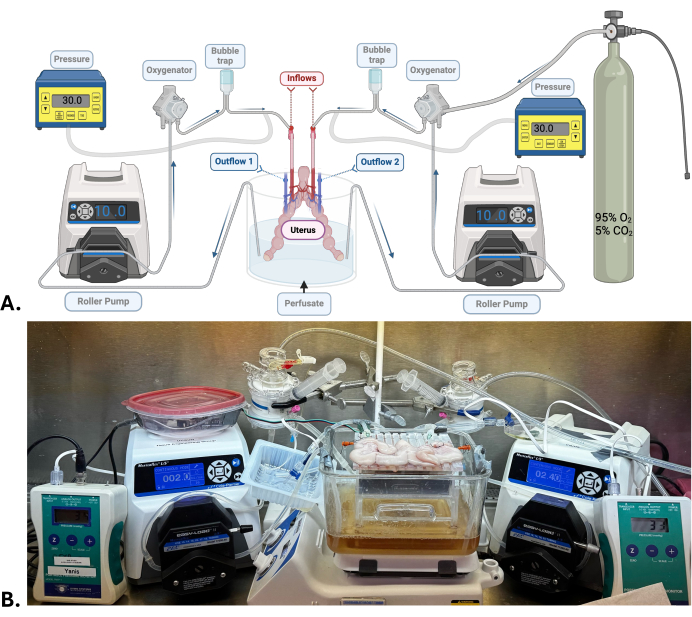
Abbildung 1: Chirurgisches Modell und maschinelles Perfusionssystem. (A) Diagramm des maschinellen Perfusionssystems, das für Uterus-SNMP verwendet wird. (B) Repräsentatives Foto einer Gebärmutter eines Schweins, die einer SNMP unterzogen wird. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Diagramm der Uterusanatomie von Mensch (links) und Schwein (rechts), das die Hauptvaskularisation durch die Uterusarterie zeigt. Die anatomischen Merkmale der Gebärmutter des Schweins sind hauptsächlich auf das Vorhandensein eines kleinen Körpers zurückzuführen, der in zwei große Gebärmutterhörner unterteilt ist. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 3: Intra- und postoperative Ansichten. (A) Intraoperatives Bild der Gebärmutter nach Identifizierung der Gebärmuttergefäße. (B) Postoperative Bilder der Gebärmutter nach der Entnahme und Heparin-Kochsalzlösung-Spülung. A: Korpus; B: Gebärmutterhörner; C: Gebärmutterhals; D: Gebärmutterarterien; E: Gebärmuttervenen; F: Rohr; G: Eierstock. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
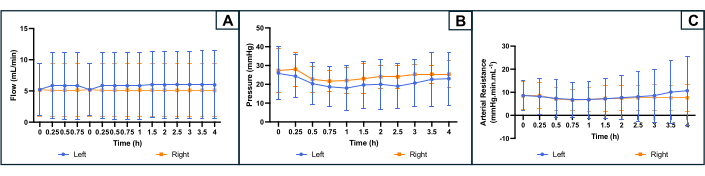
Abbildung 4: Profil der Perfusionsparameter während der 4-stündigen maschinellen Perfusion auf beiden Uterusseiten. (A) Flussrate (mL/min). (B) Druck (mmHg). (c) Berechneter arterieller Widerstand (mmHg.min.mL-1). Die Kurven zeigen den Durchschnitt für jede Seite der Gebärmutter an, und die Fehlerbalken zeigen die Standardabweichung des Mittelwerts an. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
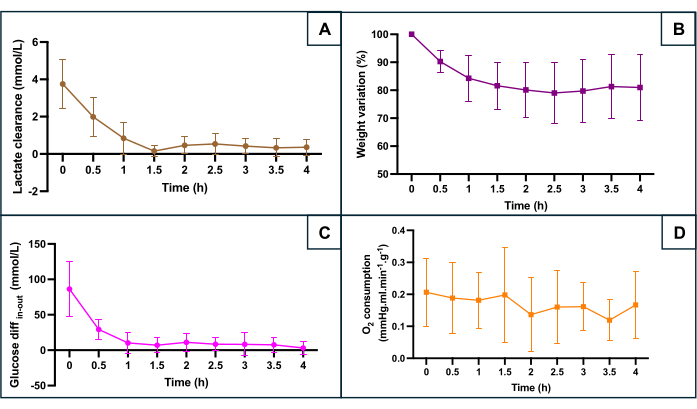
Abbildung 5: Überwachung der wichtigsten Hypoxiemarker während der maschinellen Perfusion. (A) Laktat-Clearance während der ersten 90 Minuten der Perfusion vor der Stabilisierung. (B) Das Gewicht nimmt während der gesamten Perfusion ab. (C) Differenz zwischen der Glukosekonzentration im Zu- und Abfluss. (D) BerechneterØ 2-Verbrauch . Die Daten stellen den Durchschnitt für beide Seiten jeder Gebärmutter dar, und Fehlerbalken zeigen die Standardabweichung des Mittelwerts. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 6: Repräsentative Angiographie des uterinen Gefäßbaums nach subnormothermer Konservierung. (A) Vor der Injektion von Kontrastmittel. (B) Nach Injektion von Kontrastmittel. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| Name der Komponente | Menge | Name der Komponente | Menge |
| Deionisiertes Wasser | 1L | Dextran niedriger Anteil (~75 kDa) | 5 g |
| NaCl | 5.026 Gramm | Rinderserumalbumin | ca. 150 g |
| Kcl | 0,343 Gramm | Hydrocortison [50 mg/ml] | 0,2 mL |
| CaCl2 . 2H20 | 0,221 Gramm | Dexamethason [1,6 g/100 mg] | 4 mL |
| NaH2PO4 | 0,187 Gramm | Natriumhydroxid [1 mol/ml] | ca. 16 ml |
| NaHCO3 | ca. 1,26 Gramm | Niedermolekulares Heparin | 200 IE |
| MgCl2 . 6H2T� | 0,244 Gramm | Insulin | 200 IE |
| D-Glukose | 4,3 g | Vancomycin | ca. 1,5 g |
| PEG (35 kDa) | 5 g |
Tabelle 1: Zusammensetzung der Steen+-Lösung. NaCl: Natriumchlorid; KCl: Kaliumchlorid; CaCl2. 2H20: Calciumchlorid-Dihydrat; NaH2PO4: Natriumdihydrogenphosphat; NaHCO3: Natriumbicarbonat; MgCl2 . 6H2O: Magnesiumchlorid-Hexahydrat; PFLOCK; Polyethylenglykol.
Ergänzende Abbildung 1: Perfusionssystem mit einer einzigen Pumpe. (A) Schema des maschinellen Perfusionssystems "Y-System", das für den Vorversuch verwendet wurde. (B) Repräsentatives Foto des Aufbaus für den Vorversuch. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Abbildung 2: Profil der Perfusionsparameter während des 4,5h-SNMP für das Vorexperiment. (A) Durchflussrate (mL/min). (B) Druck (mmHg). (c) Berechneter arterieller Widerstand (mmHg.min.mL-1). (D) Gewichtszunahme während der Perfusion. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Abbildung 3: Foto des Uterus am Ende des Vorversuchs (4,5 h-SNMP). Eine asymmetrische Verteilung der Ödeme ist vor allem im rechten Horn (rechts im Bild) zu erkennen. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Diskussion
Die Gebärmuttertransplantation, die oft als Teil der VCA angesehen wird, hat sich in den letzten Jahren rasant entwickelt. Parallel dazu wurde die maschinelle Perfusion bei VCA untersucht, da sie robuste Beweise für die Verbesserung der Erhaltung solider Organe zeigte. Hypotherme und subnormotherme maschinelle Perfusion ermöglichte in Schweinemodellen eine Konservierung von myokutanem und knochenhaltigem VCAvon bis zu 24 Stunden 26,27,28. Da die Gebärmutter Herausforderungen stellt, die mit knochen- und hauthaltiger VCA vergleichbar sind, ist es wichtig, ähnliche Techniken für UTx zu erforschen, um die Konservierungsqualität und die langfristigen Ergebnisse zu verbessern29. Neben der Verbesserung der Organqualität ist ein potenzieller Vorteil der dynamischen Konservierung durch maschinelle Perfusion die Erweiterung des Spenderpools30. Die Entnahme der Gebärmutter von Lebendspendern birgt erhebliche Risiken, wie z. B. Harnleiterverletzungen während der Dissektion des Uterusstiels, aber auch hormonelle Störungen und alle potenziellen Risiken, die mit der frühen Menopause aufgrund der möglicherweise durchgeführten Ovariektomie verbunden sind31,32. Das Ziel, die Qualität der verstorbenen Spenderorgane zu verbessern, würde die Notwendigkeit solcher Eingriffe bei der Beschaffung von Lebendspendern vermeiden. Das ultimative Ziel wäre es, die Entnahme von Gebärmutter sowohl bei lebenden als auch bei verstorbenen Spenderinnen zu ermöglichen, um den Bedürfnissen von Frauen mit absoluter Gebärmutterunfruchtbarkeit gerecht zu werden33.
Dieser Artikel stellt ein reproduzierbares Modell für die Beschaffung und Konservierung der Gebärmutter von Schweinen mittels maschineller Perfusion vor. Die Verbesserung der Konservierungsqualität und -dauer ist für die Erweiterung des Spenderpools relevant, indem hirntote Spenderinnen in die Lage versetzt werden, zuverlässige Quellen für die Beschaffung von Gebärmutter zu sein. Klinisch wurden die meisten UTx auf der Grundlage von Lebendspendern durchgeführt, meist Familienmitgliedern oder engen Freunden. Die Ischämiezeit ist ein kritischer Faktor für die endgültige Lebensfähigkeit des Organs, insbesondere bei hirntoten Spendern. IRI ist definiert als zelluläre Schädigung, die durch eine Abfolge von Ischämie (Unterbrechung der Durchblutung des Gefäßbaums) und Reperfusion (Rückkehr der Sauerstoffversorgung) verursacht wird, die oft mit einem Temperaturanstieg verbunden ist und zu den Zellschäden beiträgt. Diese Kaskade von Ereignissen produziert reaktive Sauerstoffspezies, die schließlich zu chronischen Entzündungen, Apoptose, Antigenfreisetzung und Transplantatabstoßung führen 7,8,34. Warme (WIT) und kalte Ischämiezeiten sind kritische Faktoren im IRI-Prozess, aber nur wenige Autoren haben ihn in der Gebärmutter untersucht. In einer Studie, in der die Wirkung der Langzeitkonservierung von SCS bei UTx-Mäusen untersucht wurde, wurde eine Transplantation nach 24 Stunden SCS durchgeführt, wobei sich bei fünf von sechs Tieren erfolgreiche Trächtigkeiten entwickelten. Nach 48 Stunden SCS zeigten alle Transplantate jedoch eine Nekrose35. In einer anderen Studie, in der UTx bei 14 Mutterschafen nach 3 h SCS (n = 7) und 24 h SCS (n = 7) verglichen wurde, waren nur 7 Tiere 8 Tage nach der Transplantation am Leben, wobei 35% der Gebärmutter in Bezug auf Ödeme und Nekrosen als lebensfähig galten, 2 Gebärmutter in der 3-Stunden-SCS-Gruppe und 3 Gebärmutter in der 24-Stunden-SCS-Gruppe36. Interessanterweise wurde die Kontraktion des Myometriums in lebensfähigen uteri aufrechterhalten, aber die Bewertung der Methode wurde nicht spezifiziert. Dies unterstreicht, wie wichtig es ist, zu berücksichtigen, dass eine erfolgreiche Gebärmuttertransplantation nicht nur ein lebensfähiges Transplantat, sondern auch eine funktionelle Menstruation und eine erfolgreiche Schwangerschaft umfasst. In diesem Zusammenhang ist die Verringerung der IRI und ihrer negativen Folgen von grundlegender Bedeutung, um eine Verbesserung der Transplantatqualität und bessere Erfolgsraten bei Lebendgeburten zu ermöglichen. Um die Konsistenz zu gewährleisten, haben wir darauf geachtet, dass alle Organe nach vergleichbarem WIT entnommen wurden. Alle Gefäße innerhalb des breiten Bandes wurden koaguliert oder ligiert, um eine relevante Druckmessung und eine ausreichende Kapillarperfusion des gesamten Organs zu gewährleisten. Die Katheterisierung ist ein weiterer wichtiger Punkt, bei dem darauf geachtet werden muss, die Kanüle zu sichern und gleichzeitig eine Beschädigung der Gefäße zu vermeiden.
Der Vorversuch mit einem "Y-System" führte zur Optimierung von zwei unabhängigen Perfusionssystemen, die jede Uterusarterie separat adressierten. Einer der kritischen Parameter ist nämlich die Flussrate und der Perfusionsdruck26,27, die zu einer Anpassung der Flussrate führen, die den gesamten Gefäßwiderstand des Organs widerspiegelt. Ein optimierter bilateraler Zufluss ermöglichte die Laktatclearance von jeder Seite des Organs, wie in unseren Ergebnissen hervorgehoben (Abbildung 5), sowie kontinuierliche arterio-venöse Differenzmessungen für alle metabolischen Parameter. Bei subnormothermer Temperatur ermöglicht die zelluläre Reoxygenierung durch maschinelle Perfusion die Eliminierung von Laktaten, die sich während der anaeroben Stoffwechselphase angesammelt haben, die mit Hypoxie und Hypoperfusion während der Beschaffung und Kanülierung verbunden sind, wodurch die Stoffwechselaktivität niedrig gehalten und ein Laktatrückprall vermieden wird. Ähnliche Ergebnisse wurden bei den Hintergliedmaßen von Ratten gefunden19. In einem anderen anatomischen Modell zeigten Dion et al. einen anderen Ansatz, indem sie in ihrer hypothermen Perfusionsstudie die Gebärmutter mit der Aorta entnahmen37. Für zukünftige Studien wäre es von großem Interesse, die Aorten-basierte Einzelperfusion mit dem in unserem Protokoll entwickelten Modell zu vergleichen.
Während hier ein reproduzierbares Modell für die maschinelle Perfusion der Gebärmutter des Schweins beschrieben wird, ist ein Hauptanliegen die Eignung für eine weitere Transplantation. Um die Wirksamkeit von Konservierungsprotokollen zu bestätigen, ist die Transplantation von entscheidender Bedeutung, da sie das klinische Umfeld reproduziert. Dazu sind arterielle und venöse mikrochirurgische Anastomosen erforderlich. Mehrere Studien haben gezeigt, dass die Vena uterovarialis bei klinischer UTx eingesetzt werden kann, wenn die Vena uterus von unzureichendem Kaliber ist, um eine venöse Drainage zu gewährleisten38,39. Eine Einschränkung in diesem Modell ist der fehlende Erhalt der Gebärmutter-Eierstock-Vene. In allen eingeschlossenen Replikaten wurde jedoch nach 4 h SNMP kein schweres Ödem festgestellt, und es wurde ein kontinuierlicher venöser Abfluss aus allen Uterusvenen festgestellt. Dies deutet auf einen Unterschied zwischen dem Human- und dem Schweinemodell hin, was zu einer möglichen Vereinfachung der UTx-Verfahren bei Yucatan-Minischweinen führen könnte. Weitere Studien sollten die Verlängerung der Perfusionszeit über 4 h hinaus umfassen, um die Grenzen der dynamischen Konservierung zu bestimmen. Zusammenfassend lässt sich sagen, dass dieser Artikel ein reproduzierbares Modell für den Uterus von Schweinen zur Untersuchung der maschinellen Perfusionskonservierung beschreibt und eine wertvolle Ressource für das Targeting von IRI mit dem Ziel bietet, die Gesamtzahl der verfügbaren Organe für UTx zu erhöhen.
Offenlegungen
Alle Autoren haben kein finanzielles Interesse zu deklarieren.
Danksagungen
Diese Arbeit wurde teilweise vom National Institute of Health unter der Auszeichnung Nr. R01AR082825 (BEU) und Shriners Children's 84308 (YB) finanziert. HO und YB wurden von der Fondation des Gueules Cassées gefördert. Die Unterstützung von YB durch die Société Française de Chirurgie Plastique, Reconstructrice et Esthétique (SOFCPRE, Frankreich) und das CHU de Rennes (Frankreich) wird sehr geschätzt.
Materialien
| Name | Company | Catalog Number | Comments |
| Affinity Pixie Oxygenation System | Medtronic | BBP241 | Oxygenator |
| Bovin serum albumin | Sigma-Aldrich | A9647 | Perfusate component |
| Calcium chloride dihydrate | Sigma-Aldrich | 223506 | Perfusate component |
| Carbon Dioxide Oxygen | Airgas | UN3156 | Carbon Dioxide Oxygen mix gas |
| D-(+)-Glucose monohydrate | Sigma-Aldrich | 49159 | Perfusate component |
| Dexamethasone | Sigma-Aldrich | D2915 | Perfusate component |
| Dextran | Thermo scientific | 406271000 | Perfusate component |
| Heparin sodium injection | Eugia Pharma | 63739-953-25 | Perfusate component |
| Humulin Regular Insulin human | Lilly | 0002-8215-01 | Perfusate component |
| Hydrocortisone sodium succinate | Pfizer | 0009-0011-03 | Perfusate component |
| Magnesium chloride hexa-hydrate | Sigma-Aldrich | M9272 | Perfusate component |
| MasterFlex L/S | Cole-Parmer | 77200-32 | Roller pump |
| Polyethylene glycol 35000 | Sigma-Aldrich | 25322-68-3 | Perfusate component |
| Potassium chloride | Sigma-Aldrich | 7447-40-7 | Perfusate component |
| Pressure Monitor, Portable, PM-P-1 | Living Systems Instrumentation | PM-P-1 | Pressure sensor |
| Radnoti Bubble Trap Compliance Chamber | Radnoti | 130149 | Bubble trap |
| RAPIDPoint500 | Siemens | 500 | Blood Gas System |
| Sodium bicarbonate | Sigma-Aldrich | S5761 | Perfusate component |
| Sodium chloride | Sigma-Aldrich | S9888 | Perfusate component |
| Sodium hydroxide | Sigma-Aldrich | 72068 | Perfusate component |
| Sodium phosphate monobasique dihydrate | Sigma-Aldrich | 71505 | Perfusate component |
| Syringe 1 mL | BD | 309659 | Sample procurement |
| Vancomycine hydrochloride | Slate run pharmaceuticals | 70436-021-82 | Perfusate component |
Referenzen
- Ejzenberg, D., et al. Livebirth after uterus transplantation from a deceased donor in a recipient with uterine infertility. Lancet. 392 (10165), 2697-2704 (2019).
- Fageeh, W., Raffa, H., Jabbad, H., Marzouki, A. Transplantation of the human uterus. Int J Gynaecol Obstet. 76 (3), 245-251 (2002).
- Lavoue, V., et al. Which donor for uterus transplants: brain-dead donor or living donor? A systematic review. Transplantation. 101 (2), 267-277 (2017).
- Brännström, M., et al. Registry of the International Society of Uterus Transplantation: First report. Transplantation. 107 (1), 172-181 (2023).
- Van Dieren, V., et al. Acute rejection rates in vascularized composite allografts: A systematic review of case reports. J Surg Res. 298, 33-44 (2024).
- Kristek, J., et al. Human uterine vasculature with respect to uterus transplantation: A comprehensive review. J Obs Gynaecol Res. 46 (11), 1999-2007 (2020).
- He, J., Khan, U. Z., Qing, L., Wu, P., Tang, J. Improving the ischemia-reperfusion injury in vascularized composite allotransplantation: Clinical experience and experimental implications. Front Immunol. 13, 998952 (2022).
- Ponticelli, C. Ischaemia-reperfusion injury: A major protagonist in kidney transplantation. Nephrol Dial Transplant. 29 (6), 1134-1140 (2014).
- Harris, K., et al. Metabolic response of skeletal muscle to ischemia. Am J Physiol. 250 (2 Pt 2), H213-H220 (1986).
- Wranning Almen, C., et al. Short-term ischaemic storage of human uterine myometrium--basic studies towards uterine transplantation. Hum Reprod. 20 (10), 2736-2743 (2005).
- Bodewes, S. B., et al. Oxygen transport during ex situ machine perfusion of donor livers using red blood cells or artificial oxygen carriers. Int J Mol Sci. 22 (1), 235 (2020).
- Boncompagni, E., et al. Decreased apoptosis in fatty livers submitted to subnormothermic machine-perfusion respect to cold storage. Eur J Histochem. 55 (4), e40 (2011).
- Czigany, Z., et al. Hypothermic oxygenated machine perfusion reduces early allograft injury and improves post-transplant outcomes in extended criteria donation liver transplantation from donation after brain death: Results from a Multicenter Randomized Controlled Trial (HOPE ECD-DBD). Ann Surg. 274 (5), 705-712 (2021).
- Markmann, J. F., et al. Impact of portable normothermic blood-based machine perfusion on outcomes of liver transplant: The OCS Liver PROTECT randomized clinical trial. JAMA Surg. 157 (3), 189-198 (2022).
- Cypel, M., et al. Normothermic ex vivo lung perfusion in clinical lung transplantation. New Eng J Med. 364 (15), 1431-1440 (2011).
- Roesel, M. J., Ius, F., Knosalla, C., Iske, J. The role of ex-situ perfusion for thoracic organs. Curr Opin Organ Transplant. 27 (5), 466-473 (2022).
- Michel, S. G., et al. Twelve-hour hypothermic machine perfusion for donor heart preservation leads to improved ultrastructural characteristics compared to conventional cold storage. Ann Transplant. 20, 461-468 (2015).
- Ghoneima, A. S., Sousa Da Silva, R. X., Gosteli, M. A., Barlow, A. D., Kron, P. Outcomes of kidney perfusion techniques in transplantation from deceased donors: A systematic review and meta-analysis. J Clin Med. 12 (12), 3221 (2023).
- Charlès, L., et al. Effect of subnormothermic machine perfusion on the preservation of vascularized composite allografts after prolonged warm ischemia. Transplantation. 108 (5), e280-e290 (2024).
- Duru, &. #. 1. 9. 9. ;., et al. Review of machine perfusion studies in vascularized composite allotransplant preservation. Front Transplantation. 2, 103-111 (2023).
- Brännström, M., Diaz-Garcia, C., Hanafy, A., Olausson, M., Tzakis, A. Uterus transplantation: Animal research and human possibilities. Fertil Steril. 97 (6), 1269-1276 (2012).
- Wranning, C. A., et al. Auto-transplantation of the uterus in the domestic pig (Sus scrofa): Surgical technique and early reperfusion events. J Obstet Gynaecol Res. 32 (4), 358-367 (2006).
- Croome, K. P., et al. American Society of Transplant Surgeons recommendations on best practices in donation after circulatory death organ procurement. Am J Transplant. 23 (2), 171-179 (2023).
- Dickens, B. M. Legal and ethical issues of uterus transplantation. Int J Gynaecol Obstet. 133 (1), 125-128 (2016).
- Díaz, L., et al. Ethical considerations in animal research: The Principle of 3R's. Rev Invest Clin. 73 (4), 199-209 (2020).
- Goutard, M., et al. Machine perfusion enables 24-h preservation of vascularized composite allografts in a swine model of allotransplantation. Transpl Int. 37 (1), 102-111 (2024).
- Berkane, Y., et al. Towards optimizing sub-normothermic machine perfusion in fasciocutaneous flaps: A large animal study. Bioengineering (Basel). 10 (12), 1545 (2023).
- Brouwers, K., et al. 24-hour perfusion of porcine myocutaneous flaps mitigates reperfusion injury: a 7-day follow-up study. Plast Reconstr Surg Glob Open. 10 (2), e4123 (2022).
- Richter, O., et al. Extracorporeal perfusion of the human uterus as an experimental model in gynaecology and reproductive medicine. Human Reprod. 15 (6), 1235-1240 (2000).
- O'Neill, K., et al. Availability of deceased donors for uterus transplantation in the United States: Perception vs Reality. Transplantology. 5 (1), 27-36 (2024).
- Chan, J. K., Morrow, J., Manetta, A. Prevention of ureteral injuries in gynecologic surgery. Am J Obstet Gynecol. 188 (5), 1273-1277 (2003).
- Rocca, W. A., et al. Accelerated accumulation of multimorbidity after bilateral oophorectomy: A population-based cohort study. Mayo Clin Proc. 91 (11), 1577-1589 (2016).
- Dion, L., et al. Procurement of uterus in a deceased donor multi-organ donation National Program in France: A scarce resource for uterus transplantation. J Clin Med. 11 (3), 730 (2022).
- Agarwal, A., et al. Clinicopathological analysis of uterine allografts including proposed scoring of ischemia reperfusion injury and t-cell-mediated rejection-dallas uterus transplant study: A pilot study. Transplantation. 106 (1), e10-e20 (2022).
- Díaz-García, L., et al. Pregnancy in transplanted mouse uterus after long-term cold ischaemic preservation. Hum Reprod. 18 (10), 2142-2150 (2003).
- Tricard, J., et al. Uterus tolerance to extended cold ischemic storage after auto-transplantation in ewes. Eur J Obstet Gynecol Reprod Biol. 214, 162-167 (2017).
- Dion, L., et al. Hypothermic machine perfusion for uterus transplantation. Fertil Steril. 120 (6), 1259-1261 (2023).
- Brännström, M., et al. Experimental uterus transplantation. Hum Reprod Update. 16 (3), 329-340 (2010).
- Ozkan, O., Ozkan, O., Dogan, N. U. The Ozkan technique in current use in uterus transplantation: from the first ever successful attempt to clinical reality. J Clin Med. 12 (8), 2812 (2023).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten