Method Article
إنشاء نموذج للخنازير لدراسة الحفاظ على ديناميكية الرحم وزرعها
In This Article
Summary
تم وصف نموذج رحم الخنازير المفصل والقابل للتكرار ، من الشراء الجراحي إلى بدء التروية الآلية ، مما يسمح بدراسة الحفاظ على الرحم في الزرع.
Abstract
حتى الآن ، تعد زراعة الرحم هي الخيار الوحيد للنساء المصابات بالعقم الرحمي المطلق ، مثل المصابات بمتلازمة روكيتانسكي ، لتجربة الحمل والولادة. على الرغم من الاهتمام المتزايد بزراعة الرحم في السنوات الأخيرة ، لا تزال هناك العديد من القضايا التي تتطلب مزيدا من البحث ، بما في ذلك إصابة نقص التروية وإعادة التروية وتأثيرها على جودة الكسب غير المشروع ورفضه. سلطت الأدبيات الحديثة الضوء على معدل مضاعفات تخثر يصل إلى 20٪ بعد زرع الرحم. قد ينتج هذا النوع من المضاعفات عن تلف الخلايا البطانية الناجم عن نقص الأكسجة ، مما يؤدي غالبا إلى رفض الطعم الرحمي. يحدث نقص الأكسجة أثناء التخزين البارد الثابت ، والذي يظل المعيار الذهبي للحفاظ على الكسب غير المشروع في زراعة الأعضاء الصلبة. في الآونة الأخيرة ، ثبت أن الحفظ الديناميكي باستخدام التروية الآلية يحسن التخزين طويل الأجل للأعضاء التقليدية والهامشية عن طريق تقليل الإصابة الإقفارية ونقص الأكسجة. في هذا البروتوكول ، نهدف إلى وصف كل خطوة جراحية تنطوي عليها شراء رحم الخنازير والحفاظ الديناميكي ، بناء على كل من عنيق الرحم ، لتمكين توصيل وبدء بروتوكول تروية الجهاز.
Introduction
تطورت زراعة الرحم (UTx) بشكل كبير على مدى السنوات العشر الماضية ، حيث بدأت العديد من الفرق برامج البحث السريري. حتى الآن ، فإن المؤشر الرئيسي على UTx هو العقم الرحمي المطلق بسبب عدم تكوين الرحم ، بما في ذلك متلازمة Mayer-Rokitansky-Küster-Hauser (MRKH). متلازمة MRKH هي اضطراب خلقي ينتشر فيه واحد من كل 5,000 ولادة حية1. يمكن أن يعالج UTx أسبابا إضافية للعقم ، بما في ذلك تلك الناتجة عن استئصال الرحم بسبب مرض خبيث ، ونزيف ما بعد الولادة ، والأورام الليفية الرحمية ، والعواقب المعدية ، والتشوهات الخلقية المختلفة. يشير هذا إلى أن ما يقرب من 1 من كل 500 امرأة قد تكون مؤهلة للحصول على UTx.
حدث أول تجربة سريرية على الإطلاق في عام 2000 في المملكة العربية السعودية2 ، لكن مضاعفات الأوعية الدموية أدت إلى استئصال الرحم بعد ثلاثة أشهر. منذ ذلك الحين ، تم إجراء العديد من حالات UTx ، بناء على كل من المتبرعين الأحياء والمتوفين ، مما أدى إلى أكثر من 80 ولادة حية3،4. على غرار عالم زراعة الأعضاء الصلبة وزراعة الأوعية الدموية المركبة (VCA) ، يمثل الرفض المناعي تحديا كبيرا في UTx. 5 يمكن أن تؤدي عدة عوامل إلى رفض الكسب غير المشروع ، بما في ذلك فشل الدورة الدموية الدقيقة والركود الوريدي ، وكلاهما يمكن أن يؤدي إلى مضاعفات التخثر. في مراجعة حديثة لدراسة الأوعية الدموية الرحمية في الزرع ، أبلغ كريستيك وآخرون عن ما يصل إلى 15٪ من تجلط الشرياني و 5٪ من التخثر الوريدي6. بالإضافة إلى ذلك ، يعد نقص التروية الباردة والدافئة من العوامل الحاسمة التي يجب معالجتها لعملية الزرع الناجحة ، حيث يمكن أن تؤدي إصابة نقص التروية وإعادة التروية (IRI) إلى خلل في الكسب غير المشروع والرفض الحاد7،8. تستجيب الخلايا العضلية للإجهاد الإقفاري عن طريق إنتاج اللاكتات لمدة تصل إلى 6 ساعات9 ، وبعد ذلك يكون تلف الخلايا العضلية لا رجعة فيه. تم توثيق تأثير نقص التروية الباردة على عضل الرحم في الدراسات السريرية ، وقد ثبت أن استخدام محلول جامعة ويسكونسن الشبيه بالخلايا أثناء التخزين البارد الثابت (SCS) يحسن الحفظ مع استجابة انقباضية أفضل للبروستاجلاندين وتركيزات ATP أعلى عند مقارنتها بمحلول أسيتات رينجر10. ومع ذلك ، لا يزال تأثير نقص التروية الدافئ والبارد غير مستكشف بشكل جيد في UTx.
يظل SCS هو المعيار الذهبي للحفاظ على VCA ، بما في ذلك الرحم ، ومعظم عمليات زرع الأعضاء الصلبة. ومع ذلك ، في السنوات الأخيرة ، أدت التطورات الكبيرة في أنظمة نضح الماكينة وحلول الحفظ إلى نقلة نوعية. هناك الآن أدلة قوية تدعم أن نضح الماكينة الديناميكي يمكن أن يحسن ويطيل الحفاظ على الأعضاء الصلبة السليمة والهامشية11،12،13،14،15. تستخدم هذه التقنية الآن بشكل شائع في الممارسة السريرية لزراعة الرئة والقلب والكبدوالكلى 14،16،17،18. أظهر الحفاظ الديناميكي على الأعضاء فوائد متعددة ، بما في ذلك تقليل نقص التروية الباردة وإصابات نقص الأكسجة من خلال توفير إمدادات مستمرة من الأكسجين والمغذيات ، وإزالة المستقلبات السامة ، وتحسين جودة الكسب غير المشروع ومعايير الجدوى12،19. تم تطوير طرائق متعددة ، تتراوح من انخفاض حرارة الجسم إلى نضح الآلة القياسي (مع أو بدون حاملات الأكسجين) ، مع توفر العديد من النفحات ، ولكن تم اختبار عدد قليل منها فقط على الرحم20. لضمان المساهمة الكبيرة لوجهات النظر البحثية هذه ، فإن النماذج الجراحية قبل السريرية ذات الصلة ذات أهمية حاسمة.
في هذا العمل ، يتم استخدام نضح الآلة دون المعيارية الحرارية (SNMP) كطريقة للحفاظ على الأعضاء الديناميكية المؤكسجة في درجة حرارة الغرفة (حوالي 20 درجة مئوية) عن طريق تدوير التعفير من خلال مضخة أسطوانية ومؤكسج. يتم استخدام نموذج الخنازير المناسب للدراسات المتعلقة ب UTx والحفظ نظرا لأوجه التشابه مع الجهاز التناسلي البشري من حيث التشريح وعلم وظائف الأعضاء وحجم الوعاءالدموي 21،22. يتم شراء الرحم بعد الموت أثناء الدورة الدموية ، مما يوفر أهمية للتبرع بعد الموت القلبي ويشير إلى إمكانية تأخير الشراء بعد جميع الأعضاء الصلبة الأخرى ذات الصلة23،24. بالإضافة إلى ذلك ، يسهل هذا النموذج تطوير دراسات الحفاظ على الرحم داخل مختبرات الزرع القائمة مع التركيز على الأعضاء الأخرى ، مع تطبيق مبادئ "3Rs"25. الهدف هو إنشاء نموذج حفظ جديد يعتمد على عنيق الرحم وتقييم موثوقيته للحفاظ على الديناميكية. يتم تفصيل جميع خطوات الإجراء ، من استئصال الرحم إلى الحفظ ، بما في ذلك النقاط الرئيسية المميزة حول استخدام SNMP.
سبق البروتوكول الموصوف أدناه تجربة أولية تستند إلى مضخة واحدة ونظام تدفق "أنبوب Y" لكلا الشرايين الرحمية (الشكل التكميلي 1). بعد 4 ساعات من SNMP ، اكتسب العضو أكثر من 50٪ من وزنه الأولي. يظهر التدفق والضغط والمقاومة وتباين الوزن في الشكل التكميلي 2. لم يسمح نظام التروية الفردي المنفصل إلى تدفقين داخليين بتعديل كل معدل تدفق لضغط كل جانب. في هذه الحالة ، أدى SNMP إلى وذمة كبيرة في نصف العضو (الشكل التكميلي 3). ثبت أن هذا النظام غير مناسب لنموذج الرحم ، ويرجع ذلك جزئيا إلى أنه لا ينبغي اعتباره نموذجا متماثلا تماما. لذلك ، تم استخدام نظامين للتروية الآلية في هذا البروتوكول ، واحد لكل شريان رحمي.
Protocol
تلقت جميع رعاية إنسانية وفقا لدليل المعهد الوطني للصحة لرعاية واستخدام المختبر ، وتمت الموافقة على البروتوكولات من قبل لجنة رعاية واستخدام المؤسسية في مستشفى ماساتشوستس العام (IACUC). بشكل عام ، تم استخدام 6 إناث من خنازير يوكاتان الصغيرة التي تزن 30-40 كجم لشراء الرحم ، مع أربعة رحم يخضع ل SNMP. تم إخماد جميع بجرعة واحدة كاملة (100 وحدة دولية / كجم) قبل القتل الرحيم. تم شراء الأعضاء بعد الوفاة مع أقل من 60 دقيقة من نقص التروية الدافئ. كان من الممكن حصاد أعضاء أخرى من نفس المتبرع لدراسات مختلفة ، وفقا لمبادئ "3Rs"25. راجع جدول المواد للحصول على تفاصيل حول جميع الكواشف والمعدات المستخدمة في البروتوكول.
1. التحضير قبل الجراحة (قبل يوم من الجراحة)
- تحضير محلول التعطير. بالنسبة لتروية الآلة دون المستوى المعياري ، تم استخدام حل Stin + المحسن ل VCA26،27. تم استخدام لتر واحد من المحلول لكل رحم ، والتكوين مفصل في الجدول 1.
ملاحظة: تضاف كمية كبيرة من هيدروكسيد الصوديوم إلى الريشة بهدف تحقيق درجة حموضة تتراوح بين 7.5 و 7.6. هذه القيمة عالية بشكل صريح ولكنها ضرورية لأن الرقم الهيدروجيني يميل إلى الانخفاض أثناء تدوير الماكينة وتزويدها بخليط كربوجين (95٪ أكسجين ؛ 5٪ ثاني أكسيد الكربون). - قم بإعداد نظام التروية للآلة (الشكل 1). تحقق من وجود تسريبات وفقاعات عند تدوير الانحطار.
2. شراء الرحم بعد الوفاة
ملاحظة: لمحاكاة التبرع بعد الموت القلبي و / أو شراء ما بعد الوفاة ، يجب القتل الرحيم للحيوان وفقا لإرشادات IACUC المحلية. يجب تفضيل التسخين على الحقن الخماسي الوريدي لتجنب السمية التي يمكن أن تتداخل مع الدراسة.
- ضع القتل رحيم في وضع الاستلقاء. افرك منطقة البطن وضع ستائر معقمة.
- قم بعمل شق سري متوسط 10 سم بشفرة # 20.
- افتح الأنسجة تحت الجلد ومرض السكتة الدماغية بمشرط كهربائي أحادي القطب.
ملاحظة: يجب الانتباه إلى عدم إتلاف الأمعاء عن طريق فتح تجويف البطن. - توضع الأمعاء الدقيقة جانبا بشاش جراحي وتكشف الرحم.
ملاحظة: يظهر تشريح الرحم للنموذج المستخدم في الشكل 2 أ. - تابع بالمثل للجانبين الأيسر والأيمن على النحو التالي:
- التعرف على الأوعية الرحمية.
ملاحظة: يتم وضع الوريد الرحمي بشكل جانبي على الشريان الرحمي (الشكل 3). - قم بإنشاء فتحة في الرباط العريض بشكل جانبي إلى الوريد الرحمي باستخدام ملقط الزاوية اليمنى.
- من خلال هذه الفتحة ، أدخل 2-0 خيوط ربطة عنق حريرية لربط أوعية المبيض وتحرير الرحم من النسيج الضام المحيط في الرباط العريض باستخدام الكي.
- اربط أوعية الرحم والمبيض بخيوط 2-0 من الحرير وقم بإزالة المبيض والأنبوب.
- هيكل عظمي للأوعية الرحمية وتقسيمها بالقرب من الأوعية الحرقفية الداخلية قدر الإمكان.
ملاحظة: يجب الانتباه إلى الحفاظ على العنق لأطول فترة ممكنة لتسهيل القنية وتوقع تراجع العنق بعد قطعها. - كرر الخطوات 2.5.1-2.5.5 على الجانب الآخر.
- التعرف على الأوعية الرحمية.
- قم بإزالة الرحم عن طريق قطع عنق الرحم بمشرط كهربائي أحادي القطب.
ملاحظة: استخدمي وقتا طويلا للتلامس لضمان تخثر أوعية عنق الرحم بشكل صحيح ، مما يمنع التسرب أثناء التروية.
3. التحضير للتروية
- على طاولة جانبية، قم بتوسيع الشرايين الرحمية باستخدام موسع جراحي مجهري وأدخل قسطرة وعائية. قم بتأمين التقنية برباط حريري 3-0 (الشكل 2 ب).
ملاحظة: هنا ، تم استخدام قسطرة وعائية 18 جم لجميع الشرايين. يجب الحرص على عدم إدخال القسطرة بعيدا جدا لتجنب القنية الانتقائية ، لأن التشعب قريب نسبيا. لا يتم تعبئة الأوردة الرحمية ، لأن التدفق الوريدي كاف لإبقاء تجويف هذه الأوعية مفتوحا ، مما يسمح بجمع سهل. بالإضافة إلى توفير الوقت ، قد يؤدي القنية المؤلمة إلى تلف الأوعية الدموية ويحتمل أن تؤثر على التدفق الوريدي. - اغسل الشرايين الرحمية يدويا بمقدار 20 مل من محلول الهيبارين على كل جانب حتى يتم غسل جميع الأوعية وتصبح التدفقات الخارجة واضحة.
ملاحظة: يجب الانتباه إلى عدم التدفق بضغط عال ، مما قد يؤدي إلى إصابات الأوعية الدموية الدقيقة وفشل التروية. - وزن الرحم.
4. نضح آلة تحت الحرارة
ملاحظة: بالنسبة للرحم ، يلزم وجود نظامين مستقلين للتروية الآلية. يتم توصيل كل شريان رحمي بنظام تروية يتكون من مضخة أسطوانية ، ومؤكسج ، ومصيدة فقاعات ، ومستشعر ضغط. يدور التعقيم الموجود في الخزان من خلال أنابيب سيليكون متصلة بالعناصر المذكورة أعلاه قبل أن يمر عبر العضو عبر الشريان الرحمي إلى الوريد الرحمي على كل جانب ، حيث يخرج الإنشاب ويتم إطلاقه في نفس الخزان.
- قم بتوصيل الرحم بأنظمة نضح الماكينة عن طريق توصيل قنيات الشريان الرحمي بأنبوب التدفق (الشكل 1).
- باستخدام المضخة الأسطوانية ، اضبط معدل التدفق على منخفض (2.5-4.0 مل / دقيقة) للحفاظ على ضغط شرياني ثابت بين 25-35 مم زئبق.
- تقييم معلمات الجدوى في كل نقطة زمنية محددة مسبقا في كل من التدفق والتدفق الخارج باستخدام حقنة سعة 1 مل وتحليل العينات باستخدام آلة نظام غازات الدم [على سبيل المثال ، مقاييس غازات الدم (الأس الهيدروجيني ، pCO2 ، pO2 ، اللاكتات ، القاعدة الزائدة ، البيكربونات) ، الجلوكوز ، الصوديوم ، البوتاسيوم ، الكالسيوم ، الكلوريد].
ملاحظة: في هذا البروتوكول ، يستمر التروية لمدة 4 ساعات ، ويتم أخذ عينات من التدفق الداخل والخارج كل 30 دقيقة. - وزن الرحم في نهاية التروية.
النتائج
أثناء التروية ، تم توصيل النظام بمستشعر الضغط الذي يسجل الضغط أثناء التجربة. تم تسجيل الضغط في البداية لنظام خال من الرحم ، والذي تم طرحه من تسجيلات الضغط أثناء تروية الرحم للحصول على ضغط الأعضاء الحقيقي. تم تكييف معدل التدفق للحفاظ على الضغط ضمن النطاق المطلوب وتم التحكم فيه بواسطة مضخة الأسطوانة. تم حساب المقاومة باستخدام الصيغة R = P / Q (R: المقاومة (mmHg.mL.min-1) ؛ P: الضغط (مم زئبق) ؛ س: معدل التدفق (مل / دقيقة)).
يظهر تطور معلمات التروية في الشكل 4. كان متوسط معدل التدفق الأولي 5.2 (2.4 دقيقة ، بحد أقصى 10.0) مل / دقيقة على كلا الجانبين ولم يتقلب كثيرا أثناء التجربة. بناء على الأدبيات والتجارب السابقة ، تم ضبط الضغط المستهدف عند 25-35 مم زئبق. كان متوسط الضغط الشرياني الأولي 26 (10 دقيقة ، 36 كحد أقصى) ملم زئبق على الجانب الأيسر من الرحم و 27 (16 دقيقة ، 39 كحد أقصى) ملم زئبق على الجانب الأيمن. نظرا لأن التدفق والضغط كانا مستقرين قليلا ومنخفضين ، فقد أظهر ملف تعريف المقاومة الشرياني الناتج أيضا منحنى مسطحا طوال التجربة. كان متوسط مقاومة الأوعية الدموية الأولية 8.5 (دقيقة 1 ، بحد أقصى 13.3) مم زئبق مل في الدقيقة -1 على كلا الجانبين (الشكل 4).
تم تقييم الحفاظ على SNMP وفقا للعديد من معايير التمثيل الغذائي (الشكل 5): تصفية اللاكتات (الفرق بين تدفق اللاكتات وتدفق اللاكتات) ، وتغير الوزن ، والفرق بين الجلوكوز المتدفق والجلوكوز الخارج الذي يعكس استهلاك الجلوكوز ، واستهلاك الأكسجين. تم حساب استهلاك الأكسجين باستخدام الصيغة O2الاستهلاك = 0.0314 × Q x (pO2 التدفق الداخل - pO2 التدفق الخارج) / W (Q: معدل التدفق (مل مل / دقيقة) ، pO2: ضغط الأكسجين الجزئي (مم زئبق) ، W: الوزن (جم) ، و 0.0314 ثابت هنري في الماء عند 20 درجة مئوية و 1 ضغط جوي). يشير الانخفاض في مستويات اللاكتات خلال الساعة الأولى من التروية إلى أن التروية الآلية سمحت بإزالة اللاكتات بعد التراكم خلال المرحلة الإقفارية الدافئة. أظهر تغير الوزن أن أيا من الرحم لم يكن مصابا بوذمة. سلط المنحنى الضوء على أن فقدان الوزن حدث بشكل رئيسي خلال الساعتين الأوليين وأن الوزن يميل إلى الاستقرار بعد ذلك. انخفض فرق الجلوكوز بين التدفق الداخل والخارج خلال الساعة الأولى من التروية قبل أن يستقر عند قيم منخفضة. ظل استهلاك الأكسجين ثابتا أثناء التروية.
بعد 4 ساعات من SNMP ، تم إجراء تصوير الأوعية الدموية في كل رحم ، مما أدى إلى تنظيف 20 مل ببطء من عامل التباين في كل شريان رحمي (الشكل 6) ، مما مكن من تقييم شجرة الأوعية الدموية بعد مرحلة الحفظ. في جميع الأعضاء ، تم تحديد الأوعية الدموية الدقيقة جيدا على طول عنق الرحم وجسم الرحم والقرون.
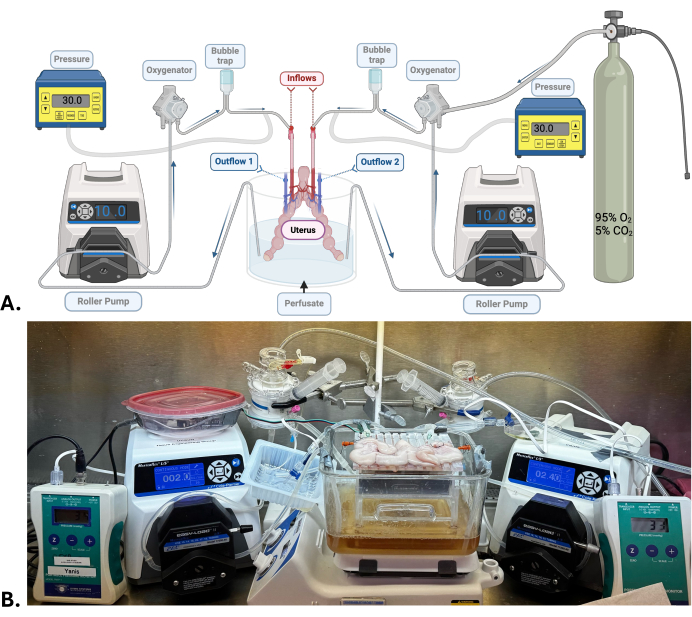
الشكل 1: النموذج الجراحي ونظام التروية الآلية. (أ) رسم تخطيطي لنظام نضح الماكينة المستخدم في SNMP للرحم. (ب) صورة تمثيلية لرحم خنزير يخضع ل SNMP. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: رسم تخطيطي لتشريح الرحم البشري (اليسار) والخنزير (اليمين) يوضح الأوعية الدموية الرئيسية من خلال الشريان الرحمي. ترجع الخصائص التشريحية للرحم الخنزير بشكل أساسي إلى وجود جسم صغير مقسم إلى قرنين كبيرين في الرحم. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3: وجهات النظر أثناء وبعد الجراحة. (أ) صورة الرحم أثناء الجراحة بعد تحديد أوعية الرحم. (ب) صور الرحم بعد الجراحة بعد الشراء وتدفق الهيبارين الملحي. أ: المجموعة. ب: قرون الرحم. ج: عنق الرحم. د: الشرايين الرحمية. ه: الأوردة الرحمية. F: أنبوب. ز: المبيض. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
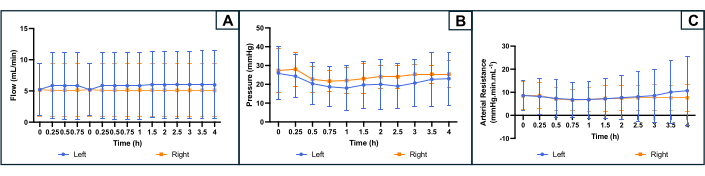
الشكل 4: ملف تعريف معلمات التروية أثناء 4 ساعات من نضح الجهاز على جانبي الرحم. (أ) معدل التدفق (مل / دقيقة). (ب) الضغط (مم زئبق). (ج) المقاومة الشريانية المحسوبة (mmHg.min.mL-1). تشير المنحنيات إلى المتوسط لكل جانب من جوانب الرحم ، وتشير أشرطة الخطأ إلى الانحراف المعياري للمتوسط. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
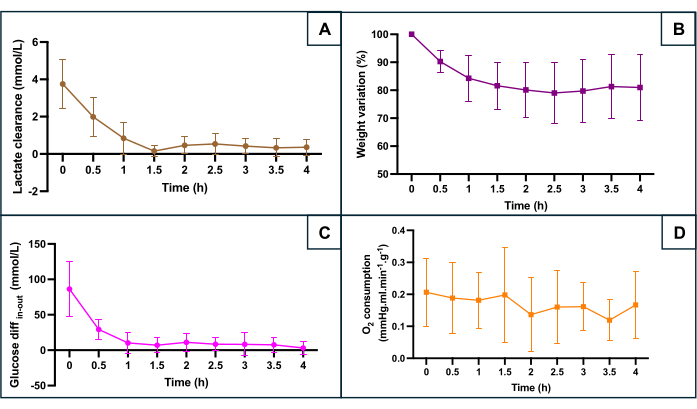
الشكل 5: مراقبة علامات نقص الأكسجة الرئيسية أثناء نضح الآلة. (أ) تصفية اللاكتات خلال أول 90 دقيقة من التروية قبل الاستقرار. (ب) ينخفض الوزن طوال فترة التروية. (ج) الفرق بين تركيز الجلوكوز الداخل والخارج. (د) الاستهلاكالمحسوب O 2 . تمثل البيانات المتوسط لكلا جانبي كل رحم ، وتظهر أشرطة الخطأ الانحراف المعياري للمتوسط. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 6: تصوير الأوعية الدموية التمثيلي لشجرة الأوعية الدموية الرحمية بعد الحفاظ على الحرارة دون القاعية. (أ) قبل حقن عامل التباين. (ب) بعد حقن عامل التباين. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
| اسم المكون | كم | اسم المكون | كم |
| المياه المنزوعة الأيونات | 1 لتر | كسر ديكستران المنخفض (~ 75 كيلو دالتون) | 5 جرام |
| كلوريد الصوديوم | 5.026 جرام | ألبومين مصل الأبقار | 150 جرام |
| كيه سي إل | 0.343 جرام | هيدروكورتيزون [50 مجم / مل] | 0.2 مل |
| كلوريدالهواء 2 . 2 ساعة20 | 0.221 جرام | ديكساميثازون [1.6 جم/100 مجم] | 4 مل |
| NaH2PO4 | 0.187 جرام | هيدروكسيد الصوديوم [1 مول / مل] | 16 مل |
| NaHCO3 | 1.26 جرام | الهيبارين منخفض الوزن الجزيئي | 200 وحدة دولية |
| MgCl2. 6 ساعات2ص | 0.244 جرام | إنسولين | 200 وحدة دولية |
| د-جلوكوز | 4.3 جرام | فانكومايسين | 1.5 جرام |
| PEG (35 كيلو دالتون) | 5 جرام |
الجدول 1: تكوين محلول ستين +. كلوريد الصوديوم: كلوريد الصوديوم. KCl: كلوريد البوتاسيوم. CaCl2. 2H20: ثنائي هيدرات كلوريد الكالسيوم. NaH2PO4: فوسفات ثنائي هيدروجين الصوديوم. NaHCO3: بيكربونات الصوديوم. MgCl2. 6H2O: سداسي هيدرات كلوريد المغنيسيوم. الوتد; البولي إيثيلين جلايكول.
الشكل التكميلي 1: نظام التروية القائم على مضخة واحدة. (أ) رسم تخطيطي لتروية الآلة "نظام Y" المستخدم في التجربة الأولية. (ب) صورة تمثيلية للإعداد للتجربة الأولية. الرجاء النقر هنا لتنزيل هذا الملف.
الشكل التكميلي 2: ملف تعريف معلمات التروية خلال 4.5h-SNMP للتجربة الأولية. (أ) معدل التدفق (مل / دقيقة). (ب) الضغط (مم زئبق). (ج) المقاومة الشريانية المحسوبة (mmHg.min.mL-1). (د) زيادة الوزن طوال فترة التروية. الرجاء النقر هنا لتنزيل هذا الملف.
الشكل التكميلي 3: صورة للرحم في نهاية التجربة الأولية (4.5 ساعة-SNMP). يتضح التوزيع غير المتماثل للوذمة ، بشكل رئيسي في القرن الأيمن (على يمين الصورة). الرجاء النقر هنا لتنزيل هذا الملف.
Discussion
تطورت زراعة الرحم ، التي غالبا ما تعتبر جزءا من VCA ، بسرعة في السنوات القليلة الماضية. في موازاة ذلك ، بدأ استكشاف نضح الآلة في VCA لأنه أظهر دليلا قويا في تحسين الحفاظ على الأعضاء الصلبة. سمح نضح الآلة الخافض للحرارة وتحت الحرارة بالحفاظ على ما يصل إلى 24 ساعة في نماذج الخنازير من VCA العضلي الجلدي والمحتوي على العظام26،27،28. نظرا لأن الرحم يمثل تحديات مماثلة ل VCA المحتوية على العظام والجلد ، فمن الأهمية بمكان استكشاف تقنيات مماثلة ل UTx لتعزيز جودة الحفظ والنتائج طويلةالمدى 29. بالإضافة إلى تحسين جودة الأعضاء ، فإن الفائدة المحتملة للحفظ الديناميكي باستخدام التروية الآلية هي توسيع مجموعة المتبرعين30. يفرض استرجاع الرحم من المتبرعين الأحياء مخاطر كبيرة ، مثل إصابة الحالب أثناء تشريح عنيق الرحم ، ولكن أيضا الاضطراب الهرموني وجميع المخاطر المحتملة المرتبطة بانقطاع الطمث المبكر بسبب استئصال المبيض الذي يمكن إجراؤه31،32. والغرض من تحسين نوعية أعضاء المتبرعين المتوفين من شأنه أن يتجنب الحاجة إلى مثل هذه الجراحة في إجراءات شراء المتبرعين الأحياء. سيكون الهدف النهائي هو تمكين شراء الرحم لدى كل من المتبرعات الأحياء والمتوفات من أجل تلبية احتياجات النساء المصابات بالعقم الرحمي المطلق33.
تقدم هذه المقالة نموذجا قابلا للتكرار لشراء رحم الخنزير وحفظه باستخدام نضح الآلة. يعد تحسين جودة الحفظ ومدته أمرا وثيق الصلة بتوسيع مجموعة المانحين من خلال تمكين المتبرعين المتوفين دماغيا من أن يكونوا مصادر موثوقة لشراء الرحم. سريريا ، تم إجراء معظم UTx بناء على متبرعين أحياء ، معظمهم من أفراد الأسرة أو الأصدقاء المقربين. يعد وقت نقص التروية عاملا حاسما في بقاء الأعضاء النهائية ، خاصة في المتبرعين المتوفين دماغيا. يتم تعريف IRI من خلال التلف الخلوي الناجم عن سلسلة من نقص التروية (انقطاع الدورة الدموية في شجرة الأوعية الدموية للأعضاء) وإعادة التروية (عودة إمدادات الأكسجين) ، وغالبا ما يرتبط بزيادة درجة الحرارة ، مما يساهم في تلف الخلايا. تنتج سلسلة الأحداث هذه أنواع أكسجين تفاعلية ، مما يؤدي في النهاية إلى التهاب مزمن ، وموت الخلايا المبرمج ، وإطلاق المستضد ، ورفض الكسب غير المشروع7،8،34. تعتبر أوقات نقص التروية الدافئة (WIT) والباردة من العوامل الحاسمة في عملية IRI ، لكن عددا قليلا فقط من المؤلفين درسوها في الرحم. في دراسة تستكشف تأثير الحفاظ على SCS على المدى الطويل في الفئران UTx ، تم إجراء عملية الزرع بعد 24 ساعة من SCS ، مع تطور حالات الحمل الناجحة في خمسة من أصل ستة. ومع ذلك ، بعد 48 ساعة من SCS ، أظهرت جميع عمليات الزرع نخر35. في دراسة أخرى قارنت UTx في 14 نعجة بعد 3 ساعات من SCS (ن = 7) و 24 ساعة من SCS (ن = 7) ، كانت 7 فقط على قيد الحياة بعد 8 أيام من الزرع ، مع 35٪ من الرحم تعتبر قابلة للحياة فيما يتعلق بالوذمة والنخر ، و 2 الرحم في مجموعة SCS 3 ساعات ، و 3 رحم في مجموعة SCS 24 ساعة36. ومن المثير للاهتمام ، أن تقلص عضل الرحم تم الحفاظ عليه في الرحم القابل للحياة ، ولكن لم يتم تحديد تقييم الطريقة. هذا يسلط الضوء على الأهمية الحاسمة للنظر في أن عملية زرع الرحم الناجحة لا تنطوي فقط على طعم قابل للحياة ولكن أيضا الحيض الوظيفي والحمل الناجح. في هذا الصدد ، فإن تقليل IRI وعواقبه السلبية أمر أساسي للسماح بتحسين جودة الكسب غير المشروع وتحسين معدلات نجاح المواليد الأحياء. لضمان الاتساق ، حرصنا على حصاد جميع الأعضاء بعد الذكاء المماثل. تم تخثر جميع الأوعية داخل الرباط العريض أو ربطها لضمان قياس الضغط ذي الصلة والتروية الشعرية الكافية للعضو بأكمله. القسطرة هي نقطة حاسمة أخرى حيث يجب الانتباه لتأمين القنية مع تجنب إتلاف الأوعية.
أدت التجربة الأولية مع "نظام Y" إلى تحسين نظامي نضح مستقلين ، يعالجان كل شريان رحمي على حدة. في الواقع ، أحد المعلمات الحاسمة هو معدل التدفق وضغط التروية26،27 ، مما يؤدي إلى تكييف معدل التدفق ، مما يعكس مقاومة الأوعية الدموية الإجمالية للعضو. سمح التدفق الثنائي الأمثل بإزالة اللاكتات من كل جانب من جوانب العضو ، كما هو موضح في نتائجنا (الشكل 5) ، بالإضافة إلى قياسات الفرق الشرياني الوريدي المستمر لجميع المعلمات الأيضية. في درجة الحرارة دون المستوى القياسي ، تسمح إعادة الأكسجة الخلوية عن طريق التروية الآلية بالتخلص من اللاكتات المتراكمة خلال مرحلة التمثيل الغذائي اللاهوائية المرتبطة بنقص الأكسجة ونقص التروية أثناء الشراء والقنية ، مما يحافظ على انخفاض نشاط التمثيل الغذائي وتجنب ارتداد اللاكتات. تم العثور على نتائج مماثلة في الأطراف الخلفية للفئران19. في نموذج تشريحي آخر ، Dion et al. أظهر نهجا مختلفا عن طريق حصاد الرحم مع الشريان الأورطي في دراسة التروية المنخفضة للحرارة37. سيكون من الأهمية بمكان للدراسات المستقبلية أن تقارن بشكل صحيح التروية الفردية القائمة على الشريان الأورطي بالنموذج الذي تم تطويره في بروتوكولنا.
بينما يتم وصف نموذج قابل للتكرار لنضح الرحم الخزيري هنا ، فإن أحد المخاوف الرئيسية هو مدى ملاءمة المزيد من الزرع. من أجل تأكيد فعالية بروتوكولات الحفظ ، يعد الزرع أمرا بالغ الأهمية لأنه يعيد إنتاج البيئة السريرية. هذا يتطلب مفاغرة جراحية مجهرية شريانية وريدية. أظهرت العديد من الدراسات أنه يمكن استخدام الوريد الرحمي والمبيض في UTx السريري عندما يكون الوريد الرحمي من عيار كاف لضمان التصريف الوريدي38،39. أحد القيود في هذا النموذج هو عدم الحفاظ على الوريد الرحمي والمبيض. ومع ذلك ، لم يتم تسجيل وذمة رئيسية بعد 4 ساعات SNMP في جميع التكرارات المضمنة ، ولوحظ تدفق وريدي مستمر من جميع أوردة الرحم. يشير هذا إلى وجود فرق بين النماذج البشرية والخنازير مع تبسيط محتمل لإجراءات UTx في خنازير يوكاتان الصغيرة. يجب أن تشمل الدراسات الإضافية تمديد وقت التروية إلى ما بعد 4 ساعات لتحديد حدود الحفظ الديناميكي. في الختام ، تصف هذه المقالة نموذج رحم الخنازير القابل للتكرار لدراسة الحفظ القائم على التروية الآلية وتوفر موردا قيما لاستهداف IRI بهدف زيادة العدد الإجمالي للأعضاء المتاحة ل UTx.
Disclosures
ليس لدى جميع المؤلفين مصلحة مالية للإعلان عنها.
Acknowledgements
تم تمويل هذا العمل جزئيا من قبل المعهد الوطني للصحة بموجب الجائزة رقم R01AR082825 (BEU) و Shriners Children's 84308 (YB). تلقى HO و YB تمويلا من Fondation des Gueules Cassées. ويؤيد إلى حد كبير الدعم المقدم من Société Française de Chirurgie Plastique و Reconstructrice et Esthétique (SOFCPRE ، فرنسا) و CHU de Rennes (فرنسا) إلى YB.
Materials
| Name | Company | Catalog Number | Comments |
| Affinity Pixie Oxygenation System | Medtronic | BBP241 | Oxygenator |
| Bovin serum albumin | Sigma-Aldrich | A9647 | Perfusate component |
| Calcium chloride dihydrate | Sigma-Aldrich | 223506 | Perfusate component |
| Carbon Dioxide Oxygen | Airgas | UN3156 | Carbon Dioxide Oxygen mix gas |
| D-(+)-Glucose monohydrate | Sigma-Aldrich | 49159 | Perfusate component |
| Dexamethasone | Sigma-Aldrich | D2915 | Perfusate component |
| Dextran | Thermo scientific | 406271000 | Perfusate component |
| Heparin sodium injection | Eugia Pharma | 63739-953-25 | Perfusate component |
| Humulin Regular Insulin human | Lilly | 0002-8215-01 | Perfusate component |
| Hydrocortisone sodium succinate | Pfizer | 0009-0011-03 | Perfusate component |
| Magnesium chloride hexa-hydrate | Sigma-Aldrich | M9272 | Perfusate component |
| MasterFlex L/S | Cole-Parmer | 77200-32 | Roller pump |
| Polyethylene glycol 35000 | Sigma-Aldrich | 25322-68-3 | Perfusate component |
| Potassium chloride | Sigma-Aldrich | 7447-40-7 | Perfusate component |
| Pressure Monitor, Portable, PM-P-1 | Living Systems Instrumentation | PM-P-1 | Pressure sensor |
| Radnoti Bubble Trap Compliance Chamber | Radnoti | 130149 | Bubble trap |
| RAPIDPoint500 | Siemens | 500 | Blood Gas System |
| Sodium bicarbonate | Sigma-Aldrich | S5761 | Perfusate component |
| Sodium chloride | Sigma-Aldrich | S9888 | Perfusate component |
| Sodium hydroxide | Sigma-Aldrich | 72068 | Perfusate component |
| Sodium phosphate monobasique dihydrate | Sigma-Aldrich | 71505 | Perfusate component |
| Syringe 1 mL | BD | 309659 | Sample procurement |
| Vancomycine hydrochloride | Slate run pharmaceuticals | 70436-021-82 | Perfusate component |
References
- Ejzenberg, D., et al. Livebirth after uterus transplantation from a deceased donor in a recipient with uterine infertility. Lancet. 392 (10165), 2697-2704 (2019).
- Fageeh, W., Raffa, H., Jabbad, H., Marzouki, A. Transplantation of the human uterus. Int J Gynaecol Obstet. 76 (3), 245-251 (2002).
- Lavoue, V., et al. Which donor for uterus transplants: brain-dead donor or living donor? A systematic review. Transplantation. 101 (2), 267-277 (2017).
- Brännström, M., et al. Registry of the International Society of Uterus Transplantation: First report. Transplantation. 107 (1), 172-181 (2023).
- Van Dieren, V., et al. Acute rejection rates in vascularized composite allografts: A systematic review of case reports. J Surg Res. 298, 33-44 (2024).
- Kristek, J., et al. Human uterine vasculature with respect to uterus transplantation: A comprehensive review. J Obs Gynaecol Res. 46 (11), 1999-2007 (2020).
- He, J., Khan, U. Z., Qing, L., Wu, P., Tang, J. Improving the ischemia-reperfusion injury in vascularized composite allotransplantation: Clinical experience and experimental implications. Front Immunol. 13, 998952 (2022).
- Ponticelli, C. Ischaemia-reperfusion injury: A major protagonist in kidney transplantation. Nephrol Dial Transplant. 29 (6), 1134-1140 (2014).
- Harris, K., et al. Metabolic response of skeletal muscle to ischemia. Am J Physiol. 250 (2 Pt 2), H213-H220 (1986).
- Wranning Almen, C., et al. Short-term ischaemic storage of human uterine myometrium--basic studies towards uterine transplantation. Hum Reprod. 20 (10), 2736-2743 (2005).
- Bodewes, S. B., et al. Oxygen transport during ex situ machine perfusion of donor livers using red blood cells or artificial oxygen carriers. Int J Mol Sci. 22 (1), 235 (2020).
- Boncompagni, E., et al. Decreased apoptosis in fatty livers submitted to subnormothermic machine-perfusion respect to cold storage. Eur J Histochem. 55 (4), e40 (2011).
- Czigany, Z., et al. Hypothermic oxygenated machine perfusion reduces early allograft injury and improves post-transplant outcomes in extended criteria donation liver transplantation from donation after brain death: Results from a Multicenter Randomized Controlled Trial (HOPE ECD-DBD). Ann Surg. 274 (5), 705-712 (2021).
- Markmann, J. F., et al. Impact of portable normothermic blood-based machine perfusion on outcomes of liver transplant: The OCS Liver PROTECT randomized clinical trial. JAMA Surg. 157 (3), 189-198 (2022).
- Cypel, M., et al. Normothermic ex vivo lung perfusion in clinical lung transplantation. New Eng J Med. 364 (15), 1431-1440 (2011).
- Roesel, M. J., Ius, F., Knosalla, C., Iske, J. The role of ex-situ perfusion for thoracic organs. Curr Opin Organ Transplant. 27 (5), 466-473 (2022).
- Michel, S. G., et al. Twelve-hour hypothermic machine perfusion for donor heart preservation leads to improved ultrastructural characteristics compared to conventional cold storage. Ann Transplant. 20, 461-468 (2015).
- Ghoneima, A. S., Sousa Da Silva, R. X., Gosteli, M. A., Barlow, A. D., Kron, P. Outcomes of kidney perfusion techniques in transplantation from deceased donors: A systematic review and meta-analysis. J Clin Med. 12 (12), 3221 (2023).
- Charlès, L., et al. Effect of subnormothermic machine perfusion on the preservation of vascularized composite allografts after prolonged warm ischemia. Transplantation. 108 (5), e280-e290 (2024).
- Duru, &. #. 1. 9. 9. ;., et al. Review of machine perfusion studies in vascularized composite allotransplant preservation. Front Transplantation. 2, 103-111 (2023).
- Brännström, M., Diaz-Garcia, C., Hanafy, A., Olausson, M., Tzakis, A. Uterus transplantation: Animal research and human possibilities. Fertil Steril. 97 (6), 1269-1276 (2012).
- Wranning, C. A., et al. Auto-transplantation of the uterus in the domestic pig (Sus scrofa): Surgical technique and early reperfusion events. J Obstet Gynaecol Res. 32 (4), 358-367 (2006).
- Croome, K. P., et al. American Society of Transplant Surgeons recommendations on best practices in donation after circulatory death organ procurement. Am J Transplant. 23 (2), 171-179 (2023).
- Dickens, B. M. Legal and ethical issues of uterus transplantation. Int J Gynaecol Obstet. 133 (1), 125-128 (2016).
- Díaz, L., et al. Ethical considerations in animal research: The Principle of 3R's. Rev Invest Clin. 73 (4), 199-209 (2020).
- Goutard, M., et al. Machine perfusion enables 24-h preservation of vascularized composite allografts in a swine model of allotransplantation. Transpl Int. 37 (1), 102-111 (2024).
- Berkane, Y., et al. Towards optimizing sub-normothermic machine perfusion in fasciocutaneous flaps: A large animal study. Bioengineering (Basel). 10 (12), 1545 (2023).
- Brouwers, K., et al. 24-hour perfusion of porcine myocutaneous flaps mitigates reperfusion injury: a 7-day follow-up study. Plast Reconstr Surg Glob Open. 10 (2), e4123 (2022).
- Richter, O., et al. Extracorporeal perfusion of the human uterus as an experimental model in gynaecology and reproductive medicine. Human Reprod. 15 (6), 1235-1240 (2000).
- O'Neill, K., et al. Availability of deceased donors for uterus transplantation in the United States: Perception vs Reality. Transplantology. 5 (1), 27-36 (2024).
- Chan, J. K., Morrow, J., Manetta, A. Prevention of ureteral injuries in gynecologic surgery. Am J Obstet Gynecol. 188 (5), 1273-1277 (2003).
- Rocca, W. A., et al. Accelerated accumulation of multimorbidity after bilateral oophorectomy: A population-based cohort study. Mayo Clin Proc. 91 (11), 1577-1589 (2016).
- Dion, L., et al. Procurement of uterus in a deceased donor multi-organ donation National Program in France: A scarce resource for uterus transplantation. J Clin Med. 11 (3), 730 (2022).
- Agarwal, A., et al. Clinicopathological analysis of uterine allografts including proposed scoring of ischemia reperfusion injury and t-cell-mediated rejection-dallas uterus transplant study: A pilot study. Transplantation. 106 (1), e10-e20 (2022).
- Díaz-García, L., et al. Pregnancy in transplanted mouse uterus after long-term cold ischaemic preservation. Hum Reprod. 18 (10), 2142-2150 (2003).
- Tricard, J., et al. Uterus tolerance to extended cold ischemic storage after auto-transplantation in ewes. Eur J Obstet Gynecol Reprod Biol. 214, 162-167 (2017).
- Dion, L., et al. Hypothermic machine perfusion for uterus transplantation. Fertil Steril. 120 (6), 1259-1261 (2023).
- Brännström, M., et al. Experimental uterus transplantation. Hum Reprod Update. 16 (3), 329-340 (2010).
- Ozkan, O., Ozkan, O., Dogan, N. U. The Ozkan technique in current use in uterus transplantation: from the first ever successful attempt to clinical reality. J Clin Med. 12 (8), 2812 (2023).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved