Method Article
Создание модели свиньи для изучения динамического сохранения и трансплантации матки
В этой статье
Резюме
Описана подробная и воспроизводимая модель матки свиньи, начиная с хирургического вмешательства и заканчивая инициацией аппаратной перфузии, что позволяет изучать сохранение матки при трансплантации.
Аннотация
На сегодняшний день трансплантация матки является единственным вариантом для женщин с абсолютным маточным бесплодием, таких как женщины с синдромом Рокитанского, чтобы пережить беременность и родить. Несмотря на растущий интерес к трансплантации матки в последние годы, некоторые вопросы все еще требуют дальнейших исследований, в том числе ишемия-реперфузионное повреждение и его влияние на качество трансплантата и отторжение. В недавней литературе подчеркивается, что частота тромботических осложнений составляет до 20% после трансплантации матки. Этот тип осложнения может возникнуть в результате повреждения эндотелиальных клеток, вызванного гипоксией, что часто приводит к отторжению маточного трансплантата. Гипоксия индуцируется во время статического холодного хранения, которое остается золотым стандартом сохранения трансплантата при трансплантации солидных органов. В последнее время было показано, что динамическая консервация с помощью машинной перфузии улучшает долгосрочное хранение обычных и маргинальных органов за счет снижения ишемического и гипоксического повреждения. В этом протоколе мы стремимся описать каждый хирургический этап, связанный с получением и сохранением матки свиньи на основе обеих ножок матки, чтобы обеспечить подключение и инициирование протокола аппаратной перфузии.
Введение
Трансплантация матки (UTx) значительно развилась за последние десять лет, и несколько команд начали программы клинических исследований. На сегодняшний день основным показанием к ВТХ является абсолютное маточное бесплодие вследствие агенезии матки, в том числе синдром Майера-Рокитанского-Кюстера-Хаузера (MRKH). Синдром MRKH является врожденным заболеванием, встречающимся чаще одного из 5 000 живорожденных женщин1. ЮТХ потенциально может устранить дополнительные причины бесплодия, в том числе возникшие в результате гистерэктомии из-за злокачественного заболевания, послеродового кровотечения, миомы матки, инфекционных осложнений и различных врожденных пороков развития. Это говорит о том, что примерно 1 из 500 женщин может иметь право на UTx.
Первый в истории клинический UTx был проведен в 2000 году в Саудовской Аравии2, но сосудистые осложнения привели к гистерэктомии три месяца спустя. С тех пор было проведено несколько случаев ВТХ, основанных как на живых, так и на умерших донорах, в результате чего было зарегистрировано более 80 живорождений3,4. Подобно области трансплантации солидных органов и васкуляризированных композитных аллотрансплантатов (VCA), иммунное отторжение является серьезной проблемой при UTx. 5 К отторжению трансплантата могут привести несколько факторов, включая микроциркуляторную недостаточность и венозный застой, оба из которых могут привести к тромботическому осложнению. В недавнем обзоре, изучающем васкуляризацию матки при трансплантации, Kristek et al. сообщили о 15% артериального тромбоза и 5% венозного тромбоза6. Кроме того, холодная и теплая ишемия являются критическими факторами, на которые необходимо обратить внимание для успешной трансплантации, поскольку ишемия-реперфузионное повреждение (ИРИ) может привести к дисфункции трансплантата и острому отторжению 7,8. Миоциты реагируют на ишемический стресс продукцией лактата в течение 6 ч9 ч, после чего повреждение мышечных клеток необратимо. Влияние холодовой ишемии на миометрий было задокументировано в клинических исследованиях, и было показано, что использование внутриклеточного раствора Университета Висконсина во время статического холодового хранения (SCS) улучшает сохранность с лучшей сократительной реакцией на простагландин и более высокими концентрациями АТФ по сравнениюс раствором ацетата Рингера. Тем не менее, влияние теплой и холодной ишемии остается плохо изученным в UTx.
SCS остается золотым стандартом для сохранения VCA, включая матку, и для большинства трансплантаций солидных органов. Однако в последние годы значительный прогресс в системах перфузии машин и решениях для консервации привел к смене парадигмы. В настоящее время существуют убедительные доказательства того, что динамическая машинная перфузия может улучшить и продлить сохранение здоровых и маргинальных солидных органов 11,12,13,14,15. Этот метод в настоящее время широко используется в клинической практике для трансплантации легких, сердца, печени и почек 14,16,17,18. Динамическое сохранение органов продемонстрировало множество преимуществ, включая минимизацию холодовой ишемии и гипоксии за счет обеспечения непрерывного снабжения кислородом и питательными веществами, очищения от токсичных метаболитов и улучшения качества и жизнеспособности трансплантата12,19. Было разработано несколько методов, от гипотермической до нормотермической аппаратной перфузии (с переносчиками кислорода или без них), с несколькими доступными перфузатами, но только некоторые из них были протестированы на матке. Для обеспечения существенного вклада таких исследований решающее значение имеют соответствующие доклинические хирургические модели.
В данной работе субнормотермическая машинная перфузия (SNMP) используется в качестве метода динамического консервирования кислорода при комнатной температуре (около 20 °C) путем циркуляции перфузата через роликовый насос и оксигенатор. Используется модель свиньи, которая актуальна для исследований по UTx и сохранению из-за ее сходства с репродуктивной системой человека с точки зрения анатомии, физиологии и размера сосуда21,22. Матка закупается после смерти кровообращения, что обеспечивает актуальность для донорства после сердечной смерти и предполагает возможность задержки закупки после всех других соответствующих солидных органов23,24. Кроме того, эта модель облегчает проведение исследований по сохранению матки в рамках существующих трансплантационных лабораторий, уделяя особое внимание другим органам, применяя принципы «3R»25. Цель состоит в том, чтобы создать новую модель сохранения на основе ножок матки и оценить ее надежность для динамического сохранения. Подробно описаны все этапы процедуры, от гистерэктомии до консервации, с учетом выделенных ключевых моментов использования SNMP.
Описанный ниже протокол предшествовал предварительному эксперименту, основанному на использовании одного насоса и системы притока «Y-образной трубки» для обеих маточных артерий (дополнительный рисунок 1). После 4 ч SNMP орган набрал более 50% от своего первоначального веса. Изменение расхода, давления, сопротивления и веса показано на дополнительном рисунке 2. Единая перфузионная система, разделенная на два входа, не позволяла модулировать скорость каждого потока в соответствии с давлением каждой стороны. В этом случае SNMP приводила к значительному отеку в половине органа (дополнительный рисунок 3). Эта система оказалась непригодной для модели матки, отчасти потому, что ее не следует считать идеально симметричной моделью. Поэтому в этом протоколе были использованы две системы аппаратной перфузии, по одной на каждую маточную артерию.
протокол
Все животные получили гуманный уход в соответствии с Руководством Национального института здравоохранения по уходу и использованию лабораторных животных, а протоколы были одобрены Комитетом по институциональному уходу за животными и их использованию (IACUC) Массачусетской больницы общего профиля. В общей сложности для получения маток было использовано 6 самок юкатанских минипигов весом 30-40 кг, при этом четыре матки были подвергнуты SNMP. Все животные были гепаринизированы одной полной дозой (100 МЕ/кг) перед эвтаназией. Забор органов происходил после смерти с менее чем 60-минутной теплой ишемией. Другие органы могли быть собраны у того же донора для других исследований в соответствии с принципом «3R»25. Подробную информацию обо всех реагентах и оборудовании, использованных в протоколе, см. в Таблице материалов .
1. Предоперационная подготовка (за сутки до операции)
- Приготовьте раствор перфузата. Для субнормотермной машинной перфузии было использовано решение Steen+, оптимизированное для VCA 26,27. Использовался один литр раствора на одну матку, а состав подробно описан в таблице 1.
ПРИМЕЧАНИЕ: В перфузат добавляют большое количество гидроксида натрия с целью достижения pH около 7,5-7,6. Это значение явно высокое, но необходимое, так как pH будет иметь тенденцию падать по мере циркуляции и насыщения машины кислородом карбогенной смесью (95% кислорода; 5% углекислого газа). - Настройте систему перфузионной обработки машины (рис. 1). Проверьте наличие утечек и пузырей при циркуляции перфузата.
2. Посмертное закупка матки
ПРИМЕЧАНИЕ: Для имитации донорства после сердечной смерти и/или посмертного зародыша, животное должно быть усыплено в соответствии с местными рекомендациями IACUC. Обескровливание следует отдавать предпочтение внутривенному введению пентобарбитала, чтобы избежать токсичности, которая может помешать исследованию.
- Усыпьте усыпленное животное в положение лежа на спине. Очистите область живота и наложите стерильные простыни.
- Сделайте средний инфрапупочный разрез 10 см с помощью лезвия #20.
- Вскрыть подкожную клетчатку и апоневроз с помощью монополярного электрического скальпеля.
ПРИМЕЧАНИЕ: Следует обратить внимание на то, чтобы не повредить кишечник при вскрытии брюшной полости. - Отведите в сторону тонкую кишку с помощью хирургической марли и обнажите матку.
ПРИМЕЧАНИЕ: Анатомия матки используемой модели показана на рисунке 2А. - Проделайте то же самое для левой и правой сторон следующим образом:
- Определите маточные сосуды.
ПРИМЕЧАНИЕ: Маточная вена расположена латерально к маточной артерии (Рисунок 3). - Создайте отверстие в широкой связке латерально к маточной вене с помощью щипцов под прямым углом.
- Через это отверстие вставьте 2-0 швов шелковой галстука, чтобы перевязать сосуды яичников и освободить матку от окружающей соединительной ткани в широкой связке с помощью прижигания.
- Перевязать маточно-яичниковые сосуды шелковой завязкой 2-0 швов и удалить яичник и трубу.
- Скелетизируйте маточные сосуды и разделите их как можно ближе к внутренним подвздошным сосудам.
ПРИМЕЧАНИЕ: Необходимо обратить внимание на то, чтобы ножка оставалась как можно дольше, чтобы облегчить канюляцию и предусмотреть ретракцию ножки после ее разрыва. - Повторите шаги 2.5.1-2.5.5 с противоположной стороны.
- Определите маточные сосуды.
- Удалите матку, разрезав шейку матки монополярным электрическим скальпелем.
ПРИМЕЧАНИЕ: Используйте длительное время контакта, чтобы обеспечить надлежащую коагуляцию сосудов шейки матки, предотвращая утечку во время перфузии.
3. Подготовка к перфузии
- На приставном столике расширьте обе маточные артерии с помощью микрохирургического расширителя и вставьте ангиокатетер. Закрепите канюляцию шелковыми завязками 3-0 (Рисунок 2B).
ПРИМЕЧАНИЕ: Здесь для всех артерий был использован ангиокатетер 18 G. Необходимо соблюдать осторожность, чтобы не вводить катетер слишком далеко, чтобы избежать селективной канюляции, так как бифуркация относительно близка. Маточные вены не канюлируются, так как венозный отток достаточен для поддержания просвета этих сосудов открытым, что позволяет легко собирать. Помимо экономии времени, травматическая канюляция может привести к повреждению сосудов и потенциально повлиять на венозный отток. - Медленно вручную промывайте обе маточные артерии 20 мл раствора гепарина с каждой стороны, пока все сосуды не будут промыты и оттоки не станут чистыми.
ПРИМЕЧАНИЕ: Следует обращать внимание на то, чтобы не проводить промывание под высоким давлением, что может привести к микрососудистым повреждениям и недостаточности перфузии. - Взвесьте матку.
4. Субнормотермная машинная перфузия
ПРИМЕЧАНИЕ: Для матки требуются две независимые системы аппаратной перфузии. Каждая маточная артерия подключена к перфузионной системе, состоящей из роликового насоса, оксигенатора, пузырьковой ловушки и датчика давления. Перфузат в резервуаре циркулирует по силиконовым трубкам, соединенным с перечисленными выше элементами, прежде чем пройти через орган через маточную артерию к маточной вене с каждой стороны, откуда перфузат выходит и высвобождается в том же резервуаре.
- Подключите матку к аппаратным перфузионным системам, подключив канюли маточных артерий к входной трубке (рисунок 1).
- С помощью роликового насоса отрегулируйте расход до низкого уровня (2,5-4,0 мл/мин) для поддержания постоянного артериального давления в пределах 25-35 мм рт.ст.
- Оцените параметры жизнеспособности в каждый заданный момент времени как на входе, так и на оттоке с помощью шприца объемом 1 мл и анализируйте образцы с помощью аппарата для системы обработки газов крови [например, показатели газов крови (pH, pCO2, pO2, лактат, избыток оснований, бикарбонат), глюкозы, натрия, калия, кальция, хлорида].
ПРИМЕЧАНИЕ: В этом протоколе перфузия длится 4 часа, а образцы из притока и оттока отбираются каждые 30 минут. - Взвесьте матку по окончании перфузии.
Результаты
Во время перфузии система подключалась к датчику давления, который регистрировал давление во время эксперимента. Первоначально давление регистрировалось для системы, свободной от матки, которое вычиталось из записей давления во время перфузии матки для получения реального давления органа. Расход был адаптирован для поддержания давления в нужном диапазоне и контролировался роликовым насосом. Сопротивление рассчитывали по формуле R = P / Q (R: сопротивление (мм рт. ст.мл.мин-1); P: давление (мм рт.ст.); Q: расход (мл/мин)).
Эволюция параметров перфузии показана на рисунке 4. Средний начальный расход составил 5,2 (мин 2,4, не более 10,0) мл/мин с обеих сторон и не сильно колебался в течение эксперимента. На основании литературы и предыдущих экспериментов целевое давление было установлено на уровне 25-35 мм рт.ст. Среднее начальное артериальное давление составляло 26 (мин 10, макс. 36) мм рт.ст. с левой стороны матки и 27 (мин 16, макс. 39) мм рт.ст. с правой стороны. Поскольку поток и давление были немного стабильными и низкими, результирующий профиль артериального сопротивления также показывал плоскую кривую на протяжении всего эксперимента. Среднее исходное сосудистое сопротивление составило 8,5 (мин 1, макс. 13,3) мм рт.ст.мл.мин-1 с обеих сторон (рис. 4).
Сохранение SNMP оценивали по нескольким метаболическим параметрам (рис. 5): клиренс лактата (разница между оттоком лактата и притоком лактата), изменение веса, разница между входящей и исходящей глюкозой, отражающая потребление глюкозы, и потребление кислорода. Расход кислорода рассчитывали по формуле O2consumption = 0,0314 x Q x (pO2 приток - pO2 отток) / W (Q: расход (мл/мин), pO2: парциальное давление кислорода (мм рт. ст.), W: вес (г) и 0,0314 постоянной Генри в воде при 20 °C и 1 атм). Снижение уровня лактата в течение первого часа перфузии указывает на то, что перфузия аппарата позволила вывести лактат после накопления во время теплой ишемической фазы. Изменение веса показало, что ни у одной из маток не было отека. Кривая показала, что потеря веса происходила в основном в течение первых двух часов, а затем имела тенденцию к стабилизации. Разница глюкозы между притоком и оттоком уменьшалась в течение первого часа перфузии, прежде чем стабилизироваться на низких значениях. Потребление кислорода оставалось постоянным во время перфузии.
Через 4 ч после SNMP проводили ангиографию в каждой матке, медленно промывая 20 мл контрастного вещества в каждой маточной артерии (рис. 6), что позволило оценить состояние сосудистого дерева после фазы консервации. Во всех органах микроциркуляторное русло было хорошо идентифицировано вдоль шейки матки, тела матки и рогов.
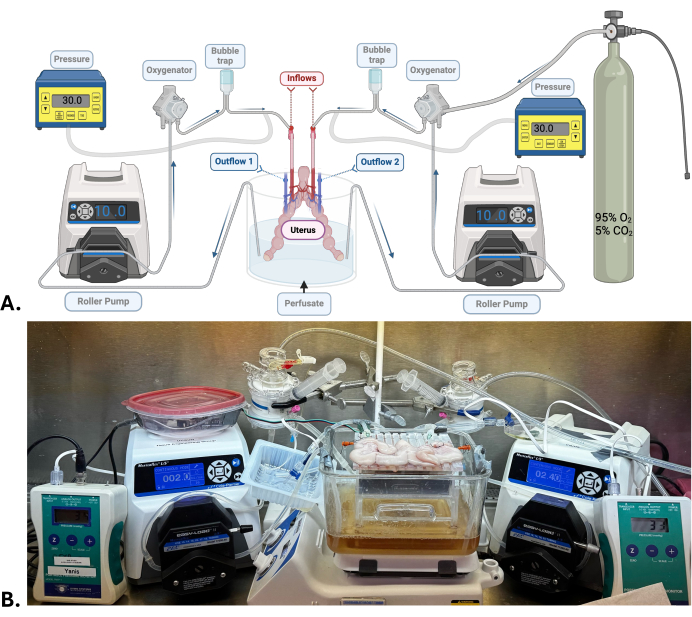
Рисунок 1: Хирургическая модель и аппаратная перфузионная система. (A) Схема аппаратной перфузионной системы, используемой для SNMP матки. (B) Репрезентативная фотография матки свиньи, проходящей процедуру SNMP. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 2: Диаграмма анатомии матки человека (слева) и свиньи (справа), показывающая основную васкуляризацию через маточную артерию. Анатомические особенности свиной матки обусловлены в основном наличием небольшого тела, разделенного на два больших маточных рога. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 3: Интра- и послеоперационный виды. (А) Интраоперационная картина матки после выявления маточных сосудов. (Б) Послеоперационные изображения матки после забора и промывания гепарином солевым раствором. А: корпус; В: рога матки; C: шейка матки; D: маточные артерии; Е: маточные вены; F: трубка; Г: яичник. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
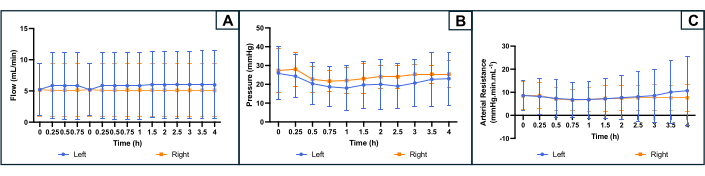
Рисунок 4: Профиль параметров перфузии во время 4-часовой аппаратной перфузии с обеих сторон матки. (A) Скорость потока (мл/мин). (B) Давление (мм рт.ст.). (c) Расчетное артериальное сопротивление (mmHg.min.mL-1). Кривые показывают среднее значение для каждой стороны матки, а полосы погрешности указывают на стандартное отклонение среднего значения. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
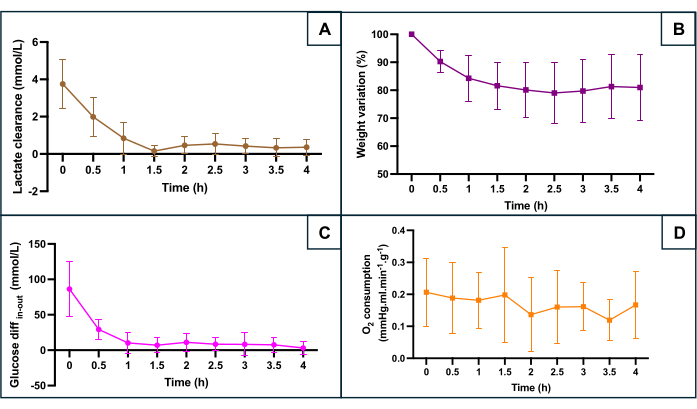
Рисунок 5: Мониторинг основных маркеров гипоксии во время перфузии аппарата. (A) Клиренс лактата в течение первых 90 минут перфузии перед стабилизацией. (B) Вес уменьшается на протяжении всей перфузии. (C) Разница между концентрацией глюкозы на входе и на выходе. (D) Рассчитано потреблениеО2 . Данные представляют собой среднее значение для обеих сторон каждой матки, а полосы погрешности показывают стандартное отклонение среднего значения. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 6: Репрезентативная ангиография сосудистого дерева матки после субнормотермической консервации. (А) Перед введением контрастного вещества. (В) После введения контрастного вещества. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
| Название компонента | Количество | Название компонента | Количество |
| Деионизированная вода | 1л | Декстран с низкой фракцией (~75 кДа) | 5 г |
| NaCl | 5.026 г | Бычий сывороточный альбумин | 150 г |
| KCl | 0,343 г | Гидрокортизон [50 мг/мл] | 0,2 мл |
| CaCl2 . 2Ч20 | 0,221 г | Дексаметазон [1,6 г/100 мг] | 4 мл |
| 2PO4 | 0,187 г | Гидроксид натрия [1 моль/мл] | 16 мл |
| НаОГС3 | 1,26 г | Низкомолекулярный гепарин | 200 МЕ |
| MgCl2 . 6Ч2О | 0,244 г | Инсулин | 200 МЕ |
| D-глюкоза | 4,3 г | Ванкомицин | 1,5 г |
| PEG (35 кДа) | 5 г |
Таблица 1: Состав раствора Стин+. NaCl: хлорид натрия; KCl: хлорид калия; CaCl2. 2Ч20: кальция хлорида дигидрат; 2PO4: дигидрофосфат натрия; NaHCO3: бикарбонат натрия; MgCl2 . 6H2O: гексагидрат хлорида магния; КОЛЫШЕК; Полиэтиленгликоль.
Дополнительный рисунок 1: Перфузионная система на основе одного насоса. (А) Схема машинной перфузии "Y-системы", использованной для предварительного эксперимента. (B) Репрезентативная фотография установки для предварительного эксперимента. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный рисунок 2: Профиль параметров перфузии в течение 4,5 ч-SNMP для предварительного эксперимента. (A) Расход (мл/мин). (B) Давление (мм рт.ст.). (c) Расчетное артериальное сопротивление (mmHg.min.mL-1). (D) Увеличение веса на протяжении всей перфузии. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный рисунок 3: Фотография матки в конце предварительного эксперимента (4,5 ч-SNMP). Асимметричное распределение отека очевидно, в основном в правом роге (справа на изображении). Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Обсуждение
Трансплантация матки, которую часто считают частью VCA, быстро развивалась в последние несколько лет. Параллельно с этим в VCA начали изучать машинную перфузию, поскольку она продемонстрировала убедительные доказательства в улучшении сохранения солидных органов. Гипотермическая и субнормотермная машинная перфузия позволила сохранить до 24 ч у свиней модели миокожных и костесодержащих VCA 26,27,28. Поскольку матка представляет проблемы, сравнимые с СВКА, содержащими кости и кожу, крайне важно изучить аналогичные методы для ВТС для повышения качества сохранности и долгосрочных результатов29. Помимо улучшения качества органов, потенциальным преимуществом динамической консервации с помощью машинной перфузии является расширение пула доноров. Извлечение матки от живых доноров сопряжено со значительными рисками, такими как повреждение мочеточника во время рассечения ножки матки, а также гормональные сбои и все потенциальные риски, связанные с ранней менопаузой из-за овариэктомии, которая может быть выполнена31,32. Цель улучшения качества органов умершего донора позволит избежать необходимости проведения такой операции в процедурах закупки живых доноров. Конечная цель состоит в том, чтобы обеспечить возможность восстановления матки как у живых, так и у умерших доноров, чтобы удовлетворить потребности женщин с абсолютным бесплодием матки.
В данной статье представлена воспроизводимая модель приобретения и сохранения матки свиней с помощью аппаратной перфузии. Улучшение качества и продолжительности сохранности имеет важное значение для расширения пула доноров, позволяя донорам с мертвым мозгом быть надежными источниками для закупки матки. Клинически большинство ЮТХ проводились на основе живых доноров, в основном членов семьи или близких друзей. Время ишемии является критическим фактором в жизнеспособности конечного органа, особенно у доноров с мертвым мозгом. IRI определяется клеточным повреждением, вызванным последовательностью ишемии (прерывание кровообращения в сосудистом дереве органа) и реперфузии (возвращение кислорода), часто связанной с повышением температуры, что способствует повреждению клеток. Этот каскад событий приводит к образованию активных форм кислорода, что в конечном итоге приводит к хроническому воспалению, апоптозу, высвобождению антигена и отторжению трансплантата 7,8,34. Теплое (WIT) и холодное время ишемии являются критическими факторами в процессе ИРИ, но лишь немногие авторы изучали его в матке. В исследовании, изучающем эффект долгосрочного сохранения ГКС у мышей UTx, трансплантация проводилась через 24 ч после ГКС, при этом успешная беременность развилась у пяти из шести животных. Однако через 48 ч после ГКС у всех трансплантатов был обнаружен некроз35. В другом исследовании, в котором сравнивали UTx у 14 овец после 3 ч СКС (n = 7) и 24 ч после СКС (n = 7), только 7 животных были живы через 8 дней после трансплантации, при этом 35% маток считались жизнеспособными в отношении отека и некроза, 2 матки в группе 3 ч ГКС и 3 матки в группе36 ч ГКС. Интересно, что сокращение миометрия сохранялось в жизнеспособной матке, но метод оценки не уточнялся. Это подчеркивает критическую важность рассмотрения того, что успешная трансплантация матки включает в себя не только жизнеспособный трансплантат, но и функциональную менструацию и успешную беременность. В связи с этим, снижение IRI и их негативных последствий является первичным для улучшения качества трансплантатов и повышения показателей успешности живорождения. Чтобы обеспечить постоянство, мы позаботились о том, чтобы извлечь все органы после сопоставимого WIT. Все сосуды в пределах широкой связки были коагулированы или перевязаны для обеспечения соответствующего измерения давления и адекватной капиллярной перфузии всего органа. Катетеризация является еще одним важным моментом, на который следует обратить внимание, чтобы закрепить канюлю, не повреждая при этом сосуды.
Предварительный эксперимент с «Y-системой» привел к оптимизации двух независимых перфузионных систем, воздействуя на каждую маточную артерию отдельно. Действительно, одним из критических параметров является скорость потока и перфузионное давление 26,27, которые обуславливают адаптацию скорости потока, отражая общее сосудистое сопротивление органа. Оптимизированный двусторонний приток позволил обеспечить клиренс лактата с каждой стороны органа, как показано в наших результатах (рис. 5), а также непрерывные измерения артериовенозных различий для всех метаболических параметров. При субнормотермной температуре клеточная реоксигенация с помощью аппаратной перфузии позволяет устранить лактаты, накопленные во время анаэробной метаболической фазы, связанной с гипоксией и гипоперфузией, во время заготовки и канюляции, сохраняя метаболическую активность на низком уровне и предотвращая отскок лактата. Аналогичные результаты были обнаружены на задних конечностях крыс19. В другой анатомической модели Dion et al. продемонстрировали другой подход, собрав матку с аортой в своем исследовании гипотермической перфузии37. Для будущих исследований было бы очень интересно правильно сравнить одиночную перфузию на основе аорты с моделью, разработанной в нашем протоколе.
Несмотря на то, что здесь описана воспроизводимая модель машинной перфузии матки свиньи, одной из основных проблем является пригодность для дальнейшей трансплантации. Для подтверждения эффективности протоколов сохранения трансплантация имеет решающее значение, поскольку она воспроизводит клинические условия. Для этого необходимы артериальные и венозные микрохирургические анастомозы. Несколько исследований показали, что маточно-яичниковая вена может быть использована при клинической ЮТХ, когда маточная вена имеет недостаточный калибр для обеспечения венозного дренажа38,39. Одним из ограничений в этой модели является недостаточная сохранность маточно-яичниковой вены. Тем не менее, после 4 ч SNMP у всех включенных реплик не было зарегистрировано большого отека, а из всех маточных вен отмечался непрерывный венозный отток. Это предполагает разницу между моделью человека и свиньи с потенциальным упрощением процедур UTx у минипигов Юкатана. Дальнейшие исследования должны включать увеличение времени перфузии более чем на 4 ч для определения пределов динамической сохранности. В заключение следует отметить, что в данной статье описывается воспроизводимая модель свиной матки для изучения консервации на основе машинной перфузии и предоставляется ценный ресурс для таргетирования IRI с целью увеличения общего числа доступных органов для UTx.
Раскрытие информации
Все авторы не имеют финансового интереса, чтобы заявить об этом.
Благодарности
Эта работа была частично профинансирована Национальным институтом здравоохранения в рамках гранта No R01AR082825 (BEU) и Shriners Children's 84308 (YB). HO и YB получили финансирование от Fondation des Gueules Cassées. Выражаем глубокую признательность за поддержку компании YB со стороны Société Française de Chirurgie Plastique, Reconstructrice et Esthétique (SOFCPRE, Франция) и CHU de Rennes (Франция).
Материалы
| Name | Company | Catalog Number | Comments |
| Affinity Pixie Oxygenation System | Medtronic | BBP241 | Oxygenator |
| Bovin serum albumin | Sigma-Aldrich | A9647 | Perfusate component |
| Calcium chloride dihydrate | Sigma-Aldrich | 223506 | Perfusate component |
| Carbon Dioxide Oxygen | Airgas | UN3156 | Carbon Dioxide Oxygen mix gas |
| D-(+)-Glucose monohydrate | Sigma-Aldrich | 49159 | Perfusate component |
| Dexamethasone | Sigma-Aldrich | D2915 | Perfusate component |
| Dextran | Thermo scientific | 406271000 | Perfusate component |
| Heparin sodium injection | Eugia Pharma | 63739-953-25 | Perfusate component |
| Humulin Regular Insulin human | Lilly | 0002-8215-01 | Perfusate component |
| Hydrocortisone sodium succinate | Pfizer | 0009-0011-03 | Perfusate component |
| Magnesium chloride hexa-hydrate | Sigma-Aldrich | M9272 | Perfusate component |
| MasterFlex L/S | Cole-Parmer | 77200-32 | Roller pump |
| Polyethylene glycol 35000 | Sigma-Aldrich | 25322-68-3 | Perfusate component |
| Potassium chloride | Sigma-Aldrich | 7447-40-7 | Perfusate component |
| Pressure Monitor, Portable, PM-P-1 | Living Systems Instrumentation | PM-P-1 | Pressure sensor |
| Radnoti Bubble Trap Compliance Chamber | Radnoti | 130149 | Bubble trap |
| RAPIDPoint500 | Siemens | 500 | Blood Gas System |
| Sodium bicarbonate | Sigma-Aldrich | S5761 | Perfusate component |
| Sodium chloride | Sigma-Aldrich | S9888 | Perfusate component |
| Sodium hydroxide | Sigma-Aldrich | 72068 | Perfusate component |
| Sodium phosphate monobasique dihydrate | Sigma-Aldrich | 71505 | Perfusate component |
| Syringe 1 mL | BD | 309659 | Sample procurement |
| Vancomycine hydrochloride | Slate run pharmaceuticals | 70436-021-82 | Perfusate component |
Ссылки
- Ejzenberg, D., et al. Livebirth after uterus transplantation from a deceased donor in a recipient with uterine infertility. Lancet. 392 (10165), 2697-2704 (2019).
- Fageeh, W., Raffa, H., Jabbad, H., Marzouki, A. Transplantation of the human uterus. Int J Gynaecol Obstet. 76 (3), 245-251 (2002).
- Lavoue, V., et al. Which donor for uterus transplants: brain-dead donor or living donor? A systematic review. Transplantation. 101 (2), 267-277 (2017).
- Brännström, M., et al. Registry of the International Society of Uterus Transplantation: First report. Transplantation. 107 (1), 172-181 (2023).
- Van Dieren, V., et al. Acute rejection rates in vascularized composite allografts: A systematic review of case reports. J Surg Res. 298, 33-44 (2024).
- Kristek, J., et al. Human uterine vasculature with respect to uterus transplantation: A comprehensive review. J Obs Gynaecol Res. 46 (11), 1999-2007 (2020).
- He, J., Khan, U. Z., Qing, L., Wu, P., Tang, J. Improving the ischemia-reperfusion injury in vascularized composite allotransplantation: Clinical experience and experimental implications. Front Immunol. 13, 998952 (2022).
- Ponticelli, C. Ischaemia-reperfusion injury: A major protagonist in kidney transplantation. Nephrol Dial Transplant. 29 (6), 1134-1140 (2014).
- Harris, K., et al. Metabolic response of skeletal muscle to ischemia. Am J Physiol. 250 (2 Pt 2), H213-H220 (1986).
- Wranning Almen, C., et al. Short-term ischaemic storage of human uterine myometrium--basic studies towards uterine transplantation. Hum Reprod. 20 (10), 2736-2743 (2005).
- Bodewes, S. B., et al. Oxygen transport during ex situ machine perfusion of donor livers using red blood cells or artificial oxygen carriers. Int J Mol Sci. 22 (1), 235 (2020).
- Boncompagni, E., et al. Decreased apoptosis in fatty livers submitted to subnormothermic machine-perfusion respect to cold storage. Eur J Histochem. 55 (4), e40 (2011).
- Czigany, Z., et al. Hypothermic oxygenated machine perfusion reduces early allograft injury and improves post-transplant outcomes in extended criteria donation liver transplantation from donation after brain death: Results from a Multicenter Randomized Controlled Trial (HOPE ECD-DBD). Ann Surg. 274 (5), 705-712 (2021).
- Markmann, J. F., et al. Impact of portable normothermic blood-based machine perfusion on outcomes of liver transplant: The OCS Liver PROTECT randomized clinical trial. JAMA Surg. 157 (3), 189-198 (2022).
- Cypel, M., et al. Normothermic ex vivo lung perfusion in clinical lung transplantation. New Eng J Med. 364 (15), 1431-1440 (2011).
- Roesel, M. J., Ius, F., Knosalla, C., Iske, J. The role of ex-situ perfusion for thoracic organs. Curr Opin Organ Transplant. 27 (5), 466-473 (2022).
- Michel, S. G., et al. Twelve-hour hypothermic machine perfusion for donor heart preservation leads to improved ultrastructural characteristics compared to conventional cold storage. Ann Transplant. 20, 461-468 (2015).
- Ghoneima, A. S., Sousa Da Silva, R. X., Gosteli, M. A., Barlow, A. D., Kron, P. Outcomes of kidney perfusion techniques in transplantation from deceased donors: A systematic review and meta-analysis. J Clin Med. 12 (12), 3221 (2023).
- Charlès, L., et al. Effect of subnormothermic machine perfusion on the preservation of vascularized composite allografts after prolonged warm ischemia. Transplantation. 108 (5), e280-e290 (2024).
- Duru, &. #. 1. 9. 9. ;., et al. Review of machine perfusion studies in vascularized composite allotransplant preservation. Front Transplantation. 2, 103-111 (2023).
- Brännström, M., Diaz-Garcia, C., Hanafy, A., Olausson, M., Tzakis, A. Uterus transplantation: Animal research and human possibilities. Fertil Steril. 97 (6), 1269-1276 (2012).
- Wranning, C. A., et al. Auto-transplantation of the uterus in the domestic pig (Sus scrofa): Surgical technique and early reperfusion events. J Obstet Gynaecol Res. 32 (4), 358-367 (2006).
- Croome, K. P., et al. American Society of Transplant Surgeons recommendations on best practices in donation after circulatory death organ procurement. Am J Transplant. 23 (2), 171-179 (2023).
- Dickens, B. M. Legal and ethical issues of uterus transplantation. Int J Gynaecol Obstet. 133 (1), 125-128 (2016).
- Díaz, L., et al. Ethical considerations in animal research: The Principle of 3R's. Rev Invest Clin. 73 (4), 199-209 (2020).
- Goutard, M., et al. Machine perfusion enables 24-h preservation of vascularized composite allografts in a swine model of allotransplantation. Transpl Int. 37 (1), 102-111 (2024).
- Berkane, Y., et al. Towards optimizing sub-normothermic machine perfusion in fasciocutaneous flaps: A large animal study. Bioengineering (Basel). 10 (12), 1545 (2023).
- Brouwers, K., et al. 24-hour perfusion of porcine myocutaneous flaps mitigates reperfusion injury: a 7-day follow-up study. Plast Reconstr Surg Glob Open. 10 (2), e4123 (2022).
- Richter, O., et al. Extracorporeal perfusion of the human uterus as an experimental model in gynaecology and reproductive medicine. Human Reprod. 15 (6), 1235-1240 (2000).
- O'Neill, K., et al. Availability of deceased donors for uterus transplantation in the United States: Perception vs Reality. Transplantology. 5 (1), 27-36 (2024).
- Chan, J. K., Morrow, J., Manetta, A. Prevention of ureteral injuries in gynecologic surgery. Am J Obstet Gynecol. 188 (5), 1273-1277 (2003).
- Rocca, W. A., et al. Accelerated accumulation of multimorbidity after bilateral oophorectomy: A population-based cohort study. Mayo Clin Proc. 91 (11), 1577-1589 (2016).
- Dion, L., et al. Procurement of uterus in a deceased donor multi-organ donation National Program in France: A scarce resource for uterus transplantation. J Clin Med. 11 (3), 730 (2022).
- Agarwal, A., et al. Clinicopathological analysis of uterine allografts including proposed scoring of ischemia reperfusion injury and t-cell-mediated rejection-dallas uterus transplant study: A pilot study. Transplantation. 106 (1), e10-e20 (2022).
- Díaz-García, L., et al. Pregnancy in transplanted mouse uterus after long-term cold ischaemic preservation. Hum Reprod. 18 (10), 2142-2150 (2003).
- Tricard, J., et al. Uterus tolerance to extended cold ischemic storage after auto-transplantation in ewes. Eur J Obstet Gynecol Reprod Biol. 214, 162-167 (2017).
- Dion, L., et al. Hypothermic machine perfusion for uterus transplantation. Fertil Steril. 120 (6), 1259-1261 (2023).
- Brännström, M., et al. Experimental uterus transplantation. Hum Reprod Update. 16 (3), 329-340 (2010).
- Ozkan, O., Ozkan, O., Dogan, N. U. The Ozkan technique in current use in uterus transplantation: from the first ever successful attempt to clinical reality. J Clin Med. 12 (8), 2812 (2023).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены