Method Article
Besleyicisiz Koşullar Altında Kültürlenen İnsan Pluripotent Kök Hücrelerinde CRISPR-Cas9 Aracılı Gen Delesyonuna
Bu Makalede
Özet
Sunulan yöntem, yüksek verimli bir lentiviral aracılı gen dağıtım sistemi kullanarak L2HGDH genini hedefleyen sgRNA'ları kararlı bir şekilde ifade eden insan embriyonik kök hücre (hESC) hattı H9'da CRISPR aracılı bir gen nakavtının oluşturulmasını açıklar.
Özet
Genom düzenleme için CRISPR-Cas9 sistemi, kök hücreler de dahil olmak üzere memeli hücrelerinde gen fonksiyonu çalışmalarında devrim yarattı. Bununla birlikte, bu tekniğin, özellikle pluripotent kök hücrelerde pratik uygulaması, zaman ve emek yoğun olması ve düşük düzenleme verimliliğine sahip olması gibi bazı zorluklar ortaya çıkarmaktadır. Burada, yüksek verimli ve stabil bir lentiviral aracılı gen dağıtım sistemi kullanarak, L2HGDH geni için sgRNA'ları kararlı bir şekilde ifade eden bir insan embriyonik kök hücre (hESC) hattında CRISPR aracılı bir gen nakavtının oluşturulmasını açıklıyoruz. L2HGDH geninin ekzon 1'ini hedefleyen sgRNA'lar kimyasal olarak sentezlendi ve hESC enfeksiyonu için daha yüksek lentiviral titreler ve puromisin kullanılarak stabil seçim elde etmek için sgRNA'ların yapısal ekspresyonunu Cas9 ile yüksek verimli bir tek vektör sisteminde birleştiren lentiCRISPR v2-puro vektörüne klonlandı. Puromisin ile seçilen hücreler daha da genişletildi ve sınırlı seyreltme yöntemi kullanılarak tek hücreli klonlar elde edildi. Tek klonlar genişletildi ve Western blot analizi kullanılarak L2HGDH ekspresyonunda %100'lük bir azalma ile doğrulandığı gibi, L2HGDH geni için birkaç homozigot nakavt klonu elde edildi. Ayrıca, MSBSP-PCR kullanılarak, CRISPR mutasyon bölgesi, seçilen homozigot klonlarda Cas9'un PAM tanıma dizisinin yukarı akışında haritalandı. Kesin ekleme/silme işlemlerini analiz etmek için Sanger dizilemesi yapıldı ve klonların fonksiyonel karakterizasyonu yapıldı. Bu yöntem, daha önce bildirilen viral olmayan gen verme yöntemlerine kıyasla önemli ölçüde daha yüksek bir homozigot delesyon yüzdesi üretti. Bu rapor L2HGDH genine odaklansa da, bu sağlam ve uygun maliyetli yaklaşım, gen fonksiyon çalışmaları için pluripotent kök hücrelerdeki diğer genler için homozigot nakavtlar oluşturmak için kullanılabilir.
Giriş
İnsan embriyonik kök hücreleri (hESC'ler) ve indüklenmiş pluripotent kök hücreler (iPSC'ler), vücuttaki tüm hücre tiplerine farklılaşma potansiyeline sahip kök hücrelerdir. Bu hücreler, insan gelişimini incelemenin yanı sıra çeşitli hastalıkların altında yatan mekanizmaları anlamak için değerli araçlar olarak hizmet eder ve böylece rejeneratif tıp, hastalık modellemesi ve ilaç keşfi için muazzam bir umut vaat eder. Bu tür çalışmalar, belirli genlerin organizmaların gelişimine, işleyişine ve düzenlenmesine nasıl katkıda bulunduğunun araştırılmasını içerir 1,2.
Gen işlevini deşifre etmek için, gen nakavt etme veya aşırı ekspresyon gibi genetik manipülasyon ve genom düzenleme dahil olmak üzere çeşitli teknikler ve yaklaşımlar kullanılır. Bunlar arasında CRISPR-Cas9 teknolojisi, gen nakavt ve gen düzenleme çalışmaları için en verimli yaklaşım olarak ortaya çıkmıştır 1,2,3. CRISPR-Cas9 sistemi, ilgilenilen belirli bir DNA dizisini tanımlamak ve bağlamak için özel olarak tasarlanmış tek bir kılavuz RNA (sgRNA) molekülü kullanarak çalışır. Moleküler bir kılavuz görevi gören sgRNA, Cas9 enzimini genomda modifikasyon gerektiren kesin konuma yönlendirir. Bağlandıktan sonra, Cas9 belirlenen bölgede DNA'da çift sarmallı bir kırılma başlatır. DNA'nın bölünmesini takiben, hücrenin doğal onarım mekanizmaları aktive edilir. Bunlar iki ana onarım yolunu içerir: homolog olmayan uç birleştirme (NHEJ) ve homolojiye yönelik onarım (HDR). NHEJ genellikle kırılma bölgesinde eklemeler veya delesyonlar (indels) ile sonuçlanır ve bu da gen bozulmasına veya inaktivasyona yol açar. Tersine, HDR, kırılma bölgesine yeni DNA dizilerinin yerleştirilmesini sağlayarak hedeflenen genetik değişikliklerin tanıtılmasını kolaylaştırır4.
Pluripotent kök hücrelerde gen delesyonlarının önemi göz önüne alındığında, hESC'lerde / iPSC'lerde CRISPR-Cas9 aracılı gen nakavtları hakkında çeşitli protokoller yayınlanmıştır. Bununla birlikte, bu protokollerin çoğu, son derece zaman alıcı, emek yoğun ve viral olmayan gen dağıtım yöntemlerinin kullanılması nedeniyle düşük verimliliğe sahip olma gibi önemli sınırlamalarla karşı karşıyadır5. Bu hücrelerin diğer hücre tiplerine kıyasla daha düşük düzenleme verimliliğine sahip olduğu bilindiğinden, bu zorluklar hESC'lerde/iPSC'lerde daha da belirgindir5. Bu sınırlamalardan bazıları, Cas9 ve sgRNA'ları içeren plazmit dağıtımının verimliliğini artırarak ele alınabilir. Bu, gen düzenleme sonuçlarını önemli ölçüde iyileştirebilen bir lentiviral vektör sistemi kullanılarak başarılı bir şekilde başarılabilir. Lentivirus paketleme protokolleri iyi kurulmuş ve basittir, sınırlı deneyime sahip araştırmacılar tarafından bile laboratuvarlarda kolayca benimsenmesini sağlar. Lentivirüsler, hESC'ler ve iPSC'ler dahil olmak üzere çeşitli hücre tiplerinde yüksek enfeksiyon verimliliği sergiler. Bu nedenle, Cas9-sgRNA ekspresyonu için bir lentiviral sistem kullanmak, gen fonksiyonu çalışmaları için hESC'lerde/iPSC'lerde rutin gen düzenleme deneyleri için idealdir.
Burada, hESC'lerde geleneksel protokollerden nispeten daha kısa bir süre içinde yüksek verimli CRISPR-Cas9 tabanlı gen delesyonları için basit ve anlaşılır bir yöntem sunuyoruz (Şekil 1). Cas9 ve sgRNA'nın yapısal ekspresyonuna sahip bir lentiviral vektör kullanılmış olmasına rağmen, kontrol edilebilir Cas9 ekspresyonu için ilaca bağlı Cas9 ekspresyonu ile kolayca değiştirilebilir.
Protokol
Bu çalışmada kullanılan gen dizileri, reaktifler ve ekipmanların ayrıntıları Malzeme Tablosunda listelenmiştir.
1. Tek kılavuz RNA (sgRNA) tasarımı, klonlama ve lentiviral vektör üretimi
NOT: L2HGDH geninin ekzon 1'ini hedefleyen, her ikisi de Qiu ve ark.6'dansırasıyla 1 ve 2 dizileri için AGG ve TGG'nin PAM bölgeleri ile uyarlanmış iki farklı sgRNA dizisi kullanılır. Her iki sgRNA da 20 bp uzunluğundaydı ve uçlar, önceki rapor6'da açıklandığı gibi hedef vektörde (LentiCRISPRv2) klonlanacak kısıtlama enzimi Bsmb1 için bağlayıcı diziler eklemek üzere değiştirildi. Klonlama amacıyla sgRNA'ların tasarımı sırasında bağlayıcı diziler eklendi.
- Tavlanmış sgRNA'lar6 ve daha önce bildirildiği gibi optimize edilmiş protokol kullanılarak Bsmb1 tek kesimli lentiviral vektör, LentiCRISPRv2'ye klonlanır7.
- Standartlaştırılmış ve optimize edilmiş protokol7'yi kullanarak lentiviral paketleme ve konsantrasyon ile devam edin.
- Lentivirüs üretimi için, DMEM,% 10 FBS ve 1x penisilin / streptomisin (P / S) kullanarak hücreleri (1 HEK293T× 105 hücre /cm2) tohumlayın ve nemli koşullar altında% 5 CO2 atmosferinde 37 ° C'de doku kültürü inkübatöründe gece boyunca inkübe edin.
- % 90 birleştiğinde, giriş vektörü (boş omurga veya plazmitleri eksprese eden sgRNA) ile HEK293T hücreleri birlikte transfekte edin ve daha önce tarif edildiği gibi düşük maliyetli katyonik polimer PEI kullanarak plazmitleri paketleyin7.
- Transfeksiyondan 48 saat ve 72 saat sonra Lentiviral süpernatant (LVS) partikülleri içeren şartlandırılmış ortamı toplayın ve sükroz yastığı kullanarak ultrasantrifüjlemeye devam edin ve tüpleri 1,25,000 ° C'de 2 saat boyunca 4 x g'da döndürün.
- LVS partikül konsantrasyonu ile PBS, alikot cinsinden orijinal hacmin en az 200 katına kadar devam edin ve kullanıma kadar -80 ° C'de saklayın.
- Üreticinin talimatlarını izleyerek qPCR Lentivirus Titre Kitini kullanarak lentiviral partiküllerin titresini belirleyin (bkz. Malzeme Tablosu).
2. Lentiviral enfeksiyonlar ve tek hücreli klonal yayılım
- LVS partikülleri ile enfeksiyonlar için, 1 × 105 hücre/0.5 mL hESC kültür ortamına (Bazal ortam + P / S + 10 μM Kaya İnhibitörü) sahip tohum hESC (H9) hücre süspansiyonu, 500 μL ortamda tam Matrigel (1:50) kaplı P24 oyuklu plakalar üzerinde ve hücrelerin yapışmasına izin vermek için gece boyunca inkübe edilir. LVS ile enfekte olmayacak ancak enfekte olmayan kontrol olarak hizmet etmek için puromisin ile muamele edilecek ekstra kuyular tohumlayın.
NOT: Hücre sayımı, manuel hemositometre veya otomatik hücre sayacı kullanılarak gerçekleştirilebilir. - Ertesi gün, hücreleri 8 μg/mL polibren ile birlikte 10 ° C'lik Enfeksiyon Çokluğunda (MOI) enfekte edin ve 37 ° C'de 8 saat inkübe edin, ardından taze hESC ortamı + Kaya İnhibitörü içermeyen P / S ile ortam değişimi yapın ve hücreler% 90 birleşene kadar kültürlemeye devam edin.
- Hücreler genellikle enfeksiyondan 48-72 saat sonra %90 birleşmeye ulaştığında, ortamı 0.8 μg/mL puromisin konsantrasyonu ile destekleyerek puromisin seçimine başlayın ve enfekte olmayan hücrelerde (kontrol grubu) tüm hücreler ölene kadar seçime devam edin.
- Seçim tamamlandıktan sonra (genellikle 4-6 gün), kararlı hücreleri bölün (1: 4) ve kriyoprezervasyon ve daha fazla analiz için genişletin.
- L2HGDH-sgRNA-16 eksprese eden hücreleri kullanarak tek hücre seçimi ve klonal genişleme gerçekleştirin.
- Bu amaçla, 500 hücre / 10 mL tam büyüme ortamına eşdeğer bir hücre süspansiyonu hazırlayın ve 96 oyuklu bir plakanın her bir oyuğuna bu süspansiyondan 100 μL tohumlayın.
- Hücreleri 3 gün boyunca rahatsız etmeyin ve sonra gözlemleyin.
- Tek klonlar veren kuyuları işaretleyin ve kolonilerin daha da genişlemesi, kriyoprezervasyon yapması ve analiz etmesi için yeterli bir boyuta ulaşılana kadar (genellikle 2 hafta) ortamı her gün değiştirin.
3. gDNA ekstraksiyonu, MS-BSP PCR ve Sanger dizilimi
- Üreticinin talimatlarını izleyerek genomik DNA izolasyon Kitini kullanarak hücrelerden gDNA'yı izole edin (bkz. Malzeme Tablosu).
- Mutasyon Bölgelerine Dayalı Spesifik Primerler (MS-BSP) analizini8 kullanarak PAM tanıma dizilerinin yukarısındaki mutasyon bölgelerinin haritalanmasına devam edin.
- Bunun için, tarafsız bir sağ astar L2H-UMSBSP-R1, herhangi bir hedefi yükseltmek için Ekson1 dışındaki bölgeyi büyütmek üzere tasarlanmıştır.
- Hedef diziyi PAM tanıma dizilerine yakın bir şekilde yükseltmek için sgRNA ile aynı diziye sahip önyargılı bir sol primer L2H-BMSBSP-F1 tasarlayın.
NOT: PCR'nin çok yüksek katı koşullarında, ürün mutasyona uğramamış klonlarda jel üzerinde gözlenecektir. CRISPR-nakavt klonlarında, PAM tanıma dizilerinin yukarı akışına yakın mutasyonlar sergileyen hiçbir ürün gözlenmeyecektir. - Tek baz çifti mutasyonlarını haritalamak için, PCR, L2HGDH'nin tüm ekzon 1'ini kapsayan 468 bp'lik bir diziyi çoğaltır ve Sanger dizilemesine ve ardından clustalw8 kullanılarak çoklu dizi hizalama analizine tabi tutulur.
4. hESC-farklılaşma ve embriyoid cisim (EB) oluşumu testi
- Daha önce ikili smad inhibisyon yöntemi 9,10,11 kullanılarak tarif edildiği gibi yerleşik protokolleri izleyerek nöro-ektoderm kaderine doğru kontrol ve hESC'lerin (H9) farklı CRISPR klonlarının yönlendirilmiş farklılaşması ile devam edin.
- % 90 birleşme durumunda, hücreleri% 100 KSR ortamında ilk 24 saat boyunca LDN193189 (200 nM) ve SB431542 (10 μM) ile tedavi edin ve ardından 939 gün daha XAV2 (2 μM) ekleyin.
- 3 gün sonra, KSR ortamının yüzdesini azaltın (% 15 (h / v) KSR,% 1 (h / v) L-glutamin,% 1 (h / v) P / S,% 1 (h / v) 10 mM MEM ve% 0.1 (h / h) 2-merkaptoetanol (% 75,% 50,% 25) ile N2 ortamı (1x N2 takviyesi ile desteklenmiş DMEM / F12, 1x P / S, ) 8 günlük bir süre içinde %100 N2 ortamına.
- 12. Günün başında, nöro-ektoderm belirteci olarak PAX6 kullanarak hücreleri immün boyama için düzeltin.
- Mezoderm ve endodermal kader belirleme çalışmaları için, önceki yayınlarda açıklanan küçük molekül CHIR99021 tabanlı bir yaklaşım kullanın12,13.
- Bunun için, hücreler% 70 birleşmeye ulaştığında, 24 saat boyunca Kesin Endoderm (DE) ortamında 3 μM CHIR99021 ile tedavi edin ve ardından mezoderme özgü belirteç olarak Brachuary kullanarak immünoboyama için fiksasyon yapın.
- Endodermal aşama için, FOXA2 kullanarak immün boyama için fiksasyon yapmadan önce hücreleri CHIR99021 ilavesi olmadan sadece DE ortamında 24 saat daha kültürleyin.
- EB oluşum testi için, mikrografları almadan önce 24 saat boyunca süspansiyon koşulları altında hücreleri kültürlemek için Matrigel kullanmadan hücreleri düşük bağlı hücre yüzeylerine tohumlayın.
5. Batı lekesi analizi
- Hücreleri PBS kullanarak iki kez yıkayın ve %1 SDS içeren 1x RIPA tamponu ve 1x proteaz ve fosfataz inhibitör kokteyli kullanarak parçalayın.
- Lizatları 4 ° C'de 10 dakika boyunca 16.000 x g'da santrifüjleme ve ardından süpernatanların toplanmasıyla temizleyin.
- Üreticinin talimatlarını izleyerek BCA protein tahlil kitini kullanarak toplam hücre proteinini ölçün. 4 × yüklemeli boya numune tamponu kullanarak numuneleri 2 μg/μL'ye ayarlayın.
- Protein numunelerini 10 dakika boyunca 70 ° C'de denatüre edin, her numuneden eşit miktarda yükleyin ve% 4 -% 12 gradyan SDS-PAGE jelleri7 kullanarak çözün ve ardından 4 ° C'de 1 saat boyunca 100 V'luk sabit bir voltajda PVDF membranına aktarın.
- % 5 yağsız süt kullanarak zarları bloke edin ve rotasyonla gece boyunca 4 ° C'de birincil antikor seyreltmelerinde inkübe edin.
- Daha sonra, membranları PBST tamponu kullanarak 5x yıkayın ve oda sıcaklığında 1 saat boyunca HRP konjuge uygun ikincil antikorlarda inkübe edin.
- Membranları PBST 5x ile tekrar yıkayın, kemilüminesan substrat ile inkübe edin ve X-ışını filmleri kullanarak geliştirin.
6. İmmün boyama
- Hücreleri P4 kuyu plakalarına tohumlayın ve hücrelerin yüzeylere düzgün bir şekilde bağlanmasını sağlamak için fiksasyondan önce en az 24 saat inkübe edin.
- Ölü hücreleri ve ortam bileşenlerini çıkarmak için hücreleri 3 kez PBS ile yıkayın, ardından oda sıcaklığında 15 dakika boyunca% 4 PFA kullanarak fiksasyon yapın.
- % 0.3 triton X-100 kullanarak hücreleri geçirgen hale getirin, ardından oda sıcaklığında 1 saat boyunca PBS'de% 2 BSA kullanarak% 2 BSA kullanarak spesifik olmayan bağlanmayı bloke edin.
- Numuneleri, gece boyunca 4 ° C'de% 1 BSA içinde seyreltilmiş birincil antikorlarla (OCT4, NANOG, SOX2, KI67, PAX6, Brachuary, FOXA2) inkübe edin.
- Hücreleri 3x PBS ile yıkayın ve oda sıcaklığında 1 saat boyunca% 1 BSA ile seyreltilmiş uygun ikincil antikorlarla (Keçi anti-fare 488, Keçi anti-tavşan 488, Keçi anti-fare 546, Keçi anti-tavşan 546) inkübe edin.
- Son olarak, numuneleri PBS 3x ile yıkayın ve bir floresan mikroskobu kullanarak DAPI ve görüntü ile lekeleyin.
Sonuçlar
L2HGDH sgRNA'ların lentiCRISPRv2 puro'da klonlanması
lentiCRISPRv2 puro vektörü ticari olarak elde edildi (Malzeme Tablosuna bakınız) ve BsmB1 ile sindirildi, bu da 1.8 Kb'lik bir doldurma parçasının serbest bırakılmasıyla sonuçlandı. Şekil 2A'da gösterildiği gibi, vektörün tam bir sindirimi gözlendi. Her yapı için, altı klon, bir primer olarak ters sgRNA dizisi ve vektör dizisi içinden bir ileri primer (U6-459F) kullanılarak ekin varlığı veya yokluğu açısından tarandı. Bu yaklaşımı kullanarak, Şekil 2B'de gösterildiği gibi, yalnızca eke sahip klonlar 288 bp'lik bir PCR ürünü verdi ve sgRNA'nın ters dizisini içermeyen negatif klonlar, hiçbir PCR ürünü ile sonuçlanmadı.
H9 enfeksiyonları, stabil seçimler ve Western blot
hESC'ler, L2HGDH geninin ekzon 1'ini hedef alan iki farklı sgRNA'yı eksprese eden lentiviral partiküller ile enfekte edildi ve puromisin ile seçildi. Kullanılan iki sgRNA'dan hangisinin gen delesyonunu indüklemede daha verimli olduğunu belirlemek için, kararlı bir şekilde birlikte eksprese eden sgRNA ve Cas9 hücrelerinin heterojen popülasyonlarından Western blot analizi yapıldı. Şekil 3A'da gösterildiği gibi, L2HGDH-sgRNA-1, heterojen hücre popülasyonlarında L2HGDH ekspresyonunu azaltmada diğer diziden daha verimliydi.
Klonal seçim, genişletme ve protein analizi
L2HGDH-sgRNA-1 eksprese eden hücreler için tek hücre seçimi ve klonal genişleme yapıldı. Tek klonlar veren kuyucuklar, kolonilerin daha da genişlemesi, kriyoprezervasyon ve analiz yapması için yeterli bir boyuta (genellikle 2 hafta) ulaşılana kadar işaretlendi ve büyütüldü (Şekil 3B). Toplam 22 klon, L2HGDH için beş homozigot nakavt (% 23) veren Western blot analizi kullanılarak analiz edildi. Bu sonuç, tek bir kasetten hem sgRNA hem de Cas9'un kararlı ko-ekspresyonu için lentiviral aracılı gen iletimi kullanılarak yüksek bir gen nakavt verimliliğini göstermektedir. Şekil 4, kontrol hücreleri ile birlikte beş homozigot nakavt klonunun Western blot analizini göstermektedir ve seçilen klonlardaki kontrole kıyasla %100 azaltılmış ekspresyon göstermektedir.
DNA düzeyinde analiz
Cas9'un PAM tanıma dizisinin yukarı akışındaki CRISPR mutasyon bölgesini haritalamak için, kontrol hücrelerinden ve beş farklı klondan alınan genomik DNA kullanılarak Mutasyon Bölgelerine Dayalı Spesifik Primerler Polimeraz Zincir Reaksiyonu (MS-BSP PCR) gerçekleştirildi. Şekil 5'te gösterildiği gibi, iki klon (A5 ve B4) PAM tanıma dizisine hemen yakın mutasyonlara sahipken, diğer üç klon (A1, A9 ve B12) mutasyonun PAM bölgesine çok yakın olmayabileceğini ve L2HGDH geninin ekzon 1'i içindeki 20bp sgRNA dizisinin daha yukarısında olduğunu gösterdi.
DNA'daki kesin mutasyonları bulmak için, kontrol hücrelerinden (sadece vektör enfekte H9) saflaştırılmış PCR ürünleri ve ayrıca üç farklı CRISPR klonu, A5, A1 ve B4, Sanger dizilemesine tabi tutuldu ve mutasyon bölgeleri, PAM bölgesi8'in yukarı akışında çoklu hizalama aracı kullanılarak haritalandı. Sonuçlar, PAM bölgesinin yukarı akışındaki A5 klonunda delesyon mutasyonunu ortaya çıkardı. Diğer iki klon, A1 ve B4, Şekil 6'da vurgulandığı gibi, PAM bölgesinin yukarı akışında insersiyonel mutasyon gösterdi.
Klonların fonksiyonel analizi
hESC'lerde CRISPR nakavt hücre hatlarının üretilmesi üzerine, bir sonraki adım, pluripotentliklerini ve farklılaşma potansiyellerini doğrulamaktır. Bu amaçla, A1, A5 ve B4 olmak üzere üç farklı klon için farklı pluripotentlik belirteçlerini test ettik ve sonuçları kontrol (yalnızca vektör ile enfekte olmuş H9) hücreleriyle karşılaştırdık. Sonuçlar, OCT4, NANOG ve SOX2 belirteçleri için immün boyama ile belirlenen nakavt hücre hatlarının pluripotens potansiyelinde hiçbir değişiklik göstermedi. Daha sonra, kontrol ve nakavt hücre hatları, hücre proliferasyon belirteci KI67 için de boyandı ve bu da kontrole kıyasla nakavt hücre hatlarında hiçbir değişiklik göstermedi. Bu sonuçlar, CRISPR nakavtının bu hücrelerin kendini yenileme özelliklerini etkilemediğini göstermektedir. Ek olarak, EB ve koloni oluşumu da etkilenmemiştir (Şekil 7). Laboratuvarımızda kurulan in vitro yöntemler kullanılarak, tüm klonlar, PAX6 (nöroektoderm belirteci), Brachyury (mezoderm belirteci) ve FOXA2 (endoderm belirteci) için immün boyama ile doğrulandığı gibi üç germ tabakası hücresine başarıyla farklılaştırıldı. Kontrol hücrelerine kıyasla nakavt hücre hatlarının farklılaşma potansiyelinde herhangi bir değişiklik gözlenmedi, bu da nakavt hücrelerinin farklılaşma potansiyellerini koruduğunu gösterdi (Şekil 8).

Şekil 1: Etüt tasarımını 5 adımda gösteren şematik diyagram. Adım 1: sgRNA'ların Bsmb1 sindirilmiş V2 CRISPR vektörüne tasarlanması ve klonlanması. Adım 2: Polifeksiyonlar ve ultrasantrifüjleme kullanılarak viral konsantrasyon kullanılarak HEK293T hücrelerinin birlikte transfekte edilmesiyle paketleme plazmitleri ile birlikte sgRNA taşıyan giriş vektörü kullanılarak lentiviral partiküllerin üretilmesi. Adım 3: 10-20 MOI'de lentiviral partiküller kullanılarak hESC'lerin enfeksiyonu ve puromisin kullanılarak stabil hücre seçimi ve ardından sgRNA'ların etkinliğini görmek için heterojen hücre popülasyonlarının analizi. Adım 4: Heterojen popülasyonlarda maksimum yıkım gösteren hücrelerden seyreltme yöntemiyle tek hücre klonlama ve tek klon seçimi. Adım 5: Tek klonların genişletilmesi ve DNA düzeyinde analiz, protein ve klonların saplılık ve farklılaşma potansiyeli için fonksiyonel analizi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 2: lentiCRISPR V2.puro vektöründe sgRNA'ların klonlanması. (A) lentiCRISPR V2.puro vektörünün kısıtlama enzimi BsmB1 ile sindirimi. Ok, vektörün sindirimi üzerine salınan 1.8 Kb'lik bir doldurma parçasını gösterir. (B) L2HGDH sgRNA yapı 1 ve 2'nin farklı klonları için koloni PCR analizi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 3: Tek hücreli seçim kullanılarak western lekeleri ve klonal yayılım. (A) Kontrol (C) H9 hESC'leri ile birlikte, kararlı bir şekilde birlikte eksprese eden sgRNA (L2H-1 ve L2H-2) ve Cas9'un heterojen popülasyonlarının iki farklı biyolojik replikasından (S1 ve S2) Western blot analizi. (B) L2HGDH-sgRNA-1'i stabil bir şekilde eksprese eden H9 hücrelerinin tek hücre seçimi ve klonal genişlemesi. Oklar, yalnızca tek klonları gösteren 96 kuyulu plakanın kuyularını gösterir. Ölçek çubuğu = 100 μM. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 4: H9'un farklı klonlarından Western blot analizi. (AC) 22 klonun toplam hücre lizatlarından Western blot analizi, L2HGDH için beş homozigot nakavt (%23) verdi. (D) Western blot kullanılarak yapılan farklı bir biyolojik replikat deneyinden L2HGDH nakavtlarının doğrulanması. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
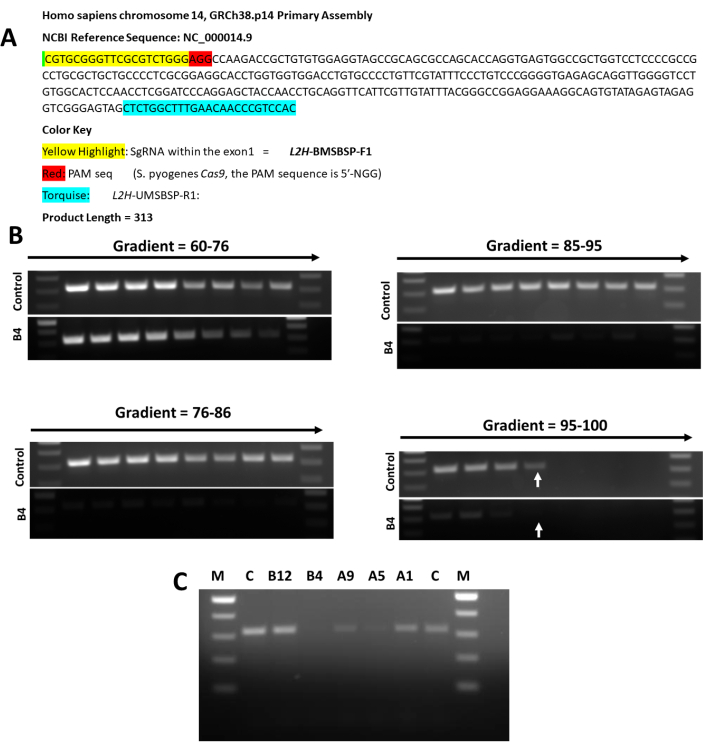
Şekil 5: Farklı H9 klonlarının MSBSP PCR analizi. (A) MSBSP PCR analizi için kullanılan L2HGDH ekzon 1'in dizi analizi. (B) Kontrol ve H9 V2 L2HGDH KO Clone B4 kullanılarak MSBSP PCR analizi için tavlama sıcaklığının optimizasyonu. 96.8'de, kontrol bir bant gösterir, ancak B4 oklarla gösterildiği gibi bir bant göstermez. (C) Tüm homozigot KO klonlarının analizi, ekzon 1 içindeki mutasyon bölgesinin aşağıdaki haritalanmasıyla sonuçlandı. A1 = In/Del, PAM sahasına yakın değil; A5 = PAM sahasına yakın/Del; A9 = In/Del PAM sahasına oldukça yakın; B4 = In/Del PAM sahasına çok yakın B12 = In/Del PAM sahasına yakın değil. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 6: Sanger dizili PCR ürünlerinin referans L2HGDH ekzon 1 dizisi ile hizalanması. A1, A5 ve B4'ten Sanger dizili PCR ürünlerinin ve kontrol hücrelerinin çoklu hizalamaları, NCBI veritabanından L2HGDH'nin ilk ekzonu içinde bir referans dizisi ile birlikte yapıldı. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
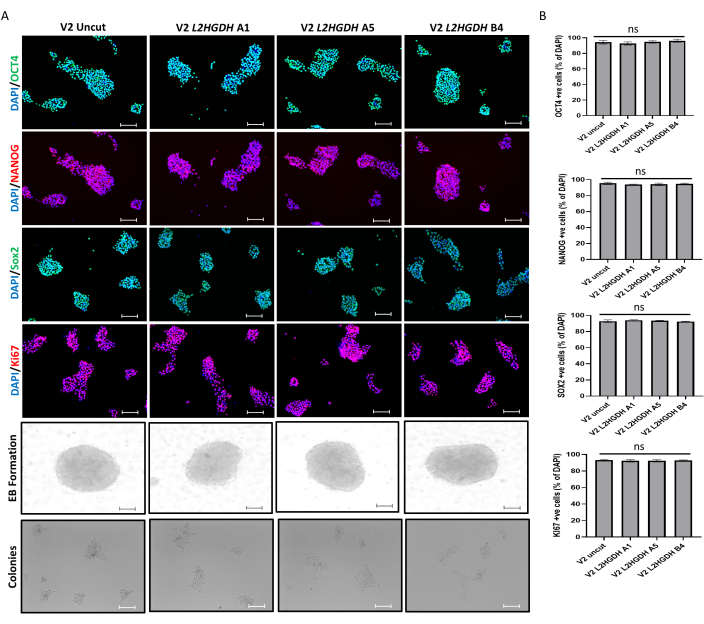
Şekil 7: CRISPR nakavt hücre hatlarının fonksiyonel karakterizasyonu. (A) Hücreler, kontrol ile enfekte olmuş H9 hESC'lere göre pluripotens belirteçleri (OCT4, NANOG, SOX2), kendini yenileme (KI67), EB'ler ve koloni oluşumu için immün boyandı. Ölçek çubukları: 100 μM. (B) Pozitif (+ve) eksprese eden hücrelerin yüzdesi DAPI boyamaya göre hesaplandı. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 8: CRISPR nakavt hücre hatlarının farklılaşma potansiyeli. Kontrol ile enfekte olmuş H9 hücrelerine göre PAX6 (nöroektoderm), Brachyury (mezoderm) ve FOXA2 (Endoderm) için belirteçler kullanılarak CRISPR nakavt hücre hatlarının farklılaşma potansiyelleri açısından fonksiyonel karakterizasyonu. Ölçek çubukları: 100 μM. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
| Protokol adımı | Gereken süre |
| LentiCRISPRv2'de sgRNA'ların klonlanması | 4 gün |
| Lentivirüs üretimi ve titresi tayini | 5 gün |
| hESC enfeksiyonları, stabil hücre seçimleri ve genişleme | 2 hafta |
| Tek hücreli klonal seçim ve genişletme | 2 hafta |
| Klonların fonksiyonel analizi | 2 hafta |
Tablo 1: Protokol adımları için zaman çizelgesi ve gereken tahmini süre.
Tartışmalar
Bu çalışma, CRISPR-Cas9 teknolojisi aracılığıyla hESC'lerde yüksek verimli ve uygun maliyetli gen delesyonlarını mümkün kılan bir yöntemi standartlaştırmıştır. Bu yöntem, hESC enfeksiyonundan başlayarak tek hücreli klonal seçim ve yayılıma kadar 3-4 hafta içinde hESC'lerde L2HGDH geninin homozigot delesyonunu başarıyla sağlamıştır (Tablo 1). CRISPR-Cas9 aracılı gen manipülasyonları çoğu hücrede geçici transfeksiyonlarla elde edilebilse de, bu, zayıf transfeksiyon verimliliği ve yüksek hücre toksisitesi nedeniyle kök hücrelerde zor hale gelir. Farklı çalışmalar, kurtarılan klonların %10'una kadarının delesyon gösterdiğini bildirmiştir. Örneğin, Mali ve ark. AAVS1 lokusu3'ü hedefledikten sonra insan kaynaklı pluripotent kök hücrelerde %2 ila %4 genom düzenleme etkinliği bildirmiştir. Başka bir çalışma, pluripotentlik ve nöral farklılaşmada rol oynayan uzun kodlamayan bir RNA olan TUNA'yı hedeflemek için saf hESC'lerde %1,3-8,4'lük düzenleme verimlilikleri bildirmiştir14. Ocana ve arkadaşları tarafından insan pluripotent kök hücrelerinde CFTR geni hedeflendikten sonra %10'a kadar verimlilik bildirilmiştir.15 Bu nedenle, verimli gen düzenlemesi elde etmek için verimli bir Cas9-gRNA dağıtım yöntemi gereklidir ve bu özellikle kök hücreler için geçerlidir, çünkü bu hücreler tipik somatik hücrelere ve ölümsüzleştirilmiş hücre dizilerine kıyasla geçici dağıtım yöntemlerine karşı daha yüksek düzeyde duyarlılık ve direnç sergiler5.
Bu çalışmada, homozigot CRISPR nakavt hücre hatlarını elde etmenin oldukça verimli bir yolu, sgRNA'ların hESC'lere lentiviral aracılı iletimi kullanılarak bildirilmiştir. CRISPR-Cas9'u hESC'lere iletmek için lentiviral vektörlerin kullanılması, gen delesyonunun elde edilmesinde, kimyasal veya mekanik yollarla viral olmayan vektör transfeksiyonlarının kullanılmasından çok daha verimli ve daha az zaman alıcı olduğunu kanıtladı (veriler gösterilmemiştir). Bu, klonal seçim ve bireysel klonların çoğaltılmasından sonra önemli ölçüde daha yüksek genom düzenleme verimliliği (~% 23) ile sonuçlandı. Bu nedenle, sgRNA'ların ve Cas9'un hESC'lere lentiviral aracılı iletiminin yanı sıra lentivirüs üretimi için uygun maliyetli bir yaklaşımı birleştirerek, mevcut yöntem yalnızca yüksek verimli ve daha az zaman alıcı değil, aynı zamanda uygun maliyetlidir.
Başarılı bir yaklaşım için önerilerden bazıları şunlardır: (1) Hem Cas9 hem de sgRNA'ları eksprese eden tek bir lentiviral vektör sistemi kullanmak. (2) Cas9 ve sgRNA'ları eksprese eden aynı plazmit üzerinde puromisin gibi bir antibiyotik seçim markörünün varlığı, hücrelerin yaklaşık %100'ünün Cas9-sgRNA ekspresyonu için pozitif olmasını sağlar. Bu, başarılı gen düzenleme olaylarının olasılığını önemli ölçüde artırır. (3) hESC'lerdeki enfeksiyonlar için yararlı olması için, lentiviral vektörlerin yüksek virüs titreleri verecek şekilde konsantre edilmesi vazgeçilmezdir. Kullanılan çeşitli teknikler arasında en ekonomik yaklaşım, büyük hacimlerde LVS kullanmak ve bunları 107 ila 108 IU / mL aralığında titreler elde etmek için orijinal hacmin 100-500 katı kadar konsantre etmektir. (4) Plazmitlerle hücre transfeksiyonlarını HEK293T için uygun maliyetli ve verimli bir yöntem için, virüs paketlemesi için lentiviral vektör transfeksiyonu için PEI (polietilenimin) kullanılması eşit derecede verimlidir ve bu nedenle, yaygın olarak kullanılan transfeksiyon reaktifi lipofektamin7 ile karşılaştırıldığında uygun maliyetlidir. (5) Ortalama lentiviral titreler 5 × 107 IU/mL aralığında olmalıdır. (6) Bu hücrelerde ilgilenilen genin homozigot delesyonlarını elde etmek için tek hücre seçimi ile klonal çoğaltma gereklidir. (7) Önceki çalışmalar, insan pluripotent kök hücrelerinde CRISPR-Cas9 aracılı gen düzenlemesinin çok az hedef dışı mutasyonlasonuçlandığını göstermiş olsa da 16,17, hedef dışı bölgeleri kontrol etmek hala ihtiyatlıdır. Bu, özellikle klinik öneme sahip deneyler için, hedef dışı etkileri en aza indirmek için verimli gRNA tasarım araçları ve düzenlenmiş hücre dizilerinin18 genom çapında dizilenmesi yoluyla başarılabilir. (8) Son olarak, seçilen klonların normal karyotipi, büyük ölçekli genomik değişikliklerin olmadığından emin olmak için G-bandı ve yüksek çözünürlüklü analiz gibi yöntemler kullanılarak doğrulanmalıdır. Genomik instabiliteyi gösterebilecek mikronükleus oluşumunun sıklığını değerlendirmek için bir mikronükleus testi de yapılabilir.
Bu yöntemin en önemli sınırlamalarından biri, Cas9 ve sgRNA'ların stabil genomik entegrasyonuna yol açan ve istenmeyen bir durum olan düzenleme sonrası yapısal ekspresyonlarına yol açan bir lentiviral vektör sisteminin kullanılmasıdır. Gelecekte, bu yöntem, Cas9'un kontrollü ekspresyonu için doksisiklin tedavisi ile Tet-on sistemi gibi, Cas9 geninin ekspresyonunu yönlendiren ilaca bağlı bir promotör ile kurucu promotörlerin değiştirilmesiyle geliştirilebilir.
Açıklamalar
Yazarlar herhangi bir çıkar çatışması olmadığını beyan ederler.
Teşekkürler
Bu çalışma, Birleşik Arap Emirlikleri Üniversitesi (UAEU) - hibe #12M105, hibe #12R167 (Zayed Sağlık Bilimleri Merkezi), 21R105 (Zayed Bin Sultan Hayırsever ve İnsani Yardım Vakfı (ZCHF)) ve Abu Dabi'nin İleri Teknoloji Araştırma Konseyi'nin (ATRC) teknoloji programı yönetimi ayağı olan ASPIRE'den ASPIRE Hassas Tıp Araştırma Enstitüsü Abu Dabi (ASPIREPMRIAD) ödül numarası VRI-20-10 aracılığıyla araştırma hibeleri ile desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 2-MERCAPTOETHANOL | Invitrogen | 31350010 | |
| 38.5 mL, Sterile + Certified Free Open-Top Thinwall Ultra-Clear Tubes | Beckman Coulter | C14292 | |
| Accutase | Stem cell technologies | 7920 | |
| bFGF Recombinant human | Invitrogen | PHG0261 | |
| Brachyury Rabbit mAb | Abclonal | A5078 | |
| BsmBI-v2 | NEB | R0739S | |
| chir99021 | Tocris | 4423/10 | |
| Corning Matrigel Basement Membrane Matrix, LDEV-free | Corning | 354234 | |
| Cyclopamine | Stem cell technologies | 72074 | |
| DMEM media | Invitrogen | 11995073 | |
| DMEM NUTRIENT MIX F12 | Invitrogen | 11320033 | |
| DPBS w/o: Ca and Mg | PAN Biotech | P04-36500 | |
| Fetal bovie serum | Invitrogen | 10270106 | |
| FoxA2/HNF3β | CST | 8186 | |
| GAPDH (14C10) Rabbit mAb Antibody | CST | 2118S | |
| Gentle Cell Dissociation Reagent | Stem cell technologies | 7174 | |
| HyClone Non Essential Amino Acids (NEAA) 100x Solution | GE healthcare | SH30238.01 | |
| Ki-67 (D3B5) Rabbit mAb | CST | 9129 | |
| KnockOut Serum Replacement | Invitrogen | 10828028 | |
| L GLUTAMINE, 100x | Invitrogen | 2924190090 | |
| L2H-BMSBSP-F1 | Macrogen | CGTGCGGGTTCGCGTCTGGG | |
| L2HGDH Polyclonal antibody | Proteintech | 15707-1-AP | |
| L2HGDH-SgRNA1-F | Macrogen | CACCGCGTGCGG GTTCGCGTCTGGG | |
| L2HGDH-SgRNA1-R | Macrogen | AAACCCCAGACGC GAACCCGCACGC | |
| L2HGDH-SgRNA2-F | Macrogen | CACCGCCCGCGG GCTTTTCGCCGG | |
| L2HGDH-SgRNA2-R | Macrogen | AAACCCGGCGAA AAGCCCGCGGGC | |
| L2H-SeqF1 | Macrogen | GCTAAAGAGCGC GGGTCCTCGG | |
| L2H-SeqR1 | Macrogen | GTGGACGGGTTG TTCAAAGCCAGAG | |
| L2H-UMSBSP-R1 | Macrogen | GTGGACGGGTTG TTCAAAGCCAGAG | |
| LentiCRISPRv2 | Addgene | 52961 | |
| mTesR1 complete media | Stem cell technologies | 85850 | |
| Nanog Antibody | CST | 3580 | |
| NEUROBASAL MEDIUM 1x CTS | Invitrogen | A1371201 | |
| Neuropan 2 Supplement 100x | PAN Biotech | P07-11050 | |
| Neuropan 27 Supplement 50x | PAN Biotech | P07-07200 | |
| Oct-4 Antibody | CST | 2750 | |
| Pax6 (D3A9V) XP Rabbit mAb | CST | 60433 | |
| PENICILLIN STREPTOMYCIN SOL | Invitrogen | 15140122 | |
| pMD2.G | Addgene | 12259 | |
| Polybrene infection reagent | Sigma | TR1003- G | |
| Polyethylenimine, branched | Sigma | 408727 | |
| psPAX2.0 | Addgene | 12260 | |
| Puromycin | Invitrogen | A1113802 | |
| qPCR Lentivirus Titer Kit | Abm | LV900 | |
| Rock inhibitor Y-27632 dihydrochloride | Tocris | 1254 | |
| SB 431542 | Tocris | 1614/10 | |
| Sox2 Antibody | CST | 2748 | |
| Sucrose | Sigma | 57-50-1 | |
| TRYPSIN .05% EDTA | Invitrogen | 25300062 | |
| U6-459F | Macrogen | GAGGGCCTATT TCCCATGATTC | |
| Wizard Genomic DNA Purification Kit | Promega | A1120 | |
| XAV 939 | Tocris | 3748/10 |
Referanslar
- Jinek, M., et al. A programmable dual-RNA-guided DNA endonuclease in adaptive bacterial immunity. Science. 337 (6096), 816-821 (2012).
- Jiang, F., Doudna, J. A. CRISPR-Cas9 structures and mechanisms. Annu Rev Biophys. 46 (1), 505-529 (2017).
- Mali, P., et al. RNA-guided human genome engineering via Cas9. Science. 339 (6121), 823-826 (2013).
- Xue, C., Greene, E. C. DNA repair pathway choices in CRISPR-Cas9-mediated genome editing. Trends Genet. 37 (7), 639-656 (2021).
- Zhang, Z., et al. CRISPR/Cas9 genome-editing system in human stem cells: Current status and future prospects. Mol Ther Nucleic Acids. 9, 230-241 (2017).
- Qiu, Z., et al. MYC regulation of D2HGDH and L2HGDH influences the epigenome and epitranscriptome. Cell Chem Biol. 27 (5), 538-550.e537 (2020).
- Sheikh, M. A., Ansari, S. A. Lentiviral mediated delivery of shRNAs to hESCs and NPCs using low-cost cationic polymer polyethylenimine (PEI). J Vis Exp. (183), e63953 (2022).
- Guo, J., et al. A simple and cost-effective method for screening of CRISPR/Cas9-induced homozygous/biallelic mutants. Plant Methods. 14 (1), 40 (2018).
- Ardah, M. T., Parween, S., Varghese, D. S., Emerald, B. S., Ansari, S. A. Saturated fatty acid alters embryonic cortical neurogenesis through modulation of gene expression in neural stem cells. J Nutr Biochem. 62, 230-246 (2018).
- Parween, S., et al. Higher O-GlcNAc levels are associated with defects in progenitor proliferation and premature neuronal differentiation. Front Cell Neurosci. 11, 415 (2017).
- Parween, S., et al. Nutrient-sensitive protein O-GlcNAcylation modulates the transcriptome through epigenetic mechanisms during embryonic neurogenesis. Life Sci Alliance. 5 (8), e202201385 (2022).
- Varghese, D. S., et al. Developmental modeling of hepatogenesis using obese iPSCs-hepatocyte differentiation uncovers pathological features. Cell Death Dis. 13 (7), 670 (2022).
- Varghese, D. S., Alawathugoda, T. T., Ansari, S. A. Fine-tuning of hepatocyte differentiation from human embryonic stem cells: Growth factor. Stem Cells Int. 2019 (5), 5968236 (2019).
- Jacobs, E. Z., et al. CRISPR/Cas9-mediated genome editing in naïve human embryonic stem cells. Sci Rep. 7 (1), 16650 (2017).
- Cuevas-Ocaña, S., et al. A cell-based optimized approach for rapid and efficient gene editing of human pluripotent stem cells. Int J Mol Sci. 24 (3), 12345 (2023).
- Veres, A., et al. Low incidence of off-target mutations in individual CRISPR-Cas9 and TALEN-targeted human stem cell clones detected by whole-genome sequencing. Cell Stem Cell. 15 (1), 27-30 (2014).
- Smith, C., Gore, A., Yan, W., Abalde-Atristain, L., Li, Z., He, C. Whole-genome sequencing analysis reveals high specificity of CRISPR/Cas9 and TALEN-based genome editing in human iPSCs. Cell Stem Cell. 15 (1), 12-13 (2014).
- Zhang, X. H., Tee, L. Y., Wang, X. G., Huang, Q. S., Yang, S. H. Off-target effects in CRISPR/Cas9-mediated genome engineering. Mol Ther Nucleic Acids. 4 (7), e264 (2015).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır